一种放射性药物的药物代谢动力学成像检测系统的制作方法
本发明涉及生物检测技术领域,尤其涉及一种放射性药物的药物代谢动力学成像检测系统。
背景技术:
细胞、细菌等微小生物的药物代谢动力学检测对于环境评估、微小生物代谢具有重要意义。但是,由于检测条件以及检测设备的限制,目前对于微小生物的药物代谢动力学检测至少存在着如下问题:检测数据不精确、或检测数据不全面、或能够同时检测的微小生物样本有限。
技术实现要素:
为解决现有存在的技术问题,本发明实施例提供了一种放射性药物的药物代谢动力学成像检测系统,针对微小生物不仅能够获得精确、全面的检测数据,而且能够同时检测多个微小生物样本。
本发明实施例提供了一种放射性药物的药物代谢动力学成像检测系统,包括正电子发射断层成像(positronemissiontomography,pet)探头、设置于所述pet探头内的微流控芯片、以及与所述微流控芯片连接的流体操作单元;其中,所述微流控芯片包括至少一个微流道;所述流体操作单元,用于为所述微流道注入检测液体。
上述方案中,所述pet探头为圆形结构、或平板结构、或半圆形结构。
上述方案中,所述pet探头为二平板结构时,所述pet探头包括第一子探头和第二子探头;
所述第一子探头和所述第二子探头为长方体形状,且所述第一子探头和所述第二子探头按照上下方向平行放置。
上述方案中,所述pet探头为四平板结构时,所述pet探头包括第一子探头、第二子探头、第三子探头和第四子探头;
所述第一子探头、所述第二子探头、所述第三子探头和所述第四子探头为长方体形状,所述第一子探头、所述第二子探头、所述第三子探头和所述第四子探头依次连接形成一个两面开口的腔室。
上述方案中,所述微流道设置有进液口和出液口;其中,所述进液口用于与所述流体操作单元连接,使检测液体将所述流体操作单元及所述进液口进入所述微流道;所述出液口用于与所述系统外部的液体回收装置连接,使所述检测液体流入所述液体回收装置。
上述方案中,所述流体操作单元至少包括:流体管路和流体控制装置;所述流体管路与所述进液口连接。
所述流体控制装置容纳所述检测液体的检测液容器提供压力,使所述检测液体经所述流体管路进入所述进液口。
上述方案中,所述系统还包括:辐射屏蔽装置。
上述方案中,所述辐射屏蔽装置底部设置有可移动滑轮。
上述方案中,所述辐射屏蔽装置内容置有所述pet探头、所述微流控芯片、所述流体操作单元、液体回收装置和检测液容器。
上述方案中,所述系统还包括环境控制装置,用于控制所述微流控芯片所处的环境参数。
本发明实施例提供的放射性药物的药物代谢动力学成像检测系统,将pet探头与微流控芯片结合,在微流控芯片上培养微小生物,通过pet探头以影像的方式检测放射性分子进入微小生物、在微小生物体内代谢以及从微小生物体内流出的过程。由于微流控芯片具有至少一个微流道,当微流控芯片具有两个及两个以上微流道时,使得所述放射性药物的药物代谢动力学成像检测系统能够同时对多种类型的至少两个微小生物样本进行检测;并且,通过pet探头能够获取精确、全面的微小生物影像数据。
附图说明
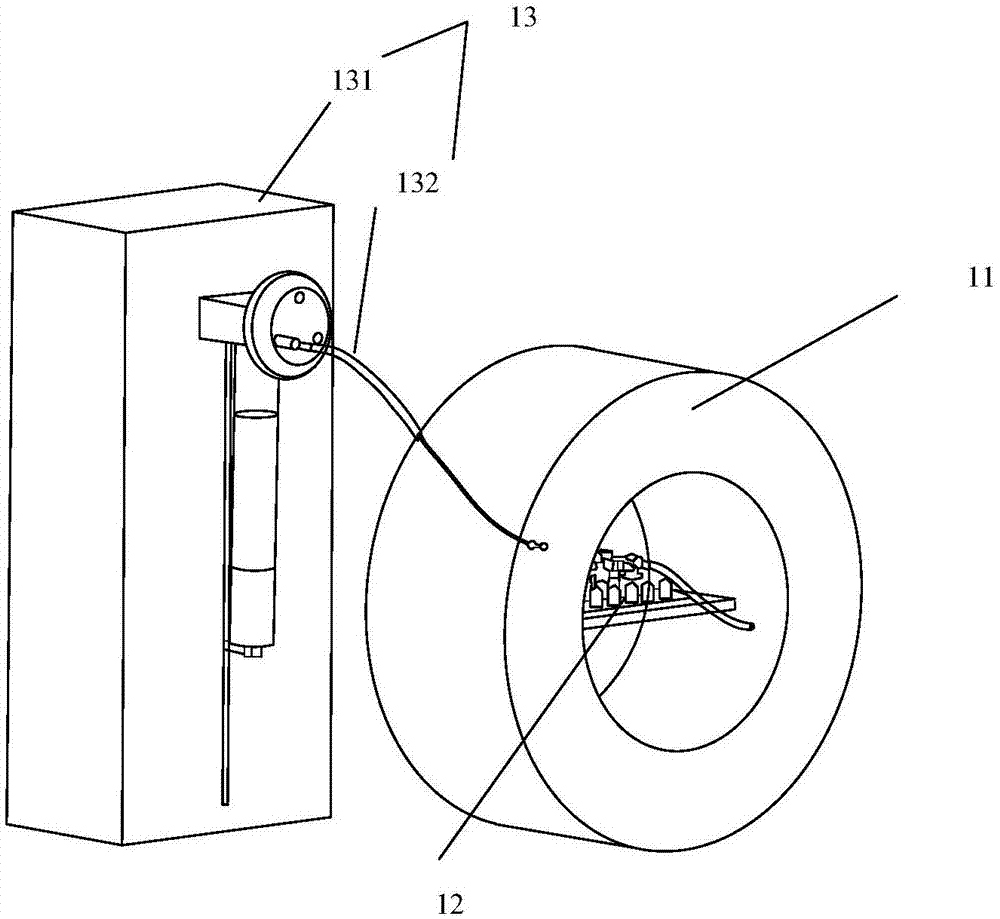
图1为本发明实施例一提供的放射性药物的药物代谢动力学成像检测系统的组成结构示意图;
图2为本发明实施例微流控芯片的结构示意图;
图3为本发明实施例二提供的放射性药物的药物代谢动力学成像检测系统的组成结构示意图;
图4为本发明实施例三提供的放射性药物的药物代谢动力学成像检测系统的组成结构示意图;
图5为本发明实施例辐射屏蔽装置与放射性药物的药物代谢动力学成像检测系统的一种位置关系示意图;
图6为本发明实施例辐射屏蔽装置与放射性药物的药物代谢动力学成像检测系统的另一种位置关系示意图;
图7a为本发明实施例底座的可选结构示意图一;
图7b为本发明实施例底座的可选结构示意图二;
图7c为本发明实施例底座的可选结构示意图三;
图8为本发明实施例微流控芯片与环境控制装置的位置关系示意图;
图9为本发明实施例采集时间为30s时获取的图像示意图;
图10a为本发明实施例采集时间为4分钟时获取的图像示意图;
图10b为本发明实施例微流道中可以培养细胞的区域示意图;
图11为本发明实施例采集时间为45分钟时获取的图像示意图;
图12为本发明实施例针对两个微流道进行动态成像定量分析得到的动态吸收曲线示意图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
相关技术中,应用于细胞、细菌等微小生物的检测系统主要包括ligandtracer检测系统和基于正电子相机的微流控放射影像分析系统(cimr)。
ligandtracer检测系统利用倾斜旋转的细胞培养皿培养细胞,让细胞在培养皿中的特定位置生长,在旋转中对细胞区域进行荧光或放射性活度计数。但是,在旋转中细胞在高点时将脱离检测液体界面,细胞在低点时将再次浸润到检测液体中。一方面,由于细胞不是时时刻刻都在检测液体中,而是细胞与检测液体结合进行吸收、分离、再进行检测这样的循环过程;因此,利用ligandtracer检测系统进行微小生物检测得到的数据是间断的。另一方面,由于检测液体的体积是固定的,随着时间的增加,检测液体中探针分子的浓度是减小的,因此,ligandtracer检测系统对细胞等微小生物的检测是有条件限制的,使得检测数据仅仅是近似的数据,并非准确数据。再一方面,ligandtracer检测系统对微小生物进行检测的过程中,检测液体旋转和脱离的过程对于细胞的贴壁性能要求比较高,因此ligandtracer检测系统能够检测的细胞类型有限。
cimr采用持续恒定低流速灌注的方式对微小生物进行检测,但是,由于cimr中的正电子相机是一种二维探测设备,因此cimr仅能对微小生物进行二维成像。并且,由于正电子相机的检测区域最大为14mm*14mm,因此一次只能进行一个微小生物样本的动态检测;对于检测过程中使用的时刻衰变的放射性核素探针来说,检测多个微小生物样本时,需要消耗更多的放射性活度,增加了检测的成本。
基于上述问题,本发明实施例提出了利用一种基于微流控芯片的放射性药物的药物代谢动力学成像检测系统。
实施例一
参见图1,图1为本发明实施例一提供的放射性药物的药物代谢动力学成像检测系统的可选组成结构示意图,包括:
pet探头11、微流控芯片12和流体操作单元13;其中,所述pet探头11为环形结构,所述微流控芯片12位于所述pet探头11的圆环内。
所述流体操作单元13用于为所述微流道注入检测液体,所述流体操作单元13包括:流体控制装置131和流体管路132。其中,所述流体管路132与所述进液口122连接;所述流体控制装置131为容纳所述检测液体的检测液容器提供压力,使所述检测液体经所述流体管路132进入所述进液口122。
在一些可选实施例中,流体控制装置131可以是注射泵、蠕动泵、或空气泵等任意能够控制流体的装置。
在一些可选实施例中,所述进液口122和所述出液口123的结构为管路接口。
所述微流控芯片12的结构,如图2所示,包括至少一个微流道121;所述微流道121设置有进液口122和出液口123;其中,
所述进液口122用于与所述流体操作单元13连接,使检测液体将所述流体操作单元13及所述进液口122进入所述微流道121;所述出液口123用于与所述系统外部的液体回收装置连接,使所述检测液体流入所述液体回收装置。
需要说明的是,本发明实施例图1以微流控芯片12包括6个微流道121作为示例。
在应用本发明实施例提供的放射性药物的药物代谢动力学成像检测系统时,通过流体控制装置131为容纳所述检测液体的检测液容器提供压力,使所述检测液体经所述流体管路132进入所述进液口122,进而流入所述微流道121;所述检测液体包括放射性核素探针。所述微流道121内放置细胞、细菌等微小生物,再通过pet探头11对微小生物进行成像,基于成像数据能够检测微小生物对放射性核素探针的代谢过程,如放射性核素探针流入微小生物体、放射性核素探针被微小生物体吸收、放射性核素探针流出微小生物体。
本发明实施例中,用两个微流道来检测一个微小生物样本。检测液体从第一微流道的第一进液口注入第一微流道,再从第一微流道的第一进液口流出,然后通过第二微流道的第二进液口注入第二微流道,在第二微流道中容纳有微小生物样本。以本发明实施例图1所示的放射性药物的药物代谢动力学成像检测系统为例,微流控芯片包括六个微流道,可以同时对三个微小生物样本进行药物代谢动力学检测。所述三个微小生物样本可以是同一种类型的微小生物,也可以是不同类型的微小生物。
在一些实施例中,还可以用一个微流道来检测一个微小生物样本;此时,微流道的中间部位具有凸起,使微流道内部凸起两侧的检测液体能够连通,在凸起的一侧放入微小生物检测样本。
实施例二
本发明实施例二提供的放射性药物的药物代谢动力学成像检测系统的另一个可选结构如图3所示,与图1所示的结构相似,不同之处在于本发明实施例二提供的放射性药物的药物代谢动力学成像检测系统中的pet探头为二平板结构,所述pet探头11包括第一子探头111和第二子探头112;
所述第一子探头111和所述第二子探头112为长方体形状,且所述第一子探头111和所述第二子探头112按照上下方向平行放置。
实施例三
本发明实施例三提供的放射性药物的药物代谢动力学成像检测系统的又一个可选结构如图4所示,与图1所示的结构相似,不同之处在于,本发明实施例三提供的放射性药物的药物代谢动力学成像检测系统中的pet探头为四平板结构,所述pet探头11包括第一子探头111、第二子探头112、第三子探头113和第四子探头114;
所述第一子探头111、所述第二子探头112、所述第三子探头113和所述第四子探头114为长方体形状,第一子探头111、所述第三子探头113、所述第二子探头112和所述第四子探头114依次连接形成一个两面开口的腔室;所述微流控芯片12位于所述腔室内部。
上述实施例二和实施例三仅对pet探头为二平板结构和四平板结构进行了说明,在实际应用中,可根据需要将pet探头设置为六平板结构、八平板结构等由偶数个平板构成的平板结构。
实施例四
本发明实施例四提供的放射性药物的药物代谢动力学成像检测系统的结构与图1、图3、图4所示的结构相似,不同之处在于,本发明实施例四提供的放射性药物的药物代谢动力学成像检测系统还包括辐射屏蔽装置15,所述辐射屏蔽装置15的一个可选结构为底部设置有可移动滑轮,使得所述辐射屏蔽装置15能够根据需要灵活移动。
在一些可选实施例中,辐射屏蔽装置与放射性药物的药物代谢动力学成像检测系统的一种位置关系示意图,如图5所示,所述辐射屏蔽装置15内容置有所述pet探头11、所述微流控芯片12、所述流体操作单元13、液体回收装置16和检测液容器17;图5所示的pet探头为半环形结构。
在另一些可选实施例中,辐射屏蔽装置与放射性药物的药物代谢动力学成像检测系统的另一种位置关系示意图,如图6所示,所述pet探头11与所述流体操作单元13通过所述辐射屏蔽装置15进行隔离。
需要说明的是,基于本发明实施例一至实施例四提供的微流道121的结构,在实际应用时,可以以两个微流道作为一组,其中一个微流道用于容置作为参考的检测液体,另一个微流道用于容置检测液体和微小生物。
本发明上述实施例中,所述微流控芯片12放置于底座上,所述底座的可选结构如图7a、7b和7c所示。
基于本发明实施例一至实施例四提供的放射性药物的药物代谢动力学成像检测系统,所述放射性药物的药物代谢动力学成像检测系统还包括:环境控制装置14,用于控制所述微流控芯片12所处的环境参数;所述环境参数包括:温度、湿度、环境气体的组成成分等。微流控芯片与环境控制装置的位置关系示意图,如图8所示,所述微流控芯片12置于所述环境控制装置14内部。
基于图5所示的放射性药物的药物代谢动力学成像检测系统,在微流道a中注入放射性活度为0.4mbq,体积为100μl的[18f]fdg溶液;在微流道b中注入放射性活度为0.2mbq,体积为100μl的[18f]fdg溶液。采集时间为30s时获取的图像如图9所示,图9中微流道a和微流道b中被框出的区域为微流道中可以培养细胞的区域。
基于图5所示的放射性药物的药物代谢动力学成像检测系统,在微流控芯片的4个微流道中分别注入放射性活度为1.8mbq,体积为100μl的[18f]fdg溶液。采集时间为4分钟时获取的图像如图10a所示,图10b中被框出的区域为微流道中可以培养细胞的区域。
基于图4所示的放射性药物的药物代谢动力学成像检测系统,在微流控芯片的6个微流道中分别注入放射性活度为4mbq,体积为100μl的[18f]fdg溶液。采集时间为45分钟时获取的图像如图11所示,图11中被框出的区域为微流道中可以培养细胞的区域,图11示出了一个视野下乳腺癌细胞系mda-mb-231的显微镜图像(200×)
针对第5微流道和第6微流道进行动态成像定量分析得到的动态吸收曲线如图12所示,虚线代表没有微小生物的微流道对应的动态吸收曲线,实线代表有微小生物的微流道对应的动态吸收曲线。通过上述动态吸收曲线,能够获取微小生物的药物代谢动力学信息。
本发明实施例中,pet探头的检测灵敏度高,但是由于其分辨率在1mm至2mm之间,使得pet探头不能用于细胞等微小物体的成像和检测,仅能够用于人体、小型动物的成像检测;且目前pet探头能够检测的体积最小的对象是小鼠。因此,相关技术中,pet探头一般仅用于体内成像检测,尚未应用于微小生物的成像检测。本发明实施例提供的放射性药物的药物代谢动力学成像检测系统在不提高pet分辨率的基础上,基于微流控芯片能够获取微小生物对特定放射性核素探针在生物体内的吸收情况。如此,克服了pet探头在微小生物检测方面的不足,延伸了pet探头的检测对象范围。并且,基于pet探头和微流控芯片的放射性药物的药物代谢动力学成像检测系统的检测视野大,一次可以同时检测多个微小生物样本。基于同一个放射性药物的药物代谢动力学成像检测系统进行多个微小生物样本同时检测时,能够减小生物样本之间的系统误差;相比于采用一个系统检测一个生物,本发明实施例能够有效地减少放射性核素探针的放射性活度耗费,节省成本。另外,由于pet探头是三维成像设备,因此,本发明实施例提供的放射性药物的药物代谢动力学成像检测系统不仅能够用于二维平面的成像检测,还可以用于三维细胞培养物、细菌等可移动的活体对象的检测,极大地提高了检测对象的范围。
基于上述放射性药物的药物代谢动力学成像检测系统,本发明实施例五还提供一种生物检测方法,以所述生物为细胞为例,所述方法的处理流程,包括以下步骤:
步骤s101,将细胞接种到微流控芯片中的一个微流道中,邻近的一个微流道不接种细胞,作为参考通道。
步骤s102,待细胞成长的实验所需测定条件时,将微流控芯片转移到检测系统的载物台上。
步骤s103,如需控制气体构成、温度和湿度等条件,则由环境控制装置来实现。
步骤s104,通过管路连接流体操作单元、微流控芯片的参考通道、细胞通道和出液口。多个样本的连接方式是一样的。
步骤s105,配制核素探针分子溶液,并将配制的核素探针分子溶液注入微流控芯片的参考通道和细胞通道。同时,利用pet探头对微流控芯片进行成像,获得成像数据。
步骤s106,检测之后,在光学显微镜下对细胞进行相差成像,获取细胞图像,并对微流道中的细胞进行计数。
步骤s107,对成像数据进行处理,得到细胞对核素探针的药物代谢动力学曲线和动力学参数。
需要说明的是,本发明实施例所涉及的pet探头可以是基于硅光电倍增管(sipm)、光电倍增管(pmt)、雪崩二极管(apd),位置敏感雪崩二极管(psapd)、sipin二极管等光电探测器的检测系统;也可以是基于碲化镉(cdte)、碲锌镉(cdznte)等半导体探测器的检测系统。当然,本发明实施例所涉及的pet探头不限于上述列举的检测系统,任何能够对微小生物进行三维成像的探测结构均在本发明的保护范围之内。
其中,pet探头的闪烁晶体,可以是mls晶体、lgso晶体、锗酸铋(bgo)晶体、硅酸钆(gso)晶体、碘化钠(nai)晶体、镥精细硅酸盐(lfs)晶体、钨酸铅(pbwo4)晶体、硅酸钇镥(lyso)晶体、硅酸镥(lso)晶体、铝酸镥(luap)、焦硅酸镥(lps)、labr3:ce晶体等。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!