一种检测β-淀粉样蛋白的基于THMS的电化学发光适体传感器及其制备方法和应用与流程
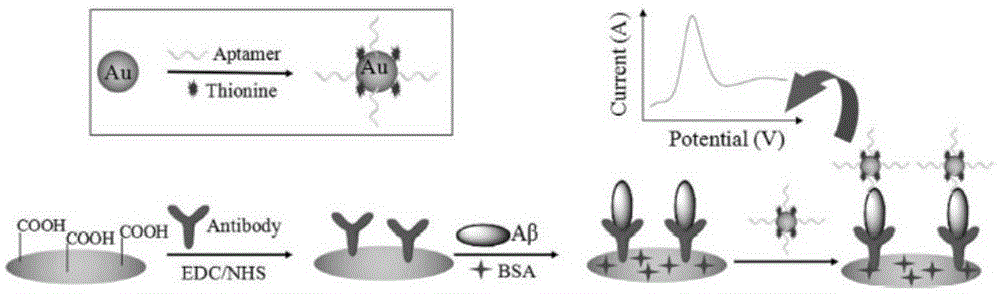
本发明属于生物分子检测领域,具体涉及一种检测β-淀粉样蛋白的基于thms的电化学发光适体传感器及其制备方法和应用。
背景技术:
阿尔兹海默症(alzheimer’sdisease,ad)是不可逆的神经退行性疾病,是痴呆最常见的病因,已引起了广泛的关注。β-淀粉样蛋白(amyloidβ-proein,aβ)级联假说认为aβ聚集过程中形成具有神经毒性的低聚物和纤维体,进而沉积形成的老年斑是诱发ad的重要因素。众多临床研究提示血液、脑脊液和脑组织内的aβ水平异常与ad的病程进展密切相关,aβ已成为目前研究ad的重要生物标志物之一。
aβ是淀粉样前体蛋白(app)由β、γ-分泌酶经复杂的酶切而产生,即app经β-分泌酶切割生成c99(保留app最后99个氨基酸),c99随后被γ-分泌酶在c端的不同位置切割生成不同长度的aβ,主要生成含有40、42个氨基酸的多肽aβ40、aβ42。aβ存在多种形态,如aβ单体(aβm)、aβ低聚物(aβo)和aβ纤维体(aβf)。研究表明aβ的单体形式没有神经毒性,而通过成核依赖性复合过程形成的低聚物和纤维体显示出神经毒性,aβ的非正常聚集是ad的病理基础,在ad的早期诊断、跟踪、预防和治疗中具有重要价值。而aβ聚集过程的动力学不稳定性造成了对其检测的难度,建立灵敏、高效检测不同形态aβ的分析方法对于促进ad诊疗技术的发展是十分必要的。
aβ的传统检测方法主要是免疫检测方法,如酶联免疫分析(elisa)、比色免疫和磁珠免疫等。elisa是目前最常用的方法,其既可定性诊断又可定量诊断,同时可测定的标本数量很大;但其标记过程复杂、时间长,所需免疫试剂多,易引入随机误差且检测信号放大程度有限。比色免疫直观简单,但易受到干扰,稳定性较差。磁珠免疫易于分离和再生,但成本较大。后又发展了微阵列免疫和毛细管等电聚焦(cief)免疫测定检测aβ,但其仪器投入费用较贵和操作复杂。此外,基于抗原抗体特异性反应的免疫检测方法所使用的抗体相对昂贵且易受外界环境的影响。
电化学生物传感方法是利用生物活性材料(如酶、蛋白、抗体、微生物及核酸等)作为识别元件,将生化反应转变成可定量的物理/化学信号,从而能够进行生命物质和化学物质检测和监控的高新技术。由于仪器设备简单、选择性好、灵敏度高、响应快速、成本低及不受样品颜色和浊度的影响等突出特征,电化学生物传感器(换能器为电化学电极)是目前研究aβ最具潜力的一种快速简便的新型方法。根据识别元件的不同,国内外近几年主要报道了六类aβ电化学生物传感方法(包括无标记、抗体、多肽、凝溶胶蛋白、血红素和抗体-适体联用),其中抗体作为识别元件的报道最多,抗体-适体联用仅见一篇文献报道(y.l.zhou,h.q.zhang,l.t.liu,c.m.li,z.chang,x.zhu,b.x.yeandm.t.xu.sci.rep.,2016,6,35186.)进行定量检测(图1),适体单独作为识别元件的尚未报道。
电化学发光(电致化学发光,ecl),是经电化学反应直接或间接引发的化学发光现象,其兼具电化学、化学发光二者的优点。ecl生物传感器是在电化学生物传感器的基础上发展的一种新型检测技术。具有灵敏度高、动力学响应范围宽、重现性好,可控性和选择性好及检出限低等特点,在生物分析领域具有极好的应用潜能。目前,国内外报道ecl检测aβ的文章仅有几篇,几乎都采用抗体作为识别元件构建三明治复合物进行检测。仅ke等(h.ke,h.f.sha,y.f.wang,w.w.guo,x.zhang,z.m.wang,c.s.huangandn.q.jia.biosens.bioelectron.,2018,100,266-273.)制备了一种抗体和适体联用的“类三明型治”aβecl传感器,应用磁性fe3o4修饰电极固载介孔碳纳米球@全氟磺酸/ru(bpy)32+/抗体,先后与aβ、适体-金纳米棒培育,形成“类三明治”的免疫传感器。由于ru(bpy)32+到金纳米棒的共振能量转移使ru(bpy)32+的ecl信号猝灭,根据ecl前后信号的变化,进行定量检测(图2)。适体单独作为识别元件的尚未报道。
适体(aptamer)是一段人工合成的,能够特异性识别靶标分子的单链dna或rna序列,是一种新型的生物分子识别元件,与传统识别元件抗体相比,其具有诸多优势,如(1)易合成,成本低,且批间差异小;(2)具有更高的亲和力和特异性,不依赖体内条件,不受抗原低免疫原性或毒性的影响;(3)通过在体外自由操作能够严格控制适体的化学合成,使其具有更高的纯度和再生性;(4)作用的靶标范围更广,除了蛋白质、完整细胞等大分子外还能检测毒素、金属离子等小分子;(5)适体尺寸更小,能够通过细胞膜进入细胞内,检测细胞内的靶分子;(6)更易于修饰和标记,且标记不会丧失原有生物活性;(7)可以分离结构相似或发生交叉反应的物质;(8)更易储存和运输,由温度引起的变性是可逆的。这些优点使适体逐渐取代抗体,应用到了分析检测的各个领域。但是目前国内外仅见将适体单独作为aβ的识别元件进而检测aβ的荧光生物传感,未见其它检测技术的相关报道。
基于dna的分子开关是一种dna的组装体,它能在两个或多个状态中以可控的方式实现可逆的切换。主要是目标分子和外界环境(温度、ph和光等)因素诱发其状态切换。它被广泛的用于生物传感器的研发与设计,比如基于单链dna分子开关和双链dna分子开关的电化学生物传感。但是单链dna分子开关大多需要对识别探针进行信号标记,进而将影响其特异性与亲和力;双链dna分子开关需要将探针的结构从dna/dna双链体切换到dna/靶标,进而妨碍识别dna对其靶标的识别和结合能力。为了解决上述策略设计的固有缺陷,三螺旋分子开关(thms)被广泛用作检测不同目标物的传感策略。thms结构是基于watson-crick和hoogsteen碱基配对原理,一条核苷酸链通过氢键作用插入到双链dna结构的大沟中,平行或反平行缠绕在一起形成。它通常由两部分组成,包括①具有两个臂片段的靶标特异性适体序列或dna序列,②被捕获在适体的两臂片段之间的序列(信号转导探针)。thms结构可以保留原始适体的高选择性,强度和亲和力,并且不需要对原始适体进行标记。近几年,国内外主要集中研究了基于thms的电化学、比色、表面增强拉曼散射和荧光生物传感器,用于检测dna、农药(啶虫脒)、抗生素(四环素、土霉素)、酶(凝血酶、溶菌酶)、激素(胰岛素)、小分子(三磷酸腺苷atp)、金属离子(pb2+、hg2+、k+)和干扰素r等。将thms和ecl的联合应用,用来检测aβ未见相关报道。
技术实现要素:
发明目的:针对现有技术存在的问题,本发明提供一种检测β-淀粉样蛋白的基于thms的电化学发光适体传感器及其制备方法和应用。本发明制备的基于thms的电化学发光适体传感器其完全保留适体的特有结构和活性,具有高灵敏度、高选择性、高稳定性,可以定量检测aβ蛋白,并且检测的线性范围宽、检出限低,。
技术方案:为了实现上述目的,如本发明所述一种检测β-淀粉样蛋白的基于thms的电化学发光适体传感器的制备方法,其特征在于,包括如下步骤:
(1)适体捕获探针、信号探针的设计与合成:
人工设计合成适体捕获探针:aptamer;信号探针:完全互补ssdna;
(2)thms电化学发光适体传感器的构建与优化:
①aptamer/au电极的制备
将巯基修饰的aptamer滴加在金电极表面,避光培育,再滴加巯基己醇(mch)封闭未覆盖的活性位点,放置备用;
②rucu@aunps-ssdna的制备
低温法制备ru(bpy)32+/铜纳米颗粒共掺杂金的合金核壳光学复合纳米颗粒rucu@aunps;
将将巯基修饰的ssdna溶解于rucu@aunps的水溶液中,反应后形成rucu@aunps-ssdna,离心洗涤,分散后保存;
③thms的形成
将aptamer/au电极与rucu@aunps-ssdna温育,电极经tris-hcl溶液清洗,在电极表面形成thms。
④aptamer-aβ的形成
thms修饰电极与检测目标蛋白aβ温育,电极经tris-hcl溶液清洗,此电极记作aptamer-aβ电极。
⑤ecl检测
将thms电极、aptamer-aβ电极分别作为工作电极,ag/agcl电极作为参比电极,pt丝电极作为对电极,构成三电极体系,经所述三电极体系构建基于thms的电化学发光适体传感器。分别进行两次ecl测定,前后两次ecl信号的差值定量aβ。即分别检测thms电极和aptamer-aβ电极的ecl信号为ecl1和ecl2,计算两者的ecl强度差值为δiecl(δiecl=ecl1-ecl2)。
步骤⑤先在裸金电极上形成thms修饰电极,thms修饰电极作为工作电极进行检测获得第一次的ecl信号;thms修饰电极进一步与aβ培育,aβ与thms结构里面的aptamer结合,打开三螺旋结构,形成aptamer-aβ修饰电极,aptamer-aβ修饰电极作为工作电极进行检测获得第二次的ecl信号,前后两次信号的差值定量aβ。
其中,步骤(1)所述aptamer为针对aβ低聚物(aβo)的线性aptamer,末端携带两个臂段,其碱基序列如seqidno.1所示。同时设计aptamer-con作为对照,所述aptamer-con末端仅携带单臂段,其碱基序列如seqidno.2所示。
其中,步骤(1)所述完全互补ssdna,其碱基序列如seqidno.3。同时设计单碱基错配ssdna-one、三碱基错配ssdna-three及完全不互补ssdna-non作为对照,其碱基序列如seqidno.4-6所示。
进一步地,步骤(1)所述aptamer和aptamer-con的5'端修饰活性基团巯基,使其能够固定在金电极上,并在ssdna、ssdna-one、ssdna-three及ssdna-non的3'端修饰巯基,通过au-s键与低温法制备的rucu@aunps结合。ssdna巯基化是为了a-s键结合制备的合金核壳光学复合纳米颗粒rucu@aunps。
其中,步骤(2)中①所述电极避光培育后,经巯基己醇占据空位点、tris-hcl溶液清洗,除去电极表面非特异性吸附的aptamer。
其中,步骤(2)中②中低温法制备rucu@aunps具体步骤为:通过冰浴条件下硼氢化钠还原硫酸铜和碘化钾制备cunps,再将cunps、ru(bpy)32+混合,缓慢滴加四氯金酸溶液和硼氢化钠溶液生成rucu@aunps,离心分离提纯后,4℃条件下保存备用。
本发明所述制备方法所制备的基于thms的电化学发光适体传感器。
本发明所述制备方法所制备的基于thms的电化学发光适体传感器在β-淀粉样蛋白定量检测中的应用。
本发明所述电化学发光适体传感器定量检测β-淀粉样蛋白的具体步骤为:应用所构建的基于thms的电化学发光适体传感器,对aβ进行定量检测包括线性范围、相关系数及检出限;所述线性曲线是以系列aβ标准溶液浓度对数为横坐标,ecl强度差值(△iecl)为纵坐标绘制线性曲线;其中△iecl是加入aβ前后ecl强度值的变化。
其中,所述基于thms的电化学发光适体传感器主要参数设置:电位扫描范围+0.2~+1.2v,扫描速率0.1v/s,光电倍增管高压800v,检测液为0.1mol/ltris-hcl,含20mmol/ltpraph7.4。
本发明考察定量检测β-淀粉样蛋白的选择性、稳定性、重现性等效能指标;与传统的酶联免疫吸附法、文献方法比对研究,验证本分析方法的可靠性。
本发明通过设计合成β-淀粉样蛋白适体序列经thms构建电化学发光分析系统并进行相关参数优化,应用所构建的分析系统定量检测aβ。本发明首次将适体单独作为aβ的识别元件,并结合thms特殊构型以构建ecl传感器,一方面适体作为识别元件可显著提高其与aβ的亲和力和特异性,另一方面由携带两个臂段的适体捕获探针和信号探针通过六个t-a·t碱基对互补杂交形成thms,具有高稳定性和灵敏度,同时保留适体的特有结构和活性。电化学发光适体传感检测β-淀粉样蛋白的新方法,为β-淀粉样蛋白的分析检测提供一种新思路,具有良好的应用前景。
本发明设计的aptamer和ssdna通过六个t-a·t碱基对杂交形成三螺旋(thms),具有较好的稳定性,通过低温法制备的联吡啶钌(ru(bpy)32+)、纳米铜胶(cunps)共掺杂光学复合纳米粒子rucu@aunps,在所述检测条件下展示强的电致化学发光行为,是较好的ssdna标记物。
本发明以aptamer作为识别元件的δiecl与aβ浓度呈现对应关系(信号差值signaloff型),并且首次以aptamer单独首次作为aβo的识别元件且aptamer未做任何信号标记,aptamer如果进行标记修饰,会不同程度的破坏其特有结构和活性,影响后续的传感识别效果;aptamer未做任何信号标记,可完全保留aptamer的特有结构和活性,给检测带来高的特异性和灵敏度;现有技术中一般都对aptamer进行标记信号,如标记了金纳米棒或者是标记aunps,如图1所示。
此外,本发明首次将aptamer直接固定在电极表面,aptamer直接固定在电极表面,一则制备流程简单方便,可固载最大量(人为调控aptamer的浓度,使其达到固载量的饱和);二则其作为捕获探针,因其固载量大,可有效提高后面识别探针的负载量,有效提高传感器的灵敏度。而现有技术中一般是先在电极上固定抗体,最后才是适配体,如图2所示。
有益效果:与现有技术相比,本发明具有如下优点:
本发明的制备方法简单高效、实用性强,制备的基于thms的电化学发光适体传感器制备得到的基于thms的电化学发光适体传感器性能优良,其完全保留适体的特有结构和活性,具有高灵敏度、高选择性和稳定性;可以定量检测aβ蛋白,并且检测的线性范围宽、检出限低。本发明首次将适体单独作为aβ的识别元件,并结合thms特殊构型以构建ecl传感器,为aβ蛋白的分析检测提供一种新思路,具有良好的应用前景。
高灵敏度:以适体为aβ的识别元件并结合thms特殊构型以构建ecl传感器,一方面适体作为识别元件可显著提高其与aβ的亲和力和特异性,另一方面由携带两个臂段的适体捕获探针和信号探针互补杂交形成thms,其杂交效率明显高于双螺旋分子开关,能有效提高检测的灵敏度;因其在室温下杂交可最大限度保留适体的特有结构和活性。
高选择性:①将thms修饰电极分别与10fmol/l的aβ、牛血清白蛋白、牛血红蛋白、凝血酶、混合样品(4种蛋白混合物)及空白样品培育,分别测定蛋白加入前后的ecl信号,结果显示只有aβ和混合样品具有相当的高的△iecl,而牛血清白蛋白、牛血红蛋白及凝血酶的△iecl几乎与空白样品相当(见附图3)。②将thms修饰电极分别与10fmol/l的aβ不同聚集形态(包括单体aβm、寡聚体aβo和纤维体aβf)及空白样品培育,构建基于thms的电化学发光适体传感器,分别进行加入前后ecl信号检测,发现只有aβo具有相当的高的△iecl,aβf其次,而aβm的△iecl几乎与空白样品相当(见附图4)。③将aptamer分别与完全互补ssdna、单碱基错配ssdna-one、三碱基错配ssdna-three、完全不互补ssdna-non及空白培育,构建dna分子开关,结果显示只有ssdna能与aptamer完全互补杂交形成三螺旋复合物,产生强的ecl信号(见附图5)。由此说明所述基于thms的电化学发光适体传感器具有高的选择性和特异性。
高稳定性:分别使用适体捕获探针aptamer、aptamer-con与信号探针ssdna杂交,构建dna分子开关,4℃放置过夜。结果发现aptamer-con和ssdna杂交形成双螺旋,即使没有靶蛋白aβ也观察到强的△iecl应答信号(见附图6),这可能是由于aptamer-con和ssdna之间形成的双螺旋(六个互补碱基对)不稳定,易解离。aptamer和ssdna通过六个t-a·t碱基对杂交形成三螺旋,相对具有较好的稳定性。
(3)对aβ蛋白的检测本发明制备得到的基于thms的电化学发光适体传感器检测的线性范围宽、检出限低应用所构建的基于thms的电化学发光适体传感器定量检测aβ。线性范围从1pmol/l,100fmol/l,10fmol/l,1fmol/l,跨越4个数量级,检出限达0.5fmol/l(见附图7)。
附图说明
图1为现有技术基于“类三明治”电化学传感方法检测aβ示意图谱;
图2为现有技术基于“类三明治”电化学发光传感方法检测aβ示意图谱;
图3为本发明不同蛋白质的△iecl检测图;
图4为本发明不同aβ聚集形态的△iecl检测图;
图5为本发明不同碱基序列杂交的iecl检测图;
图6为本发明不同适体的△iecl检测图;
图7为本发明aβ定量检测曲线。
具体实施方式
以下结合实施例和附图对本发明作进一步说明。
实施例中相关简写说明如下:
阿尔兹海默症(ad)
β-淀粉样蛋白(aβ)
淀粉样前体蛋白(app)
aβ单体(aβm)
aβ寡聚体(aβo)
aβ纤维体(aβf)
酶联免疫分析(elisa)
电化学发光(ecl)
三螺旋分子开关(thms)
适配体(aptamer)
完全互补dna(ssdna)
单碱基错配dna(ssdna-one)
三碱基错配dna(ssdna-three)
巯基己醇(mch)
合金核壳光学复合纳米颗粒(rucu@aunps)
三丙胺(tpra)
实施例1
(1)适体捕获探针和信号探针的设计和合成:
在含有24个aβ适体dna序列的适体捕获探针两端加上两个臂序列,以结合信号探针的中心部分,形成稳定的三螺旋结构,并在适体的5'端加上识别基团巯基,使能够固定在金电极上。设计和合成特定序列的信号探针,并在3'端修饰巯基,通过au-s键与低温法制备的rucu@aunps结合。
适体捕获探针:aptamer、aptamer-con(对照);信号探针:完全互补ssdna、单碱基错配ssdna-one(对照)、三碱基错配ssdna-three(对照)及完全不互补ssdna-non(对照);其碱基序列如seqidno.1-6所示,具体见表1。
表1
*粗体字母为aβ识别序列;下划线字母为形成三螺旋或双螺旋的序列;斜体字母为错配碱基序列
(2)thms电化学发光适体传感器的构建与优化:
①aptamer/au电极的制备
将2μl10-5mol/l5'-sh-aptamer滴加在预处理过的金电极表面,避光4℃下培育12h后。电极经50mmol/ltris-hcl(ph7.4)溶液清洗,除去电极表面非特异性吸附的aptamer。上述电极滴加2μl1mmol/lmch避光4℃放置30min左右,以封被电极表面未被捕获aptamer覆盖的活性位点,4℃放置备用,即获得aptamer/au电极。
②rucu@aunps-ssdna的制备
首先低温法制备rucu@au,具体过程为:冰浴条件下,在100ml1mmol/l硫酸铜和1mmol/l碘化钾的混合溶液中,分三至四次加入硼氢化钠溶液至6mmol/l。反应10min后加入一定量的约3-4mg十二烷基磺酸钠溶液,以防止铜胶的凝聚。迅速将所得的铜胶溶液离心,除去上清液,离心产物溶解在25ml0.3mmol/l柠檬酸三钠溶液中,得到分散在柠檬酸三钠溶液中铜胶溶液。然后,1ml铜胶溶液、40nmru(bpy)32+混合,同时缓慢滴入10ml1mmol/l四氯金酸溶液和20ml1mmol/l硼氢化钠溶液。在滴加过程中需激烈搅拌,保证还原生成的金尽量均匀地覆盖在铜胶表面,反应最终生成墨绿色的胶体溶液,经离心提纯,用去离子水分散装入深色玻璃瓶中,4℃下保存备用即得到化学性质比较稳定的壳/核型rucu@aunps。
将1od合成的3'-sh-ssdna溶解于rucu@aunps的水溶液中,浓度是10-4mol/l的ssdna溶解于1mlrucu@aunps。4℃下反应12h后形成rucu@aunps-ssdna,离心洗涤,用50mmol/ltris-hcl(ph7.4)分散后放入4℃冰箱保存。
③thms的形成
将2μl的aptamer/au电极与10μl的rucu@aunps-ssdna在50mmol/ltris-hcl(ph7.4,含0.3mol/lnacl、2mmol/lmgcl2、10mmol/lkcl),25℃温育90min,电极经50mmol/ltris-hcl(ph7.4)溶液清洗,在电极表面形成thms。
④aptamer-aβ的形成
thms修饰电极与不同浓度的检测目标蛋白aβ(不同浓度指的是下面的检测浓度为:1fmol/l、10fmol/l、100fmol/l、1pmol/l、10pmol/l和100pmol/l)在50mmol/ltris-hcl(ph7.4,含2mmol/lmgcl2、10mmol/lkcl),室温下培育30min。电极经50mmol/ltris-hcl(ph7.4)溶液清洗,此电极记作aptamer-aβ电极。
将thms电极、aptamer-aβ电极分别作为工作电极,ag/agcl电极(饱和kcl)作为参比电极,pt丝电极作为对电极,构成三电极体系,经所述三电极体系构建基于thms的电化学发光适体传感器。分别检测thms电极和aptamer-aβ电极的ecl信号为ecl1和ecl2,计算两者的ecl强度差值为δiecl(δiecl=ecl1-ecl2)。
基于thms的电化学发光适体传感器主要参数设置:电位扫描范围+0.2~+1.2v,扫描速率0.1v/s,光电倍增管高压800v。检测液为0.1mol/ltris-hcl,含20mmol/ltpra(ph7.4)。
应用所构建的基于thms的电化学发光适体传感器,对aβ进行定量检测包括线性范围、相关系数及检出限;所述线性曲线是以系列aβ标准溶液浓度对数为横坐标,ecl强度差值(△iecl)为纵坐标绘制线性曲线;其中△iecl是加入aβ前后ecl强度值的变化。
实施例2
应用实施例1所构建的基于thms的电化学发光适体传感器,对aβ进行定量检测包括线性范围、相关系数及检出限。
aβ蛋白检测范围:1fmol/l、10fmol/l、100fmol/l、1pmol/l、10pmol/l和100pmol/l
aβ蛋白线性范围:1fmol/l、10fmol/l、100fmol/l、1pmol/l。
aβ蛋白线性曲线:y=906.73x+774.98,相关系数:0.9997,检出限:0.5fmol/l。
为了研究传感器的重现性和稳定性,分别采用了7根电极,使用同样的方式同时构筑电化学传感器,测定100fmol/laβ,计算相应的相对标准偏差(rsd3.39%)。应用100fmol/l的多种蛋白物质(如凝血酶、牛血清红蛋白、牛血清白蛋白、凝血酶)、aβ聚集三种形态(aβm、aβo、aβf)及与适体捕获探针完全互补、单碱基错配、三碱基错配、完全不互补的信号探针杂交考查该方法的选择性。对照结果显示,本分析方法具有较好的特异性和选择性。本分析方法与传统酶联免疫吸附法、文献方法比对具有较好的一致性,证实本分析方法的可靠性。
应用实施例1所构建的基于thms的电化学发光适体传感器对本传感器的定量检测和方法学研究,包括重现性、稳定性、特异性和选择性,还有相关可靠性验证。其中附图3-6都是关于特异性和选择性的研究,而附图7是定量检测。
实施例3
为了考察本方法对aβ的选择性,分别制备10fmol/l空白(a)、牛血清白蛋白(b)、牛血清红蛋白(c)、凝血酶(d)及其混合物(f)与10fmol/laβ(e)。首先按之前步骤在相同的实验条件下构建thms电极,此时检测的ecl信号记为ecl1,最后比较加入上述蛋白质后再次检测的ecl信号记为ecl2,最后比较这两者的ecl信号差记为δiecl=ecl1-ecl2。
结果如图3所示,图3比较了不同蛋白质的△iecl检测图。将aβ分别用10fmol/l的空白(a)、牛血清白蛋白(b)、牛血清红蛋白(c)、凝血酶(d)及其混合物(f)替代进行实验,然后将分别温育了上述物质的传感器的△iecl同温育了10fmol/laβ(e)的信号进行比较。由于该传感器为信号减小型,结果发现温育aβ和混合物的传感器△iecl明显高于其他对比蛋白(见附图3)。
实施例4
为了考察本方法aptamer对aβo的特异性,制备了同样浓度10fmol/l的不同聚集形态aβ(aβm、aβo和aβf)。首先按之前步骤在相同的实验条件下构建thms电极,此时检测的ecl信号记为ecl1,最后比较加入上述不同聚集形态的aβ后再次检测的ecl信号记为ecl2,最后比较这两者的ecl信号差记为δiecl=ecl1-ecl2。
结果如图4所示,图4是不同aβ聚集形态的△iecl检测图。当aβm和空白样品存在时,与aβo相比iecl信号差不明显,这主要是由于适体与aβo特异性结合,不结合单体,所以不会产生ecl信号的变化。当aβf存在时,△iecl与单体相比虽然有所增加,但是与aβo相比,△iecl仍然较小(见附图4),这主要是由于aβf在聚集过程中可能仍保留少量aβo。
实施例5
为了考察dna杂交的专一性,制备同样浓度的标记rucu@aunps的完全互补、单碱基错配、三碱基错配和完全不互补的信号探针,然后与固定在电极上的aptamer充分杂交,最后在0.1mol/ltris-hcl,含20mmol/ltpra(ph7.4)检测ecl信号。
结果如图5所示,图5是不同碱基序列杂交的iecl检测图。当aptamer分别与完全互补(e)、单碱基错配(d)、三碱基错配(c)、完全不互补(b)及空白(a)培育,结果显示ecl信号的逐渐减弱,而适配体与完全互补碱基杂交时,ecl信号最强(见附图3,这是因为只有e能与aptamer完全互补杂交形成三螺旋复合物,产生强的ecl信号。由图3、图4和图5可说明该适体传感器有较好的选择性和特异性。
实施例6
为了考察三螺旋的特性,设计合成了与aptamer相同的识别碱基序列但仅携带一个臂段的aptamer-con(可与ssdna完全互补形成普通双螺旋结构)。将相同浓度10-5mol/laptamer和aptamer-con分别固定在金电极表面,并在相同的实验条件下与信号探针杂交形成thms、双螺旋,并分别记录ecl信号记为ecl1,接着避光放入4℃冰箱过夜,并再次分别记录相应的ecl信号记为ecl2,分析和比较这两者的ecl信号差记为δiecl=ecl1-ecl2。
结果如图6所示,图6比较了不同适体的△iecl检测图。aptamer-con具有与aptamer相同的识别碱基序列,除了aptamer-con仅在一端具有互补碱基因此不能与信号探针形成三螺旋结构。结果比较了三螺旋与双螺旋杂交(a、c)和4℃放置过夜(b、d)的ecl信号(见附图6),发现①aptamer比aptamer-con杂交ecl信号高,这可能因为通过六个t-a·t碱基对配对形成的三螺旋的刚性结构使标记信号更靠近电极表面;②aptamer-con和信号探针杂交形成双螺旋,即使没有靶蛋白aβ也观察到较强的△iecl应答信号(见附图6图),这可能是由于信号探针和aptamer-con之间形成的双螺旋不稳定。
实施例7
为了本方法定量检测aβ,用50mmol/ltris-hcl(ph7.4)配制一系列浓度的aβ,包括1fmol/l、10fmol/l、100fmol/l、1pmol/l、10pmol/l和100pmol/l,首先按之前步骤在相同的实验条件下构建thms电极,此时检测的ecl信号记为ecl1,之后加入上述浓度的aβ及空白溶液后再次检测的ecl信号记为ecl2,最后比较这两者的ecl信号差记为δiecl=ecl1-ecl2。δiecl与aβ呈现对应关系。
结果如图7所示,图7是aβ定量检测曲线。应用基于thms的电化学发光适体传感器对系列浓度的aβ进行测定,包括杂交(a)、0mol/l(b)、1fmol/l(c)、10fmol/l(d)、100fmol/l(e)、1pmol/l(f)、10pmol/l(g)和100pmol/l(h)的ecl信号(见附图5),发现从1pmol/l,100fmol/l,10fmol/l,1fmol/l范围△iecl呈线性(见附图7插图),跨越4个数量级,检出限达0.5fmol/l。
序列表
<110>东南大学
<120>一种检测β-淀粉样蛋白的基于thms的电化学发光适体传感器及其制备方法和应用
<160>6
<170>siposequencelisting1.0
<210>1
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttttttgcctgtggtgttggggcgggtgcgtttttt36
<210>2
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>2
ttttttgcctgtggtgttggggcgggtgcg30
<210>3
<211>9
<212>dna
<213>人工序列(artificialsequence)
<400>3
cgcaaaaaa9
<210>4
<211>9
<212>dna
<213>人工序列(artificialsequence)
<400>4
cgcaataaa9
<210>5
<211>9
<212>dna
<213>人工序列(artificialsequence)
<400>5
cgcatatat9
<210>6
<211>9
<212>dna
<213>人工序列(artificialsequence)
<400>6
cgctttttt9
- 还没有人留言评论。精彩留言会获得点赞!