一种利用化学振荡检测分析双氧水的方法与流程
本发明涉及一种利用化学振荡检测分析双氧水的方法,属于化学分析、环境监测技术领域。
背景技术:
化学振荡反应是在开发体系中进行的远离平衡的一类反应。反应过程中,这类反应的组分浓度不是单调地发生变化,而是一些组分的浓度忽高忽低,呈周期性变化,即化学振荡。化学振荡已经成为化学动力学的一个重要分支。
一类典型的化学振荡反应是belousov-zhabotinski反应,简称b-z化学振荡。该反应将nabro3、h2so4、nabr、丙二酸混合均匀,加入显色剂后,均匀的红色溶液会出现蓝色,并呈环状向外扩展,形成同心圆状花纹。化学振荡的动力学机理比较复杂。1972年,科学家提出俄勒冈(fkn)模型,用来解释b-z振荡反应机理。fkn机理由三个过程(a、b和c)组成:
a:br-+bro3-+2h+→hbro2+hbro(1)
br-+hbro2+h+→2hbro(2)
b:hbro2+bro3-+h+→2bro2·+h2o(3)
bro2·+ce3++h+→hbro2+ce4+(4)
2hbro2→bro3-+h++hbro(5)
c:ce4++brch(cooh)2+h2o+hbro→2br-+4ce3++3co2+6h+(6)
当双氧水(h2o2)加入b-z振荡体系,在体系中ce4+等金属离子的催化下,将发生反应:
因此,在b-z化学振荡体系中,加入双氧水后,h2o2分解产生的o2,将影响化学振荡的振幅,周期和振荡时间,在建立化学振荡特征参数与待测双氧水浓度的关系后,实现双氧水的检测分析。
双氧水在医疗卫生中广泛应用为消毒剂,同时也是一种重要的环境污染物,在工业废水或生活污水排放时,要求对其进行有效的检测分析。现有的双氧水检测方法有比色法、化学发光法等。比色法精确度较低,化学发光法虽然精确度较高,但是检测设备投资大。
技术实现要素:
为了克服现有双氧水检测技术的不足,本发明的目的在于提供一种利用化学振荡检测分析双氧水的方法。利用化学振荡体系对双氧水有灵敏的响应电势,且在一定的检测温度和双氧水浓度范围内,响应电势与双氧水的浓度线性关联,从而确定待测溶液中的双氧水浓度。本发明方法简便,精确度较高,易于操作。
一张利用化学振荡检测分析双氧水的方法,其通过将含有双氧水的待测液加入化学振荡体系中,监测电势的变化,利用电势与h2o2浓度的线性关系,测定待测液中双氧水的浓度。
上述化学振荡体系是指b-z化学振荡体系和b-r化学振荡体系。
上述化学振荡体系中包括底物、氧化剂、催化剂和无机酸;所述底物选自丙二酸、柠檬酸、苹果酸、酒石酸、乙酰丙酮、草酸或乙酰乙酸乙酯的一种或几种,浓度为:0.1~2.0摩尔/升;氧化剂选自溴酸钠、溴酸钾、碘酸钠或碘酸钾中的任一种,浓度为:0.1~2.0摩尔/升;催化剂选自硝酸铈铵、硫酸铈铵、硫酸锰或硝酸锰中的任一种,浓度为:0.0005~0.01摩尔/升;无机酸为硫酸,浓度为0.50~3.0摩尔/升。优选的,化学振荡体系中,底物的浓度为0.4~1.5摩尔/升,氧化剂的浓度为0.15~1.0摩尔/升,催化剂的浓度为0.001~0.008摩尔/升,无机酸的浓度为0.8~2.0摩尔/升。
上述检测温度为室温~60℃,待测液中的双氧水浓度范围为8.34×10-6~1.668×10-4摩尔/升。
和现有技术相比,本发明的有益效果在于:检测双氧水方法简单,检测的浓度范围8.34×10-6~1.668×10-4摩尔/升内,其检测低限为8.34×10-6摩尔/升,有望用于工业废水、医药卫生等行业中双氧水的检测、定量分析。
附图说明
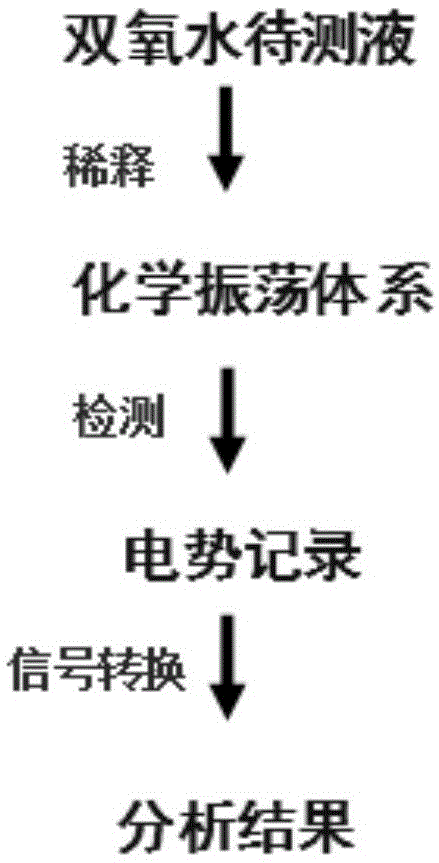
图1为本发明涉及的使用化学振荡检测分析双氧水的流程图。
图2由实施例1观测到依次加入不同量的双氧水溶液对化学振荡电势响应(1-5分别为依次加入65微升,2×65微升,4×65微升,8×65微升,16×65微升浓度为5.735×10-2摩尔/升的双氧水溶液)。
图3由实施例1得到的响应电势与h2o2浓度变化情况。
图4由实施例1得到的振荡再发生期与h2o2浓度变化情况。
图5由实施例2得到的响应电势与h2o2浓度变化情况。
图6由实施例2得到的振荡再发生期与h2o2浓度变化情况。
具体实施方式
以下通过实施例和附图对本发明的技术方案进行详细介绍。本发明包括但不限于以下实施方式。
本发明涉及的使用化学振荡检测分析双氧水的过程如图1所示。检测时,将h2o2待测液加入配制的化学振荡体系中,监测电势的变化,利用电势与h2o2浓度的数量关系,测定待测h2o2的浓度。
实施例1
化学振荡体系的配制。实例所用试剂均为分析纯。配制0.50摩尔/升丙二酸溶液,0.20摩尔/升溴酸钾溶液,0.80摩尔/升h2so4溶液和0.004摩尔/升硝酸铈铵酸性溶液(含有0.20摩尔/升h2so4)。
实施例2
电势~时间曲线的记录。室温下记录,即在100毫升的烧杯中,依次加入由实施例1所述的丙二酸溶液、溴酸钾溶液和硫酸溶液各10毫升,放入铂片工作电极,硫酸亚汞参比电极(内置饱和硫酸钾溶液),铂片对电极构成三电极体系,在搅拌下,加入10毫升硝酸铈铵溶液后,使用电池综合测试仪ct2001a记录电势~时间曲线。
应用实施例1:化学振荡响应电势与双氧水浓度检测分析
量取580微升30%双氧水(密度:1.11克/毫升),用蒸馏水稀释至100毫升,溶液浓度为5.735×10-2摩尔/升。为记录化学振荡响应电势,在化学振荡发生并稳定一段时间后,依次加入65微升,2×65微升,4×65微升,8×65微升,16×65微升浓度为5.735×10-2摩尔/升的配制的双氧水溶液。图2为加入双氧水溶液后化学振荡电势变化。加入后,响应电势降低。假定h2o2添加后瞬间混合均匀,根据振荡反应体系溶液的体积,可以计算化学振荡溶液中h2o2的加入体系的初始浓度,分别为9.30×10-5摩尔/升,1.855×10-4摩尔/升,3.686×10-4摩尔/升,7.278×10-4摩尔/升,1.420×10-3摩尔/升。图3为响应电势与h2o2的初始浓度的数量关系。加入一定量的h2o2后,化学振荡暂时停止,但随后体系恢复化学振荡。恢复化学振荡所用时间,在此定义为振荡再发生期。图4为振荡再发生期与h2o2加入后的初始浓度的线性关系。
利用上述响应电势或振荡再发生期与h2o2浓度的数量关系,可在9.30×10-5~1.420×10-3摩尔/升的浓度范围内,用于对h2o2的检测分析。
应用实施例2:双氧水浓度检测低限的测定
先将应用实施例1所述的双氧水溶液稀释10倍。然后在化学振荡发生并稳定一段时间后,依次加入65微升,2×65微升,5×65微升,10×65微升,20×65微升浓度为5.735×10-3摩尔/升的h2o2稀释溶液,如应用实施例1,初始h2o2浓度分别为8.34×10-6摩尔/升,1.668×10-5摩尔/升,4.169×10-5摩尔/升,8.339×10-5摩尔/升,1.668×10-4mol·l-1摩尔/升,图5和图6分别为响应电势和振荡再发生期与加入h2o2时浓度的数量关系。双氧水浓度检测低限为0.0834×10-4摩尔/升,在浓度范围8.34×10-6~1.668×10-4摩尔/升范围内,记录响应电势或振荡再发生期均可以检测h2o2的加入浓度。
- 还没有人留言评论。精彩留言会获得点赞!