检测去甲基卡波地那非、丙氧基艾地那非、N-乙基他达拉非和羟丙基去甲基他达拉非方法与流程
本发明涉及食品(含保健食品)、药品检测方法,具体是用于补肾壮阳类中成药和抗疲劳类保健食品,或者非法宣称补肾壮阳和抗疲劳类食品中非法添加去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非含量的高效液相色谱-串联质谱测定方法。
背景技术:
目前,在国内市场销售产品中发现有非法添加此去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非等4种物质,但还没有这些物质的筛查、定量和确证方法,且此化合物国内外未批准药用,未见其毒理学研究数据,毒性危害未知。为了保障人民群众的饮食用药安全,经过多次试验,并考虑一测多评,一种条件下尽可能筛选多个类似物,在前期方法学验证的基础上,建立去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非等4种物质的快速检验方法,供监督应用。
技术实现要素:
本发明目的是提供一种针对补肾壮阳类中成药和抗疲劳类保健食品,或者非法宣称补肾壮阳和抗疲劳类食品中非法添加去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非的补充检验方法,该方法的原理为:试样经乙腈超声提取,过滤后,滤液供液相色谱-串联质谱测定,外标法定量确认。
本发明是采用如下技术方案实现的:
一种检测去甲基卡波地那非、丙氧基艾地那非、n-乙基他达拉非和羟丙基去甲基他达拉非的方法,包括如下步骤:
(1)、试剂和材料
1.1、试剂
1.1.1、甲酸(hcooh):色谱纯。
1.1.2、乙腈(c2h3n):色谱纯。
1.1.3、水为gb/t6682规定的一级水。
1.2、试剂配制
1.2.1、0.1%甲酸水溶液:取甲酸1ml用水稀释至1000ml。
1.3、标准物质
去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非的中文名称、英文名称、cas登录号、分子式、相对分子量见表22。
表22
1.4、标准溶液配制
1.4.1、标准储备液:分别精密称取去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非各10.0mg,用乙腈溶解并稀释至25ml,摇匀,制成浓度为400μg/ml标准储备液,-20℃保存,保存期7天。
1.4.2混合标准中间液ⅰ:分别准确吸取去甲基卡波地那非、丙氧基艾地那非、羟丙基去甲基他达拉非和n-乙基他达拉非标准储备液0.1ml(去甲基卡波地那非0.5ml),乙腈定容至10ml,摇匀,制成4μg/ml(去甲基卡波地那非浓度为20μg/ml)的混合标准中间液ⅰ,-20℃保存,保存期7天。
1.4.3混合标准中间液ⅱ:准确吸取混合标准中间液ⅰ1.0ml于100ml容量瓶中,乙腈定容至刻度,摇匀,制成40ng/ml(去甲基卡波地那非浓度为200ng/ml)的混合标准中间液ⅱ,-20℃保存,保存期7天。
1.4.4、标准系列工作液的制备:分别准确吸取0.1ml、0.2ml、0.5ml、1.0ml、1.5ml、2.0ml的混合标准中间液ⅱ(1.4.3),用空白溶剂乙腈及空白基质提取液定容至10ml,将其稀释成浓度分别为0.4ng/ml、0.8ng/ml、2.0ng/ml、4.0ng/ml、6.0ng/ml、8.0ng/ml(去甲基卡波地那非浓度分别为2.0ng/ml、4.0ng/ml、10.0ng/ml、20.0ng/ml、30.0ng/ml、40.0ng/ml)的标准系列工作液。临用时配制。
(2)、仪器和设备
2.1、高效液相色谱-串联质谱仪,配有电喷雾(esi)离子源。
2.2、天平:感量分别为0.1mg和1mg。
2.3、超声波清洗器。
(3)、分析步骤
3.1、试样制备
3.1.1、固态试样
取适量混匀,研细,称取0.5g试样(精确至0.01g)于25ml容量瓶中,加入乙腈20ml,超声提取20min,放冷,乙腈定容至刻度,摇匀,用滤膜(0.22μm,有机相型)过滤,取续滤液,根据实际浓度适当稀释至标准曲线线性范围内,备用。
3.1.2、液态试样
取适量摇匀,吸取0.5ml于25ml容量瓶中,加入乙腈定容至刻度,摇匀,用滤膜(0.22μm,有机相型)过滤,取续滤液,根据实际浓度适当稀释至标准曲线线性范围内,备用。
3.1.3、空白试验
不加试样按试样同法处理,制得空白溶液。
称取与试样等量的空白基质试样,按试样同法处理,制得空白基质试样溶液,备用。
3.2、仪器参考条件
3.2.1、色谱条件
a)色谱柱:c18(2.0×150mm,3μm),或性能相当者;
b)流动相:a为乙腈,b为0.1%甲酸水溶液(1.2.1),梯度洗脱程序见下表1:
c)流速:300μl/min。
d)柱温:35℃。
e)进样量:2μl。
表1流动相及梯度洗脱条件
流动相梯度洗脱:时间段0-1min,流动相a10%,流动相b90%;时间段1-7min,流动相a10%到90%,流动相b90%到10%;时间段7~9min,流动相a90%,流动相b10%;时间段9-9.1min,流动相a90%到10%,流动相b10%到90%;时间段9.1~12min,流动相a10%,流动相b90%。
注:在有共流出成分影响目标化合物检测时,可以适当调节流动相比例,使尽可能与干扰成分分离,减少干扰。
3.2.2、质谱条件
a)离子源:电喷雾离子源(esi源)。
b)扫描方式:正离子扫描(esi+)。
c)检测方式:多反应离子监测(mrm)。
d)干燥气、雾化气、加热气等均为高纯氮气或其他合适气体,使用前应调节相应参数使质谱灵敏度达到检测要求,干燥气流速、加热气流速、雾化气流速、接口温度、脱溶剂管温度、加热器温度、碰撞能量等参数应优化至最佳灵敏度,监测离子对和定量离子对等信息详见如下。
质谱参考条件:
离子源:电喷雾离子源(esi);
检测方式:多反应监测(mrm);
扫描方式:正离子扫描(esi+);
雾化气流速:3.0l/min;
加热气流速:10.0l/min;
干燥气流速:10.0l/min;
接口温度:300℃;
脱溶剂管温度:250℃;
加热器温度:400℃。
3.3、定性测定
按照高效液相色谱—串联质谱条件测定试样和标准工作溶液,记录试样和标准溶液中各化合物的色谱保留时间,当试样中检出与某标准品质量色谱峰保留时间一致的色谱峰(变化范围在±2.5%之内),并且试样色谱图中所选择的监测离子对的相对丰度比与相当浓度标准溶液的离子相对丰度比的偏差不超过表21规定的范围,可以确定试样中检出相应化合物。
表21定性确证时相对离子丰度的最大允许偏差
3.4、定量测定
3.4.1、标准曲线的制作
将混合标准工作溶液(1.4.4)分别按仪器参考条件(3.2)进行测定,得到相应的标准溶液的色谱峰面积。以混合标准工作溶液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。必合要时可用空白基质试样溶液(5.1.3)配制基质混标准工作溶液绘制标准曲线。
3.4.2、试样溶液的测定
将试样溶液(3.1)按仪器参考条件(3.2)进行测定,得到相应的样品溶液的色谱峰面积。根据标准曲线得到待测液中组分的浓度,平行测定次数不少于两次。
3.4.3、空白基质试样溶液的测定
空白基质试样溶液的测定同3.4.2。
(4)、分析结果的表述
将高效液相色谱-串联质谱测得浓度代入下式计算含量:
式中:x—试样中各待测物的含量,单位为毫克每千克(mg/kg);
c—从标准曲线中读出的供试品溶液中各待测物的浓度,单位为微克每升(μg/l);
v—样液最终定容体积,单位为毫升(ml);
m—试样溶液所代表的质量,单位为克(g);
k—稀释倍数。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
(5)、精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
(6)、其他
当称样量为0.5g或0.5ml,定容体积为25ml时,本方法中去甲基卡波地那非、丙氧基艾地那非、羟丙基去甲基他达拉非和n-乙基他达拉非的检出限分别为10μg/kg(μg/l)、2μg/kg(μg/l)、2μg/kg(μg/l)和2μg/kg(μg/l),定量限分别为30μg/kg(μg/l)、6μg/kg(μg/l)、6μg/kg(μg/l)和6μg/kg(μg/l)。
空白试验应无干扰。
本发明方法具有如下优点:
1、一个条件一次检测保健食品及食品中添加的去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非等4个化学品。
2、本发明检测方法快速、准确,既能定性又能定量检测。
3、以上四种化学品为国内首次发现保健食品及食品中的非法添加物,所建立方法为监督部门的监管提供依据。
本发明设计合理,具有很好的时间应用及推广价值。
附图说明
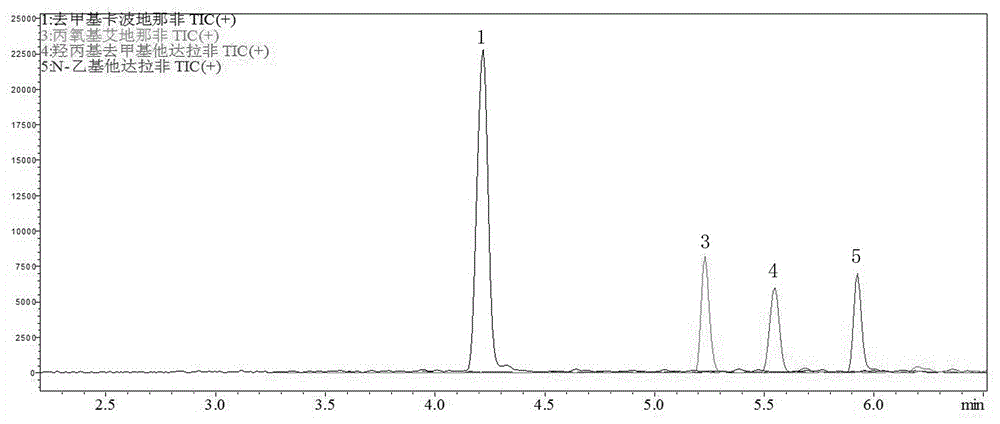
图1表示去甲基卡波地那非、丙氧基艾地那非、羟丙基去甲基他达拉非、n-乙基他达拉非标准物质的总离子流色谱图。
图2表示去甲基卡波地那非标准物质的提取离子色谱图。
图3表示丙氧基艾地那非标准物质的提取离子色谱图。
图4表示羟丙基去甲基他达拉非标准物质的提取离子色谱图。
图5表示n-乙基他达拉非标准物质的提取离子色谱图。
图6表示胶囊剂空白基质色谱图。
图7表示片剂空白基质色谱图。
图8表示酒剂空白基质色谱图。
图9表示饮料空白基质色谱图。
图10表示咖啡空白基质色谱图。
图11表示去甲基卡波地那非阳性样品(马来西亚咖啡)色谱图。
图12表示丙氧基艾地那非阳性样品(特制硬汉露酒)色谱图。
图13表示羟丙基去甲基他达拉非阳性样品(玛咖虫草咖啡)色谱图。
图14表示n-乙基他达拉非阳性样品(牡蛎海参片)色谱图。
具体实施方式
下面结合附图对本发明的具体实施例进行详细说明。
本实施例对“食品(含保健食品)中去甲基卡波地那非、丙氧基艾地那非、n-乙基他达拉非和羟丙基去甲基他达拉非的测定”检验方法进行方法学验证,并对提供的实际样品进行测定。“食品(含保健食品)中去甲基卡波地那非、丙氧基艾地那非、n-乙基他达拉非和羟丙基去甲基他达拉非的测定”检验方法属于定性及定量方法,验证内容包括专属性、校准曲线、准确度和精密度、检出限和定量限、实际样品的测定。
一、验证测试方法和条件具体如下:
1、试剂和材料
1.1、试剂
1.1.1、乙腈,色谱纯,dikma提供。
1.1.2、甲酸,色谱纯,天津市科密欧化学试剂有限公司提供。
1.1.3、水为屈臣氏纯化水。
1.2、标准品
1.2.1、去甲基卡波地那非纯度99.7%,tlc提供。
1.2.2、丙氧基艾地那非纯度99.0%,tlc提供。
1.2.3、羟丙基去甲基他达拉非纯度98.7%,tlc提供。
1.2.4、n-乙基他达拉非纯度99.5%,tlc提供。
1.3、溶液的配制
1.3.1、0.1%甲酸水溶液:取甲酸1ml用水稀释至1000ml。
1.4、标准溶液的配制
1.4.1、标准储备溶液的配制
分别精密称取去甲基卡波地那非、丙氧基艾地那非、羟丙基去甲基他达拉非和n-乙基他达拉非各10.0mg,用乙腈溶解并稀释至25ml,摇匀,制成浓度为400μg/ml标准储备液,-20℃保存,保存期7天。
1.4.2、混合标准中间溶液的配制
混合标准中间液ⅰ:分别准确吸取去甲基卡波地那非、丙氧基艾地那非、羟丙基去甲基他达拉非和n-乙基他达拉非标准储备液(1.4.1)0.1ml(去甲基卡波地那非0.5ml),乙腈定容至10ml,摇匀,制成4μg/ml(去甲基卡波地那非浓度为20μg/ml)的混合标准中间液ⅰ,-20℃保存,保存期7天。
混合标准中间液ⅱ:准确吸取混合标准中间液ⅰ1.0ml于100ml容量瓶中,乙腈定容至刻度,摇匀,制成40ng/ml(去甲基卡波地那非浓度为200ng/ml)的混合标准中间液ⅱ,-20℃保存,保存期7天。
1.4.3、空白基质提取液:空白样品为购买自市场的不含目标物的样品,包括:咖啡、含玛咖的胶囊、含牡蛎的片剂、含虫草人参的露酒、运动功能饮料。称取空白试样各0.5g(精确至0.01g),分别置于25ml容量瓶中,与样品同法处理,作为空白基质提取液。
1.4.4、混合标准工作溶液的配制
标准系列工作液的制备:分别准确吸取0.1ml、0.2ml、0.5ml、1.0ml、1.5ml、2.0ml的混合标准中间液ⅱ(1.4.2),用空白溶剂乙腈及空白基质提取液定容至10ml,将其稀释成浓度分别为0.4ng/ml、0.8ng/ml、2.0ng/ml、4.0ng/ml、6.0ng/ml、8.0ng/ml(去甲基卡波地那非浓度分别为2.0ng/ml、4.0ng/ml、10.0ng/ml、20.0ng/ml、30.0ng/ml、40.0ng/ml)的标准系列工作液。临用时配制。
1.5、阳性样品
阳性样品购买自本省流通市场。马来西亚咖啡(含去甲基卡波地那非)、特制硬汉露酒(含丙氧基艾地那非)、玛咖虫草咖啡(含羟丙基去甲基他达拉非)、牡蛎海参片(含n-乙基他达拉非)
2、仪器和设备
2.1、高效液相色谱-串联质谱仪:配有电喷雾(esi)离子源。
2.2、天平:感量为1mg和0.1mg。
2.3、超声波清洗器。
3、仪器条件
3.1、液相色谱条件
色谱柱:c18(2.0×150mm,3μm),或性能相当者;
柱温:35℃
流速:300μl/min
进样量:2μl
流动相:a为乙腈,b为0.1%甲酸水溶液(1.3.1),梯度洗脱程序见表1:
表1流动相及梯度洗脱条件
3.2、质谱参考条件
离子源:电喷雾离子源;
扫描方式:正离子扫描;
检测方式:多反应离子监测;
雾化气流速:3.0l/min;
加热气流速:10.0l/min;
干燥气流速:10.0l/min;
接口温度:300℃;
脱溶剂管温度:250℃;
加热器温度:400℃;
多反应离子监测的优化条件见表2:
表2多反应离子监测的优化条件
*定量离子对。
4、测定步骤
4.1、试样制备
4.1.1、固态试样
取适量混匀,研细,称取0.5g试样(精确至0.01g)于25ml容量瓶中,加入乙腈20ml,超声提取20min,放冷,乙腈定容至刻度,摇匀,用滤膜(0.22μm,有机相型)过滤,取续滤液,根据实际浓度适当稀释至标准曲线线性范围内,备用。
4.1.2、液态试样
取适量摇匀,吸取0.5ml于25ml容量瓶中,加入乙腈定容至刻度,摇匀,用滤膜(0.22μm,有机相型)过滤,取续滤液,根据实际浓度适当稀释至标准曲线线性范围内,备用。
4.1.3、空白试验
不加试样按试样同法处理,制得空白溶液。称取与试样等量的空白基质试样,按试样同法处理,制得空白基质试样溶液,备用。
4.2、定性测定
按照高效液相色谱—串联质谱条件测定试样和标准工作溶液,记录试样和标准溶液中各化合物的色谱保留时间,当试样中检出与某标准品质量色谱峰保留时间一致的色谱峰(变化范围在±2.5%之内),并且试样色谱图中所选择的监测离子对的相对丰度比与相当浓度标准溶液的离子相对丰度比的偏差不超过表21规定的范围,可以确定试样中检出相应化合物。
表21定性确证时相对离子丰度的最大允许偏差
4.3、定量测定
4.3.1、标准曲线的制作
将混合标准工作溶液分别按仪器参考条件进行测定,得到相应的标准溶液的色谱峰面积。以混合标准工作溶液的浓度为横坐标,以色谱峰的峰面积为纵坐标,绘制标准曲线。必合要时可用空白基质试样溶液配制基质混标准工作溶液绘制标准曲线。
4.3.2、试样溶液的测定
将试样溶液按仪器参考条件进行测定,得到相应的样品溶液的色谱峰面积。根据标准曲线得到待测液中组分的浓度,平行测定次数不少于两次。
对照品色谱图见图1至图5。
4.3.3、空白基质试样溶液的测定
空白基质试样溶液的测定同4.3.2。
标准物质色谱图见图6至图10。
5、分析结果的表述
将高效液相色谱-串联质谱测得浓度代入下式计算含量:
式中:
x—试样中各待测物的含量,单位为毫克每千克(mg/kg);
c—从标准曲线中读出的供试品溶液中各待测物的浓度,单位为微克每升(μg/l);
v—样液最终定容体积,单位为毫升(ml);
m—试样溶液所代表的质量,单位为克(g);
k—稀释倍数。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
二、验证结果
1、专属性
将空白溶剂乙腈、空白基质提取液及混合标准系列工作液中为0.8ng/ml浓度点(去甲基卡波地那非浓度为4.0ng/ml)注入液质联用色谱仪中,考察基质中存在的物质是否对被测组分存在干扰。
2、校准曲线
将空白溶剂乙腈混合标准系列工作液及空白基质混合标准系列工作液注入液质联用色谱仪中,测定相应的峰面积,以标准工作液的浓度(x)为横坐标,以峰面积(y)纵坐标,绘制校准曲线并列出校准曲线的线性方程和线性范围。
表3线性关系、相关系数及线性范围(乙腈)
表4线性关系、相关系数及线性范围(饮料基质)
表5线性关系、相关系数及线性范围(酒剂基质)
表6线性关系、相关系数及线性范围(片剂基质)
表7线性关系、相关系数及线性范围(胶囊基质)
表8线性关系、相关系数及线性范围(咖啡基质)
3、检出限和定量限
取混合标准中间液ⅱ0.1ml加入到0.5g空白基质中,加乙腈定容25ml后过滤,取上清液稀释后,过滤膜进行分析得出4种化合物的检出信号,以信号和噪音(s/n)的比值作为考察定量限和检出限的指标。s/n=10的信号浓度为定量限,s/n=3的信号浓度为检出限。当称样量为0.5g,定容体积为25ml时,计算去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非的检出限和定量限。
表9方法的检出限、定量限(μg/kg)
4、精密度
按照样品处理方法,分别在饮料、酒剂、片剂、胶囊和咖啡5种空白基质中加入4种成分,平行配制6份浓度为0.8ng/ml(去甲基卡波地那非浓度为4ng/ml)的供试品溶液,代入当日标准曲线计算含量及rsd。
表10日内精密度试验结果(ng/ml)(饮料基质)
表11日内精密度试验结果(ng/ml)(酒剂基质)
表12日内精密度试验结果(ng/ml)(片剂基质)
表13日内精密度试验结果(ng/ml)(胶囊基质)
表14日内精密度试验结果(ng/ml)(咖啡基质)
5、回收率实验
按照样品处理方法,分别在5种空白基质中加入4种成分,配制低(0.4ng/ml,去甲基卡波地那非浓度为2ng/ml)、中(0.8ng/ml,去甲基卡波地那非浓度为4ng/ml)、高浓度(4ng/ml,去甲基卡波地那非浓度为20ng/ml)供试品溶液,各水平浓度平行配制6份,根据标准曲线计算浓度,并计算回收率及rsd。
表15加样回收率实验(饮料)(n=6)
表16加样回收率实验(酒剂)(n=6)
表17加样回收率实验(片剂)(n=6)
表18加样回收率实验(胶囊)(n=6)
表19加样回收率实验(咖啡)(n=6)
6、样品的测定
6.1、固态试样
取适量混匀,研细,称取0.5g试样(精确至0.01g)于25ml容量瓶中,加入乙腈20ml,超声提取20min,放冷,乙腈定容至刻度,摇匀,用滤膜(0.22μm,有机相型)过滤,取续滤液,根据实际浓度适当稀释至标准曲线线性范围内,备用。
6.2液态试样
取适量摇匀,吸取0.5ml于25ml容量瓶中,加入乙腈定容至刻度,摇匀,用滤膜(0.22μm,有机相型)过滤,取续滤液,根据实际浓度适当稀释至标准曲线线性范围内,备用。
取阳性样品按上述制备方法制备供试品溶液。阳性样品:马来西亚咖啡(含去甲基卡波地那非)、特制硬汉露酒(含丙氧基艾地那非)、玛咖虫草咖啡(含羟丙基去甲基他达拉非)、牡蛎海参片(含n-乙基他达拉非)。测定结果如下表。
表204种成分含量测定结果(mg/g、mg/ml)
阳性样品中4中成分色谱图见图11-图14。
该方法的实验结果均满足要求,表明本法可专属、灵敏、快速地初筛和确证补肾壮阳类中成药和抗疲劳类保健食品,或者非法宣称补肾壮阳和抗疲劳类食品中非法添加去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非。本方法适用于酒、咖啡、功能饮料、玛咖片、保健食品中去甲基卡波地那非、n-乙基他达拉非、丙氧基艾地那非和羟丙基去甲基他达拉非含量的测定。
最后所应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照本发明实施例进行了详细说明,本领域的普通技术人员应当理解,对本发明的技术方案进行修改或者等同替换,都不脱离本发明的技术方案的精神和范围,其均应涵盖本发明的权利要求保护范围中。
- 还没有人留言评论。精彩留言会获得点赞!