河豚毒素免疫荧光快速检测试纸条及制备方法与检测方法与流程
本发明涉及河豚毒素检测技术领域,尤其涉及河豚毒素免疫荧光快速检测试纸条及制备方法与检测方法。
背景技术:
我国许多地方有食用河豚鱼的习惯,仅福建省河豚鱼的产量就达到了5000t,产值5亿,河豚鱼的养殖还带动周边的餐饮业、旅游业的发展,形成良好的社会效益。由于野生的河豚鱼与养殖的河豚鱼分辨不清,野生河豚鱼经常含有致死剂量的河豚毒素,食用河豚鱼中毒的事件时有发生,因此非常有必要对河豚毒素的快速检测进行研究。河豚毒素是一种非蛋白,低分子量的神经毒素,其可以与钠离子通道结合,进而影响到动物的肌肉与神经功能。
目前国内外对河豚毒素的检测主要有:1、生物检测法,具体为小鼠检测法或组织培养检测法等;2、理化检测法,具体为荧光分析法、薄层层析法、高效液相色谱法或气相色谱法等;3、免疫学检测法,如直接竞争酶联免疫法等。
目前检测河豚毒素主要是应用小鼠检测法(db35/531-2004《棕斑腹刺鲀、暗鳍腹刺鲀加工品》附录b河豚毒素检验),由小鼠检测法直接测定毒性,对于水产品安全性检测是很重要的,尤其是对于未知的毒素和污染物是难以替代的直观测定方法。但小鼠检测法的缺点是灵敏度不高,有假阳性现象,且重现性较差(标准偏差较大),无法断定毒素的成分,并对实验所用的小鼠的品系和体重要求苛刻。
理化检测法所需的样品前处理非常复杂。目前,河豚毒素的仪器检测及小鼠检测法都需要在实验室内由专业技术人员完成检测,仪器检测较为繁琐,并且成本昂贵,难以适应实际工作的需要。
为了简单、方便地检测出水产品中有无河豚毒素的存在,中国专利cn202522562u提供了一种河豚毒素检测试纸,其由载体板、硝酸纤维膜、胶体金垫、加样垫和吸收垫组成,载体板位于底层,硝酸纤维膜、胶体金垫、加样垫、吸收垫依次粘贴在载体板上表面,硝酸纤维膜位于载体板中部,胶体金垫设在硝酸纤维膜的一侧并与硝酸纤维膜部分重叠,加样垫设在胶体金垫上并与胶体金垫部分重叠,吸收垫设在硝酸纤维膜的另一侧并与硝酸纤维膜部分重叠,胶体金垫上均匀的涂布一层有胶体金标记的鼠抗河豚毒素单克隆抗体,硝酸纤维膜上靠近加样垫一端设有包被有检测抗原的检测线,靠近吸收垫一端设有包被有质控抗体的质控线。这种试纸虽然使用方便,但是它同时存在下列问题:1、对河豚毒素检测只是定性,没有定量,并且也没有给出检测限;2、试纸宽1cm,太宽,检测时浪费较多;3、使用纯化的单克隆抗体及高纯度的河豚毒素标准品制备人工抗原,抗体效价降低、成本高昂;4、金标抗体、人工抗原及羊抗鼠的使用量高,提高使用成本;5、层析试纸条设计不够合理,检测样品使用量较多,还需滴加生理盐水,检测方法不够简便;6、玻璃纤维膜切条后,再用胶体金标记的单克隆抗体涂布,37℃烘干,制备不方便,不适用于产业化生产。
技术实现要素:
本发明的目的在于解决现有技术中的上述问题,提供河豚毒素免疫荧光快速检测试纸条及制备方法与检测方法,实现对河豚毒素的快速定量检测,检测线性范围为10~200ng/ml,最低检测出限为1ng/ml,最高检测限为370ng/ml,可以满足日常对河豚毒素的快速检测需求。
为达到上述目的,本发明采用如下技术方案:
河豚毒素免疫荧光快速检测试纸条,包括载体垫、样品垫、结合垫、吸水垫、层析膜、检测线和质控线;所述载体垫设于最底层,载体垫上从一侧到另一侧依次铺设有样品垫、结合垫、层析膜和吸水垫;结合垫的一端设于样品垫下面,结合垫的另一端盖设于层析膜一端的上面,层析膜的另一端设于吸水垫的下面,检测线和质控线设于层析膜上,且检测线设于靠近结合垫的一端,质控线设于靠近吸水垫的一端;检测线上包被有河豚毒素人工抗原,质控线上包被有羊抗鼠二抗,结合垫上喷有荧光聚苯乙烯乳胶结合的河豚毒素抗体。所述检测线和质控线的间距为0.4~0.6cm。
河豚毒素免疫荧光快速检测试纸条的制备方法,包括以下步骤:
步骤1、样品垫和结合垫的制备:首先取河豚毒素人工抗原免疫过小鼠的脾细胞与骨髓瘤细胞融合培养,筛选阳性杂交瘤细胞体外培养,克隆扩大培养后冻存,选用balb/c小鼠或其亲代小鼠,先用降植烷或液体石蜡进行小鼠腹腔注射,6~8天后将杂交瘤细胞接种到小鼠腹腔中,然后在5~12天后收集腹水,收集饱合度为30%~50%硫酸铵的沉淀即为纯化后的抗体,用eu微球标记,并用0.01mpbs溶解,最后真空干燥;
步骤2、层析膜的加工:用划膜仪将形成检测线的河豚毒素人工抗原与形成质控线的质控抗体均匀地划在层析膜中间,干燥;
步骤3、组装:将载体垫、层析膜、样品垫、结合垫和吸水垫拼接成层状结构,所述载体垫位于底部,载体垫的上方设有层析膜,样品垫和吸水垫分别设置于层析膜的两端,结合垫设于层析膜和样品垫之间,且结合垫和吸水垫分别与层析膜部分重叠,检测线设置在靠近结合垫的一端,质控线设置在靠近吸水垫的一端;
步骤4、用切条机将组装后的试纸切割成条状结构,即制成河豚毒素免疫荧光快速检测试纸条。
本发明也可采用卡式外壳将河豚毒素免疫荧光快速检测试纸条进一步组装成河豚毒素免疫荧光快速检测卡,河豚毒素免疫荧光快速检测卡还设有点样窗口和检测窗口,点样窗口开设于样品垫上方,检测窗口设于层析膜上方。
所述步骤1中的河豚毒素人工抗原是通过在河豚毒素粗制品中加入牛血清蛋白,再加入乙酸钠缓冲液和乙醛,然后置于离心管中并在空气浴摇床后用ph7.0的磷酸缓冲液透析,最后冻干后即制成。
所述质控抗体为羊抗鼠二抗,所述河豚毒素人工抗原和质控抗体的划膜浓度均为0.5~2mg/ml。河豚毒素人工抗原通过河豚毒素粗制品制得,而不再使用河豚毒素高纯品,其成本得到有效控制。
所述层析膜为硝酸纤维素膜;所述层析膜在室温25℃、相对湿度小于40%的气氛下进行干燥。
在组装完成后用切条机将条状结构的宽度控制在2.9~3.5mm,所述样品垫的上方部分覆盖有胶带层。
河豚毒素免疫荧光快速检测方法,包括以下步骤:
步骤1、样本收集:首先取绞碎后的样品于提取管内,加入提取液,然后采用沸水浴提取,冷却到室温,最后离心取上清液用于检测;
步骤2、检测:取几滴待测溶液滴加于样品垫上,5~15min后,把河豚毒素免疫荧光快速检测试纸条插入荧光读卡仪,记录荧光读卡仪显示的浓度即为检测溶液中河豚毒素的含量。
本发明所述检测方法对河豚毒素提取液中河豚毒素的最低检出限为1ng/ml,检测线性范围为10~200ng/ml。
本发明检测方法的工作原理如下:
取几滴待测溶液滴加于河豚毒素免疫荧光快速检测卡的样品窗口中,当样品中没有河豚毒素时,样品垫上的荧光微球标记的抗体在毛细管作用下延着硝酸纤维膜层析,并与检测线和质控线结合,出现检测线与质控线两个带有荧光的条带;当样品含有河豚毒素时,河豚毒素与样品垫上的荧光微球标记的抗体竞争结合,与检测线的荧光微球标记的抗体结合减少,检测线上的荧光减弱。根据检测检测线与质控线的荧光比值,通过四参数拟合,可以实现对样品的河豚毒素的定量检测。
相对于现有技术,本发明技术方案取得的有益效果是:
1、本发明采用eu微球标记河豚毒素抗体,结合荧光读卡仪,可以对河豚毒素进行定量分析,并可以在直接在仪器上显示出检测溶液中河豚毒素的含量,极大地提高检测灵敏度以及使用的便捷性,检测限可以达到1ng/ml,而胶体金免疫层析检测限只能达到100ng/ml,本发明实现了对河豚毒素的快速定量检测,对河豚产业的健康发展有重要的意义。
2、本发明可以通过目测对河豚毒素进行快速定量分析,具有灵敏度高、特异性好、操作简便、快速判读的特性。
3、本发明的产品体积小、重量轻、携带方便、易于保存流通,可用于现场或实验室快速检测样品中河豚毒素的定量分析。
4、人工抗原可选择使用粗制的河豚毒素而不是用河豚毒素高纯品,极大地降低了使用成本。
5、河豚毒素免疫荧光快速检测试纸条的宽度约为3mm,减少检测样品使用量并降低了使用成本。
附图说明
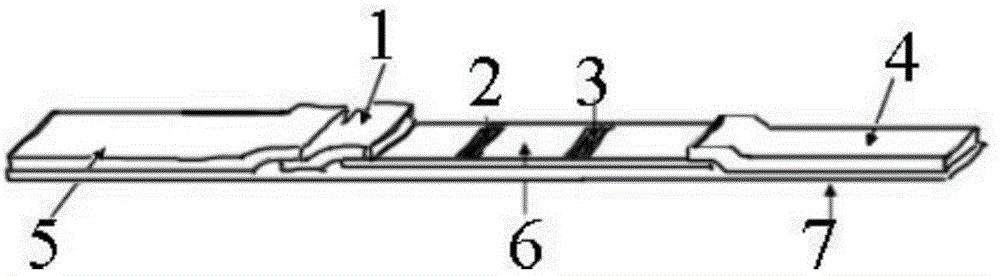
图1为河豚毒素免疫荧光快速检测试纸条的结构示意图;
图2为河豚毒素免疫荧光快速检测卡的结构示意图;
图3为抗体标记浓缩液的照片图;
图4为eu标记抗体与荧光比值的四参拟合曲线图;
图5为河豚毒素基质标准曲线图;
图6为f(x)的函数曲线图;
图7为g(x)的函数曲线图;
图8为河豚毒素免疫荧光快速检测卡与液质联用方法检测河豚鱼样品中河豚毒素相关性分析图。
附图标记:1-结合垫,2-检测线,3-质控线,4-吸水垫,5-样品垫,6-层析膜,7-载体垫,8-卡式外壳,9-点样窗口,10-检测窗口。
具体实施方式
为了使本发明所要解决的技术问题、技术方案及有益效果更加清楚,以下结合附图和实施例,对本发明做进一步详细说明。
如图1所示,本发明所述的河豚毒素免疫荧光快速检测试纸条包括结合垫1、检测线2、质控线3、吸水垫4、样品垫5、层析膜6和载体垫7;其中:
所述载体垫7设于最底层,载体垫7上从一侧到另一侧依次铺设有样品垫5、结合垫1、层析膜6和吸水垫4;结合垫1的一端设于样品垫5下面,结合垫1的另一端盖设于层析膜6一端的上面,层析膜6的另一端设于吸水垫4的下面,检测线2和质控线3设于层析膜6上,且检测线2设于靠近结合垫1的一端,质控线3设于靠近吸水垫4的一端;检测线2上包被有河豚毒素人工抗原,质控线3上包被有羊抗鼠二抗,结合垫1上喷有荧光聚苯乙烯乳胶结合的河豚毒素抗体。
如图2所示,可将河豚毒素免疫荧光快速检测试纸条组装在卡式外壳8内构成河豚毒素免疫荧光快速检测卡,河豚毒素免疫荧光快速检测卡还设有点样窗口9和检测窗口10,点样窗口9开设于样品垫5上方,检测窗口10设于层析膜6上方,为了直观地表示检测线2和质控线3,分别用c和t在河豚毒素免疫荧光快速检测试纸条上标示出质控线3和检测线2。
河豚毒素免疫荧光快速检测试纸条的制备方法,包括以下步骤:
步骤1、样品垫和结合垫的制备:首先取河豚毒素人工抗原免疫过小鼠的脾细胞与骨髓瘤细胞融合培养,筛选阳性杂交瘤细胞体外培养,克隆扩大培养后冻存,选用balb/c小鼠或其亲代小鼠,先用降植烷或液体石蜡进行小鼠腹腔注射,6~8天后将杂交瘤细胞接种到小鼠腹腔中,然后在5~12天后收集腹水,收集饱合度为30%~50%硫酸铵的沉淀即为纯化后的抗体,用eu微球标记,并用0.01mpbs溶解,最后真空干燥;
步骤2、层析膜的加工:用划膜仪将形成检测线的河豚毒素人工抗原与形成质控线的质控抗体均匀地划在层析膜中间,干燥;
步骤3、组装:将载体垫、层析膜、样品垫、结合垫和吸水垫拼接成层状结构,所述载体垫位于底部,载体垫的上方设有层析膜,样品垫和吸水垫分别设置于层析膜的两端,结合垫设于层析膜和样品垫之间,且结合垫和吸水垫分别与层析膜部分重叠,检测线设置在靠近结合垫的一端,质控线设置在靠近吸水垫的一端;
步骤4、用切条机将组装后的试纸切割成条状结构,即制成河豚毒素免疫荧光快速检测试纸条,可将河豚毒素免疫荧光快速检测试纸条组装在卡式外壳内构成河豚毒素免疫荧光快速检测卡。
本发明中步骤1中的河豚毒素人工抗原是通过在河豚毒素粗制品中加入牛血清蛋白,再加入乙酸钠缓冲液和乙醛,然后置于离心管中并在空气浴摇床后用ph7.0的磷酸缓冲液透析,最后冻干后即制成。
所述质控抗体为羊抗鼠二抗,所述河豚毒素人工抗原和质控抗体的划膜浓度均为0.5~2mg/ml。河豚毒素人工抗原通过河豚毒素粗制品制得,而不再使用河豚毒素高纯品,其成本得到有效控制。
所述层析膜为硝酸纤维素膜;所述层析膜在室温25℃、相对湿度小于40%的气氛下进行干燥。
在组装完成后用切条机将条状结构的宽度控制在2.9~3.5mm,所述样品垫的上方部分覆盖有胶带层。
每一批生产的河豚毒素免疫荧光快速检测试纸条用荧光读卡仪检测时,需对荧光读卡仪进行校正,校正方法如下:
配制2500ng/ml河豚毒素标准品,逐倍进行稀释成1250ng/ml、625ng/ml、312.5ng/ml……至1.2ng/ml。将河豚毒素标准品滴加至新生产的河豚毒素免疫荧光快速检测卡上,10min后用荧光读卡仪读出t/c值,用elisacalc软件进行参数拟合,将获得的参数输入到读卡仪,读卡仪就可以应用于这批河豚毒素免疫荧光快速检测卡的检测,不必每次校正。
采用本发明河豚毒素免疫荧光快速检测试纸条检测河豚毒素步骤如下:
步骤1、取1g绞碎后的样品于提取管内,加提取液至5ml,沸水浴提取10min,冷却到室温,离心取上清液用于检测。如果不能立即检测,可将提取液冷藏保存,长期保存应-20℃冷冻提取液。
步骤2、测试前先将河豚毒素免疫荧光快速检测卡和待检提取液恢复至室温。在未做好准备前请不要打开铝箔袋,打开后请在1h内使用。从包装袋中取出河豚毒素免疫荧光快速检测卡和一次性滴管,置于水平清洁桌面上。在河豚毒素免疫荧光快速检测卡上标记待检样本(或标准品)编号;用一次性滴管吸取待检样本,滴加3滴于点样窗口中,加样后开始计时,10min后将河豚毒素免疫荧光快速检测卡置于荧光读卡仪的卡槽内,按键读取结果。超过10min,随着时间的延长,数值会有所下降。
本实施例中抗体的标记步骤如下:
步骤1:激活缓冲液配制:首先溶解1.92gmes游离酸,然后加去离子水到100ml。
步骤2:取0.5~2ml的羧基荧光微球,加入mes激活缓冲液10ml,涡旋混匀,离心,去上清液,重复加入激活缓冲液,涡旋,离心,再把羧基荧光微球重新悬浮在10ml激活缓冲液中,加入100mgedac或其它的水溶性碳二亚胺(edc、cmc等),室温下不断搅拌反应10~20min。用0.01~0.05m的pbs缓冲液洗2次,悬浮在pbs缓冲液5ml中,尽可能地确保粒子悬浮良好。加入0.5~2mg河豚毒素抗体,室温下连续搅拌2~4h,加入终止液10ml(0.1%的bsa或其它蛋白肽类溶液),轻轻混合30min,清洗后重新悬浮在pbs中。
酶标板包被:取15ml的离心管,加包被液(0.01~0.10m碳酸盐缓冲液,ph8~10)10ml,加2μl相应的包被抗原(2mg/ml),充分混匀;取排枪槽,倒入相应的包被液,用排枪加抗原,100μl/孔,然后4℃过夜;甩去板条内的包被液,在报纸上扣干;排枪加洗涤液(pbst,含1%吐温的pbs缓冲液),200μl/孔,摇床上震荡3min,甩去洗涤液,在报纸上扣干;重复洗涤3次。
酶标板封闭:0.2gbsa加配好的0.05mol/l碳酸盐缓冲液溶解定量至100ml;用排枪往板条内加封闭液200μl/孔,37℃孵育2h,洗涤液洗涤3次,扣干,装入标记有相应标记的自封袋内,-20℃保存。
标记抗体荧光检测:在包被板以1:800、1:1600、1:3200、1:6400、1:12800、1:25600、1:51200的比例加入荧光标记抗体,37℃孵育45min,用洗涤液洗三次,扣干,用酶标仪荧光模块检测。
表1
表1为eu标记河豚毒素抗体的荧光检测结果;图3为eu标记完的河豚毒素抗体照片;对eu标记的河豚毒素抗体(1mg/ml)稀释不同倍数后,通过与包被有河豚毒素抗原的96孔板孵育反应,检测的的荧光值分析如表1所示,其中y=fx/f800。由表1可以看出标记有eu颗粒的河豚毒素抗体与96孔板上包被的抗原可以有效结合。对抗体稀释倍数和荧光比值用elisacalc软件进行四参数拟合,拟合曲线方程y=(a-d)/[1+(x/c)^b]+d,其中a为3.44749,b为1.13280,c为364.46335,d为-0.00491,决定系数r2为0.99961;拟合曲线如图4所示,结果说明eu标记河豚毒素抗体的浓度与待测组与对照组的荧光比值呈相关性,eu标记河豚毒素抗体可以应用于竞争法检测未知抗原的浓度。
阴性样品的制备:经lc-ms/ms法(gb5009206-2016“食品安全国家标准水产品中河豚毒素的测定”)检测河豚毒素浓度小于3μg/kg的水产品作为对照品。
河豚毒素储备液配制如下:
1mg/ml河豚毒素储备液:准确称取上述对照品0.010g,置于10ml棕色容量瓶中,用去离子水溶解并定容至刻度,于-20℃以下保存。
10μg/ml河豚毒素工作液:取1mg/ml河豚毒素储备液100μl于10ml棕色容量瓶中,用去离子水定容至刻度,临用前配制。
1μg/ml河豚毒素工作液:取10μg/ml河豚毒素储备液1ml于10ml棕色容量瓶中,用去离子水定容至刻度,临用前配制。
河豚毒素添加样品的制备如下:
10μg/kg添加样品:取1μg/ml河豚毒素工作液10μl于1g阴性河豚肉中混匀,按此方法制备添加样品。
20μg/kg添加样品:取1μg/ml河豚毒素工作液20μl于1g阴性河豚肉中混匀,按此方法制备添加样品。
40μg/kg添加样品:取1μg/ml河豚毒素工作液40μl于1g阴性河豚肉中混匀,按此方法制备添加样品。
对河豚毒素免疫荧光快速检测卡的最低检测限与检测范围的操作步骤如下:
在7份15ml的离心管中分别加入1g搅碎的河豚鱼肉阴性样品,分别添加1000ng、500ng、250ng、125ng、62.5ng、31.25ng、0ng的河豚毒素,加提取液至5ml,煮沸10min后冷却,滴加提取液补至5ml,4000rpm离心5min取上清液待用,即每ml溶液相当于含河豚毒素200ng、100ng、50ng、25ng、12.5ng、6.25ng和0ng。分别取3滴加到河豚毒素免疫荧光快速检测卡的点样窗口内,10min后读取荧光读卡仪中t线与c线的荧光响应值,如表2所示为标准品浓度与t/c值;以检测线荧光值t与控制线荧光值c比值(t/c)为纵坐标(y),以标准溶液浓度为横坐标(x),用elisacalc软件进行四参数逻辑曲线拟合,获得四参数拟合方程y=(a-d)/[1+(x/c)^b]+d,a为19.17436,b为0.91388,c为33.35052,d为-2.11786,r2为0.99545,四参数逻辑基质标准曲线如图5所示,通过做基质加标标准曲线,可以减少基质复杂成份对检测的影响,减少误差。把四个参数写录到荧光读卡仪可读取的文档文件assay.txt中,输入到荧光读卡仪中,就可以通过荧光读卡器检测样品中河豚毒素的浓度。
表2
设y=f(x),差值百分比计算如公式(1)和(2)所示:
f(x)的曲线图如图6所示,随着x值的增加,f(x)值逐渐减小,当x>238时,随着x值的增加,f(x)增加,f(x)的最小值是0.96,说明当荧光比值误差小于0.96%时,溶液浓度检测误差小于1ng/ml时;当x>371时,f(x)小于零,所以根据f(x)和f(x),可以计算出河豚毒素免疫荧光快速检测卡的检测范围小于370ng/ml。根据图7的g(x)函数曲线可以看出当待测液浓度大于1.18ng/ml时,河豚毒素免疫荧光快速检测卡的荧光比值与空白样的荧光比值误差大于5%。因此河豚毒素免疫荧光快速检测卡的可以检测范围大约是1~370ng/ml。
由于河豚毒素免疫荧光快速检测卡批间生产和批内生产还存在生产上的误差,为满足检测的要求,对生产的3批次河豚毒素免疫荧光快速检测卡检测的准确度和精密度进行验证。通常可以用平均相对误差(aard)表示检测结果的准确度,用变异系数(cv)表示检测结果的精密度。以检测范围的最低值10μg/kg的2倍和4倍进行验证实验,表3为河豚中河豚毒素准确度和精密度结果,由表3可以看出三批河豚毒素免疫荧光快速检测卡的平均相对误差在7.8%到15.2%之间,回收率在76.1%到106.9%之间,平均回收率为89.4%,河豚毒素免疫荧光快速检测卡批内变异系数在8.8~12.6之间,批间变异系数9.1~11.2之间。
表3
河豚毒素免疫荧光快速检测卡的假阴性和假阳性检测步骤和结果如下:
用3个批次的河豚毒素荧光免疫层析定量快速检测卡对50份阴性的样品(40份河豚毒素阴性空白样品和10份河豚毒素添加浓度为10μg/kg的样品)进行检测,分别以荧光读卡仪读数河豚毒素含量≤10μg/kg和≥10μg/kg的河豚样品为阴性对照和阳性对照,计算假阳性率,表4为河豚毒素免疫荧光快速检测卡检测阴性样品的假阳性率试验结果。
表4
用3个批次的河豚毒素荧光免疫层析定量快速检测卡对50份阳性的样品(40份河豚毒素添加浓度为20μg/l的样品和10份河豚毒素添加浓度为40μg/l的样品)进行检测。分别以荧光读卡仪读数河豚毒素含量≤10μg/kg和≥10μg/kg的河豚样品为阴性对照和阳性对照,计算假阴性率,表5为河豚毒素免疫荧光快速检测卡检测阴性样品的假阴性率试验结果。
表5
取水产样品10份,同时采用本发明河豚毒素免疫荧光快速检测试纸条和gb5009206-2016“食品安全国家标准水产品中河豚毒素的测定”进行检测,对检测结果进行比较。
河豚毒素小鼠检测法如下:
采集河豚毒素及织纹螺的肌肉组织20g,加入等量的0.1%醋酸溶液捣碎,沸水浴中抽提5min,抽提液5000r/min离心20min后,取上清液1ml对体重20g左右的小白鼠进行腹腔注射,并测定其死亡时间,根据小白鼠死亡时间推算出织纹螺毒素的毒力。将体重为20g小白鼠在30min毒死的毒素,毒力定义为一个小鼠单位(mouseunit,mu)。本方法毒素检出限为1mu/ml软组织。
表6
河豚鱼样品小鼠检测与河豚毒素免疫荧光快速检测卡检测结果对比如表6所示,根据1个鼠单位为220ng进行计算,以小鼠检测方法的结果为标准参考,荧光免疫层析方法检测河豚毒素的平均相对误差为4.1%,可以满足日常对河豚毒素检测的要求。
本实施例液相色谱-串联质谱法的检测限为1μg/kg,定量限为3μg/kg。液相色谱条件:色谱柱:c18色谱柱,150mm×2.1mm,粒径5μm;流动相:乙腈/5mmol/l乙酸铵的0.1%甲酸水(v/v,20/80);柱温:40℃;进样量:10μl。质谱条件:离子源:esi源;扫描方式:正离子扫描;检测方式:多反应离子监测。表7为河豚毒素多反应监测的优化参数。
表7
河豚毒素免疫荧光快速检测卡检测结果与仪器方法测定值比对如下:
选用20个河豚肉样品,其中12个为阴性样,检测结果均为阴性;8个为随机加标样(10~40μg/kg),用河豚毒素免疫荧光快速检测卡检测结果与液质联用检测结果(液质联用检测限为1μg/kg,定量限为3μg/kg)如表8所示。河豚毒素免疫荧光快速检测卡检测结果相对误差在4.1~56.1%之间。相关性分析如图8所示,河豚毒素免疫荧光快速检测卡检测结果与液质联用检测结果的线性方程为y=0.9052x+2.0623,相关系数r=0.9381。结果说明河豚毒素免疫荧光快速检测卡的检测结果与液质联用检测结果有良好线性相关,可以应用于对河豚样品河豚毒素的检测筛选工作。
表8(μg/kg)
表9
本发明的快速定量检测方法,其保留了胶体金试纸条现场快速检测的优点,又加入了荧光检测技术灵敏度高的特点,同时配以相关仪器以实现对样品的快速定量检测。表9为荧光免疫层析检测方法与常规检测方法对比表,如表9所示,荧光免疫层析技术可以满足定量检测,同时相比常规检测,具有检测时间短、检测成本低的特点。
本发明河豚毒素免疫荧光快速检测卡,实现对河豚毒素的快速定量检测,检测范围为1~370ng/ml,可以满足日常对河豚毒素的快速检测需求。
河豚毒素免疫荧光快速检测卡最低检测限是1ng/ml,定量限是10ng/ml,检测线性范围是10~200ng/ml,检测误差小于15%。与仪器法比较,检测50份阴性河豚的假阳性率为0%,50份阳性河豚的假阴性率为0%,可以满足日常对河豚毒素的快速检测需求。
- 还没有人留言评论。精彩留言会获得点赞!