基于电位分辨电化学发光的抗原检测方法与流程
本发明属于肿瘤标志物同时识别与检测领域,尤其涉及基于电位分辨电化学发光的抗原检测方法。
背景技术:
常规影像学检查在肿瘤早期诊断中捉襟见肘,而组织活检技术对患者侵害性较大,不适于预后判断和疗效监测。肿瘤标志物是肿瘤细胞通过基因表达而合成、分泌,或由机体对肿瘤发生反应而生成的一类物质,在肿瘤早期筛查、预后判断及疗效监测等方面有重要作用。因此,需要发展高灵敏度的免疫传感器用于肿瘤标志物的检测。目前已报道的免疫传感器大多用于单一肿瘤标志物检测。然而,肿瘤标志物并不具备器官特异性,单一肿瘤标志物对于肿瘤细胞异常表现的敏感性或特异性偏低。如癌胚抗原(cea)在肺癌、乳腺癌、结直肠癌、宫颈癌等多种癌症中均可检出。寻找针对某一种肿瘤,并具有100%特异性和敏感性的“理想”肿瘤标志物是十分困难的。临床上为了提高肿瘤检测的准确性和可靠性,往往都是检测与目标肿瘤相关的一组标志物,因此,亟待发展多组分免疫分析新方法与新技术。
迄今为止,科研人员已结合免疫分析、核酸杂交等生化分析手段,将多种光电分析方法,如荧光分光光度法、化学发光法、电化学发光法、电化学法和光致电化学法等用于肿瘤标志物的检测。其中,电化学发光无需外加光源,设备简单,采用其作为输出信号的传感器灵敏度高、背景信号低。目前已构建的多指标电化学发光免疫分析传感器大多采用空间分辨的形式实现不同肿瘤标志物的区分的。这种结构的传感器需要构建光电性能稳定的多孔板电极阵列,分析成本高,样品消耗量大。发明专利“一种检测双肿瘤光致电化学免疫传感器的构建方面”(专利申请号:201711054579.x)公开了一种基于枝状二氧化钛纳米棒-钛酸锶(b-tio2nrs-srtio3)异质结双组份光致电化学免疫传感器的构建方法,可实现甲胎蛋白和糖类抗原153的同时检测。该方法由于激发光源和检测信号完全分离,在检测过程中背景信号被极大地削弱,从而提高了检测灵敏度。但是,水热法合成纳米材料易受环境影响,重复性较差,进而影响到修饰电极界面的稳定性和重现性。
最近发展起来的电位分辨多色电化学发光免疫分析法,受到人们广泛的关注。实现电位分辨电化学发光的发光体种类繁多,既可以是分子发光体,也可以是纳米发光体,抑或是二者形成的杂化体。目前,使用最为广泛的电化学发光分子是三联吡啶钌(ii)(ru(bpy)32+)及其衍生物,这类化合物发光强度稳定,发光效率高,但其发光波长单一,已报道的钌联吡啶配合物的电化学发光波长大多位于红橙光范围;而且钌(ii)金属配合物的中心金属配位场分裂能有限,采用配体修饰等策略对其发光波长调控的能力极其微弱,因此,限制了其在多指标同时检测中的应用。金属铱(iii)的配位场分裂能高于钌(ii),可用于短波长电化学发光探针分子的制备。理论上,可以从激发和发射两个途径区分电化学发光过程。合成一系列发射波长迥异的发光分子,即可通过调节发射过程实现电化学发光的光谱分辨,该过程的调制相对简单。但是,对于电化学发光激发过程的调制则比较复杂,其难点在于发光体的选择和激发电位的控制上。对于大多数发光体,一旦施加的电位达到发光电位临界值,发光会持续产生。如果多种发光体的发射波长相近,则很难通过测试发光强度实现精确的多组分定量分析,除非发光体具备电位分辨能力。
技术实现要素:
本发明的目的在于提供一种提出了一种基于电位分辨多色电化学发光对同一样本中多种抗原同时检测的方法,该方法灵敏度高、检测通量高、分析速度快、样品消耗量少。
为了达到上述目的,本发明的技术方案如下:
一种基于电位分辨电化学发光的抗原检测方法,包括以下步骤:
(1)制备电化学发光探针,所述电化学发光探针的材料选自钌金属配合物或铱金属配合物;
(2)将步骤(1)制备的电化学发光探针掺杂到聚合物微球;
(3)将检测抗体标记到聚合物微球表面,得到检测抗体和电化学发光探针双重编码聚合物微球;
(4)将捕获抗体共价标记到磁微球表面,得到捕获抗体标记的免疫磁微球;
(5)将步骤(3)制备的双重编码聚合物微球和免疫磁微球放入待测溶液中,磁分离,再通过溶胀聚合物微球释放电化学探针;
(6)采集步骤(5)释放的电化学探针在不同电位下的电化学发光信号,识别检测的抗原。
在步骤(1)中,所述的电化学探针的电化学发光波长为491nm到636nm,发光电位位于0.7v至1.75v之间。
所述的电化学发光探针的材料选自二(2-(2,4-二氟苯基)-5-三氟甲基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱(iii)、三(2-苯基吡啶)合铱(iii)、二(2-苯基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱(iii)、二(2-苯基吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)铱(iii)、三(2,2′-联吡啶)钌(ii)或二(2,2′-联吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)钌(ii)中的一种或至少两种的组合。
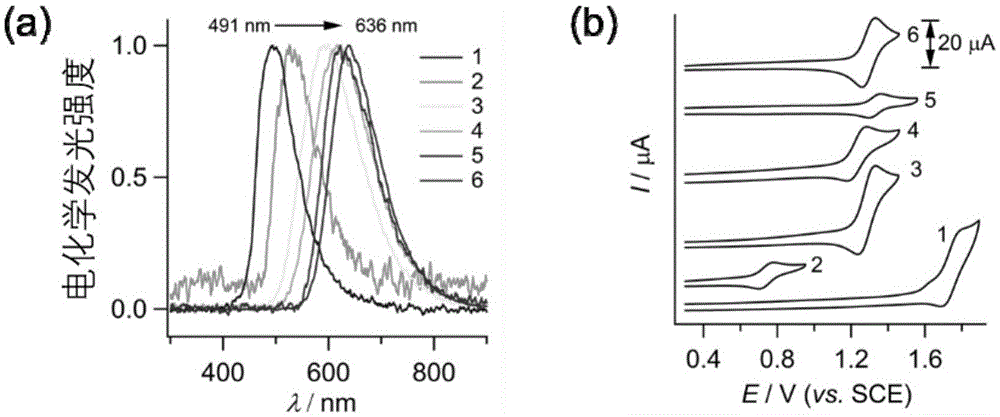
上述材料制备的电化学发光探针对应的电化学发光波长和电位依次为:622nm,1.33v;636nm,1.30v;491nm,1.75v;526nm,0.74v;591nm,1.29v;614nm,1.23v。
二(2-(2,4-二氟苯基)-5-三氟甲基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱、三(2-苯基吡啶)合铱、二(2-苯基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱和二(2-苯基吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)铱的结构式如下所示:
三(2,2′-联吡啶)钌和二(2,2′-联吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)钌的结构式如下所示:
本发明所述的电化学发光探针具有乙烯基功能化标记位点或者可掺杂到聚合物微球中,实现对生化识别单元,如抗体和dna等的标记。
(2-苯基吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)铱电化学发光探针和二(2,2′-联吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)钌电化学发光探针具有可修饰的乙烯基功能化位点。
所述的钌金属配合物电化学发光探针的材料选自二(2,2′-联吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)钌、二(2-(2,4-二氟苯基)-5-三氟甲基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱或三(2-苯基吡啶)合铱中的一种或至少两种的组合。
在步骤(2)中,所述的聚合物微球选自聚苯乙烯微球、聚甲基丙烯酸环氧丙酯微球或聚丙烯酰胺微球中的一种。
球粒径分布均一,表面具有羧基、氨基、羟基等多种官能基团,直径为100nm至10μm。
在步骤(5)中,溶胀聚合物微球的溶剂选自乙腈、四氢呋喃或n,n-二甲基甲酰胺中的一种。
有机溶剂与水的体积比为1:9,2:8和3:7中的一种,进一步优选为1:9。
溶解二(2,2′-联吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)钌电化学探针和二(2-(2,4-二氟苯基)-5-三氟甲基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱电化学探针的有机溶剂为乙腈,溶解三(2-苯基吡啶)合铱电化学探针的有机溶剂为四氢呋喃。
在步骤(6)中,所述的电化学发光信号为电位、发光波长和强度。
在步骤(6)中,通过电化学发光池采集电化学发光信号,所述电化学发光池由工作电极、对电极和参比电极组成,所述工作电极选自氧化铟锡电极、氟掺杂氧化锡电极、金电极、玻碳电极或丝网印刷电极中的一种。
所述的待测溶液选自缓冲溶液、血液、尿液、组织液或唾液中的一种;所述的待测溶液中含有的抗原选自癌胚抗原(cea)、甲胎蛋白(apf)和人绒毛膜促性腺激素(β-hcg)中的一种或至少两种的组合。
具体地,在步骤(2)中,掺杂到聚合物微球的方法为:将电化学发光探针的有机溶液,滴加至含有聚合物微球的水相溶液中,振荡混合,洗涤,放置于真空干燥烘箱中处理;加入pbs溶液,重新分散,避光保存。
当检测多种抗原时,需要配置不同电化学发光探针的有机溶液,分别滴加至含有聚合物微球的水相溶液中,制备不同电化学发光探针掺杂到聚合物微球。
所加入有机溶剂量为20μl-200μl;超声时间为10min-2h。
混合条件为:温度为室温,时间为1-3小时;真空干燥烘箱温度为30-60℃,时间1-3小时;pbs缓冲液浓度为5-50mm,ph6.8-7.4。
具体地,在步骤(3)中,将检测抗体标记到聚合物微球表面的方法为:加入mes缓冲溶液,洗涤;再加入现配的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和n-羟基琥珀酰亚胺磺酸钠盐的mes缓冲溶液,振荡反应,用含有吐温-20的pbs溶液(pbst)洗涤;加入链酶亲和素溶液,孵育,洗涤,重悬于pbs溶液中;加入生物素化的检测抗体,孵育,pbst溶液洗涤,加入bas封闭,避光保存。
所述的mes缓冲溶液的浓度为0.05-0.2m,ph为4-6,进一步优选为5.5。1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和n-羟基琥珀酰亚胺磺酸钠盐的mes缓冲溶液均为10-20mg/ml。孵育温度为室温或37℃,时间为15-30分钟。pbst缓冲溶液中吐温-20的浓度为wt.0.002-0.01%;链酶亲和素浓度为0.1-1mg/ml。
生物素化抗体浓度为1mg/ml;孵育温度为室温或37℃,时间为0.5-1.5小时;bsa浓度为wt.0.5-2%。
具体地,在步骤(5)中,先将免疫磁微球加入到待测样本中,孵育,磁分离,洗涤;再加入双重编码聚合物微球,孵育,形成免疫复合物,磁分离,洗涤;加入有机溶剂,密封,超声,溶胀聚合物微球,释放发光探针。
待测样本为含有癌胚抗原(cea)、甲胎蛋白(afp)和人绒毛膜促性腺激素(β-hcg)的pbs溶液,三种抗原的浓度分别为5ng/ml,25ng/ml和5miu/ml,对应于临床诊断临界值;免疫反应孵育温度为室温或37℃,时间为0.5-1小时。
有机溶剂体积为50-500μl,超声20-60分钟。
具体地,在步骤(6)中,将待测液加入到电化学池中,施加三种不同的氧化电位,分别记录每一电位下的电化学发光光谱;根据发光波长、电位与待测物的对应关系,进行分类,识别。
具体地,在步骤(7)中,工作电极优选为玻碳电极(gce);测试中使用的共反应剂分子为三正丙胺(tpra),浓度为20-100mm,采用的支持电解质为四丁基六氟磷酸铵(tbapf6),浓度为0.2m。
本发明通过合成发光电位不同且发光波长迥异的电化学发光探针,并将其掺入到聚合物微球中,进一步将检测抗体标记到聚合物微球表面,由此制备得到检测抗体和电化学发光探针双重编码聚合物微球;然后将捕获抗体共价标记到磁微球表面,再将免疫磁微球和双重编码聚合物小球先后加入到待测溶液中,经由免疫夹心反应,形成免疫复合物,利用磁分离技术,将免疫复合物从反应体系中拉取下来;加入有机溶剂,溶胀聚合物微球,释放电化学发光探针;通过三电极系统施加不同的电位,采集不同电位下的电化学发光信号,根据电化学发光信号产生电位、发光波长和强度,实现多种目标分析物的同时识别与选择性检测。
相对于现有技术,本发明的有益效果具体体现在:
(1)本发明提供的抗原检测方法通过电化学发光波长和电位均可分辨的探针分子,并且构建了一种电位分辨多色电化学发光的免疫分析传感器传感器,实现了多种指标的同时测定,弥补了单组分免疫分析通量低,测试时间长的缺陷,同时改善了基于空间分辨的多组分免疫分析样品消耗量大及基底电极界面构筑成本高的问题。
(2)本发明构建的多组分免疫分析传感器具有灵敏度高、准确性好的特点,非常适用于开发针对某一目标肿瘤检测的试剂盒,如cea作为宫颈癌的首选指标,而afp和hcg等则作为辅助指标。
(3)本发明提供的抗原检测方法分析速度快,只要几分钟即可得到检测结果。
(4)本发明提出的抗原检测方法只需更换相应的抗体对,即可实现对其他抗原的高灵敏同时检测;也可拓展到其他指标的检测,如传染性疾病、心血管疾病、性腺激素等指标。结合核酸杂交技术,则可实现dna分子诊断。
(5)本发明提供的抗原检测方法的样本消耗量少,仅需50μl-1ml。
附图说明
图1为本发明提供的电化学发光探针分子的电化学发光光谱图和伏安图;
图2为本发明提供的检测抗体和探针分子双重编码聚合物微球的制备流程图;
图3为实施例1中检测抗原的流程示意图;
图4为实施例1电化学发光测试的示意图;
图5为实施例1中对同一样本三种抗原(afp、cea和β-hcg)的检测结果:(a)不同氧化电位下得到的电化学发光光谱,(b)归一化图,(c)模式识别图;
图6为实施例2中对单一组分选择性检测结果:(a)cea,(b)afp,(c)β-hcg,(d)检测结果图。
具体实施方式
为了阐明本发明的技术方案及技术目的,下面结合附图及具体实施方法对本发明作进一步介绍。
如图2所示,本发明提供了一种基于电位分辨电化学发光的抗原检测方法,包括以下步骤:
(1)制备电化学发光探针,所述电化学发光探针的材料选自钌金属配合物或铱金属配合物。
电化学发光探针的材料选自三(2,2′-联吡啶)钌、二(2,2′-联吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)钌、二(2-(2,4-二氟苯基)-5-三氟甲基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱、三(2-苯基吡啶)合铱、二(2-苯基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱或二(2-苯基吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)铱。其电化学发光光谱图和伏安图如图1所示,分别对应5-6号、1-4号。
(2)将步骤(1)制备的电化学发光探针掺杂到聚合物微球;
(3)将检测抗体标记到聚合物微球表面,得到检测抗体和电化学发光探针双重编码聚合物微球。
(4)将捕获抗体共价标记到磁微球表面,得到捕获抗体标记的免疫磁微球。
(5)将步骤(3)制备的双重编码聚合物微球和免疫磁微球放入待测溶液中,磁分离,再通过溶胀聚合物微球释放电化学探针。
(6)采集步骤(5)释放的电化学探针在不同电位下的电化学发光信号,识别检测的抗原。
实施例1
如图3所示,同时检测甲胎蛋白(afp)、癌胚抗原(cea)和人绒毛膜促性腺激素(β-hcg)。
多指标同时检测的模拟样本是含有cea、afp和β-hcg的pbs溶液。根据肿瘤标志物的临床检测值,检测体系中cea、afp和β-hcg终浓度分别调节为5ng/ml、25ng/ml和5miu/ml。多种肿瘤标志物同时检测的流程主要包括孵育、磁分离、洗涤、检测等步骤。具体操作如下:
(1)分别取100μl三种捕获抗体标记的磁珠溶液(磁珠浓度均为1mg/ml)加入到300μlpbs模拟样本中,在37℃恒温振荡器中孵育30min。孵育完成后,将离心管放在磁分离架上,静置3min,吸弃上清液,再加入400μlpbst缓冲溶液,重新混匀,洗涤;此步骤重复3次。
(2)加入300μl0.5%bsa/pbs溶液,再依次加入25μl1mg/mlab(afp)-二(2,2′-联吡啶)(4,4′-二乙烯基苯基-2,2′-联吡啶)钌@psb,25μl10mg/mlab(cea)-三(2-苯基吡啶)合铱@psb和25μl10mg/mlab(β-hcg)-二(2-(2,4-二氟苯基)-5-三氟甲基吡啶)(4,4′-二叔丁基-2,2′-联吡啶)铱@psb,混合均匀后,37℃孵育30min。磁分离/洗涤操作如上所述,重复5次。其中,psb是指聚苯乙烯微球,ab是指检测抗体。
(3)将免疫复合物放入60℃真空干燥烘箱中,干燥2h。加入100μl乙腈溶液,超声,溶胀聚苯乙烯微球,释放探针分子;磁分离及离心处理后,保留上清液。
(4)在电化学发光测试前,加入100μl含有100mmtpra和0.2mtbapf6的乙腈溶液。
图4为电化学发光测试的示意图。
图5为多种肿瘤标志物同时检测的电化学发光谱(a)及归一化光谱图(b);当施加0.75v的氧化电位时,采集到了发光波长位于520nm的电化学发光谱,对应于cea的检出;当施加1.33v的氧化电位时,观察到了发光波长位于640nm的电化学发光峰,表明afp的成功检出;当施加的氧化电位为1.75v时,在500nm处观察到了一个电化学发光峰,说明β-hcg的存在;由于ru(bpy)2(dvbpy)2+的电化学发光具有电位跟随性,因此,在640nm出也观察到了一组电化学发光信号。通过提取电化学发光谱的电位和波长两种信息,对检测结果进行分类,得到模式识别图(c)。多次测试后,得到的平均值及标准偏差。
实施例2
将任意一对检测抗体标记的聚合物微球和捕获抗体标记的磁珠加入到该模拟样本中,考察多指标样本中单一指标的选择性检测性能。
以afp的选择性检测为例,取100μl含有1mg/mlab(afp)-mb的pbs缓冲溶液和200μl0.5%bsa/pbs溶液加入到300μl上述样本中,37℃孵育30min。分离/洗涤,重复3次;然后加入300μl0.5%bsa/pbs溶液,25μl1mg/mlab(afp)-ru@psb和50μl0.5%bsa/pbs溶液,混合均匀后,37℃孵育30min。分离/洗涤,重复5次,真空干燥后,加入100μl乙腈溶液,超声溶胀。检测cea和β-hcg时,加入的探针分子浓度均为10mg/ml,其他操作步骤与上述流程均一致。
图6所示的是单一组分选择性检测的电化学发光光谱图及结果图。当外加电位为0.74v时,观察到了一个波长位于520nm的电化学发光光谱,对应于cea的检出(图6a);当外加电位为1.33v,观察到了发光波长位于640nm的电化学发光峰,对应于afp的检出(图6b);当外加电位为1.75v时,观察到了发光波长位于500nm的电化学发光峰,对应于β-hcg的检出(图6c);图6d是多次测量得到的结果图,表明该方法具有良好的选择性和特异性。
- 还没有人留言评论。精彩留言会获得点赞!