抗坏血酸测定用电极和生物传感器的制作方法
本发明涉及用于测定试样中的抗坏血酸浓度的电极和生物传感器,尤其涉及用于测定高浓度的抗坏血酸的电极和生物传感器。
背景技术:
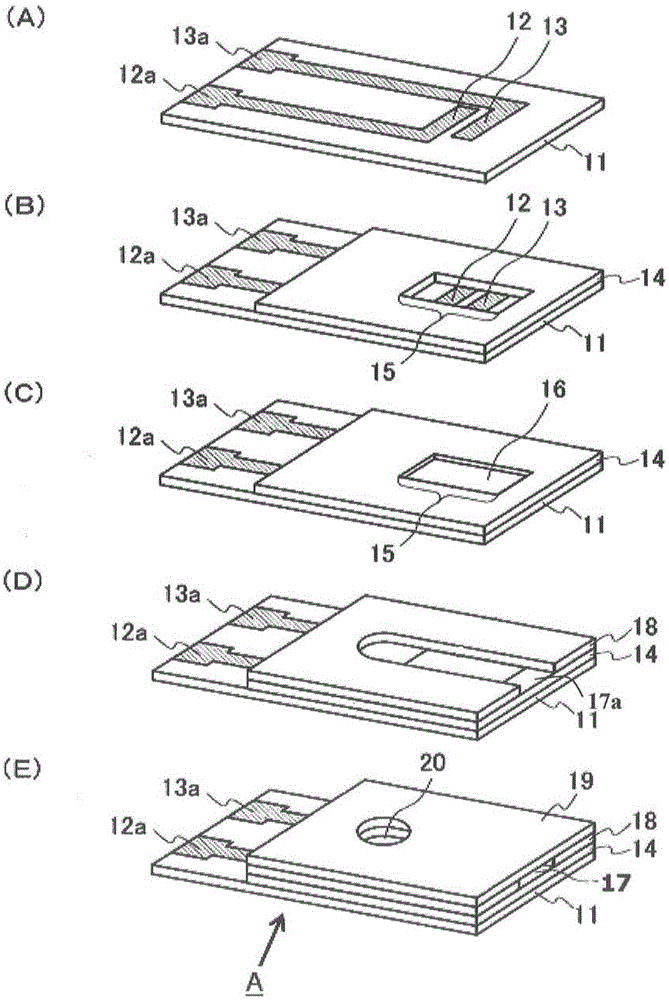
:抗坏血酸(维生素c)通过饮食摄取,被小肠吸收而广泛分布到体内的脏器和组织中。在生物化学方面,参与胶原蛋白的合成、左旋肉碱的合成、肾上腺皮质激素的合成、儿茶酚胺的合成、过氧化脂质的分解、活性氧的分解等,在生物体内起到重要的作用。近年来,维生素c的强还原性所带来的抗癌作用、免疫力增强、以及美肌、美白效果受到关注,被应用于高浓度维生素c点滴疗法等中。作为抗坏血酸的测定,可以举出用于抗坏血酸缺乏症诊断的测定、食品中的抗坏血酸的测定等。另外,在高浓度维生素c点滴疗法中,必须即时监控血中的维生素c浓度,另外,在糖尿病的自我血糖测定中,血中的抗坏血酸会对葡萄糖测定值产生影响,因此需要根据抗坏血酸浓度的测定值对葡萄糖值进行校正。在专利文献1中公开了下述方法:作为食品中的微量营养素,利用高效液相色谱(hplc)法对抗坏血酸进行测定。在专利文献2中,作为抗坏血酸测定的一例,公开了一种生物传感器,其具有以包含抗坏血酸氧化酶和铁氰化物等电子介体的检测层作为构成要素的电极。现有技术文献专利文献专利文献1:日本特表2005-517926专利文献2:日本特开平09-243591技术实现要素:关于现有文献1的利用高效液相色谱(hplc)法的抗坏血酸测定,由于装置昂贵而存在成本方面的问题。另外,上述装置大多设置于大型的医疗设施或检查中心,在未设置有装置的设施中,要对检查进行外包分析,因此无法进行实时测定,特别是在高浓度维生素c点滴疗法中,考虑到维生素c的代谢及排出的影响,希望进行实时测定,从而成为问题。在现有文献2中,能够利用生物传感器进行简便、即时(实时)的测定,但由于使用了抗坏血酸氧化酶等酶催化剂,因此存在非特异性催化反应导致的测定精度变差的问题。另外,由于酶的变性而使传感器的保存稳定性差,因此需要增加酶的配方量,存在成本提高的问题。鉴于上述情况,本发明的课题在于以良好地精度、低成本、简便地进行抗坏血酸的即时测定。发明人为了解决上述课题进行了深入研究,结果发现了下述抗坏血酸响应电极,其不使用现有的hplc或抗坏血酸氧化酶之类的酶催化剂,能够以良好的精度简便地测定抗坏血酸。即,本发明提供一种抗坏血酸响应电极,其特征在于,包含电极和检测层,该检测层与该电极接触,包含从抗坏血酸进行电子转移的非催化剂的电子受体、以及氨基酸与糖类和/或可溶性蛋白质,在该检测层中,上述电子受体被上述抗坏血酸还原,该电子受体在上述电极被氧化。另外,本发明提供一种生物传感器,其包含基板以及设置于该基板上的上述抗坏血酸响应电极和反电极。另外,本发明提供一种抗坏血酸浓度的测定方法,其特征在于,使含抗坏血酸的试样与上述生物传感器反应,对上述抗坏血酸响应电极施加氧化电位并测定响应电流,基于该响应电流计算出抗坏血酸浓度。另外,本发明提供一种测定装置,其由下述部分构成:上述生物传感器;控制部,控制对生物传感器的电压施加;检测部,检测通过对生物传感器施加电压而得到的抗坏血酸响应电流;运算部,由上述电流值计算出抗坏血酸的浓度;和输出部,输出上述计算出的抗坏血酸的浓度。上述“电子受体”是能够从具有能够提供电子的电子供体的功能的化合物转移电子的化合物。上述“非催化剂”是指不具有酶或细胞器等催化化学反应的生物体催化剂的功能、或者生物体催化剂的功能小。抗坏血酸作为还原性物质具有强电子供体的功能。利用该特性,实现了将来自抗坏血酸的电子向电子受体的电子转移。此外,转移了来自电子供体的电子后的电子受体成为还原体,因此能够在电极上以电化学方式进行氧化反应。此外,在上述检测层中,除了上述电子受体以外,通过添加适量的氨基酸与糖类和/或可溶性蛋白质,能够控制在仅有电子受体的反应体系中产生的过度的反应速度。由此,抗坏血酸高浓度区域中的传感器性能的线性和再现性飞跃性地提高。通过这些各种功能完成了本发明。发明的效果本发明的抗坏血酸响应电极由于不使用酶,因此能够进行抑制了由非特异性催化反应导致的测量精度的劣化的、高精度的抗坏血酸的测定。另外,由于不存在因酶蛋白的变性引起的保存稳定性的问题,因此能够抑制成本。此外,通过使电子受体和抗坏血酸在适量的氨基酸与糖类和/或可溶性蛋白质的存在下进行反应,即使在抗坏血酸高浓度区域也能够以良好的精度进行测定。因此,根据本发明,能够以良好的精度、低成本且简便地进行抗坏血酸的即时测定。附图说明图1是示出本发明的一个实施方式的生物传感器的制造方法的一例的工序图,(a)~(e)示出各工序中的生物传感器的示意图。图2是示出本发明的测定装置的一个方式的示意图。图3是示出使用了本发明的测定装置的测定程序的一个方式的流程图。图4是示出使包含各种浓度的抗坏血酸的试样与实施例和比较例的生物传感器反应并施加电压时的响应电流值的图。图5是示出包含各种浓度的抗坏血酸的试样的测定时的实施例和比较例的生物传感器的再现性的图。图6是示出使包含各种浓度的抗坏血酸的试样与氨基酸和可溶性蛋白质浓度不同的实施例的生物传感器反应并施加电压时的响应电流值的图。图7是示出使包含各种浓度的抗坏血酸的试样与包含各种浓度的各种氨基酸和各种浓度的可溶性蛋白质的实施例的生物传感器反应并施加电压时的响应电流值的图。图8是示出使包含各种浓度的抗坏血酸的试样与包含氨基酸和糖类或可溶性蛋白质的实施例的生物传感器反应并施加电压时的响应电流值的图。a示出使用包含牛磺酸和木糖醇的实施例的生物传感器的结果。b示出使用包含牛磺酸和海藻糖的实施例的生物传感器的结果。c示出使用包含牛磺酸和bsa(牛血清白蛋白)的实施例的生物传感器的结果。具体实施方式(电极的构成)本发明的抗坏血酸响应电极的特征在于,包含电极和检测层,该检测层包含从抗坏血酸进行电子转移的非催化剂的电子受体、以及氨基酸与糖类和/或可溶性蛋白质,在上述检测层中,上述电子受体被上述抗坏血酸还原,该电子受体在上述电极被氧化。需要说明的是,检测层与包含酶和电子受体的现有酶电极不同,在本发明的抗坏血酸响应电极中,检测层包含电子受体、但不包含酶。(电极)电极只要是具有导电性的材料就没有特别限制,例如使用金(au)、铂(pt)、银(ag)和钯(pd)之类的金属材料、或者以石墨、碳纳米管、石墨烯、介孔碳等碳为代表的碳材料而形成。电极例如形成于绝缘性基板上。绝缘性基板利用聚醚酰亚胺(pei)、聚对苯二甲酸乙二醇酯(pet)、聚乙烯(pe)之类的热塑性树脂、聚酰亚胺树脂、环氧树脂之类的各种树脂(塑料)、玻璃、陶瓷、纸之类的绝缘性材料形成。电极和绝缘性基板的尺寸、厚度可以适当设定。(电子受体)作为电子受体,只要是从抗坏血酸接受电子而被还原、在电极上被再氧化、无催化作用的化合物即可,例如可以举出钌化合物、铁氰化钾、细胞色素c、吡咯并喹啉醌(pqq)、nad+、nadp+、铜络合物和吩嗪硫酸甲酯及其衍生物、锇络合物等,它们可以单独使用,也可以合用两种以上。这些之中,优选为由氧化型的金属原子和配体构成的络合物,更优选为由3价钌(ru(iii))和配体构成的氧化型钌络合物。本发明中使用的电子受体可以使用利用通常的有机合成化学方法合成的电子受体、或者市售的电子受体。(氧化型钌络合物)作为氧化型钌络合物的配体,例如可以举出氨、联吡啶、咪唑、氨基酸、菲咯啉、乙二胺等含氮配体或卤素配体。需要说明的是,也可以将它们组合而作为混合配体。成为电子受体的氧化型钌络合物也可以以盐等方式含有于检测层中,在反应前和/或反应时形成反应性的络合物。这种方式也包含在本发明中。例如,作为钌氨络合物,优选可以举出以下的化合物。[ru(nh3)5x]n+此处,作为x,可以举出nh3、卤素、cn、吡啶、烟酰胺、联吡啶或h2o等,这些之中,优选nh3或卤素(例如cl、f、br、i)。上述化学式中的n+表示氧化型钌(iii)络合物的价数,根据x的种类适当确定。作为联吡啶钌络合物的例子,例如有[(联吡啶)3钌]、[(4,4’-二甲基-2,2’-联吡啶)3钌]、[(4,4’-二苯基-2,2’-联吡啶)3钌]、[(4,4’-二氨基-2,2’-联吡啶)3钌]、[(4,4’-二羟基-2,2’-联吡啶)3钌]、[(4,4’-二羧基-2,2’-联吡啶)3钌]、[(4,4’-二溴-2,2’-联吡啶)3钌]、[(5,5’-二甲基-2,2’-联吡啶)3钌]、[(5,5’-二苯基-2,2’-联吡啶)3钌]、[(5,5’-二氨基-2,2’-联吡啶)3钌]、[(5,5’-二羟基-2,2’-联吡啶)3钌]、[(5,5’-二羧基-2,2’-联吡啶)3钌]、[(5,5’-二溴-2,2’-联吡啶)3钌]等。作为咪唑钌络合物的例子,例如有[(咪唑)6钌]、[(4-甲基咪唑)6钌]、[(4-苯基咪唑)6钌]、[(4-氨基咪唑)6钌]、[(4-羟基咪唑)6钌]、[(4-羧基咪唑)6钌]、[(4-溴咪唑)6钌]等。检测层中的电子受体的含量可以根据测定试样的种类等适当确定,例如,相对于检测层的每1cm2表面积,优选为0.1μmol~50μmol、更优选为0.1μmol~10μmol、特别优选为0.1μmol~5μmol。作为电极用试剂(检测层制备液)中的电子受体的含量,没有特别限定,例如为1.5质量%~10质量%、优选为2.5质量%~5质量%。(氨基酸、糖类、可溶性蛋白质)本发明的抗坏血酸响应电极中,在检测层中,电子受体从试样中包含的抗坏血酸接受电子而被还原,被还原的电子受体在电极上被再氧化。此处,通过在检测层中包含氨基酸与糖类的组合、氨基酸与可溶性蛋白质的组合、或者氨基酸与糖类和可溶性蛋白质的组合,能够调整试剂(特别是电子受体)的溶解速度,能够调整氧化还原反应速度。因此,甚至在抗坏血酸高浓度区域也能维持良好的线性。另外,通过在检测层中包含氨基酸与糖类和/或可溶性蛋白质的组合,传感器间的试剂的溶解速度也变得均匀,因此可得到高浓度区域中的高再现性。作为氨基酸,只要富于可溶性、能够与上述成分组合而调整试剂的溶解速度并调整氧化还原反应速度就没有特别限定。此处,氨基酸除了氨基羧酸以外还包含以牛磺酸为代表的氨基磺酸。作为氨基酸,例如可以举出甘氨酸、丙氨酸等脂肪族氨基酸、苯丙氨酸等芳香族氨基酸、脯氨酸等亚氨基酸、丝氨酸、苏氨酸等含氧氨基酸、半胱氨酸、甲硫氨酸、牛磺酸等含硫氨基酸、缬氨酸、亮氨酸、异亮氨酸等支链氨基酸、天冬氨酸、谷氨酸等酸性氨基酸、天冬酰胺、谷氨酰胺等酸性氨基酸酰胺、赖氨酸、精氨酸等碱性氨基酸、色氨酸、组氨酸等杂环式氨基酸或它们的盐(例如谷氨酸钠等)等,优选脂肪族氨基酸、含氧氨基酸、含硫氨基酸、酸性氨基酸盐。它们可以单独使用,也可以合用两种以上。检测层中的氨基酸的含量可以根据测定试样的种类等适当确定,例如,相对于检测层的每1cm2表面积,优选为1μmol~100μmol、更优选为10μmol~50μmol、特别优选为10μmmol~15μmol。作为电极用试剂中的氨基酸的含量,没有特别限定,例如为2.5质量%~5.0质量%、优选为4.5质量%~5.0质量%。作为糖类,只要富于可溶性、能够与氨基酸组合而调整试剂的溶解速度并调整氧化还原反应速度就没有特别限定,例如可以举出单糖、二糖、低聚糖、多糖、糖醇、氨基糖等,优选二糖和糖醇。作为单糖,可以举出葡萄糖、果糖、甘露糖、半乳糖、木糖、阿拉伯糖等。作为二糖,可以举出海藻糖、曲二糖、黑曲霉二糖、麦芽糖、异麦芽糖、乳糖、蔗糖等。作为低聚糖,可以举出糊精、低聚半乳糖、低聚果糖等,作为糖醇,可以举出山梨糖醇、木糖醇、赤藓醇、甘露醇、麦芽糖醇等。它们可以单独使用,也可以合用两种以上。检测层中的糖类的含量可以根据测定试样的种类等适当确定,例如,相对于检测层的每1cm2表面积,优选为1μmol~100μmol、更优选为1μmol~50μmol、特别优选为1μmol~10μmol。作为电极用试剂中的糖类的含量,没有特别限定,例如为1.2质量%~2.5质量%、优选为2.4质量%~2.5质量%。作为可溶性蛋白质,只要富于可溶性、能够与氨基酸组合而调整试剂的溶解速度并调整氧化还原反应速度、可溶于水性溶剂就没有特别限定,例如可以举出来自蚕丝蛋白的neoproteinsaver(nps)(东洋纺);作为牛、人等的血清成分的白蛋白、酪蛋白、明胶等可溶于水性溶剂的蛋白质。它们可以单独使用,也可以合用两种以上。可溶性蛋白质的分子量没有特别限制,例如可以为1,000da~100,000da左右。检测层中的可溶性蛋白质的含量可以根据测定试样的种类等适当确定,例如,相对于检测层的每1cm2表面积,优选为0.1nmol~50nmol、更优选为10nmol~50nmol、特别优选为10nmol~30nmol。作为电极用试剂中的可溶性蛋白质的含量,没有特别限定,例如为1.2质量%~2.5质量%、优选为2.4质量%~2.5质量%。本发明中使用的氨基酸、糖类、可溶性蛋白质可以使用利用通常的有机合成化学方法合成的物质、或者市售品。作为电极中的氨基酸与糖类的含有比(质量比),通常为5:1~1:1、优选为2.5:1~1:1。作为电极中的氨基酸与可溶性蛋白质的含有比(质量比),通常为5:1~1:1、优选为2.5:1~1:1。作为电极中的电子受体与氨基酸的含有比(质量比),通常为1:5~1:1、优选为2:3~1:2。在电极制造工序中,作为检测层制备液,可以制备成含有电子受体、氨基酸、糖类、可溶性蛋白质、以及溶剂或分散介质的对应于丝网印刷的油墨,通过利用丝网印刷方法在树脂等基材上进行图案印刷来形成电极,能够提高电极制作效率,能够缩小传感器间差异。需要说明的是,检测层可以追加包含缓冲剂、表面活性剂等添加剂,它们的含量可以适当设定。作为缓冲剂,优选胺系缓冲剂,例如可以举出tris、aces、ches、capso、taps、caps、bis-tris、tapso、tes、tricine和ada等。这些物质可以为一种,也可以合用两种以上。另外,作为上述缓冲剂,也可以使用具有羧基的缓冲剂,例如可以举出乙酸-乙酸钠缓冲剂、苹果酸-乙酸钠缓冲剂、丙二酸-乙酸钠缓冲剂、琥珀酸-乙酸钠缓冲剂等。作为表面活性剂,可以包含tritonx-100、chaps、十二烷基硫酸钠、全氟辛烷磺酸或硬脂酸钠。另外,可以举出烷基氨基羧酸(或其盐)、羧基甜菜碱、磺基甜菜碱和磷酸酯甜菜碱等。(电极的制作方法)本发明的抗坏血酸响应电极例如如下制作。即,在绝缘性基板的单面上形成作为电极发挥功能的金属层。例如,在规定厚度(例如100μm左右)的膜状的绝缘性基板的单面上,通过丝网印刷、物理蒸镀(pvd、例如溅射)或化学蒸镀(cvd)将金属材料成膜,由此形成具有所期望的厚度(例如30nm左右)的金属层。也可以代替金属层而形成由碳材料形成的电极层。接着,在电极上涂布包含电子受体的检测层制备液,并使其干燥,由此能够在电极上配置检测层。本发明的抗坏血酸响应电极能够在用于测定试样中包含的抗坏血酸的浓度的生物传感器中使用。如上所述,本发明的抗坏血酸响应电极通过在检测层中包含氨基酸与糖类和/或可溶性蛋白质,能够调整试剂(特别是电子受体)的溶解速度,能够调整氧化还原反应速度。即,甚至在抗坏血酸高浓度区域也能维持线性,并且传感器间的再现性也高。利用本发明的抗坏血酸响应电极的测定中使用的试样中包含的抗坏血酸的浓度没有特别限定,例如可以为50、100、200、300、500、600、800、1,000mg/dl以上。需要说明的是,试样只要是包含测定对象物质的试样就没有特别限制,优选生物体试样,可以举出血液、尿等。(生物传感器)作为抗坏血酸传感器的生物传感器在包含本发明的抗坏血酸响应电极(工作电极)的同时还包含作为反电极的电极。作为反电极,只要是通常能够用作生物传感器的反电极的电极即可,例如可以使用通过丝网印刷而成膜的碳电极、通过物理蒸镀(pvd、例如溅射)或化学蒸镀(cvd)而成膜的金属电极、通过丝网印刷而成膜的银/氯化银电极。另外,也可以使用将银/氯化银电极、通过丝网印刷而成膜的碳电极、或通过物理蒸镀或化学蒸镀而成膜的金属电极作为参比电极的三电极系统。使包含抗坏血酸的试样接触本发明的抗坏血酸响应电极(工作电极)表面时,通过抗坏血酸的氧化反应而产生的电子被转移到电子受体,电子受体被还原。并且,通过对工作电极施加氧化电位,还原型的电子受体在工作电极表面被氧化,由此产生氧化电流。基于该电流值能够测定试样中的抗坏血酸浓度。以下,基于图1对本发明的生物传感器的一例进行说明。图1的(a)~(e)是示出制造生物传感器的一系列工序的立体图。需要说明的是,本发明的生物传感器不限定于以下的方式。如图1的(e)所示,该生物传感器a具备:基板11;由具有引出部12a的工作电极12和具有引出部13a的反电极13构成的电极系统;绝缘层14;包含电子受体、氨基酸与糖类和/或可溶性蛋白质、缓冲液的检测层16;具有开口部(狭缝)的间隔物18;和具有贯通孔20的罩19。如图1的(b)所示,在基板11上设有检测部15,在检测部15,与基板11的宽度方向平行地配置有工作电极12和反电极13。上述两电极的一端分别成为引出部12a、13a,它们与检测部15中的另一端垂直地配置(图1的(a))。另外,工作电极12与反电极13之间成为了绝缘部。在具备这种电极系统的基板11上,如图1的(b)所示,除引出部12a、13a和检测部15之外层叠有绝缘层14,在未层叠有绝缘层14的上述检测部15上层叠有检测层16。并且,如图1的(d)所示,在绝缘层14上配置有间隔物18,该间隔物18从成为试样导入口17a的一端起具有宽度窄的开口部(狭缝),该开口部使覆盖与检测部15对应的部位的部分开放。进而,在间隔物18上配置有罩19,该罩19在对应于与上述间隔物18的开口部(狭缝)的成为试样导入口的一端不同的另一端的部位具有贯通孔20(图1的(e))。在该生物传感器a中,作为上述开口(狭缝)部的空间部分、并且被上述检测层16和绝缘层14与罩19夹持的空间部分成为毛细管结构的试样供给部17。该毛细管17藉由开口(狭缝)部的成为试样导入口17a的一端和贯通孔20而与外部连通。并且,上述贯通孔20成为用于利用毛细管现象吸入试样的空气孔。从试样液导入口17a供给的试样液通过毛细管现象在毛细管17内朝向贯通孔20行进,在检测层16中发生电极反应。这样的生物传感器例如可以如下制作。首先,如图1的(a)所示,在基板11上形成由具有引出部12a的工作电极12和具有引出部13a的反电极13构成的电极系统。接着,如图1的(b)所示,在形成有上述电极系统12、13的基板11上形成绝缘层14。该绝缘层形成于除电极的引出部12a、13a和形成电子受体等的检测部15以外的基板11上。上述绝缘层14例如可以通过将使绝缘性树脂溶解到溶剂中而成的绝缘糊料印刷到上述基板11上,并对其进行加热处理或紫外线处理而形成。作为绝缘性树脂,例如可以举出聚酯、丁缩醛树脂、酚醛树脂等,作为上述溶剂,例如可以举出卡必醇乙酸酯、二元酸酯系混合溶剂(dbe溶剂)等。接着,如图1的(c)所示,在未形成有绝缘层14的检测部15中,在基板11和电极12、13上形成检测层16。检测层16例如可以通过制备出分散有电子受体、氨基酸与糖类和/或可溶性蛋白质、以及缓冲剂的分散液,将其分注到上述检测部15并进行干燥而形成。作为上述分散液的制备中使用的溶剂,例如可以使用水、缓冲液、醇、n,n-二甲基甲酰胺(dmf)、二甲基亚砜(dmso)等。接着,如图1的(d)所示,在绝缘层14上配置间隔物18。如图所示,间隔物18的与上述检测层16对应的部位成为了开口部。作为间隔物18的材料,例如可以使用树脂制膜或带等。另外,若为双面胶带,则不仅是与上述绝缘膜14的粘接,后述的罩19也能够容易粘接。除此以外,例如也可以通过抗蚀剂印刷等手段来形成间隔物。接着,如图1的(e)所示,在上述间隔物18上配置罩19。作为上述罩19的材料,没有特别限制,例如可以使用各种塑料等,优选可以举出pet等透明树脂。关于该生物传感器a的使用方法,举出试样为全血、测定对象物为抗坏血酸、电子受体为钌(iii)化合物的例子来进行说明。首先,使全血试样接触生物传感器a的开口部17的一端(试样导入口17a)。该开口部17如上所述为毛细管结构,在与其另一端对应的罩19上设有空气孔20,因此上述试样通过毛细管现象被抽吸到内部。被抽吸的上述试样到达设置于检测部15上的检测层16表面。然后,到达表面的试样中的抗坏血酸与检测层16中的钌(iii)化合物发生反应。具体而言,通过因作为测定对象物的抗坏血酸的氧化反应而发生了移动的电子,钌(iii)化合物被还原,生成钌(ii)化合物。需要说明的是,在检测层16中,钌(iii)化合物的溶解速度通过氨基酸和可溶性蛋白质进行了调节。通过对电极施加正电位,在存在于检测层16中的该钌(ii)化合物与位于检测层16下的电极之间进行电子转移,从而流通氧化电流。基于此能够测定抗坏血酸浓度。具体而言,从全血试样的供给起经过一定时间后,利用施加上述电压的单元在反电极13与工作电极12之间施加电压,将与电极接触的检测层中的还原型的钌(ii)化合物电化学地氧化为钌(iii)化合物,利用藉由工作电极12的引出部12a测定上述电信号的单元等对此时的氧化电流进行检测。该氧化电流的值与试样中的抗坏血酸浓度成比例,因此,若利用上述运算单元将其运算为抗坏血酸浓度,则能够求出试样中的抗坏血酸浓度。作为对工作电极12施加的电压,只要相对于反电极为正电压即可,优选为10mv~700mv、50mv~500mv或100mv~400mv。可以在接触试样后,以非施加的状态保持规定时间后,对电极系统施加电压;也可以在与上述试样接触的同时对电极系统施加电压。作为在非施加的状态下保持的时间,例如为30秒以下或20秒以下。(装置)接着,利用附图对本发明的测定装置进行说明。此处,对抗坏血酸测定装置的一个方式进行了例示,但本发明的测定装置不限定于以下的方式。图2示出了容纳在测定装置b内的主要电子部件的构成例。控制计算机28、恒电位仪29、电力供给装置31设置在容纳于壳体内的基板30上。控制计算机28在硬件上包含cpu(中央运算处理装置)之类的处理器、存储器(ram(randomaccessmemory,随机存取存储器)、rom(readonlymemory,只读存储器))之类的记录介质和通信单元,处理器将存储在记录介质(例如rom)中的程序加载至ram并运行,由此,作为具备输出部21、控制部22、运算部23和检测部24的装置发挥功能。需要说明的是,控制计算机28也可以包含半导体存储器(eeprom,闪存)或硬盘之类的辅助存储装置。控制部22对电压施加的时机、施加电压值等进行控制。电力供给装置31具有电池26,向控制计算机28、恒电位仪29供给工作用的电力。需要说明的是,电力供给装置31也可以设置在壳体的外部。恒电位仪29是使工作电极的电位相对于参比电极保持恒定的装置,由控制部22进行控制,使用端子cr、w在抗坏血酸传感器27的反电极和工作电极之间施加规定的电压,对在端子w中得到的工作电极的响应电流进行测定,将响应电流的测定结果送到检测部24。运算部23由检测出的电流值进行测定对象物质的浓度的运算,并进行存储。输出部21与显示单元25之间进行数据通信,将由运算部23得到的测定对象物质的浓度的运算结果发送到显示单元25。显示单元25例如可以将由测定装置b接收到的抗坏血酸浓度的运算结果以规定格式显示在显示屏幕上。图3是示出利用控制计算机28进行的抗坏血酸浓度测定处理的示例的流程图。控制计算机28的cpu(控制部22)受理抗坏血酸浓度测定的开始指示时,控制部22控制恒电位仪29,对工作电极施加规定的电压,开始对来自工作电极的响应电流进行测定(步骤s01)。需要说明的是,也可以将检测到传感器向测定装置上的安装作为浓度测定开始指示。接着,恒电位仪29测定通过电压施加而得到的响应电流、即基于来自试样内的测定对象物质(抗坏血酸)的电子向电极的移动而产生的电荷转移控速电流、例如电压施加后1~20秒后的稳态电流,并送到检测部24(步骤s02)。运算部23基于电流值进行运算处理,计算出抗坏血酸浓度(步骤s03)。例如,控制计算机28的运算部23预先保存有抗坏血酸浓度的计算式或抗坏血酸浓度的校准曲线数据,使用这些计算式或校准曲线计算出抗坏血酸浓度。输出部21通过其与显示单元25之间形成的通信链路将抗坏血酸浓度的计算结果发送到显示单元25(步骤s04)。之后,控制部22对测定错误的有无进行检测(步骤s05),若没有错误则结束测定,将抗坏血酸浓度显示于显示部。若有错误,则在进行错误显示后,结束基于图3的流程的处理。另外,也可以将计算结果保存于运算部23,之后调出计算结果,显示于显示部而进行确认。需要说明的是,此处,在向显示单元25发送计算结果(步骤s04)后,利用控制部22进行了测定错误检测(步骤s05),但也可以更换这些步骤的顺序。实施例下面,举出实施例对本发明进行更具体的说明,但本发明不限定于下述方式。<实施例1>如图1所示,生物传感器按照以下顺序进行制作。首先,如图1的(a)所示,作为抗坏血酸传感器的绝缘性基板11,准备pet制基板(长度50mm、宽度6mm、厚度250μm),在其一个表面上通过丝网印刷形成由分别具有引出部的工作电极12和反电极13构成的碳电极系统。接着,如图1的(b)所示,在上述电极上形成绝缘层14。首先,将绝缘性树脂聚酯溶解于溶剂卡必醇乙酸酯中使其为75%(wt),制备绝缘性糊料,将其在上述电极上进行丝网印刷。印刷条件为300目丝网、刮刀压力40kg,印刷的量为每1cm2电极面积为0.002ml。需要说明的是,在检测部15上和引出部12a、13a上不进行丝网印刷。然后,在155℃加热处理20分钟,形成了绝缘层14。进而,如图1的(c)所示,在未形成有绝缘层14的检测部15上形成钌化合物层(检测层)16。首先,制备包含2.9%(wt)的钌化合物([ru(nh3)6]cl3、heesung公司制造)、5.0%(wt)的牛磺酸、2.4%(wt)的nps(东洋纺)、chaps、2-丙醇和蒸馏水的钌化合物液(ph7.5)。将1.0μl的钌化合物液分注到检测部15。将每一枚传感器的检测层中含有的试剂的混配量示于表1。需要说明的是,检测部15的表面积为约0.02cm2,上述检测部15中的电极12、13的表面积为约0.003cm2。然后,使其在25℃进行干燥,形成了钌化合物层16。如图1的(d)所示,将具有开口部的间隔物18配置于绝缘层14上。进而,如图1的(e)所示,在间隔物18上配置具有作为空气孔的贯通孔20的罩19,制作出生物传感器。被上述罩19和绝缘层14夹持的间隔物18的开口部的空间成为毛细管结构,因此将其作为试样供给部17。将如此制作的生物传感器作为实施例的生物传感器1。另外,在上述生物传感器1中将牛磺酸和nps置换为蒸馏水,除此以外同样地制作了比较例的生物传感器。【表1】接着,制备出以规定浓度(实施例为0、140、280、490、560、840、1120或1400mg/dl,比较例为0、50、100、200、300、400、600、800或1000mg/dl)包含抗坏血酸(asa)的、血细胞比容(ht)值为42%的含抗坏血酸的全血试样。然后,从上述生物传感器的试样供给部供给各含抗坏血酸的全血试样并使其反应,之后利用计时电流法测量电流值。测定顺序如下设定:开路20秒→200mv20秒(对终点进行测定)。将结果示于图4。在使用实施例的生物传感器1的情况下,可以确认到:在所测定的整个浓度区域,可得到伴随着抗坏血酸的浓度增加、响应电流增加的电流廓线。另一方面,在使用比较例的生物传感器的情况下,在低浓度区域(400mg/dl以下),得到了伴随着抗坏血酸的浓度增加、响应电流增加的电流廓线,但在高浓度区域(600mg/dl以上),在抗坏血酸的浓度与响应电流值之间未得到足够良好的线性。通过添加牛磺酸和nps,能够降低试剂(特别是钌化合物)的溶解速度。即,能够调整氧化还原反应速度,结果确认到,在600mg/dl以上的抗坏血酸高浓度区域也能维持良好的线性。需要说明的是,上述抗坏血酸的测定使用了全血,但全血中存在尿酸、谷胱甘肽等还原性物质。本发明中,在上述还原性物质的存在下,也能在广泛的浓度区域进行抗坏血酸的测定,在本测定条件下能够确认测定具有特异性。另外,使用抗坏血酸浓度为100mg/dl~1400mg/dl(比较例为100mg/dl~1000mg/dl)的含抗坏血酸的全血试样,以cv=sd/ave计算出n=5时的再现性(cv)(%)。将结果示于表2和图5。在使用实施例的生物传感器1的情况下,可以确认到:在所测定的整个浓度区域,可得到再现性。另一方面,在使用比较例的生物传感器的情况下,在低浓度区域(400mg/dl以下)得到了再现性,但在高浓度区域(600mg/dl以上)未得到足够良好的再现性。通过添加氨基酸和作为可溶性蛋白质的nps,传感器间的试剂的溶解速度也变得均匀,因此确认到高浓度区域的再现性提高。【表2】表2100mg/dl300mg/dl400mg/dl600mg/dl800mg/dl1000mg/dl1400mg/dl比较例4.88%3.96%7.49%25.25%13.62%18.39%-实施例6.26%5.97%7.72%3.49%2.51%1.71%1.13%在上述生物传感器1中使牛磺酸和nps分别为0.5倍量,除此以外同样地制作了生物传感器2。使用生物传感器1和生物传感器2,与上述同样地对各含抗坏血酸的全血试样测量电流值。将结果示于图6。在使用生物传感器1和生物传感器2的情况下,均在抗坏血酸的浓度与响应电流值之间得到了良好的线性,但生物传感器1的线性性能更提高。即,确认到:电极用试剂中的牛磺酸浓度为4.5%~5.0%左右、nps的添加量为2.4%~2.5%左右时更加优选。<实施例2>在上述生物传感器1中使氨基酸为下述表3中记载的氨基酸和量,使nps为下述表3中记载的量,除此以外同样地制作了生物传感器。使用该生物传感器,与上述同样地对各含抗坏血酸的全血试样测量电流值。将结果示于图7。即使是牛磺酸以外的氨基酸,也确认到线性得到改善。另外确认到:氨基酸和nps的添加量越多,在超高浓度区域越显示出良好的线性。【表3】表3<实施例3>在上述生物传感器1中使nps为bsa或糖类(木糖醇、海藻糖),除此以外同样地制作了生物传感器。使用该生物传感器,与上述同样地对各含抗坏血酸的全血试样测量电流值。将结果示于图8。确认到:即使与氨基酸一同使用糖类(木糖醇、海藻糖),在抗坏血酸的浓度与响应电流值之间也可得到良好的线性。另外确认到:即使使用bsa作为可溶性蛋白质,在抗坏血酸的浓度与响应电流值之间也可得到良好的线性。符号说明a···生物传感器11···基板12···工作电极12a···引出部13···反电极13a···引出部14···绝缘层15···检测部16···检测层17···开口部(狭缝)17a···试样导入口18···间隔物19···罩20···空气孔b···测定装置21···输出部22···控制部23···运算部24···检测部25···显示单元26···电池27···抗坏血酸传感器28···控制计算机29···恒电位仪30···基板31···电力供给装置cr、w···端子s01~s05···抗坏血酸浓度测定处理中的各步骤当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1