通过等离子体聚焦离子束处理生物低温样品的方法、装置和系统与流程
本发明涉及一种使用等离子体聚焦离子束(focusedionbeams,fib)处理生物冷冻样品的方法、装置和系统。随后样品可用于质谱(massspectrometry,ms);基因组学,如基因测序分析或下一代测序(nextgenerationsequencing,ngs)分析;以及蛋白质组学。
背景技术:
二十世纪下半叶电子和扫描探针显微镜的发展已经能以纳米、分子和原子分辨率提供物质内部结构和组成的惊人图像。很大程度上,这一进步是通过计算机辅助的显微镜操作、数据采集和分析方法实现的。二十一世纪初的成像技术的进步为高准确性结构和功能信息的可获得性打开了先河。从硬件角度来看,高分辨率成像方法现在通常以亚埃精度分辨原子位置,从而可以深入了解材料的原子结构和动力学。
各种显微术可与本发明相关,如电子显微术、带电粒子显微术、透射电子显微镜(transmissionelectronmicroscope,tem)、扫描电子显微镜(scanningelectronmicroscope,sem)和扫描透射电子显微镜(scanningtransmissionelectronmicroscope,stem),以及各种亚种类,如所谓的“双束”工具(例如fib-sem),其另外采用聚焦离子束(fib),允许支持行为,如离子束铣削或离子束引发的沉积(ion-beam-induceddeposition,ibid)或离子型成像。这是高性能显微术方法的非排他性列表。
更具体地说,在sem中,通过扫描电子束照射样本促使从样本中发出例如呈次级电子、反向散射电子、x射线和光致发光(红外、可见和/或紫外光子)形式的“辅助”辐射;然后,检测发出的这一辐射通量的一个或多个分量并将其用于图像累积目的。
在tem中,用于照射样本的电子束被选择为具有足够高的能量以穿透样本(为此目的,样本通常将比在sem样本的情况中更薄);然后,可使用从样本中发出的透射电子来创建图像。当此类tem以扫描模式操作(因此变成stem)时,所讨论的图像将在电子束的扫描动作期间累积。
替代使用电子作为照射束,还可使用其它种类的带电粒子来执行带电粒子显微术。就此而言,短语“带电粒子”应广义地理解为涵盖,例如,电子、正离子、(例如,ga或he离子)、负离子、质子和正电子。
关于离子型显微术,可以例如从如下信息源中收集一些其它信息:w.h.escovitz,t.r.fox和r.levi-setti,《带场离子源的扫描透射离子显微镜(scanningtransmissionionmicroscopewithafieldionsource)》,《美国国家科学院学报(proc.nat.acad.sci.usa)》72(5),第1826-1828页(1975)。
应注意,除了成像之外,带电粒子显微镜(cpm)还可能具有其它功能,如执行光谱术、检查衍射图、执行(定位的)表面改性(例如铣削、蚀刻、沉积)等。
虽然几十年来已知各种形式的扫描显微镜,但它们有一个共同的缺点,即在许多科学和技术领域中开始表现为瓶颈。这个缺点与以下事实有关:扫描型成像往往是一个相对缓慢和繁琐的过程,因此传统上仅限于研究非常小的(部分的)样本,例如典型的在cpm中的几十纳米和在共聚焦显微镜中的数十微米级。然而,在人类所致力于的许多领域中,逐渐需要这些技术在保持所提供的分辨率的同时将其成像面积扩大几个数量级。例如:在细胞生物学中,需要将细胞水平成像扩展到组织水平,例如以便更清楚地研究,尤其脑组织、肌肉组织、肿瘤(癌症组织)等中的(不同类型的)细胞之间的相互作用
在矿物学/岩石学中,需要将分子水平的分析扩展到颗粒和颗粒边界的水平,例如,以便更清楚地研究在跟踪研究中石基质材料中的气体捕获行为;石英地层中的贵金属包封;合成宝石和其它晶体中的不希望有的夹杂物等
在半导体行业,例如在针对关键尺寸、覆盖、污染等进行质量控制时,希望将各个结点水平的研究扩大到更广泛的整个器件和器件阵列的范围。
然而,将当前的扫描显微术技术扩展到如此大的成像尺度将需要大幅度增加的图像累积时间以致基本上无法维持这种扩展。因此,尽管存在极大需求和需要,但现有的技术是如此不实用以至于就这方面而言将它们排除在现实适用性之外。
当前扫描显微镜技术的另一个问题会在成像辐射敏感的样本,例如(活的)生物样本、低温样本等时表现出来。用高能束(特别是带电粒子)照射这些样本的操作倾向于在照射束的撞击足迹处/附近造成损坏(如分子重排/突变、解冻、干燥等)。为了减轻这种影响,可以考虑降低强度和/或增加照射束的扫描速度,但是这种措施通常会导致信噪比(signal-to-noiseratio,snr)不合需要地降低。
这些技术在授予本发明受让人的ep2963673a1以及ep2958131a1中进一步描述。近年来,受让人也广泛研发了这种方法。
在显微术的另一方法涉及通过聚焦离子束(也被称为fib)进行定点分析、沉积和材料剥蚀。这种技术尤其用于半导体行业、材料科学中且越来越多地用于生物领域中。fib设置是一种类似于扫描电子显微镜(sem)的科学仪器。然而,sem在隔室中使用聚焦电子束成像样品,而fib设置替代地使用聚焦离子束。fib也可以并入具有电子束和离子束色谱柱的系统中,允许使用任一束来研究相同的特征。
最普遍的仪器使用液体金属离子源(liquidmetalionsources,lmis),尤其是镓离子源。也可用基于元素金和铱的离子源。在镓lmis中,镓金属与钨针接触,加热的镓润湿钨并流向针尖,其中相反力表面张力与电场使镓形成尖形尖端,称为泰勒(taylor)锥。这一锥的尖端半径极其小(约2nm)。这个小尖端(大于1×108伏每厘米)处的巨大电场导致镓原子的电离和场发射。
随后源离子通常加速到1-50kev(千电子伏特)的能量,并且通过静电透镜聚焦到样品上。lmis产生具有非常小的能量扩散的高电流密度离子束。现代fib可以向样品提供数十纳安培的电流,或者可以以几纳米量级的光斑尺寸对样品成像。
聚焦离子束(fib)系统已经商业生产大约二十年,主要供大型半导体制造商使用。fib系统的工作方式类似于扫描电子显微镜(sem),不同在于顾名思义,fib系统使用可以在低射束电流下操作用于成像或高射束电流下用于定点溅射或铣削的精准聚焦的离子束(通常是镓),而非电子束。
镓(ga+)初级离子束撞击样品表面并溅射少量材料,所述少量材料作为次级离子(i+或i-)或中性原子(n0)离开表面。初级射束也产生次级电子(e-)。当初级射束在样品表面上产生光栅时,来自溅射离子或次级电子的信号被收集,形成图像。
在低初级射束电流下,溅射的材料极少,且现代fib系统可轻松实现5nm的成像分辨率(ga离子的成像分辨率由溅射和检测器效率限制在约5nm)。在较高初级电流下,可以通过溅射去除大量材料,从而可以将样本精确铣削至亚微米甚至纳米级。
如果样品不导电,可以使用低能电子校正枪来提供电荷中和。以这种方式,通过使用初级正离子束来用次级正离子成像,即使高度绝缘的样品也可以在没有导电表面涂层的情况下被成像和铣削,如sem中所要求的。
直到最近,在半导体行业一直大量使用fib。如缺陷分析、电路修改、光掩模修复以及集成电路上定点位置的透射电子显微镜(tem)样品制备等应用已成为常见的程序。最新的fib系统具有高分辨率成像的能力;在许多情况下,这种能力与原位切片相结合,消除了在单独的sem仪器中检查fib切片样本的需要。实现最高分辨率成像并防止对敏感样品的损坏仍然需要sem成像。然而,将sem和fib色谱柱组合到同一隔室上使得能够利用两者的益处。
与电子显微镜不同,fib本身对样本具有破坏性。当高能镓离子撞击样品时,它们将从表面溅射原子。镓原子也将植入到表面上层几纳米处,并且使表面成为非晶形的。
由于具有溅射能力,fib可用作微米和纳米加工工具,用于改性或加工微米和纳米级材料。fib微米加工自身已经成为一个广泛领域,但是结合fib的纳米加工是一个仍在发展的领域。通常,用于成像的最小束尺寸是2.5-6nm。最小铣削特征稍微大一些(10-15nm),因为其取决于总的束尺寸和与被铣削样品的相互作用。
fib工具设计用于蚀刻或加工表面,理想的fib可以加工掉一个原子层而不会对下一层中的原子造成任何破坏,或者在表面上方留下任何破坏。然而,目前由于溅射,加工通常在亚微米长度尺度上使表面变粗糙。fib也可用于通过离子束引发的沉积沉积材料。当气体,如六羰基钨(w(co)6)被引入到真空室并使其化学吸附到样品上时,fib辅助产生化学气相沉积。通过用所述射束扫描区域,前体气体将分解成挥发性和非挥发性组分;非挥发性组分,例如钨,作为沉积物保留在表面上。这点很有用,因为沉积的金属可以用作牺牲层,用来保护下面的样品免受所述射束的破坏性溅射。长度从纳米到数百微米,钨金属沉积允许金属线在需要的地方放置。其它材料,如铂、钴、碳、金等也可以局部沉积。
fib样品制备的缺点是上文提及的表面损坏和植入,当使用如高分辨率“晶格成像”tem或电子能量损失谱等技术时会产生明显的影响。通过使用较低射束电压或较低离子能量的fib铣削,或者在完成fib工艺之后通过用低压氩离子束进一步铣削,可以最小化所述损坏层。
fib制备可在适当配备的仪器中与低温冷冻样品一起使用,允许对含有液体或脂肪的样品进行横截面分析,如生物样品、药品、泡沫、油墨以及食品。
fib也用于次级离子质谱(secondaryionmassspectrometry,sims)。在用初级聚焦离子束溅射样本表面之后,收集并分析喷射的次级离子。
在较低射束电流下,fib成像分辨率在成像形貌方面开始与更熟悉的扫描电子显微镜(sem)相媲美,然而fib的两种成像模式,使用均由初级离子束产生的次级电子和次级离子,提供了许多优于sem的优点。
fib次级电子图像显示强烈的颗粒取向对比。结果,可以容易地成像颗粒形态而无需借助化学蚀刻。通过仔细选择成像参数也可以增强颗粒边界对比度。fib次级离子图像也揭示了化学差异,并且在腐蚀研究中特别有用,因为在氧气存在下金属的次级离子产率可以增加三个数量级,从而清楚地揭示了腐蚀的存在。
ffib次级电子成像的另一个优点是离子束不会改变蛋白质标记中使用的荧光探针的信号,从而创造了将fib次级电子图像与荧光显微镜所获得的图像相关联的机会。
另一个潜在应用领域是质谱(ms)。这是一种分析技术,可以使化学物种电离并根据离子的质荷比对离子进行分类。简单说来,质谱测量样品中的质量。质谱用于许多不同领域,并应用于纯样品以及复杂混合物。
质谱是作为质荷比的函数的离子信号强度的图。这些谱图用于确定样品的元素或同位素特征、颗粒和分子的质量,并阐明分子(如肽和其它化合物)的化学结构。
在典型的ms程序中,样品,其可为固体、液体或气体,被电离,例如通过用电子轰击它。这可能导致一些样品分子破碎成带电碎片。随后根据它们的质荷比将这些离子分离,通常通过将其加速并将其置于电场或磁场:相同质荷比的离子将经历相同的偏转量。通过能够检测带电粒子的机构,例如电子倍增器,来检测离子。结果显示为检测到的离子的相对丰度的谱图,所述相对丰度作为质荷比的函数。将已知质量与识别的质量相关联或通过特征性碎裂模式可以识别样品中的原子或分子。
质谱特别是蛋白质表征和测序的重要方法。对全蛋白进行电离的两种主要方法为电喷雾电离(electrosprayionization,esi)和基质辅助激光解吸/电离(matrix-assistedlaserdesorption/ionization,maldi)。为了保持可用质谱仪的性能和质量范围,有两种方法可用来表征蛋白质。在第一种方法中,用上述的两种技术之一对完整蛋白质进行电离,然后引入质量分析仪。这种方法被称为蛋白质分析的“自上而下(top-down)”策略。然而,自上而下的方法主要限于低通量单一蛋白质研究。在第二种方法中,蛋白质在电泳分离后使用蛋白酶,如胰蛋白酶或胃蛋白酶,酶解成较小的肽,溶液或凝胶。还使用其它蛋白水解剂。然后将这批肽产物引入质量分析仪。当使用肽的特征模式鉴定蛋白质时,所述方法被称为肽质量指纹谱(peptidemassfingerprinting,pmf),如果使用串联ms分析中测定的序列数据进行鉴定,则称其为从头肽测序。这些蛋白质分析程序也被称为“自下而上(bottom-up)”方法。然而,开始使用第三种方法,这种中间的“自中而下(middle-down)”方法涉及分析比典型的胰蛋白酶肽更大的蛋白水解肽。
另一个关注领域是大规模并行测序(massiveparallelsequencing/massivelyparallelsequencing),它是任何几种使用大规模并行处理概念的高通量dna测序方法;它也被称为新一代测序(ngs)或第二代测序。其中一些技术出现于1994年至1998年,且从2005年起一直可以在市面上买到。这些技术使用小型化和并行化平台,每次仪器运行测序100万至430亿个短读段(各50-400个碱基)。
许多ngs平台在工程配置和测序化学方面存在差异。它们经由流动细胞中的空间分离、克隆扩增的dna模板或单一dna分子共享大规模并行测序的技术范例。这种设计与桑格(sanger)测序(也被称为毛细管测序或第一代测序)非常不同,后者基于各个测序反应中所产生的链终止产物的电泳分离。
使用了各种技术,但每一种技术总在某些方面受限。tem可以揭示蛋白质在其天然环境中的结构细节,但电子束对生物组织非常有害,并且剂量必须保持很低,这限制了信号和分辨率。组学研究(例如基因组学、蛋白质组学以及代谢组学)不是在空间上或时间上分辨的。chip-seq和clip-seq程序需要繁琐的生化分离步骤。原位基因测序技术,如fisseq,不能分辨密集区域,如核仁或应力颗粒。质谱蛋白质组学可以对细胞内的蛋白质组成进行全面的定量的分析。然而,ms不提供任何固有的空间定位,并且受所使用的提取方法(如分馏或免疫沉淀)的特定性限制。
低温样品的fib铣削得到广泛使用,但ga+fib受到典型的65na的最大射束电流的限制。鉴于生物样品的典型尺寸,gafib铣削通常不实用。此外,ga污染可能会对后续分析产生负面影响。o+fib铣削的优点是高兼容性(铣削伪影,如帘幕,减少了,且无ga污染)和对生物组织的高材料去除速率,这使得能够实现新的分离和纯化技术,如部分生物体删除和/或细胞器切除。
之前引用的所有专利和非专利文献以及其中所含引文均通过引用方式并入本文中。
技术实现要素:
鉴于上述情况,本发明的目标是提供一种用于处理,尤其是呈冷冻或低温保存形式的生物样品的改进的和/或替代的方法、装置和系统。
通过根据本发明的方法、装置和系统来实现所述目标。
本发明尤其涉及处理至少一种生物样品的方法。此方法尤其用于高性能显微术;蛋白质组学分析;测序,如ngs等。根据本发明,所述方法包含提供至少一种呈冷冻形式的生物样品的步骤。这可为呈玻璃质的或适于铣削和进一步分析的任何其它形式。铣削通过包含o+和/或xe+等离子体中的至少一种的等离子体离子束处理至少一部分样品。也可以使用另外包含ar+、n+、kr+、ne+、he+和/或h+的离子束。
这尤其包括这些等离子体或任何其它等离子体的任何混合物。当进一步称为o+或o+等离子体或o+等离子束时,涵盖o+、o2+和其它物种以及包含o+、o2+和其它o型相关物种的等离子体或等离子束。
还包含双等离子体,如pfib。
当使用xe+等离子束或等离子束时,可以添加o2气体。已显示这在保护样品方面特别有利,特别是在射束的周围,以避免对生物样品造成任何伤害。
铣削可以通过包含至少10%o+等离子体离子,优选至少25%、更优选至少50%、更优选至少66%、更优选至少75%,更优选至少80%、更优选至少90%且更优选几乎或恰好100%o+等离子体离子的等离子体离子束进行。当探针或样品被溅射并且因此以其它方式经受物理和化学应力时,这些等离子体离子还可以提供样品保护的有利作用。
根据本发明的方法还可以包含铣削优选低温保存或呈低温形式或处于任何相关状态的生物样品。
还可以实现通过有效射束电流为至少6na、优选至少10na、优选至少50na、更优选至少100na、更优选至少200na、甚至更优选至少300na、甚至更优选至少400na、甚至更优选至少500na、甚至更优选至少600na、甚至更优选至少650na、甚至更优选至少700na、甚至更优选至少800na、甚至更优选至少900na、甚至更优选至少1000na的至少一个等离子体离子束铣削至少一部分样品的进一步步骤。这可以支持相当快或比以前更快的样品处理和铣削。无论如何,样品没有受损坏或损坏较少。
铣削至少一部分样品的进一步步骤可以另外通过质量去除速率为至少100微米3/秒、优选至少200微米3/秒、更优选至少300微米3/秒、更优选至少500微米3/秒且更优选至少1000微米3/秒的至少一个等离子体离子束进行。这比现有技术快数倍或甚至十倍甚至数十倍,同时仍保存生物样品。例如,500微米3/秒的铣削速率可以由1μa的射束电流和粉碎效率为0.5微米3/纳库(μm3/nc)的目标材料来获得。如果使用2μa的更大射束电流,可以得到1000微米3/秒的去除速率。
本发明可包含铣削样品以进行以下中至少一个的步骤:去除所述样品的不需要的部分;和提取目标。如果需要,相应地通过几个剥蚀步骤或循环的逐点剥蚀或逐面剥蚀来控制铣削。
还可以实现在累积样品中累积多个目标的进一步步骤。这可以应用于图像生成、蛋白质组学、基因组学等许多不同的任务。
处理可以是亚微米处理,并且所述方法可以进一步包含生成至少用于可视化和控制铣削中的一个或两者的至少一个显微图像的步骤。
sem和/或tem显微术可以生成显微图像。也可以使用其它显微方法或其组合。
也可以通过质谱分析进行分析样品或累积样品的进一步步骤,优选通过所谓的轨道阱融合质谱仪(orbitrapfusionmassspectrometer)进行,已显示所述质谱仪特别适用于分析这些样品,特别是用于蛋白质组学目的。因此,本发明可以提供分析和/或测定样品中蛋白质的进一步步骤。
替代地或另外地,可以进行通过下一代测序(ngs)对目标进行测序的进一步步骤。
优选地在分析样品中所含有的蛋白质时,还可以通过本发明跟踪目标的空间信息,并进一步用于目标的分析。
本发明还涉及一种用于处理至少一种生物样品,尤其用于实施前述方法的装置,其包含至少一个用于至少一种呈冷冻形式的生物样品的支持物;和至少一个等离子体离子束发生器,所述等离子体离子束发生器被配置成生成至少一个包含o+或xe+等离子体中的至少一种的等离子体离子束。也可以使用另外包含ar+、n+、kr+、ne+、he+和/或h+的离子束。前文和下文所描述的且与方法相关地要求保护的任何其它特征也包涵在本发明的装置类别中。
本发明还包含双等离子体离子发生器。
所述装置的等离子体离子束发生器可以被配置成生成包含至少10%o+等离子体离子,优选至少25%、更优选至少50%、更优选至少66%、更优选至少75%、更优选至少80%、更优选至少90%且更优选几乎或恰好100%o+等离子体离子的等离子体离子束。
所述装置还可以被配置成实现之前提到的并且在根据本发明的方法的上下文中要求保护的有效射束电流和/或质量去除速率。
所述装置还可以包含用于生成至少用于可视化和控制铣削中的一个的显微图像的显微镜,优选sem或tem显微镜。
本发明还针对一种系统或组件,其包含根据前面和下面的描述的装置,和以下中的至少一个:显微镜,优选sem或tem显微镜;和质谱仪,优选轨道阱融合质谱仪;以及测序站,优选ngs站。通过这样的系统,可以实现用于蛋白质组学分析和测序的新且有利的工作流程。
本发明还涵盖使用前文、下文中所描述的且要求保护的方法,其至少用于以下中的一个:蛋白质组学分析;基因组学,如基因测序;以及高性能显微术,如sem或tem。
等离子体组分的确切性质和量取决于许多因素,包括rf功率。在某些情况下,如果有证据表明某一物种在铣削样品时更有效,则可优选调整rf功率以强调所述物种(优选产生的物种)而非另一物种。较高的rf功率倾向于产生更多的o+,更低的rf功率倾向于产生更多的o2+,因此可以相应地进行调整。
本发明可以优选通过使用低温保存的细胞的fib铣削来分离目标或所关注区域(roi)来定位蛋白质组学数据,以获得更全面的细胞蛋白质组成。相比之下,使用标准技术,蛋白质不被定位,并且不能如此容易地被定位在细胞中的特定位置。
存在激光解剖方法用以隔离某些区域,但样品必须保持为活的(弃除时间方面因素)或化学固定的,这会影响蛋白质组学结果并降低某些信号。本发明可以优选地避免这种情况。
本发明能够在生物样品中以高时间和空间分辨率进行灵敏的蛋白质分析。目前在发育生物学研究中使用各种技术进行蛋白质分析,但每一种技术总在某些方面受限。本发明可以使用xe+或更尤其o+等离子体fib(以及其它离子物种,如ar+、n+、kr+、ne+、he+和/或h+),其提供低温保存的生物样品的极高的去除速率,和凭借本受让人的质谱仪的灵敏蛋白质检测。
本发明还包含用于分离和浓缩低温生物样品的方法或工作流程,用于质谱蛋白质分析和基因测序分析。
低温制备至关重要,因为骤冷过程会立即阻止细胞活动,从而使生物体的状况保存在特定时刻。除了这种时间分辨之外,还可以使用fib铣削技术实现样品内的高空间分辨。具体而言,受让人最近的工作表明,o+等离子体fib在有机底物(包括低温生物组织)上去除大量材料方面非常有效。
在两个可能的实施例的其中之一中独特地利用pfib中o+的高铣削速率:首先,o+铣削可用于删除样品的特定区域,结果是其余区域的后续蛋白质分析不会受到整体样品的蛋白质特征的污染和稀释。在细胞或生物体内不同区域之间蛋白质分布可以不同,并且这种删除不想要的区域的方法有助于集中所关注的真实信号,这对于生物体发育的研究而言很重要。其次,传统的分块和提升技术可用于切除样品内的目标区域。可以根据需要对多个相同的样品重复所述过程,以获得适合于后续分析工具的检测极限的必需数量的材料。
目前,对蛋白质组学(大规模蛋白质提取和分析)具有最佳灵敏度的质谱仪器是受让人的融合质谱仪,因此结合o+等离子体fib技术与受让人的质谱技术的工作流程将产生一个独特的强大的生物样品分析工具。fib提供的低温制备和现场规格使用户能够以高空间和时间分辨率捕获所关注的区域,并且质谱仪的灵敏度使得能检测细微的蛋白质变化。因此,本发明可以是用于生物学研究的强大的新工具。
根据本发明,经冷冻的样品通过冷冻处理、受影响或结痂,并且也可以是呈低温或低温保存的形式。
o+等离子束可以在这些较大的生物样品上进行实际可行的样品制备,为未来可切换的离子物种pfib提供价值。
现在将参考附图讨论本技术。
附图说明
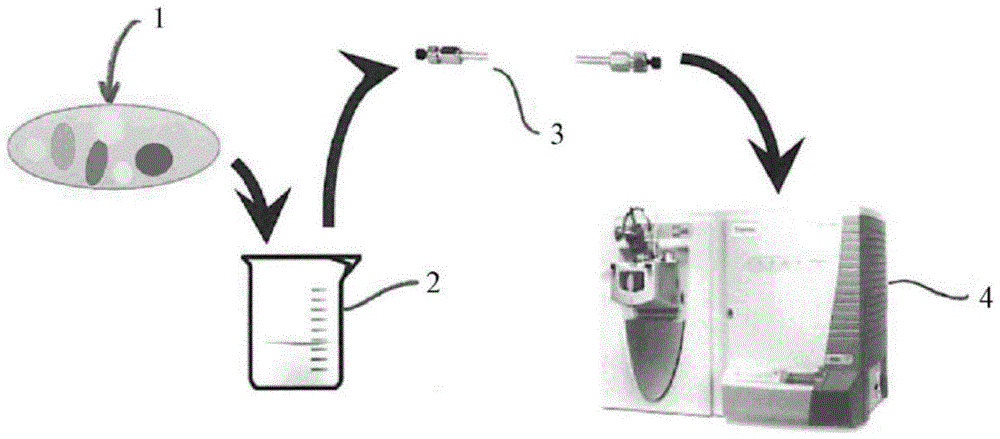
图1描绘了根据现有技术的工作流程的实施例。
图2显示了fib铣削站的原理布置。
图3描绘了根据本发明的铣削结果。
图4分别显示了胚胎前部和胚胎后部的网格的制备。
具体实施方式
图1示意性地描绘了本领域实践的典型工作流程的实施例。旨在进一步分析所示的生物样品1,所述生物样品由一种或多种生物体、细胞、结构、蛋白质、dna、rna等组成。为分析生物样品中所含有的细胞、细胞部分、蛋白质、rna和/或dna,将样品1通过一种或多种消化物或酶(由分别的容器2表示)暴露于一个或多个阶段以进行其所选择的分解和瓦解等。在高压液相色谱仪3(hplc)中可以进一步分离部分、分子、蛋白质等,从而可以更好地隔离所特别关注的部分。然后可以将它们转移到质谱仪4中,以进一步隔离并指定所关注的部分、分子、蛋白质等。一个缺点是化学和物理分离相当不明确,且不定位这些蛋白质等。
此外,已知激光解剖可以隔离所关注的部分。但是,样品应保持活性,同时弃除时间方面因素或应进行化学固定,否则会影响蛋白质组学结果并降低信号质量。
图2显示了fib样品制备的示范性实例。如图2所示,所述由ga+离子发生器5生成的镓(ga+)初级离子束撞击样品表面并溅射少量材料,所述少量材料作为次级离子(i+或i-)或中性原子(n0)离开表面。初级射束还产生次级电子(e-)。当初级射束在样品表面上产生光栅时,来自溅射离子或次级电子的信号被收集,形成图像。
根据本发明的初级离子束现包含o+和/或氙+,如前文所述且下文所要求保护的。还可以包含ar+、n+、kr+、ne+、he+和/或h+。
在低初级射束电流下,溅射的材料极少,且现代fib系统可轻松实现5nm的成像分辨率(ga离子的成像分辨率由溅射和检测器效率限制在约5nm)。在较高初级电流下,可以通过溅射去除大量材料,从而可以将样本精确铣削至亚微米甚至纳米级。
气体辅助蚀刻和/或任选的气枪6可以实现所选择的沉积。这可以根据本发明施加,尤其当xe+用作初级离子束时,有利地通过气枪6添加o2。
如果样品不导电,可以使用低能电子校正枪7来提供电荷中和。以这种方式,通过使用初级正离子束来用次级正离子成像,即使高度绝缘的样品也可以在没有导电表面涂层的情况下被成像和铣削,如sem中所要求的。
根据图3,可以根据本发明通过选择目标11和/或去除不需要的部分12来处理生物样品1。如图所示,这可以通过将目标11从不需要的部分12中铣削出来或者通过从目标11铣削和溅射掉不需要的部分12来完成。后者是大量去除不需要的部分或体积。
图4中显示两个图表。左侧图表例示了胚胎的两个不同区域(前部(y轴)和后部(x轴))的网格的制备,并且证明了本发明的一个优选优点,即空间信息的额外使用。更具体地,图4显示了根据本发明的在生物样品中目标的空间选择或分布。在目前的情况下,已经开发了胚胎(果蝇(drosophila)胚胎)的两个不同区域的网格,前部和后部。还可以跟踪更多区域。
样品在本受让人的轨道阱融合质谱仪上运行,以鉴定各种蛋白质。如前文所述,那些也可以在空间上分配。
在图4的右侧,显示了相对于rna表达目标的蛋白质表达目标的分布。
当在本说明书中使用相对术语,如“约”,“基本上”或“近似”时,此类术语也应被解释为还包括确切术语。也就是说,例如,“基本上直的”应该被解释为还包括“(完全)直的”。
无论何时在上述或所附权利要求中叙述步骤,应注意,在本文中叙述步骤的顺序可能是优选顺序,但是可能不必以所叙述的顺序执行所述步骤。也就是说,除非另有说明或者除非技术人员清楚,否则叙述所述步骤的顺序可以不是强制性的。也就是说,当本文件陈述,例如,方法包含步骤(a)和(b)时,不一定意味着步骤(a)在步骤(b)之前,而是也可能是步骤(a)与步骤(b)同时进行(至少部分地)或步骤(b)在步骤(a)之前。此外,当说步骤(x)在另一步骤(z)之前时,这并不意味着在步骤(x)与(z)之间不存在步骤。也就是说,处于步骤(z)之前的步骤(x)包涵在步骤(z)之前直接执行步骤(x)的情况,以及在一个或多个步骤(y1)直至步骤(z)之前执行(x)的情况。当使用诸如“之后”或“之前”之类的术语时,相应的考虑适用。
比较实例
已经进行了使用ga+、xe+和o+的测试。样品制备需要选择性地去除大部分低温保存的果蝇(果蝇胚胎)。已经观察到以下情况。
使用ga+等离子体离子束时,可用电流约为50na。随着剂量在样品上积累,铣削速率呈现出降低。铣削所需的时间呈现出不利于所需的样品量。
使用xe+时,电流增加,使铣削速率提高10倍。然而,甚至使用02气体也可以提高铣削速率。
对于所述应用,使用o+作为初级离子束显示出最好的结果,实现高达4500微米3/秒的铣削速率(相比于ga+增强45倍)。另外有利的是,样品呈现出并没有像如此高的铣削速率会造成的离子束损坏(可能通过局部加热)。随着样品变小或对于不受支持/浸没在冰中的样品,这点更加明显。
o+等离子体离子束在1μa设置下具有30kev的电压,测量的有效电流为680na。相比于ga+离子束设置,此电流超过13倍大。
在上述使用o+等离子体离子束的实例中,射束经历了具有15μmz-深度,1μs停留时间,65x-重叠和85%y-重叠的ccs模式。因此可以在约7分钟内去除一半的果蝇胚胎。
因此,根据本发明的o+等离子体离子束可以创建允许在单个期间中制备多个样品的工作流程。最后,对于一个样品可能需要约100个细胞,因此与标准方法相比节省了大量的时间。
- 还没有人留言评论。精彩留言会获得点赞!