cAMP合成反应体系成分的分离鉴定方法及其应用与流程
本发明涉及生物酶检测技术领域,具体涉及一种camp合成反应体系成分的分离鉴定方法及其应用。
背景技术:
在真核生物中,腺苷酸环化酶(adenylatecyclase,acs)是腺苷酸环化酶信号系统中的重要组成成分,它负责催化第二信使3',5'-环化腺苷单磷酸(cyclicadenosinemonophosphate,camp)的产生,后者通过影响蛋白激酶a(proteinkinasea,pka)、camp激活的交换蛋白(exchangeproteindirectlyactivatedbycamp,epac)、cre结合的转录因子(campresponseelement-bindingprotein,creb)以及环核苷酸门控的离子通道(cyclicnucleotide-gatedionchannels,cngcs)等活性,参与各种生命活动。
在哺乳动物中,acs是一个大家族。但在植物中,对于催化camp合成的腺苷酸环化酶的知识仍显不足,目前仅有7个acs被鉴定。因此,只有从植物中鉴定更多的acs才能更好的研究植物中的腺苷酸环化酶信号系统。
目前,最常用的acs鉴定方法是通过体外酶活试验进行验证,其原理是将表达的目的蛋白加入到含有反应底物的体系,通过检测是否有camp的产生,从而确认目的蛋白是否是一个ac。
检测camp的方法主要有两种,分别是酶联免疫吸附检测法(enzymelinkedimmunosorbentassay,elisa)和液相色谱法(liquidchromatography,lc)。
1971年瑞典学者engvail和perlmann、荷兰学者vanweerman和schuurs分别报道将免疫技术发展为检测体液中微量物质的固相免疫测定方法,即为elisa。elisa是利用特异性的抗体对camp进行识别和定量,其准确性取决于camp抗体的特异性。该方法虽然操作简单,检测限达到1~100ng/ml,但是检测试剂盒价格昂贵,可检测样品数较少,且不同试剂盒抗体的特异性也参差不齐。
1906年俄国植物学家茨维特将植物色素提取液加到装有碳酸钙微粒的玻璃柱子上部,继而以石油醚淋洗柱子,发明色谱法。目前lc为检测camp的主要方法,lc是利用标准品确定camp在一定色谱条件下的保留值,随后检测样品中在该时间是否有色谱峰出现,并进一步利用峰面积对样品中的camp含量进行测定。该方法虽然可以直接观测camp的产生并定量,测试费用低、测试灵活,但是在鉴定acs上仍存在不足之处。比如,长期以来只能是单一检测camp,没有把反应底物atp(adp和amp)组合到一起进行检测,此外amp、ado(adenosine)与camp的结构相似,现有的lc检测camp时无法排除它们之间的干扰,本领域内技术人员普遍认为无法将amp、ado与camp分离[anucleotidephosphataseactivityinthenucleotidebindingdomainofanorphanresistanceproteinfromrice,thejournalofbiologicalchemistry,287(6),2012.4023-4032;anarabidopsisclathrinassemblyproteinwithapredictedroleinplantdefensecanfunctionasanadenylatecyclase,biomolecules,2018,doi:10.3390/biom8020015;thearabidopsisthalianak+-uptakepermease7containsafunctionalcytosolicadenylatecyclasecatalyticcentre,febsletters,589,2015,3848-3852]。
因此,亟待建立可以将camp合成相关的物质一起分离、能够进一步提高camp鉴定的检测限和准确性的检测体系或方法,以期为鉴定植物中的ac提供一个更准确可靠、更快捷的方法。
技术实现要素:
本发明要解决的技术问题:其一是要提供一种camp合成反应体系成分的分离检测方法,以便能同时将五种camp合成途径中的相关分子(atp、adp、amp、ado和/或camp)进行基线分离,以实现各成分的准确定性;其二是要提供一种低检测限的camp定量检测方法,以便能定量检测出极低浓度的camp;其三是要提供一种高可靠性的从camp合成反应体系中分离鉴定camp的方法,以实现camp的快速、准确的定量检测及鉴定,为准确acs奠定了坚实的技术基础。
为解决上述技术问题,本发明采用如下技术方案:
建立一种camp合成反应体系成分的分离检测方法,包括以下步骤:
(1)确定标准品的出峰时间:
i.取标准品atp、adp、amp和camp溶于水,取ado溶于纯甲醇溶液,用滤膜过滤后得标准品溶液;优选0.22µm的pvdf滤膜;
ii.将准品溶液稀释至48~52µg/ml(优选50µg/ml),取48~52μl(优选50μl)上样到液相色谱仪;
iii.配制100%乙腈和95~105mmkh2po4(优选100mm),ph3.8~4.2(优选4.0),按照2:98的体积混匀得流动相,进行等度洗脱,流速为0.8~1.2ml/min(优选1ml/min),柱温为28~32℃(优选30℃);
iv.将uv检测器的检测波长设置为254nm,检测标准品出峰时间;
(2)利用上述色谱法检测目标蛋白酶活:
i.取待检测样品以质量体积比为1:8~12(优选1:10)的比例加入到新配置的反应缓冲液中,在22~28℃(优选25℃)的条件下反应1~2h后,3000×g离心4~6min取上清;
ii.将所述上清稀释至48~52µg/ml(优选50µg/ml),取48~52μl(优选50μl)上样到液相色谱仪;
iii.取步骤(1)中所述流动相进行等度洗脱,流速为0.8~1.2ml/min(优选1ml/min),柱温为28~32℃(优选30℃);
vi.采用步骤(1)中所述检测条件,对照标准品出峰时间,判断ado、atp、adp、amp和/或camp是否存在,还可以进一步计算其生成量。
优选的,所述步骤(2)中,所述反应缓冲液为50mmph8.0tris-hcl,2mmibmx,5mmmgcl2或mncl2,1mmatp、adp、amp中的任意一种。
以上通过利用由100%乙腈和100mmkh2po4,ph4.0按照优化的ph值以及体积比混合,作为液相色谱分离的流动相对待测物进行等度洗脱,选择优化的254nm紫外光进行检测,在该条件下可以有效的将5种camp合成途径中的相关分子(atp、adp、amp、ado和camp)进行基线分离。在鉴定目的蛋白的腺苷酸环化酶活时,可以通过选择不同反应底物(atp、adp和/或amp),鉴定是否有camp的产生,同时可以彻底排除ado等类似物的干扰。该方法还可直观的通过色谱峰观测camp的产生。
建立一种低检测限的camp定量检测方法,包括以下步骤:
(1)体外酶活反应:
取待检测样品以质量体积比为1:8~12(优选1:10)的比例加入到新配置的反应缓冲液中,在22~28℃(优选25℃)的条件下反应1~2h后,3000×g离心4~6min取上清;
所述反应缓冲液为50mmph8.0tris-hcl,2mmibmx,5mmmgcl2或mncl2,1mmatp;
(2)制备标准曲线:
取camp标准品溶于乙腈,配制浓度为1、5、10、20、50ng/ml的标准品溶液;
(3)样品的液相色谱分离及质谱鉴定:
分别取所述标准品溶液和所述上清8~12μl(优选10μl),自动上样进入超高效液相色谱,色谱柱选用c18,其规格为100mm×4.6mm,1.7μm;流动相a为0.1%v/v甲酸/乙腈,流动相b为100%乙腈,进行梯度洗脱,流速为0.25~0.35ml/min(优选0.3ml/min);
质谱仪选择正离子模式,数据采用srm扫描模式,q1质量设置为330.1m/z和q3质量设置为135.8m/z;
(4)记录二级质谱数据,提取所述135.8m/z碎片离子的tic峰图与标准曲线进行比对,计算camp的含量。
优选的,所述步骤(3)中,所述梯度洗脱的条件为:0min:90%a+10%b;1min:90%a+10%b;2.5min:5%a+95%b;3.5min:5%a+95%b;3.6min:5%a+95%b;10min:90%a+10%b;
所述质谱仪的相关参数设置为:电压为5500v,帘气值为30、cad为medium、tem为500、ionsourcegas1为50、ionsourcegas2为55、declusteringpotential为80;选择的离子对为330.1/135.8m/z和330.1/118.7m/z。
以上通过利用与质谱仪兼容的流动相甲酸和乙腈溶液,利用梯度洗脱的方式分离camp进入质谱仪,选择的离子对为(330.1/135.8m/z;330.1/118.7m/z),其中330.1m/z为camp母离子,而135.8m/z和118.7m/z为特异的碎片离子,通过这种方法可以准确的鉴定camp的产生并对其进行定量。使检测限由原来的0.5ng/ml提高到0.01ng/ml。
基于上述两种检测技术方案,综合设计一种从camp合成反应体系中分离鉴定camp的方法,包括以下步骤:
(1)取atp、adp、amp、camp和ado标准品,自动上样到高效液相色谱仪,检测所述标准品的出峰时间;
(2)取待检测蛋白样品,加入反应缓冲液a中在22~28℃(优选25℃)的条件下反应1~2h后,3000×g离心4~6min取上清,上样到液相色谱仪进行等度洗脱;
(3)将uv检测器的检测波长设置为254nm,对照标准品出峰时间,判断是否有camp生成,完成定性检测;
(4)若有camp生成,则再取待检测蛋白样品,加入反应缓冲液b中在22~28℃(优选25℃)的条件下反应1~2h之后,3000×g离心4~6min取上清,获得反应液;
(5)取camp标准品溶于乙腈,配制浓度为1、5、10、20、50ng/ml的标准品溶液;
(6)取步骤(4)所得反应液和步骤(5)所得标准品溶液上样进入超高效液相色谱,进行梯度洗脱;质谱仪选择正离子模式,q1质量设置为330.1m/z,q3质量设置为135.8m/z;
(7)记录二级质谱数据,提取135.8m/z碎片离子的tic峰面积与标准曲线进行比对,计算camp的含量,以完成精确的定量检测。
优选的,所述高效液相色谱仪的型号为rigoll3000;色谱柱选用c18,其规格为250mm×4.6mm,5μm。
优选的,在步骤(1)中,检测所述标准品的出峰时间的具体步骤为:
i.取标准品atp、adp、amp和camp溶解于水,取ado溶解于纯甲醇溶液中,用滤膜过滤后得标准品溶液;优选0.22µm的pvdf滤膜;
ii.将标准品稀释至48~52µg/ml(优选50µg/ml),取48~52μl(优选50μl)上样到液相色谱仪;
iii.配制100%乙腈和95~105mmkh2po4(优选100mm),ph3.8~4.2(优选4.0),按照2:98的体积混匀得流动相,进行等度洗脱,流速为0.8~1.2ml/min(优选1ml/min),柱温为28~32℃(优选30℃);
iv.将uv检测器的检测波长设置为254nm,检测标准品出峰时间。
优选的,所述步骤(2)中,所述反应缓冲液a为50mmph8.0tris-hcl,2mmibmx,5mmmgcl2或mncl2,1mmatp、adp、amp中的任意一种;
洗脱时,流动相为按照2:98的体积比混匀的100%乙腈和95~105mmkh2po4(优选100mm)所述流动相的ph为3.8~4.2(优选4.0);所述洗脱的流速为0.8~1.2ml/min(优选1ml/min),柱温为28~32℃(优选30℃)。
优选的,所述步骤(5)中,所述反应缓冲液b为50mmph8.0tris-hcl,2mmibmx,5mmmgcl2或mncl2,1mmatp。
优选的,所述步骤(6)中,所述高效液相色谱仪的型号为acquity(absciex),偶联的质谱仪为qtrap5500(absciex);色谱柱选用c18,其规格为100mm×4.6mm,1.7μm;
所述梯度洗脱时,流动相a为0.1%v/v甲酸/乙腈;流动相b为100%乙腈;流速为0.25~0.35ml/min(优选0.3ml/min);
所述梯度洗脱的条件为:0min:90%a+10%b;1min:90%a+10%b;2.5min:5%a+95%b;3.5min:5%a+95%b;3.6min:5%a+95%b;10min:90%a+10%b;
所述质谱仪的参数设置为:电压为5500v,帘气值为30、cad为medium、tem为500、ionsourcegas1为50、ionsourcegas2为55、declusteringpotential为80;数据均采用srm扫描模式。
上述三种检测方法(camp合成反应体系成分的分离检测方法、低检测限的camp定量检测方法或从camp合成反应体系中分离鉴定camp的方法)均可应用于腺苷酸环化酶鉴定当中,尤其是第三种方法实现了对camp先定性后定量的目标,创造性的提供了一套严格、方便的acs鉴定方法,使鉴定结果更为可靠和准确。
与现有技术相比,本发明的有益技术效果在于:
1.发明人通过长期大量的科学试验,进行筛选和鉴定工作,投入大量的人力、物力和多学科多理论支持得到本发明的检测方法,该方法克服了本领长久以来的关于acs鉴定的技术认知偏见(即现有技术条件下无法将amp、ado与camp分离),依托现有的仪器设备条件,通过合理巧妙的选择设置高效液相色谱仪和反向色谱柱及优化的色谱分离条件,首次可同时将五种camp合成途径中的相关分子(atp、adp、amp、ado和camp)进行基线分离。
2.本发明中,将液相色谱(acquityuplc,waters)和质谱(q-trap,absciex)偶联,利用srm(selectivereactionmonitoring)的扫描模式,最终选择camp的母子离子对(330.1/135.8m/z)对camp进行定性和定量,能显著提高对极低量camp检测的准确性,显著提高检测的最低浓度,有效的排除ado对camp检测的影响。
3.本发明方法将现有的液相色谱检测限由原来的0.5ng/ml降低到0.01ng/ml,检测范围由原来的1ng/ml~100ng/ml扩大到0.01ng/ml~10ug/ml。
4.本发明方法通过实现对五种camp合成途径中的相关分子的基线分离,不仅可排除amp、ado等对camp的干扰,使实验结果更加准确,还可以灵活的检测目标蛋白是否可以利用不同反应底物(atp、adp和/或amp)产生camp。
5.本发明为鉴定acs提供了一个严格、可靠、可信且便捷的检测方法和鉴定思路。
附图说明
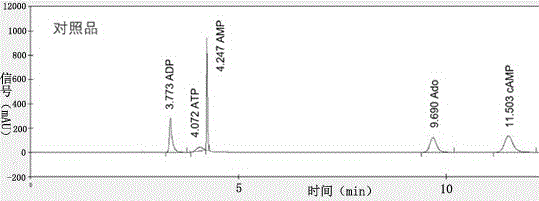
图1为五种camp合成途径中的相关标准品色谱分离图;
图2为以atp为反应底物鉴定ac活性的色谱图;
图3为以adp为反应底物鉴定ac活性的色谱图;
图4为以amp为反应底物鉴定ac活性的色谱图;
图5为质谱条件下camp和其碎片离子的质谱峰图;
图6为利用建立的液相色谱-质谱鉴定camp的生成及含量图。
具体实施方式
下面结合附图和实施例来说明本发明的具体实施方式,但以下实施例只是用来详细说明本发明,并不以任何方式限制本发明的范围。
在以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的试剂如无特别说明,均为市售常规试剂;所涉及的试验方法或步骤,如无特别说明,均为常规方法或步骤。
实施例:camp合成反应体系成分的分离鉴定方法
1.蛋白样品制备
将camp基因序列构建至含有his标签的真核表达载体中,通过瞬时转染人肾上皮细胞he293t(17)细胞中过表达目的蛋白,利用rapi裂解液裂解获得细胞蛋白,通过含有his标签抗体的proteina/g纯化目的蛋白样品用于实验。
2.液相色谱分离
液相色谱分离条件是选择高效液相色谱仪rigoll3000(beijing,china),利用反向色谱柱c18(250mm×4.6mm,5μm)进行分离。
(1)确定标准品的出峰时间
i.取1mg的标准品atp、adp、amp和camp溶解于1ml超纯水,取1mgado溶解在1ml纯甲醇溶液中,再用0.22µm的pvdf滤膜过滤;
ii.将标准品稀释到50µg/ml,50μl上样到液相色谱仪(rigoll3000);
iii.配制100%乙腈和100mmkh2po4,ph4.0按照2:98的体积混匀后,作为流动相进行等度洗脱,流速为1ml/min,柱温为30℃;
iv.将uv检测器的检测波长设置为254nm,检测标准品出峰时间。
五种camp合成途径中的相关标准品色谱分离图如图1所示。五种camp合成途径中的相关标准品的性质及分离条件如表1所示。
表1五种camp合成途径中的相关标准品的性质及分离条件
(2)以atp为底物检测体外酶活反应
i.取纯化的蛋白样品10μg加入到新配置的100μl反应缓冲液[50mmph8.0tris-hcl、2mmibmx(isobutylmethylxanthine)、5mmmgcl2或者mncl2、1mmatp]中在25℃的条件下反应1~2h之后,3000×g离心5min取上清;
ii.将反应液稀释到50µg/ml,50μl上样到液相色谱仪;
iii.配制100%乙腈和100mmkh2po4,ph4.0按照2:98的体积混匀后,作为流动相进行等度洗脱,流速为1ml/min,柱温为30℃;
iv.将uv检测器的检测波长设置为254nm,对照标准品出峰时间,判断是否有camp生成。
如图2所示,腺苷酸环化酶能够以atp为反应底物生成camp。
(3)以adp为底物检测体外酶活反应
i.取纯化的蛋白样品10μg加入到新配置的100μl反应缓冲液(50mmph8.0tris-hcl、2mmisobutylmethylxanthine、5mmmgcl2或者mncl2、1mmadp)中在25℃的条件下反应1~2h之后,3000×g离心5min取上清;
ii.将反应液稀释到50µg/ml,50μl上样到液相色谱仪;
iii.配制100%乙腈和100mmkh2po4,ph4.0按照2:98的体积混匀后,作为流动相进行等度洗脱,流速为1ml/min,柱温为30℃;
iv.将uv检测器的检测波长设置为254nm,对照标准品出峰时间,判断是否有camp生成。
如图3所示,腺苷酸环化酶不能以adp为反应底物生成camp。
(4)以amp为底物检测体外酶活反应
i.取纯化的蛋白样品10μg加入到新配置的100μl反应缓冲液[50mmph8.0tris-hcl、2mmibmx(isobutylmethylxanthine)、5mmmgcl2或者mncl2、1mmamp]中在25℃的条件下反应1~2h之后,3000×g离心5min取上清;
ii.将反应液稀释到50µg/ml,50μl上样到液相色谱仪;
iii.配制100%乙腈和100mmkh2po4,ph4.0按照2:98的体积混匀后,作为流动相进行等度洗脱,流速为1ml/min,柱温为30℃;
iv.将uv检测器的检测波长设置为254nm,对照标准品出峰时间,判断是否有camp生成。
如图4所示,腺苷酸环化酶不能以amp为反应底物生成camp。
3.液质联用法鉴定camp的含量
(1)体外酶活反应
取纯化的蛋白样品10μg加入到新配置的100μl反应缓冲液(50mmph8.0tris-hcl、2mmibmx、5mmmgcl2或者mncl2、1mmatp)中在25℃的条件下反应1~2h之后,3000×g离心5min取上清;
(2)制备标准曲线
取camp标准品溶于乙腈,配制浓度为1、5、10、20、50ng/ml的标准品溶液;
(3)样品的液相色谱分离及质谱鉴定
标准品和反应液取10μl上样进入超高效液相色谱uplc(waters,usa),色谱柱选用c18(100mm×4.6mm,1.7μm),流动相a为0.1%v/v甲酸/乙腈,流动相b为100%乙腈,进行梯度洗脱,流速为0.3ml/min;
梯度洗脱的条件为:
0min:90%a+10%b;1min:90%a+10%b;2.5min:5%a+95%b;3.5min:5%a+95%b;3.6min:5%a+95%b;10min:90%a+10%b;
质谱仪(absciexq-trap,sciex,usa)选择正离子模式,电压为5500v,帘气值设为30、cad为medium、tem为500、ionsourcegas1为50、ionsourcegas2为55、declusteringpotential为80;数据均采用srm扫描模式,q1质量设置为(330.1m/z)和q3质量设置为(135.8m/z);选择的离子对为(330.1/135.8m/z;330.1/118.7m/z),其中330.1m/z为camp母离子,而135.8m/z和118.7m/z为碎片离子;
(4)将碎片离子(135.8m/z)的tic峰面积与标准曲线进行比对,计算camp的含量。
如图5所示,该图为质谱条件下camp母离子和其碎片离子的质谱峰图示意图,其中330.1m/z为camp母离子,而135.8m/z为其碎片离子,可以用于camp的鉴定和定量;如图6所示,选择碎片离子135.8m/z,提取其总离子流图(tic)进行camp的定量,结果显示camp的出峰时间均在2.12min;两次碎片离子的质谱峰面积为1.21e5和1.15e5,进一步比对标准曲线,计算得camp含量为1.2ng/ml,试验准确性和重复性好。
上面结合附图和实施例对本发明作了详细的说明,但是,所属技术领域的技术人员能够理解,在不脱离本发明宗旨的前提下,还可以对上述实施例中的各个具体参数进行变更,形成多个具体的实施例,均为本发明的常见变化范围,在此不再一一详述。
- 还没有人留言评论。精彩留言会获得点赞!