细胞培养物蛋白质表达量和蛋白质聚集体量的检测方法和系统与流程
本发明涉及蛋白质检测技术领域,尤其是涉及一种细胞培养物蛋白质表达量和蛋白质聚集体量的检测方法和系统。
背景技术:
现代生物工程多采用哺乳动物细胞,以液体悬浮法生产蛋白质药物,细胞培养液中的蛋白质的表达量随培养时间发生变化,在培养后期需要频繁取样监控以寻找投入和产出的最佳平衡点;但常用的亲和高效液相色谱法测定蛋白质表达量,其测定的蛋白质表达量是包含蛋白质的聚集体形态、单体形态和含有fc的片段的加和值,而一般只有单体形态的蛋白质才是所需的,因此这种方法测定的结果不是准确的目标分子(单体形态)的表达量。此外,在细胞培养过程中,细胞分泌的蛋白质分子由于所处的液体环境、机械环境和分子自身物理化学属性等,会发生不同程度的聚集,这对于蛋白质的生产是不期望发生的,会影响工艺的收率和产品质量,因此监控培养物中蛋白质的聚集体百分比也是评价培养工艺的重要参数。此外,在进行细胞株开发时,不同克隆表达的蛋白质聚集体百分比和表达量是衡量所筛选细胞株的重要指标,这也需要一种简便可靠的方法对蛋白质的表达量和纯度进行检测。
传统的分析技术由于细胞培养物中的氨基酸、维生素、宿主蛋白、dna等成分的存在,会干扰目标蛋白的检测,所以无法直接测定细胞培养物中蛋白质的聚集体百分比,测定聚集体百分比需要首先使用亲和色谱柱对细胞培养上清待测样品进行纯化,再采用体积排阻-高效液相色谱检测,这种方式存在两种缺点:第一,使用大量的低ph流通相洗脱结合在亲和色谱柱上的目标蛋白时,低ph压力会容易导致样品聚集体的增高,虽然收集洗脱液后可以再对收集物进行ph调节,但ph调节使用的碱性溶液同样因局部溶液不均一导致聚集体进一步可能增高,这些都会导致测试结果不准确;第二:较为耗费人力和珍贵的样品,尤其当待测的细胞培养物样本数量较多、样本体积较少时,这种缺点尤为突出,如在进行细胞株开发时。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种细胞培养物蛋白质表达量和蛋白质聚集体量的检测方法,以解决现有技术中存在的无法准确检测蛋白质表达量以及聚集体百分比。
本发明的第二目的在于提供一种细胞培养物蛋白质表达量和蛋白质聚集体量的检测系统,系统结构简单,操作方便。
为了实现本发明的上述目的,特采用以下技术方案:
细胞培养物蛋白质表达量和蛋白质聚集体量的检测方法,包括如下步骤:
细胞培养物经串接的亲和色谱柱和体积排阻色谱柱进行梯度洗脱和检测;
梯度洗脱的流动相包括:流动相a:10-200mm磷酸二氢钠-磷酸氢二钠混合物,50-500mm氯化钠,ph6.8±0.5;流动相b:10-200mm甘氨酸,20-300mm氯化钠,ph2.5±0.5。
目前市面上的二维液相色谱是一种可同时测定细胞培养物中蛋白质表达量和聚集体百分比的有效方法,但是这种方法必须采用二维液相色谱仪,其缺点是设备价格高昂、维护较普通液相色谱复杂等,导致方法不容易控制及验证比较难通过,故这些缺点限制了其推广使用。
本发明的检测方法,将亲和色谱柱和体积排阻色谱柱串接,采用一定的流动相进行梯度洗脱,能够同时检测细胞培养物中蛋白质表达量和聚集体百分比,简便、易用、费用低廉,且结果可靠。
优选的,梯度洗脱的流动相包括:流动相a:40-60mm磷酸二氢钠-磷酸氢二钠混合物,250-350mm氯化钠,ph6.8±0.5;流动相b:50-150mm甘氨酸,100-200mm氯化钠,ph2.5±0.5。
优选的,梯度洗脱的流动相包括:流动相a:50mm磷酸二氢钠-磷酸氢二钠混合物,300mm氯化钠,ph6.8;流动相b:100mm甘氨酸,150mm氯化钠,ph2.5。
通过对梯度洗脱的流动相成分进行优化,能够进一步提高目标蛋白单体和目标蛋白聚集体的分离度,从而得到更精准的目标蛋白表达量和蛋白质聚集体的百分比。
优选的,串接的方式为亲和色谱柱和体积排阻色谱柱直接串接。
优选的,串接的方式为亲和色谱柱和体积排阻色谱柱通过六通阀转动连通串接。亲和色谱柱内接于六通阀的进样定量环的流路上,进样状态下,亲和色谱柱细胞培养物待测液经六通阀送入亲和色谱柱进行富集,进样结束后,目标蛋白单体及其聚集体富集在亲和色谱柱上;进样结束后,转动六通阀使亲和色谱柱和体积排阻色谱柱连通,梯度洗脱将目标蛋白的单体及其聚集体洗脱分离。相较于直接串联的方式,进一步节省了梯度洗脱的时间。
优选的,当亲和色谱柱和体积排阻色谱柱采用直接串接的方式时,梯度洗脱程序为:0%b0-60min,100%b60.1-90min。
优选的,当亲和色谱柱和体积排阻色谱柱采用六通阀转动连通的串接方式时,梯度洗脱程序为:0%b0-10min,100%b10.1-15.1min,0%b15.2-40min。更优选的,当采用六通阀转动连接的串接方式时,进样结束后,预先采用超纯水对亲和色谱柱进行预洗脱。采用超纯水对亲和色谱柱洗脱,使留在亲和色谱柱上的细胞培养物上清中的杂质组分经六通阀排出,然后再转动切换六通阀,使亲和色谱柱与体积排阻色谱柱连通。
优选的,梯度洗脱的流速为0.2-1ml/min。
优选的,细胞培养物的进样量为10-50μl。细胞培养物中蛋白质的浓度为0.5-5mg/ml。
优选的,细胞培养物中的目标蛋白质包括iga、igg(igg1、igg2、igg3、igg4)、igm、kappa轻链、lambda轻链、细胞因子等中的任一种。更优选的,细胞培养物中的目标蛋白质为igg1。
优选的,亲和色谱柱的填料的配基类型包括特异性结合iga、igg(igg1、igg2、igg3、igg4)、igm、kappa轻链、lambda轻链、细胞因子等配基中的任一种。
优选的,体积排阻色谱柱包括tosohtskg3000swxl(5μm颗粒或3μm颗粒)、watersproteinbeh2(
优选的,将细胞培养物预处理后进行梯度洗脱和检测,预处理的方法包括:取细胞培养物上清液,离心再取上清液作为待测样品。更优选的,离心的条件为:转速为10000-16000rpm,时间为5-15min,温度为5±1℃。进一步优选的,离心的条件为:转速为13000rpm,时间为10min,温度为5℃。
优选的,采用紫外-可见光进行检测。更优选的,检测波长为280nm。
本发明还提供了一种细胞培养物蛋白质表达量和蛋白质聚集体量的检测系统,包括溶剂泵、进样器六通阀、亲和色谱柱、体积排阻色谱柱、紫外可见光检测器;溶剂泵通过进样器六通阀连接于亲和色谱柱,体积排阻色谱柱串接于亲和色谱柱,体积排阻色谱柱的流出端连接于紫外可见光检测器。
优选的,进样器六通阀上的进样定量环设置在六通阀的二号位和五号位之间,亲和色谱柱内接于二号位与五号位的流路上,并且位于定量环的下游,溶剂泵连接于进样器六通阀的一号位,体积排阻色谱柱外接于进样器六通阀的六号位。
与现有技术相比,本发明的有益效果为:
(1)本发明的检测方法,将亲和色谱柱和体积排阻色谱柱串接,能够同时检测细胞培养物中蛋白质表达量和聚集体百分比;
(2)本发明的检测方法,测试结果准确,且无需购置复杂昂贵的二维高效液相色谱设备;并且,本发明的检测方法,适应性好,不受细胞培养物中的杂质组分干扰;
(3)本发明的检测系统,结构简单,操作方便。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
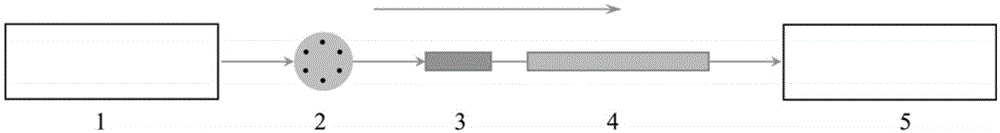
图1为本发明实施例1提供的检测系统的结构示意图;
图2为本发明实施例1提供的梯度洗脱后检测的色谱图;
图3为图2的色谱图的局部放大图;
图4为本发明实施例2提供的检测系统的结构示意图;
图5为本发明实施例2提供的梯度洗脱后检测的色谱图;
图6为图5的色谱图的局部放大图。
附图标记:
1-溶剂泵;2-进样器六通阀;3-亲和色谱柱;
4-体积排阻色谱柱;5-紫外可见光检测器;21-一号位;
22-二号位;23-三号位;24-四号位;
25-五号位;26-六号位;27-定量环;
x-目标蛋白单体;y-目标蛋白聚集体;z-杂质组分;
l-基线变化。
具体实施方式
下面将结合附图和具体实施方式对本发明的技术方案进行清楚、完整地描述,但是本领域技术人员将会理解,下列所描述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
在本发明的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
本发明实施例中采用的部分仪器和试剂信息如下:
仪器:
高效液相色谱仪(dad、vwd、mwd或flr检测器):厂商,安捷伦;型号:agilent1260;本发明各实施例的色谱柱的串接,是在hplc的柱温箱或进样器和柱温箱中实现的;
电子天平:厂商,梅特勒·托利多;型号,ms204/ml204t;
冷冻离心机:厂商,艾本德;型号,5424r;
亲和色谱柱:lifetechnologiesporosa/20(stainlesssteel)2.1mm×30mm(1-5024-12);
体积排阻色谱柱:tosohtskgelg3000swxl,7.8×300mm,5μm(008541)。
试剂:
二水合磷酸二氢钠:分析纯,国药/20040718;
无水磷酸氢二钠:分析纯,国药/20040618;
氯化钠:分析纯,国药/10019318;
甘氨酸:分析纯,sigma/g8790;
盐酸:分析纯,国药/10011018。
实施例1
图1是本发明实施例1提供的细胞培养物蛋白质表达量和蛋白质聚集体量的检测系统,如图1所示,该检测系统包括溶剂泵1、进样器六通阀2、亲和色谱柱3、体积排阻色谱柱4、紫外可见光检测器5。溶剂泵1通过进样器六通阀2连接于亲和色谱柱3,体积排阻色谱柱4串接于亲和色谱柱3,体积排阻色谱柱3的流出端连接于紫外可见光检测器5。
其中,将亲和色谱柱3用短peek管路和接头直接与体积排阻色谱柱4进行串联作为一个整体,接在进样器六通阀2的6号位和紫外可见光检测器5之间。其中,亲和色谱柱3在前,体积排阻色谱柱4在后,接入高效液相色谱系统。
采用本实施例的直接串接方式的系统对细胞培养物上清液中蛋白质表达量和蛋白质聚集体百分比进行检测,其中,细胞培养物为单克隆抗体,宿主细胞为cho,培养基为acti-pro,细胞培养物为igg1,培养物中基质为宿主细胞及其蛋白和dna、培养基、培养添加物(酸碱、葡萄糖等)、细胞代谢物等,取细胞培养物上清液,于13000rpm/min的转速下,5℃,离心10min,收集上清液作为待测样品,待测样品中蛋白质浓度为约2-3mg/ml。
待测样品经进样器六通阀2进样,进样器样品盘温度为5±3℃,进样量为30μl,进样结束后,通过溶剂泵1推动流动相进行梯度洗脱,梯度洗脱程序如下表1:
表1梯度洗脱程序
其中,流动相a为:50mmpb(磷酸二氢钠-磷酸氢二钠混合物),300mm氯化钠,ph6.8;流动相b为:100mm甘氨酸,150mm氯化钠,ph2.5。梯度洗脱的流速为:0.6ml/min。
在亲和色谱柱将目标蛋白单体和聚集体富集后,采用100%流动相a洗脱,能够保证杂质组分不会干扰蛋白质的聚集体和单体的检测,然后再使用100%流动相b将富集在亲和色谱柱上的蛋白质单体及其聚集体洗脱,并经随后的体积排阻色谱柱进一步分离。
经本实施例的方法检测得到的色谱图如图2和3所示,从图2中可知,经过本实施例的检测方法,杂质组分z(包含宿主蛋白、dna、培养基组分)得到充分分离洗脱,同时目标蛋白聚集体y和目标蛋白单体x有效分离,计算得到待测样品中目标蛋白质单体表达量为2.5mg/ml,蛋白质聚集体百分比为98.98%。
实施例2
图4是本发明实施例2提供的细胞培养物蛋白质表达量和蛋白质聚集体量的检测系统,如图4所示,该检测系统包括溶剂泵1、进样器六通阀2、亲和色谱柱3、体积排阻色谱柱4、紫外可见光检测器5。溶剂泵1通过进样器六通阀2连接于亲和色谱柱3,体积排阻色谱柱4串接于亲和色谱柱3,体积排阻色谱柱3的流出端连接于紫外可见光检测器5。
本实施例中,将亲和色谱柱3的接在进样器六通阀2的内部,将亲和色谱柱3接在进样器六通阀2的进样定量环27后。具体的,进样器六通阀2上的进样定量环27设置在六通阀的二号位22和五号位25之间,亲和色谱柱3内接于二号位22与五号位25的流路上,并且位于定量环27的下游,溶剂泵1连接于进样器六通阀2的一号位21,体积排阻色谱柱4外接于进样器六通阀2的六号位26。
当自动进样器六通阀2在load模式下,待测样品通过进样针注入定量环27中,并流经亲和色谱柱,目标蛋白单体和聚集体在亲和色谱柱上富集,杂质等废液经四号位24排出收集,进样结束后,进样一针或数针总体积大于100μl的超纯水以使滞留在亲和色谱柱上的细胞培养物上清中的杂质组分经由六通阀4号位24排出至废液,以保证杂质组分不被洗脱到后面的体积排阻色谱柱4和紫外可见光检测器5中,这样在随后的梯度洗脱中,只有蛋白质单体及其聚集体进入后面的体积排阻色谱柱4并进一步被分离。当进样及清洗步骤结束后,切换自动进样器六通阀2在inject模式下,启动溶剂泵,将流动相经一号位21、二号位22、定量环27到达亲和色谱柱3,五号位25和六号位26连通,进行梯度洗脱。
采用本实施例的六通阀转动连通串接方式的系统对细胞培养物上清液中蛋白质表达量和蛋白质聚集体百分比进行检测,其中,细胞培养物为单克隆抗体,宿主细胞为cho,培养基为acti-pro,细胞培养物为igg1,细胞培养物为宿主细胞及其蛋白和dna、培养基、培养添加物(酸碱、葡萄糖等)、细胞代谢物等,取细胞培养物上清液,于13000rpm/min的转速下,5℃,离心10min,收集上清液作为待测样品,待测样品中蛋白质浓度为约2-3mg/ml。
待测样品经进样器六通阀2进样,进样器样品盘温度为5±3℃,在load模式下,二号位22和三号位23连通,四号位24和五号位25连通,六号位26和一号位21连通,进样量为30μl,进样结束后,继续进样100μl超纯水,切换进样器六通阀2至inject模式,一号位21和二号位22连通,三号位23和四号位24连通,五号位25和六号位26连通,通过溶剂泵1推动流动相进行梯度洗脱,梯度洗脱程序如下表2:
表2梯度洗脱程序
其中,流动相a为:50mmpb(磷酸二氢钠-磷酸氢二钠混合物),300mm氯化钠,ph6.8;流动相b为:100mm甘氨酸,150mm氯化钠,ph2.5。梯度洗脱的流速为:0.6ml/min。
相比实施例1中的直接串接的方式,节省了梯度洗脱的时间。
经本实施例的方法检测得到的色谱图如图5和6所示,从图5中可知,经过本实施例的检测方法,杂质组分z(包含宿主蛋白、dna、培养基组分)得到充分分离洗脱,同时目标蛋白聚集体y和目标蛋白单体x有效分离,计算得到待测样品中目标蛋白质单体表达量为2.51mg/ml,蛋白质聚集体百分比为98.42%。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!