一种用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子及其制备方法与流程
本发明涉及医疗领域,尤其涉及一种用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子及其制备方法。
背景技术:
根据世界卫生组织国家癌症研究署研究统计,每年全球新增口腔癌患者约300,000人,死亡人数约120,000。相比20世纪60年代,口腔癌发病率上升15%,成为全身第六位最常见的恶性肿瘤。在美国,每天有超过100名的患者被诊断为口腔癌,其死亡率远高于一般的癌症,5年存活率仅为50%~60%,几乎每小时就有一名患者死于口腔癌。
表皮生长因子受体(epidermalgrowthfactorrecptor,egfr)属于erbb受体家族的一种,是一种酪氨酸激酶型跨膜受体,通过与配体结合激活下游信号通路来调控上皮细胞的生长,而上皮细胞的egfr突变或过表达一般会引发肿瘤。研究表明口腔黏膜癌前病变时期egfr表达即开始增强,并在黏膜上皮癌变过程中随着病变程度加重而表达加强,是口腔黏膜鳞癌的重要预后因素。相比其他分子标记物,egfr只在上皮细胞中表达,而且从正常上皮向鳞状细胞癌发展的过程中表达水平不断增高。可以作为口腔鳞癌肿瘤细胞的分子标记物用于鉴别诊断肿瘤细胞。
目前对口腔鳞癌的治疗主要还是以手术治疗为主的综合序列治疗。而手术切缘应确保无肿瘤细胞残留,临床上对术中手术切缘的判断主要依靠术中快速冰冻组织切片的组织病理学形态来判断,但这种传统技术仅对组织标本的几个层面进行检查,可能存在一定的漏诊,特别是癌旁组织中散在一些微小肿瘤灶,这也导致了部分手术切缘为阴性的患者术后出现肿瘤复发,因此,单纯依靠传统病理组织切片技术难以全面评价肿瘤切缘的情况。为了能够更加准确地评价肿瘤的手术切缘,手术切缘的分子边界这一概念随之产生。所谓肿瘤手术切缘的分子边界是指利用分子生物学和(或)基因组学的技术方法,检测手术切缘处的一些与肿瘤高度相关的基因或蛋白的表达情况,从而发现阴性切缘处的局部隐匿性癌灶,并根据这些分子标记物的表达情况对肿瘤做出准确的分子定界,更好地判断肿瘤的术后复发和评估肿瘤预后。但是传统的分子生物学技术如免疫组织化学、蛋白印迹、pcr及基因芯片等技术均既需要从肿瘤组织手术切缘部位切取组织检测,无法达到术中原位检测的要求,又需要对组织进行处理后检测,耗费时间,无法达到术中快速诊断要求。
近年来,拉曼光谱技术被引入到恶性肿瘤的诊断及检测中,为临床诊断恶性肿瘤提供了一种原位、快速、准确、无创的新方法。在生物样本的光谱检测研究中,拉曼光谱技术具有一定的优势,如谱峰较红外光谱分辨率高,不受水分干扰,成像实时快速等,特别适用于对红外光谱干扰较强的含有大量水分的生物样本研究。此外,拉曼光谱无需对样本进行特殊处理即可获得大量关于细胞、组织或体液内分子构成、分子结构和分子之间相互作用的信息,反映蛋白质、核酸、脂类等物质成分变化、结构改变等,被称为分子指纹技术。基于拉曼光谱技术的快速、无创检测方法,国内外学者开展了一系列拉曼光谱检测口腔癌的研究,取得了令人满意的成果,其诊断准确率可达90%以上。但由于拉曼光谱信号较弱,样本组织的拉曼信号易受高荧光背景影响,限制其在成分复杂的生物样本检测的应用。而表面增强拉曼光谱技术(surface-enhancedramanspectroscopy,sers)的应用可以很好地克服这一弱点。sers是基于电磁场增强和电荷转移增强的拉曼光谱新技术,不但具有拉曼光谱的优势,同时检测灵敏度较常规拉曼光谱高,甚至可以用于检测单分子结构,在医学研究领域被广泛应用于疾病生化物质变化的检测及疾病的鉴别诊断,如对鼻咽癌及胃肠道肿瘤的sers研究中发现,应用sers技术可以成功鉴别肿瘤组织及正常组织,并获得了较高的准确率、特异性及灵敏度。sers电磁场增强和电荷转移增强的原理是在样本中加入纳米级探针,当待测成分与纳米探针相互积聚时使得局域电磁场增强,而拉曼散射强度与分子所处光电场强度平方成正比,增强的局域电磁场极大地增加了吸附在探针表面分子产生拉曼散射的几率,所以增强了待测样本的拉曼强度,可以指数级(106到1014倍数)放大微弱的拉曼信号,sers谱峰较荧光谱峰窄,不存在光漂白和淬灭现象,明显提高其信噪比,而探针材料本身无明显的拉曼信号,不会对样本信号造成干扰,使其成为检测微量物质、单个细胞及分子的有力工具,可以反映物质含量的变化、分子及基团的结构改变等信息。而常规用于sers检测的纳米粒子多为未经修饰裸露纳米级金或银粒子,这些纳米粒子需要在复杂生物组织环境中应用,未经表层修饰,多是通过au-s键与蛋白质等生物大分子非特异性结合,无法与egfr蛋白特异性结合。这种未经表层修饰的裸露纳米探针容易跟一些杂质分子结合而无法特异性的与检测目标分子结合,同时裸露的探针容易产生团聚现象引起假阳性信号。
因此,制备一种能够增强拉曼光谱信号、应用于拉曼光谱检测口腔鳞癌肿瘤细胞egfr受体的纳米粒子成为迫在眉睫。
技术实现要素:
为了解决上述问题,本发明提出一种能够特异性识别口腔鳞癌肿瘤细胞的用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子及其其制备方法。
本发明通过以下技术方案实现的:
本发明提出一种用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子,所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子由纳米级金粒子与4-巯基苯甲酸、α-巯基-ω羧基聚乙二醇和egfr抗体反应制成;所述4-巯基苯甲酸修饰于所述纳米级金粒子表面,所述α-巯基-ω羧基聚乙二醇修饰于所述纳米级金粒子表面未被所述4-巯基苯甲酸修饰的剩余空间,所述egfr抗体与所述α-巯基-ω羧基聚乙二醇链接,所述纳米级金粒子作为sers探针。
本发明提出一种用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子的制备方法,所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子的制备包括如下步骤:
步骤一:应用柠檬酸钠及四氯金酸通过氧化还原方法制备纳米级金粒子;
步骤二:4-巯基苯甲酸与纳米级金粒子反应制备au-mba粒子;
步骤三:α-巯基-ω羧基聚乙二醇与au-mba粒子制备au-mba-peg粒子;
步骤四:au-mba-peg粒子与egfr抗体反应制成所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子。
进一步的,所述步骤一制备的纳米级金粒子的直径为30-70nm。
进一步的,所述纳米级金粒子的最佳直径为50nm。
进一步的,所述步骤二的详细过程为:取10ml合成的50nm纳米级金粒子溶液,在搅拌下缓慢滴加100μl0.1mm的4-巯基苯甲酸溶液,搅拌反应30min后静置12小时制成au-mba粒子溶液。
进一步的,所述步骤三的详细过程为:取10mlau-mba粒子溶液,在搅拌下缓慢滴加550μl0.2mm的分子量为5000的α-巯基-ω羧基聚乙二醇溶液,使α-巯基-ω羧基聚乙二醇的终浓度为20μm,搅拌反应30min后静置12小时制成au-mba-peg粒子溶液。
进一步的,所述步骤三的详细过程为:取10mlau-mba-peg粒子溶液,加入0.5mm的edc和nhs溶液各10μl,静置反应30min后离心去除多余的edc和nhs,之后加入2μl的egfr抗体,搅拌反应30min后静置室温下反应2小时,然后在4℃下反应12小时,使egfr抗体中的氨基充分与活化的α-巯基-ω羧基聚乙二醇中的羧基反应并链接,制成所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子。
本发明的有益效果:
本发明提出的用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子能够与口腔鳞癌肿瘤细胞特性结合,从而获得特异性的拉曼信号,从而快速、准确、实时、原位的检测口腔鳞癌肿瘤细胞;相比传统冰冻病理组织切片检查,节省时间,提高准确度,为临床术中口腔鳞癌肿瘤细胞是否残留提供新的检测方法。
附图说明
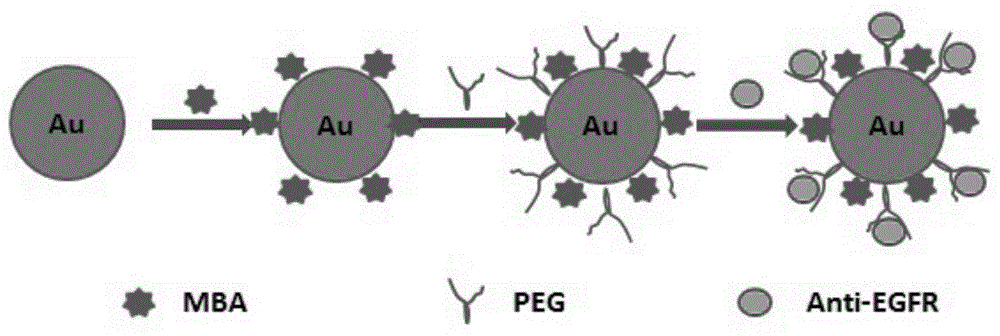
图1为本发明的用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子的合成示意图;
图2为本发明的用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子的纳米级金粒子的扫描电镜图像及拉曼光谱图;
图3为本发明的用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子的au-mba-peg粒子的扫描电镜图像及拉曼光谱图;
图4为本发明的用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子的扫描电镜图像及拉曼光谱图。
具体实施方式
为了更加清楚、完整的说明本发明的技术方案,下面结合附图对本发明作进一步说明。
请参考图1至图4,本发明提出一种用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子,所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子由纳米级金粒子与4-巯基苯甲酸、α-巯基-ω羧基聚乙二醇和egfr抗体反应制成;所述4-巯基苯甲酸修饰于所述纳米级金粒子表面,所述α-巯基-ω羧基聚乙二醇修饰于所述纳米级金粒子表面未被所述4-巯基苯甲酸修饰的剩余空间,所述egfr抗体与所述α-巯基-ω羧基聚乙二醇链接,所述纳米级金粒子作为sers探针。
在本实施方式中,图1中的au为纳米级金粒子;图1中的mba为4-巯基苯甲酸;图1中的peg为α-巯基-ω羧基聚乙二醇;图1中的anti-egfr为egfr抗体;所述纳米级金粒子作为sers探针,所述egfr抗体中的氨基充分与活化的所述α-巯基-ω羧基聚乙二醇中的羧基反应并链接,所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子能够与口腔鳞癌肿瘤细胞特性结合,从而获得特异性的拉曼信号,从而快速、准确、实时、原位的检测口腔鳞癌肿瘤细胞;相比传统冰冻病理组织切片检查,节省时间,提高准确度,为临床术中口腔鳞癌肿瘤细胞是否残留提供新的检测方法;所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子具有拉曼活性信号,不仅可以增强拉曼光谱信号,同时表面修饰所述4-巯基苯甲酸具有特征性拉曼信号,便于检测。
本发明提出一种用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子的制备方法,所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子的制备包括如下步骤:
步骤一:应用柠檬酸钠及四氯金酸通过氧化还原方法制备纳米级金粒子;
步骤二:4-巯基苯甲酸与纳米级金粒子反应制备au-mba粒子;
步骤三:α-巯基-ω羧基聚乙二醇与au-mba粒子制备au-mba-peg粒子;
步骤四:au-mba-peg粒子与egfr抗体反应制成所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子。
在本实施方式中,柠檬酸钠及四氯金酸通过氧化还原方法是常用的制备所述纳米级金粒子的方法,通过控制柠檬酸钠及四氯金酸的温度及浓度,可以制备不同直径的纳米探针,操作简便,被广泛应用。
进一步的,所述步骤一制备的纳米级金粒子的直径为30-70nm。
进一步的,所述纳米级金粒子的最佳直径为50nm。
进一步的,所述步骤二的详细过程为:取10ml合成的50nm纳米级金粒子溶液,在搅拌下缓慢滴加100μl0.1mm的4-巯基苯甲酸溶液,搅拌反应30min后静置12小时制成au-mba粒子溶液。
进一步的,所述步骤三的详细过程为:取10mlau-mba粒子溶液,在搅拌下缓慢滴加550μl0.2mm的分子量为5000的α-巯基-ω羧基聚乙二醇溶液,使α-巯基-ω羧基聚乙二醇的终浓度为20μm,搅拌反应30min后静置12小时制成au-mba-peg粒子溶液。
进一步的,所述步骤三的详细过程为:取10mlau-mba-peg粒子溶液,加入0.5mm的edc和nhs溶液各10μl,静置反应30min后离心去除多余的edc和nhs,之后加入2μl的egfr抗体,搅拌反应30min后静置室温下反应2小时,然后在4℃下反应12小时,使egfr抗体中的氨基充分与活化的α-巯基-ω羧基聚乙二醇中的羧基反应并链接,制成所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子。
使用时,将所述用于拉曼光谱检测口腔鳞癌肿瘤细胞的纳米粒子应用培养基调整浓度至1nmol/l后加入细胞培养皿内,经过24小时细胞内吞粒子后对爬片生长的细胞进行封片操作,将其固定在两块盖玻片之间的空隙内进行成像;经过该操作处理,细胞密封于pbs薄液层中,可保持状态约2h。应用nanophotonraman-11激光显微共聚焦拉曼光谱仪检测,采谱条件为:532nm,线扫描成像,功率约为10mw,曝光时间10s每条线,光栅为600/mm,镜头为100倍油镜(na1.45),最后应用ramanimager软件绘制细胞拉曼光谱图。
当然,本发明还可有其它多种实施方式,基于本实施方式,本领域的普通技术人员在没有做出任何创造性劳动的前提下所获得其他实施方式,都属于本发明所保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!