一种用于猝灭剂检测的荧光传感器及检测方法与流程
本发明涉及荧光传感器技术领域。更具体地,涉及一种用于猝灭剂检测的荧光传感器及检测方法。
背景技术:
适配体作为一种新兴的生物材料,具有特异性强,生物兼容性好,易修饰等特点,在生物传感、医药研究等方面有着广泛的应用。适配体用于传感领域,主要利用的是由分析物引起的适配体链段构型改变所引起的信号变化。常见的适配体传感器包含三部分,荧光团,适配体链以及猝灭基团,对于检测物自身的特性却少有考虑。而检测物中,金属离子如cu2+,生物小分子如atp,自身都具有一定的荧光猝灭能力。
目前,有机分子型荧光探针的构建大多都是建立在往已有的荧光团上修饰识别基团来实现的。这种识别基团能够选择性地、高灵敏地与分析物结合,进而实现分析物的检测。检测的灵敏度和选择性取决于识别基团。在这方面,适配体起到的作用与有机识别基团相一致,其性能上甚至优于有机识别基团。我们设想,能否实现利用检测物自身的猝灭作用,而不再利用猝灭剂的辅助,就能实现猝灭剂型检测物的检测。2003年,guonanchen等人第一次报道了利用hg2+作为猝灭剂,在无外加辅助猝灭剂的条件下,实现了对hg2+进行检测的dna探针设计。该报道验证了我们利用检测物作为猝灭剂的设想。然而,该方法利用了另一条dna辅助链,增加了体系的复杂性,同时增加了检测时的稳定时间。
技术实现要素:
本发明的一个目的在于提供一种基于荧光分子标记的适配体链段进行猝灭剂检测的荧光传感器,为传感器的设计提供了一种新思路。
本发明的另一个目的在于提供一种利用如上所述的荧光传感器进行未知溶液中猝灭剂浓度检测的检测方法。
为达到上述第一个目的,本发明采用下述技术方案:
一种用于猝灭剂检测的荧光传感器,所述荧光传感器由猝灭剂特定的适配体链段和荧光团组成;其中,所述荧光团修饰在适配体链段的3’端或5’端。
优选地,在所述荧光传感器中,当所述适配体链段为ag适配体链段、hg适配体链段、atp适配体链段或dopamine适配体链段时,所述荧光团为6-fam;
或在所述荧光传感器中,当所述适配体链段为cu适配体链段时,所述荧光团为6-fam、tamra或rox。
优选地,所述cu适配体链段的序列如seqidno.1所示;ag适配体链段的序列如seqidno.2所示;hg适配体链段的序列如seqidno.3所示;atp适配体链段的序列如seqidno.4所示;dopamine适配体链段的序列如seqidno.5所示。
优选地,当适配体链段为cu适配体链段、ag适配体链段、hg适配体链段或atp适配体链段时,荧光团修饰在适配体链段的5’端;
当适配体链段为dopamine适配体链段时,荧光团修饰在适配体链段的3’端。
本发明还提供一种如上任一项所述的荧光传感器在检测猝灭剂cu2+、ag+、hg2+、atp或dopamine中的应用。
为达到上述第二个目的,本发明采用下述技术方案:
一种利用如上任一项所述的荧光传感器进行猝灭剂检测的检测方法,包括以下步骤:
选择所述荧光传感器的合适浓度以及合适的检测溶液体系,在荧光光谱仪测试系统下选择特定的激发波长,进行以最大荧光发射峰强度为纵坐标、以猝灭剂浓度为横坐标的标准曲线绘制;
选择与猝灭剂结构相似、可能会产生干扰的类似物进行荧光传感器的选择性测试;
用检测溶液体系将待检测溶液稀释若干倍,检测此时的荧光强度值,与标准曲线进行对比,求算出待检测溶液中的猝灭剂浓度。
优选地,绘制标准曲线时,荧光传感器cu-adfs,cu-ta-adfs,cu-ro-adfs,ag-adfs,hg-adfs和dopamine-adfs采用的荧光传感器浓度为300nm;荧光传感器atp-adfs采用的荧光传感器浓度为500nm。
优选地,绘制标准曲线时,
cu-adfs的检测溶液体系为25mmhepes,100mmnacl,1mmmgcl2的缓冲溶液体系(ph=7.0);
cu-ta-adfs和cu-ro-adfs的检测溶液体系为100mmnacl,1mmmgcl2超纯水溶液体系。
ag-adfs和hg-adfs的检测溶液体系为25mmhepes缓冲溶液体系(ph=7.0);
atp-adfs和dopamine-adfs的检测溶液体系为1xpbs缓冲溶液体系(ph=7.4)。
优选地,在荧光光谱仪测试系统下,
荧光传感器cu-adfs,ag-adfs,hg-adfs,atp-adfs,dopamine-adfs选择的激发波长为485nm;
荧光传感器cu-ta-adfs选择的激发波长为560nm;荧光传感器cu-ro-adfs选择的激发波长为585nm。
本发明的有益效果如下:
本发明选择了选择性强、灵敏度高的适配体链段作为识别基团,末端修饰的荧光团作为检测单元,构建了一种基于荧光团修饰的适配体链段进行猝灭剂检测的新方法,为荧光传感器的设计和适配体的应用推广提供了一种新思路。与现有技术相比,本发明的明显优势在于:
(1)与传统的有机荧光分子型传感器相比,适配体链段作为识别基团具有超越有机分子识别基团的灵敏度和选择性;同时,该发明涉及的传感器无需复杂的合成,结构简单,使用方便。
(2)与传统的适配体型荧光传感器相比,该发明设计的传感器属于无猝灭基团辅助的适配体传感器,相比较于双末端修饰、中间修饰的适配体型传感器更加经济实惠;同时,不再引入多余的猝灭剂,无前处理过程,操作快捷方便。
(3)本发明所设计的传感器更有利于生物体系的检测,dna作为一种重要的遗传物质,具有非常优异的生物相容性,在生物检测、医学诊断等领域具有较大的应用前景。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
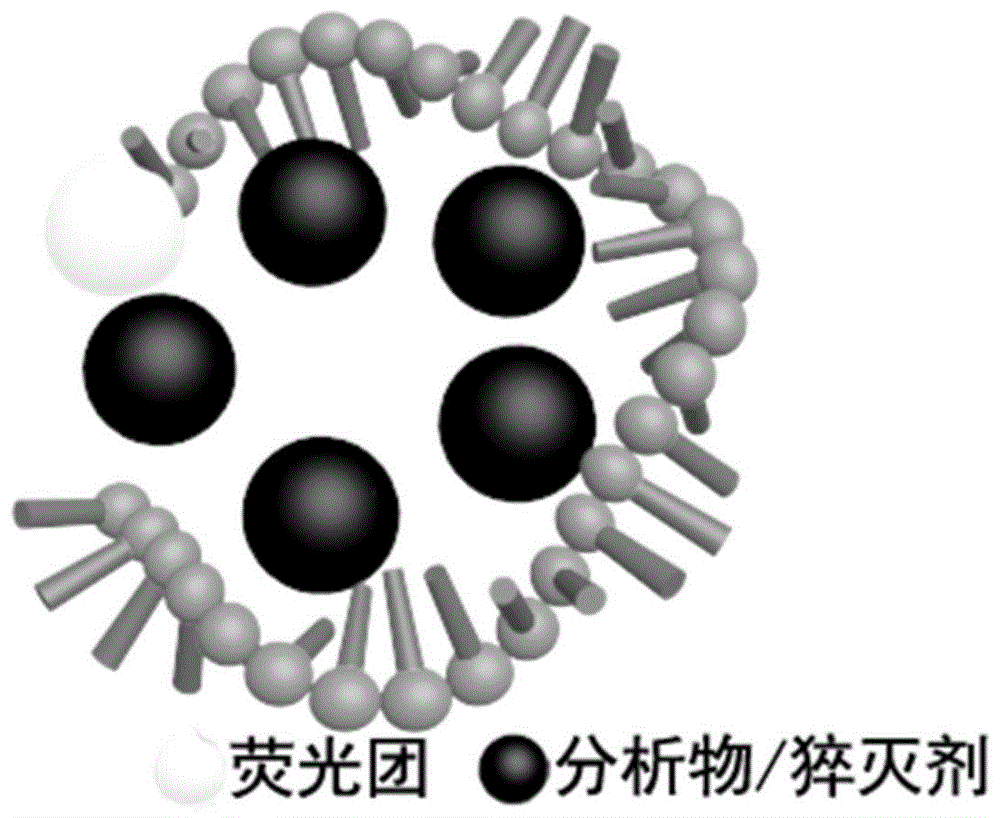
图1示出本发明实施例1,2,3,4,5中关于利用本发明提供的荧光传感器进行猝灭剂检测的机理示意图。
图2示出本发明实施例1中关于利用cu适配体修饰的tamra进行cu2+检测以及直接利用tamra进行cu2+检测的滴定曲线。
图3示出本发明实施例1中关于利用cu适配体修饰的tamra荧光传感器的选择性。
图4示出本发明实施例1中关于利用cu适配体修饰的tamra荧光传感器进行污水体系中cu2+检测结论图。
图5示出本发明实施例2中关于利用ag适配体修饰的6-fam荧光传感器进行ag+检测以及直接利用6-fam进行ag+检测的滴定曲线。
图6示出本发明实施例3中关于利用hg适配体修饰的6-fam荧光传感器进行hg2+检测以及直接利用6-fam进行hg2+检测的滴定曲线。
图7示出本发明实施例4中关于利用atp适配体修饰的6-fam荧光传感器进行atp检测以及直接利用6-fam进行atp检测的滴定曲线。
图8示出本发明实施例5中关于利用dopamine适配体修饰的6-fam荧光传感器进行dopamine检测以及直接利用6-fam进行dopamine检测的滴定曲线。
具体实施方式
为使本发明的、技术方案和优点更加清楚,下面将结合附图对本发明实施方式作进一步地详细描述。
需要说明的是,本发明中6-fam、tamra和rox均是常见的荧光分子;其中,“fam”是指羧基荧光素,是荧光素衍生物的一种;术语“tamra”全称羧基四甲基罗丹明,是罗丹明类荧光素衍生物。
本发明中cu适配体链段修饰的6-fam、tamra、rox荧光传感器,分别标记为cu-adfs,cu-ta-adfs,cu-ro-adfs;ag适配体链段、hg适配体链段、atp适配体链段、dopamine适配体链段修饰的6-fam荧光传感器,分别标记为ag-adfs,hg-adfs,atp-adfs,dopamine-adfs。
一方面,本发明提供一种用于猝灭剂检测的荧光传感器,所述荧光传感器由猝灭剂特定的适配体链段和荧光团组成;其中,所述荧光团修饰在适配体链段的3’端或5’端。本发明中的荧光传感器,与传统的有机荧光分子型传感器相比,适配体链段作为识别基团具有超越有机分子识别基团的灵敏度和选择性,且该发明涉及的传感器无需复杂的合成,结构简单,使用方便;本发明中的荧光传感器与传统的适配体型荧光传感器相比,属于无猝灭基团辅助的适配体传感器,相比较于双末端修饰、中间修饰的适配体型传感器更加经济实惠,且不再引入多余的猝灭剂,无前处理过程,操作快捷方便。
本发明中的分析物要求对被修饰的荧光团有一定的荧光猝灭能力,如cu2+,ag+,hg2+,atp,dopamine对6-fam,cu2+对tamra以及rox;适配体可以是离子适配体,如cu2+,ag+,hg2+,也可以是生物小分子,如atp,dopamine。本发明具体列举的几种荧光团和分析物猝灭剂的种类,仅仅是对本发明的进一步具体说明。本领域技术人员可以在本发明提供的设计思路的基础上,选择其它合适的荧光团和适配体链段的组合,制备得到其它的荧光传感器,本发明对此不再一一列举。
在本发明优选的实施方式中,根据分析物与荧光团之间的关系,共构建了七种适配体型荧光传感器,包括cu-adfs,cu-ta-adfs,cu-ro-adfs,ag-adfs,hg-adfs,atp-adfs,dopamine-adfs。具体地,在所述荧光传感器中,当所述适配体链段为ag适配体链段、hg适配体链段、atp适配体链段或dopamine适配体链段,所述荧光团为6-fam;当所述适配体链段为cu适配体链段时,所述荧光团为6-fam、tamra或rox。
本发明中的五种适配体链段,所述cu适配体链段的序列如seqidno.1所示;ag适配体链段的序列如seqidno.2所示;hg适配体链段的序列如seqidno.3所示;atp适配体链段的序列如seqidno.4所示;dopamine适配体链段的序列如seqidno.5所示。
表1适配体链段序列表
关于荧光团在适配体链段上的修饰位置,需要根据具体情况进行选择。适配体链段与分析物结合后会形成特定的二级结构,调整荧光团在适配体链段上的嵌入位置,能够改变荧光团与猝灭剂间的距离,进而产生不同的猝灭特性。在本发明具体的实施方式中,当适配体链段为cu适配体链段、ag适配体链段、hg适配体链段或atp适配体链段时,荧光团修饰在适配体链段的5’端;当适配体链段为dopamine适配体链段时,荧光团修饰在适配体链段的3’端。在本发明的其它实施方式中,根据具体情况,荧光团也可以选择性的修饰在适配体链段的其它合适位置。
本发明还提供一种如上任一项所述的荧光传感器在检测猝灭剂cu2+、ag+、hg2+、atp或dopamine中的应用。可以理解的是,本领域技术人员可以在本发明的设计思路的基础上,设计出其他种类直接利用荧光分子标记适配体链段的荧光传感器,用于检测其他种类的猝灭剂。
另一方面,本发明还提供一种利用如上任一项所述的荧光传感器进行猝灭剂检测的检测方法,包括以下步骤:
(1)选择所述荧光传感器的合适浓度以及合适的检测溶液体系,在荧光光谱仪测试系统下选择合适的激发波长,进行以最大荧光发射峰强度为纵坐标、以猝灭剂浓度为横坐标的标准曲线绘制;
(2)选择与猝灭剂结构相似、可能会产生干扰的类似物进行荧光传感器的选择性测试;
(3)用检测溶液体系将待检测溶液稀释若干倍,检测此时的荧光强度值,与标准曲线进行对比,求算出待检测溶液中的猝灭剂浓度。
其中,进行荧光传感器标准曲线的绘制包括以下步骤:
准确配置5mmcu2+,0.05mmag+,0.5mmhg2+,50mmatp,100mmdopamine标准溶液,用作猝灭剂滴定。准确配置25mmhepes,100mmnacl,1mmmgcl2缓冲溶液体系(ph=7.0),作为cu-adfs的检测溶液体系。准确配置100mmnacl,1mmmgcl2溶液体系,作为cu-ta-adfs和cu-ro-adfs荧光传感器的检测溶液体系。准确配置25mmhepes缓冲溶液体系(ph=7.0)作为ag-adfs和hg-adfs的检测溶液体系。准确配置1xpbs缓冲溶液体系作为atp-adfs和dopamine-adfs的检测溶液体系。
对于cu-adfs,cu-ta-adfs,cu-ro-adfs,ag-adfs,hg-adfs,dopamine-adfs标准曲线的绘制,采用的300nm传感器浓度。移取3ul100um上述荧光传感器,分别加入到1ml对应的检测溶液体系中。对于atp-adfs标准曲线的绘制,采用的是500nm传感器浓度,移取5ul100um的atp-adfs,加入到1ml1xpbs缓冲溶液体系中。
以fl-4600荧光光谱仪(日立)作为检测平台。对于cu-adfs,ag-adfs,hg-adfs,atp-adfs,dopamine-adfs,选择激发波长为485nm,对于cu-ta-adfs,cu-ro-adfs,激发波长分别为560nm和585nm。分别往含有适配体荧光传感器的检测溶液体系中滴加猝灭剂标准溶液,记录不同猝灭剂浓度时对应的最大发射峰处的荧光强度,并进行归一化处理。归一化处理的操作为,标记不含有猝灭剂的检测溶液体系的最大发射峰处荧光强度为f0,标记含有不同猝灭剂浓度(浓度标记为x)的检测溶液体系的最大发射峰处荧光强度为fx,以fx/f0值作为相对荧光强度。绘制相对荧光强度与猝灭剂浓度的标准曲线。
其中,传感器选择性测试的实验步骤包括:
准确配置5mmcd2+,ni2+,zn2+,cr3+,co2+,pb2+,hg2+,ca2+,mg2+标准溶液。取300nmcu-ta-adfs加入到含100mmnacl,1mmmgcl2的超纯水检测溶液。分别往体系中加入50um上述干扰离子,测试干扰离子存在下,最大发射波长处的荧光强度值。
其中,荧光传感器应用于未知溶液体系中猝灭剂浓度的测试,以cu-ta-adfs荧光传感器检测工业中浸泡有铜管的污水为例,步骤包括:
采用的待检测溶液是工业中浸泡有铜管的污水,除去待检测溶液体系中的明显杂质,取上清液溶液若干。利用100mmnacl,1mmmgcl2的超纯水溶液将污水待测样品稀释10倍,检测液总体积控制在1ml,向体系中加入300nmcu-ta-adfs,记录最大发射波长处的荧光强度,进行归一化处理,得到相对荧光强度值。重复测定三次,取平均值作为测试结果。代入标准曲线拟合的非线性方程,求算得到cu2+浓度为61.95um,相比较于原子吸收法的测定结果60.72um,荧光测试法仅存在2.026%的偏差。
下面结合具体实施例进行详细说明。
实施例1
1)设计并制备出cu适配体修饰的6-fam,tamra,rox荧光传感器,分别标记为cu-adfs,cu-ta-adfs,cu-ro-adfs,其基本结构分别为:6-fam-atcgcgatattttctgtagcgattcttgtttgagcgctcggtacgaacaga;tamra-atcgcgatattttctgtagcgattcttgtttgagcgctcggtacgaacaga;rox-atcgcgatattttctgtagcgattcttgtttgagcgctcggtacgaacaga。
2)准确配置标准浓度为5mm的cu2+溶液,用作标准曲线的标定。配置25mmhepes,100mmnacl,1mmmgcl2的缓冲溶液体系(ph=7.0),用作cu-adfs的检测溶液体系。配置100mmnacl,1mmmgcl2的超纯水溶液体系,用作cu-ta-adfs、cu-ro-adfs的检测溶液体系。选择fl-4600荧光光谱仪(日立)作为检测仪器,选择485nm作为cu-adfs的激发波长,选择560nm作为cu-ta-adfs的激发波长,选择585nm作为cu-ro-adfs的激发波长,采集最大发射峰处荧光强度,进行归一化处理。归一化处理的操作为,标记不含有猝灭剂的检测溶液体系的最大发射峰荧光强度为f0,标记含有不同猝灭剂浓度(浓度标记为x)的检测溶液体系的最大发射峰荧光强度为fx,以fx/f0值作为相对荧光强度。
3)对于cu-adfs,采用2um的间隔逐滴加入分析物cu2+,同时记录不同cu2+浓度时的相对荧光强度值,一直采样到50um,重复三次。对于cu-ta-adfs和cu-ro-adfs,采用5um的间隔逐滴加入分析物cu2+,同时记录不同cu2+浓度时的相对荧光强度值,一直采样到50um,重复三次。绘制相对荧光强度值与猝灭剂浓度的标准曲线。从图2中可以看出,随着体系cu2+浓度的增加,cu-ta-adfs的荧光强度逐渐降低。而对比游离的tamra溶液,在相同的离子浓度下,荧光强度几乎不变化,说明了适配体在增强荧光猝灭的过程中起到了非常重要的作用。
4)取3ul100umcu-ta-adfs,加入到1ml100mmnacl,1mmmgcl2的超纯水溶液体系中。准确配置5mmcd2+,ni2+,zn2+,cr3+,co2+,pb2+,hg2+,ca2+,mg2+标准溶液。分别往体系中加入50um上述干扰离子,测试干扰离子存在下,最大发射波长处的荧光强度值。标记不存在干扰离子时荧光强度为fintial,标记加入50um干扰离子后的荧光强度为fend,以fintial/fend作为参比值,其中fintial/fend数值越大表明存在的干扰越严重,fintial/fend数值越小表明干扰不明显。从图3可以看出,当干扰物浓度为50um时,除了cr3+存在一定的干扰外,其它金属离子对cu-ta-adfs几乎不存在干扰,表明cu-ta-adfs具有优异的选择性。
5)取100ul待检测的污水溶液,加入到900ul100mmnacl,1mmmgcl2的超纯水溶液体系中。向体系中加入3ul100umcu-ta-adfs,测试此时的荧光强度,重复三次,取平均值作为测试结果,并进行归一化处理,得到平均相对荧光强度值。将相对荧光强度值代入标准曲线非线性方程,从图4可以看出,计算得到cu2+的浓度为61.95um,与原子吸收法测试得到的数据相比,仅存在2.026%的偏差。
实施例2
1)设计并制备出ag适配体修饰的6-fam荧光传感器,标记为ag-adfs,其基本结构为:6-fam-ctctcttctcttcatttttcaacacaacacac。
2)准确配置标准浓度为0.05mm的ag+溶液,用作标准曲线的标定。配置25mmhepes缓冲溶液体系(ph=7.0),用作ag-adfs的检测溶液体系。选择fl-4600荧光光谱仪(日立)作为检测仪器,选择485nm作为ag-adfs的激发波长,采集最大发射峰处荧光强度,进行归一化处理。归一化处理的操作为,标记不含有猝灭剂的检测溶液体系的最大发射峰荧光强度为f0,标记含有不同猝灭剂浓度(浓度标记为x)的检测溶液体系的最大发射峰荧光强度为fx,以fx/f0值作为相对荧光强度。
3)对于ag-adfs,采用0.2um的间隔逐滴加入分析物ag+,同时记录不同ag+浓度时的相对荧光强度值,一直采样到3.6um,重复三次。绘制相对荧光强度值与猝灭剂浓度的标准曲线。从图5中可以看出,随着体系ag+浓度的增加,ag-adfs的荧光强度逐渐降低。而对比游离的6-fam溶液,在相同的离子浓度下,荧光强度几乎不变化,说明了适配体在增强荧光猝灭的过程中起到了非常重要的作用。
实施例3
1)设计并制备出hg适配体修饰的6-fam荧光传感器,标记为hg-adfs,其基本结构为:6-fam-ttctttcttccccttgtttgtt。
2)准确配置标准浓度为0.5mm的hg2+溶液,用作标准曲线的标定。配置25mmhepes,用作hg-adfs的检测溶液体系。选择fl-4600荧光光谱仪(日立)作为检测仪器,选择485nm作为hg-adfs的激发波长,采集最大发射峰处荧光强度,进行归一化处理。归一化处理的操作为,标记不含有猝灭剂的检测溶液体系的最大发射峰荧光强度为f0,标记含有不同猝灭剂浓度(浓度标记为x)的检测溶液体系的最大发射峰荧光强度为fx,以fx/f0值作为相对荧光强度。
3)对于hg-adfs,采用1um的间隔逐滴加入分析物hg2+,同时记录不同hg+浓度时的相对荧光强度值,一直采样到12um,重复三次。绘制相对荧光强度值与猝灭剂浓度的标准曲线。从图6中可以看出,随着体系hg2+浓度的增加,hg-adfs的荧光强度逐渐降低。而对比游离的6-fam溶液,在相同的离子浓度下,荧光强度几乎不变化,说明了适配体在增强荧光猝灭的过程中起到了非常重要的作用。
实施例4
1)设计并制备出atp适配体修饰的6-fam荧光传感器,标记为atp-adfs,其基本结构为:6-fam-acctgggggagtattgcggaggaaggt。
2)准确配置标准浓度为50mm的atp溶液,用作标准曲线的标定。配置1xpbs缓冲溶液,用作atp-adfs的检测溶液体系。选择fl-4600荧光光谱仪(日立)作为检测仪器,选择485nm作为atp-adfs的激发波长,采集最大发射峰处荧光强度,进行归一化处理。归一化处理的操作为,标记不含有猝灭剂的检测溶液体系的最大发射峰荧光强度为f0,标记含有不同猝灭剂浓度(浓度标记为x)的检测溶液体系的最大发射峰荧光强度为fx,以fx/f0值作为相对荧光强度。
3)对于atp-adfs,采用0.2mm的间隔逐滴加入分析物atp,同时记录不同atp浓度时的相对荧光强度值,一直采样到5mm,重复三次。绘制相对荧光强度值与猝灭剂浓度的标准曲线。从图7中可以看出,随着体系atp浓度的增加,atp-adfs的荧光强度逐渐降低。而对比游离的6-fam溶液,在相同的atp浓度下,虽然荧光强度有一定程度的降低,但atp-adfs的荧光猝灭现象更为明显,说明了适配体在增强荧光猝灭的过程中起到了非常重要的作用。
实施例5
1)设计并制备出dopamine适配体修饰的6-fam荧光传感器,标记为dopamine-adfs,其基本结构为:gtctctgtgtgcgccagagacactggggcagatatgggccagcacagaatgaggccc-6-fam。
2)准确配置标准浓度为100mm的dopamine溶液,用作标准曲线的标定。配置1xpbs缓冲溶液,用作dopamine-adfs的检测溶液体系。选择fl-4600荧光光谱仪(日立)作为检测仪器,选择485nm作为dopamine-adfs的激发波长,采集最大发射峰处荧光强度,进行归一化处理。归一化处理的操作为,标记不含有猝灭剂的检测溶液体系的最大发射峰荧光强度为f0,标记含有不同猝灭剂浓度(浓度标记为x)的检测溶液体系的最大发射峰荧光强度为fx,以fx/f0值作为相对荧光强度。
3)对于dopamine-adfs,采用0.5mm的间隔逐滴加入分析物dopamine,同时记录不同dopamine浓度时的相对荧光强度值,一直采样到10mm,重复三次。绘制相对荧光强度值与猝灭剂浓度的标准曲线。从图8中可以看出,随着体系dopamine浓度的增加,dopamine-adfs的荧光强度逐渐降低。而对比游离的6-fam溶液,在相同的dopamine浓度下,虽然荧光强度有一定程度的降低,但dopamine-adfs的荧光猝灭现象更为明显,说明了适配体在增强荧光猝灭的过程中起到了非常重要的作用。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
序列表
<110>中国科学院理化技术研究所
中国科学院大学
<120>一种用于猝灭剂检测的荧光传感器及检测方法
<130>jlc19i0195e
<160>5
<170>siposequencelisting1.0
<210>1
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>1
atcgcgatattttctgtagcgattcttgtttgagcgctcggtacgaacaga51
<210>2
<211>32
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctctcttctcttcatttttcaacacaacacac32
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttctttcttccccttgtttgtt22
<210>4
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>4
acctgggggagtattgcggaggaaggt27
<210>5
<211>57
<212>dna
<213>人工序列(artificialsequence)
<400>5
gtctctgtgtgcgccagagacactggggcagatatgggccagcacagaatgaggccc57
- 还没有人留言评论。精彩留言会获得点赞!