药物颗粒剂的近红外质量监控方法与流程
本发明属于药剂的质检分析领域,具体涉及药物颗粒剂的近红外质量监控方法。
背景技术:
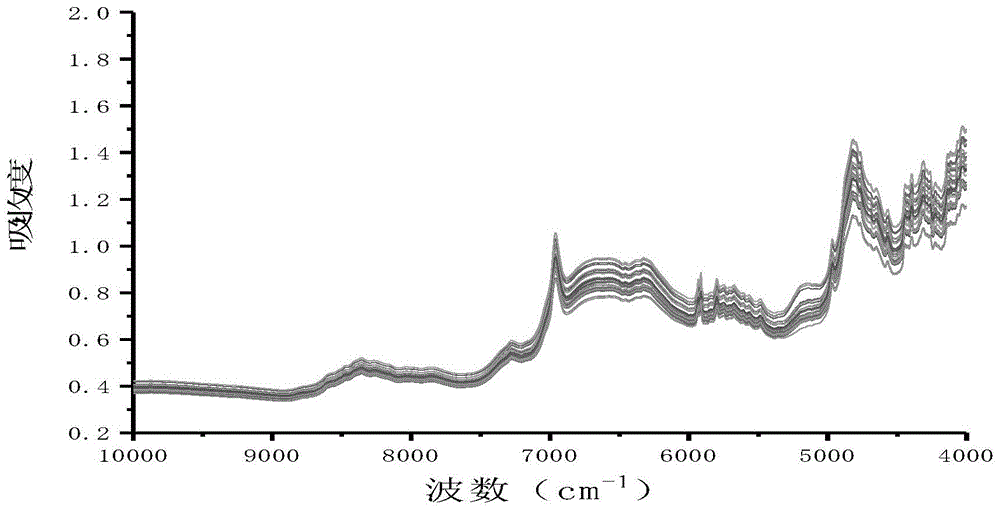
:目前的药物颗粒剂采用的是批生产模式。2010版gmp规定“批”为经一个或若干个加工过程生产的、具有预期均一质量和特性的、一定数量的原辅料、包装材料或成品。口服或外用的固体、半固体制剂在成型或分装前使用同一台混合设备一次混合所生产的均质产品也为一批。药物颗粒的湿法制备过程包括制软材、制粒、干燥、整粒等步骤。其中整粒步骤中一般为多个子批经混合设备混合均匀,经检验合格后分装得成品。现在普遍的制软材混合设备一般为每批2000kg,根据制软材混合设备大小小批量生产、直接整粒分装的缺点为批量小,批次多,需要增加大量的检验成本。大批量的生产则需要多个子批经整粒后的混合设备混合均匀经检验合格后分装,其缺点是:1.需要大空间存放颗粒中间体的中转场所;2.增加均匀混合工序,混合工序还造成生产的中断,而降低生产效率。近红外光是介于紫外-可见光和中红外光之间的电磁波,其波长范围为700~2500nm(14286~4000cm-1),又分为短波(700~1100nm)和长波(1100~2500nm)近红外2个区域。近红外光谱(nearinfraredspectrum,nirs)主要是由于分子振动的非谐振性使分子振动从基态向高能级跃迁时产生的,主要反映的是含氢基团x-h(c-h、n-h、o-h等)振动的倍频和合频吸收,该谱区信号容易提取,信息量相对较丰富,绝大多数的物质在近红外区都有响应。近红外光谱分析技术是指利用近红外光谱区包含的物质信息,主要用于有机物质定性和定量分析的一种分析技术。现有技术有一些运用近红外光谱方法检测颗粒含量的方法,比如中国专利申请cn105572071a公开了一种利用近红外光谱法快速检测感冒灵颗粒的提取液的方法及应用,先扫描和采集已知含量的中药颗粒的提取液的近红外光谱,采用偏最小二乘法建立近红外光谱与标准含量之间的定量校准模型;然后扫描和采集待测样品的近红外光谱,并将特征波段下的光谱信息导入上述的定量校准模型中,求出待测样品中的中药含量值。然而该方法并未解决批次粒度均一性和含量均一性是否合格的问题。技术实现要素:为了解决药物颗粒剂批次内、批次间粒度均一性和含量均一性是否合格的问题,本发明的目的在于提供一种药物颗粒剂的近红外质量监控方法。本发明的目的通过下述技术方案实现:药物颗粒剂的近红外质量监控方法,包括以下步骤:(1)扫描、采集待测颗粒剂的近红外光谱图,扫描光谱范围为10000~4000cm-1;测定待测颗粒剂中的指标成分含量;所述测定待测颗粒剂中的指标成分含量,优选采用hplc方法,结果更准确;所述近红外光谱图的扫描、采集优选在15~30℃下进行;所述近红外光谱图的扫描、采集,光源为卤钨灯,检测器为ingaas检测器,分辨率为8cm-1;(2)以偏最小二乘法对得到的颗粒剂近红外光谱信息分别和测得的指标成分含量的真实值进行关联建立校正模型,得出颗粒剂在近红外范围内的特征波段和拟合方程;(3)对所采集的颗粒剂的近红外光谱进行马氏距离计算,得到离群阈值,进行离群判定,判断颗粒剂的粒度均一性是否符合要求;(4)首先,根据各批次颗粒剂的原始近红外光谱和步骤(2)建立的校正模型,计算判断各批次颗粒剂的指标成分含量是否符合质控标准;若符合才到下一步;第二,第n批次颗粒剂的指标成分含量预测值与第(n+1)批次的预测值进行计算rsd值,若第n批次预测值与第(n+1)批次预测值rsd≤5.0%,判断其符合质量均一性;若第n批次预测值与第(n+1)批次预测值rsd>5.0%,判断质量均一性不符合要求,需要再次混合使其质量均一性达到要求;本发明所述的药物颗粒剂包括中药颗粒剂和化学药颗粒剂;所述的中药颗粒剂譬如实施例涉及的清开灵颗粒(其指标成分为栀子苷);所述的化学药颗粒剂譬如实施例涉及的对乙酰氨基酚颗粒。本发明相对于现有技术具有如下的优点及效果:1、药物颗粒剂以前主要是靠生产工人的经验对生产产品进行质量监控,本发明在线监控颗粒剂的生产质量,提高生产的智能化,缩短生产工人的培训时间。2、本发明方法使用近红外在线质量控制系统为绿色无污染的检测,可以减少化验室检验的频次,起到保护环境的作用。3、本发明方法在整粒阶段对生产的药物颗粒进行质量均一性评估,可以减少下一步混合均匀的工序,加快生产节奏,提高生产效率,降低生产成本,同时可以减少中间体转运的储存空间,提高生产场地的利用效率。附图说明图1是清开灵颗粒的近红外光谱图。图2是sec和secv变化趋势图。图3是预测值与真实值比较图。图4是对乙酰氨基酚颗粒的近红外光谱图。图5是sec和secv变化趋势图。图6是预测值与真实值比较图。具体实施方式下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。实施例1清开灵颗粒的近红外质量监控方法,包括以下步骤:①清开灵颗粒采集原始近红外光谱近红外光谱采集条件:在室温15~30℃下,利用浙江聚光科技在线近红外分析系统-4692型进行数据采集;具体操作条件为:光源为卤钨灯,检测器为ingaas检测器;其中,分辨率为8cm-1,扫描次数为32次,扫描光谱范围为10000~4000cm-1。按照上述条件扫描所得的清开灵颗粒近红外光谱图见图1。②清开灵颗粒的指标成分含量测定采用hplc方法测定清开灵颗粒中栀子苷的含量,表1为栀子苷的含量表:表1清开灵颗粒中栀子苷的含量表批号栀子苷mg/g批号栀子苷mg/g170610-60.40170610-250.37170610-70.38170610-260.37170610-80.39170610-270.37170610-90.38170610-280.38170610-100.39170610-290.37170610-110.39170610-300.37170610-120.38170610-310.37170610-130.40170610-320.37170610-140.40170610-330.40170610-150.38170610-340.37170610-160.38170610-350.39170610-170.38170610-360.37170610-180.37170610-370.38170610-190.37170610-380.39170610-200.39170610-390.39170610-210.37170610-400.39170610-220.37170610-410.39170610-230.39170610-420.38170610-240.39170610-430.38③校正模型的建立及检验对步骤①所采集的原始光谱数据进行预处理,预处理方法为以下的一种:无谱图预处理(raw)、卷积平滑(savitzky-golaysmoothing,sg)、一阶卷积求导(firstderivativeconvolution,1stdc)、二阶卷积求导(secondderivativeconvolution,2nddc)、多元散色校正(multiplicativescattercorrection,msc)、标准正态变量变换(standardnormalvariatetransformation,snv)、归一化法(normalize,n);得到清开灵颗粒指标成分含量的特征光谱信息;以偏最小二乘法对得到的清开灵颗粒指标成分含量特征光谱信息分别和步骤②所测得的指标成分含量的真实值进行关联建立校正模型,并采用决定系数(thecoefficientofdetermination,r2)、交叉检验的校正标准偏差(standarderrorofcrossvalidation,secv)、校正标准偏差(standarderrorofcalibration,sec)和主因子数(latentvariables,lv)来评价模型的预测性能。其中,决定系数越接近1,校正均方差越小,则校正值与近红外预测值相关性越好。通过sec和secv的比较(图2)、预测值与真实值的比较(图3),得到最优建模的条件为:谱图的处理方式为谱图无处理,波长的选择为5195~6387cm-1、8782~9962cm-1,拟合方程为:y=0.9907x+0.0026、相关系数r为0.9907。④利用新建预测模型对清开灵颗粒质量均一性进行评价1、对所采集的189份清开灵颗粒的近红外光谱进行马氏距离计算(采用thunirv3.0化学计量学软件计算),得到离群阈值为7.995,进行离群判定,判断颗粒剂的粒度均一性是否符合要求。结果如图2所示,各批清开灵颗粒的粒度均一性均符合要求。表2近红外光谱的一致性评价表2、清开灵颗粒质量均一性判定首先,根据各批次清开灵颗粒的原始近红外光谱和步骤(2)建立的校正模型,计算判断各批次清开灵颗粒的指标成分含量是否符合质控标准(栀子苷含量0.1mg/g以上);若符合才到下一步;第二,第n批次清开灵颗粒的指标成分含量预测值与第(n+1)批次的预测值进行计算rsd值,若第n批次预测值与第(n+1)批次预测值rsd≤5.0%,判断其符合质量均一性;若第n批次预测值与第(n+1)批次预测值rsd>5.0%,判断质量均一性不符合要求,需要再次混合使其质量均一性达到要求。结果如表3所示:表3清开灵颗粒质量均一性判断根据表3数据,第n个预测值与第(n+1)个预测值rsd≤5.0%,判断清开灵颗粒质量均一性符合要求,直接进行分装包装,得成品。实施例2对乙酰氨基酚颗粒的近红外质量监控方法,包括以下步骤:①对乙酰氨基酚颗粒采集原始近红外光谱近红外光谱采集条件:在室温15~30℃下,利用浙江聚光科技在线近红外分析系统-4692型进行数据采集;具体操作条件为:光源为卤钨灯,检测器为ingaas检测器;其中,分辨率为8cm-1,扫描次数为32次,扫描光谱范围为10000~4000cm-1。按照上述条件扫描所得的对乙酰氨基酚颗粒近红外光谱图见图4。②对乙酰氨基酚颗粒的指标成分含量测定采用hplc方法测定对乙酰氨基酚颗粒中对乙酰氨基酚的含量,表4为对乙酰氨基酚的含量表:表4对乙酰氨基酚含量表批号对乙酰氨基酚(mg/g)批号对乙酰氨基酚(mg/g)170307-121.11170308-120.12170307-221.16170308-221.09170307-321.31170308-321.00170307-420.89170308-420.86170307-520.71170308-520.05170307-621.42170308-621.15170307-721.28170308-721.05170307-820.91170308-820.23170307-921.29170308-919.10170307-1021.13170308-1019.98170307-1120.15170308-1121.11170307-1220.27170308-1220.99170307-1320.06170308-1319.87170307-1620.27170308-1421.03170307-1720.49170308-1520.42170307-1820.40170308-1620.15170307-1920.28170308-1720.04170307-2020.24170308-1820.92170307-2120.30170308-1920.13③校正模型的建立及检验利用实施例1中相同的建模方法(包括图5和图6),得到最优建模的条件为:谱图的处理方式为多元散射校正,波长的选择为4000~5191cm-1、6391~7583cm-1,拟合方程为:y=0.9925x+0.0021、相关系数r为0.9925。④利用新建预测模型对对乙酰氨基酚颗粒质量均一性进行评价1、对所采集的100份对乙酰氨基酚颗粒的近红外光谱进行马氏距离计算(采用thunirv3.0化学计量学软件计算),得到离群阈值为8.473,进行离群判定,判断颗粒剂的粒度均一性是否符合要求。结果如表5所示,各批对乙酰氨基酚颗粒的粒度均一性均符合要求。表5近红外光谱的一致性评价表2、对乙酰氨基酚颗粒质量均一性判定首先,根据各批次对乙酰氨基酚颗粒的原始近红外光谱和步骤(2)建立的校正模型,计算判断各批次对乙酰氨基酚颗粒的指标成分含量是否符合质控标准(对乙酰氨基酚含量在18.0-22.0mg/g);若符合才到下一步;第二,第n批次对乙酰氨基酚颗粒的指标成分含量预测值与第(n+1)批次的预测值进行计算rsd值,若第n批次预测值与第(n+1)批次预测值rsd≤5.0%,判断其符合质量均一性;若第n批次预测值与第(n+1)批次预测值rsd>5.0%,判断质量均一性不符合要求,需要再次混合使其质量均一性达到要求。结果如表6所示:表6对乙酰氨基酚颗粒质量均一性判断根据上表数据,第n个预测值与第(n+1)个预测值rsd≤5.0%,判断对乙酰氨基酚颗粒质量均一性符合要求,直接进行分装包装,得成品。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1