一种组织中泰乐菌素残留的检测方法与流程
本发明属于兽药残留检测领域,具体涉及各种组织中泰乐菌素残留的检测方法。
背景技术:
在我国,畜禽养殖业是非常发达的行业,也是我国的基础行业。随着畜禽养殖业的发展,各种药物的使用也越来越频繁,特别是抗生素的使用,更是涉及到生产各个部分。抗生素不仅能够促进动物生长,还可以防病治病,这使得抗生素使用量随之增加。但是随着抗生素使用的越来越多,产生的抗生素滥用问题也就越来越严重,这也是当下亟待解决的问题。抗生素经过口服、注射等方式进入动物体内,然后经过肠道等的吸收,血液将抗生素带到全身或是靶部位,最后通过肝脏、肾脏、胰腺等代谢出体外。在整个过程中,泰乐菌素在动物体内能够起到不同的作用。但是,抗生素在动物体内的过程可能出现残留,这是对人类或环境都是有非常大的危害的。抗生素残留在动物体内,当作用于动物体内的病菌时,如果未达到杀死细菌的的最低浓度,很可能是细菌出现突变而产生更严重的耐药性;如果人类食用了有抗生素残留的动物制品,会积累抗生素对人体的伤害,很多抗生素对人体都是有很大的副作用的,也会有产生耐药基因的可能;再则抗生素在进入环境后,对水中或是土壤中的微生物也会产生影响,破坏生态环境。
泰乐菌素(tylosin),亦称泰农、泰乐霉素,是美国于1959年从弗氏链霉菌的培养液中获得的一种大环内酯类抗生素。酒石酸泰乐菌素分子式为2(c46h77no17)·c4h6o6,分子量为1982.31,为白色或淡黄色粉末,易溶于水。因其肠道吸收好,体内扩散快,血药浓度高,在临床上多用于治疗药物使用。其临床应用方法较多,如片剂口服、粉剂饮水、肌肉注射、皮下注射、混饲给药、喷雾药浴等。泰乐菌素是一类动物专用抗生素,目前已经广泛的用于我国的畜禽生产行业,也是国际上使用最多的兽用抗生素之一。泰乐菌素的使用,不仅能够作为饲料添加剂促进动物的生长,更可以用来防治动物各种病原菌的感染,提高生产性能。据国家农业部统计,目前国际市场对泰乐菌素的年需求量在15000吨左右,我国的需求量在200吨左右。如此大量的使用在动物身上,既是对我国畜禽业的方法有很大的帮助,但也会带来很多的问题。
由于泰乐菌素在畜禽生产中的大量使用,泰乐菌素在动物体内的残留也成为动物食品安全的很大问题。为了能够减少动物组织中的泰乐菌素残留、提防细菌耐药性的出现、保障人类生活食品的安全,必须建立起检测动物组织中泰乐菌素残留的检测方法。
技术实现要素:
本发明的目的是提供一种组织中泰乐菌素残留的检测方法,以解决上述现有技术存在的问题,以提高检测效率、降低检测限、简化检测程序。
本发明提供一种组织中泰乐菌素残留的检测方法,包括以下步骤:
步骤1、制备供试品样品:
(1)将称量好的组织用淋洗溶剂淋洗,匀浆,提取,涡旋,超声,离心处理,得到上清液;
(2)重复上述提取步骤一次,第二次离心处理,合并两次上清液;
(3)在步骤(2)得到的上清液中加入蛋白沉淀剂,涡旋,离心,取上清液,蒸干,得到残渣;
(4)用有机溶剂溶解步骤(3)中的残渣两次,合并两次溶解液;
(5)hlb固相萃取小柱净化;
(6)氮气吹干洗脱液,加流动相溶解残渣,过滤溶解液,经hplc检测滤液,制成供试品样品;
步骤2、绘制标准曲线
取泰乐菌素标准储备液,用流动相依次稀释成10ppm、5ppm、2ppm、1ppm、0.5ppm、0.2ppm和0.1ppm的标准工作品溶液,用hplc检测,每种浓度每天重复测定5次,重复操作5天,将所得峰面积均值与对应浓度作线性回归,绘制标准曲线并得到线性回归方程和相关系数;
步骤3、测定
吸取上述标准工作品溶液和供试品样品进行检测,根据外标法计算泰乐菌素残留量;采用高效液相色谱仪对组织中残留的泰乐菌素进行检测。
优选地,所述的一种组织中泰乐菌素残留的检测方法,包括以下步骤:
步骤1、制备供试品样品:
(1)用淋洗溶剂将组织淋洗干净,5000r/min匀浆5min,然后将组织置于50ml离心管中,加入提取剂,涡旋5~6min,超声10min,4℃,4000r/min离心10min,取上清液于另一离心管中;
(2)重复提取步骤一次,第二次10000r/min离心,合并两次上清液;
(3)将步骤(2)得到的上清中液加入0.5ml蛋白沉淀剂,涡旋2min,4℃,10000r/min离心10min,取上清液于旋转蒸发瓶中,置于旋转蒸发仪上蒸干,得到残渣;
(4)用有机溶剂溶解步骤(3)中的残渣两次,合并两次溶解液;
(5)hlb固相萃取小柱净化,hlb小柱净化过程如下:hlb柱先依次用3ml甲醇、3ml水活化,将上述溶解液倾倒至hlb柱中,控制流速小于3ml/min,用3ml5%氨水、3ml水先后淋洗,抽干,6ml乙腈洗脱,收集洗脱液;
(6)置45℃氮气吹干,加流动相1ml溶解残渣,溶解液过0.22μm有机滤膜,滤液经hplc检测;
步骤2、绘制标准曲线
取泰乐菌素标准储备液,用流动相依次稀释成10ppm、5ppm、2ppm、1ppm、0.5ppm、0.2ppm和0.1ppm的标准工作品溶液,用hplc检测,每种浓度每天重复测定5次,重复操作5天,将所得峰面积均值与对应浓度作线性回归,绘制标准曲线并得到线性回归方程和相关系数;
步骤3、测定
吸取上述标准工作品溶液和供试品样品进行检测,根据外标法计算泰乐菌素残留量;采用高效液相色谱仪对组织中残留的泰乐菌素进行检测。
优选地,所述淋洗溶剂为3ml质量分数5%氨水、3ml水。
优选地,所述提取剂为乙腈。
优选地,所述组织与提取剂的料液比为1:4。
优选地,所述流动相为0.1m的甲酸铵-乙腈。
优选地,所述蛋白沉淀剂为体积分数为10%的乙酸锌溶液。
优选地,步骤(4)中所述有机溶剂为体积分数为2%偏磷酸和体积分数为20%的甲醇水溶液。
优选地,所述hplc检测条件为波长282nm,进样40μl,柱温30℃,流速1ml/min。
优选地,步骤3中高效液相色谱仪的洗脱梯度为0min(a70:b30)-8min(a70:b30)-15min(a0:b100)-15.1min(a70:b30)-20min(a70:b30)。
本发明的有益效果:
本发明研究并建立了组织中泰乐菌素残留的固相萃取-高效液相色谱检测方法,通过本发明方法可以有效地从组织中提取泰乐菌素,尽最大可能降低组织中其他杂质的影响,从而提高检测的准确度。
本发明所述检测方法采用乙腈作为提取剂,因为泰乐菌素易溶于乙腈等有机溶解,乙腈不但能够充分溶解泰乐菌素,而且具有较强的去除蛋白质、组织渗透能力和脱脂作用,可以有效去除提取液中的脂肪,一方面可以降低样品基质对分析测定的干扰,另一方面避免脂类物质污染色谱柱和仪器。然后再用10%的乙酸锌溶液沉淀蛋白,除去蛋白杂质,降低蛋白在检测中的干扰。泰乐菌素为弱碱性化合物,第二次溶解采用弱酸溶液2%偏磷酸20%甲醇水能够充分的溶解泰乐菌素,除去脂肪等其他杂质。hlb固相萃取柱的吸附剂主要以反相保留机理为主,对极性物质的保留提供很好的水浸润性,在固相萃取中能够很好的保留泰乐菌素。淋洗先采用5%的氨水,然后用纯水洗去氨水,最后用纯乙腈洗脱,除去其他杂质,排除检测干扰。
本检测方法采用0.1m甲酸铵-乙腈作为流动相进行梯度洗脱,通过优化流动相比例和洗脱梯度时间,排除了其他杂质的干扰,保证了泰乐菌素药峰的独立与响应,做到无杂峰干扰药峰,出峰时间良好,能够很好地重现试验方法,准确度高,专属性强。
本发明经试验研究,建立了检测动物组织中泰乐菌素残留的检测方法,该方法经过验证具有较好的重复性和使用性,为我国动物中抗生素的残留检测、动物食品的安全、降低细菌耐药性产生的可能性与实验研究提供依据。
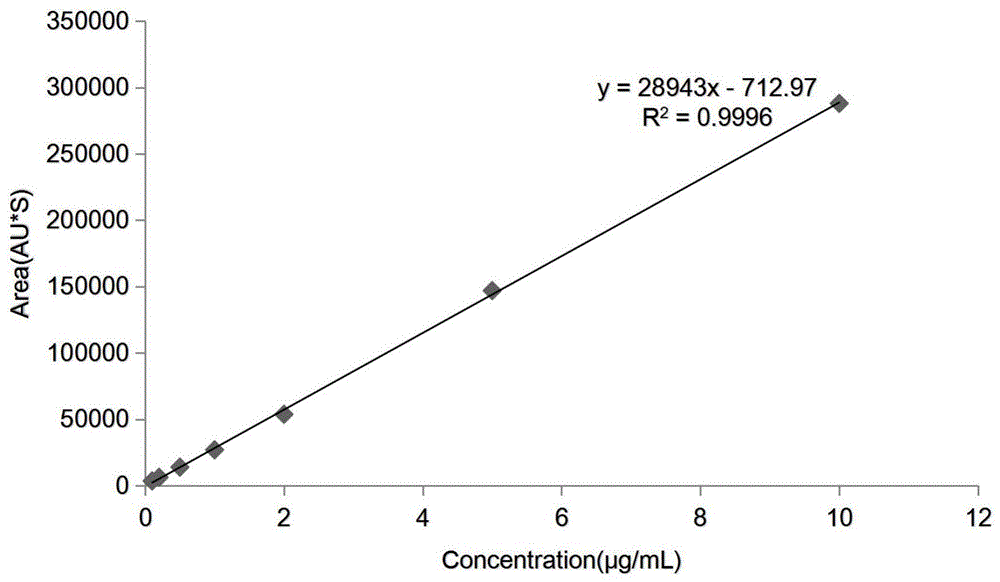
本发明泰乐菌素标准品在0.1-10μg/ml浓度范围内线性关系良好,标准曲线如图1所示,回归方程为y=28943x-712.97,相关系数r2=0.9996;鸡血浆中泰乐菌素药物在0.1-10μg/ml药物浓度范围内表现线性良好,工作曲线如图2所示,回归方程为y=28145x-791.28,相关系数r2=0.9998;鸡肺组织中泰乐菌素药物在0.1-10μg/ml浓度范围内线性关系良好,工作曲线如图3所示,回归方程为y=27516x-817.12,相关系数r2=0.9998。
泰乐菌素在鸡血浆中的检测限和定量限分别为0.018μg/ml和0.060μg/ml,在鸡肺组织中的检测限和定量限分别为0.018μg/ml和0.061μg/ml。当血浆中添加泰乐菌素浓度为0.05μg/ml、0.2μg/ml、1μg/ml时,泰乐菌素血浆回收率在90.57%-94.25%之间,日间变异系数在0.90%-2.55%之间;当肺组织中添加泰乐菌素浓度为0.05μg/ml、0.2μg/ml、1μg/ml时,泰乐菌素肺组织回收率在85.37%-92.43%之间,日间变异系数在1.85%-2.98%之间。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为泰乐菌素标准曲线;
图2为鸡血浆中泰乐菌素工作曲线;
图3为鸡肺组织中泰乐菌素工作曲线;
图4为鸡血浆中无泰乐菌素的色谱图;
图5为鸡血浆中有无泰乐菌素的色谱图;
图6为鸡肺组织中无泰乐菌素的对比色谱图;
图7为鸡肺组织中有无泰乐菌素的对比色谱图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明所述外标法为本领域技术人员可实施的方式,并非本发明要点,在此不作赘述。
实施例1
1.供试品样品的制备:
取适量泰乐菌素标准储备液,0.1m甲酸铵-乙腈混合溶液(甲酸铵与乙腈的体积比为70:30)依次稀释成10ppm、5ppm、2ppm、1ppm、0.5ppm、0.2ppm和0.1ppm的标准工作液,用hplc检测,检测波长为282nm,进样40μl,柱温:30℃,流速1ml/min;
2.标准曲线绘制:取适量泰乐菌素标准储备液,用流动相依次稀释成10ppm、5ppm、2ppm、1ppm、0.5ppm、0.2ppm和0.1ppm的标准工作液,用hplc检测,检测波长为282nm,进样40μl,柱温30℃,流速1ml/min,每种浓度每天重复测定5次,重复操作5天,将所得峰面积均值与对应浓度作线性回归,绘制标准曲线并得到线性回归方程和相关系数;
3.测定:吸取上述标准工作品溶液和供试品样品进行检测,根据外标法计算泰乐菌素残留量;采用高效液相色谱仪对组织中残留的泰乐菌素进行检测;
色谱条件:色谱柱agilentsb-aq,250×4.6mm(i.d.),5μm;采用0.1m的甲酸铵作为流动相a,乙腈作为流动相b,检测波长为282nm,进样40μl,柱温:30℃,流速1ml/min,洗脱梯度为0min(a70:b30)-8min(a70:b30)-15min(a0:b100)-15.1min(a70:b30)-20min(a70:b30),泰乐菌素在13.800分钟左右出现峰高。
实施例2
1.供试品样品的制备:
鸡血浆样品处理方法:取0.5ml鸡血浆,加入2ml乙腈,涡旋三分钟,然后10000r/min离心3min,取上清液,向沉淀物中加入1ml乙腈,重复提取过程,取上清液,合并上清液,氮气吹干,0.5ml流动相复溶,过0.22μl的滤膜,进行液相检测;
2.血浆工作曲线的建立:取适量泰乐菌素标准储备液,用流动相依次稀释成10ppm、5ppm、2ppm、1ppm、0.5ppm、0.2ppm和0.1ppm的标准工作液。取0.5ml血浆,加入适宜浓度的标准溶液,使各样品中药物浓度达到10ppm、5ppm、2ppm、1ppm、0.5ppm、0.2ppm和0.1ppm,按照样品前处理方法进行处理,hplc检测,检测波长为282nm,进样40μl,柱温30℃,流速1ml/min。将所得峰面积均值与对应浓度作线性回归,计算血浆中工作曲线的回归方程和相关系数。
3.测定:吸取上述标准工作品溶液和供试品样品进行检测,根据外标法计算泰乐菌素残留量;采用高效液相色谱仪对组织中残留的泰乐菌素进行检测;
色谱条件:色谱柱agilentsb-aq,250×4.6mm(i.d.),5μm;采用0.1m的甲酸铵作为流动相a,乙腈作为流动相b,检测波长为282nm,进样40μl,柱温:30℃,流速1ml/min,洗脱梯度为0min(a70:b30)-8min(a70:b30)-15min(a0:b100)-15.1min(a70:b30)-20min(a70:b30),泰乐菌素在13.800分钟左右出现峰高。
实施例3
1.供试品样品的制备:
(1)准确称取匀浆制备的鸡肺1.0g于50ml离心管中,加入4ml乙腈溶液,涡旋5~6min,超声10min,4℃,4000r/min离心10min,取上清液于另一离心管中;
(2)重复提取步骤一次,第二次10000r/min离心,合并两次上清液;
(3)上清液中加入10%乙酸锌溶液0.5ml沉淀蛋白,涡旋2min,4℃,10000r/min离心10min,取上清液于旋转蒸发瓶中,置于旋转蒸发仪上蒸干;
(4)用2%偏磷酸20%甲醇2ml溶解残渣两次,合并两次溶解液;
(5)hlb固相萃取小柱净化,hlb小柱净化过程如下:hlb柱依次用3ml甲醇、3ml水活化,将上述溶解液倾倒至hlb柱中,控制流速小于3ml/min,用3ml5%氨水、3ml水先后淋洗,抽干,6ml乙腈洗脱,收集洗脱液;
(6)置45℃氮气吹干,加流动相0.1m甲酸铵-乙腈混合溶液(甲酸铵与乙腈的体积比为70:30)溶解残渣,溶解液过0.22μm有机滤膜,滤液经hplc检测,检测波长为282nm,进样40μl,柱温:30℃,流速1ml/min;
2.鸡肺组织工作曲线的建立:取适量泰乐菌素标准储备液,用流动相依次稀释成10ppm、5ppm、2ppm、1ppm、0.5ppm、0.2ppm和0.1ppm的标准工作液,取1g肺组织,加入适宜浓度的标准溶液,使各样品中药物浓度达到10ppm、5ppm、2ppm、1ppm、0.5ppm、0.2ppm和0.1ppm,按照样品前处理方法进行处理,hplc检测,检测波长为282nm,进样40μl,柱温30℃,流速1ml/min。将所得峰面积均值与对应浓度作线性回归,计算鸡肺组织中工作曲线的回归方程和相关系数;
3.测定:吸取上述标准工作品溶液和供试品样品进行检测,根据外标法计算泰乐菌素残留量;采用高效液相色谱仪对组织中残留的泰乐菌素进行检测;
色谱条件:色谱柱agilentsb-aq,250×4.6mm(i.d.),5μm;采用0.1m的甲酸铵作为流动相a,乙腈作为流动相b,检测波长为282nm,进样40μl,柱温:30℃,流速1ml/min,洗脱梯度为0min(a70:b30)-8min(a70:b30)-15min(a0:b100)-15.1min(a70:b30)-20min(a70:b30),泰乐菌素在13.800分钟左右出现峰高。
方法验证:
在空白血浆和肺组织灌洗液中加入一系列较低浓度的泰乐菌素,使血浆和肺组织中的泰乐菌素浓度分别为1μg/ml、0.5μg/ml、0.1μg/ml、0.08μg/ml、0.05μg/ml、0.04μg/ml、0.03μg/ml,按照样品前处理方法处理后进行hplc检测。每个浓度样品5个平行,重复测定5d,取25次测定结果均值s和n,以达到s/n大于等于3时样品的最低浓度为该方法的lod,以达到s/n大于等于10时样品的最低浓度确定为该方法的lod。
泰乐菌素在鸡血浆中的检测限和定量限分别为0.018μg/ml和0.060μg/ml,在肺组织中的检测限和定量限分别为0.018μg/ml和0.061μg/ml。当血浆中添加泰乐菌素浓度为0.05μg/ml、0.2μg/ml、1μg/ml时,泰乐菌素血浆回收率在90.57%-94.25%之间,日间变异系数在0.90%-2.55%之间;当肺组织中添加泰乐菌素浓度为0.05μg/ml、0.2μg/ml、1μg/ml时,泰乐菌素肺组织回收率在85.37%-92.43%之间,日间变异系数在1.85%-2.98%之间。
验证结果表明:
1.泰乐菌素标准品在0.1-10μg/ml浓度范围内线性关系良好,标准曲线如图1所示,回归方程为y=28943x-712.97,相关系数r2=0.9996;
2.鸡血浆中泰乐菌素药物在0.1-10μg/ml药物浓度范围内表现线性良好,工作曲线如图2所示,回归方程为y=28145x-791.28,相关系数r2=0.9998;
3.鸡肺组织中泰乐菌素药物在0.1-10μg/ml浓度范围内线性关系良好,工作曲线如图3所示,回归方程为y=27516x-817.12,相关系数r2=0.9998。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!