锌离子检测方法及锌离子检测用发光纳米探针的制备方法与流程
本发明涉及一种锌离子检测方法及锌离子检测用发光纳米探针的制备方法,属于发光检测技术领域。
背景技术:
众所周知,锌(zn)是生物体必需的微量元素之一,广泛参与生命活动的各个方面,如生长发育、生殖遗传、免疫、内分泌等。美国国家科学研究委员会制定了锌摄入量膳食指南,其原因是人体在缺乏zn的情况下容易导致免疫力低下,伤口难以愈合以及生长发育缓慢。研究表明,随着年龄增长,大脑的认知功能会逐渐下降,这可能与细胞中的zn含量有关,即zn可以调节大脑突触传递,在保护大脑正常运行方面扮演重要角色。食品是人们除其他营养品、药品以外最直接最安全最天然的摄入锌的方式,日常饮食中经常食用富含锌的食物基本就能满足自身需要。因此,建立一种灵敏、快速、简便、准确的测定锌的方法具有重要意义。
检测zn的方法有很多,如高效液相色谱法、气相色谱法、毛细管电泳法、紫外分光光度法、原子吸收光谱法、电感耦合等离子体原子发射光谱法、电化学检测等。这些方法或仪器昂贵,或前处理繁琐,不适合实现快速检测。
技术实现要素:
为解决上述现有技术的不足,本发明提供一种锌离子检测用发光纳米探针的制备方法。该探针对zn2+实行高灵敏度和高选择性的响应检测。
本发明提供一种锌离子检测用发光纳米探针的制备方法,步骤包括:
(1)将羟乙基脱乙酰壳多糖与超纯水进行水浴反应,至羟乙基脱乙酰壳多糖完全溶解,得羟乙基脱乙酰壳多糖纳米凝胶储备液,放置冷却至室温;将冷却后的羟乙基脱乙酰壳多糖纳米凝胶储备液用超纯水稀释成0.5-2.0mg/ml的羟乙基脱乙酰壳多糖纳米凝胶溶液;
(2)将步骤(1)得到的羟乙基脱乙酰壳多糖纳米凝胶溶液与半胱氨酸超声混合至溶解,再加入cuso4·5h2o溶液,温和搅拌30min,得到锌离子检测用发光纳米探针cuncs@gc溶液。
进一步的,步骤(1)中所述羟乙基脱乙酰壳多糖和超纯水的比例为(10-25)mg:(1-10)ml。
进一步的,步骤(2)中所述羟乙基脱乙酰壳多糖纳米凝胶溶液、半胱氨酸以及cuso4·5h2o溶液的比例为(2.5-4.5)ml:(0.0121-0.0605)g:(0.5–2.5)ml。
本发明还提供一种锌离子检测方法,步骤包括:向一定体积的ph值为7.4的如上述的cuncs@gc溶液中加入相同体积不同浓度的zn2+溶液,再用超纯水稀释后进行锌离子含量检测。
进一步的,步骤包括:(1)取至少五种不同浓度的200μl的zn2+标准溶液,随即加入到体积为400μl、ph为7.4的cuncs@gc溶液中,最后用超纯水稀释至体积为1ml,充分混合均匀反应5min后,以固定激发波长为387nm进行光致发光发射光谱的测定,并记录在该激发波长下加入不同浓度zn2+后cuncs@gc溶液的发射强度光谱图;(2)向400μlcuncs@gc溶液中分别加入上述未加标和不同加标量的样液200μl,最后由超纯水稀释至1ml,在387nm激发波长下测定荧光强度;最后经线性方程计算锌含量以及回收率。
进一步的,用于食品中锌离子的检测,步骤包括:(1)使用微波消解对牛奶、啤酒或茶叶进行前处理,得到样液;(2)所述样液按照未加标、加标0.05mm、加标0.15mm、加标0.45mm进行锌含量的测定,具体为:向cuncs@gc溶液中分别加入未加标和不同加标量的样液200μl,最后由超纯水稀释至1ml,在387nm激发波长下测定荧光强度;最后经线性方程计算锌含量以及回收率。
有益效果:
本发明为无标记型发光纳米探针,可直接对zn2+实行高灵敏度和高选择性的响应检测。本发明所制备的发光纳米探针对zn2+具有快速响应的特征,且检出限低,线性范围较宽,灵敏度和选择性高,生物相容性优良。基于zn2+引发gc纳米凝胶包裹的cuncs产生聚集诱导发光(aie)效应从而构建的新型“发光”检测模式的纳米探针制备简单快速、低毒无污染,在与zn2+相关的饮用水安全和食品分析领域具有潜在的应用前景。
附图说明
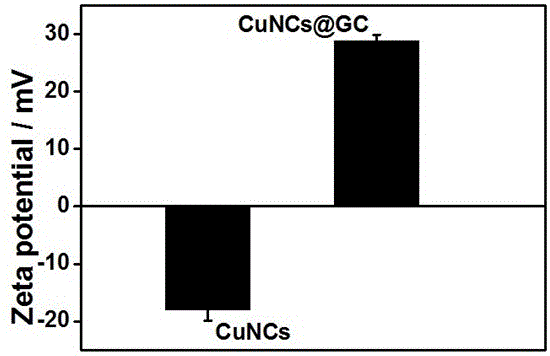
图1为实施例1的cuncs@gc和对比例1的cuncs在ph为7.4时的zeta电位图。
图2为实施例1中加入不同浓度zn2+之后测得cuncs@gc的zeta电位变化图。
图3为本发明实施例1、对比例1-4的产物的透射电镜图(tem);
其中图3a为对比例1的产物的cuncs的透射电镜图;
图3b为对比例2的产物的cuncs@gc(0.5mg/ml)的透射电镜图;
图3c为实施例1的产物的cuncs@gc(1.0mg/ml)的透射电镜图;
图3d为对比例3的产物的cuncs@gc(1.5mg/ml)的透射电镜图;
图3e为对比例4的产物的cuncs@gc(2.0mg/ml)的透射电镜图。
图4为本发明实施例1的cuncs@gc以及cu2p电子的x射线光电子能谱图(xps)。
图5为本发明对比例1(a),实施例1(b)的荧光强度谱图。
图6为不同浓度的gc纳米凝胶复合cuncs后的荧光强度谱图。
图7为本发明的cuncs@gc的合成步骤以及zn2+的检测原理。
图8为纳米探针在加入30μm的zn2+后的荧光强度差值对比加入常见金属离子后的荧光强度差值。
图9为纳米探针在加入30μm的zn2+后的荧光强度差值对比加入氨基酸类后的荧光强度差值。
图10为纳米探针在加入30μm的zn2+后的荧光强度差值对比加入其他生物物质后的荧光强度差值。
图11为对实施例2中的cuncs@gc溶液加入不同浓度zn2+后的荧光强度变化光谱图;其中
图11a为对实施例2中的cuncs@gc溶液加入浓度为0-750μm的zn2+标液的荧光强度变化光谱图。
图11b为荧光强度差值(i-i0)与不同浓度zn2+标液作图后所得分别在低浓度范围(1.5μm-100μm)和高浓度范围(100μm-750μm)内呈现的良好线性关系图(i0为cuncs@gc溶液的荧光强度,i为cuncs@gc溶液中加入不同浓度zn2+标液后的荧光强度)。
图12为基于cuncs@gc纳米复合材料的荧光探针用于检测a549活细胞中zn2+所得的共焦荧光图像。
具体实施方式
以下结合具体实施例来进一步解释本发明,但实施例对本发明不做任何形式的限定。
实施例1
一种锌离子检测用发光纳米探针的制备方法,步骤如下:
(1)羟乙基脱乙酰壳多糖(以下简称gc)纳米凝胶溶液的制备:准确称取50mg的gc倒于盛有10ml超纯水的离心管中,然后准备好温度在80℃左右的水浴锅,将gc溶液放入水浴锅20min,至gc完全溶解,即得浓度为5mg/ml的gc纳米凝胶储备液,放置冷却至室温。
将冷却后的gc纳米凝胶储备液用超纯水稀释成1.0mg/ml的gc纳米凝胶溶液。放置在4℃的环境中,供后续实验使用。
(2)cuncs@gc溶液的制备:使用移液枪移取4.5ml步骤(1)制备得到的gc纳米凝胶溶液于10ml的小烧杯,并编号1,然后准确称取0.0605g的半胱氨酸(以下简称cys)加入1号小烧杯中,超声5min至溶解,接着向1号烧杯中加入0.5ml的60mm的cuso4·5h2o溶液,随即混合溶液的颜色由澄清无色变为浅黄色透明溶液,最后温和搅拌30min,即合成了锌离子检测用发光纳米探针(cuncs@gc溶液)。合成的cuncs@gc溶液置于4℃的环境中存放,以供后续步骤使用。
将1号的cuncs@gc溶液倒入离心管中,在365nm紫外手提灯下照射,观察发光情况,然后再在387nm的激发波长下记录不同浓度gc纳米凝胶溶液复合的cuncs的荧光强度。
本发明所用的纳米凝胶类型为羟乙基脱乙酰基壳多糖。一方面,普通壳聚糖经过羟乙基脱乙酰基处理,能够在水中很好的溶解,不需要添加醋酸增加在水中的溶解度。另一方面,羟乙基脱乙酰基壳多糖与普通壳聚糖相比,其水溶液在1-14全ph范围内性质稳定,普通壳聚糖水溶液在ph=8以后会出现絮状沉淀,所以羟乙基脱乙酰基壳多糖复合的铜纳米团簇性质更优良、稳定性更好。
铜纳米团簇(cuncs)由于其制备成本低、合成简单快速、光学性能优良、低毒以及生物相容性好等优点,在纳米材料中可与金、银纳米团簇媲美,因而在发光领域备受关注。半胱氨酸(cys)的化学名称为2-氨基-3-巯基丙酸,其中巯基(-sh)很容易与cu形成强配位键cu-s键,因此可作为保护剂和还原剂来制备cuncs。羟乙基脱乙酰壳多糖(gc)纳米凝胶具有大的比表面积,良好的生物相容性,用gc纳米凝胶将cuncs包裹起来,可防止聚集的纳米团簇发生松散和结构僵化的现象,并显著提高了原本cuncs的发光强度。本发明结合cys修饰的cuncs、gc纳米凝胶的优点将两者复合,用cuncs@gc溶液作为发光纳米探针,并成功应用于食品中的锌检测以及生物活细胞中锌离子成像。
对比例1
一种锌离子检测用发光纳米探针的制备方法,首先配制好20mm的cuso4·5h2o溶液,在7个10ml的小烧杯中均用移液枪移取5ml配制的cuso4·5h2o溶液,并编号1-7,然后准确称0.0121g、0.0204g、0.0363g、0.0484g、0.0605g、0.0726g和0.0847g的半胱氨酸(cys),将称取好的cys依次倒入编号1-7的盛有cuso4·5h2o溶液的小烧杯中,超声5min至完全溶解,在这个过程中会观察到混合溶液由澄清透明变成灰褐色再变至浅黄色悬浮液,最后经温和搅拌30min,即得浓度为100mmcys保护的cuncs。将制备好的cuncs在365nm紫外手提灯下照射,观察发光情况,然后再在405nm的激发波长下记录不同浓度cys保护的cuncs的荧光强度。
图1的结果表明,对比例1中的单纯cuncs表面电荷为负电荷,在ph=7.4时的zeta电势为-17.8mv,而实施例1中的cuncs@gc表面电荷为正电荷,其在ph=7.4时的zeta电势为28.9mv,这是由于gc纳米凝胶中含有大量的胺基,所以被包裹后的cuncs的zeta电势为正值,且比单纯cuncs的zeta电势绝对值大,表明gc纳米凝胶包裹的cuncs结构更稳定,不易松散。
图2的结果表明,由加入不同浓度zn2+(0、10、100、150、250、500、750、1000μm)之后的zeta电势变化图可以看出,随着zn2+浓度的增加,cuncs@gc的zeta电势值也在增大,原因是zn2+可以与包裹在gc纳米凝胶中的cu-s复合物表面的羧酸根离子(coo-)反应,然后消耗掉了部分coo-后,cuncs@gc体系中存在更多的是电正电荷的胺基,因此,cuncs@gc体系的zeta电势随zn2+浓度增加呈现增大的趋势。
对比例2
一种锌离子检测用发光纳米探针的制备方法,步骤同实施例1。不同之处仅在于:将冷却后的gc纳米凝胶原液用超纯水稀释成0.5mg/ml的gc纳米凝胶溶液;制备得到2号的cuncs@gc。
对比例3
一种锌离子检测用发光纳米探针的制备方法,步骤同实施例1。不同之处仅在于:将冷却后的gc纳米凝胶原液用超纯水稀释成1.5mg/ml的gc纳米凝胶溶液;制备得到3号的cuncs@gc。
对比例4
一种锌离子检测用发光纳米探针的制备方法,步骤同实施例1。不同之处仅在于:将冷却后的gc纳米凝胶原液用超纯水稀释成2mg/ml的gc纳米凝胶溶液;制备得到4号的cuncs@gc。
图3为本发明实施例1、对比例1-4的产物的透射电镜图(tem)。
由图3a所示,所制备的cuncs基本呈圆球状,大小相似,不均匀的分布在水溶液中,表明由半胱氨酸作为保护剂和还原剂的cuncs成功合成;但是纳米团簇分布不均匀,会导致cuncs稳定性相对差。
图3b为cuncs@gc(0.5mg/ml)的tem图,从图中可以看出分散的纳米团簇分布相对均匀,但gc数量较少不足以完全将纳米团簇包裹束缚起来,只能对部分纳米团簇显示交叉链接效果。
图3c为cuncs@gc(1.0mg/ml)的tem图,图中所示的纳米团簇基本被gc包裹成团状,分布较为均匀,而且相对于纯cuncs,其荧光强度提升了约3倍。
图3d及3e为cuncs@gc(1.5mg/ml)和cuncs@gc(2.0mg/ml)的tem图,上述tem图清晰地显示了gc本身的严重聚集,进而导致cuncs@gc的荧光强度会低于cuncs@gc(1.0mg/ml)的荧光强度。
因此,适当数量的gc有利于得到一个组织良好的自组装结构。
图4为本发明所述的实施例1的cuncs@gc(1.0mg/ml)以及cu2p电子的x射线光电子能谱图(xps)。从cuncs@gc(1.0mg/ml)的xps可以看出,cuncs@gc中包含的元素有c、o、n、s、cu,这与cuncs的xps显示出的元素相一致,说明复合的gc并没有与cuncs发生化学反应而改变cuncs的原本结构,只是通过静电作用将cuncs包裹,增加其稳定性。通过cu2p电子的xps可以看出,在932.4ev和952.5ev处的峰值分别为cu2p3/2和cu2p1/2的结合能,这两个峰均归属于为cu0的特征峰,并且在943.7ev无特征峰,说明cuncs@gc系统中几乎没有cu2+存在。
图5为本发明所述的对比例1(a),实施例1(b)的荧光强度谱图,cuncs激发波长为405nm,发射波长为605nm,cuncs@gc的激发和发射波长分别为387nm、615nm。从图中可以看出两者的荧光强度谱图存在明显差异,cuncs@gc(1.0mg/ml)的荧光强度值几乎是纯cuncs的3倍,说明gc纳米凝胶可以极大的增强体系的发光强度。
图6为本发明所述的不同浓度的gc纳米凝胶复合cuncs后的荧光强度谱图,从图中可以看出,随着gc纳米凝胶浓度的增加,cuncs@gc体系的荧光强度呈现先增加后减少的趋势,在gc纳米凝胶浓度为1mg/ml时,发光强度最大,结合图3的tem图,选择1.0mg/ml作为最佳浓度。
实施例2
一种锌离子检测方法,步骤包括:向一定体积的ph值为7.4的发光纳米探针中加入相同体积不同浓度的zn2+溶液,再用超纯水稀释后进行锌离子含量检测。
具体步骤为:
(1)取至少五种不同浓度的200μl的zn2+标准溶液,随即加入至ph为7.4的cuncs@gc溶液中,最后用超纯水稀释至体积为1ml,充分混合均匀反应5min后,以固定激发波长为387nm进行光致发光发射光谱的测定,并记录在该激发波长下加入不同浓度zn2+后cuncs@gc溶液的发射强度光谱图;
(2)向400μlcuncs@gc溶液中分别加入上述未加标和不同加标量的样液200μl,最后由超纯水稀释至1ml,在387nm激发波长下测定荧光强度;最后经线性方程计算锌含量以及回收率。
图7为本发明的cuncs@gc的合成步骤以及zn2+的检测原理,在聚集状态时cuncs@gc都能够发光;当ph调至7.4,cuncs@gc溶液均变成无色透明的状态,表明此时溶液中的纳米团簇呈现分散状态,不能发光,zn2+加入后,以一种交联剂的作用将溶液中分散的纳米团簇重新连接聚集起来,溶液重新发光。
进行抗干扰实验:首先准备好含有常见金属离子k+、na+、mg2+、ca2+的水溶液,浓度为1.5mm;含有微量金属离子fe3+、cu2+、cr3+、mn2+、ni2+的水溶液,浓度为300μm;氨基酸类水溶液均为300μm;其他生物物质da、ua、aa水溶液浓度为1.5mm,gsh水溶液浓度为1mm,glucose、lactate水溶液浓度为3mm。取400μlcuncs@gc溶液于2ml小离心管中,然后向小离心管中再分别加入上述不同的干扰物质200μl,最后由超纯水稀释至1ml,在387nm激发波长下测定荧光强度。最后与加入30μl的zn2+比较荧光强度。
图8、9、10为本发明所述的纳米探针在加入30μm的zn2+后的荧光强度差值对比加入对其他干扰物质后的荧光强度差值。首先是分别加入常见金属离子k+、na+、mg2+、ca2+浓度为1.5mm以及微量金属fe3+、cu2+、cr3+、mn2+、ni2+浓度为300μm后的荧光强度差值(加入金属离子后的荧光强度-未加入金属离子时的强度);然后是分别加入氨基酸类(1甘氨酸、2丙氨酸、3苯丙氨酸、4缬氨酸、5组氨酸、6异亮氨酸、7精氨酸、8天冬氨酸、9脯氨酸、10丝氨酸、11亮氨酸、12酪氨酸、13色氨酸、14苏氨酸、15天冬酰胺、16谷氨酸、17甲硫氨酸)的浓度均为300μm后的荧光强度差值;最后是分别加入其他生物物质da、ua、aa为1.5mm,gsh为1mm,glucose、lactate为3mm后的荧光强度差值。从三个图中可以看出该纳米探针对zn2+检测有较好的选择性。
本发明构建的发光纳米探针用以检测水中以及食品、生物领域的锌离子。检测方法为基于“发光”模式的纳米探针,检测装置为分子荧光光谱仪(caryeclipse)。
图11为对实施例2中的cuncs@gc溶液加入不同浓度zn2+后的荧光强度变化光谱图,其中图11a为对实施例2中的cuncs@gc溶液加入浓度为0-750μm的zn2+标液的荧光强度变化光谱图,图11b为荧光强度差值(i-i0)与不同浓度zn2+标液作图后所得分别在低浓度范围(1.5μm-100μm)和高浓度范围(100μm-750μm)内呈现的良好线性关系图(i0为cuncs@gc溶液的荧光强度,i为cuncs@gc溶液中加入不同浓度zn2+标液后的荧光强度)。从图11a中可以看出,随着zn2+浓度在0.1μm–750μm的范围内逐渐增加,cuncs@gc溶液的荧光强度逐渐增大,将所得数据作图,发现加入的zn2+的浓度在1.5μm-100μm以及100μm-750μm范围内与荧光强度差(加入zn2+后的荧光强度-没有添加zn2+时的荧光强度)分别呈现线性关系,从图11b中可以看出,对应的线性方程为δi1=0.38c1+9.79(r2=0.9943)和δi2=0.02c2+46.79(r2=0.9859)。表明该纳米探针可以灵敏地检测zn2+的浓度。
实施例3
一种食品中锌离子检测方法,步骤包括:
对食品样品进行检测之前,使用微波消解对牛奶、啤酒和茶叶进行前处理,具体做法就是将三种食品取一定量放入聚四氟乙烯管中,加入5ml的硝酸和5ml的h2o2在电加热板上预消解30min,然后放入微波消解仪中按照设定好的程序进行消解,最后用超纯水定容至100ml即可。
每种样品都按照未加标、加标0.05mm、加标0.15mm、加标0.45mm进行锌含量的测定。
向400μlcuncs@gc溶液中分别加入上述未加标和不同加标量的样液200μl,最后由超纯水稀释至1ml,在387nm激发波长下测定荧光强度。最后经实施例2中的线性方程计算锌含量以及回收率。
表1为实施例3的锌离子检测方法与电感耦合等离子体(icp)法测定牛奶、啤酒、茶叶中的锌含量的结果比较。
表1不同检测方法检测的锌含量的结果表
由表1可以看出,使用该发光纳米探针测得的食品中的锌含量与传统方法icp测得锌含量值差别不大,说明该发光纳米探针具有良好的实用性,可以替代繁琐复杂的传统检测方法。
实施例4
一种生物活细胞中zn2+成像方法,步骤包括:
进行生物活细胞成像实验之前要做的是细胞毒性实验,采用mtt实验来评估所制备的纳米探针的细胞毒性。具体实施过程为:首先a549细胞培养在96孔细胞培养板中,最终密度为8000个细胞/板,接着向每个细胞培养板中加入不同体积的cuncs@gc溶液(1,2.5,5,7.5,10,15μl)后在37℃、5%co2的条件下孵育24h;然后再向每个细胞培养板中加入mtt(最终浓度为5mg/ml)在同样条件下培养4h,在150μl的dmso溶液中有晶体形成,用细胞计数器观察上述晶体在570nm的吸光度(od)来计算细胞成活率。将10μl混有500μmzn2+的cuncs@gc溶液用移液枪加到1ml的细胞培养基中,细胞孵育30min后在共聚焦荧光显微镜下观察。
图12为基于cuncs@gc纳米复合材料的荧光探针用于检测a549活细胞中zn2+所得的共焦荧光图像,由图可以看出该纳米探针反应灵敏,能够实现生物体活细胞zn2+的快速灵敏检测。
本发明可用其他的不违背本发明的精神或主要特征的具体形式来概述。因此,无论从哪一点来看,本发明的上述实施方案都只能认为是对本发明的说明而不能限制本发明,权利要求书指出了本发明的范围,而上述的说明并未指出本发明的范围,因此,在与本发明的权利要求书相当的含义和范围内的任何改变,都应认为是包括在本发明的权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!