一种肌酸激酶同工酶的均相检测试剂盒及其应用的制作方法
1.本发明属于均相检测技术领域,具体涉及一种肌酸激酶同工酶的均相检测试剂盒及其制备方法和应用。
背景技术:
2.肌酸激酶(ck)是一种二聚体酶,它有四种不同的形式:线粒体同工酶、胞浆同工酶ck-mm(肌型)、肌酸激酶脑型同工酶ck-bb(脑型)、肌酸激酶同工酶(ck-mb),其中肌酸激酶同工酶主要位于心肌。
3.肌酸激酶同工酶在急性心肌梗死(ami)、心肌坏死时释放进入外周血,在临床症状出现3-8小时后即可检出,与肌红蛋白和肌钙蛋白联合检测,能判断心肌是否受损,是研究和诊断急性心肌梗塞(ami)的指标。临床上主要用于心肌梗死的辅助诊断。
4.常用的ck-mb检测方法有金标定性试验、荧光免疫法、联免疫吸附试验(elisa)、磁微粒化学发光法(cmia)和生化仪检测。光激化学发光的基础原理是一种均相免疫反应。它是基于两种微粒表面包被的抗原或抗体,在液相中形成免疫复合物而将两种微粒拉近。在激光的激发下,发生微粒之间的单线态氧的转移,进而产生高能级的红光,通过单光子计数器和数学拟合将光子数换算为分析物的浓度。而当样本不含分析物时,两种微粒间无法形成免疫复合物,两种微粒的间距超出单线态氧传播范围,单线态氧在液相中迅速淬灭,检测时则无高能级红光产生。基于光激化学发光方法的试剂盒,与现有检测试剂盒相比,具有操作方便、检测快速、灵敏度高、准确性好等优点;将其应用于心肌损伤的监测,可以提高急性心肌梗塞诊断的准确率。
5.cn106093411a公开了一种针对急性心肌梗塞诊断的一步均相ck-mb检测试剂盒及其在检测ck-mb含量中的应用,其采用光激化学发光法,虽然较现有技术具有操作方便、检测快速、特异性强等优点,但是灵敏度仍然不高,该试剂盒更无法兼顾到高灵敏度和宽检测量程。
技术实现要素:
6.本发明所要解决的技术问题是针对现有技术的不足提供了一种肌酸激酶同工酶的均相检测试剂盒,其测定的主体体液中ck-mb标志物的定量结果可以用于临床上心肌梗死的辅助诊断,既有较合适的灵敏度,又有很宽的检测量程。
7.为此,本发明第一方面提供了一种肌酸激酶同工酶的均相检测试剂盒,其包括试剂1,所述试剂1包含第一缓冲溶液以及悬浮于其中的受体颗粒,所述受体颗粒能够与活性氧作用产生化学发光,其与肌酸激酶同工酶抗体结合,所述肌酸激酶同工酶抗体能够与肌酸激酶同工酶特异性结合,其特征在于:所述受体颗粒包括第一载体,所述第一载体的内部填充有发光组合物,所述第一载体的表面键合肌酸激酶同工酶抗体,所述受体颗粒在试剂1中的粒径分布变异系数c.v值不低于5%且不高于25%。
8.在本发明的一些实施方式中,所述受体颗粒在试剂1中的粒径分布变异系数c.v值
不高于15%。
9.在本发明的一些具体实施例中,所述受体颗粒在试剂1中的粒径分布变异系数c.v值可以选自5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25%。
10.在本发明的一些实施方式中,所述第一载体的表面包被有多糖,所述肌酸激酶同工酶抗体通过与多糖分子的键合而结合到第一载体上。
11.在本发明的一些实施方式中,所述第一载体的表面包被至少两个连续多糖层的涂层。
12.在本发明的一些实施方式中,所述涂层的第一多糖层与第二多糖层自发关联。
13.在本发明的一些实施方式中,所述涂层中的每一层多糖具有官能团,所述多糖层的官能团与前一多糖层的官能团所带电荷相反。
14.在本发明的另一些实施方式中,所述涂层中的每一层多糖具有官能团,每一多糖层通过其官能团与前一多糖层上的官能团之间的反应从而与前一多糖层共价连接。
15.在本发明的一些实施方式中,所述涂层的最外一层多糖层具有至少一个侧基官能团,其与肌酸激酶同工酶抗体键合。
16.在本发明的一些实施方式中,所述涂层的最外一层多糖层的侧基官能团选自醛基、羧基、巯基、氨基、羟基和马来胺基中的至少一种。
17.在本发明的一些优选实施方式中,所述涂层的最外一层多糖层的侧基官能团选自醛基和/或羧基。
18.在本发明的一些实施方式中,每升所述第一缓冲溶液中的糖含量为0.01-1g。
19.在本发明的一些优选实施方式中,每升所述第一缓冲溶液中的糖含量为0.02-0.2g。
20.在本发明的一些实施方式中,每毫克所述受体颗粒的糖含量不低于20微克。在本发明的一些具体实施例中,每毫克所述受体颗粒的糖含量可以选自20.2毫克、40毫克、45.1毫克、55.8毫克、60.3毫克。
21.在本发明的一些优选实施方式中,每升所述第一缓冲溶液中的糖含量不低于40微克。
22.在本发明的一些实施方式中,所述多糖选自含有三个或三个以上未修饰或修饰的单糖单元的碳水化合物;优选选自葡聚糖、淀粉、糖原、菊粉、果聚糖、甘露聚糖、琼脂糖、半乳聚糖、羧基葡聚糖和氨基葡聚糖中的至少一种;更优选选自葡聚糖、淀粉、糖原和聚核糖中的至少一种,最优选为葡聚糖和/或葡聚糖衍生物。
23.本发明的一些具体的实施方式中,所述多糖为葡聚糖。
24.在本发明的一些实施方式中,所述试剂盒还包括已知肌酸激酶同工酶浓度的系列校准品溶液,所述系列校准品溶液中肌酸激酶同工酶的浓度为0-510ng/ml。
25.在本发明的一些实施方式中,所述系列校准品溶液中肌酸激酶同工酶的浓度包括0、4、10、50、200和510ng/ml。
26.在本发明的另一些实施方式中,所述试剂盒还包括试剂2,所述试剂2包含与特异性结合配对成员中的一员连接的肌酸激酶同工酶抗体,所述肌酸激酶同工酶抗体能够与肌酸激酶同工酶特异性结合。
27.在本发明的一些实施方式中,所述试剂盒还包括试剂3,所述试剂3包含第二缓冲溶液以及悬浮于其中的供体颗粒,所述供体颗粒与特异性结合配对成员中的一员结合。
28.在本发明的一些实施方式中,所述供体颗粒包括第二载体,所述第二载体的内部填充有敏化剂,所述第二载体的表面键合有特异性结合配对成员中的一员;所述供体颗粒在试剂3中每毫克所述供体颗粒中的糖含量不高于40mg。
29.在本发明的一些实施方式中,所述供体颗粒在试剂3中的粒径分布变异系数c.v值不低于5%且不高于25%。在本发明的一些具体实施例中,所述供体颗粒在试剂3中的粒径分布变异系数c.v值选自5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25%。
30.在本发明的一些实施方式中,所述试剂盒中含有至少1个试剂条,所述试剂条上开设有若干盛装试剂的试剂孔,其中至少2个试剂孔分别用于盛装所述试剂1和试剂2。
31.在本发明的另一些实施方式中,所述试剂盒中含有至少1个试剂条,所述试剂条上开设有若干盛装试剂的试剂孔,其中至少3个试剂孔分别用于盛装所述试剂1、试剂2和试剂3。
32.本发明的第二方面提供了一种如本发明的第一方面所述的试剂盒在化学发光分析仪上的应用。
33.本专利的发明人研究发现,受体颗粒和供体颗粒的体积小,在试剂盒中的浓度低,制备工艺非常复杂,其质量容易受多种因素的影响,因此需要根据多次的检测实验来获得最佳的控制技术特征,比如受体颗粒和供体颗粒的粒径分布变异系数c.v值,由于受体颗粒和供体颗粒的体积内部要融入发光组合物或敏化剂,外部要包被抗体抗原或链霉亲和素,为了保证微粒的均一性,降低由微粒大小不均带来的误差,本领域技术人员通常会考虑将粒径分布变异系数c.v值控制在较小的数值范围,甚至越低越好。然而,本专利的发明人发现,如果想实现微粒的c.v值很小,对生产工艺的要求过高,极大地增加了试剂生产成本,不能形成产业化,使试剂无法在临床诊断中大量使用。尤其是包被了多糖之后,纳米微球的粒径分布变异系数c.v值的变化就更显著、更不稳定,难以满足医疗器械产品注册以及临床应用的试剂要求。但是,c.v值如果过大,光激化学发光检测的效果又不好。因此,本专利的发明人惊讶地发现,如果将受体颗粒和供体颗粒的粒径分布变异系数c.v值控制在一个合适范围内,能够获得最佳的光激化学发光检测结果,实现既有较合适的灵敏度,又有很宽的检测量程。
34.本发明的有益效果为:
35.将本发明提供的试剂盒在用于体外诊断主体是否患有心肌损伤中具有可行性,利用本发明提供的试剂盒以及相应的方法测定主体体液中ck-mb标志物的定量结果可用于辅助诊断心肌梗死。本发明的试剂盒既有较合适的灵敏度,又有很宽的检测量程。
具体实施方式
36.为使本发明容易理解,下面将详细说明本发明。但在详细描述本发明前,应当理解本发明不限于描述的具体实施方式。还应当理解,本文中使用的术语仅为了描述具体实施方式,而并不表示限制性的。
37.在提供了数值范围的情况下,应当理解所述范围的上限和下限和所述规定范围中
的任何其他规定或居间数值之间的每个居间数值均涵盖在本发明内。这些较小范围的上限和下限可以独立包括在较小的范围中,并且也涵盖在本发明内,服从规定范围中任何明确排除的限度。在规定的范围包含一个或两个限度的情况下,排除那些包括的限度之任一或两者的范围也包含在本发明中。
38.除非另有定义,本文中使用的所有术语与本发明所属领域的普通技术人员的通常理解具有相同的意义。虽然与本文中描述的方法和材料类似或等同的任何方法和材料也可以在本发明的实施或测试中使用,但是现在描述了优选的方法和材料。
39.i.术语
40.本发明所述用语“均相”所对应的英文定义为“homogeneous”,其是指无须对结合的抗原抗体复合物和剩余的游离抗原或抗体进行分离既可进行检测。
41.本发明所述用语“待检样品”是指可能含有被分析物的一种混合物。可以被用在本发明公开的方法中的典型待检样品包括体液,如血液、血浆、血清、尿、精液、唾液等。
42.本发明所述用语“抗体”以最广含义使用,包括任何同种型的抗体,保留对抗原的特异性结合的抗体片段,包括但不限于fab、fv、scfv、和fd片段、嵌合抗体、人源化抗体、单链抗体、双特异性抗体、和包含抗体的抗原结合部分和非抗体蛋白的融合蛋白。在任何需要的情况下,抗体可以进一步与其它部分,诸如特异性结合配对成员,例如生物素或亲和素(生物素-亲和素特异性结合配对成员中的一员)等缀合。
43.本发明所述用语“抗原”是指能够刺激机体产生免疫应答,并能与免疫应答产物抗体和致敏淋巴细胞在体内外结合,发生免疫效应的物质。所述抗原可以为融合抗原,且在任何需要的情况下,抗原可以进一步与其它部分,诸如特异性结合配对成员,例如生物素或亲和素(生物素-亲和素特异性结合配对成员中的一员)等缀合。
44.本发明所述用语“结合”或“键合”指由于例如共价、静电、疏水、离子和/或氢键等相互作用,包括但不限于如盐桥和水桥等物理或化学作用引起的两个分子间的联合。
45.本发明所述用语“特异性结合”是指两种物质之间的相互辨别和选择性结合反应,从立体结构角度上说就是相应的反应物之间构象的对应性。
46.本发明所述用语“特异性结合配对成员”是指这样一对分子,它们能够相互特异性结合,例如,酶-底物、抗原-抗体、配基-受体。一个具体的特异性结合配对成员对的例子是生物素-亲和素系统,其中“生物素”广泛存在于动植物组织中,其分子上有两个环状结构,分别为咪唑酮环和噻吩环,其中咪唑酮环是与亲和素结合的主要部位。活化的生物素可以在蛋白质交联剂的介导下,与已知的几乎所有生物大分子偶联,包括蛋白质、核酸、多糖和脂类等;而“亲和素”是由链霉菌分泌的一种蛋白质,分子量为65kd。“亲和素”分子由4条相同的肽链组成,其中每条肽链都能结合一个生物素。因此每个抗原或抗体可同时偶联多个生物素分子,从而产生“触手效应”提高分析灵敏度。本发明中所述亲和素选自卵白亲和素、链霉亲和素、卵黄亲和素、中性亲和素和类亲和素,优选选自中性亲和素和/或链霉亲和素。
47.本发明所述用语“活性氧”是指机体内或者自然环境中由氧组成,含氧并且性质活泼的物质的总称,主要为一种激发态的氧分子,包括氧的一电子还原产物超氧阴离子(o2·-)、二电子还原产物过氧化氢(h2o2)、三电子还原产物羟基自由基(
·
oh)以及一氧化氮和活性氧(1o2)等。
48.本发明所述用语“供体颗粒”是指通过能量或者活性化合物的激活后能够产生与
受体颗粒反应的诸如活性氧的活性中间体的敏化剂。供体颗粒可以是光活化的(如染料和芳香化合物)或者化学活化的(如酶、金属盐等)。在本发明的一些实施方式中,所述供体颗粒通过功能基团被包被在基体上形成填充有感光化合物的高分子微粒,在光激发下能够产生活性氧,此时感光微球也可以称为供氧微球或感光微球。所述供体颗粒表面可以有亲水性的醛基葡聚糖,内部填充有光敏剂。所述光敏剂可以是本领域已知的光敏剂,优选相对光稳定且不与活性氧有效反应的化合物,其非限定性的例子包括亚甲基蓝、玫瑰红、卟啉、和酞菁等化合物,以及这些化合物的具有1-50个原子取代基的衍生物,所述取代基用于使得这些化合物更具有亲脂性或更具有亲水性、和/或作为连接至特异性结合配对成员的连接基团。所述供体颗粒表面还可以填充其他敏化剂,其非限定性的例子是某些化合物,它们催化过氧化氢转化为活性氧和水。其他一些供体的例子包括:1,4-二羧基乙基-1,4-萘内过氧化物、9,10-二苯基蒽-9,10-内过氧化物等,加热这些化合物或者这些化合物直接吸收光会释放活性氧,例如活性氧。
49.本发明所述用语“受体颗粒”是指能够与活性氧反应可以产生可检测信号的化合物。供体颗粒被能量或者活性化合物诱导激活并释放高能态的活性氧,该高能态的活性氧被近距离的受体颗粒俘获,从而传递能量以激活所述受体颗粒。在本发明的一些实施方式中,所述受体颗粒通过功能基团填充于载体中形成填充有发光组合物的高分子微粒,所述发光组合物包含有能够与活性氧发生反应的化学发光化合物。在本发明的一些具体实施例中,所述化学发光化合物,其经历与活性氧的化学反应以形成不稳定的亚稳态中间体,所述亚稳态中间体可以分解,同时或随后发光。这些物质的典型例子包括但不限于:烯醇醚、烯胺、9-烷叉黄原胶、9-烷叉-n-烷基吖啶满、芳基乙醚烯、双环氧乙烯、二甲基噻吩、芳基咪唑或光泽精。
50.本发明中,所述“发光组合物”即一种被称作为标记物的化合物,可进行化学反应以便引起发光,比如通过被转化为在电子激发态下形成的另一种化合物。激发态可以是单线态或是三重激发态。激发态可弛豫到基态直接发光,或者是通过将激发能量传递到发射能量受体,从而自身恢复到基态。在此过程中,能量受体颗粒将被跃迁为激发态而发光。
51.本发明所述的“载体”其可以是任何尺寸的,其可以是有机的或是无机的,其可以是可膨胀或不可膨胀的,其可以是多孔的或非多孔的,其具有任何密度,但优选具有和水接近的密度,优选能漂浮于水中,且由透明、部分透明或不透明的材料构成。所述载体可以有或没有电荷,当带有电荷时,优选是负电荷。所述载体可以是固体(如聚合物、金属、玻璃、有机和无机物诸如矿物、盐和硅藻)、小油滴(如碳氢化合物、碳氟化合物、硅质流体)、囊泡(如合成的诸如磷脂、或天然的诸如细胞、及细胞器官)。载体可以是乳胶颗粒或是含有有机或无机聚合物的其他颗粒、脂双层如脂质体、磷脂囊泡、小油滴、硅颗粒、金属溶胶、细胞和微晶染料。载体通常具有多功能性,或者能够通过特异或非特异的共价或非共价相互作用而结合到供体或受体上。有许多官能团是可用的或者将其合并进来。典型的官能团包括羧酸、乙醛、氨基、氰基、乙烯基、羟基、巯基等。适用于本发明的载体的一个非限制性的例子是聚苯乙烯乳胶微球。
52.本发明所述的“粒径分布变异系数c.v值”是指在纳米粒度仪的检测结果中,粒径在高斯分布中的变异系数。c.v是衡量标准物质中各颗粒粒径变异程度的一个统计量。标准物质粒径分布变异系数用于表示标准物质的颗粒粒径分散程度,常用标准差与标准物质平
均粒径的比值的百分数表示,后者也称分散度。变异系数的计算公式为:变异系数c.v值=(标准偏差sd/平均值mean)
×
100%。标准偏差(standard deviation,sd)也被称为标准差,它描述各数据偏离平均数的距离(离均差)的平均数,它是离差平方和平均后的方根,用σ表示。标准差是方差的算术平方根。标准偏差能反映一个数据集的离散程度,标准偏差越小,这些值偏离平均值就越少,反之亦然。标准偏差σ为正态分布曲线上的拐点(0.607倍峰高处)至峰高与时间轴的垂线间的距离,即正态分布曲线上两拐点间距离的一半。半高峰宽(wh/2)是指峰高一半处的峰宽,wh/2=2.355σ。通过正态分布曲线两侧的拐点作切线,在基线上的截距称为峰宽或称基线宽度,w=4σ或w=1.699wh/2。
[0053]ⅱ.具体实施方案
[0054]
下面将更详细地说明本发明。
[0055]
光激化学发光分析技术的技术原理为:敏化剂在激光照射下能将周围环境中的氧分子激发为单线态氧分子,单线态氧分子能够与相距200nm左右的发光组合物反应,产生一定波长的光信号;当样品中包含待测抗原或抗体时,该抗原抗体的免疫反应能够使包含敏化剂的供体颗粒与包含发光组合物的受体颗粒结合,从而产生特定波长的光信号,检测该光信号即可检测待测抗原或抗体的含量。在上述描述的光激化学发光免疫反应中,受体颗粒和供体颗粒的直径、材质、表面性质等会显著影响敏化剂激发单线态氧分子的效率及单线态氧分子的能量传递效率;也会影响供体颗粒和受体颗粒的非特异性结合,从而导致检测结果出现误差,因此,供体颗粒和受体颗粒的直径范围、微粒大小的均一性、微粒的材质、表面化学性质等是光激化学发光分析技术研发改进的重点方向,而绝非本领域一般常识或行业惯例。
[0056]
当临床样本中存在ck-mb标志物时,ck-mb同时与包被ck-mb抗体i(单克隆抗体)的受体颗粒以及生物素标记的ck-mb抗体ii(单克隆抗体)特异性结合,并于受体颗粒表面形成双抗体夹心复合物;此时,如加入链霉亲和素修饰的供体颗粒,生物素与链霉亲和素结合而使得两种颗粒相互靠近,在激发光源的激发下,供体颗粒释放单线态氧,在溶液中碰到受体颗粒后产生化学发光,从而更进一步激发同一个颗粒上的荧光基团产生级联放大反应产生荧光。此时,存在的ck-mb标志物含量越多,则荧光强度越强。本发明正是基于上述方法作出的。
[0057]
为此,本发明第一方面涉及一种肌酸激酶同工酶的均相检测试剂盒,其包括试剂1,所述试剂1包含第一缓冲溶液以及悬浮于其中的受体颗粒,所述受体颗粒能够与活性氧作用产生化学发光,其与肌酸激酶同工酶抗体结合,所述肌酸激酶同工酶抗体能够与肌酸激酶同工酶特异性结合,其特征在于:所述受体颗粒包括第一载体,所述第一载体的内部填充有发光组合物,所述第一载体的表面键合肌酸激酶同工酶抗体,所述受体颗粒在试剂1中的粒径分布变异系数c.v值不低于5%且不高于25%。
[0058]
在本发明的一些实施方式中,所述受体颗粒在试剂1中的粒径分布变异系数c.v值不高于15%。
[0059]
在本发明的一些具体实施例中,所述受体颗粒在试剂1中的粒径分布变异系数c.v值选自5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25%。
[0060]
在本发明的一些实施方式中,所述第一载体的表面包被有多糖,所述肌酸激酶同
工酶抗体通过与多糖分子的键合而结合到第一载体上。
[0061]
在本发明的一些实施方式中,所述第一载体的表面包被至少两个连续多糖层的涂层。本发明所述的“连续多糖层”是指多个多糖层相互之间直接键合连接,在两个多糖层之间不含有其他非多糖层。
[0062]
在本发明的一些实施方式中,所述涂层的第一多糖层与第二多糖层自发关联。本发明所述的“自发”是指多个多糖层相互之间自发形成有序结构,例如,电荷相互作用或分子自组装的方式。
[0063]
在本发明的一些实施方式中,所述涂层中的每一层多糖具有官能团,所述多糖层的官能团与前一多糖层的官能团所带电荷相反。
[0064]
在本发明的另一些实施方式中,所述涂层中的每一层多糖具有官能团,每一多糖层通过其官能团与前一多糖层上的官能团之间的反应从而与前一多糖层共价连接。
[0065]
在本发明的一些实施方式中,所述涂层的最外一层多糖层具有至少一个侧基官能团,其与肌酸激酶同工酶抗体键合。
[0066]
在本发明的一些实施方式中,所述涂层的最外一层多糖层的侧基官能团选自醛基、羧基、巯基、氨基、羟基和马来胺基中的至少一种。
[0067]
在本发明的一些优选实施方式中,所述涂层的最外一层多糖层的侧基官能团选自醛基和/或羧基。
[0068]
在本发明的一些实施方式中,每升所述第一缓冲溶液中的糖含量为0.01-1g。
[0069]
在本发明的一些优选实施方式中,每升所述第一缓冲溶液中的糖含量为0.02-0.2g。
[0070]
在本发明的一些实施方式中,每毫克所述受体颗粒的糖含量不低于20微克。本发明的受体颗粒中的糖含量可以来自于受体颗粒表面包被的多糖,也可以来自于抗原抗体或特异性结合配对成员自身结构中所携带的多糖成分。
[0071]
在本发明的一些具体实施例中,每毫克所述受体颗粒的糖含量为20.2毫克、40毫克、45.1毫克、55.8毫克、60.3毫克。
[0072]
在本发明的一些优选实施方式中,每升所述第一缓冲溶液中的糖含量不低于40微克。
[0073]
在本发明的一些实施方式中,所述多糖选自含有三个或三个以上未修饰或修饰的单糖单元的碳水化合物;优选选自葡聚糖、淀粉、糖原、菊粉、果聚糖、甘露聚糖、琼脂糖、半乳聚糖、羧基葡聚糖和氨基葡聚糖中的至少一种;更优选选自葡聚糖、淀粉、糖原和聚核糖中的至少一种,最优选为葡聚糖和/或葡聚糖衍生物。多糖,特别是葡聚糖和葡聚糖衍生物,它们可以增加载体表面的亲水性,并提供抗体分子和载体表面连接的共轭位点。受体微粒表面包被多糖可以增加微球的亲水性,并避免非特异性吸附现象的发生,极大影响后期光激化学发光检测的光信号。本专利的发明人发现,精确控制微球表面的糖含量在合适范围内,能够很好地解决光激化学发光技术在体外诊断领域应用所存在的某些技术问题。
[0074]
在本发明的一些实施方式中,所述试剂盒还包括已知肌酸激酶同工酶浓度的系列校准品溶液,所述系列校准品溶液中肌酸激酶同工酶的浓度为0-510ng/ml。
[0075]
在本发明的一些实施方式中,所述系列校准品溶液中肌酸激酶同工酶的浓度包括0、4、10、50、200和510ng/ml。
[0076]
在本发明的另一些实施方式中,所述试剂盒还包括试剂2,所述试剂2包含与特异性结合配对成员中的一员连接的肌酸激酶同工酶抗体,所述肌酸激酶同工酶抗体能够与肌酸激酶同工酶特异性结合。
[0077]
在本发明的一些实施方式中,所述试剂盒还包括试剂3,所述试剂3包含第二缓冲溶液以及悬浮于其中的供体颗粒,所述供体颗粒与特异性结合配对成员中的一员结合。
[0078]
在本发明的一些实施方式中,所述供体颗粒包括第二载体,所述第二载体的内部填充有敏化剂,所述第二载体的表面键合有特异性结合配对成员中的一员;所述供体颗粒在试剂3中每毫克所述供体颗粒中的糖含量不高于40mg。
[0079]
在本发明的一些实施方式中,所述供体颗粒在试剂3中的粒径分布变异系数c.v值不低于5%且不高于25%。在本发明的一些具体实施例中,所述供体颗粒在试剂3中的粒径分布变异系数c.v值为选自5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%和25%。
[0080]
在本发明的一些实施方式中,所述试剂盒中含有至少1个试剂条,所述试剂条上开设有若干盛装试剂的试剂孔,其中至少2个试剂孔分别用于盛装所述试剂1和试剂2。
[0081]
在本发明的另一些实施方式中,所述试剂盒中含有至少1个试剂条,所述试剂条上开设有若干盛装试剂的试剂孔,其中至少3个试剂孔分别用于盛装所述试剂1、试剂2和试剂3。
[0082]
在本发明中,糖浓度或糖含量可以采用蒽酮法测定糖。利用蒽酮法测多糖是本领域技术人员所知悉的一种方法,糖类遇浓硫酸脱水生成糠醛或其衍生物,糠醛或羟甲基糠醛进一步与蒽酮试剂缩合产生蓝绿色物质,其在可见光区620nm~630nm波长处有最大吸收,且其光吸收值在一定范围内与糖的含量成正比关系。此法可用于单糖、寡糖和多糖的含量测定,并具有灵敏度高,简便快捷,适用于微量样品的测定等优点。
[0083]
第二方面涉及一种如第一方面所述的试剂盒在化学发光分析仪上的应用。
[0084]
在本发明的一些实施方式中,所述应用包括如下步骤:
[0085]
步骤s1,在盛液装置中分别加入待测样品、校准品和/或质控品;
[0086]
步骤s2,向盛液装置中加入试剂1和试剂2;
[0087]
步骤s3,将盛液装置放入化学发光分析仪上进行反应和检测
[0088]
在本发明的另一些实施方式中,所述应用包括如下步骤:
[0089]
步骤s1,在盛液装置中分别加入待测样品、校准品和/或质控品;
[0090]
步骤s2,向盛液装置中加入试剂1、试剂2和试剂3;
[0091]
步骤s3,将盛液装置放入化学发光分析仪上进行反应和检测。
[0092]ⅲ.具体实施例
[0093]
为使本发明更加容易理解,下面将结合实施例来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径或常规方法制得。
[0094]
实施例1试剂1的制备
[0095]
1.1第一载体的制备及表征过程
[0096]
1)准备100ml的三口烧瓶,加入40mmol苯乙烯、5mmol甲基丙烯酸、10ml水,搅拌10min后通n
2 30min;
[0097]
2)称取0.12g过硫酸钾和0.2g氯化钠,溶于40ml水中配制成水溶液。将该水溶液加入到步骤1的反应体系中,继续通n
2 30min;
[0098]
3)将反应体系升温至70℃,反应15小时;
[0099]
4)将反应完成后的乳液冷却至室温,用合适的滤布过滤。得到的乳液用去离子水多次离心沉降清洗,直至离心初的上清液的电导率接近去离子水,然后用水稀释,以乳液形式保存;
[0100]
5)由纳米粒度仪测得此时羧基聚苯乙烯乳胶微球粒径的gaussian
[0101]
分布平均粒径为202.5nm,变异系数(c.v)=5.6%。
[0102]
1.2发光组合物的填埋过程
[0103]
1)准备25ml的圆底烧瓶,加入0.1g二甲基噻吩衍生物和0.1g铕(ⅲ)配合物(mtta-eu
3+
),10ml 95%乙醇,磁力搅拌,水浴升温至70℃,获得配合物溶液;
[0104]
2)准备100ml的三口烧瓶,加入10ml 95%乙醇、10ml水和10ml浓度为10%、步骤1.1中获得的羧基聚苯乙烯乳胶微球,磁力搅拌,水浴升温至70℃;
[0105]
3)将步骤1)中的配合物溶液缓慢滴加至步骤2)中的三口烧瓶中,70℃反应2小时后停止搅拌,自然冷却;
[0106]
4)将上述乳液离心1小时,30000g,离心后弃去上清液,得到内部填埋有发光组合物的羧基聚苯乙烯乳胶微球。
[0107]
1.3受体颗粒的表面包被葡聚糖
[0108]
1)取50mg氨基葡聚糖固体于20ml圆底烧瓶中,加入5ml 50mm/ph=6磷酸盐缓冲液,30℃避光搅拌溶解;
[0109]
2)取100mg已制备好的内部填埋有发光组合物的羧基聚苯乙烯乳胶微球,加入到氨基葡聚糖溶液中搅拌2小时;
[0110]
3)将10mg edc
·
hcl溶于0.5ml 50mm/ph=6磷酸盐缓冲液后滴加到上述反应液中,30℃避光反应过夜;
[0111]
4)将反应后的混合液30000g离心45min后弃去上清液,加入50mm/ph=10碳酸盐缓冲液超声分散。重复离心清洗三次后用50mm/ph=10碳酸盐缓冲液定容,使其终浓度为20mg/ml;
[0112]
5)取100mg醛基葡聚糖固体于20ml圆底烧瓶中,加入5ml 50mm/ph=10碳酸盐缓冲液,30℃避光搅拌溶解,得到醛基葡聚糖溶液;
[0113]
6)将上述步骤4)中得到的微球溶液加入到醛基葡聚糖溶液中搅拌2小时;
[0114]
7)将15mg硼氢化钠溶于0.5ml 50mm/ph=10碳酸盐缓冲液后滴加到上述反应液中,30℃避光反应过夜;
[0115]
8)将反应后的混合液30000g离心45min后弃去上清液,加入50mm/ph=10碳酸盐缓冲液超声分散。重复离心清洗三次后用50mm/ph=10碳酸盐缓冲液定容,使其终浓度为20mg/ml,得到半成品微球溶液。
[0116]
9)由纳米粒度仪测得此时半成品微球粒径的gaussian分布平均粒径为241.6nm,变异系数(c.v)=11.50%。
[0117]
1.4ck-mb抗体i的偶联
[0118]
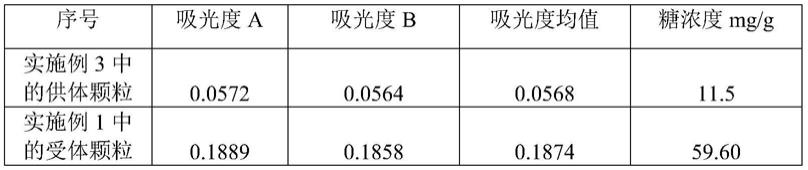
1)将ck-mb抗体i透析至ph值=10的50mm cb缓冲液,测得浓度为1.4mg/ml。
[0119]
2)在2ml离心管中加入0.5ml(1.3)中获得的受体颗粒以及0.36ml步骤1)获得的ck-mb抗体i,混匀后加入100μl 10mg/ml nabh4溶液(50mm cb缓冲液),2-8℃反应4小时。
[0120]
3)反应完毕后加入0.5ml 100mg/ml bsa溶液(50mm cb缓冲液),2-8℃反应2小时。
[0121]
4)反应完毕后将离心45min,30000g,离心后弃去上清液,用50mm mes缓冲液重新悬浮。重复离心清洗四次,并稀释至终浓度为100μg/ml,获得偶联ck-mb抗体i的试剂1。
[0122]
5)由纳米粒度仪测得此时微球粒径的gaussian分布平均粒径值为248.9nm,变异系数(c.v值)=9.90%。
[0123]
实施例2试剂2的制备
[0124]
2.1将ck-mb抗体ii透析至0.1m nahco3缓冲液,测得浓度为1.1mg/ml。
[0125]
2.2取步骤1)中的ck-mb抗体ii0.5mg,浓度调整为1mg/ml,加入2.7μl浓度为16.8mg/ml的biotin混匀,2-8℃反应14-18小时。
[0126]
2.3反应完成透析于20mm的tris缓冲液中。
[0127]
实施例3试剂3的制备
[0128]
3.1第二载体的制备
[0129]
a)准备100ml的三口烧瓶,加入40mmol苯乙烯、5mmol丙烯醛、10ml水,搅拌10min后通n
2 30min。
[0130]
b)称取0.11g过硫酸铵和0.2g氯化钠,溶于40ml水中配制成水溶液。将该水溶液加入到步骤a)的反应体系中,继续通n
2 30min。
[0131]
c)将反应体系升温至70℃,反应15小时。
[0132]
d)将反应完成后的乳液冷却至室温,用合适的滤布过滤。得到的乳液用去离子水多次离心沉降清洗,直至离心初的上清液的电导率接近去离子水,然后用水稀释,以乳液形式保存。
[0133]
e)由纳米粒度仪测得该醛基聚苯乙烯乳胶微球粒径的高斯分布平均粒径为201.3nm,变异系数(c.v)=8.0%。
[0134]
3.2敏化剂的填充
[0135]
a)准备25ml的圆底烧瓶,加入0.11g酞菁铜,10ml n,n-二甲基甲酰胺,磁力搅拌,水浴升温至75℃,获得光敏剂溶液。
[0136]
b)准备100ml的三口烧瓶,加入10ml 95%乙醇、10ml水和10ml浓度为10%、3.1中获得的醛基聚苯乙烯乳胶微球,磁力搅拌,水浴升温至70℃。
[0137]
c)将步骤a)中的溶液缓慢滴加至步骤b)中的三口烧瓶中,70℃反应2小时后停止搅拌,自然冷却,获得乳液。
[0138]
d)将上述乳液离心1小时,30000g,离心后弃去上清液,用50%乙醇重新悬浮。重复离心清洗三次后用ph值=10的50mm cb缓冲液重新悬浮,使其终浓度为20mg/ml。
[0139]
3.3试剂3的制备
[0140]
a)微球混悬液处理:吸取一定量步骤3.2制备的微球于高速冷冻离心机中离心,弃去上清,加入一定量mes缓冲液,超声细胞破碎仪上超声至颗粒重新悬浮,加入mes缓冲液调节微球浓度至100mg/ml。
[0141]
b)亲和素溶液配制:称量一定量链霉亲和素,加mes缓冲液溶解至8mg/ml。
[0142]
c)混合:将处理好的微球混悬液、8mg/ml的亲和素以及mes缓冲液,以2:5:1的体积
比进行混合,迅速混匀,得到反应液。
[0143]
d)反应:mes缓冲液配制25mg/ml的nabh3cn溶液,按照与反应液1:25的体积比加入,迅速混匀。37℃旋转反应48小时。
[0144]
e)封闭:mes缓冲液配制75mg/ml的gly溶液以及25mg/ml的nabh3cn溶液,按照与反应液2:1:10的体积比加入上述溶液中,混匀,37℃旋转反应2小时。再加入200mg/ml的bsa溶液(mes缓冲液),其与反应液体积比为5:8,迅速混匀,37℃旋转反应16小时。
[0145]
f)清洗:向反应好的溶液中加入mes缓冲液,高速冷冻离心机离心,弃上清,加入新鲜mes缓冲液超声法重新悬浮,再次离心,如此清洗3次,最后用少量的缓冲液进行悬浮,测定固含量,并用缓冲液调节浓度至150μg/ml,获得包含供体颗粒的试剂3。
[0146]
g)由纳米粒度仪测得试剂3中供体颗粒a的高斯分布平均粒径为227.7nm,变异系数c.v值为6.5%。
[0147]
实施例4:利用蒽酮法检测糖含量
[0148]
4.1微球样品预处理:
[0149]
分别取实施例1中含有1mg受体颗粒的试剂1和实施例3中含有1mg供体颗粒的试剂3,各自在20000g离心40min,倒去上层清液后用纯化水超声分散,重复离心分散三次后各自用纯化水定容至1mg/ml,作为待检样品。
[0150]
4.2葡萄糖标准溶液的配制:
[0151]
用纯化水将1mg/ml葡萄糖储备液配制成0mg/ml、0.025mg/ml、0.05mg/ml、0.075mg/ml、0.10mg/ml、0.15mg/ml的标准溶液曲线。
[0152]
4.3蒽酮溶液的配制:用80%硫酸溶液配制成2mg/ml。
[0153]
4.4向离心管分别加入0.1ml各浓度的葡萄糖标准溶液及待测样本,每管各加1ml蒽酮溶液。
[0154]
4.5 85摄氏度孵育30min。
[0155]
4.6将样品反应管15000g离心40min,移液器枪头从管底吸取澄清液体进行吸光度的测定,避免将上部悬浮物吸出。
[0156]
4.7恢复至室温,测量620nm的吸光度。
[0157]
4.8以标准品浓度为x值,吸光度为y值,进行一次直线回归,得到如表1所示的标准曲线吸光度数值,并以此检测待检样品的糖含量。
[0158]
实施例1中的受体颗粒和实施例3中的供体颗粒的糖含量如下表2所示。
[0159]
表1
[0160]
序号浓度mg/ml吸光度a吸光度b吸光度均值10.150.4150.4110.413020.10.2930.3020.297530.0750.2140.2270.220540.050.1460.1530.149550.0250.1010.0980.0995600.0320.0310.0315
[0161]
表2
[0162][0163]
实施例5肌酸激酶同工酶检测试剂盒(光激化学发光法)
[0164]
本试剂盒含有实施例1中制备的试剂1(含有ck-mb抗体i包被的受体微粒)、实施例2中制备的试剂2(含有生物素标记的ck-mb抗体ii)、肌酸激酶同工酶系列校准品、肌酸激酶同工酶质控品以及实施例3中制备的试剂3(含有亲和素包被的供体颗粒),在均相条件下,采用双抗体夹心免疫光激化学发光法定量检测人血清和血浆样本中的肌酸激酶同工酶(ck-mb)的浓度。
[0165]
下表3是本实施例制备的肌酸激酶同工酶检测试剂盒(光激化学发光法)的主要组成成分。
[0166]
表3
[0167][0168][0169]
实施例6试剂盒性能的测定
[0170]
利用博阳生物科技(上海)有限公司开发的lica500自动光激化学发光检测仪检测并本实施例中试剂盒的性能。lica500自动光激化学发光检测仪检测肌酸激酶同工酶的具体流程步骤如下:
[0171]
1.在反应孔中分别加入50μl样品或校准品、质控品;
[0172]
2.在反应孔中依次加入15μl试剂1和15μl试剂2;
[0173]
3.振动,37℃温育10分钟;
[0174]
4.自动加入150μl的试剂3(光激化学发光分析系统通用液,lica通用液);
[0175]
5.振动,37℃温育2分钟;
[0176]
6.激光照射微孔并计算每孔发光光子量;
[0177]
7.根据定标曲线,计算样品浓度。
[0178]
本实施例检测结果有效性的判定方法:每批次试验时均应该进行质控品的检测,单孔测定,检测结果应在要求的质控范围内,如超出范围,则本次试验结果不可信,必须重新检测,必要时重新定标。
[0179]
经本试剂盒检测健康人群血浆样本400份,其中女性200位,男性200位,对应的97.5%的人群测值水平分别为:女性:3.5ng/ml,男性:4.8ng/ml。
[0180]
本实施例的试剂盒的检测性能评价结果如下:
[0181]
空白限:≤0.1ng/ml;
[0182]
线性:线性范围0.1~500ng/ml区间内,线性相关系数r值≥0.9900;
[0183]
准确度:回收率在(85%~115%)范围内;
[0184]
重复性:变异系数(c.v)≤10%;
[0185]
批间差:批间变异系数(c.v)≤15%。
[0186]
实施例7试剂盒灵敏度和检测上限的测定
[0187]
定义灵敏度点为当浓度cx的信号高于两倍浓度c0的信号,即rlu(cx)>2rlu(c0),则对应的检测试剂灵敏度为cx。定义检测上限点为使用nccls ep-6文件中的方法确定的范围上限。
[0188]
(1)将ck-mb抗原稀释到0.1ng/ml、0.3ng/ml、0.5ng/ml、0.7ng/ml、0.9ng/ml、3ng/ml、5ng/ml、100ng/ml、300ng/ml、500ng/ml、700ng/ml、900ng/ml、1100ng/ml、1300ng/ml、1500ng/ml的系列浓度,分别采用实施例1制备的试剂1(含偶联ck-mb抗体i的受体颗粒,浓度为100μg/ml),然后实施例2制备的试剂2(含相同的生物素标记的ck-mb抗体ⅱ,稀释到2ug/ml)和实施例3制备的试剂3(含供体颗粒的试剂)检测上述浓度系列ck-mb抗原,利用博阳生物科技(上海)有限公司开发的光激化学发光分析系统检测灵敏度和检测上限如表4所示。
[0189]
表4
[0190]
[0191][0192]
从表4可知,当所述受体颗粒粒径分布的变异系数不低于5%不高于25%时,包含该受体颗粒的试剂盒既有较合适的灵敏度,又有很宽的检测量程。
[0193]
实施例8试剂1中受体颗粒的糖含量对于试剂盒性能的影响
[0194]
利用上述实施例1中的试剂1的制备方法来制备包含如下一系列受体颗粒的试剂1,并利用实施例4中给出的蒽酮法检测受体颗粒中的糖含量。
[0195]
参考上述实施例5中给出的方法,制备包括不同糖含量的试剂1的肌酸激酶同工酶检测试剂盒(光激化学发光法),光激化学发光检测过程是在博阳生物科技(上海)有限公司开发的lica ht自动光激化学发光分析系统上完成并输出检测结果。
[0196]
表5
[0197]
序号试剂1中受体颗粒的糖含量mg/g光激化学发光检测信号量112.65210220.233520340.038901445.155936555.860075660.359520
[0198]
从表5可知,当所述试剂1中受体颗粒的糖含量不低于20mg/g时,包含该受体颗粒的试剂盒的光激化学发光检测信号量较高。
[0199]
实施例9临床样本的检测
[0200]
本实施例检测40份的临床样本,利用实施例5中制备得到的试剂盒(光激化学发光法)进行检测。所用的ck-mb定量测定检测试剂盒(光激化学发光法)包括:包含ck-mb抗体i(单克隆抗体)包被的受体颗粒的试剂1、包含生物素标记的ck-mb抗体ii(单克隆抗体)的试剂2以及含有供体颗粒的试剂3(光激化学发光分析系统通用液)。其中,试剂3中供体颗粒的浓度为150ug/ml,供体颗粒在试剂r3中的粒径分布变异系数c.v值=6.5%,根据实施例4中给出的蒽酮法检测供体颗粒的糖含量为11.5ug/mg,受体颗粒的糖含量为59.60ug/mg。
[0201]
检测过程是在博阳生物科技(上海)有限公司开发的全自动光激化学发光分析系统(lica ht)上完成并输出检测结果,具体检测步骤包括:
[0202]
a.在反应孔中加入临床样本;
[0203]
b.在反应孔中依次加入试剂1和试剂2;
[0204]
c.温育;
[0205]
d.在反应孔中加入试剂3;
[0206]
e.温育;
[0207]
f.两次激光照射反应孔并计算每孔发光光子量;
[0208]
g.计算待测样本中的ck-mb浓度。
[0209]
当临床样本中存在ck-mb标志物时,ck-mb同时与包被ck-mb抗体i(单克隆抗体)的受体颗粒以及生物素标记的ck-mb抗体ⅱ(单克隆抗体)特异性结合,并于受体颗粒表面形成双抗体夹心复合物;此时,如加入链霉亲和素修饰的供体颗粒,生物素与链霉亲和素结合而使得两种颗粒相互靠近,在激发光源的激发下,供体颗粒释放活性氧,在溶液中碰到受体颗粒后产生化学发光,从而更进一步激发同一个颗粒上的荧光基团产生级联放大反应产生荧光。此时,存在的ck-mb标志物含量越多,则荧光强度越强,根据发光的强弱定量检测患者血清中ck-mb的量,具体检测结果如下表6所示:
[0210]
表6
[0211]
[0212][0213]
经数据比对,罗氏测值与本实施例8上述测值相关性为0.9963,斜率为0.9632。样本1-23号为正常体检病人,分布范围0.3ng/ml-4.13ng/ml,中值为1.09ng/ml;样本24-40号为鉴定有心肌损伤病人,分布范围4.55ng/ml-260.48ng/ml,中值为20.06g/ml。
[0214]
肌酸激酶(ck)是一种二聚体酶,它有四种不同的形式:线粒体同工酶、胞浆同工酶ck-mm(肌型)、肌酸激酶脑型同工酶ck-bb(脑型)、肌酸激酶同工酶(ck-mb),其中肌酸激酶同工酶(ck-mb)主要位于心肌。肌酸激酶同工酶在急性心肌梗死(ami)、心肌坏死时释放进入外周血,在临床症状出现3~8小时后即可检出,与肌红蛋白和肌钙蛋白联合检测,能判断心肌是否受损,是研究和诊断急性心肌梗塞(ami)的指标。临床上主要用于心肌梗死的辅助诊断。根据本发明的实施7的数据可以表明,将本发明所述的供体试剂在制备用于体外诊断主体是否患有心肌损伤的方法所使用的试剂盒中的用途具有可行性,利用发明所述的供体试剂以及相应的方法测定主体体液中ckmb标志物的定量结果可用于辅助诊断心肌梗死。
[0215]
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1