一种基于ECL夹心免疫传感的抗原检测试剂盒的制作方法
本发明属于传感器领域,具体涉及一种基于ecl夹心免疫传感的抗原检测试剂盒。
背景技术:
电化学发光(ecl)又称电致化学发光,是化学发光与电化学相结合的技术,是通过施加一定的电压进行电化学反应,在电极表面产生一些电生中间态的物质,然后这些电生中间态的物质之间或电生中间态的物质与体系中某些组分之间通过电子传递形成激发态,由激发态返回到基态而产生的一种发光现象。该技术集成了发光分析的高灵敏和电化学电位可控性的优点,线性范围宽,仪器设备简单,操作方便,分析快速,因此逐渐成为分析化学工作者十分感兴趣的研究领域。
电化学发光免疫分析是80年代末发展起来的一种新型的发光免疫分析方法,是电化学发光和免疫测定相结合的产物。该技术是通过电化学发光物标记抗原或抗体,利用抗原与抗体免疫反应前后电化学发光信号的改变,从而实现对待测物的定量分析检测。与其他免疫分析方法相比,它具有如下特点:无放射性辐射危害,无污染,是一种在电极表面由电化学引发的特异性化学发光反应;灵敏度高;检测速度快,仅需几分钟甚至几秒钟;稳定性好;应用范围宽,即可检测不同分子大小的抗原、半抗原和抗体,又可检测核酸探针。因此,电化学发光免疫分析在生物分析检测领域有着广泛的应用前景。
过硫酸钾阴极电化学发光免疫传感器是近几年新发展起来的将化学、电化学和免疫传感器结合在一起的一种新的检测和分析技术。s2o82-的水溶液在电化学还原过程中能产生氧化态的so4·-,与此同时,溶解氧被还原成ooh·,其进一步反应生成单线态(1o2)*,释放出多余能量从而产生光辐射。so4·-自由基和ooh·自由基这两种中间态物质的浓度变化决定着s2o82-的ecl强度的大小,因此,不管是增加so4·-自由基或者ooh·自由基的浓度,s2o82-的ecl强度均能够被增强。利用酶催化产生活性氧增强s2o82-的ecl信号的研究已有报道,然而,将过渡金属纳米材料作为共反应剂促进so4·-产生,增强过硫酸盐的ecl信号的免疫传感方法研究却罕有报道。
前列腺特异性抗原(prostatespecificantigen,psa)是由前列腺上皮组织分泌的一种特异性蛋白,前列腺特异抗原在血清中主要以三种形式存在:①游离前列腺特异抗原(fpsa),占总前列腺特异抗原(tpsa)的10%~30%;②前列腺特异抗原与α1-抗糜蛋白酶结合形成的复合物(psa-act);③前列腺特异抗原与α2-巨球蛋白酶结合形成的复合物(psa-α2m)。前列腺特异抗原的主要生理功能是可防止精液凝固,具有极高的组织器官特异性,是目前诊断前列腺癌的首选标志物。目前,现有技术中已经报道了多种对fpsa抗原的检测方法(如jugoslovmedbiohem2005,24,129-134;journalofimmunologicalmethods2011,369,74-80,但是,这些方法对fpsa抗原的检出限还普遍较高(0.016ng·ml-1~0.08μg·l-1),不能满足临床灵敏度的需求。因此,利用过硫酸钾阴极电化学发光免疫传感的优势,研制出检测限更低、检出范围更宽的基于ecl免疫传感的检测试剂盒,对前列腺癌等疾病的准确诊断将具有非常重要的意义。
技术实现要素:
本发明的目的在于提供一种基于ecl夹心免疫传感的抗原检测试剂盒及其在定量检测抗原浓度中的用途。
本发明提供了一种基于ecl夹心免疫传感的抗原检测试剂盒,所述抗原检测试剂盒包括以下组分:
(1)一抗修饰的电极;
(2)银纳米颗粒标记的二抗;
(3)过硫酸盐溶液。
进一步地,所述抗原检测试剂盒还包括待测抗原的标准溶液。
进一步地,所述一抗修饰的电极是通过下述方法制得的:先将金颗粒修饰在电极表面,然后再将一抗键合到所得电极表面,然后封闭非特异性位点。
进一步地,所述将金颗粒修饰在电极表面的方法为:将电极浸泡在氯金酸溶液中进行电沉积;所述氯金酸溶液的浓度优选为0.5~2%,更优选为1%,所述电沉积的电压优选为-0.3~-0.1v,更优选为-0.2v,所述电沉积的时间优选为20~40s,更优选为30s;所述电极为玻碳电极,优选为抛光后的玻碳电极;
和/或,所述将一抗键合到所得电极表面的方法为:将所得电极浸泡于一抗溶液中,在4℃下过夜;所述一抗溶液的浓度优选为5mg·ml-1;
和/或,所述封闭非特异性位点的方法为:将所得电极在牛血清白蛋白中浸泡,所述牛血清白蛋白的浓度优选为1%,所述浸泡时间优选为25min。
进一步地,所述银纳米颗粒标记的二抗是由以下方法制得的:将二抗与银纳米颗粒混合,在冰浴条件下搅拌,然后离心除去未结合的二抗,再用牛血清白蛋白封闭非特异性位点后,即得;所述搅拌的时间优选为1~3小时,更优选为2小时。
进一步地,所述银纳米颗粒是通过下述方法制得的:在冰浴条件下,将agno3溶液逐滴加入到不断搅拌的nabh4溶液中,持续搅拌至体系颜色变为黄绿色,即得;所述agno3溶液优选为1mm,所述nabh4溶液优选为2mm,所述持续搅拌时间为15min以上。
进一步地,所述过硫酸盐溶液为过硫酸钾溶液,所述过硫酸盐溶液的浓度优选为0.1m,ph优选为7.4。
进一步地,所述一抗为fpsa一抗,所述待测抗原为fpsa抗原,所述二抗为fpsa二抗。
本发明还提供了一种定量检测抗原浓度的方法,所述方法是利用上述基于ecl夹心免疫传感的抗原检测试剂盒进行检测的,具体步骤包括:
(a)各浓度待测抗原的标准溶液下ecl强度的测定:
a1.将待测抗原的标准溶液配置成梯度浓度,然后将一抗修饰的电极在浓度为ci的待测抗原的标准溶液中孵育,得抗原修饰的电极;
a2.将所得抗原修饰的电极在银纳米颗粒标记的二抗中孵育,得到目标电极,利用电化学发光分析仪,在过硫酸盐溶液中,测得目标电极的ecl强度ii;
(b)将待测抗原的标准溶液配置成0ng·ml-1,按照步骤(a)的方法,得到0ng·ml-1浓度下的目标电极的ecl强度i0;
(c)绘制标准曲线:以ecl强度变化值δii为纵坐标,lgci为横坐标,绘制曲线,并进行线性回归,得到标准曲线;其中,δii=ii-i0;
(d)待测抗原浓度的测定:将一抗修饰的电极在待测抗原中孵育,得抗原修饰的电极;将所得抗原修饰的电极在银纳米颗粒标记的二抗中孵育,得到目标电极,利用电化学发光分析仪,在过硫酸盐溶液中,测得目标电极的ecl强度ix;
将δix带入步骤(c)所得标准曲线的纵坐标中,对应得到的横坐标,即为待测抗原浓度的lg值;其中,δix=ix-i0。
进一步地,步骤(a1)中,所述孵育温度为室温,孵育时间为5分钟以上,优选为35分钟以上,更优选为35~45分钟;
和/或,步骤(a2)中,所述孵育温度为室温,孵育时间为5分钟以上,优选为25分钟以上,更优选为25~35分钟。
进一步地,步骤(a)中,ci为0.002~10ng·ml-1;
步骤(a2)、(d)中,所述电化学发光分析仪的测试参数为:在0v~-1.8v的电位范围内进行循环伏安法扫描,扫描速度为0.1v/s,光电倍增管高压为600v。
进一步地,步骤(c)中,所述标准曲线为y=1640.27x+4883.96。
本发明还提供了上述基于ecl夹心免疫传感的抗原检测试剂盒在定量检测抗原浓度中的用途。
本发明中,室温指25±2℃。
本发明中,nano-ag即银纳米颗粒。
本发明首次通过nano-ag在过硫酸钾水溶液中的循环伏安和电致化学发光(ecl)行为阐释了nano-ag对过硫酸钾的催化机理。该催化机理如下:
电化学阳极扫描过程中发生氧化反应,nano-ag被氧化为ag+;阴极扫描过程中发生还原反应,s2o82-被还原为so4·-,继续与hoo·发生反应产生活性氧激发态向基态跃迁发光,ag+在电化学阴极扫描时,电化学还原为ag0,以循环往复促进so4·-的生成,催化过硫酸盐的ecl信号。
ag-e→ag+(1)
s2o82-+e→so4·-+so42-(2)
ag++s2o82-→so4·-+so42-+ag2+(3)
ag++e→ag(4)
so4·-+h2o→ho·+hso4-(5)
ho·→hoo·+h2o(6)
o2+h2o+e→hoo·+ho-(7)
本发明采用新的固相共反应剂nano-ag,通过电化学氧化还原循环往复原位生成的ag+离子催化s2o82-向so4·-的转化,从而增敏s2o82-的ecl信号。
本发明通过电沉积的方法,将金颗粒修饰在玻碳电极(gce)上,然后,通过au-s键将一抗键合到电极表面,bsa封闭非特异性位点,再特异性结合fpsa抗原。最后,nano-ag标记的fpsa二抗与fpsa抗原特异性结合固载到电极表面,构建了基于固相夹心模式ecl免疫传感的目标电极。该目标电极中,nano-ag标记的fpsa二抗能够有效增强过硫酸钾的检测信号,并进一步增强目标电极的灵敏度;同时,随着fpsa抗原浓度的增大,结合到电极表面的nano-ag标记的二抗越多,检测到的ecl强度越强。
实验证明,利用本发明的抗原检测试剂盒定量检测fpsa抗原浓度时,对fpsa抗原检测的线性范围为0.002~10ng·ml-1,检出限为0.7pg·ml-1。与现有技术中的其他的方法相比,本发明基于ecl夹心免疫传感的方法在检测抗原时具有更宽的线性范围和更低的检测限,在临床检测中具有很好的应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
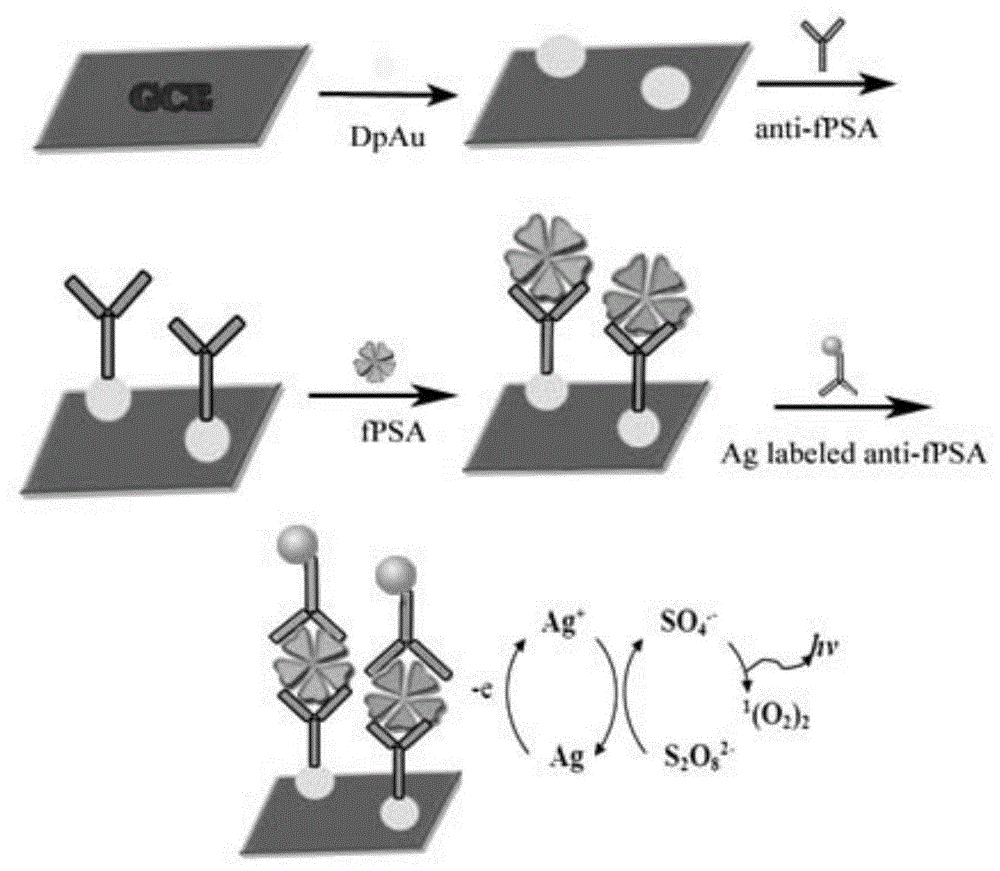
图1:本发明目标电极制备过程示意图。
图2:实验例1电极组装过程中各修饰电极在0.1ms2o82-(pbs,ph7.4)中的ecl强度:(a)裸电极gce,(b)dpau/gce,(c)anti-fpsa/dpau/gce,(d)bsa/anti-fpsa/dpau/gce,(e)fpsa/bsa/anti-fpsa/dpau/gce。
图3:电极逐步组装过程的tem图:(a)dpau/gce,(b)fpsa
/bsa/anti-fpsa/dpau/gce,(c)目标电极;(d)nano-ag溶胶的紫外可见吸收光谱图。
图4:未标记二抗的电极(a)和目标电极(b)在0.1ms2o82-(pbs,ph7.4)中的ecl强度。
图5:一抗修饰电极bsa/anti-fpsa/dpau/gce与fpsa抗原孵育时间优化实验结果。
图6:fpsa抗原修饰的电极fpsa/bsa/anti-fpsa/dpau/gce与nano-ag标记的二抗的孵育时间优化实验结果。
图7:优化目标电极对不同浓度fpsa抗原的ecl响应实验结果。
图8:优化目标电极对不同浓度fpsa抗原ecl响应的标准曲线。
图9:优化目标电极对不同浓度fpsa抗原ecl响应的稳定性结果。
具体实施方式
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
其中,gce电极为玻碳电极,φ=4mm;bsa为牛血清白蛋白,>96%;fpsa为游离前列腺特异抗原;fpsa二抗为labeledanti-fpsa(配对第二抗体),购买于郑州博赛生物工程有限责任公司;fpsa一抗为anti-fpsa(固载抗体),购买于郑州博赛生物工程有限责任公司。
实施例1基于ecl夹心免疫传感的抗原检测试剂盒的制备
本发明的抗原检测试剂盒包括以下组分:(1)一抗修饰的电极;(2)fpsa抗原的标准溶液;(3)银纳米颗粒标记的二抗;(4)过硫酸盐溶液。
第一步,制备一抗修饰的电极:
gce电极的预处理:将裸电极gce先后用0.5μm,0.05μm的al2o3糊抛光,然后依次在蒸馏水、乙醇、蒸馏水中超声洗涤3min,室温下晾干待用。
将预处理好的gce电极浸泡在氯金酸(haucl4,1%)溶液中电沉积一层均匀的金纳米颗粒(电沉积电压-0.2v,电沉积时间30s),记为dpau/gce,用三次水冲洗并于室温下晾干。然后,将修饰的电极dpau/gce浸泡于5mg·ml-1的fpsa一抗溶液中,在4℃下过夜,通过au-s键结合fpsa一抗于修饰电极表面,得anti-fpsa/dpau/gce。用1%bsa封闭多余的纳米金位点25min,得修饰电极bsa/anti-fpsa/dpau/gce,即一抗修饰的电极。
第二步,制备fpsa抗原的标准溶液:
取fpsa抗原标准品,稀释成以下梯度浓度的标准溶液:0ng·ml-1、0.002ng·ml-1、0.005ng·ml-1、0.05ng·ml-1、0.1ng·ml-1、0.5ng·ml-1、1ng·ml-1、5ng·ml-1和10ng·ml-1。
第三步,制备银纳米颗粒标记的二抗:
(a)nano-ag的合成
在合成nano-ag之前,将合成过程中使用的容器都预先用配置好的铬酸洗液浸泡,自来水冲洗干净后再用三次水冲洗,置于室温晾干备用。
在冰浴条件下,将10ml1mmagno3水溶液逐滴加入到不断搅拌的30ml2mmnabh4中,持续搅拌15min至溶胶颜色变为黄绿色,表明nano-ag生成,得到nano-ag溶胶,待用。
利用紫外可见吸收光谱图对所得nano-ag溶胶进行测试,结果如图3d所示,可以看出nano-ag的特征吸收峰位置在400nm左右,与文献报道相一致,表明黄绿色溶胶确实为银纳米颗粒nano-ag。
(b)nano-ag标记的二抗的制备
将20ul5mg·ml-1的fpsa二抗加入到3ml步骤1所得的nano-ag溶胶中,在冰浴条件下持续搅拌2h使nano-ag结合到fpsa二抗上。然后,在3000rpm转速下离心15min,除去未结合的fpsa二抗分子。
用bsa(200μl1%)封闭非特异性结合位点并分散nano-ag标记的二抗,4℃下保存备用。
第四步,制备过硫酸盐溶液:
取k2s2o8,用磷酸缓冲溶液(pbs)配置成0.1m,ph7.4的溶液。
以下通过实验例证明本发明的有益效果。
实验例1抗原检测试剂盒发生免疫反应时电极组装过程的ecl信号变化1、测试方法
为了研究本发明抗原检测试剂盒发生免疫反应时电极组装过程中所得各修饰电极的ecl强度变化,取实施例1抗原检测试剂盒中一抗修饰电极(bsa/anti-fpsa/dpau/gce),于25℃下将bsa/anti-fpsa/dpau/gce浸泡在20μl40ng·ml-1fpsa抗原溶液中孵育40min,用pbs(ph7.4)缓冲液冲洗掉非特异性结合的抗原,得到fpsa抗原修饰的电极(fpsa/bsa/anti-fpsa/dpau/gce)。然后将fpsa/bsa/anti-fpsa/dpau/gce于25℃下与20μlnano-ag标记的二抗孵育40min,用pbs(ph7.4)缓冲液冲洗后,得到目标电极。
取以下各电极:(a)裸电极gce,(b)dpau/gce,(c)anti-fpsa/dpau/gce,(d)bsa/anti-fpsa/dpau/gce,(e)fpsa/bsa/anti-fpsa/dpau/gce,用电化学发光分析仪(mpi-e型电化学发光分析仪,西安瑞迈电子科学技术有限公司),在0.1mk2s2o8(pbs,ph7.4)溶液中,在0v~-1.8v的电位范围内进行循环伏安法扫描,扫描速度为0.1v/s,光电倍增管高压为600v,分别测定其ecl强度。
2、测试结果
结果如图2所示。曲线a是裸电极gce在0.1ms2o82-(pbs,ph7.4)中的比较弱的发光信号,当电极表面电沉积一层纳米金颗粒后,s2o82-的ecl强度显著增加(曲线b),这是由于nano-au促进电子传递,增加了单位时间内激发态数目。当继续孵育上fpsa一抗(曲线c)和用bsa封闭多余的纳米金位点后(曲线d),ecl信号相继减小,这是因为抗体蛋白质和bsa蛋白质阻碍了s2o82-向电极表面的扩散。当fpsa抗原孵育到电极表面后,由于免疫复合物的作用ecl信号继续减小(曲线e)。目标电极逐步组装过程的ecl信号变化与理论相符,表明目标电极的成功组装(组装示意图如图1所示)。所以,本发明的抗原检测试剂盒能够通过免疫反应实现电极的组装,并在电极组装过程中表现出不同的ecl信号。
实验例2抗原检测试剂盒免疫反应时电极逐步组装过程的tem图
1、测试方法
为了研究本发明的抗原检测试剂盒发生免疫反应时电极组装过程中所得各修饰电极的形貌变化,按照实验例1相同的方法,制得目标电极。
取以下各修饰电极:(a)dpau/gce,(b)fpsa/bsa/anti-fpsa/dpau/gce,(c)目标电极,用缓冲溶液冲洗,除去非特异性吸附后,用tem表征修饰电极表面的外观形貌。
2、测试结果
结果如图3a~3c所示。图3a为电极表面电沉积形成的荷花状的金颗粒(dpau/gce)。图3b为电极表面修饰了蛋白复合层fpsa/bsa/anti-fpsa/dpau/gce后的形貌。蛋白复合层为绝缘体,在扫描电镜下不导电,形成半透明膜覆盖在金颗粒表面,说明蛋白复合层成功固载到了电极表面。当nano-ag标记的二抗通过特异性反应与fpsa/bsa/anti-fpsa/dpau/gce上的fpsa抗原结合后,大量粒径约为20nm左右的纳米颗粒均匀分布在电极表面(图3c),说明nano-ag标记的二抗已经成功与抗原特异性结合,表明利用本发明的抗原检测试剂盒能够组装得到基于ecl夹心免疫传感的目标电极。
实验例3抗原检测试剂盒免疫反应过程中的ecl增敏作用
1、测试方法
为了进一步研究本发明的抗原检测试剂盒发生免疫反应后所得电极ecl变化的原因,按照实验例1相同的方法,制得目标电极。
另外,参照实验例1的方法,将nano-ag标记的二抗替换为fpsa二抗(即没有被nano-ag标记的fpsa二抗),制得未标记二抗的电极。
分别以上述未标记二抗的电极和目标电极为对象,用电化学发光分析仪,在0.1mk2s2o8(pbs,ph7.4)溶液中,在0v~-1.8v的电位范围内进行循环伏安法扫描,扫描速度为0.1v/s,光电倍增管高压为600v,分别测定其ecl强度。
2、测试结果
结果如图4所示。从图中可以明显地看出,目标电极的ecl强度显著高于未标记二抗的电极。这是因为当未被标记的二抗特异性与fpsa抗原结合固载到电极表面时,由于蛋白质的电子阻碍作用,ecl信号降低。然而,当被nano-ag标记的二抗结合到电极表面后,ecl强度明显增高。所以,nano-ag对目标电极在过硫酸钾中的ecl起到了明显的增敏作用。
实验例4免疫反应实验条件的筛选
1、一抗与抗原孵育时间的优化
(1)实验方法
参照实验例1的方法,将一抗修饰电极bsa/anti-fpsa/dpau/gce与fpsa抗原溶液的孵育时间分别设置为0min、5min、10min、15min、20min、25min、30min、35min、40min和45min,得到不同的目标电极。
然后将上述目标电极分别在0.1mk2s2o8(pbs,ph7.4)溶液中测定其ecl强度。
(2)实验结果
如图5所示,可以看出,随着孵育时间的增加,s2o82-的ecl强度逐渐减小。当孵育时间延长到35min时,s2o82-的ecl信号强度基本上保持稳定,这表明,当孵育时间达到35min时,电极表面fpsa一抗与fpsa抗原的键合达到饱和,因此,选用35min作为一抗修饰电极bsa/anti-fpsa/dpau/gce与fpsa抗原溶液的最佳孵育时间。
2、二抗与抗原孵育时间的优化
(1)实验方法
参照实验例1的方法,将fpsa抗原修饰的电极fpsa/bsa/anti-fpsa/dpau/gce与nano-ag标记二抗的孵育分别设置为0min、5min、10min、15min、20min、25min、30min和35min,得到不同的目标电极。
然后将上述目标电极分别在0.1mk2s2o8(pbs,ph7.4)溶液中,在0v~-1.8v的电位范围内进行循环伏安法扫描,扫描速度为0.1v/s,光电倍增管高压为600v,测定其ecl强度。
(2)实验结果
如图6所示,可以看出,随着二抗与抗原孵育时间增加,s2o82-的ecl强度逐渐增高。但是,当孵育时间延长到25min时,s2o82-的ecl信号强度基本上保持稳定,这表明,当孵育时间达到25min时,fpsa抗原与fpsa二抗的键合达到饱和。因此,选用25min作为fpsa抗原修饰的电极fpsa/bsa/anti-fpsa/dpau/gce与nano-ag标记的二抗的最佳孵育时间。
实验例5不同浓度fpsa抗原的ecl响应标准曲线的建立
1、实验方法
为了研究目标电极对不同fpsa抗原浓度的ecl响应,参照实验例1的方法和实验例4中的优化实验条件,将实验例1中一抗修饰电极bsa/anti-fpsa/dpau/gce与fpsa抗原溶液的孵育时间确定为35min,将fpsa抗原修饰的电极fpsa/bsa/anti-fpsa/dpau/gce与nano-ag标记的二抗的孵育时间确定为25min,将fpsa抗原溶液的浓度分别设置为0ng·ml-1、0.002ng·ml-1、0.005ng·ml-1、0.05ng·ml-1、0.1ng·ml-1、0.5ng·ml-1、1ng·ml-1、5ng·ml-1和10ng·ml-1,得到不同的优化目标电极。
用电化学发光分析仪,在0.1mk2s2o8(pbs,ph7.4)溶液中,在0v~-1.8v的电位范围内进行循环伏安法扫描,扫描速度为0.1v/s,光电倍增管高压为600v,分别测定上述优化目标电极的ecl强度ii。同时,用相同条件下孵育0ng·ml-1fpsa抗原所得的电极做空白样品对照,并记录其对应的ecl强度,记为i0。扣除空白信号后,优化目标电极对不同浓度抗原的ecl信号响应记录为:
δii=ii-i0(i=1,2,3…9)
2、实验结果
优化目标电极随fpsa抗原浓度变化的ecl响应电位-ecl强度图见图7。可以看出随fpsa抗原浓度增加,免疫结合到电极表面的nano-ag标记二抗增加,目标电极响应的ecl强度明显增加。基于nano-ag对过硫酸盐的ecl催化,可明显放大响应信号。这是因为随着fpsa抗原浓度的增大,结合到电极表面的nano-ag标记的二抗越多,检测到的ecl强度增强,可以进一步以此来定量检测fpsa抗原。对上述结果进行处理,以fpsa抗原浓度(ci)的对数值lgci为横坐标,该fpsa抗原浓度下测得的电化学发光强度的变化值δii为纵坐标,得到优化目标电极对fpsa抗原标准溶液检测的标准曲线(如图8所示)。
图8所示标准曲线的线性响应方程为y=1640.27x+4883.96,线性相关系数为r=0.9987。其中,y表示电化学发光强度的变化值δi,x表示fpsa抗原浓度的对数值lgc。本实验制得的优化目标电极对fpsa抗原检测的线性范围为0.002~10ng·ml-1,检出限为0.7pg·ml-1(信噪比s/n=3)。如表1所示,本发明的检测试剂盒对fpsa抗原的检出限远低于现有技术中其他分析方法对fpsa抗原的检出限。
表1本发明检测试剂盒与其他方法对比的fpsa检测限
实验例6本发明基于ecl夹心免疫传感检测方法的稳定性测试
1、实验方法
采用实验例5中的方法,制得优化目标电极,检测不同浓度fpsa抗原的ecl信号强度,以评估基于本发明检测试剂盒的检测方法的稳定性。选取的用来进行稳定性测试的fpsa抗原浓度分别为0.005ng·ml-1、0.1ng·ml-1、和5ng·ml-1,每一个浓度平行5次测定,ecl强度的测定条件为:用电化学发光分析仪在0.1mk2s2o8(pbs,ph7.4)溶液中,在0v~-1.8v的电位范围内进行循环伏安法扫描,扫描速度为0.1v/s,光电倍增管高压为600v。
2、实验结果
从图9中可以看出,随着抗原浓度的增加,电化学发光信号强度也随着增大。每一个特定浓度5次平行测定的相对标准偏差(rsd)均小于2.05%,表明该检测方法有良好的稳定性,能够用于fpsa抗原浓度的定量检测。
实验例7本发明基于ecl夹心免疫传感的检测方法的选择性测试1、实验方法
采用标准加入法考察基于本发明检测试剂盒的检测方法的选择性,具体方法操作为:将fpsa标准抗原溶液加入到两倍于该fpsa抗原加标浓度的cea、afp和bsa蛋白混合溶液中,以模拟人血清环境,使最终混合溶液中fpsa抗原浓度分别为0.05ng·ml-1、0.10ng·ml-1、1.00ng·ml-1、10.00ng·ml-1,利用实验例5优化实验条件下所得的标准曲线,在优化实验条件下测定fpsa抗原浓度,计算回收率,结果见表2。
回收率=found(ng·ml-1)÷add(ng·ml-1)×100%
其中,found为测得的fpsa抗原浓度,add为混合溶液中理论的fpsa抗原浓度。
2、实验结果
从表2中可以看出,不同浓度fpsa抗原下测得回收率在96.8%到108.0%之间。表明该检测方法对fpsa抗原测定具有良好的选择性,可用于实际样品的检测。
表2测定混合溶液中fpsa抗原的加标回收率
综上,本发明提供了一种基于ecl夹心免疫传感的抗原检测试剂盒,该抗原检测试剂盒中,银纳米颗粒标记的二抗能够有效增强过硫酸钾的检测信号,增强免疫传感的灵敏度。实验证明,利用本发明的抗原检测试剂盒定量检测fpsa抗原浓度时,对fpsa抗原检测的线性范围为0.002~10ng·ml-1,检出限为0.7pg·ml-1。与现有技术中的其他的方法相比,本发明基于ecl夹心免疫传感的方法在检测抗原时具有更宽的线性范围和更低的检测限,在临床检测中具有很好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!