一种检测钾离子和钠离子浓度的电化学试条及其检测方法与流程
本发明涉及电化学检测
技术领域:
,更具体地,涉及一种检测钾离子和钠离子浓度的电化学试条及其检测方法。
背景技术:
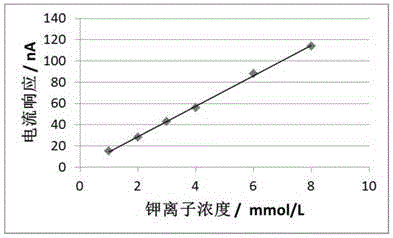
:钾离子和钠离子为人体不可缺少的常量元素,作为血液中电解质的重要组成成分,钾离子和钠离子与人体内各种生物化学反应和生命活动密切相关。当血液中钾离子和钠离子浓度过高或过低时会引起相关生理疾病,如对心脏和血压正常功能造成危害,严重时可能出现急性致死的风险。故血液中钾离子和钠离子浓度的检测具有重要的临床意义。目前,常用的检测血液中钾离子和钠离子浓度的商品化仪器主要有基于离子选择性电极法的电解质测试仪以及基于酶法的生化仪等,上述方法需要专业的人员操作,过程复杂,检测时间过长,不能满足急诊或现场检测对仪器小型化、快速化和简便化的需求。此外,对于某些慢性低血钾患者需要长期补钾,定期检测体内血钾的浓度,而目前的电解质测试仪不适合家用,导致患者需要前往医院抽取静脉血检测,影响了患者的生活质量。并且由于高浓度的钠离子也能激活丙酮酸激酶的活性,对钾离子的准确测量尤其是低浓度钾离子的测量产生较大的正干扰,对钠离子浓度检测和对钾离子浓度检测需要分组进行检测,导致使用操作麻烦,耗费时间,增加检测成本。故开发出一种可同时检测全血中钾离子和钠离子浓度的适合医用和家用的手持式快速检测系统具有很强的必要性和创新性。技术实现要素:本发明要解决的技术问题是针对现有技术对全血钾离子浓度和钠离子浓度检测效率低的不足,提供一种同时检测钾离子和钠离子浓度的电化学试条。本发明要解决的另一技术问题是一种同时检测钾离子和钠离子浓度的电化学试条的检测方法。本发明的目的通过以下技术方案予以实现:一种检测钾离子和钠离子浓度的电化学试条,所述电化学试条包括工作电极和参比电极,所述工作电极包括第一工作电极和第二工作电极,第一工作电极修饰有检测钾离子浓度的酶膜,所述酶膜包含有丙酮酸激酶和丙酮酸氧化酶;第二工作电极修饰有检测钠离子浓度的酶膜,所述酶膜包含有β-半乳糖苷酶和半乳糖酶氧化酶。进一步地,所述检测钾离子浓度的酶膜的生物反应膜液原料包括丙酮酸激酶、丙酮酸氧化酶、过氧化物酶、粘结剂、表面活性剂、辅因子、电子媒介体、填充剂和溶剂。进一步地,所述检测钾离子浓度的酶膜的生物反应膜液原料包括丙酮酸激酶0.6~1.4wt.%、丙酮酸氧化酶0.5~1.5wt.%、过氧化物酶0.6~1.4wt.%、粘结剂3~8wt.%、表面活性剂0.1~0.3wt.%、辅因子1.6~2.4wt.%、电子媒介体0.8~1.2wt.%、填充剂3~8wt.%和溶剂余量。优选地,所述检测钾离子浓度的酶膜的生物反应膜液原料包括丙酮酸激酶1wt.%、丙酮酸氧化酶1wt.%、过氧化物酶1wt.%、粘结剂5wt.%、表面活性剂0.2wt.%、辅因子2wt.%、电子媒介体1wt.%、填充剂5wt.%和溶剂余量。进一步地,所述辅因子包括磷酸烯醇式丙酮酸、二磷酸腺苷、磷酸二氢镁和kryptoflxk221的一种或多种。本发明利用钾离子激活丙酮酸激酶的活性,且其活性与钾离子的浓度相关,激活后的丙酮酸激酶催化磷酸烯醇式丙酮酸和二磷酸腺苷产生丙酮酸,丙酮酸氧化酶催化丙酮酸、无机磷和氧气反应生成双氧水,过氧化物酶催化双氧水与还原性电子媒介体反应产生氧化性电子媒介体,再通过负电位测量氧化型电子媒介体的还原电流,从而得到与钾离子浓度成线性关系的电流值,实现对血液中钾离子浓度的定量检测。进一步地,所述检测钠离子浓度的酶膜的生物反应膜液原料包括β-半乳糖苷酶、半乳糖酶氧化酶、过氧化物酶、粘结剂、表面活性剂、辅因子、电子媒介体、填充剂和溶剂。进一步地,所述检测钠离子浓度的酶膜的生物反应膜液原料包括β-半乳糖苷酶1.0~1.5wt.%、半乳糖酶氧化酶0.5~1.5wt.%、过氧化物酶0.5~1.5wt.%、粘结剂3~8wt.%、表面活性剂0.1~0.3wt.%、辅因子2.0~30wt.%、电子媒介体0.8~1.2wt.%、填充剂3~8wt.%和溶剂余量。优选地,所述检测钠离子浓度的酶膜的生物反应膜液原料包括β-半乳糖苷酶1.2wt.%、半乳糖酶氧化酶1wt.%、过氧化物酶1wt.%、粘结剂5wt.%、表面活性剂0.2wt.%、辅因子2.4wt.%、电子媒介体1wt.%、填充剂5wt.%和溶剂余量。进一步地,所述辅因子包括o-硝基酚-β-d-吡喃半乳糖、乙二醇二乙醚二胺四乙酸锂、硫酸镁、氯化锂和kryptoflxk221。进一步地,所述粘结剂为羟乙基纤维素、羧甲基纤维素、海藻酸钠、聚乙烯醇的一种或多种;所述表面活性剂为triton-100、吐温、span的一种或多种;所述电子媒介体为2,2’-连氮-双(3-乙基苯并噻唑-6-磺酸)二胺盐、对苯酚、二氨基联苯胺、邻苯二胺、4-氯-1萘酚的一种或多种;所述填充剂为乳糖、蔗糖、半乳糖、葡萄糖、麦芽糖的一种或多种。本发明利用钠离子激活β-半乳糖苷酶的活性,且其活性与钠离子的浓度相关,激活后的β-半乳糖苷酶催化底物o-硝基酚-β-d-吡喃半乳糖产生o-硝基酚和半乳糖,半乳糖经半乳糖酶氧化酶作用生成半乳糖己二醛糖和双氧水,过氧化物酶催化双氧水与还原性电子媒介体反应产生氧化性电子媒介体,再通过负电位测量氧化型电子媒介体的还原电流,从而得到与钠离子浓度成线性关系的电流值,实现对血液中钠离子浓度的定量检测。进一步地,所述参比电极的生物反应膜的原料包括羟乙基纤维素3~8wt.%、triton-100有0.1~0.3wt.%、硫酸镁0.3~0.8wt.%、2,2’-连氮-双(3-乙基苯并噻唑-6-磺酸)二胺盐0.8~1.5wt.%、乳糖5~10wt.%和tris缓冲液余量。进一步地,电极的导电材料可为碳材料、金、铂、钯等导电物质。进一步地,所述电化学试条可通过行业类熟知的类似血糖试条的组装方法制造,电化学测试条可通过虹吸作用自动吸入样本。根据上述的电化学试条用于同时检测血液中的钠离子浓度和钾离子浓度。由于高浓度的钠离子也能激活丙酮酸激酶的活性,对钾离子的准确测量尤其是低浓度钾离子的测量产生较大的正干扰,本发明还提供了检测钾离子和钠离子浓度的检测方法,用于校正钠离子对钾离子测试的正干扰,提高钾离子测量的准确性。利用所述电化学试条分别测量钾离子传感器工作电极表面的电流响应iw-k+,钠离子传感器工作电极表面的电流响应iw-na+,以及由于钠离子的干扰所引起的钾离子传感器工作电极表面的正干扰电流△i,建立iw-na+和△i之间的函数关系式△i=f(iw-na+),通过iw-na+计算出相应的△i值,得到与钾离子浓度相对应的真实校正电流响应iw-c-k+,其中iw-c-k+=iw-k+-△i,其具体检测步骤包括:s1.配置钾离子和钠离子的静脉全血样本,记为s1,其中钾离子浓度为m1,钠离子浓度为n1,再向其中加入nacl,使静脉全血中钠离子浓度依次增大,分别标记各浓度样本为s2、s3、s4、s5、s6···sn;s2.采用电化学测试法分别测量试条表面钾离子工作电极的电流响应(iw-k+)和钠离子工作电极的电流响应(iw-na+),分别记为s1(iw-k+-1、iw-na+-1)、s2(iw-k+-2、iw-na+-2)、s3(iw-k+-3、iw-na+-3)、s4(iw-k+-4、iw-na+-4)、s5(iw-k+-5、iw-na+-5)、s6(iw-k+-6、iw-na+-6)···sn(iw-k+-n、iw-na+-n);s3.以s1样本中钠离子浓度最低的样本为背景浓度,此时规定由钠离子的干扰所引起的钾离子传感器工作电极表面的正干扰电流△i-1=0;s2样本中(iw-k+-2、iw-na+-2)所导致的钾离子工作电极电流响应的增加值△i-2=iw-k+-2—iw-k+-1;s3样本中(iw-k+-3、iw-na+-3)所导致的钾离子工作电极电流响应的增加值△i-3=iw-k+-3—iw-k+-1;依次类推,可以计算出随着钠离子浓度增大所导致的钾离子工作电极表面的电流响应增加值△i-ns4.通过步骤(3)获取不同iw-na+下对应的△i,建立iw-na+和△i之间的函数关系式△i=f(iw-na+),计算出相应的△i值,通过iw-c-k+=iw-k+-△i得到与钾离子浓度相对应的真实校正电流响应。与现有技术相比,有益效果是:本发明创造性的提供一种包含有第一工作电极、第二工作电极和一个参比电极的电化学试条,第一工作电极表面修饰有检测血液中钾离子浓度的酶膜,第二工作电极修饰有检测血液中钠离子浓度的酶膜,用于同时检测全血中钾离子和钠离子浓度。本发明通过血液中的钾离子激活丙酮酸激酶的活性,利用其活性与钾离子的浓度相关的特性,通过激活后的丙酮酸激酶通过一系列的催化作用,从而得到与钾离子浓度成线性关系的电流值,实现对血液中钾离子浓度的定量检测。同时利用钠离子激活β-半乳糖苷酶的活性,其活性与钠离子的浓度相关的特性,激活后的β-半乳糖苷酶通过一系列的催化作用,从而得到与钠离子浓度成线性关系的电流值,实现对血液中钠离子浓度的定量检测。本发明利用所述电化学试条分别测量钾离子传感器工作电极表面的电流响应和钠离子传感器工作电极表面的电流响应,与干扰电流建立关系式,得到在钠离子影响下与钾离子浓度相对应的真实校正电流响应。本发明所述的检测方法减小钠离子对钾离子测量的正干扰,提高了钾离子测量的准确度,实现了钾离子和钠离子双指标的一体化快速准确度检测。附图说明图1是本发明电化学试条的电流响应与钾离子浓度的线性关系;图2是本发明电化学试条的电流响应与钠离子浓度的线性关系;图3是本发明所制电化学试条与酶法试剂盒对钾离子浓度检测结果的相关性;图4是本发明所制电化学试条与离子选择性电极法对钾离子浓度检测结果的相关性;图5是本发明所制电化学试条与酶法试剂盒对钠离子浓度检测结果的相关性;图6是本发明所制电化学试条与离子选择性电极法对钠离子浓度检测结果的相关性。具体实施方式下面结合实施例进一步解释和阐明,但具体实施例并不对本发明有任何形式的限定。若未特别指明,实施例中所用的方法和设备为本领常规方法和设备,所用原料均为常规市售原料。实施例1本实施例提供第一工作电极的检测钾离子浓度的酶膜的原料及制备方法,其生物反应膜的原料下表1所示:表1制备步骤包括:取tris缓冲液,加入羟乙基纤维素、乳糖和triton-100,搅拌5小时后溶解完全。然后依次加入磷酸烯醇式丙酮酸,二磷酸腺苷,磷酸二氢镁,kryptoflxk221和2,2’-连氮-双(3-乙基苯并噻唑-6-磺酸)二胺盐,搅拌溶解。最后,加入丙酮酸激酶、丙酮酸氧化酶和过氧化物酶,搅拌溶解,获得钾离子传感器工作电极酶膜反应膜液。第一工作电极表面修饰钾离子传感器工作电极酶膜反应液,置于37℃下烘干6min,按常规方法组装好后获得电化学测试条。其中所述粘结剂还可以为羧甲基纤维素、海藻酸钠、聚乙烯醇;所述表面活性剂还可为吐温、span;所述电子媒介体还可为对苯酚、二氨基联苯胺、邻苯二胺、4-氯-1萘酚;所述填充剂还可为蔗糖、半乳糖、葡萄糖、麦芽糖。实施例2本实施例提供第二工作电极的检测钠离子浓度的酶膜的原料及制备方法,其生物反应膜的原料下表2所示:表2制备步骤包括:取tris缓冲液,加入羟乙基纤维素、乳糖和triton-100,搅拌5小时后溶解完全。然后依次加入o-硝基酚-β-d-吡喃半乳糖,乙二醇二乙醚二胺四乙酸锂,硫酸镁,氯化锂,kryptoflxk221和2,2’-连氮-双(3-乙基苯并噻唑-6-磺酸)二胺盐,搅拌溶解。最后,加入β-半乳糖苷酶、半乳糖酶氧化酶和过氧化物酶,搅拌溶解,获得钠离子传感器工作电极酶膜反应膜液。第二工作电极表面修饰钾离子传感器工作电极酶膜反应液,置于37℃下烘干6min,按常规方法组装好后获得电化学测试条。其中所述粘结剂还可以为羧甲基纤维素、海藻酸钠、聚乙烯醇;所述表面活性剂还可为吐温、span;所述电子媒介体还可为对苯酚、二氨基联苯胺、邻苯二胺、4-氯-1萘酚;所述填充剂还可为蔗糖、半乳糖、葡萄糖、麦芽糖。实施例3本实施例提供参比电极的酶膜的原料及制备方法,其生物反应膜的原料下表3所示:表3组分含量粘结剂羟乙基纤维素5%表面活性剂triton-1000.2%辅因子硫酸镁0.5%电子媒介体2,2’-连氮-双(3-乙基苯并噻唑-6-磺酸)二胺盐1%填充剂乳糖8%溶剂tris缓冲液85.3%制备步骤包括:取85.3mltris缓冲液,加入5g羟乙基纤维素、8g乳糖和0.2gtriton-100,搅拌5小时后溶解完全。然后,依次加入0.5g硫酸镁和1g2,2’-连氮-双(3-乙基苯并噻唑-6-磺酸)二胺盐,搅拌溶解。获得参比电极酶膜反应膜液,参比电极表面修饰反应液,置于37℃下烘干6min,按常规方法组装好后获得电化学测试条。其中所述粘结剂还可以为羧甲基纤维素、海藻酸钠、聚乙烯醇;所述表面活性剂还可为吐温、span;所述电子媒介体还可为对苯酚、二氨基联苯胺、邻苯二胺、4-氯-1萘酚;所述填充剂还可为蔗糖、半乳糖、葡萄糖、麦芽糖。实施例4本实施例提供对钾离子的电化学响应的检测,步骤包括:取一定体积的新鲜静脉血样本,样本中钠离子浓度为低浓度背景值,配置含有不同浓度钾离子的静脉血样本,钾离子浓度分别为1.0mmol/l、2.0mmol/l、3.0mmol/l、4.0mmol/l、6.0mmol/l和8.0mmol/l。利用虹吸作用,实施例2提供的电化学测试条的液腔自动吸入约10μl静脉全血样本,采用chi电化学工作站(上海辰华,型号760e)测量实施例2提供的电化学测试条对不同浓度钾离子的电流响应iw-k+,在第一工作电极表面施加电位为-0.2v,测定时间为30s,所得结果如下表4所示:表4钾离子浓度(mmol/l)电流响应(na)1.0152.0283.0434.0566.0888.0114如表4和图1所示,在钾离子的浓度为1.0-8.0mmol/l时,电流响应与钾离子浓度成线性关系,线性关系式为y=14.353x-0.0784,r2=0.999。实施例5本实施例提供对钠离子的电化学响应的检测,步骤包括:取一定体积的新鲜静脉血样本,以钾离子浓度为低浓度背景值,配制不同浓度钠离子的静脉血样本,钠离子浓度分别为100mmol/l、110mmol/l、130mmol/l、150mmol/l、160mmol/l和170mmol/l。利用虹吸作用自动吸入约10μl静脉全血样本,采用chi电化学工作站(上海辰华,型号760e)测量实施例1~3提供的电化学测试条对不同浓度钠离子的电流响应iw-na+,在第二工作电极表面施加电位为-0.2v,测定时间为30s,所得结果如下表5所示:表5钠离子浓度(mmol/l)电流响应(na)1008011093130112150132160143170160由表5和图2所示,在钠离子的浓度为100~170mmol/l时,电流响应与钠离子浓度成线性关系,线性关系式为y=1.0856x-28.364,r2=0.9935。实施例6本实施例提供减小钠离子对钾离子测量的正干扰的步骤为:取一定体积的新鲜静脉血样本,使样本中钾离子浓度为1.0mm,钠离子浓度为100mm,再向其中加入不同浓度的nacl,使静脉全血中钠离子浓度分别为110mmol/l、120mmol/l、140mmol/l、150mmol/l和170mmol/l。利用虹吸作用自动吸入约10μl静脉全血样本,采用chi电化学工作站(上海辰华,型号760e)测量实施例1~3提供的电化学测试条表面钾离子工作电极(iw-k+)和钠离子工作电极(iw-na+)的电流响应,在第一工作电极(钾离子工作电极)表面和第二工作电极(钠离子工作电极)表面同时施加电位为-0.2v,测定时间为30s,得到iw-k+和iw-na+,计算出相应的△i,所得数据下表6所示。将表中的iw-na+和△i进行数据拟合,得到具体的函数关系式为△i=-0.0023(iw-na+)2+0.8451(iw-na+)-54.309,其中iw-na+≤80时△i=0。实际测量时,由iw-na+计算出△i的值,再对iw-k+进行校正得iw-c-k+。为了表明本发明所述电化学测量方法可显著降低钠离子对钾离子测量结果的干扰,考察了校正和未校正条件下,钾离子的测量偏差。将测量结果大于10%的钾离子浓度输出改变定义为显著干扰,测量结果如表7所示。表7模式钾离子浓度(mmol/l)产生显著干扰时的钠离子浓度(mmol/l)未校正1.0106未校正2.0110未校正4.0115未校正6.0142校正1.0128校正2.0137校正4.0148校正6.0163由表7结果可知,对iw-k+进行校正后,使用本发明所述电化学测量方法测量钾离子时可显著提高抗钠离子干扰的能力。实施例6本实施例提供对钠离子和钾离子同时检测的方法,步骤为:取静脉血样本,采用实施例1~3中所制的电化学试条同时检测样本中钾离子和钠离子的浓度。利用虹吸作用,自动吸入约10μl静脉全血样本,采用chi电化学工作站(上海辰华,型号760e)测量实施例1~3提供的电化学测试条对不同浓度钾离子和钠离子的电流响应,在第一工作电极表面和第二工作电极表面同时施加电位为-0.2v,测定时间为30s。使用实施例6中的电化学测试方法对第一工作电极表面测得的电流响应iw-k+进行校正得iw-c-k+,再将iw-c-k+带入实施例4中所得线性关系(y=14.353x-0.0784,r2=0.999),得样本中钾离子浓度。将第二工作电极表面测得的电流响应iw-na+带入实施例5中所得线性关系(y=1.0856x-28.364,r2=0.9935),得样本中钠离子浓度。取5组静脉血样品,分别采用本发明的检测方法、在全自动生化仪上(迈瑞bs-350)采用钾离子酶法试剂盒(中生北控生物科技股份有限公司)和钠离子酶法试剂盒(中生北控生物科技股份有限公司)测定样本中的钾离子和钠离子浓度以及采用基于离子选择性电极法原理的电解质分析仪(nova4analyzer)检测样本中的钾离子和钠离子浓度,结果如下表8所示:表8从表8和图3~6可知,本发明所制电化学试条分别对钾离子和钠离子的检测结果与酶法试剂盒和离子选择性电极法检测结果的相关性好,相关系数r2均大于0.99,相关性良好,可用于临床检测。显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1