一种基于回音壁模式光学微腔的外泌体检测方法与流程
本发明是一种利用回音壁模式的微腔对细胞分泌物外泌体进行检测,主要涉及的技术包括细胞激光器原理和外泌体与微腔的检测识别方法,属于激光技术与生物医学光子学领域。
背景技术:
回音壁模式光学微腔(微球腔,微环腔,微盘腔等),具有极小的模式体积,超高q值、超高的能量密度和极窄的线宽等优越特性,因此成为最有发展潜力的光学器件之一。微腔作为一种特殊的光学谐振腔,当激光耦合进微腔内部时,且在满足全反射和相位匹配的条件下,光信号在微腔内通过边界连续全反射,将光子长时间的局域在微腔内形成回音壁模式的介质谐振腔,在外界激励下当增益大于损耗时,就会输出新的波段激光信号。
光学微腔因其微小,灵敏等优点广泛应用于生物传感和检测。检测原理是光耦合进微腔中满足谐振条件,在微腔表面发生全反射形成约200nm的倏逝波,当微腔与待测物结合时,微腔内部的光运动轨道长度会增加且周围折射率也会发生变化,不同物质导致折射率发生的变化不同,此时即可通过波谱的位移来确定待测物的存在。
外泌体属于细胞分泌物,由脂质双层包围的细胞外囊泡,尺寸为20-170nm,包含蛋白质和核酸。且除了自身携带标记蛋白和反映细胞来源的组织或细胞类型特异性蛋白外,还含有各种mrna、microrna及sirnas等。它们由所有细胞分泌并广泛的存在于体液中,其中包括血液、泪液、唾液、尿液、乳汁、脑脊液和腹液等。因此关于对外泌体的检测发现,有助于对人类生命体的探索发现。
当光束在微腔内壁发生全反射行走一圈的光程是波长的整数倍时候,会发生共振现象,将谐振光子长时间的限制在微米尺度,也就使得谐振模式范围内的物质与光子多次发生相互作用。2016年,frankvollmer小组基于回音壁模式的微球腔与金纳米棒的等离激元谐振耦合,通过回音壁谐振频率用移动成功在水溶液中检测到单个原子离子。
本发明是基于此背景产生的。
技术实现要素:
本发明是一种基于回音壁模式通过检测细胞分泌物外泌体来进行细胞探索的方法属于激光技术与生物医学领域的交叉领域。方法包括以下几点:(1)回音壁微腔的选取;(2)微腔的表面修饰选择;(3)微腔与待测细胞外泌体的识别探测方法。本发明可通过纳米级的激发波长位移变化实现高灵敏度检测,能够在细胞外进行识别检测。回音壁模式使荧光在腔内形成谐振,产生激光,延长了跟踪检测时间并根据增强的检测信号实现跟踪识别的功能。
具体包括以下步骤:
步骤1:该实验所使用的微腔可以为微球腔、微环腔、微盘腔、等固态微腔,微腔的制作材料可以是传播损耗较小的硅类化合物、无定型玻璃材料和聚合物材料等,通过高温熔融和溶胶凝胶法制备微腔。在微腔内可以选择掺杂染料、量子点、荧光蛋白等其中的一种荧光物质。用符合相应条件波长的激光耦合进微腔内形成谐振,达到阈值条件时激发出激光。
步骤2:将荧光微腔表面进行功能化处理,购买羧基修饰或氨基修饰的荧光微腔,然后与氨基或者羧基修饰的适体或者特异性抗体蛋白经过氨基和羧基的共价偶联的结合,从而使荧光微腔可以特异性识别待检测的不同细胞的外泌体。
步骤3:将修饰羧基或氨基的荧光微腔与能够和相应的细胞外泌体发生特异性结合的氨基或者羧基修饰的适体或特异性抗体蛋白进行共价偶联。经过2-4小时,羧基或者氨基修饰的荧光微腔与氨基或者羧基修饰的适体发生特异性识别,氨基羧基经脱水缩合反应连接在一起;将连接好的微腔-适体与相应的细胞提取的外泌体一起孵育0.5个小时,适体与相应的外泌体的表面发生特异性识别并结合。或者将购买的修饰了具有特异性识别外泌体外表抗原的抗体的荧光微腔与外泌体进行混合孵育0.5小时,通过共聚焦检测验证连接成功后接下来用激光器照射微球。激发荧光耦合进微球内产生回音壁模式下的激光,外接光谱仪接受光谱信号,本实验需使用未连接外泌体的荧光微腔-适体的光谱信号做对照。
本实验主要应用的是模式移动传感机制即回音壁模式的谐振波长随着环境的变化而变化,而且谐振波长变化越大,说明被检测分子浓度越高;同时,不同的谐振波长对应于不同的检测物质。激光耦合进微腔内部,主要在腔内发生全反射,但是在第二介质(微腔外表面的空气或者液体)仍然存在光场,即倏逝场,分布范围约为微球表面的几百纳米,因此当外泌体结合到微腔表面时,会改变倏逝场,导致频率漂移,又因为微腔的高品质因子q和窄线宽特性,使得频谱漂移信号被放大,故能够通过光谱仪观察频移来检测特定细胞分泌的外泌体。不同的外泌体对倏逝场的扰动结果不同,则相应的频移也不同,以此来区别不同的外泌体。
与现有技术相比,本发明具有如下优势:
1、检测方法简单,成本低,灵敏度高,可以在细胞外检测细胞内的一些物质。本实验利用激光基于回音壁模式来检测外泌体,使用的聚苯乙烯荧光微球,直径为15μm,具有高品质因子q和极窄线宽,因此灵敏度较高,且制作成本低;外泌体不但含有多种可以作为标记物的蛋白质,而且细胞分泌的外泌体还包含大量的核酸小分子。该方法高灵敏度可以实现低浓度的检测。
2.实现在细胞外检测。微球在细胞内作为一个谐振腔,由回音壁模式产生激光输出,充当一个细胞激光器的作用,大量研究表明外泌体可以通过转移致癌蛋白和核酸参与正常的细胞和癌症细胞的发生、生长、进展、转移,那么该细胞激光器便可以实现可跟踪外泌体的运动,在不同的位置实现检测,而且对细胞影响很小,其实用性更强。
3.基于回音壁模式的检测弥补了荧光信号的自吸收和漂白作用,使荧光在腔内形成谐振激发出激光,增强信号强度便于检测,延长了观察与检测时间,增加了检测的可靠性和稳定性。
附图说明:
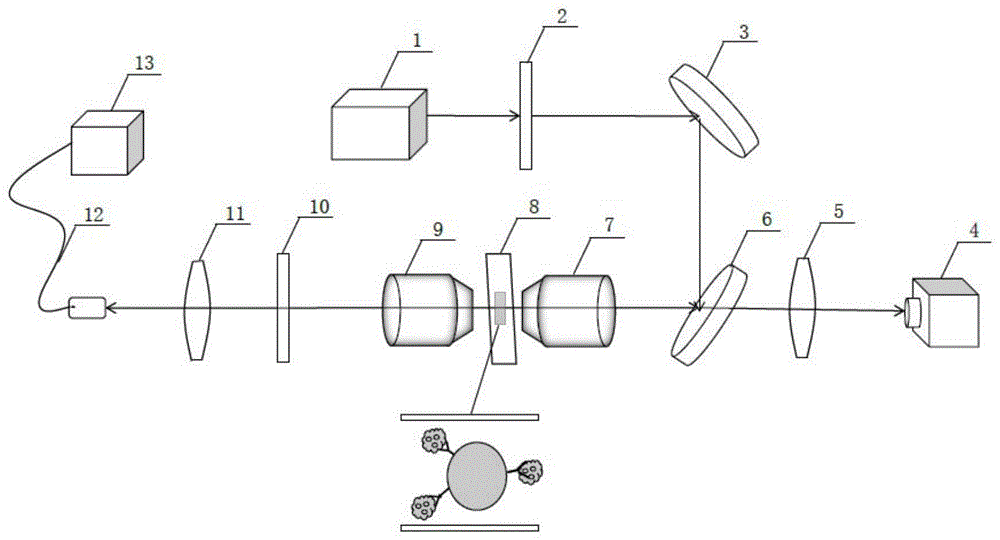
图1是本发明实验装置结构图说明:1、532nm脉冲激光器;2、衰减片;3、银镜;4、ccd相机;5、聚焦透镜;6、二向色镜;7、40倍显微物镜;8、样品;9、60倍显微物镜;10、滤波片;11、聚焦透镜;12、传输光纤和探头;13、光谱仪。
具体实施方式
下面结合实施案例对本发明做进一步说明,但本发明并不限于以下实施案例。因为外泌体内含有和细胞内同样的核酸及蛋白质分子,所以我们可以通过对不同种类的细胞进行检测,其中包括各种正常细胞及癌细胞检测相应的microrna、蛋白质等。
实施案例1利用有源微球腔检测乳腺细胞sk-br3外泌体
本实验选用羧基修饰的聚苯乙烯荧光微球,微球直径为15μm,折射率为n=1.59,具有高q值和小的模式体积。
本实验使用的激光光源为532nm脉冲激光器,不同激光器使用的微球激发波长不同,检测的物质为乳腺细胞sk-br3分泌的外泌体,首先利用外泌体试剂盒将该乳腺细胞分泌的外泌体提取出来,然后将浓度为0.1kg/l的羧基修饰的聚苯乙烯荧光微球悬浮于mes缓冲液中,加入1-乙基-3-(二甲胺丙基)碳二亚胺溶液和n-羟基琥珀酰亚胺溶液,将浓度为0.5μmol/l的氨基修饰特定序列的适体与羧基修饰的荧光微球混合在室温下搅拌2-4小时,离心清洗后将成功连接适体的荧光微球与提取的外泌体混合在室温下培养0.5个小时,经清洗后首先使用共聚焦检测是否连接成功,再用移液枪取出滴在使用poly-d-lysine即多聚赖氨酸清洗过的盖玻片上,最后将载玻片样品置于三维调整架上,调节调整架,使激光自由耦合进微球,增大激光功率至微球的激光激发阈值,将在光谱仪上观察到激光,与只结合适体的微球激发光谱比较,通过光谱移动来确定这种乳腺细胞外泌体的存在。
具体实验步骤如下:
(1)测量羧基修饰的聚苯乙烯荧光微球的光谱。取出浓度为0.1kg/l的羧基修饰的聚苯乙烯荧光微球,将其悬浮ph=7.4的pbs缓冲液中摇匀,微球与pbs缓冲液的体积比为1:10,用移液枪将混合后的溶液滴在经过poly-d-lysine即多聚赖氨酸清洗过的盖玻片,防止微球移动,利用图中装置对羧基修饰的微球进行泵浦,测量激光输出,出现的激光中心峰值在610nm,记录光谱输出图,作为参考以计算后续实验的频移值。
(2)测量连接适体-微球的光谱。首先在离心管中添加下列物质:0.5μmol/l氨基修饰的适体、浓度为0.1kg/l的直径为15μm的羧基修饰的微球、0.1mol/l1-乙基-3-(二甲胺丙基)碳二亚胺溶液简写为edc、0.1mol/l的n-羟基琥珀酰亚胺溶液简写为nhs,ph=5.5的mes缓冲液,上述物质的体积比为:适体:微球:1-乙基-3-(二甲胺丙基)碳二亚胺溶液:0.1mol/l的n-羟基琥珀酰亚胺溶液:mes=1:1:5:5:10。在室温条件下旋转搅拌并孵化2-4小时;然后需要离心清洗,离心5分钟,除去上清液,在ph=7.4的pbs缓冲液中重新悬浮;然后离心5min,除去上清液,最后将颗粒重新悬浮在pbs缓冲液中,获得悬浮液。同样用移液枪将连接好的适体-微球滴加在经过处理的盖玻片上,利用装置图,用532nm激光泵浦适体-微球,测量连接好适体的微球的激光谱,当前浓度下激发的激光中心峰值在609.3nm,发现激光的中心峰值发生了移动。改变加入适体浓度,其他实验条件不变再次进行激发与步骤(1)中的谱图对照,根据谱线的频移,绘制频移-浓度标准曲线。改变加入氨基修饰的特定序列的适体的浓度,测量相应浓度下的激光光谱图,根据回音壁检测物质的原理,产生频移最大时,说明适体的结合效率最高,所以可以计算测定最佳适体连接效率。
(3)测定特定外泌体的存在。首先使用无外泌体的血清培养该乳腺细胞,然后用外泌体试剂盒提取出细胞分泌的外泌体;将连接好的适体-微球与提取出的外泌体一起孵育0.5个小时,用移液枪滴加在经过poly-d-lysine即多聚赖氨酸清洗过的盖玻片上,利用装置图在532nm激光泵浦下,记录激光激发光谱,当前激光的中心峰值为607.6nm,与(2)参考谱对比,发现激光的中心峰值发生了移动,由此根据测量的频移,测定该外泌体的存在。
(4)实验结果,可以快速灵敏的在细胞外实现对细胞内物质的检测。
实施案例2利用有源微球腔检测前列腺细胞分泌的外泌体上的生物大分子的前列腺特异性抗原即psa
目前对于前列腺特异性抗原的检测主要是侵入性的,包括通过直肠指检检查、经直肠超声引导的活组织检查等。利用有源腔对外泌体进行检测,具有非侵入性的优势,同时对psa测量更加方便快速,本发明的研究内容为利用特定适体修饰的有源微球对前列腺细胞分泌的外泌体中的psa进行检测。
具体实验步骤如下:
(1)首先购买羧基修饰的荧光微球;
(2)需要修饰的适体,适体序列为5’-ttattaaagctcgccatcaaatagc-3’-nh2,与羧基修饰的微球,根据公式s=(6/ρsd)·c计算求出所需适体浓度,其中s是单层修饰需要的适体的量(mg适体/g微球),ρs是微球的密度(g/cm3),d是微球的直径,c是微球表面的容量。
(3)先将羧基修饰的微球置于ph=5.5的mes溶液中,再加入edc和nhs,使其在适宜的环境中活化羧基。然后加入适体,经过涡旋振荡离心清洗得到连接适体成功的荧光微球。
(4)提取纯化外泌体,先使用正常含有外泌体的牛血清培养该类前列腺细胞,生长状态良好,细胞数目至视野范围内70%-80%时,使用无外泌体牛血清进行传代培养,生长状态良好,细胞数目至视野范围内70%-80%时,使用试剂盒进行提取纯化。
(5)将成功连接适体的荧光微球与提取纯化得到的外泌体放在一起混合孵育培养0.5个小时,使用共聚焦验证连接成功。
(6)在532nm脉冲激光器的泵浦下,记录激光光谱,通过与修饰羧基的微球、成功连接适体的微球的光谱图进行比较,发现修饰羧基的微球、成功连接适体的微球以及成功连接外泌体的微球三者的激光光谱依次发生了位移,当连接样品中的外泌体浓度不同时,激光谱的中心峰值相比于成功连接适体的激光谱的中心峰值,移动的位移大小也不同。由此可以利用光谱的频移来观察pas的存在,以及浓度变化。
(7)实验结果,使用该方法检测可以达到一个快速高效的检测效果。
实施案例3利用有源微球腔检测胰腺导管细胞分泌的外泌体中的磷脂酰肌醇蛋白聚糖-1简写为gpc-1
目前有关于胰腺导管细胞的相关检测手段主要是昂贵的成像研究,例如计算机断层扫描(ct)、磁共振成像(mri)和内窥镜超声等。最近磷脂酰肌醇蛋白聚糖-1(glypican-1)已被鉴定为外泌体的生物标记物。本发明基于外泌体标记物glypican-1,利用羧基修饰的荧光微球与氨基修饰的识别gpc-1的抗体识别并通过氨基羧基的共价偶联结合,然后与外泌体混合,会与外泌体表面的标记物gpc-1发生抗原抗体特异性识别并结合,使得此时的激光的发射光谱与未识别结合外泌体的羧基修饰的微腔的激光发射谱相比发生移动,识别的外泌体浓度越大产生的位移也就越大,因此可以通过光谱位移的大小实现对该物质的浓度检测。
具体实验步骤如下:
(1)首先购买带有羧基修饰的荧光微球:
a)加入ph=5.5的mes溶液和1-乙基-3-(二甲胺丙基)碳二亚胺)溶液、n-羟基琥珀酰亚胺溶液,活化羧基修饰的荧光微球;
b)羧基修饰的微球与氨基修饰的识别gpc-1的抗体结合。
(2)培养胰腺细胞u87-mg,生长状态良好时,采用试剂盒提取外泌体。
(3)将连接特异性抗体的荧光微球与外泌体一起孵育0.5个小时,并清洗后,使用532nm脉冲激光器分别对羧基修饰的微球、连接特异性抗体的微球、与不同浓度的外泌体结合的微球分别泵浦,依次得到三个激光光谱数据,通过比较三次激发的激光光谱的中心峰值,发现激光中心峰值的波长会依次发生位移,并且在制作样品时改变适体的浓度和提取的外泌体浓度,激光中心峰值的移动的大小也会相应的改变。
(4)根据输出的光谱频移图来鉴定gpc-1的存在和浓度大小。
本发明的核心部分在于激光激发回音壁模式,实现细胞外激光输出,当被修饰的有源荧光微球与抗体或者适体的特异性结合时,发生光谱频率的偏移,从而实现高灵敏度的细胞外物质检测。
- 还没有人留言评论。精彩留言会获得点赞!