一种茶叶和/或咖啡前处理和同时测定1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的方法与流程
本发明涉及分析检测
技术领域:
,具体涉及一种茶叶和/或咖啡前处理和同时测定1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的方法。
背景技术:
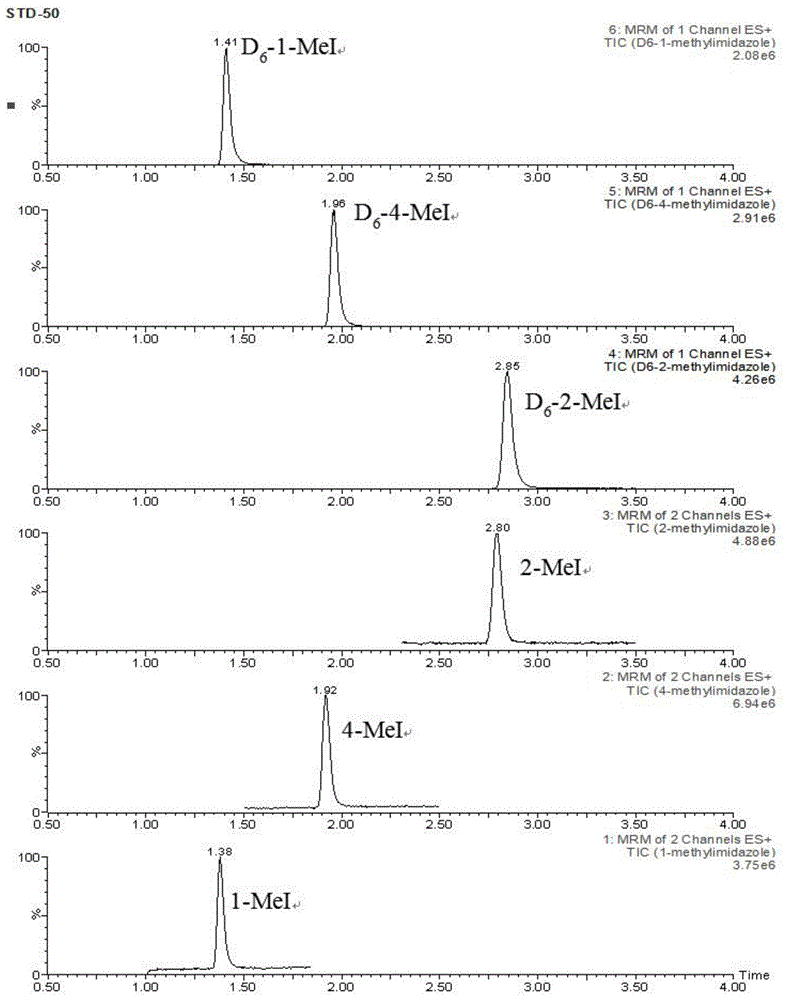
:咖啡、可可和茶是当今世界三大无酒精饮料,作为茶和咖啡原料来源的茶叶与咖啡豆均不宜直接冲煮饮用,需通过热加工过程制备而成,如茶叶中的绿茶、黑茶等需通过杀青和干燥等热加工步骤,白茶、红茶等需干燥等热加工步骤,而咖啡豆则需经过不同程度的烘焙制成,其香气的形成也主要是通过热加工过程中的美拉德反应来实现的,然而伴随着美拉德反应的进行,在热加工过程中也会发生次级反应生成氯丙醇酯、丙烯酰胺和甲基咪唑化合物等有害加工副产物(伴生危害物)。甲基咪唑类副产物主要包括4-甲基咪唑(4-mei)、2-甲基咪唑(2-mei)和1-甲基咪唑(1-mei),是一类极易溶于水的化合物,其中,4-mei和2-mei具有致癌性,属于2b级致癌物。由于2-mei和4-mei是氨法生产的焦糖色素中的主要潜在危害物,目前国内外对于食品中甲基咪唑副产物的研究多集中在焦糖色素以及焦糖色素着色食物中(包括可乐、酱油、啤酒等),而对于茶叶和咖啡等不添加焦糖色却经过热加工过程的食品中甲基咪唑副产物的研究却鲜少报道。食品中甲基咪唑化合物的分析方法主要是针对焦糖色中4-mei的分析,主要包括分光光度法、气相色谱法、气相色谱质谱联用法、高效液相色谱法、液相色谱质谱联用法等。其中,分光光度法通过对焦糖色素萃取后直接测定,在被测物最大吸收处干扰多,且需重氮化后进行测定,操作复杂且灵敏度较低;高效液相色谱法由于焦糖色素成分复杂,杂质难与被测物分离,且分析的灵敏度较低无法满足痕量分析的需要;气相色谱法与高效液相色谱法相同,分析方法的灵敏度无法满足痕量分析的需要;气质联用法在样品前处理多用衍生化法,增加了操作的复杂程度,一般也只能测定2-mei和4-mei。液相色谱质谱联用法将色谱对复杂样品的分离以及质谱的高选择性、高灵敏度结合,在食品分析领域得到广泛的应用。目前,对于不同食品基质中的4-mei的检测大多采用quechers方法进行样品前处理,但其净化效果有限,基质干扰严重,且方法均不能实现1-mei和2-mei的同时检测。《食品安全国家标准食品中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的测定》(征求意见稿)采用mcx阳离子交换检测食品中三种甲基咪唑,样品前处理步骤为:将样品粉碎均匀;称取混合均匀的样品置比色管中,加入同位素混合内标工作溶液,加2%甲酸水溶液定容,摇匀,离心,上清液待净化;吸取上清液,过固相萃取小柱,依次用2%甲酸水溶液、甲醇淋洗,再用氨水甲醇溶液洗脱,收集全部洗脱液,氮吹至近干,加入乙腈-5mmol/l乙酸铵溶液(乙腈和乙酸铵溶液体积比为9:1)溶液,涡旋,过有机滤膜,滤液供液相色谱-串联质谱仪测定。然而,由于茶叶样品的基质复杂,含有大量的茶多酚、咖啡碱、色素、糖类、有机酸等,在使用《食品安全国家标准食品中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的测定》(征求意见稿)测定时,这些杂质去除不完全,产生严重的基质抑制效应,降低了甲基咪唑化合物的仪器响应信号,使方法的检测灵敏度降低。而咖啡样品,特别是速溶咖啡样品中也含有大量的糖类、脂肪、蛋白质、纤维素、单宁、灰分、水分、咖啡因等化学物质,通过《食品安全国家标准食品中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的测定》(征求意见稿)进行前处理时,杂质去除不完全,对甲基咪唑化合物的检测造成严重的基质抑制效应,降低了其仪器响应信号,降低了方法的检测灵敏度,造成样品检测的假阴性结果。技术实现要素:本发明的目的在于提供一种茶叶和/或咖啡前处理和同时测定1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的方法,采用本发明提供的前处理方法对茶叶和/或咖啡进行处理后,基质效应影响小,提高了样品中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的检测准确度。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种样品的前处理方法,包括以下步骤:将茶叶和/或咖啡粉碎,得到样品粉末;将所述样品粉末、甲基咪唑化合物同位素混合内标应用液和无机强碱溶液混合,进行提取,得到样品提取液;采用颗粒硅藻土固相萃取柱对所述样品提取液进行净化,得到样品净化液;将所述样品净化液浓缩后超声溶解于腈类溶剂中,过滤膜,得到待测样品液。优选的,所述无机强碱溶液包括氢氧化钠溶液和/或氢氧化钾溶液;所述无机强碱溶液的浓度为0.5~1.5mol/l。优选的,所述样品粉末的质量和无机强碱溶液中的无机强碱的物质的量之比为1g:(5~30)mmol。优选的,所述样品提取液中样品的浓度为0.05~0.1g/ml,甲基咪唑化合物同位素内标物的浓度为1.0μg/ml。优选的,所述样品提取液的体积和颗粒硅藻土固相萃取柱中填料的质量之比为(0.5~1)ml:1g;所述颗粒硅藻土固相萃取柱中填料为天然硅藻土,所述天然硅藻土的粒度为30~1000μm。优选的,所述净化包括依次进行的淋洗和洗脱;所述淋洗采用的淋洗剂包括正己烷或石油醚。所述洗脱采用的洗脱剂为二氯甲烷-乙酸乙酯的混合溶剂;所述混合溶剂中二氯甲烷和乙酸乙酯的体积比为1:(0.5~2)。本发明提供了一种同时测定茶叶和/或咖啡中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的方法,包括以下步骤:采用液相色谱串联质谱检测上述技术方案所述前处理方法得到的待测样品液中的1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的含量。优选的,所述液相色谱串联质谱检测中液相色谱检测的条件包括包括:色谱柱:agilentzorbaxhilicplus柱或watersbehhilic柱;柱温:30℃;进样量:2μl;流动相:流动相a和流动相b,所述流动相a为浓度为2~10mmol/l甲酸铵水溶液,所述流动相b为乙腈,所述流动相的流速为0.2~0.6ml/min;洗脱方式:梯度洗脱。优选的,所述梯度洗脱的程序为:0.00~0.50min,所述流动相a的体积百分含量为15%,所述流动相b的体积百分含量为85%;0.5~4.00min,所述流动相a的体积百分含量由15%匀速增加到40%,所述流动相b的体积百分含量为由85%匀速降低到60%;4.00~6.00min,所述流动相a的体积百分含量为40%,所述流动相b的体积百分含量为60%;6.00~6.50min,所述流动相a的体积百分含量由40%匀速降低到15%,所述流动相b的体积百分含量为由60%匀速增加到85%;6.50~12.00min,所述流动相a的体积百分含量为15%,所述流动相b的体积百分含量为85%。优选的,所述液相色谱串联质谱检测中质谱检测的条件包括包括:离子源:电喷雾离子源;离子源温度:150℃;毛细管电压:2.5kv;脱溶剂温度:500℃;扫描方式:正离子扫描;检测方式:多反应检测;雾化气:由氮气发生器产生的氮气或高纯氮气;气帘气:由氮气发生器产生的氮气或高纯氮气;辅助加热气:由氮气发生器产生的氮气或高纯氮气;碰撞气:高纯氩气。本发明提供了一种样品的前处理方法,包括以下步骤:将茶叶和/或咖啡粉碎,得到样品粉末;将所述样品粉末、甲基咪唑化合物同位素混合内标应用液和无机强碱溶液混合,进行提取,得到样品提取液;采用颗粒硅藻土固相萃取柱对所述样品提取液进行净化,得到样品净化液;将所述样品净化液浓缩后超声溶解于腈类溶剂中,过滤膜,得到待测样品液。本发明提供的前处理方法,通过无机强碱溶液对茶叶和/或咖啡进行提取,并采用颗粒硅藻土固相萃取净化,能够去除色素及样品基质中弱极性化合物的干扰,有效降低茶叶及咖啡的基质效应,提高了茶叶及咖啡中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的检测准确度。附图说明图1为1-甲基咪唑、2-甲基咪唑、4-甲基咪唑及其内标化合物1-甲基咪唑-d6、2-甲基咪唑-d6和4-甲基咪唑-d6的标准tic图;图2为咖啡阳性样品的总离子流图;图3为茶叶阳性样品的总离子流图。具体实施方式本发明提供了一种样品的前处理方法,包括以下步骤:将茶叶和/或咖啡粉碎,得到样品粉末;将所述样品粉末、甲基咪唑化合物同位素混合内标应用液和无机强碱溶液混合,进行提取,得到样品提取液;采用颗粒硅藻土固相萃取柱对所述样品提取液进行净化,得到样品净化液;将所述样品净化液浓缩后超声溶解于腈类溶剂中,过滤膜,得到待测样品液。在本发明中,若没有特殊说明,所采用的试剂均为本领域技术人员所熟知的市售商品。本发明将茶叶和/或咖啡粉碎,得到样品粉末。本发明对于所述粉碎的方式没有特殊限定,采用本领域技术人员熟知的粉碎方式即可。得到样品粉末后,本发明将所述样品粉末、甲基咪唑化合物同位素混合内标应用液和无机强碱溶液混合,进行提取,得到样品提取液。在本发明中,所述甲基咪唑化合物同位素混合内标应用液的浓度优选为1.0μg/ml;所述甲基咪唑化合物同位素混合内标应用液中的甲基咪唑化合物同位素混合内标优选包括1-甲基咪唑-d6、2-甲基咪唑-d6和4-甲基咪唑-d6,即所述1-甲基咪唑-d6、2-甲基咪唑-d6和4-甲基咪唑-d6。的浓度均匀为1.0μg/ml。在本发明中,所述样品粉末的质量和甲基咪唑化合物同位素混合内标应用液的体积之比优选为0.5g:0.3ml。在本发明中,所述无机强碱溶液优选包括氢氧化钠溶液和/或氢氧化钾溶液;所述无机强碱溶液的浓度优选为0.5~1.5mol/l,更优选为0.8~1.2mol/l,最优选为1mol/l。在本发明中,所述无机强碱的纯度均优选为分析纯,水优选为超纯水。在本发明中,所述提取的温度优选为室温;所述提取优选在超声条件下进行,所述超声的功率优选为200~500w,更优选为300~400w;所述超声的时间优选为5~10min,更优选为7~8min。在本发明的实施例中,所述超声优选在超声波清洗器(昆山超声仪器有限公司)中进行。所述提取后,本发明优选还包括将所述提取得到的溶液进行定容和涡旋混合,得到样品提取液。在本发明中,所述定容优选利用所述无机强碱溶液进行。在本发明的实施例中,所述涡旋混合优选在多样品漩涡振荡器(德国heidolph公司)中进行。在本发明中,所述样品提取液的浓度优选为0.05~0.1g/ml,更优选为0.05~0.07g/ml,最优选为0.05g/ml。得到样品提取液后,本发明采用颗粒硅藻土固相萃取柱对所述样品提取液进行净化,得到样品净化液。在本发明中,所述颗粒硅藻土固相萃取柱中填料优选为天然硅藻土,所述天然硅藻土的粒度优选为30~1000μm。在本发明中,所述样品提取液的体积和颗粒硅藻土的质量之比优选为(0.5~1)ml:1g,更优选为(0.6~0.9)ml:1g,最优选为(0.7~0.8)ml:1g。在本发明中,所述固相萃取柱中颗粒硅藻土的填充量优选为2g/12ml。在本发明中,所述净化优选包括依次进行的淋洗和洗脱。在本发明中,所述淋洗采用的淋洗剂优选包括正己烷或石油醚;所述正己烷和石油醚的纯度均优选为色谱纯。在本发明中,所述淋洗剂的流速优选为0.5~2ml/min,更优选为1~1.5ml/min。本发明对于所述淋洗剂的用量没有特殊限定,能够除去样品基质中的油脂等化合物即可。在本发明的实施例中,所述样品提取液和淋洗剂的体积比优选为1:10。在本发明中,所述洗脱采用的洗脱剂优选为二氯甲烷-乙酸乙酯的混合溶剂;所述混合溶剂中二氯甲烷和乙酸乙酯的体积比优选为1:1;所述二氯甲烷和乙酸乙酯的纯度均优选为色谱纯。在本发明中,所述洗脱剂的流速优选为0.5~2.0ml/min,更优选为1.0~1.5ml/min。本发明对于所述洗脱剂的用量没有特殊限定,能够将固相萃取柱上吸附的三种甲基咪唑化合物完全洗脱即可。在本发明的实施例中,所述样品提取液和洗脱剂的体积比优选为1:10。所述洗脱后,本发明优选还包括在所述洗脱得到的洗脱液中加入甲酸铵缓冲液。在本发明中,所述甲酸铵缓冲液的浓度优选为5~10mmol/l;所述甲酸铵缓冲液中的甲酸铵纯度优选为色谱纯,水优选为超纯水;所述甲酸铵缓冲液和洗脱用混合溶剂的体积比优选为0.1:10。在本发明中,所述甲酸铵缓冲液能够防止净化液吹干而损失待测物。得到样品净化液后,本发明将所述样品净化液浓缩后超声溶解于腈类溶剂中,过滤膜,得到待测样品液。在本发明中,所述浓缩的方式优选为氮气吹干;所述氮气吹干的温度优选为室温。在本发明中,所述氮气吹干优选利用氮吹仪(上海安谱实验科技股份有限公司)进行。在本发明中,所述腈类溶剂优选为乙腈;所述乙腈的纯度优选为色谱纯。在本发明中,所述滤膜的孔径优选为0.22μm。本发明提供了一种同时测定茶叶和/或咖啡中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的方法,包括以下步骤:采用液相色谱串联质谱检测上述技术方案所述前处理方法得到的待测样品液中的1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的含量。在本发明中,所述液相色谱串联质谱检测优选包括以下步骤:将所述待测样品液进行液相色谱串联质谱检测,得到样品色谱图;根据所述样品色谱图得到样品中甲基咪唑化合物的峰面积;根据所述峰面积与线性曲线,采用内标法计算样品溶液中甲基咪唑化合物的含量;所述线性曲线为甲基咪唑化合物的色谱峰面积与甲基咪唑化合物浓度的线性曲线;所述甲基咪唑化合物包括1-甲基咪唑、2-甲基咪唑或4-甲基咪唑。本发明将所述待测样品液进行液相色谱串联质谱检测,得到样品色谱图。在本发明中,所述液相色谱串联质谱检测中液相色谱检测的条件包括优选包括:色谱柱优选为agilentzorbaxhilicplus柱;柱温优选为30℃;进样量优选为2μl;流动相优选为流动相a和流动相b;所述流动相a优选为甲酸铵水溶液,所述甲酸铵水溶液的浓度优选为2~10mmol/l,更优选为5~6mmol/l;所述流动相b优选为乙腈;所述流动相的流速优选为0.2~0.6ml/min,更优选为0.3~0.5ml/min,最优选为0.4ml/min;洗脱方式优选梯度洗脱。在本发明中,所述梯度洗脱过程中所述流动相a和流动相b的体积百分含量如表1所示:表1液相色谱梯度洗脱条件时间/min流动相a/体积%流动相b体积/%0.0015850.5015854.0040606.0040606.50158512.001585即,所述梯度洗脱的程序具体如下:0.00~0.50min,所述流动相a的体积百分含量为15%,所述流动相b的体积百分含量为85%;0.5~4.00min,所述流动相a的体积百分含量由15%匀速增加到40%,所述流动相b的体积百分含量为由85%匀速降低到60%;4.00~6.00min,所述流动相a的体积百分含量为40%,所述流动相b的体积百分含量为60%;6.00~6.50min,所述流动相a的体积百分含量由40%匀速降低到15%,所述流动相b的体积百分含量为由60%匀速增加到85%;6.50~12.00min,所述流动相a的体积百分含量为15%,所述流动相b的体积百分含量为85%。在本发明中,所述液相色谱串联质谱检测中质谱检测的条件包括优选包括:离子源优选为电喷雾离子源;离子源温度优选为150℃;毛细管电压优选为2.5kv;脱溶剂温度优选为500℃;扫描方式优选为正离子扫描;检测方式优选为多反应检测;雾化气优选为由氮气发生器产生的氮气或高纯氮气;气帘气优选为由氮气发生器产生的氮气或高纯氮气;辅助加热气优选为由氮气发生器产生的氮气或高纯氮气;碰撞气优选为高纯氩气。在本发明中,所述雾化气、气帘气、辅助加热气、碰撞气在使用前优选调节各气体流量以使质谱灵敏度达到检测要求;锥孔电压、碰撞能量等电压值优选优化至最优灵敏度;定性离子对、定量离子对、锥孔电压及碰撞能量如表2所示。表2甲基咪唑化合物的质谱参数其中,*代表定量离子。在本发明中,定性分析过程中,每种待测化合物的质谱定性离子必须出现,至少应包括一个母离子和两个子离子,而且同一检验批次,对同一化合物,样品中目标化合物的两个子离子的相对丰度比与浓度相当的标准溶液相比,其允许偏差不超过表3规定的范围:表3定性时相对离子丰度的最大允许偏差相对离子丰度/%>5020-5010-20≤10允许相对偏差/%±20±25±30±50得到样品色谱图后,本发明根据所述样品色谱图得到样品中甲基咪唑化合物的峰面积;根据所述峰面积与预定的标准曲线,采用内标法计算样品中甲基咪唑化合物的含量;所述标准曲线为甲基咪唑化合物的色谱峰面积与甲基咪唑化合物浓度的线性曲线;所述甲基咪唑化合物为1-甲基咪唑、2-甲基咪唑或4-甲基咪唑。在本发明中,所述标准曲线的制备方法优选包括以下步骤:配制甲基咪唑化合物系列标准工作溶液,所述甲基咪唑化合物为1-甲基咪唑、2-甲基咪唑或4-甲基咪唑;将所述甲基咪唑化合物系列标准工作溶液进行液相色谱检测,得到甲基咪唑化合物的色谱峰面积,将所述色谱峰面积与甲基咪唑化合物浓度线性拟合,得到线性曲线。本发明配制甲基咪唑化合物系列标准工作溶液,所述甲基咪唑化合物为1-甲基咪唑、2-甲基咪唑或4-甲基咪唑。在本发明中,所述甲基咪唑化合物系列标准工作溶液中1-甲基咪唑、2-甲基咪唑或4-甲基咪唑的浓度均依次优选为1.0ng/ml、5.0ng/ml、25.0ng/ml、50.0ng/ml、250.0ng/ml和500.0ng/ml;所述甲基咪唑化合物系列标准工作溶液中1-甲基咪唑-d6、2-甲基咪唑-d6和4-甲基咪唑-d6的浓度均优选为30ng/ml。在本发明中,所述甲基咪唑化合物系列标准工作溶液的配制方法优选包括:(1)配制1mg/ml的甲基咪唑化合物标准储备溶液;(2)配制2.0μg/ml的甲基咪唑化合物混合标准应用液;(3)配制1mg/ml的甲基咪唑化合物同位素内标储备溶液;(4)配制1.0μg/ml的甲基咪唑化合物同位素混合内标应用液;(5)配制甲基咪唑化合物标准品系列标准工作溶液。在本发明的实施例中,1mg/ml的甲基咪唑化合物标准储备溶液的配制具体为:准确称取甲基咪唑化合物25mg(精确至0.01mg),加水1ml使溶解,用乙腈转移至25ml棕色容量瓶中并定容至刻度,摇匀,-20℃下避光密封保存,有效期6个月,得到1mg/ml的甲基咪唑化合物标准储备溶液,在-20℃下避光密封保存,有效期为6个月;所述甲基咪唑化合物为1-甲基咪唑、2-甲基咪唑或4-甲基咪唑。在本发明的实施例中,2.0μg/ml的甲基咪唑化合物混合标准应用液的配制具体为:分别吸取100μl所述甲基咪唑化合物标准储备溶液置于同一50ml棕色容量瓶中,加乙腈稀释定容至刻度,摇匀,得到2.0μg/ml的甲基咪唑化合物混合标准应用液,在4℃避光密封保存,有效期为3个月。在本发明的实施例中,1mg/ml的甲基咪唑化合物同位素内标储备溶液的配制具体为:准确称取10mg(精确至0.01mg)1-甲基咪唑-d6,用乙腈溶解,转移至10ml棕色容量瓶中,乙腈定容至刻度,摇匀,得到1mg/ml的1-甲基咪唑-d6内标储备溶液,在-20℃下避光密封保存,有效期为6个月;准确称取10mg(精确至0.01mg)2-甲基咪唑-d6,用乙腈溶解,转移至10ml棕色容量瓶中,乙腈定容至刻度,摇匀,得到1mg/ml的2-甲基咪唑-d6内标储备溶液,在-20℃下避光密封保存,有效期为6个月;准确称取10mg(精确至0.01mg)4-甲基咪唑-d6,用乙腈溶解,转移至10ml棕色容量瓶中,乙腈定容至刻度,摇匀,得到1mg/ml的4-甲基咪唑-d6内标储备溶液,在-20℃下避光密封保存,有效期为6个月;在本发明的实施例中,1.0μg/ml的甲基咪唑化合物同位素混合内标应用液的配制具体为:分别吸取100μl所述1-甲基咪唑-d6内标储备溶液、2甲基咪唑-d6内标储备溶液和4-甲基咪唑-d6内标储备溶液于同一100ml棕色容量瓶中,用乙腈稀释定容至刻度,摇匀,得到1.0μg/ml的甲基咪唑化合物同位素混合内标应用液,在4℃避光密封保存,有效期为3个月。在本发明的实施例中,甲基咪唑化合物标准品系列标准工作溶液的配制具体为:分别吸取5μl、25μl、125μl、250μl、1250μl和2500μl步骤(2)得到的2.0μg/ml的甲基咪唑化合物混合标准应用液至5ml容量瓶中,分别加入150μl步骤(4)得到的1.0μg/ml的甲基咪唑化合物同位素混合内标应用液,用乙腈-5mmol/l甲酸铵水溶液(体积比为9:1)混合溶液定容至刻度,得到甲基咪唑化合物标准品系列标准工作溶液。得到甲基咪唑化合物系列标准工作溶液后,本发明将所述甲基咪唑化合物系列标准工作溶液进行液相色谱串联质谱检测,得到甲基咪唑化合物及其对应内标化合物的色谱峰面积,将目标化合物色谱峰与其对应内标色谱峰的峰面积比值与甲基咪唑化合物浓度线性拟合,得到线性曲线。在本发明中,所述液相色谱检测条件优选与前文所述待测定样品的液相色谱检测条件一致,在此不再赘述。本发明优选将所述浓度为1.0ng/ml、5.0ng/ml、25.0ng/ml、50.0ng/ml、250.0ng/ml和500.0ng/ml的甲基咪唑化合物系列标准工作溶液按照所述液相色谱和质谱检测条件进行lc-ms/ms检测,得到对应浓度的甲基咪唑化合物系列标准工作溶液的tic图,并根据测定的甲基咪唑化合物及其对应内标化合物的色谱峰面积,将目标甲基咪唑化合物色谱峰与其对应内标色谱峰的峰面积比值与甲基咪唑化合物浓度线性拟合,得到线性回归方程,如表4所示:表41-甲基咪唑、2甲基咪唑和4-甲基咪唑的线性曲线回归方程其中,y为浓度,单位为ng/ml;x为甲基咪唑化合物色谱峰与其对应内标色谱峰的峰面积比值。在本发明中,样品待测液的响应值在线性曲线线性范围内,当超过线性范围上限时,优选减少取样量后重新测定。在本发明中,所述采用内标法计算样品中甲基咪唑化合物的含量的计算式如式(1)所示:式(1)中,x为样品中甲基咪唑类化合物的含量,单位为μg/kg;c为样品溶液中甲基咪唑类化合物按照内标法在标准曲线中对应的浓度,单位为ng/ml;v1为样品提取液体积,单位为ml;v3为样品待测液的定容体积,单位为ml;m为样品质量,单位为g;v2为用于净化的分取体积,单位为ml;下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1(1)甲基咪唑化合物系列标准工作溶液的配制(1.1)1mg/ml的甲基咪唑化合物标准储备溶液准确称取1-甲基咪唑标准品25mg(精确至0.01mg),加水1ml使溶解,用乙腈转移至25ml棕色容量瓶中并定容至刻度,摇匀,-20℃下避光密封保存,有效期6个月,得到1mg/ml的1-甲基咪唑标准储备溶液,在-20℃下避光密封保存,有效期为6个月。准确称取2-甲基咪唑标准品25mg(精确至0.01mg),加水1ml使溶解,用乙腈转移至25ml棕色容量瓶中并定容至刻度,摇匀,-20℃下避光密封保存,有效期6个月,得到1mg/ml的2-甲基咪唑标准储备溶液,在-20℃下避光密封保存,有效期为6个月。准确称取4-甲基咪唑标准品25mg(精确至0.01mg),加水1ml使溶解,用乙腈转移至25ml棕色容量瓶中并定容至刻度,摇匀,得到1mg/ml的4-甲基咪唑标准储备溶液,在-20℃下避光密封保存,有效期为6个月。(1.2)2.0μg/ml的甲基咪唑化合物混合标准应用液分别吸取100μl所述1-甲基咪唑标准储备溶液、2-甲基咪唑标准储备溶液和4-甲基咪唑标准储备溶液置于同一50ml棕色容量瓶中,加乙腈稀释定容至刻度,摇匀,得到2.0μg/ml的甲基咪唑化合物混合标准应用液,在4℃避光密封保存,有效期为3个月。(1.3)1mg/ml的甲基咪唑化合物同位素内标储备溶液准确称取10mg(精确至0.01mg)1-甲基咪唑-d6,用乙腈溶解,转移至10ml棕色容量瓶中,乙腈定容至刻度,摇匀,得到1mg/ml的1-甲基咪唑-d6内标储备溶液,在-20℃下避光密封保存,有效期为6个月。准确称取10mg(精确至0.01mg)2-甲基咪唑-d6,用乙腈溶解,转移至10ml棕色容量瓶中,乙腈定容至刻度,摇匀,得到1mg/ml的2-甲基咪唑-d6内标储备溶液,在-20℃下避光密封保存,有效期为6个月。准确称取10mg(精确至0.01mg)4-甲基咪唑-d6,用乙腈溶解,转移至10ml棕色容量瓶中,乙腈定容至刻度,摇匀,得到1mg/ml的4-甲基咪唑-d6内标储备溶液,在-20℃下避光密封保存,有效期为6个月。(1.4)1.0μg/ml的甲基咪唑化合物同位素混合内标应用液分别吸取100μl所述1-甲基咪唑-d6内标储备溶液、2甲基咪唑-d6内标储备溶液和4-甲基咪唑-d6内标储备溶液于同一100ml棕色容量瓶中,用乙腈稀释定容至刻度,摇匀,得到1.0μg/ml的甲基咪唑化合物同位素混合内标应用液,在4℃避光密封保存,有效期为3个月。(1.5)甲基咪唑化合物标准品系列标准工作溶液分别吸取5μl、25μl、125μl、250μl、1250μl和2500μl步骤(2)得到的2.0μg/ml的甲基咪唑化合物混合标准应用液至5ml容量瓶中,分别加入150μl步骤(4)得到的1.0μg/ml的甲基咪唑化合物同位素混合内标应用液,用乙腈-5mmol/l甲酸铵水溶液(乙腈与甲酸铵水溶液的体积比为9:1)混合溶液定容至刻度,得到甲基咪唑化合物标准品系列标准工作溶液;所述甲基咪唑化合物系列标准工作溶液中1-甲基咪唑、2-甲基咪唑或4-甲基咪唑的浓度均依次优选为1.0ng/ml、5.0ng/ml、25.0ng/ml、50.0ng/ml、250.0ng/ml、500.0ng/ml,1-甲基咪唑-d6、2-甲基咪唑-d6和4-甲基咪唑-d6的浓度均优选为30ng/ml。(2)标准曲线回归方程将所述浓度为1.0ng/ml、5.0ng/ml、25.0ng/ml、50.0ng/ml、250.0ng/ml和500.0ng/ml的甲基咪唑化合物系列标准工作溶液按浓度从小到大依次进行lc-ms/ms检测,得到对应浓度的甲基咪唑化合物系列标准工作溶液的tic图,并根据测定的甲基咪唑化合物及其对应内标化合物的色谱峰面积,将目标甲基咪唑化合物色谱峰与其对应内标色谱峰的峰面积比值与甲基咪唑化合物浓度线性拟合,得到线性回归方程,如表4所示。表41-甲基咪唑、2甲基咪唑和4-甲基咪唑的线性曲线回归方程其中,y为浓度,单位为ng/ml;x为甲基咪唑化合物色谱峰与其对应内标色谱峰的峰面积比值。所述液相色谱串联质谱检测中液相色谱检测的条件包括:色谱柱agilentzorbaxhilicplus柱(1.8μm,2.1mm×50mm);柱温为30℃;进样量为2μl;流动相为流动相a和流动相b;所述流动相a为浓度5mmol/l甲酸铵水溶液;所述流动相b为乙腈;所述流动相的流速为0.4ml/min;洗脱方式梯度洗脱,梯度洗脱的条件如表1所示。表1液相色谱梯度洗脱条件时间/min流动相a/体积%流动相b体积/%0.0015850.5015854.0040606.0040606.50158512.001585所述液相色谱串联质谱检测中质谱检测的条件包括:离子源为电喷雾离子源;离子源温度为150℃;毛细管电压为2.5kv;脱溶剂温度为500℃;扫描方式为正离子扫描;检测方式为多反应检测;雾化气为高纯氮气;气帘气为高纯氮气;辅助加热气为高纯氮气;碰撞气为高纯氩气;使用前调节各气体流量以使质谱灵敏度达到检测要求;锥孔电压、碰撞能量等电压值优化至最优灵敏度;定性离子对、定量离子对、锥孔电压及碰撞能量如表2所示,标准图谱如图1所示。表2甲基咪唑化合物的质谱参数其中,*代表定量离子。实施例2(1)样品前处理(1.1)样品制备:将咖啡粉碎,得到样品粉末。(1.2)样品提取:准确称取0.5g(精确到0.0001g)所述样品粉末于10ml刻度离心管中,加入300μl浓度为1.0μg/ml甲基咪唑化合物同位素混合内标应用液和8ml浓度为1mol/l的koh溶液混合,超声提取,然后加浓度为1mol/l的koh溶液定容至刻度,涡旋混合均匀,得到样品提取液。(1.3)样品净化:吸取1ml所述样品提取液至颗粒硅藻土固相萃取柱内,加入10ml正己烷淋洗除杂,然后加入用10ml体积比为1:1的二氯甲烷-乙酸乙酯混合溶剂进行洗脱,洗脱速度为2.0ml/min,在收集的洗脱液中加入0.1ml甲酸铵缓冲液;将所得样品净化液室温氮气吹至0.1ml,加入0.9ml乙腈超声溶解5min,涡旋混合均匀,过0.22μm滤膜,得到待测样品液。(2)待测样品液的lc-ms/ms检测采用实施例1的液相色谱和质谱的检测条件对所述待测样品液进行lc-ms/ms检测,得到样品色谱图,根据所述样品色谱图得到样品中甲基咪唑化合物的峰面积;根据所述峰面积与实施例1得到的标准曲线回归方程,根据式(1),采用内标法计算待测样品液中的1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的含量,检测结果见表5。表5咖啡样品检测结果其中,nd代表未检出,最低检出浓度为6μg/kg。(3)定性分析每种待测化合物的质谱定性离子必须出现,至少应包括一个母离子和两个子离子,而且同一检验批次,对同一化合物,样品中目标化合物的两个子离子的相对丰度比与浓度相当的标准溶液相比,其允许偏差不超过表3规定的范围。表3定性时相对离子丰度的最大允许偏差相对离子丰度/%>5020-5010-20≤10允许相对偏差/%±20±25±30±50咖啡阳性样品的总离子流图如图2所示,由图2可知,该咖啡样品中同时检出3种甲基咪唑化合物。实施例3按照实施例2的方法进行检测,与实施例2的区别在于,样品为茶叶,其检测结果见表6。茶叶阳性样品的总离子流图如图3所示,由图3可知,该茶叶样品中同时检出3种甲基咪唑化合物。表6茶叶样品检测结果其中,nd代表未检出,最低检出浓度为6μg/kg。实施例4按照实施例2的方法进行检测,与实施例2的不同之处在于:向咖啡样品中加入1-甲基咪唑、2-甲基咪唑和4-甲基咪唑标准品,加标浓度为50μg/kg,测试结果为6次实验的平均值,测试结果如表7所示。实施例5按照实施例2的方法进行检测,与实施例2的不同之处在于:向咖啡样品中加入1-甲基咪唑、2-甲基咪唑和4-甲基咪唑标准品,加标浓度为500μg/kg,测试结果为6次实验的平均值,测试结果如表7所示。实施例6按照实施例2的方法进行检测,与实施例2的不同之处在于:向咖啡样品中加入1-甲基咪唑、2-甲基咪唑和4-甲基咪唑标准品,加标浓度为2000μg/kg,测试结果为6次实验的平均值,测试结果如表7所示。实施例7按照实施例2的方法进行检测,与实施例2的不同之处在于:待测样品为茶叶,向样品中加入1-甲基咪唑、2-甲基咪唑和4-甲基咪唑标准品,加标浓度为50μg/kg,测试结果为6次实验的平均值,测试结果如表7所示。实施例8按照实施例2的方法进行检测,与实施例2的不同之处在于:待测样品为茶叶,向样品中加入1-甲基咪唑、2-甲基咪唑和4-甲基咪唑标准品,加标浓度为500μg/kg,测试结果为6次实验的平均值,测试结果如表7所示。实施例9按照实施例2的方法进行检测,与实施例2的不同之处在于:待测样品为茶叶,向样品中加入1-甲基咪唑、2-甲基咪唑和4-甲基咪唑标准品,加标浓度为2000μg/kg,测试结果为6次实验的平均值,测试结果如表7所示。表7茶叶及咖啡提取物中3种甲基咪唑化合物加标回收结果由表7可知,茶叶及咖啡样品中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的加标浓度为50μg/kg、500μg/kg和2000μg/kg时,平均回收率为100.5~105.5%,精密度为1.6~4.1%。当取0.5g样品时,计算得到1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的定量限为20μg/kg,检出限为6μg/kg,说明本发明提供的前处理方法和检测方法的准确度和精确度高。实施例10将咖啡按照实施例2步骤(1)进行样品前处理得到的空白基质溶液配制标准曲线,将其斜率与溶剂标准曲线斜率的比值来评价基质效应,结果如表8所示。实施例12按照实施例11的方法评价基质效应,与实施例11的区别在于样品为茶叶,结果如表8所示。对比例1按照实施例11的方法评价基质效应,与实施例11的区别在于,茶叶按照《食品安全国家标准食品中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的测定》(征求意见稿)进行样品前处理,结果如表8所示。对比例2按照对比例1的方法评价基质效应,与对比例1的区别在于样品为咖啡,结果如表8所示。表8实施例11~12和对比例1~2中茶叶及咖啡样品中甲基咪唑化合物检测的基质效应基质效应的比值越接近1,说明基质效应影响越小,比值大于1说明存在基质增强效应,小于1说明存在基质抑制效应,由表7可知,采用国标方法进行样品前处理后后茶叶及咖啡的基质效应的比值为0.068~0.518,本发明提供的方法进行样品前处理后茶叶及咖啡的基质效应的比值为0.818~1.105,说明,本发明提供的前处理方法对于茶叶及咖啡中1-甲基咪唑、2-甲基咪唑和4-甲基咪唑的基质效应影响小,检测结果准确性和精确性高。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1