一种圣愈汤标准煎液的特征图谱、特征图谱构建方法和鉴别方法与流程
1.本发明涉及属于中药检测技术领域,具体的涉及一种圣愈汤标准煎液的特征图谱、特征图谱构建方法和鉴别方法,同样也适用于圣愈汤的其他剂型的特征图谱构建和鉴别。
背景技术:
2.圣愈汤为国家中医药管理局发布的《古代经典名方目录(第一批)》100首方剂中的一个经典名方,目录显示圣愈汤出自《兰室秘藏》(金
•
李东垣),方剂描述为:“生地黄、熟地黄、川芎、人参各三分,当归身、黄芪各五分。上
㕮
咀,如麻豆大,都作一服。水二大盏,煎至一盏,去滓,稍热无时服。治诸恶疮,血出多而心烦不安,不得睡眠,亡血故也,以此药主之。”因此,此经典名方的药味组成为生地黄、熟地黄、川芎、人参、当归、黄芪。
3.圣愈汤为国家中医药管理局发布的第一批中药经典名方,是未来经典名方研究的重点方剂之一,经典名方研究指导原则规定经典名方的现代开发是遵古创新的研究思路,在不改变原方组成的情况下进行现代标准煎液和制剂的研究。
4.随着中药及复方制剂的质量控制技术的提升,指标成分的含量测定已不能体现中药及复方制剂的质量优劣。特征图谱/指纹图谱是现代分析技术中展现中药及复方制剂的整体质量的有效方法,2020版《中国药典》部分中药品种也增加了特征图谱的检测。因此,建立经典名方圣愈汤的特征图谱方法,一方面弥补圣愈汤质量控制中特征图谱的研究空白,为经典名方圣愈汤的质量提升提供有力保障,一方面也为经典名方圣愈汤的研究开发提供有效的研究基础。
5.现有技术中有对圣愈汤中部分有效成分含量进行研究,比如:hplc法测定圣愈汤冻干粉中4个指标成分的含量(董丹华,刘玉军,李亚男,胡祥昊,孙平,李婷,刘菊妍,高鹏. hplc法测定圣愈汤冻干粉中4个指标成分的含量[j].中国药房,2020,31(05):576-58),本文献中分别采用甲醇-0.1%磷酸-水溶液,梯度洗脱方法来检测圣愈汤冻干粉中阿魏酸、毛蕊花糖苷、藁本内酯的含量,和采用乙腈-水(32:68,v/v)检测黄芪甲苷的含量。
[0006]
另一篇文献:hplc法测定圣愈汤颗粒中芍药苷的含量(刘倩,梁爱君,梁竹,于燕莉.hplc法测定圣愈汤颗粒中芍药苷的含量[j].解放军药学学报,2012,28(06):531-532),本文献中作者采用异丙醇-甲醇-水-醋酸(2:25:71:2)对圣愈汤颗粒中的芍药苷含量进行了测定。但是这些现有技术仍不能全面控制圣愈汤的质量。
[0007]
中药复方多为复杂的中药的组合物,目前,其质量控制常采用单一的某些成分的含量测定来判断复方制剂的质量,这并不能全面的展现中药复方的整体质量情况,所以需要寻求一种能够全面的定性或定量控制圣愈汤质量的有效方法,且利于推广的检测方法。
技术实现要素:
[0008]
本发明的目的在于提供一种圣愈汤特征图谱的建立方法及其特征图谱,可以解决
现有技术中圣愈汤质量检测仅几个成分的含量,而定性鉴别圣愈汤的质量控制方法空白的问题,可以达到快速判断圣愈汤中是否含中药材生地黄、熟地黄、川芎、当归、黄芪的目的。
[0009]
本发明的目的是通过以下技术方案实现的:一种圣愈汤标准煎液的特征图谱构建方法,包括以下步骤:a.对照品溶液的制备:取洋川芎内酯i、洋川芎内酯ii、隐绿原酸、阿魏酸、鸟苷、腺苷、毛蕊异黄酮葡萄糖苷、绿原酸和咖啡酸的对照品,加溶剂溶解,得对照品溶液;b.供试品溶液的制备:制备圣愈汤标准煎液或其制剂的供试品溶液;c.将步骤a、b中得到的对照品溶液和供试品溶液注入高效液相色谱仪中进行检测,以对照品溶液的特征图谱为参照图谱,从供试品溶液的特征图谱中选择共有峰,构建圣愈汤标准煎液或其制剂的特征图谱。
[0010]
进一步地,所述步骤a中,对照品溶液的制备方法包括:取洋川芎内酯i、洋川芎内酯ii、隐绿原酸、阿魏酸、鸟苷、腺苷、毛蕊异黄酮葡萄糖苷、绿原酸和咖啡酸的对照品,加甲醇溶解定容,制得每1ml含60ug各对照品的对照品溶液。
[0011]
进一步地,所述步骤b中,供试品溶液的制备方法包括:取圣愈汤标准煎液的冻干粉1g,加入体积分数为70-95%的甲醇水溶液25ml,超声处理,放冷,摇匀,滤过,取续滤液,得供试品溶液。
[0012]
进一步地,所述高效液相色谱检测条件满足:色谱柱:以十八烷基硅烷键合硅胶为填充剂;柱温:25℃;流速:1.0ml/min;进样量:10μl;流动相a为甲醇,流动相b为0.1%甲酸溶液,梯度脱洗。
[0013]
进一步地,所述梯度洗脱过程为:0~20min,流动相a为0~2%,流动相b为100~98%,20~35min,流动相a为2~20%,流动相b为98~80%,35~80min,流动相a为20~45%,流动相b为80~55%,80~100min,流动相a为45~60%,流动相b为55~40%100~120min,流动相a为60~80%,流动相b为40~20%。
[0014]
进一步地,所述高效液相色谱仪中检测波长为:0~20min,波长:290nm;20~50min,波长:270nm;50~95min,波长:254nm;95~120min,波长:280nm。
[0015]
进一步地,圣愈汤标准煎液冻干粉的制备步骤为,按原料重量份数计为:取生地黄12份、熟地黄12份、川芎12份、人参12份、当归20份、黄芪20份,加水12倍量水,浸泡30min,煎煮2次,每次1小时,过滤,合并滤液,冷冻干燥成冻干粉。
[0016]
一种圣愈汤标准煎液的特征图谱,所述特征图谱包含9个已知结构的共有峰,9个共有峰中包括洋川芎内酯i、洋川芎内酯ii、隐绿原酸、阿魏酸、鸟苷、腺苷、毛蕊异黄酮葡萄糖、绿原酸、咖啡酸的特征峰。
[0017]
一种圣愈汤标准煎液的鉴别方法,包括以下步骤:a.称取待鉴定的圣愈汤标准煎液冻干粉适量,分别制得圣愈汤标准煎液或其制剂的样
品溶液;b.将步骤a中制得的样品溶液,分别注入高效液相色谱仪检测,即得对应的待鉴定的特征色谱;c.将步骤b中得到的待鉴定的特征色谱与权利要求1所述方法构建得到的对应的特征图谱进行比对,若待鉴定的特征色谱与之对应的构建得到的特征色谱一致,则鉴别为质量合格。
[0018]
本发明与现有技术相比,具有以下优点及有益效果:(1)、圣愈汤作为国家中医药管理局发布的《古代经典名方目录(第一批)》100首方剂中的一个经典名方,是后世医家在辨证论治的基础,本发明采用高效液相色谱法构建了圣愈汤标准汤剂及其其他制剂的特征图谱,并通过此特征图谱,实现了圣愈汤配方快速鉴别,方法简单。本技术方案一方面弥补经典名方圣愈汤及其制剂质量控制中特征图谱的研究空白,为经典名方圣愈汤的质量提升提供有力保障;另一方面也为经典名方圣愈汤的研究开发提供有效的研究基础。
[0019]
(2)、本发明方法通过多批圣愈汤标准汤剂冻干粉的验证,制定了21个共有特征峰。并通过对21个特征峰的相对保留时间进行规定,可快速的鉴别供试品溶液中的黄芪、当归、川芎、生地黄和熟地黄,为圣愈汤及其制剂的定性鉴别提供有力的保障。
[0020]
(3)、本发明方法以高效液相色谱法采用梯度脱洗进行测定,具有操作简单、分离度好、精密度高、重复性好以及稳定性好等优点。
[0021]
(4)、本发明中,用本技术方案中的参数,得到的图谱基线平稳、分离度好、峰形较好、出峰较多、首次提供了对圣愈汤处方药味的全面控制的特征图谱方法。
[0022]
(5)、本发明中,使用本技术方案的方法,结合本技术方案中的参数,能够实现生地黄和熟地黄的鉴别,有效的保障了经典名方圣愈汤的投料的准确性。
附图说明
[0023]
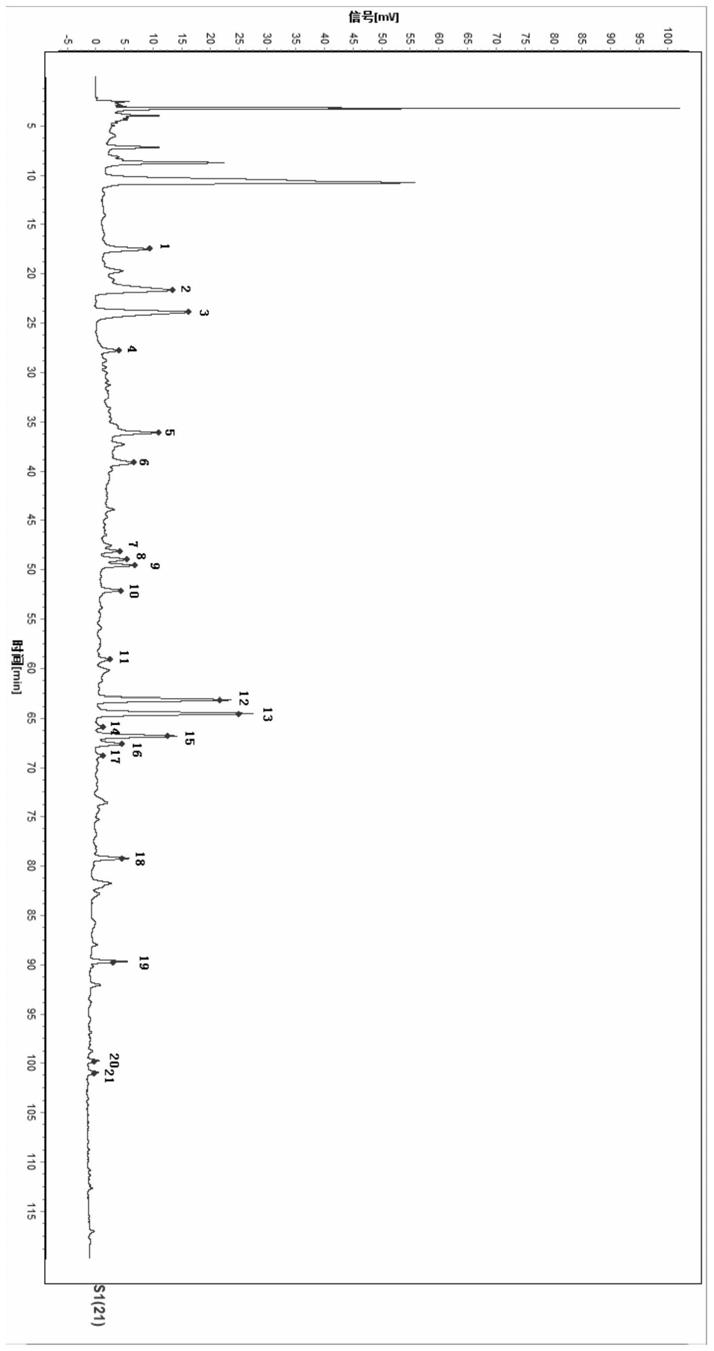
本发明的前述和下文具体描述在结合以下附图阅读时变得更清楚,附图中:图1是圣愈汤标准煎液对照特征图谱(其中:峰2、鸟苷;峰3、腺苷;峰7、隐绿原酸;峰8、咖啡酸;峰9、绿原酸;峰12、洋川芎内酯i;峰13、阿魏酸;峰15、毛蕊异黄酮葡萄糖苷;峰16、洋川芎内酯ii)。
[0024]
图2是圣愈汤标准煎液与缺阴性供试品溶液对比图。
[0025]
图3是圣愈汤标准煎液与单阴性供试品溶液对比图。
[0026]
图4是实施例3中各单阴性供试品溶液峰的统计表。
[0027]
图5是圣愈汤标准煎液特征图谱建立过程中吸收波长考察的特征图谱。
[0028]
图6是实施例5的圣愈汤特征峰指认图。
[0029]
图7是实施例5的圣愈汤特征峰指认图。
[0030]
图8是实施例5的圣愈汤特征峰指认图。
[0031]
图9是精密度试验结果-相对保留时间的统计表。
[0032]
图10是重复性试验结果-相对保留时间的统计表。
[0033]
图11是中间精密度试验结果-相对保留时间的统计表。
[0034]
图12是稳定性试验结果-相对保留时间的统计表。
[0035]
图13是稳定性试验结果-相对峰面积的统计表。
[0036]
图14是10批圣愈汤标准汤剂相对保留时间测定结果的统计表。
[0037]
图15是10批圣愈汤标准汤剂相对峰面积测定结果的统计表。
[0038]
图16是10批圣愈汤特征图谱验证结果图。
具体实施方式
[0039]
本发明提供一种圣愈汤标准煎液的特征图谱、特征图谱构建方法和鉴别方法,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处描述的具体实施例仅用以理解本发明,并不用于限定本发明。
[0040]
以下通过具体实施例对本发明做进一步说明。
[0041]
实施例中所涉及的实验仪器及材料如下:高效液相色谱仪:安捷伦1260高效液相色谱仪、岛津lc-20ad高效液相色谱仪;超声波清洗器 kq-600db型(600w, 40khz;昆山市超声仪器有限公司);电子天平:me204e/02、ms205du、xp26(梅特勒-托利多仪器有限公司);超纯水机:细胞型1810a(上海摩勒科学仪器有限公司);色谱柱:安捷伦zorbax sb-aq c18 250*4.6mm*5μm。
[0042]
试剂:甲醇、甲酸为色谱纯,水为超纯水,其余试剂均为分析纯;试药:洋川芎内酯i(批号:wkq18041806,纯度:98%,四川省维克奇生物科技有限公司)、洋川芎内酯ii(批号:wkq18010302,纯度:98%,四川省维克奇生物科技有限公司)、隐绿原酸(批号:wkq19011612,纯度:98%,四川省维克奇生物科技有限公司)、阿魏酸(批号:110773-201915,纯度:99.4%,中国食品药品检定研究院)、鸟苷(批号:111977-201501,纯度:93.6%,中国食品药品检定研究院)、腺苷(批号:110879-201703,纯度:99.7%,中国食品药品检定研究院)、毛蕊异黄酮葡萄糖苷(批号:111920-201606,纯度:97.6%,中国食品药品检定研究院)、绿原酸(批号:110753-201817,纯度:96.8%,中国食品药品检定研究院)、咖啡酸(批号:110885-201703,纯度:99.7%,中国食品药品检定研究院);黄芪饮片(批号:sy022200501、xls201808870、xls201808868、xls201808876、xls201808872)、当归饮片(批号:xls201912017、xls201910006、xls201910063、xls201910064、xls201912019、xls201910026、xls201910008、xls201910013、xls201912020、xls201912038)、人参xls201806032、川芎xls20200301、生地黄010117-1912002、熟地黄xls20200801,圣愈汤标准煎液冻干粉(sytbt01、stybt02、stybt03、sytbt04、sytbt05、sytbt06、sytbt07、sytbt08、sytbt09、sytbt10)。
[0043]
实施例1本实施例涉及圣愈汤的多种剂型的制备,包括圣愈汤的液体制剂或固体制,具体的制备方法为:圣愈汤标准煎液冻干粉的制备:按原料重量份数计为:取生地黄12份、熟地黄12份、川芎12份、人参12份、当归20份、黄芪20份,加水12倍量水,浸泡30min,煎煮2次,每次1小时,过滤,合并滤液,冷冻干燥成冻干粉。
[0044]
冷冻干燥成冻干粉的冷冻程序为预冻-升华干燥-解析干燥,具体控制参数如表1所示。
[0045]
表1以液体制剂中的口服液为例,圣愈汤口服液的制备方法:前述步骤与圣愈汤标准煎液的制备方法相同,最后合并滤液后,将滤液浓缩制得浓缩液,再向浓缩液中加辅料麦芽糖醇液、糊精、甜菊糖苷等,制得口服液或者相应的其他液体制剂。
[0046]
圣愈汤中的固体制剂,以颗粒剂为例,圣愈汤颗粒剂的制备方法:前述步骤与圣愈汤标准煎液的制备方法相同,最后合并滤液后,滤液浓缩制得浓缩液,再将浓缩液干燥后加辅料糊精、乳糖等制粒得颗粒剂。
[0047]
其中,圣愈汤的制剂提取方法皆采用经典名方古法煎煮提取,并采用现代制剂工艺制备成为不同的口服液或固体制剂。
[0048]
实施例2:本实施例涉及圣愈汤标准煎液的特征图谱建立,具体包括以下步骤:a.对照品溶液的制备:取洋川芎内酯i、洋川芎内酯ii、隐绿原酸、阿魏酸、鸟苷、腺苷、毛蕊异黄酮葡萄糖苷、绿原酸和咖啡酸的对照品适量,加甲醇溶解定容,分别制得每1ml各含60ug的对照品溶液;b.供试品溶液的制备:取圣愈汤标准煎液的冻干粉1g,置于150ml具塞锥形瓶中,加入体积分数为 70% 的甲醇水溶液25ml,密塞,超声处理30min,放冷,滤过,取续滤液,得供试品溶液;c.检测:将所述对照品溶液和供试品溶液注入高效液相色谱仪中进行检测,以对照品溶液的特征图谱为参照图谱,从供试品溶液的特征图谱中选择共有峰,构建圣愈汤剂的特征图谱。
[0049]
所述高效液相色谱检测条件满足:色谱柱:以十八烷基硅烷键合硅胶为填充剂;柱温:25℃;流速:1.0ml/min;进样量:10μl;流动相a为甲醇,流动相b为0.1%甲酸溶液,梯度脱洗。
[0050]
所述梯度洗脱过程为:0~20min,流动相a为0~2%,流动相b为100~98%,20~35min,流动相a为2~20%,流动相b为98~80%,35~80min,流动相a为20~45%,流动相b为80~55%,80~100min,流动相a为45~60%,流动相b为55~40%100~120min,流动相a为60~80%,流动相b为40~20%。
[0051]
所述检测波长为:0~20min,波长:290nm;20~50min,波长:270nm;50~95min,波长:254nm;95~120min,波长:280nm。理论板数按洋川芎内酯i峰计算应不低于5000。
[0052]
d. 以步骤c中对照品溶液的特征图谱为参照图谱,从供试品溶液的特征图谱中选择共有峰,构建圣愈汤标准煎液的特征图谱。构建的圣愈汤标准煎液的特征图谱共有21个特征峰,其中与洋川芎内酯i参照物相应的峰为s峰。计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的
±
10%之内。规定值为:0.277(峰1)、0.343(峰2:鸟苷)、0.378(峰3:腺苷)、0.439(峰4)、0.571(峰5)、0.620(峰6)、0.761(峰7:隐绿原酸)、0.775(峰8:咖啡酸)、0.785(峰9:绿原酸)、0.825(峰10)、0.936(峰11)、1.000(峰12:洋川芎内酯i,s)、1.022(峰13:阿魏酸)、1.043(峰14)、1.058(峰15:毛蕊异黄酮葡萄糖苷)、1.071(峰16:洋川芎内酯ii)、1.090(峰17)、1.255(峰18)、1.421(峰19)、1.580(峰20)、1.599(峰21),如图1所示。
[0053]
本实施例中使用的图谱构建方法,同样适用于圣愈汤的其他制剂,比如以口服液、水煎液为例的液体制剂,以片剂、粉剂、颗粒剂或胶囊剂为例的固体制剂。
[0054]
实施例3本实施例涉及鉴别缺某味或者多味药材的“圣愈汤标准煎液”的鉴别。具体步骤如下:对照品溶液的制备:取洋川芎内酯i、洋川芎内酯ii、隐绿原酸、阿魏酸、鸟苷、腺苷、毛蕊异黄酮葡萄糖苷、绿原酸和咖啡酸的对照品适量,加甲醇溶解定容,制得每1ml各含60ug的对照品溶液;缺阴性供试品溶液的制备:分别取
ꢀ“
缺当归的圣愈汤标准煎液的冻干粉”、“缺川芎的圣愈汤标准煎液的冻干粉”、“缺黄芪的圣愈汤标准煎液的冻干粉”、“缺人参的圣愈汤标准煎液的冻干粉”、“缺生、熟地黄的圣愈汤标准煎液的冻干粉”各1g,加入体积分数为 70% 的甲醇水溶液25ml,超声处理30min,放冷,摇匀,滤过,取续滤液,分别制备得“缺当归”、
ꢀ“
缺川芎”、“缺黄芪”、“缺人参”、“缺生、熟地黄”的缺阴性供试品溶液;单阴性供试品溶液的制备:分别取当归、黄芪、川芎、人参、生地黄、熟地黄标准汤剂冻干粉各1g,加入体积分数为 70% 的甲醇水溶液或甲醇25ml,超声处理30min,放冷,摇匀,滤过,取续滤液,分别制得单阴性供试品溶液。
[0055]
将所述对照品溶液和缺阴性和单阴性的供试品溶液注入高效液相色谱仪中进行检测,以对照品溶液的特征图谱为参照图谱,进行测定。结果如下图2-3。
[0056]
由图2可知:与供试品溶液相比,对于缺黄芪阴性溶液,特征图谱峰中,峰15、18、21为黄芪的特有峰;对于缺生/熟地黄阴性溶液,峰11、14、17为生/熟地黄的特有峰;对于缺川芎阴性溶液,峰5为川芎的特有峰;对于缺当归阴性溶液,峰4为当归的特有峰。表明该方法能准确的鉴定出黄芪、当归、川芎、生地黄、熟地黄。
[0057]
根据单阴性供试品溶液图谱与圣愈汤标准煎液图谱的指认可知:1号峰为人参、黄芪、当归、川芎、生地黄的共有峰,2号(鸟苷)为人参、当归、川芎的共有峰,3号(腺苷)为人参、川芎、当归、生地黄、熟地黄的共有峰,4号为当归特有峰,5号为当归、川芎共有峰,6号为:人参、黄芪、当归、川芎、熟地黄的特有峰,7号(隐绿原酸)为当归、川芎的共有峰,8号(咖啡酸)为川芎、当归的共有峰,9号(绿原酸)为人参、川芎、当归的共有峰,10号为黄芪、川芎、当归的共有峰、11号为生地黄和熟地黄的特有峰,12号(洋川芎内酯ⅰ)为川芎和当归的共有峰、13号(阿魏酸)为川芎、当归的特共有峰,14号为生地黄、熟地黄的特有峰,15号(毛蕊异黄酮葡萄糖苷)为黄芪的特有峰,16号(洋川芎内酯ⅱ)为川芎、当归的共有峰,17号峰为生地黄、熟地黄的共有峰,18、19号为黄芪的特有峰,20号峰为人参、川芎的共有峰,21号峰为黄芪、川芎的共有峰。详见下图示4。
[0058]
由图3-4可知,该方法能有效鉴别圣愈汤中的川芎、当归、黄芪、生地黄及熟地黄,同时,本方法通过峰1、峰6的鉴别,实现了该汤剂中对生地黄和熟地黄的鉴别。
[0059]
本方法中,柱温、流速、提取溶剂、用量、提取时间均采用实验中常用的参数,在实验过程中对特征图谱的建立影响不大,不会影响色谱峰的出峰顺序以及峰的数目,提取溶剂甲醇采用70-95%甲醇溶液均可,对出峰结果影响不大,选取常用的70%甲醇作为提取溶剂,这部分未在文中再进行叙述。
[0060]
实施例4波长的考察根据不同波长条件下供试品色谱峰的数目及峰高,综合考虑采用切波长采集色谱图的方法进行供试品溶液的测定。
[0061]
以实施例2所述圣愈汤标准煎液的冻干粉的供试品溶液为对象,分别调取波长254nm、260nm、270nm、280nm、290nm下色谱图进行对比,见下图5。
[0062]
由图5可知,在0~20min内,以290nm波长下,峰1较单纯,可作为特征峰;20~50min内,以270nm波长下,特征峰的峰形较好,峰高合适;50~95min内,以254nm波长下,特征峰的峰形较好,峰高合适;95~120min内,以280nm波长下,特征峰的峰形较好,峰高合适;综合考虑,采用切波长方法对供试品溶液进行特征峰的采集。切波长方法如下表2。
[0063]
表2时间(min)波长(nm)0~2029020~5027050~9525495~120280实施例5色谱峰的指认供试品溶液的制备:以实施例2所述圣愈汤标准煎液冻干粉的供试品溶液制备方法制备供试品溶液。
[0064]
对照品参照物溶液的制备:取对照品洋川芎内酯、洋川芎内酯ii、隐绿原酸、阿魏酸、鸟苷、腺苷、毛蕊异黄酮葡萄糖液、绿原酸、咖啡酸对照品适量,分别加入加甲醇,制成每1ml含各对照品60μg的对照品溶液。
[0065]
对圣愈汤标准煎剂的特征图谱进行定位、对比,指认出2号峰为鸟苷,3号峰为腺苷,7号峰为隐绿原酸,8号峰为咖啡酸,9号峰为绿原酸,12号峰为洋川芎内酯i,13号峰为阿魏酸,15号峰为毛蕊异黄酮葡萄糖苷,16号峰为洋川芎内酯ii,参见图6-8所示特征图谱。
[0066]
结果表明,供试品色谱图中,共指认出9个特征峰,分别为峰2:鸟苷、峰3:腺苷、峰7:隐绿原酸、峰8:咖啡酸、峰9:绿原酸、峰12:洋川芎内酯i、峰13:阿魏酸、峰15:毛蕊异黄酮葡萄糖苷、峰16洋川芎内酯ii。
[0067]
实施例6精密度的考察精密称取圣愈汤冻干粉1g,按照实施例2所述方法制备供试品溶液,并注入液相色谱仪,连续进样6次,计算各特征峰相对保留时间rsd%的范围为0~0.51%,表明该方法的精密度良好。结果见图9。
[0068]
实施例7重复性的考察按照实施例2中圣愈汤标准煎液供试品溶液的制备方法,平行制备6份供试品溶液,注入液相色谱仪,进行测定,计算各重复性试验供试品溶液中各特征峰的相对保留时间。结果见图示10,结果表明,6份供试品溶液各特征峰的rsd%范围为0~0.35%,表明供试品的制备方法重复性良好。
[0069]
实施例8中间精密度考察按照实施例2的圣愈汤标准煎液供试品溶液制备方法,分别由不同人员(a、b)在不同时间(t1 、t2)分别制备两份供试品溶液,进行测定。结果如图示11所示,表明,不同人员在不同时间制备供试品的测定结果中,各特征峰的rsd%在0~0.38%,表明该方法的中间精密度良好。
[0070]
实施例9稳定性的考察按照实施例2的圣愈汤标准煎液供试品溶液的制备方法,制备一份供试品溶液,分别在0、4、8、12、16、24、42小时,测定各特征峰的稳定性结果见图示12-13,实验结果表明,稳定性试验中各特征峰的相对保留时间的rsd%在0~0.54%,各特征峰的相对峰面积的rsd%在0~15.34%,除特征峰2和特征峰11的相对峰面积的rsd%值大于5%,其余各特征峰相对峰面积的rsd%均小于5%,表明供试品溶液在42小时内的稳定性较好。
[0071]
实施例10方法学验证按照实施例2的供试品溶液的制备方法,制备10批圣愈汤标汤进行测定,10批圣愈汤标准汤剂相对保留时间测定结果如图示14,10批圣愈汤标准汤剂相对峰面积测定结果如图示15,10批圣愈汤特征图谱如图16,根据10批圣愈汤标准煎液的特征图谱测定结果,选择其中重现性较好的21个色谱峰作为圣愈汤标准煎液的共有特征峰,且其相对保留时间的rsd%在0~0.42%,可以纳入特征峰的规定。21个共有峰的相对峰面积的rsd%在0~62.94%,各特征峰的相对峰面积偏差较大,故不纳入特征峰的规定。同时根据各特征峰的指认情况,选取12号峰(洋川芎内酯i)作为s,计算各特征峰的相对保留时间;同时为了增加方法的重现性和适
用性,故将各峰的相对保留时间规定值暂定为10%。
[0072]
因此,圣愈汤标准煎液的21个特征峰相对保留时间规定为:供试品色谱中应呈现21个特征峰,其中与洋川芎内酯i参照物相应的峰为s峰。计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的
±
10%之内。规定值为:0.277(峰1)、0.343(峰2)、0.378(峰3)、0.439(峰4)、0.571(峰5)、0.620(峰6)、0.761(峰7)、0.775(峰8)、0.785(峰9)、0.825(峰10)、0.936(峰11)、1.000(峰12,s)、1.022(峰13)、1.043(峰14)、1.058(峰15)、1.071(峰16)、1.090(峰17)、1.255(峰18)、1.421(峰19)、1.580(峰20)、1.599(峰21)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1