一种检测SARS-CoV-2抗原的试剂盒、方法以及用途与流程
一种检测sars-cov-2抗原的试剂盒、方法以及用途
技术领域
1.本技术涉及一种用于检测sars-cov-2抗原的试剂盒、一种用于检测 sars-cov-2抗原的方法以及一种试剂盒在检测sars-cov-2抗原中的用途。
背景技术:
2.新型冠状病毒(sars-cov-2)为单股正链rna病毒,属于β属的冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60~140nm。人感染新型冠状病毒后常见体征有呼吸道症状、发热、咳嗽、气促和呼吸困难等。在较严重的病例中,感染可导致肺炎、严重急性呼吸综合征、肾衰竭,甚至死亡。2020年1月10日,sars-cov-2的第一个基因组序列数据被公布,后来陆续有多个从患者身上分离的病毒基因组序列发布。徐心恬等(xintian xu等,science china life sciences,2020)通过遗传进化分析,推测 sars-cov-2的自然宿主与sars一样为蝙蝠,通过分子结构模拟计算,得出sars-cov-2是通过其刺突蛋白(spike protein,s蛋白)的s1亚基上受体结合区(receptor binding domain,rbd)与人血管紧张素转化酶ii(ace2) 相互作用的分子机制,来感染人呼吸道上皮细胞。中科院石正丽团队(zhou p等,nature,2020)通过体外实验发现sars-cov-2能感染过表达人ace2的非敏感细胞,表明sars-cov-2可以利用sars-cov的相同受体ace2入侵细胞。美国研究人员(daniel wrapp等,science,2020)通过对sars-cov-2的s蛋白三聚体冷冻em结构研究,进一步得出 sars-cov-2比sars-cov以更高的亲和力结合ace2。
3.目前新型冠状病毒的体外检测以及确诊主要采用实时荧光聚合酶链式反应(rt-pcr)的方法进行核酸检测。随着确诊人数的不断攀升,由于核酸检测试剂阳性率过低,出现了大量高度疑似的病例连续核酸检测阴性而不能确诊的情况;而大量疑似患者不能及时进行诊断,高危携带群体可能再次成为感染源,对疫情的防控带来极大的不利影响。
4.国家卫健委临床检验中心推荐的一个行之有效的办法就是补充 sars-cov-2特异性抗体(igm或igg)的检测。抗体是机体感染病毒后免疫应答的产物,通常igm抗体在感染早期出现,igg抗体在感染中晚期出现。sars-cov-2抗体的检测可以明确患者是否“近期或既往感染过新型冠状病毒”,一定程度上有助于核酸检测阴性但临床上疑似患者的确诊。抗体检测对临床实验室的操作要求相对于核酸检测要低,可以快速、大量检测。但 sars-cov-2特异性抗体检测存在一个“窗口期”问题:新型冠状病毒肺炎发病3~5天后,血清特异性抗体逐渐产生。首先出现的是免疫球蛋白igm抗体,约在5~7天产生;然后出现igg抗体,约在10~15天产生。通常情况下, igm抗体产生早,一经感染,快速产生,维持时间短,消失快,血液中检测阳性可作为早期感染的指标。igg抗体产生晚,维持时间长,消失慢,血液中检测阳性可作为感染和既往感染的指标。由于sars-cov-2抗原进入机体需经过一定的潜伏期才会产生igm与igg,在这一期间,血清无法检出igm 与igg,因此其无法检测处于窗口期的患者是否受到感染。
5.另一种快速、高通量的方法是进行sars-cov-2抗原的检测。传统的抗原血清学检测一般采用双抗体夹心法,即分别使用两个特异性抗sars-cov-2 抗体,其中一个作为固相
上的捕获抗体,另一个作为检测抗体;当样本中存在sars-cov-2抗原时,检测试剂与样本混合孵育后形成“抗体-抗原-抗体”的夹心复合物;最终通过检测信号值的高低确定血清或血浆中抗原的含量。由于这种sars-cov-2抗原检测需要使用两个特异性抗sars-cov-2抗体,因此,其成本相对较高。
6.目前急需开发快速、高通量的体外诊断工具,可以用来检测疑似以及确诊病例,同时也可以对疫区高危人群进行筛查,这将有利于全面控制疫情。
7.
技术实现要素:
8.本技术的目的在于提供一种用于检测sars-cov-2抗原的试剂盒、一种用于检测sars-cov-2抗原的方法以及试剂盒在检测sars-cov-2抗原中的用途。本技术用于检测sars-cov-2抗原试剂盒仅需采用一个特异性抗体即可实现sars-cov-2抗原的检测。
9.本技术第一方面涉及一种用于检测sars-cov-2抗原的试剂盒,其至少包含捕获组分和检测组分,其中,该捕获组分为包被有特异性抗sars-cov-2 抗体的固相载体并且该检测组分为标记有可检测的信号标记物的人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段,或者,该捕获组分为包被有人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段的固相载体并且该检测组分为标记有可检测的信号标记物的特异性抗sars-cov-2抗体,其中,该捕获组分用于捕获待测样本中的sars-cov-2抗原。
10.本技术第二方面涉及一种用于检测sars-cov-2抗原的方法,该方法包括:
11.将待测样本和捕获组分混合;
12.将获得的混合物进行清洗,以除去未结合的物质;
13.在经清洗的该混合物中加入经标记的检测组分进行混匀,使得所述检测组分与混合物结合,形成夹心复合物;
14.对上述夹心复合物进行清洗,以除去未结合的物质;
15.在经清洗的该夹心复合物中加入检测底物,以进行检测。
16.具体而言,在本技术的用于检测sars-cov-2抗原的方法中,包被有特异性抗sars-cov-2抗体的固相载体用作捕获组分,同时利用sars-cov-2 抗原与人血管紧张素转化酶ii(ace2)蛋白具有高亲和力的特性,采用标记有可检测的信号标记物的ace2蛋白、多肽或蛋白片段用作检测组分;或者,包被有ace2蛋白、多肽或蛋白片段的固相载体用作捕获组分并且标记有可检测的信号标记物的特异性抗sars-cov-2抗体用作检测组分。在将捕获组分、检测组分以及检测底物与待测样本混合孵育后形成“抗sars-cov-2抗体-sars-cov-2抗原-ace2”的夹心复合物,最终通过信号标记物上产生的信号值高低确定样本中sars-cov-2抗原的含量。
17.此外,本技术还涉及试剂盒在检测sars-cov-2抗原中的用途,该试剂盒至少包含捕获组分和检测组分,其中,该捕获组分为包被有特异性抗 sars-cov-2抗体的固相载体并且该检测组分为标记有可检测的信号标记物的人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段,或者,该捕获组分为包被有人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段的固相载体并且该检测组分为标记有可检测的信号标记物的特异性抗sars-cov-2抗体,其中,该捕获组分用于捕获待测样本中的sars-cov-2抗原。
附图说明
18.在下文中,参考附图描述本技术的一些实施方式。根据以下详细描述和附图,将进一步理解本技术的目的和优点。附图示出:
19.图1示出本技术的新型冠状病毒(sars-cov-2)抗原检测试剂盒1的定标曲线;
20.图2示出对比实例的新型冠状病毒(sars-cov-2)抗原检测试剂盒2的定标曲线;
21.图3示出本技术的新型冠状病毒(sars-cov-2)抗原检测试剂盒3的定标曲线。
具体实施方式
22.在下文中,将通过具体实施例更详细地描述本技术。然而,这些实施例只是代表性的并且本技术将决不被理解为受这些实施例的限制。
23.当在本技术的上下文中这些表述、特征、数值或范围结合例如为“大约、基本上、一般而言、至少、最少”等的表述提及时,本技术同样包括准确的或精确的表述、特征、数值或范围等。
24.在本技术的范围中,抗体有时也指抗体或其抗原结合性抗体片段,而抗原结合性抗体片段是指在对氨基酸序列构成的表位进行特异性识别的抗体的部分片段中,具有与原抗体相同的抗原结合性的片段。
25.在本技术的范围中,术语检测可以与“测定”、“定量”、“分析”等用语相互变换地使用,意指包含定量的和定性的确定。本技术中的检测优选在体外进行。
26.在本技术的范围中,术语cut-off值是指阳性判断值,是判断检测结果阴阳性的标准。cut-off值一般采用roc曲线的分析方式来选择确定。
27.在本技术的范围中,术语roc曲线(receiver operating characteristic curve,受试者工作特征曲线)是以假阳性率(1-特异性)为横坐标,真阳性率(灵敏度)为纵坐标所绘制的一条曲线,是反应灵敏度和特异性连续变量的综合指标。为了综合评估试剂盒的特异性和灵敏度,可以采用约登指数(youden index)这一概念:约登指数=特异性%+灵敏度%-1,最大约登指数所对应的截断点对应值作为cut-off值能够保证试剂盒的准确度最优。
28.本技术第一个方面涉及用于检测sars-cov-2抗原的试剂盒,其至少包含捕获组分和检测组分,其中,该捕获组分为包被有特异性抗sars-cov-2 抗体的固相载体并且该检测组分为标记有可检测的信号标记物的人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段,或者,该捕获组分为包被有人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段的固相载体并且该检测组分为标记有可检测的信号标记物的特异性抗sars-cov-2抗体,其中,该捕获组分用于捕获待测样本中的sars-cov-2抗原。
29.在本技术第一方面的一些实施方式中,抗sars-cov-2抗体选自单克隆抗体、双特异性抗体、嵌合抗体、人源化抗体、单链抗体,或单克隆抗体、双特异性抗体、嵌合抗体、人源化抗体或单链抗体的抗原结合片段。
30.在本技术第一方面的一些实施方式中,抗sars-cov-2抗体特异性地结合sars-cov-2上的任意表位;优选地,特异性地结合sars-cov-2的刺突蛋白(spike protein,s蛋白);更优选地,特异性地结合sars-cov-2的刺突蛋白的s1亚基;最优选地,特异性地结合sars-cov-2的s1亚基的非“受体结合区(receptor binding domain,rbd)”。
31.在本技术第一方面的一些实施方式中,人血管紧张素转化酶ii(ace2) 蛋白、多肽或蛋白片段为重组蛋白或天然蛋白。
32.在本技术第一方面的一些实施方式中,固相载体可以选自磁性微珠、芯片、试纸等,优选为磁性微珠,更优选为超顺磁性磁珠。
33.在本技术第一方面的一些实施方式中,本技术的用于检测sars-cov-2 抗原的试剂盒还可以包括其他试剂成分,包括但不限于一次抗体、标记抗体或ace2、标记酶等标记物质;显色底物、荧光底物、化学发光底物、生物素-链霉亲和素等特异性结合物质、不溶性载体、阻断剂、稀释液、洗涤液、标准物质等。
34.例如,应用于化学发光酶免疫测定法(cleia)的试剂盒可以包括包被于固相上的抗体、酶标记抗体、化学发光底物、稀释液、洗涤液等。当然,在其他实施例中,本技术实施例的抗体也可应用于制备基于双抗体夹心法或竞争法的酶免疫测定试剂盒、电化学发光免疫测定试剂盒、免疫层析试剂盒等。
35.在本技术第一方面的一些实施方式中,检测组分中的信号标记物可以例如是化学发光标记物(例如碱性磷酸酶、鲁米诺、异鲁米诺、吖啶酯、辣根过氧化物酶)、电化学发光标记物(例如三联吡啶钌)、量子点(例如金量子点、cdse量子点、zncdse量子点等)、荧光微球等,或其组合。
36.在本技术第一方面的一些实施方式中,捕获组分的浓度在0.1mg/ml至 1.0mg/ml之间。
37.在本技术第一方面的一些实施方式中,检测组分的浓度在0.1μg/ml至 2.0μg/ml之间。
38.本技术第二方面涉及一种用于检测sars-cov-2抗原的方法,该方法包括:
39.将待测样本和捕获组分混合;
40.将获得的混合物进行清洗,以除去未结合的物质;
41.在经清洗的该混合物中加入经标记的检测组分进行混匀,使得所述检测组分与混合物结合,形成夹心复合物;
42.对上述夹心复合物进行清洗,以除去未结合的物质;
43.在经清洗的该夹心复合物中加入检测底物,以进行检测;
44.其中,
45.当该捕获组分为包被有特异性抗sars-cov-2抗体的固相载体时,则该检测组分为标记有可检测的信号标记物的人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段,或者,当该捕获组分为包被有人血管紧张素转化酶ii (ace2)蛋白、多肽或蛋白片段的固相载体时,则该检测组分为标记有可检测的信号标记物的特异性抗sars-cov-2抗体,其中,该捕获组分用于捕获待测样本中的sars-cov-2抗原。
46.采用本技术的试剂盒进行免疫学测定的方法例如可以为酶联免疫吸附测定法(elisa)、化学发光酶免疫测定法(cleia)、化学发光免疫测定法(clia)、荧光抗体法(fat)、荧光酶免疫测定法(feia)、电化学发光免疫测定法 (eclia)、放射免疫测定法(ria)、免疫层析法、凝集法、竞争法等,但并不限于这些方法。本技术实施例尤其是适合应用于化学发光酶免疫测定法。
47.elisa(enzyme-linked immunosorbent assay)是使用酶标记抗体进行的免疫测
定法之一,包括直接法、间接法等,例如夹心elisa。所谓的夹心elisa 是指:使用抗原识别部位不同的抗体,其中一个抗体包被于固相上,并使用另一抗体来夹持要进行检测的抗原,从而形成抗体-抗原-抗体复合体。
48.化学发光酶免疫测定法包括免疫反应和化学发光两个部分,其原理为:使样本中的抗原与固定于固相上的抗体进行反应后,与酶标记抗体进行反应,并在洗涤后加入化学发光底物进行酶反应,然后测定发光强度。
49.在本技术第二方面的一些实施方式中,待测样本可以是鼻拭子、咽拭子、肛拭子、痰液、肺泡灌洗液、血液、血液组分例如全血、血清或血浆,优选为咽拭子。但本技术的样本不限于此,也可以是浆膜液、淋巴液、尿。
50.在本技术第二方面的一些实施方式中,待测样本的样本量5μl至50μl 之间。
51.在本技术第二方面的一些实施方式中,可以采用两种不同的加样方式,例如,可以先加入待测样本、捕获组分孵育后,磁场吸住磁珠,洗去未结合的物质,再加入检测组分孵育(加样方式1);或者先加入待测样本、捕获组分和检测组分后,再进行孵育(加样方式2)。在本技术第二方面的一些实施方式中,优选采用加样方式1。
52.在本技术第二方面的一些实施方式中,孵育时间在2min至20min之间。此外,本技术还涉及根据本技术第一方面所述的试剂盒在检测sars-cov-2 抗原中的用途。
53.此外,本技术还涉及试剂盒在检测sars-cov-2抗原中的用途,所述试剂盒至少包含捕获组分和检测组分,其中,该捕获组分为包被有特异性抗 sars-cov-2抗体的固相载体并且该检测组分为标记有可检测的信号标记物的人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段,或者,该捕获组分为包被有人血管紧张素转化酶ii(ace2)蛋白、多肽或蛋白片段的固相载体并且该检测组分为标记有可检测的信号标记物的特异性抗sars-cov-2抗体,其中,该捕获组分用于捕获待测样本中的sars-cov-2抗原。
54.以下描述本技术的一些实施例,这些实施例不是为了限制本技术,而是为了更好地说明本技术。
55.实施例1新型冠状病毒(sars-cov-2)抗原检测试剂盒1的制备
56.步骤1:捕获组分的制备
57.将特异性抗sars-cov-2抗体(三优生物医药(上海)有限公司,aha001) 包被于磁性微珠(简称磁珠)(thermo fisher)表面。下面详细描述相应的包被方法:
58.首先将特异性抗sars-cov-2抗体进行前处理,通过透析去除其缓冲基质中的保护组分。按照每毫克磁珠加入0.5μg至40μg的抗体的比例进行包被。在反应过程中磁珠表面的羧基在edc/nhs催化下与特异性抗sars-cov-2 抗体的氨基进行偶联。典型的制备过程为:取20mg表面修饰有羧基的磁珠,超声分散于10mm mes缓冲液中,加入80mg edc和120mg nhs,超声混合均匀后,置于37℃摇床15min。之后在处理后的磁珠中,按照比例加入特异性抗sars-cov-2抗体,混匀,并置于37℃摇床反应10h至18h。清洗封闭后,制备得到包被有特异性抗sars-cov-2抗体的磁珠包被物。将磁珠包被物稀释于50mm mes缓冲液(0.5m nacl、0.5%bsa、0.05%吐温20, ph=6.0),磁珠包被物浓度为0.5mg/ml。
59.步骤2:检测组分的制备
60.将人血管紧张素转化酶ii(ace2)(北京义翘神州科技股份有限公司, 10108-h02h)与碱性磷酸酶(roche life science)进行偶联,制备得酶标记物。将酶标记物稀释于
50mm mes缓冲液(0.5m nacl、0.5%bsa、0.05%吐温20,ph=6.0),酶标标记物浓度为1.0μg/ml。
61.步骤3:样本检测
62.第一步,将从采集自新冠肺炎确诊病例(核酸检测为阳性)的咽拭子样本(20μl)和包被有特异性抗sars-cov-2抗体的磁珠添加到反应管中孵育,该样本中的sars-cov-2抗原与磁珠表面的特异性抗sars-cov-2抗体结合。反应完成后,磁场吸住磁珠,洗去未结合的物质。
63.第二步,将检测组分,即标记有碱性磷酸酶的人血管紧张素转化酶ii (ace2)蛋白,加到反应管中孵育,与第一步形成的结合物上的sars-cov-2 抗原结合,形成夹心复合物。反应完成后,磁场吸住磁珠,洗去未结合的物质。
64.第三步,将化学发光底物液添加到反应管内,发光底物(3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷,amppd)被碱性磷酸酶所分解,脱去一个磷酸基,生成不稳定的中间产物,该中间产物通过分子内电子转移产生间氧苯甲酸甲酯阴离子,处于激发态的间氧苯甲酸甲酯阴离子从激发态返回基态时,产生化学发光。再通过光电倍增管对反应中所产生的光子数进行测量,所产生光子的量与样本内sars-cov-2抗原的含量成正比。定标曲线如图1所示。
65.步骤4:阳性判断值的确定
66.收集83例采集自新冠肺炎确诊病例(核酸检测为阳性)的咽拭子样本作为阳性样本,以及116例采集自新冠肺炎排除病例的咽拭子样本(核酸检测为阴性)作为阴性样本。样本测试前离心处理(相对离心力1000g,离心时间5min),并转移上清液进至洁净的样本管中,按步骤3“样本检测”进行测试,得到各样本中sars-cov-2抗原的浓度值。采用受试者工作曲线(receiveroperating characteristic curve,roc)的方法对样本测试的结果进行统计分析,得到该试剂盒的阳性判断值(cut-off值)为5.9pg/ml。
67.对比实例新型冠状病毒(sars-cov-2)抗原检测试剂盒2的制备
68.步骤1:捕获组分的制备
69.将特异性抗sars-cov-2抗体a(三优生物医药(上海)有限公司, aha001)包被于磁珠(thermo fisher)表面。下面详细描述相应的包被方法:
70.首先将特异性抗sars-cov-2抗体进行前处理,通过透析去除其缓冲基质中的保护组分。按照每毫克磁珠加入0.5μg至40μg的抗体的比例进行包被。在反应过程中磁珠表面的羧基在edc/nhs催化下与特异性抗sars-cov-2 抗体的氨基进行偶联。典型的制备过程为:取20mg表面修饰有羧基的磁珠,超声分散于10mm mes缓冲液中,加入80mg edc和120mg nhs,超声混合均匀后,置于37℃摇床15min。之后在处理后的磁珠中,按照比例加入特异性抗sars-cov-2抗体,混匀,并置于37℃摇床反应10h至18h。清洗封闭后,制备得到包被有特异性抗sars-cov-2抗体a的磁珠包被物。将磁珠包被物稀释于50mm mes缓冲液(0.5m nacl、0.5%bsa、0.05%吐温20, ph=6.0),磁珠包被物浓度为0.5mg/ml。
71.步骤2:检测组分的制备
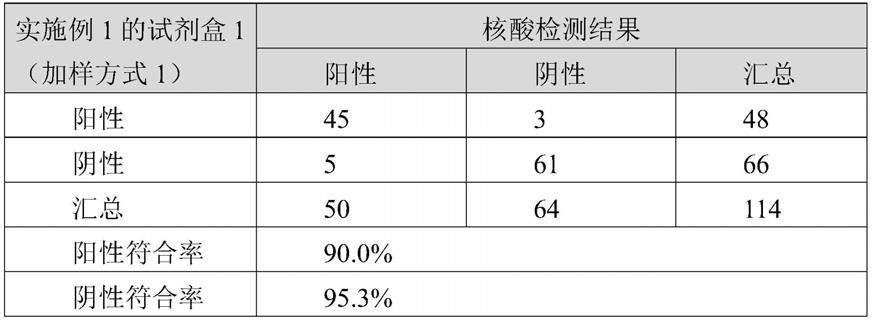
72.将特异性抗sars-cov-2抗体b(三优生物医药(上海)有限公司,aha003) 与碱性磷酸酶(roche life science)进行偶联,制备得酶标记物。将酶标记物稀释于50mm mes缓冲液(0.5m nacl、0.5%bsa、0.05%吐温20,ph=6.0),酶标标记物浓度为1.0μg/ml。
73.步骤3:样本检测
74.第一步,将从采集自新冠肺炎确诊病例(核酸检测为阳性)的咽拭子样本(20μl)和包被有特异性抗sars-cov-2抗体a的磁珠添加到反应管中孵育,样本中的sars-cov-2抗原与磁珠表面的特异性抗sars-cov-2抗体结合。反应完成后,磁场吸住磁珠,洗去未结合的物质。
75.第二步,将检测组分,即标记有碱性磷酸酶的特异性抗sars-cov-2抗体b,加入到反应管中孵育,与第一步形成的结合物上的sars-cov-2抗原结合,形成夹心复合物。反应完成后,磁场吸住磁珠,洗去未结合的物质。
76.第三步,将化学发光底物液添加到反应管内,发光底物(3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷,amppd)被碱性磷酸酶所分解,脱去一个磷酸基,生成不稳定的中间产物,该中间产物通过分子内电子转移产生间氧苯甲酸甲酯阴离子,处于激发态的间氧苯甲酸甲酯阴离子从激发态返回基态时,产生化学发光。再通过光电倍增管对反应中所产生的光子数进行测量,所产生光子的量与样本内sars-cov-2抗原的含量成正比。定标曲线如图2所示。
77.步骤4:阳性判断值的确定
78.收集83例采集自新冠肺炎确诊病例(核酸检测为阳性)的咽拭子样本作为阳性样本,以及116例采集自新冠肺炎排除病例的咽拭子样本(核酸检测为阴性)作为阴性样本。样本测试前离心处理(相对离心力1000g,离心时间5min),并转移上清液进至洁净的样本管中,按步骤3“样本检测”进行测试,得到各样本中sars-cov-2抗原的浓度值。采用受试者工作曲线(receiveroperating characteristic curve,roc)的方法对样本测试的结果进行统计分析,得到该试剂盒的阳性判断值(cut-off值)为6.2pg/ml。
79.实施例2考察实施例1和对比实例所制备的sars-cov-2抗原检测试剂盒与样本核酸检测结果的一致性
80.分别采用实施例1和对比实例所制备的sars-cov-2抗原检测试剂盒对收集的临床咽拭子样本(已离心处理)按实施例1中“检测方法”进行测试,分别比较实施例1和对比实例所制备的sars-cov-2抗原检测试剂盒测试结果与样本核酸检测结果的一致性。对114例临床咽拭子样本的检测结果如下:
81.实施例1的试剂盒1检测结果与核酸检测结果一致性如表1所示,阳性符合率为90.0%,阴性符合率95.3%;对比实例的试剂盒2与核酸检测结果一致性见表2,阳性符合率为88.0%,阴性符合率92.2%。
82.表1
[0083][0084]
表2
[0085][0086]
实施例3考察加样方式对检测结果的影响
[0087]
为研究实施例1“样本检测”中加样方式对试剂盒检测结果与样本核酸检测结果一致性的影响。分别采用以下两种加样方式:
[0088]
加样方式1:先加入样本、捕获组分孵育后,磁场吸住磁珠,洗去未结合的物质,再加入检测组分孵育(即实施例1中的步骤)。
[0089]
加样方式2:加入样本、捕获组分和检测组分后,再进行孵育。
[0090]
其余检测步骤与实施例1相同。
[0091]
研究这两种加样方法与样本核酸检测结果的一致性。如表3所示,实施例1的试剂盒1采用加样方式2的测试结果与样本核酸检测结果阳性符合率 88.0%,阴性符合率92.2%,显著低于加样方式1结果(见表1)。因此,本技术实施例1的试剂盒1优选加样方式1。
[0092]
表3
[0093]
[0094]
实施例4考察样本量对检测结果的影响
[0095]
为研究实施例1“样本检测”中样本量对检测结果的影响,分别采用不同的样本量测试样本1-4的信号值并计算信噪比,其余步骤不变。其中,样本1为不含有sars-cov-2抗原的阴性对照;样本2至样本4中抗原浓度依次升高;
[0096]
结果如表4所示,信噪比随样本量增加而增加。样本量在5μl~20μl时,信噪比随样本量增加显著升高,继续提升可接受的样本量(20μl~50μl),信噪比提升不显著,信噪比可接受。因此样本量5μl~50μl时可接受,优选样本量20μl。
[0097]
表4
[0098][0099]
实施例5考察孵育时间对检测结果的影响
[0100]
为研究实施例1“样本检测”中孵育时间对检测结果的影响,分别采用不同的孵育时间测试样本1-4的信号值并计算信噪比,其余步骤不变。
[0101]
结果如表5所示。信噪比随孵育时间增加而增加。孵育时间在2min~10min 时,信噪比随孵育时间增加显著升高,继续增加可接受的孵育时间 (10min~20min),信噪比提升不显著,孵育时间可接受。因此孵育时间在 2min~20min可接受,优选孵育时间10min。
[0102]
表5
[0103][0104]
实施例6特异性抗sars-cov-2抗体磁珠包被物及人血管紧张素转化酶ii(ace2)酶标记物浓度的确定
[0105]
根据实施例1中的方法制备捕获组分,其中特异性抗sars-cov-2抗体包被使用量固定为10μg/mg,确定特异性抗sars-cov-2抗体磁珠包被物和人血管紧张素转化酶ii(ace2)酶标记物浓度对信号值和信噪比的影响。
[0106]
一方面,固定人血管紧张素转化酶ii(ace2)酶标记物浓度为1μg/ml,采用不同的特异性抗sars-cov-2抗体磁珠包被物浓度按照实施例1“样本检测”方法测试样本1-4的信号值并计算信噪比。
[0107]
结果如表6所示,随着磁珠包被物浓度增加,磁珠包被物浓度在 0.1mg/ml~0.5mg/ml阶段信噪比提升显著;进一步增加磁珠包被物浓度 (0.5mg/ml~1.0mg/ml),信噪比提升趋缓;因此磁珠包被物浓度在 0.1mg/ml~1.0mg/ml的范围内是可接受的,磁珠包被物浓度0.5mg/ml时较佳。
[0108]
表6
[0109]
[0110][0111]
另一方面,固定特异性抗sars-cov-2抗体磁珠包被物的浓度为 0.5mg/ml,采用不同的人血管紧张素转化酶ii(ace2)酶标记物浓度,按照实施例1“样本检测”方法测试样本1~4的信号值并计算信噪比。
[0112]
结果如表7所示。随着酶标记物浓度增加,酶标记物浓度在 0.1μg/ml~0.5μg/ml阶段信噪比提升显著;进一步增加酶标记物浓度 (0.5μg/ml~2.0μg/ml),信噪比提升趋缓;因此酶标记物浓度在 0.1μg/ml~2.0μg/ml的范围内是可接受的,酶标记物浓度0.5μg/ml时较佳。
[0113]
表7
[0114]
[0115][0116]
实施例7新型冠状病毒(sars-cov-2)抗原检测试剂盒3的制备
[0117]
步骤1:捕获组分的制备
[0118]
将人血管紧张素转化酶ii(ace2)(北京义翘神州科技股份有限公司, 10108-h02h)包被于磁珠(thermo fisher)表面。
[0119]
具体包被方法为:首先将人血管紧张素转化酶ii(ace2)进行前处理,通过透析去除其缓冲基质中的保护组分。按照每毫克磁珠加入0.5μg至40μg 的抗体的比例进行包被。在反应过程中磁珠表面的羧基在edc/nhs催化下与人血管紧张素转化酶ii(ace2)的氨基进行偶联。典型的制备过程为:取 20mg表面修饰有羧基的磁珠,超声分散于10mm mes缓冲液中,加入80mgedc和120mg nhs,超声混合均匀后,置于37℃摇床15min。之后在处理后的磁珠中,按照比例加入人血管紧张素转化酶ii(ace2),混匀,并置于 37℃摇床反应10h至18h。清洗封闭后,制备得到包被有人血管紧张素转化酶ii(ace2)的磁珠包被物。将磁珠包被物稀释于50mm mes缓冲液(0.5mnacl、0.5%bsa、0.05%吐温20,ph=6.0),磁珠包被物浓度为0.5mg/ml。
[0120]
步骤2:检测组分的制备
[0121]
将特异性抗sars-cov-2抗体(三优生物医药(上海)有限公司,aha001) 与碱性磷酸酶(roche life science)进行偶联,制备得酶标记物。将酶标记物稀释于50mm mes缓冲液(0.5m nacl、0.5%bsa、0.05%吐温20,ph=6.0),酶标标记物浓度为1.0μg/ml。
[0122]
步骤3:样本检测
[0123]
第一步,将从采集自新冠肺炎确诊病例(核酸检测为阳性)的咽拭子样本(20μl)和包被有人血管紧张素转化酶ii(ace2)的磁珠添加到反应管中孵育,样本中的sars-cov-2抗原与磁珠表面的人血管紧张素转化酶ii(ace2) 结合。反应完成后,磁场吸住磁珠,洗去未结合的物质。
[0124]
第二步,将检测组分,即和标记有碱性磷酸酶的特异性抗sars-cov-2 抗体,加到反应管中孵育,与第一步形成的结合物上的sars-cov-2抗原结合,形成夹心复合物。反应完成后,磁场吸住磁珠,洗去未结合的物质。
[0125]
第三步,将化学发光底物液添加到反应管内,发光底物(3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷,amppd)被碱性磷酸酶所分解,脱去一个磷酸基,生成不稳定的中间产物,该中间产物通过分子内电子转移产生间氧苯甲酸甲酯阴离子,处于激发态的间氧苯甲酸甲酯阴离子从激发态返回基态时,产生化学发光。再通过光电倍增管对反应中所产生的光子数进行测量,所产生光子的量与样本内sars-cov-2抗原的含量成正比。定标曲线如图3所示。
[0126]
步骤4:阳性判断值的确定
[0127]
收集83例采集自新冠肺炎确诊病例(核酸检测为阳性)的咽拭子样本作为阳性样本,以及116例采集自新冠肺炎排除病例的咽拭子样本(核酸检测为阴性)作为阴性样本。样本测试前离心处理(相对离心力1000g,离心时间5min),并转移上清液进至洁净的样本管中,按步骤3“样本检测”进行测试,得到各样本中sars-cov-2抗原的浓度值。采用受试者工作曲线(receiveroperating characteristic curve,roc)的方法对样本测试的结果进行统计分析,得到该试剂盒的阳性判断值(cut-off值)为5.8pg/ml。
[0128]
实施例8考察实施例7制备的sars-cov-2抗原检测试剂盒3与样本新冠核酸检测结果的一致性
[0129]
采用实施例7所制备的sars-cov-2抗原检测试剂盒3对收集的临床咽拭子样本(样本与实施例2相同)按实施例7中“检测方法”进行测试,比较实施例7所制备的sars-cov-2抗原检测试剂盒3检测结果与样本核酸检测结果的一致性。
[0130]
结果如表8所示,实施例7的试剂盒3测试结果与样本核酸检测结果阳性符合率88.0%,阴性符合率93.8%。
[0131]
表8
[0132][0133][0134]
实施例9考察加样方式对检测结果的影响
[0135]
为研究实施例7“样本检测”中加样方式对试剂盒检测结果与临床诊断结果符合率的影响。分别采用以下两种加样方式:
[0136]
加样方式1:先加入样本、捕获组分孵育后,磁场吸住磁珠,洗去未结合的物质,再加入检测组分孵育(即实施例7中的步骤)。
[0137]
加样方式2:加入样本、捕获组分和检测组分后,再进行孵育。
[0138]
其余检测步骤与实施例7相同。
[0139]
研究这两种加样方法检测结果与样本核酸检测结果的一致性。如表9所示,加样方式2的测试结果与核酸检测结果阳性符合率86.0%,阴性符合率 89.1%,略低于加样方式1(见表8),因此,本技术实施例7的试剂盒3优选加样方式1。
[0140]
表9
[0141][0142]
实施例10察样本量对检测结果的影响
[0143]
为研究实施例7“样本检测”中样本量对检测结果的影响,分别采用不同的样本量测试样本1-4的信号值并计算信噪比,其余步骤不变。
[0144]
结果如表10所示,信噪比随样本量增加而增加。样本量在5μl~20μl时,信噪比随样本量增加显著升高,继续提高样本量(20μl~50μl),信噪比提升不显著。因此样本量5μl~50μl时可接受,优选样本量20μl。
[0145]
表10
[0146][0147][0148]
实施例11考察孵育时间对检测结果的影响
[0149]
为研究实施例7“样本检测”中孵育时间对检测结果的影响,分别采用不同的孵育时间测试样本1-4的信号值并计算信噪比,其余步骤不变。
[0150]
结果如表11所示,信噪比随孵育时间增加而增加。孵育时间在 2min~10min时,信噪比随孵育时间增加显著升高,继续增加孵育时间 (10min~20min),信噪比提升不显著。因此孵育时间在2min~20min时可接受,优选孵育时间10min。
[0151]
表11
[0152][0153][0154]
实施例12血管紧张素转化酶ii(ace2)磁珠包被物及特异性抗 sars-cov-2抗体酶标记物浓度的确定
[0155]
根据实施例7中的方法制备捕获组分,其中人血管紧张素转化酶ii(ace2) 包被使用量固定为10μg/mg,确定人血管紧张素转化酶ii(ace2)磁珠包被物和特异性抗sars-cov-2抗体酶标记物浓度对信号值和信噪比的影响。
[0156]
一方面,固定特异性抗sars-cov-2抗体酶标记物浓度为1μg/ml,采用不同的人血管紧张素转化酶ii(ace2)磁珠包被物浓度按照实施例7“样本检测”方法测试样本1-4的信号值并计算信噪比。
[0157]
结果如表12所示,随着磁珠包被物浓度增加,磁珠包被物浓度在 0.1mg/ml~0.5mg/ml阶段信噪比提升显著;进一步增加磁珠包被物浓度 (0.5mg/ml~1.0mg/ml),信噪比提升趋缓;因此磁珠包被物浓度在 0.1mg/ml~1.0mg/ml的范围内是可接受的,磁珠包被物浓度0.5mg/ml时较佳。
[0158]
表12
[0159][0160][0161]
另一方面,固定人血管紧张素转化酶ii(ace2)抗体磁珠包被物的浓度为0.5mg/ml,采用不同的特异性抗sars-cov-2抗体酶标记物浓度,按照实施例7“样本检测”方法测试样本1~4的信号值并计算信噪比。
[0162]
结果如表13所示,随着酶标记物浓度增加,酶标记物浓度在 0.1μg/ml~0.5μg/ml阶段信噪比提升显著;进一步增加酶标记物浓度 (0.5μg/ml~2.0μg/ml),信噪比提升趋缓;因此酶标记物浓度在0.1μg/ml ~2.0μg/ml的范围内是可接受的,酶标记物浓度0.5μg/ml时较佳。
[0163]
表13
[0164][0165]
从上面描述的各个实施例可以得出:本技术实施例的试剂盒具有高度特异性和灵敏度并且适用于检测待测样本中的sars-cov-2抗原,同时本技术的用于检测sars-cov-2抗原试剂盒仅需采用一个特异性抗体即可实现 sars-cov-2抗原的检测,从而提高sars-cov-2抗原检测的质量和精度并且大幅降低了检测成本。
[0166]
本技术不通过根据实施例进行的描述而限制于此。更确切地说,本技术包括每个新的特征以及特征的每个组合,这尤其是包含在权利要求中的特征的每个组合,即使该特征或者该组合本身未详细地在权利要求中或者实施例中说明时也是如此。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1