一种快速无损制备植物叶片玻片的方法及应用与流程
本发明属于植物叶片分析技术领域,具体涉及一种快速无损制备植物叶片玻片的方法及应用。
背景技术:
随着对植物功能结构研究的深入和发展,植物叶片中的叶脉和气孔关系逐渐成为科学研究者关注的热点问题。叶脉网络是叶片的主要水分运输系统,也是无机盐养分和光合作用产物的运输通道。叶脉密度和直径对叶片的水分养分运输能力具有决定性的影响,小叶脉密度越大,水分供应能力越强,叶片潜在的气体交换能力也越大。气孔是由两个保卫细胞围成一孔形成,作为植物与外界环境进行二氧化碳和水蒸汽交换的主要通道,在调节植物光合作用、蒸腾作用以及水分利用中扮演着至关重要的角色。气孔的密度和大小对叶片水分蒸腾和水分状态具有控制作用。大多数被子植物的气孔位于叶片的远轴面(下表面),如壳斗科植物锥栗、蔷薇科植物苹果等;而大多数草本植物的叶片则两面都有气孔,如落花生,小麦等;但一些水生植物,如睡莲,气孔只分布于叶片正面。叶脉和气孔对叶片的水分供应和需求具有决定性的影响,研究它们之间的协作关系,对于了解植物叶片水分利用策略具有重要意义,而获取到清晰地气孔和叶脉图片是研究二者结构功能关系的前提。
中国专利cn107179268a公开了一种禾本植物叶片表皮层气孔密度的估测方法,该方法在叶片表面涂上指甲油或透明胶,干燥后黏上透明胶带,将透明胶带连同指甲油或透明胶一起撕下,分别制作样本叶片的上层表皮样本和下层表皮样本,用显微镜观察表皮标本的细胞并拍照。但印迹法或者撕表皮法都有其局限性,例如对于表面有绒毛的叶片,这两种方法均难以得到理想的气孔照片。
中国专利cn103901169a公开了一种旱生阔叶植物叶脉拓扑结构分析方法,将植物叶片用纯水加热煮沸5-18分钟,软化叶片,再用5%-8%的氢氧化钠溶液加热煮泡5-35分钟,分离叶表皮和叶肉;随后将叶片放入盛有清水的培养皿中,用软毛刷刷下叶表皮和叶肉;然后用清水清洗残余叶肉,用滤纸吸干水分,放在与电脑相连的显微镜下观察并拍摄清晰图像;最后用软件测量分析叶脉密度和各级叶脉所占比例。这种方法一般适用于质地较硬的网状脉叶片,如旱生阔叶植物,普通植物叶片经过氢氧化钠溶液煮泡之后,会变得非常脆弱,在制片过程中极易破损,影响拍照效果。通过对100多种植物叶片的样本用氢氧化钠溶液煮泡法进行处理和拍照,发现许多植物的叶片无需去除表皮,也能获取到较为清晰的叶脉图片,用于叶脉密度的测定。例如落花生的叶片,用氢氧化钠溶液加热浸泡处理后,可同时拍到叶片两面的气孔和清晰的叶脉照片。
传统方法在使用显微镜进行拍照时,通常将处理的叶片样本放在载玻片上,盖上盖玻片,放到显微镜载物台上进行观察。而一旦观察面的叶脉不清晰或者需要观察叶片双面气孔时,就需要对样本进行翻面,重新制片。而经过处理后的叶片样品,比较脆弱易损,需要将放有样品的载玻片放到盛有水的培养皿中,轻轻揭起盖玻片,让样品在水中完成翻面,再次制片。而在实际操作中,样品在水中可能多次翻转,极易混淆已观察面和未观察面,制片后可能还是同一面,存在多次反复制片的可能。这无疑限制了实验的速度,增加了制片难度,一旦二次制片失败,需要重新进行样品处理。
综上所述,研究一种操作简单、速度快、对植物叶面损伤小的制片方法具有重要意义。
技术实现要素:
针对现有技术中存在的制片方法复杂、对叶片样品损伤大及需要二次制片的问题,本发明提供了一种快速无损制备植物叶片玻片的方法及应用,该方法制片速度快,而且降低了二次制片时对样本的损伤。
本发明通过以下技术方案实现:
一种快速无损制备植物叶片制片的方法,包括以下步骤:
(1)在载玻片上放置一片盖玻片,将植物叶片样本放置到盖玻片上,在样本上再盖一层盖玻片,吸去多余水分,放置到显微镜上进行观察并拍照;
(2)用镊子夹起两层盖玻片,将夹着样品的两层盖玻片翻面后放到载玻片上,吸去多余的水分,放置到显微镜上进行观察并拍照。
进一步地,所述的植物叶片的处理方法为:将叶片样本放入盛有5%的氢氧化钠溶液中,置于恒温水浴槽中,设置水浴槽的温度为70℃,每天更换氢氧化钠溶液,直到叶片样本不再呈现绿色,变得透亮,叶脉显现出来为止。将处理过的样本在蒸馏水中浸泡30分钟后,用1%的甲苯胺蓝溶液染色。
进一步地,所述的叶片样本选自于叶片中部1cm-2的区域。
进一步地,步骤(2)中将两层盖玻片夹起后,在载玻片上加少量水,然后再进行翻面放到载玻片上。
进一步地,所述的显微镜为光学显微镜。
本发明所述的快速无损制备植物叶片制片的方法可应用于植物叶片中叶脉和叶孔的观察。
有益效果
(1)传统方法两次制片,对样品的损伤概率大大增加,本发明制片方法制片速度快,节约了二次制片的时间,且大大减少了对待测样品的损伤程度;
(2)本发明增加一层盖玻片后,并不影响对样品的观察拍照,而且在进行翻面前,向载玻片上滴加水,可以防止气泡的产生。
附图说明
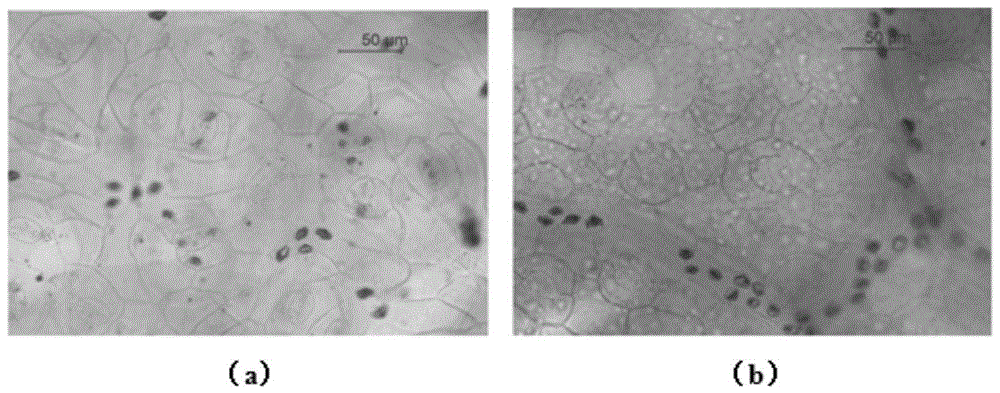
图1为实施例1落花生叶片下表面气孔(a)和落花生叶片上表面气孔(b);
图2为落花生叶片的小叶脉。
具体实施方式
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是进一步说明本发明的特征及优点,而不是对本发明进行限制。
实施例1
落花生叶片气孔密度和小脉密度的测定
(1)样品处理:在落花生叶片上(上下表面均含有气孔,观察气孔时需要进行翻面,小叶脉从叶片下表面观察时较为清晰,拍照时也可能需要翻面)剪取中部1cm-2的区域,将剪下的样本放入盛有5%氢氧化钠的试管中,置于恒温水浴槽(中国常州,诺基,dkz-450)中,水浴槽的温度设置在70℃,试管中的氢氧化钠溶液每天更换,直到叶片样本不再呈现绿色,变得透亮,叶脉显现出来为止。将处理过的样本在蒸馏水中浸泡30分钟后,用1%的甲苯胺蓝溶液染色后;
(2)在载玻片上放置一片盖玻片,将处理后的落花生叶片样本放置到盖玻片上,在样本上再盖一层盖玻片,吸取周围多余水分,用光学显微镜(德国,leica,dm2500)观察并拍照,结果如图1a所示,记数视野范围内的气孔总数,并利用气孔总数除以视野范围面积,计算出落花生叶片下表面的气孔密度为161mm-2;通过调节显微镜的细准焦螺旋,即可同时观察到小叶脉的情况,但在该观察面时,叶脉不清晰,可在下一步翻面后再次观察叶脉并拍照。
用镊子夹起两层盖玻片的一角,在载玻片上加一滴水,将夹着样品的两层盖玻片翻面后放到载玻片上,防止气泡产生,吸去多余水分后,直接放到光学显微镜(德国,leica,dm2500)下观察拍照,结果如图1b所示,落花生叶片样本上表面的气孔密度为135mm-2;通过调节显微镜的细准焦螺旋,即可同时观察到小叶脉的情况,图片中叶脉的长度用图像用处理软件imagej测量,叶脉密度是单位面积内叶脉的总长度,观察到的叶脉如图2所示,叶脉密度为7.9mmmm-2。
- 还没有人留言评论。精彩留言会获得点赞!