一种显色试剂以及测定抗坏血酸的方法
本发明涉及分析化学领域,具体是提供一种显色试剂,以及利用该显色试剂采用比色法测定l-抗坏血酸的方法。
背景技术:
l-抗坏血酸是一种天然抗氧化剂,对维持人体正常生理机能起着极其重要的作用。l-抗坏血酸的缺乏可导致多种疾病,如坏血病、免疫力低下、感冒、抑郁症、甚至是癌症。但是摄入过量的l-抗坏血酸也会给身体带来损害,患者会出现尿道结石、腹泻、胃痉挛等症状。l-抗坏血酸的含量高低常作为某些疾病诊断及营养分析的重要指标。构建性能优良的检测手段用于l-抗坏血酸的检测是非常重要的。但l-抗坏血酸极易氧化失效,而且在某些食物中含量较低,因此研究一种快速、灵敏、成本低廉的l-抗坏血酸的检测方法是十分必要的。
目前有关l-抗坏血酸的检测方法主要有经典的碘量法、液相色谱法、化学发光法、毛细管电泳法、荧光光度法、紫外分光光度法等。其中,紫外分光光度法具有适用浓度范围广、准确度高、选择性好、分析成本低、操作简单、快速等优点。但也存在显色剂准备繁琐、纳米材料制备复杂、检测限高等不足。
技术实现要素:
为了克服上述技术缺陷,本发明提供了一种显色试剂以及测定抗坏血酸的方法,其检测快速、灵敏、成本低且操作简便。利用显色试剂中铜离子(ii)过氧化物酶的活性,催化过氧化氢氧化3,3′,5,5′-四甲基联苯胺(tmb)生成氧化态tmb(即oxtmb),使溶液呈蓝色,溶液中加入l-抗坏血酸,由于l-抗坏血酸具有还原性,会使oxtmb还原成tmb,此时溶液颜色消失或变浅;具体的,加入不同浓度的l-抗坏血酸,溶液颜色的变化也会不同,即l-抗坏血酸在溶液中的浓度越大,颜色褪去的程度越大,变浅的程度与l-抗坏血酸的浓度成正比,构建线性关系,从而确定l-抗坏血酸的含量。
本发明采用的技术方案如下:
第一方面,本发明提供一种显色试剂,由铜离子(ii)溶液、3,3′,5,5′-四甲基联苯胺溶液(即tmb溶液)、过氧化氢溶液和缓冲溶液配制而成。
第二方面,本发明提供一种显色试剂的制备方法,取铜离子(ii)溶液置于具塞试管中,加入tmb溶液和过氧化氢溶液,随后用缓冲溶液定容,摇匀后置于水浴锅中孵育。
第三方面,本发明提供一种采用所述显色试剂测定抗坏血酸的用途。具体的,提供一种利用铜离子(ii)的过氧化物酶活性测定抗坏血酸的用途。
优选的,利用铜离子(ii)的过氧化物酶的活性,催化过氧化氢氧化3,3′,5,5′-四甲基联苯胺(tmb),使溶液呈蓝色,溶液中加入l-抗坏血酸,此时溶液颜色消失或变浅,变浅的程度与l-抗坏血酸的浓度成正比,从而确定l-抗坏血酸的含量。
第四方面,本发明提供一种测定抗坏血酸的方法,其包括以下步骤:
(1)配制显色试剂,测定在652nm处的紫外吸光度值a0;
(2)向上述显色试剂加入待测样品,测定在652nm处的紫外吸光度值a;
(3)计算δa=a0-a,代入线性方程δa=0.2617c+0.0471,求得c值;其中c为待测样品中l-抗坏血酸的浓度,单位为μm。
第五方面,本发明提供一种测定抗坏血酸的方法,包括以下步骤:
a)配制不同浓度的l-抗坏血酸标准溶液;
b)配制缓冲溶液、铜离子(ii)溶液、3,3′,5,5′-四甲基联苯胺溶液(即tmb溶液)、过氧化氢溶液;
c)配制显色试剂:取所述铜离子(ii)溶液置于具塞试管中,加入tmb溶液和过氧化氢溶液,随后用缓冲溶液定容,摇匀后置于水浴锅中孵育,测定在652nm处的紫外吸收强度值;
d)依次加入不同浓度的l-抗坏血酸标准溶液,静置反应,将反应后的溶液倒入石英比色皿中,进行紫外分光光度计测试,采集紫外光谱,以紫外光谱中652nm处的紫外吸收强度变化值对l-抗坏血酸的浓度建立定量分析的标准曲线,拟合得到线性方程;
e)配制待测样品溶液;
f)在孵育后的显色试剂中,加入待测样品溶液,充分反应后,采集紫外光谱,读取652nm处的紫外吸收强度值,带入到线性方程,计算待测样品中l-抗坏血酸的浓度数值,从而实现对待测样品中l-抗坏血酸的定量检测。
优选的,所述铜离子(ii)溶液为醋酸铜溶液。优选的,备用铜离子(ii)溶液配制方法为:称量2.0g的醋酸铜置于烧杯中,加入去离子水使其完全溶解,将醋酸铜溶液转入100ml容量瓶,用去离子水定容,得到0.1m醋酸铜溶液。优选的,所述显色试剂中铜离子(ii)浓度为8.0-16.0mm。更优选的,其浓度为8.0mm。
优选的,配制不同浓度的l-抗坏血酸标准溶液中,将l-抗坏血酸配制成如下浓度标准溶液:0μm,0.1μm,0.2μm,0.4μm,0.8μm,1.0μm,2.0μm,3.0μm,4.0μm,5.0μm。
优选的,所述3,3′,5,5′-四甲基联苯胺溶液(即tmb溶液)的配制方法为:称量0.12g的tmb粉末置于烧杯中,加入40ml乙醇和1mln,n-二甲基甲酰胺,磁力搅拌使其完全溶解后转入100ml棕色容量瓶,加去离子水定容,得到5mmtmb溶液。优选的,所述显色试剂中tmb浓度为0.6-1.0mm。优选的,其浓度为0.6mm。
优选的,所述显色试剂中过氧化氢浓度为1-100μm。优选的,浓度为10μm。优选的,所述过氧化氢溶液的配制方法为:取30%的过氧化氢水溶液1.02ml,加入100ml棕色容量瓶中,用去离子水定容,即得0.1m过氧化氢溶液。
优选的,所述缓冲溶液的ph值分别为2.0,2.5,3.0,3.5,4.0,4.5,5.0,6.0,7.0。优选的,所述缓冲溶液的ph为3.0。优选的,所述缓冲溶液为醋酸-醋酸钠缓冲溶液。优选的,所述醋酸-醋酸钠缓冲溶液的配制方法为:称量醋酸钠(ch3coona·3h2o)2.72g,加去离子水溶解,然后移至100ml容量瓶定容,即配制为0.2m的醋酸钠溶液;移取1.02ml冰醋酸至100ml容量瓶并定容,即得0.2m醋酸溶液;将醋酸钠溶液与醋酸溶液进行混合,然后用盐酸和氢氧化钠调节缓冲溶液的ph值分别为2.0,2.5,3.0,3.5,4.0,4.5,5.0,6.0,7.0。优选的,所述醋酸-醋酸钠缓冲溶液的ph为3.0。
优选的,配制显色试剂时,取浓度为0.1m的铜离子(ii)溶液200-400μl于5ml具塞试管中,加入浓度为5mmtmb溶液300-500μl,再加入过氧化氢溶液,随后用缓冲溶液定容至2.5ml,摇匀,置于30-60℃水浴锅中,孵育12-50min。优选的,取0.1m铜离子(ii)溶液200μl于5ml具塞试管中,加入5mmtmb溶液300μl。优选的,置于40℃水浴锅中,孵育20min。
优选的,配制待测样品溶液时,所述待测样品为奶粉。优选的,称取奶粉溶于醋酸-醋酸钠缓冲溶液中,经过离心和滤膜过滤,除去不溶物,向样品溶液中分别添加不同浓度的l-抗坏血酸,定容,得到处理后l-抗坏血酸的待测样品溶液。优选的,奶粉质量为1.0g;缓冲溶液体积为5ml;待测样品溶液浓度是0.20g/ml;滤膜为0.45μm孔径滤膜;向样品溶液中分别加入1μm、2μm、3μm的l-抗坏血酸;定容至2.5ml,得到处理后的添加1μm、2μm、3μml-抗坏血酸的待测样品溶液。所述奶粉样品购买于当地超市。
优选的,根据紫外吸收变化值与l-抗坏血酸浓度的线性关系图,得到线性方程为δa=a0-a=0.2617c+0.0471,c值为溶液中l-抗坏血酸的浓度,单位为μm。线性方程中,r2=0.9997(n=8)。a0为显色试剂在652nm处测得的紫外吸光度值。a为显色试剂加入l-抗坏血酸溶液或待测样品后,在652nm处测得的紫外吸光度值。
优选的,检测l-抗坏血酸的范围0.1-5.0μm,检测限为0.02μm。
优选的,在孵育后的显色试剂中,分别加入处理后l-抗坏血酸的待测样品溶液各250μl,20分钟后测量,采集紫外光谱,读取652nm处的紫外吸收强度值,带入到线性方程,计算待测样品中l-抗坏血酸的浓度数值。优选的,向样品溶液中分别加入1μm、2μm、3μml-抗坏血酸后定容,得到处理后的添加1μm、2μm、3μml-抗坏血酸的待测样品溶液。优选的,每个样品重复测样3次,求平均值,从而得到更加精确的浓度数值。
本发明具有的优势在于:
所述显色试剂以及测定抗坏血酸的方法,不需要纳米粒子的制备及表面修饰,没有复杂的有机合成。所述铜离子(ii)溶液,相对于天然酶和纳米材料,不仅具有高灵敏的特性,检测限为0.02μm,而且具有简便、易准备、水溶性好、稳定性好和成本低等优点。与传统显色剂邻联甲苯胺(dmb)相比,tmb具有灵敏度高,显色稳定,准确性好等优点,而且使用安全。该检测方法具有良好的选择性。可建立一种简便、快速、低廉的检测食品中抗坏血酸的方法,在食品分析领域具有潜在的应用价值。
附图说明
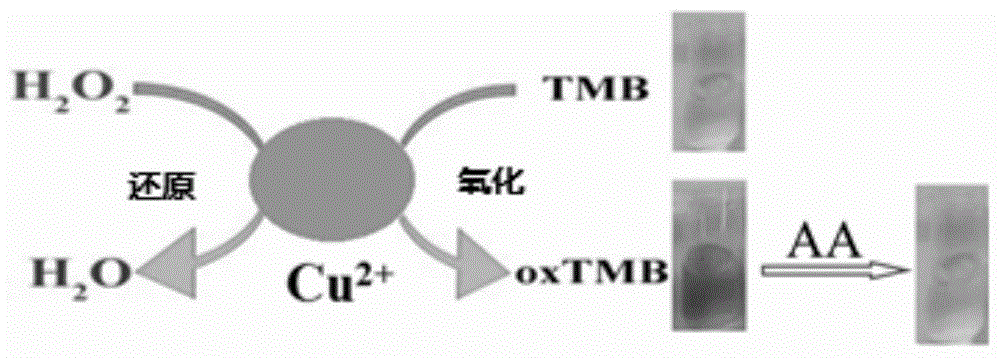
图1为本发明检测抗坏血酸的原理示意图。
图2为加入不同浓度的抗坏血酸在652nm处的紫外吸收光谱图,a-i分别为加入了抗坏血酸溶液浓度为0μm、0.1μm,0.2μm,0.4μm,0.8μm,1.0μm,2.0μm,4.0μm,5.0μm的紫外可见吸收光谱。
图3为铜离子(ii)模拟酶比色法检测抗坏血酸标准曲线图。
图4为可行性试验的紫外可见光谱图,其中a为tmb-抗坏血酸;b为tmb-铜离子(ii);c为tmb-h2o2-铜离子(ii)-抗坏血酸显色剂;d为tmb-h2o2-铜离子(ii)。
图5为反应体系ph对铜离子(ⅱ)过氧化物模拟酶的活性影响图。
图6为显色试剂中tmb浓度对铜离子(ⅱ)过氧化物模拟酶的活性影响图。
图7为体系对金属离子和生物分子的吸光度响应的选择性比较图;金属离子的浓度为20μm,生物分子的浓度为50μm。
具体实施方式
下面结合具体实施例,进一步描述本发明。但这些实施例仅限于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体实验条件的实验方法,通常按照常规条件。
下列实施例中试剂来源为:抗坏血酸(l-抗坏血酸);醋酸钠(ch3coona·3h2o);冰乙酸(hac);3,3’,5,5’-四甲基联苯胺(tmb);醋酸铜(cuac2·2h2o);氢氧化钠(naoh);盐酸(hcl);n,n-二甲基甲酰胺(dmf);乙醇;30%过氧化氢(h2o2)。所有试剂均为分析纯,所用的溶剂水均为去离子水。
实施例1
一种测定抗坏血酸的方法,包括以下步骤:
a)配制不同浓度的l-抗坏血酸标准溶液:将l-抗坏血酸配制成如下浓度标准溶液:0μm,0.1μm,0.2μm,0.4μm,0.8μm,1.0μm,2.0μm,4.0μm,5.0μm;
b)配制醋酸-醋酸钠缓冲溶液、铜离子(ii)溶液、3,3′,5,5′-四甲基联苯胺溶液(即tmb溶液)、过氧化氢溶液;具体的:
1)醋酸-醋酸钠缓冲溶液的配制:称量醋酸钠(ch3coona·3h2o)2.72g,加去离子水溶解,然后移至100ml容量瓶定容,即配制为0.2m的醋酸钠溶液;移取1.02ml冰醋酸至100ml容量瓶并定容,即得0.2m醋酸溶液;将醋酸钠溶液与醋酸溶液进行混合,然后用盐酸和氢氧化钠调节缓冲溶液的ph值分别为2.0,2.5,3.0,3.5,4.0,4.5,5.0,6.0,7.0。
2)铜离子(ii)溶液的配制:称量2.0g的醋酸铜置于烧杯中,加入去离子水使其完全溶解,将醋酸铜溶液转入100ml容量瓶,用去离子水定容,得到0.1m醋酸铜溶液。
3)显色底物tmb溶液的制备:称量0.12g的tmb粉末置于烧杯中,加入40ml乙醇和1ml二甲基甲酰胺,磁力搅拌使其完全溶解后转入100ml棕色容量瓶,加去离子水定容,得到5mmtmb溶液。
4)过氧化氢溶液的配制:取30%的过氧化氢水溶液1.02ml,加入100ml棕色容量瓶中,用去离子水定容,即得0.1m过氧化氢溶液。然后取0.1m过氧化氢溶液100μl于100ml棕色容量瓶,用去离子水定容,得到100μm过氧化氢溶液。
c)配制显色试剂:先取200μl步骤2)中的0.1m醋酸铜水溶液于5ml具塞试管中,此时溶液为无色。再加入步骤3)中5mmtmb溶液300μl、步骤4)中的100μm过氧化氢水溶液250μl,然后用步骤1)醋酸-醋酸钠缓冲溶液(ph=3)定容至2.5ml,摇匀后置于40℃水浴锅中,孵育20min,此时溶液由无色变成蓝色,得到显色试剂;测定在652nm处的紫外吸光度值a0;
d)绘制标准曲线:在显色试剂中依次加入0μm、0.1μm、0.2μm、0.4μm、0.8μm、1.0μm、2.0μm、4.0μm、5.0μm的l-抗坏血酸标准溶液各250μl,此时蓝色溶液消失或变浅。如图1所示,利用铜离子(ii)过氧化物酶的活性,催化过氧化氢氧化3,3′,5,5′-四甲基联苯胺(tmb)生成氧化态tmb(oxtmb),使溶液呈蓝色,溶液中加入l-抗坏血酸,由于l-抗坏血酸具有还原性,会使oxtmb还原成tmb,此时溶液颜色消失或变浅。静置20min后测量。将反应后的溶液倒入石英比色皿中,进行紫外分光光度计测试,采集紫外光谱(如图2所示),以紫外光谱中652nm处的紫外吸收强度变化值δa(a0-a)对l-抗坏血酸的浓度建立定量分析的标准曲线(如图3所示)。检测l-抗坏血酸的范围0.1-5.0μm,检测限为0.02μm。根据图3,得到线性方程δa=0.2617c+0.0471,r2=0.9997(n=8),c值为待测样品中l-抗坏血酸的浓度,单位为μm。
e)配制待测样品溶液:称取样品溶于醋酸-醋酸钠缓冲溶液中,经过离心和滤膜过滤,除去不溶物,向样品溶液中分别添加不同浓度的l-抗坏血酸,定容,得到处理后l-抗坏血酸的待测样品溶液。
f)在孵育后的显色试剂中,加入待测样品溶液,充分反应后,采集紫外光谱,读取652nm处的紫外吸收强度值,带入到线性方程,计算待测样品中l-抗坏血酸的浓度数值,从而实现对待测样品中l-抗坏血酸的定量检测。
实施例2——可行性实验
根据实施例1,采用比色法对体系进行可行性实验,如图4所示,a为在5ml具塞试管中,加入5mmtmb溶液300μl和10μm抗坏血酸溶液200μl,反应30分钟后,用紫外分光光度计扫描紫外吸收光谱;b)为5mmtmb溶液300μl和0.1m铜离子(ii)溶液200μl的紫外吸收曲线;c)为在b)中加入100μmh2o2250μl和10μm抗坏血酸200μl的紫外吸收曲线;d)为在b)中加入100μmh2o2250μl的紫外吸收曲线。从图4可以看出,b、c曲线的紫外吸收强度差别较大,表明h2o2在此体系中起着重要作用。c、d曲线的紫外的吸收强度有明显变化,说明抗坏血酸具有还原性对体系有明显响应。
实施例3——检测条件优化
体系最佳ph值选择:在5ml的带塞试管中,分别加入0.1m醋酸铜溶液200μl、5mmtmb溶液300μl和100μmh2o2溶液250μl,然后加入ph为2~7的醋酸-醋酸钠缓冲溶液,定容为2.5ml。利用紫外可见光分光光度计进行检测。如图5所示,从图可以看出,随着ph值的增大,溶液在652nm处的紫外吸光度值逐渐增强,ph=3时溶液在652nm处的吸光度值达到最大,之后溶液吸光度值逐渐降低。因此,反应体系最佳ph值为3。
显色试剂中3,3′,5,5′-四甲基联苯胺(tmb)的最佳浓度选择:在5ml的带塞试管中,分别加入0.1m醋酸铜溶液200μl、100μmh2o2溶液250μl和一定量不同浓度的tmb溶液,然后加入ph=3缓冲溶液,定容为2.5ml。摇匀后置于40℃恒温水浴锅中,30分钟后测定溶液的吸光度。如图6所示,随着tmb的浓度增大,溶液在652nm处的紫外吸光度值逐渐增强,当tmb浓度为0.6mm时,溶液在652nm处的紫外吸光度值达到最大,之后溶液吸光度值趋于平缓。因此,确定显色试剂中tmb浓度最佳为0.6mm。
实施例4——本发明方法的选择性
为了考察铜离子(ii)作为过氧化物模拟酶检测抗坏血酸的选择性,本实验对奶粉中一些干扰因素金属离子(钙ca2+、镁mg2+、钾k+、钠na+)、氨基酸(苏氨酸thr、组氨酸his、缬氨酸val、苯丙氨酸phe)、生物分子(葡萄糖glu、果糖fru、乳糖lac、麦芽糖mal)进行测定。在相同的条件下,分别在铜离子(ii)的体系中加入干扰物。如图7所示,在抗坏血酸(aa)存在时,溶液在625nm处紫外吸光度比较强,而干扰物在浓度较高(金属离子的浓度为20μm,生物分子的浓度为50μm)的条件下,溶液在625nm处紫外吸光度仍无显著变化。因此,干扰物对测定紫外吸光度的信号影响比较小,可以忽略。以上实验结果说明,基于铜离子(ii)比色法检测抗坏血酸具有优异的选择性和抗干扰性能,因此,此方法能直接应用于食品抗坏血酸的定量测定。
实施例5——实际样品检测
配制待测样品溶液:待测样品为奶粉,奶粉样品购买于当地超市,称取奶粉1.0g溶于5ml醋酸-醋酸钠缓冲溶液中,经过离心和0.45μm孔径滤膜过滤,除去不溶物。向处理好的样品溶液中分别加入1μm、2μm、3μm的l-抗坏血酸,定容至2.5ml,得到处理后的添加三种浓度l-抗坏血酸的待测样品溶液。
对奶粉中的l-抗坏血酸进行检测分析。在3支5ml具塞试管中,先分别加入0.1m醋酸铜溶液200μl,然后分别加入浓度5mmtmb溶液250μl和100μmh2o2溶液250μl,再用ph=3醋酸-醋酸钠缓冲溶液定容2.5ml,摇匀后置于40℃水浴锅中,孵育20min。最后依次分别加入上述处理后的添加三种浓度l-抗坏血酸的待测样品溶液250μl,20min后测量。采集紫外光谱,读取652nm处的紫外吸光强度值,带入到实施例4中得到的线性方程,每个样品重复测样3次,求平均值,计算得到奶粉中l-抗坏血酸的含量为95.8mg/(100g)(如表1)。
测定结果与说明书标示的100mg/(100g)基本相符。通过加标实验得到样品的加标回收率在90.2-106.3%之间,相对标准偏差(rsd)小于5%,说明该检测方法准确度高,具有良好的选择性。同时,所述显色试剂以及测定抗坏血酸的方法,不需要纳米粒子的制备及表面修饰,没有复杂的有机合成。本发明的检测方法可用于食品中抗坏血酸的检测。
表1奶粉中抗坏血酸的测定结果
上述内容虽然结合实施例对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
- 还没有人留言评论。精彩留言会获得点赞!