使用微粒去除非特异性结合信号的方法与流程
使用微粒去除非特异性结合信号的方法
1.相关申请
2.本技术要求于2019年2月21日提交的美国临时申请号62808746的优先权,其公开内容通过整体并入本文。
背景技术:
3.生物样品中化学和生物靶标(分子或微生物)(例如血液、血浆、血清、尿液、唾液和各种粘膜分泌物、鼻咽和口咽拭子、呼吸道痰液以及细胞和组织裂解物)的准确检测和定量对于快速准确诊断各种疾病、疾病状况监测、医疗监测以及确定适当治疗方案很重要。在许多情况下,被检测或量化的靶标少量地存在于生物样品中,并且通常与大量不相关或干扰的成分混合。此类靶标或分析物的准确检测需要高度灵敏和特异性的测试方法,例如配体结合测定(ligand binding assay,lba)。
4.灵敏度和特异性是任何基于配体结合测定检测平台的两个关键要素。“分析灵敏度”表示样品中可通过测定准确测量的最小的分析物的量。“分析特异性”指测定法测量样品中一种特定分析物而非其他分析物的能力。理论上,灵敏度和特异性是二元分类测试性能的统计量度,在统计学中也称为分类函数:灵敏度(在某些领域也称为真阳性率、召回率或检测概率)衡量被正确识别为阳性的比例(例如,被正确识别为患有此种疾病的病人的百分比)。特异性(也称为真阴性率)衡量被正确识别为阴性的比例(例如,被正确识别为没有疾病的健康人的百分比)。简言之,灵敏度是实际测试为阳性的真阳性的比例,灵敏度测试很少会“错过”阳性个体;特异性是实际测试为阴性的真阴性的比例,特异性测试不会产生假阳性。由于缺乏灵敏度和/或特异性,分析方法可能无法准确检测分析物。一方面,特异性方法可能缺乏足够的灵敏度来检测少量的目标分析物;另一方面,由于背景信号,灵敏性方法可能缺乏特异性。
5.配体结合测定(lba)是一种分析检测程序,它依赖于配体分子与受体、抗体或其他大分子的结合。检测方法用于确定所形成的配体
‑
受体复合物的存在和程度,这通常通过电化学或荧光检测方法来确定。此种类型的分析测试可用于测试样品中已知与受体结合的目标分子的存在。典型的配体结合测定将一个结合伴侣(binding partner)锚定在固体表面,因此称为固相配体结合测定,包括多孔板分析(例如elisa)、珠上(on
‑
bead)配体结合测定、柱上(on
‑
column)配体结合测定、过滤测定、表面等离子体共振测定(biacore)和基于平衡法(equilibrum
‑
based)的测定。尽管配体结合测定具有高度特异性,但多种因素(包括抗体亲和力、相互作用物的价态、测定形式、测定程序变异性和基质效应)通常会限制特定方法的灵敏度和特异性。
6.生物样品(例如血清)含有背景结合成分,包括天然抗体、类风湿因子和许多其他阻止对样品中分析物进行准确分析的基质因素。测试样品中的背景结合因子可能会使样品中目标分析物的检测和定量复杂化。
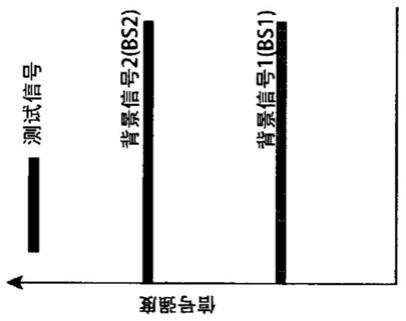
7.背景信号会影响测定的灵敏度和特异性,因为它们会导致假阳性或假阴性结果,具体取决于检测分界点(cut point)的设置方式。如图1所示,当来自分析物的检测信号远
高于背景信号时,该组分界点仅影响定量而不影响检测为靶标的阳性(图1c)。然而,当目标信号低时,不同组的分界点导致分析物信号被视为完全相反的结果(阴性或阳性)(图1a和1b)。分界点设置的此种不确定性会干扰对危及生命的疾病的准确诊断,例如疾病早期的生物标志物、低水平的传染性物种和低水平的过敏原特异性ige等。
8.背景结合有许多原因,包括测试样品或检测溶液中与基质结合并导致标记的检测剂与非预期目标的基质结合的任何因素。结合可以是结合到容器的表面位点或结合到未被预期目标覆盖的捕获剂部分或结合到与结合链复合物的任何部分结合的非预期检测剂。
9.几乎所有基于固相的测定均会受到基质结合效应的影响,包括elisa和基于微珠(bead)的测定。基质中除分析物之外的成分可以与固体表面相互作用并干扰测定结果。例如,如果测试样品中存在大量分析物相关成分(例如,天然抗体、igg),则该成分可以以剂量依赖性方式与固体表面非特异性结合并且(如果测试形式中使用分析物的抗ig检测剂)可被检测到。血清/血浆成分可能会影响测定结果,通常需要稀释患者样本进行检测以尽量减少此种影响。
10.测定变异性来自系统变异性,包括物理分离的容器、复杂的测定程序以及样品变异性,包括样品基质和分析物浓度。
11.在典型测定程序中,变异性可能来自样品处理、样品稀释、温度、移液、试剂添加顺序、孵育时间、洗涤周期等任何步骤。所有这些因素均会增加测定结果的不确定性。
12.导致非特异性结合的另一个因素是分析物与固体表面的非特异性结合,即不是与特异性分析物捕获分子结合,而是直接与表面位点结合,导致剂量依赖性非特异性信号。
13.背景结合原因的复杂性使得很难根据正常/阴性对照简单地扣除或去除背景信号,因为每个样本均有其独特的背景成分。
14.有两种常见的策略可以克服配体结合测定的背景信号:1)减少背景结合;和2)基于“阴性”对照建立分析分界点。这两种策略会影响不同方向的分析灵敏度和特异性。
15.对于elisa平台,常使用空白对照和/或不相关分子作为与测试样品相同板的孔的对照,检测生物样品中的分析物,以确定板特异性分界点(系统分界点)。由于od的读数范围有限和物理限制,elisa方法具有所有潜在的基质结合效应,因此elisa测定通常需要将样品稀释到一定程度,不仅要稀释背景结合,还要将分析物稀释到窄窗口的检测范围。这会降低测定灵敏度。具有多重微珠测定的现有技术可以同时检测来自一个以上样品的许多属性。由于检测剂是荧光标记试剂,检测范围很广。这直接导致了广泛的检测范围和许多筛选设计,因此不需要稀释样品。然而,基于微珠的检测具有与elisa检测相同的背景结合问题。市售试剂盒中有背景信号的报告,因为在阴性对照微珠上发现了强信号。已努力阻止这些信号,包括从样品中预吸附类风湿因子或对微珠进行特殊处理。这些方法通常很昂贵,且不能完全去除阴性对照微珠上的背景信号。
16.为了减少生物测定(例如elisa、western blot、基于微珠的测定或其他基于固相的测定,包括微芯片和immunocap)中的背景结合,通过使用非特异性结合的阻断材料(例如bsa)“预先占据”固相上那些潜在的结合位点,可以大大减少检测剂的非特异性结合。有时从基质中预吸附(消耗)干扰因子,例如,使用蛋白a/g预处理降低测试血清中的igg水平有助于检测特定的igm和ige抗体。然而,此种非特异性阻断材料通常不能完全阻断非特异性结合位点,典型结合缓冲液中bsa的百分比为0.1%至10%不等。高浓度阻断剂(10%)可能
会阻止或干扰检测分析物与固定在固相(例如elisa板或微珠表面)上的配体的预期特异性结合。在其他情况下,检测剂甚至可能与bsa发生反应。在血浆和血清样品中,背景结合与样品中背景结合因子的数量有关,因此在典型的elisa检测中,样品需要至少稀释50倍以减少高浓度背景结合因子(例如类风湿因子、天然抗体等)的影响。
17.在实践中减少背景结合的另一种方法是用去污剂(例如非离子去污剂tween 20)进行洗涤。虽然此种方法去除了低亲和力的背景结合信号,但目标分析物信号也会降低,因此检测灵敏度也会降低。
18.很多时候,通过稀释来降低背景信号的做法是一把双刃剑。当目标特异性信号很高时,需要滴定或稀释测试样品以优化检测信号与背景信号(增加信噪比)。然而,当分析物浓度较低时,稀释一方面会降低背景信号(即降低非特异性信号,换言之增加特异性),另一方面,样品稀释会导致分析物信号被稀释并降低灵敏度。分析物信号与背景信号(噪声)的相关性很重要,而背景信号水平用于设置为分界点。
19.对于特定测定法,控制系统分界点相对容易。例如,elisa测定中的板特异性分界点可以证明质量有保证的板和检测剂的精确度和一致性。然而,控制样本变异性极其困难,因为每个样本均有其独立的背景或基质,或其他独立变量。即使是具有不同稀释度的相同样品,每个稀释度的背景也具有独立变量。对于血清样品,通常根据混合血清或一定数量“阴性”样品的平均值(或范围)来设置分界点。该分界点可能高于或低于特定样本的实际背景信号。分界点的错误选择会导致对检测边缘信号的错误解读。
20.当实际背景信号或基质结合信号高于阴性对照产生的分界点时,可能导致假阳性。在某些情况下,如果存在相互作用,靶标信号甚至可以在抑制测定(通常用作特异性测试)中被游离分析物阻断。
21.当个体的背景低于阴性对照产生的分界点时,尤其是当个体中测试的分析物浓度较低且结合信号仅处于临界且弱于阳性对照建立的检测限(lod)时(阳性对照在具有较高背景信号的阴性样品基质中稀释),会导致假阴性结果。
22.不同的样品具有不同的基质和不同的背景以及不同数量的测试/目标分析物,所有这些均会导致测试的信号变异性。即使是阴性样本也具有其自身的基质和背景,因此基于阴性对照的分界点基础可能具有错误的基本假设,尤其是在存在样本异常值的情况下。不同的测试样本,例如来自两个不同个体的血清,通常具有不同的天然抗体、类风湿因子的背景水平。即使是来自同一个体的不同疾病状态的样本,或具有不同稀释度的同一样本,背景水平也会不同。因此,基于一定数量的外部“正常”或阴性个体的平均值而忽略异常值的lod的任意分界点不一定是lod的最佳估计。此种做法将导致一些低边缘但真正阳性的信号被解释为假阳性或掩埋在分界点读数的标准偏差范围内。
技术实现要素:
23.本发明提供了通过利用捕获微粒和对照微粒去除非特异性结合信号来准确检测样品中的一种或多种分析物的方法和试剂盒。这些方法和试剂盒能够大大提高当前基于微珠的多重免疫测定的灵敏度、特异性和准确度。
24.在本发明主题的一个方面,提供了用于检测样品中可能存在的n种目标分析物(n为等于或大于1的自然数)的方法。该方法包括:
25.(a)针对n种目标分析物中的每种分析物,向生物样品中加入多对微粒,从而形成混合物,每对微粒包括(1)捕获微粒和(2)相应的对照微粒;每个捕获微粒包含第一基底和偶联在第一基底上的至少一种捕获剂,所述捕获剂具有活性且能够与分析物特异性结合;每个对照微粒包含第二基底,所述第二基底不与能够特异性结合分析物的活性捕获剂偶联;
26.(b)针对n种目标分析物中的每种分析物,向所述混合物中加入能够结合分析物的检测剂;
27.(c)在流式细胞仪的单个文件中比对和通过n种目标分析物中的每种分析物的每个微粒,同时检测(1)与微粒结合的检测剂产生的检测信号和(2)微粒中基底发出的内参信号;所述捕获微粒与相应的对照微粒的内参信号彼此不同,且各自不同于检测信号;
28.(d)针对n种目标分析物中的每种分析物,基于检测到的不同内参信号,区分来自捕获微粒的检测信号和来自相应的对照微粒的检测信号;
29.(e)针对n种目标分析物中的每种分析物,由获得的捕获微粒的检测信号得到第一加权值,由获得的相应对照微粒的检测信号得到第二加权值,用第一加权值减去第二加权值,得到校准加权值;以及
30.(f)针对n种目标分析物中的每种分析物,基于校准加权值,确定样品中存在或不存在分析物。
31.在该方法的一些实施方式中,检测剂包含荧光染料,检测与每个微粒结合的检测剂产生的检测信号包括检测由微粒发出的荧光信号。
32.在一些实施方式中,每个微粒的基底包含荧光染料,检测每个微粒中基底发出的内参信号包括检测由微粒发出的荧光信号。在该方法的一些实施方式中,检测剂包含化学发光染料,检测与每个微粒结合的检测剂产生的检测信号包括检测由微粒发出的化学发光信号。
33.在该方法的一些实施方式中,检测剂包括放射性物质,检测与每个微粒结合的检测剂产生的检测信号包括检测由微粒发出的放射性信号。
34.在一些实施方式中,检测剂包含重金属离子标签,检测与每个微粒结合的检测剂产生的检测信号包括在质谱仪中检测代表包含在检测剂中的重金属离子标签的信号。在某些实施方式中,针对n种目标分析物中的每种分析物的每个微粒的基底包含重金属离子标签,其中,针对n种目标分析物中的任一分析物的每对微粒中的重金属离子标签彼此不同,且各自与检测剂的重金属离子标签不同,检测每个微粒中基底发出的内参信号包括在质谱仪中检测代表基底中包含的重金属离子标签的信号。
35.在一些实施方式中,n种目标分析物中的每种分析物包含对抗原或过敏原具有特异性的抗体或生物素化(biotinylated)抗体。抗原或过敏原可选自:蛋白质、细菌、病毒、细菌成分、病毒成分、毒素、药物、药物赋形剂、花粉、草、灰尘和花生。
36.在一些实施方式中,n种目标分析物中的每种分析物可以独立地选自:药物化合物、血液中的因子、蛋白质、细菌、细菌成分、病毒、病毒成分、肽、抗体、毒素、激素、细胞因子、免疫球蛋白、免疫球蛋白fab、多核苷酸、药物、药物载体和药物赋形剂。
37.在一些实施方式中,样品包括体液(或生物体液),其可选自:血液、血浆、精液、尿液、唾液、粘膜分泌物、鼻咽和口咽拭子、呼吸道痰液、鼻涕泪液和组织裂解液。体液可从已
被诊断患有预定疾病或病症(例如癌症)的个体获得。
38.在一些实施方式中,捕获剂包含抗原或抗体。抗原可选自:蛋白质、肽、细菌、病毒、细菌成分、病毒成分、毒素、激素、细胞因子、药物化合物、血液因子、免疫球蛋白、免疫球蛋白fab、多核苷酸、药物载体或赋形剂。
39.在一些实施方式中,确定分析物的丰度包括检测分析物的存在或不存在而不量化样品中分析物的量。在其他实施方式中,如果确定样品中存在某种分析物,则还确定样品中分析物的量。
40.在一些实施方式中,样品为来自人体的生物样品,n个目标分析物中的第一个分析物是具有已知同种型且对已知抗原具有特异性的人抗体,第一个分析物的每对微粒和对照微粒的捕获剂包含捕获抗体,所述捕获抗体能够特异性结合已知人抗体同种型的fc部分或与已知人抗体同种型的fc部分的受体偶联。第一个分析物的对照微粒包含饱和量的阻断抗体,其结合对照微粒中可用量的捕获抗体。阻断抗体具有相同的已知同种型,对已知抗原是非特异性的,或者对获得生物样品的个体的未经处理(treatment
‑
naive)的抗原是特异性的。第一分析物的检测剂包含已知抗原。在一些实施方式中,已知抗原选自药物或天然过敏原的成分。在一些实施方式中,捕获抗体是单克隆或多克隆的抗fc抗体。在一些实施方式中,抗fc抗体是与igg、iga、igm或ige特异性结合的抗体。在一些实施方式中,fc部分的受体是fc
‑
μ受体(fcμr)、fc
‑
γ受体(fcγr)、fc
‑
α受体(fcαr)、fc
‑
α/μ受体(fcα/μr)、fc
‑
ε受体(fcεr)或fcrn。
41.在一些实施方式中,样品中任一n种分析物的丰度的确定包括:针对n种目标分析物中的每种分析物:使用具有不同已知浓度的分析物的多个标准样品,将所述标准样品与(a)中相同的微粒对进行混合,同一标准品的捕获微粒和对照微粒数目相同。用步骤b)
‑
e)对标准样品进行处理,产生对应于不同已知浓度的一系列校准加权值;得到多个标准样品中分析物的校准加权值与已知浓度之间的数学关系;基于得到的分析物的校准加权值和所述数学关系,确定样品中分析物的丰度。在其他实施方式中,确定包括将(1)测试样品中分析物的计算校准值与(2)上面建立的多个标准样品中分析物的校准加权值和已知浓度之间的数学关系相关联。
42.在一些实施方式中,当n大于1时,针对n种目标分析物中的一种分析物的检测剂不同于针对n种目标分析物中的另一种分析物的检测剂。在其他实施方式中,针对n种目标分析物中的每种分析物的检测剂是相同的。
43.在一些实施方式中,当n大于1时,针对n种目标分析物中的一种分析物的包含在捕获微粒中的第一基底发出与针对n种目标分析物中的另一种分析物的包含在捕获微粒中的第一基底不同的内参信号。
44.在一些实施方式中,当n大于1时,针对n种目标分析物中的一种分析物的包含在对照微粒中的第二基底发出与针对n种目标分析物中的另一种分析物的包含在对照微粒中的第二基底不同的内参信号。
45.在另一方面,本发明提供了用于检测样品中的一种以上分析物的试剂盒。该试剂盒可以包括:多对微粒以及能够结合分析物的检测剂,每对微粒包括(1)捕获微粒和(2)相应的对照微粒,其中,每个捕获微粒包含第一基底和偶联在第一基底上的至少一种捕获剂,所述捕获剂具有活性且能够与样品中可能存在的分析物特异性结合;每个对照微粒包含第
二基底,所述第二基底不与能够特异性结合分析物的活性捕获剂偶联。
46.在试剂盒的一些实施方式中,检测剂包含荧光染料。在试剂盒的一些实施方式中,检测剂包含化学发光染料。在试剂盒的一些实施方式中,检测剂包括放射性物质。在试剂盒的一些实施方式中,检测剂包含重金属离子标签。
47.在一些实施方式中,第一基底和第二基底各自包含彼此不同且与检测剂中的荧光染料不同的荧光染料。
48.在一些实施方式中,第一基底和第二基底各自包含彼此不同且与检测剂中的金属离子标签不同的重金属离子标签。
49.在一些实施方式中,试剂盒可用于检测特异性病毒或其抗体,例如2019
‑
ncov。在此类的实施方式中,捕获纳米颗粒可包含特异性病毒抗体或抗原;相应的对照纳米颗粒可以仅包含载体系统,不包含病毒抗体和病毒抗原。
50.在一些实施方式中,该试剂盒可用于检测针对聚乙二醇的特异性抗体(例如ige)。在此类的实施方式中,捕获纳米颗粒可包含聚乙二醇;相应的对照纳米颗粒可包含载体系统(不含聚乙二醇)。
附图说明
51.图1a、ib和1c显示在配体结合测定中,背景结合信号(bs)确定测定法的分界点或检测限(lod)。图1a显示样品的检测信号高于背景信号bs1(其也被选为分界点),因此被认为是阳性的。图1b显示了如果选择不同的分界点bs2,则被视为阴性的相同样本的检测信号。然而,仅bs1和bs2之一可以是准确的。如果bs1是准确的,则图1b显示了假阴性结果;如果bs2是准确的,则图1a显示了一个假阳性结果。当基于“阴性”样品组确定的分界点大范围波动时,处于上线和下线之间的样品信号可能为假阴性,因此降低测定的灵敏度。图1c显示样本的测试信号远高于bs1和bs2,因此无论选择哪个分界点,结果均被认为是阳性的。在图1c的情况下,分界点会影响分析物的定量,但不会影响测试结果是阳性还是阴性。
52.图2a
‑
2h显示了一对捕获微粒(携带捕获分子)和相应的对照微粒(不携带捕获分子);两种微粒具有相同的非特异性结合背景结合位点,其中:
53.图2a显示了可与分析物特异性结合的捕获分子;
54.图2b显示了背景结合位点,背景分子可以“非特异性”结合;
55.图2c显示了分析物具有与检测分子结合的位点;
56.图2d显示了背景结合分子可以与检测分子结合;
57.图2e显示了具有捕获分子和背景结合位点的捕获微粒,以及仅具有背景结合位点的相应的对照微粒。它们被添加到含有分析物和背景结合分子的样品中(m表示许多这样的分子,其余附图一样);
58.图2f显示了捕获分子和分析物在捕获微粒表面形成结合复合物,而背景结合分子与捕获微粒和对照微粒上的背景位点形成结合复合物。加入了检测剂;
59.图2g显示了捕获微粒上的捕获分子
‑
分析物
‑
检测剂复合物以及捕获微粒和对照微粒上的背景结合位点
‑
背景结合分子
‑
检测剂复合物;
60.图2h图示了来自检测分子的检测信号的信号强度图(直方图)(通过例如荧光强度或通过质谱的标记金属强度),确定了捕获微粒和相应对照微粒之间的信号差异。
61.图3a
‑
3k显示了捕获微粒和相应的对照微粒,每个微粒均携带可以与捕获分子特异性结合的抗体(其进而可以与分析物特异性结合),其中,捕获微粒被捕获分子饱和以允许它们之间的结合,而对照微粒没有,因此当微粒均被引入含有分析物的样品时,仅捕获微粒会与分析物特异性结合(通过捕获分子),而捕获微粒和对照微粒均会结合背景分子,其中:
62.图3a显示了与捕获抗体特异性结合的捕获分子(捕获剂);
63.图3b显示了与分析物(抗体)特异性结合的捕获分子;
64.图3c显示了与背景结合分子结合的背景结合结构;
65.图3d显示了分析物与标记的检测剂结合;
66.图3e显示了背景结合分子与标记的检测剂结合;
67.图3f显示了捕获微粒,该捕获微粒携带与捕获分子特异性结合的捕获抗体;
68.图3g显示了对照微粒在缓冲液中孵育,因此不与捕获分子结合;
69.(注意:虽然图3f和图3g中仅显示了一个捕获微粒和一个相应的对照微粒(它们一起构成了一对微粒),但应理解,在测试或实验中可以有数百、数千、数百万或使用更多个这样的对)
70.图3h显示了图3f和3g中所示的微粒与含有分析物和背景结合分子的样品一起孵育;
71.图3i显示了具有捕获抗体
‑
捕获分子
‑
分析物复合物以及背景结构
‑
背景结合分子复合物的捕获微粒,以及仅具有背景结构
‑
背景结合分子复合物的相应对照微粒。当与标记的检测剂一起孵育时,捕获微粒和对照微粒形成复合物,如图3j所示;
72.图3j显示了检测剂与分析物以及背景结合分子结合的捕获微粒,以及检测剂与背景结合分子结合的对照微粒;
73.图3k是来自检测分子的检测信号的信号强度图(直方图)(通过例如荧光强度或通过质谱的标记金属强度),确定捕获微粒和相应的对照微粒之间的信号差异。
74.图4a
‑
4h显示了在与取自用聚乙二醇免疫的小鼠的血清样品共孵育后携带聚乙二醇(peg)的捕获微粒和不携带peg的相应对照微粒,两者均显示了pe标记的抗小鼠ig的滴定依赖性结合信号。对照微粒信号与背景结合相关,而捕获微粒信号与抗peg ig的特异性结合和背景结合相关。其中:
75.图4a显示了来自荧光流式细胞术(ffc)的微粒的fsc(前向散射光)和ssc(侧向散射光)参数,显示来自捕获微粒和对照微粒的信号不可区分;
76.图4b显示了被微粒基底(不同聚苯乙烯微珠)的内部荧光分开的捕获微粒和对照微粒的荧光信号;
77.图4c显示了在一次血清滴定中来自捕获微粒的检测信号的直方图;
78.图4d显示了在与图4c相同的滴定中来自相应的对照微粒的检测信号的直方图;
79.图4e显示了来自并排布置的图4a和图4b的直方图,显示了信号差异;
80.图4f和图4g是捕获微粒和相应的对照微粒的加权荧光强度对血清滴定因子的图;
81.图4h是捕获微粒和相应的对照微粒的加权荧光强度的差异对血清滴定因子的图。
82.图5a
‑
5f显示了使用第一系列的捕获微粒(称为i)和相应对照微粒(称为i
‑
ctrl)获得样品中第一分析物的校准信号的工作流程。尽管仅显示了一个捕获微粒和一个相应的
对照微粒(它们一起构成一对微粒),但应理解在测试或实验中可使用数百、数千、数百万以上个这样的对。该系列的捕获微粒和对照微粒均携带相同的捕获抗体(特异性抗同种型抗体)并具有相同的背景结合特征,但i
‑
ctrl已被与第一分析物同种型无关的抗体预先占据,该抗体是样品中可与已知抗原(药物或过敏原)特异性结合的同种型抗体。抗原包括信号部分并且在本文中被认为是检测剂。其中:
83.图5a显示捕获微粒(i)及其相应的对照微粒(i
‑
ctrl)均携带相同的捕获抗体、特异性抗同种型抗体,两种微粒具有相同的背景结合特征;
84.图5b示意性地显示了i
‑
ctrl对照微粒被同种型对照抗体预先占据并饱和,其同种型被捕获抗体特异性结合(以此种方式,i
‑
ctrl微粒失活,因此不能结合具体到分析物);
85.图5c示意性地显示了捕获微粒i和对照微粒i
‑
ctrl(已被同种型抗体饱和)均与样品一起孵育,该样品含有第一分析物(具有第一特异性同种型的特异性抗体)、与第一分析物具有相同同种型的非特异性抗体和其他背景结合分子;
86.图5d示意性地显示了被第一分析物结合的捕获微粒i和未被第一分析物结合的i
‑
ctrl微粒均与具有信号部分的抗原(例如检测剂)一起孵育并且能够与第一分析物特异性结合;
87.图5e示意性地显示了被第一分析物结合的捕获微粒i与标记抗原特异性结合,而对照微粒i
‑
ctrl不与标记抗原结合。除了标记的抗原外,两种微粒均带有相同的背景结合位点,因此结合样品中的背景结合分子相同;
88.图5f示意性地显示了检测信号强度直方图(由标记的抗原产生,例如由荧光强度或通过在荧光流式细胞术或质谱细胞术中标记金属强度的质谱检测)。确定捕获微粒i和相应的对照微粒i
‑
ctrl之间的信号差异。
89.图6a
‑
6f显示了使用第二双系列捕获微粒(称为ii)和相应的对照微粒(称为ii
‑
ctrl)获得样品中的第二分析物的校准信号的工作流程。尽管仅显示了一个捕获微粒和一个相应的对照微粒(它们一起构成一对微粒),但应理解在测试或实验中可使用数百、数千、数百万以上这样的对。该系列的捕获微粒和对照微粒均携带相同的捕获抗体(特异性的抗同种型抗体)并具有相同的背景结合特征,但ii
‑
ctrl已被与第二分析物同种型无关的抗体预先占据,该抗体是样品中可与已知抗原(药物或过敏原)特异性结合的同种型抗体。这里显示的抗原(或检测剂)可以与图5a中的抗原相同。其中:
90.图6a显示了捕获微粒(ii)及其相应的对照微粒(ii
‑
ctrl),两者均携带相同的捕获抗体、特异性抗同种型抗体,两者均具有相同背景结合特征的微粒;
91.图6b示意性地显示了ii
‑
ctrl对照微粒被同种型对照抗体预先占据和饱和,其同种型被捕获抗体特异性结合(以此种方式,ii
‑
ctrl微粒失活,因此不能结合特异性分析物);
92.图6c示意性地显示了用同种型抗体饱和的捕获微粒ii和对照微粒ii
‑
ctrl均与样品一起孵育,该样品含有第二分析物(具有第二特异性同种型的特异性抗体)、与第二种分析物具有相同同种型的非特异性抗体和其他背景结合分子;
93.图6d示意性地显示了被第二分析物结合的捕获微粒ii和未被第二分析物结合的ii
‑
ctrl微粒均与具有信号部分的抗原(例如检测剂)一起孵育并且能够与第二分析物特异性结合;
94.图6e示意性地显示了被第二分析物结合的捕获微粒ii与标记抗原特异性结合,而对照微粒ii
‑
ctrl不与标记抗原特异性结合。除了标记的抗原外,两种微粒均带有相同的背景结合位点,因此结合样品中的背景结合分子相同;
95.图6f示意性地显示了检测信号强度直方图(由标记的抗原产生,类似于图5f)。确定捕获微粒ii和相应对照微粒ii
‑
ctrl之间的信号差异。
96.图7a
‑
7f显示了使用第三双系列的捕获微粒(称为iii)和相应对照微粒(称为iii
‑
ctrl)获得样品中第三分析物的校准信号的工作流程。尽管仅显示了一个捕获微粒和一个相应的对照微粒(它们一起构成一对微粒),但应理解在测试或实验中可使用数百、数千、数百万以上个这样的对。该系列的捕获微粒和对照微粒均携带相同的捕获抗体(特异性抗同种型抗体)并具有相同的背景结合特征,但iii
‑
ctrl已被与第三分析物同种型无关的抗体预先占据,该抗体是样品中可与已知抗原(药物或过敏原)特异性结合的同种型抗体。这里显示的抗原(或检测剂)可以与图5a和/或图6a中的抗原相同。其中:
97.图7a显示了捕获微粒(iii)及其相应的对照微粒(iii
‑
ctrl),两者均携带相同的捕获抗体、特异性抗同种型抗体,两种微粒具有相同的背景结合特征;
98.图7b示意性地显示了iii
‑
ctrl对照微粒被同种型对照抗体预先占据并饱和,其同种型被捕获抗体特异性结合(以此种方式,iii
‑
ctrl微粒失活,因此不能结合具体到分析物);
99.图7c示意性地显示了用同种型抗体饱和的捕获微粒iii和对照微粒iii
‑
ctrl均与含有第三分析物(具有第三种特异性同种型的特异性抗体)的样品一起孵育,非特异性抗体与与第三种分析物和其他背景结合分子相同的同种型;
100.图7d示意性地显示了被第三分析物结合的捕获微粒iii和未被第三分析物结合的iii
‑
ctrl微粒均与具有信号部分的抗原(例如检测剂)一起孵育并且能够与第三分析物特异性结合;
101.图7e示意性地显示了被第三分析物结合的捕获微粒iii与标记抗原特异性结合,而对照微粒iii
‑
ctrl不与标记抗原特异性结合。除了标记的抗原外,两种微粒均带有相同的背景结合位点,因此结合样品中的背景结合分子相同;
102.图7f示意性地显示了检测信号强度直方图(由标记的抗原产生,类似于图5f和/或图6f的)。确定捕获微粒iii和相应的对照微粒iii
‑
ctrl之间的信号差异。
103.图8a
‑
8d显示了使用先前结合图5a
‑
5e、图6a
‑
6e和图7a
‑
7e所述的三个系列的捕获微粒和相应对照微粒对的混合物以同时检测三种分析物的工作流程。捕获微粒而非对照微粒可通过微粒携带的特异性抗同种型抗体(或特异性同种型受体)捕获不同同种型的分析物,并进一步与标记抗原(检测剂,例如荧光染料标记用于荧光流流式细胞术;或金属标记用于质谱流式细胞术)结合。通过荧光流式细胞术或质谱流式细胞术检测信号后,可通过从捕获微粒的信号中减去相应的对照微粒的信号来去除背景结合信号,可以计算出每对微粒的每个系列的信号差以检测三种分析物的存在和量化三种分析物的量。
104.图9a
‑
9c显示了与含有人抗peg抗体(igg、igm和ige同种型)的样品一起孵育的三个示例系列的人ig(即igg、igm和ige)捕获微粒对,其能够检测不同同种型的此类抗体的存在和区分同种型。图9a显示了通过荧光流式细胞术测得的混合物微粒的fsc和ssc。图9b显示了通过微粒的内部荧光来区分的三个系列的微粒对(总共6种类型)。图9c显示了通过检
测荧光信号(即peg缀合的pe)的每个同种型对的捕获微粒和对照微粒的重叠直方图。
105.图10a
‑
10d显示了将金属标记的捕获微粒和对照微粒对添加到具有不同量的抗peg igg和具有不同背景的两个人血清样品中,能够通过质谱流式细胞术检测背景差异和抗peg igg的存在。图10a是用于在含有标准人抗peg的第一血清样品的质谱流式细胞术中区分捕获微粒(含有用174yb标记的基底)和对照微粒(含有用209bi标记的基底)的内部质谱信号的等高线图igg;图10b是第一血清样品的捕获微粒和对照微粒的检测信号直方图(145nd标记的抗人igg)的重叠。图10c是包含标准抗peg igg的第二血清样品的质谱细胞计数中捕获微粒和对照微粒的内部质谱信号的等高线图(类似于图10a);图10d是捕获微粒和对照微粒的第二血清样品的检测信号直方图的重叠。
106.图11显示了根据本发明的一些实施方式的检测样品中分析物的方法的一般流程图。
具体实施方式
107.现在已发现,样品(例如生物样品)中的少量分析物可通过自校准的多步骤过程进行鉴定,可使用针对多个已知浓度的标准分析物生成的数据来确定目标分析物的数量。在一些实施方式中,分析物本身不被扩增。
108.在本发明主题的一个方面,用于检测可能存在于生物样品中的n种目标分析物的方法,n为等于或大于1的自然数,该方法包括:
109.(a)针对n种目标分析物中的每种分析物,向生物样品中加入多对微粒,从而形成混合物,每对微粒包括(1)捕获微粒和(2)相应的对照微粒;每个捕获微粒包含第一基底和偶联在第一基底上的至少一种捕获剂,所述捕获剂具有活性且能够与分析物特异性结合;每个对照微粒包含第二基底,所述第二基底不与能够特异性结合分析物的活性捕获剂偶联;
110.(b)针对n种目标分析物中的每种分析物,向所述混合物中加入能够结合分析物的检测剂;
111.(c)在流式细胞仪的单个文件中比对和通过n种目标分析物中的每种分析物的每个微粒,同时检测(1)与微粒结合的检测剂产生的检测信号和(2)微粒中基底发出的内参信号;所述捕获微粒与相应的对照微粒的内参信号彼此不同,且各自不同于检测信号;
112.(d)针对n种目标分析物中的每种分析物,基于检测到的不同内参信号,区分来自捕获微粒的检测信号和来自相应的对照微粒的检测信号;
113.(e)针对n种目标分析物中的每种分析物,由获得的捕获微粒的检测信号得到第一加权值,由获得的相应对照微粒的检测信号得到第二加权值,用第一加权值减去第二加权值,得到校准加权值;以及
114.(f)针对n种目标分析物中的每种分析物,基于校准加权值,确定生物样品中分析物的丰度。
115.上述工作流程示意性地显示于图11所示的流程图中,下文进一步描述其细节。图2a
‑
2h、图3a
‑
3k、图5a
‑
5f、图6a
‑
6f、图7a
‑
7f、图8a
‑
8d连同相关描述涉及一般方法的某些实施方式。
116.在另一方面,本发明提供了用于检测样品中的一种以上分析物的试剂盒,该试剂
盒包括:多对微粒以及能够结合分析物的检测剂,每对微粒包括(1)捕获微粒和(2)相应的对照微粒,其中,每个捕获微粒包含第一基底和偶联在第一基底上的至少一种捕获剂,所述捕获剂具有活性且能够与样品中可能存在的分析物特异性结合;每个对照微粒包含第二基底,所述第二基底不与能够特异性结合分析物的活性捕获剂偶联。下文关于各种实施方式的方面的描述与所公开的方法和试剂盒相关。
117.如本文所用,微粒是可通过流式细胞术或质谱流式细胞术检测和分析的颗粒。术语“微粒”包括可通过流式细胞术检测的微球、微型珠粒、微珠和其他颗粒。
118.微粒可包括基底或核(core)和偶联在基底上的表面官能团。基底可以为微珠。
119.在一些实施方式中,微粒可具有椭圆体形状,例如球形。在一些实施方式中,微粒的直径可以为约0.5至25微米。
120.在一些实施方式中,微粒用一种以上有色或荧光染料标记。可用于流式细胞术的微粒(包括用有色或荧光染料标记的微粒)是本领域已知的且可商购。用有色或荧光染料标记的微粒可通过包括但不限于美国专利号4,267,234、4,552,812、5,194,300、5,073,498、5,981,180和6,599,331中描述的方法来制备,这些专利的教导通过引用整体并入本文。
121.基于一个以上可检测参数,群体中的每个微粒子集可与其他子集(如果存在任何其他子集)区分开来。在一个实施方式中,可检测参数是微粒的荧光强度、大小和/或形状。
122.微粒包含可用于流式细胞术的任何材料。这些材料包括但不限于:苯乙烯、溴化聚苯乙烯、聚丙烯酸、聚丙烯腈、聚丙烯酰胺、聚丙烯醛、聚丁二烯、聚二甲基硅氧烷、聚异戊二烯、聚氨酯、聚乙酸乙烯酯、聚氯乙烯、聚乙烯吡啶、聚乙烯基苄基氯、聚乙烯基甲苯、聚偏二氯乙烯、聚二乙烯基苯、聚甲基丙烯酸甲酯、乳胶、碳水化合物(例如羧甲基纤维素、羟乙基纤维素)、琼脂、凝胶、蛋白质聚合物、多肽、真核细胞和原核细胞、脂质、金属、树脂、乳胶、橡胶、硅酮(例如聚二甲基二苯基硅氧烷)、玻璃、陶瓷、木炭、高岭石、膨润土或它们的组合。微粒可具有其他表面官能团以促进它们的附着、吸附和/或标记。这些基团可包括例如羧酸酯、酯、醇、脲、醛、胺、硫氧化物、氮氧化物或卤化物。在一个实施方式中,微粒是bd
tm
细胞计数微珠阵列(cba)。在一些实施方式中,微粒可包括超顺磁性微粒、磁性微粒或可磁化微粒。
123.如本文所用,术语“抗体”指完整的免疫球蛋白或单克隆或多克隆抗原结合片段,其具有fc(可结晶片段)区或fc区的fcrn结合片段,本文称为“fc片段”或“fc结构域”。抗原结合片段可通过重组dna技术或通过完整抗体的酶促或化学裂解产生。抗原结合片段尤其包括fab、fab’、f(ab’)2、fv、dab和互补决定区(cdr)片段、单链抗体(scfv)、单结构域抗体、嵌合抗体、双抗体以及含有足以赋予多肽特异性抗原结合的至少一部分免疫球蛋白的多肽。fc结构域包括构成两类或三类抗体的两条重链的部分。fc结构域可通过重组dna技术或通过酶促(例如木瓜蛋白酶切割)或通过完整抗体的化学切割产生。
124.如本文所用,当第一分子(例如捕获剂或分子,例如抗体)“特异性结合”第二分子(例如分析物或另一种抗体或抗原)或对其具有“特异性”时,这意味着第一分子或其一部分与第二分子结合,但基本上不与非第二分子的其他物质结合。优选地,第一分子和第二分子以“高亲和力”结合,即k
d
为1
×
10
‑7m以下、更优选为5
×
10
‑8m以下、更优选为3
×
10
‑8m以下、更优选为1
×
10
‑8m以下、更优选为5
×
10
‑9m以下或甚至更优选为1
×
10
‑9m以下。如本文所用,当第一分子“基本上不结合”第二分子时,这意味着第一分子和第二分子不能结合或不以高亲和力结合,即结合的k
d
为2
×
10
‑6m以上或更优选为1
×
10
‑5m以上、更优选为1
×
10
‑4m以上、
更优选为1
×
10
‑3m以上、甚至更优选为1
×
10
‑2m以上。
125.术语“结合蛋白”包括天然蛋白结合结构域(例如细胞因子、细胞因子受体)、抗体片段(例如fab、scfv、双抗体、可变结构域衍生的结合剂、vhh纳米抗体)、替代支架衍生的蛋白质结合结构域(例如fn3变体、锚蛋白重复变体、centyrin变体、avimer、亲和体(affibody))或任何识别特异性抗原的蛋白质。
126.如本文所用,术语“m”指许多且在某些情况下所示分子或试剂的饱和量。术语“+”表示将两种物质加在一起。符号
“→”
表示下一步。
127.如本文所用,术语“确定样品中分析物的丰度”指确定样品中分析物的量以及确定样品中分析物的简单存在或不存在。
128.如本文所用,术语“个体”优选地指人,但也包括其他哺乳动物。应注意,如本文所用,术语“患者”、“受试者”用作同义词并可互换使用。
129.在一些实施方式中,样品中被检测的分析物包括抗体、蛋白质或多肽。在一些实施方式中,分析物可以为对抗原或过敏原具有特异性的抗体或生物素化抗体,其中,抗原可以为生物样品中的细菌、细菌的成分、病毒/病毒的成分、毒素、花粉、草、灰尘、花生、药物、药物赋形剂。在一些实施方式中,分析物可以为药物化合物、血液中的因子、蛋白质、细菌、细菌成分、病毒、病毒成分、肽、抗体、毒素、激素、细胞因子、免疫球蛋白、免疫球蛋白fab、多核苷酸、药物、药物载体和药物赋形剂。药物载体是药物递送过程中的载体,可选自:脂质体、聚合物胶束、微球、纳米颗粒、蛋白质、igg fc、聚乙二醇(peg)。
130.在一些实施方式中,分析物可以为样品中病原生物的组分。该成分可以为蛋白质或多肽。病原体生物体可以为任何病原体或生物体,包括但不限于:细菌、病毒、真菌、支原体、立克次体、衣原体或原生动物来源的病原体或生物体。病原体生物的一些实例包括:不动杆菌属、放线菌属、气球菌属、气单胞菌属、产碱杆菌属、芽孢杆菌属、拟杆菌属、包特氏菌属、布兰汉氏菌属、双歧杆菌属、弯曲杆菌属、念珠菌属、嗜二氧化碳杆菌属、衣原体属、色杆菌属、梭状芽孢杆菌属、棒状杆菌属、隐球菌属、奇异球菌属、肠球菌属、丹毒丝菌属、埃希氏菌属、黄杆菌属、孪生球菌属(gemella)、淋球菌属、嗜血杆菌属、克雷伯菌属、乳杆菌属、乳球菌属、军团菌属、明串珠菌属、李斯特菌属、微球菌属、分枝杆菌属、奈瑟菌属、诺卡氏菌属、奥斯科维亚菌属、副球菌属、片球菌属、消化链球菌属、丙酸杆菌属、变形杆菌属、假单胞菌属、拉恩氏菌属、红球菌属、红螺菌属、葡萄球菌属、链霉菌属、链球菌属、弧菌属和耶尔森菌属。可检测的病毒包括但不限于肝炎病毒和人类免疫缺陷病毒(hiv)。在此类的实施方式中,所公开的方法还可包括确定获得生物样品的患者是否存在疾病,该疾病由病原生物介导。
131.在一些实施方式中,所公开的方法可同时测定一个样品中多种不同分析物的丰度,即n可为2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、1000、2000、5000、10000、100000、1000000以上,或它们之间的任何自然数。
132.在某些实施方式中,该方法中使用的流式细胞术包括荧光流式细胞术。在其他实施方式中,流式细胞术包括质谱流式细胞术。流式细胞术技术已在文献中广泛描述(例如美国专利号5,736,330、5,981,180、6,499,562和6,649,414,其教导通过引用整体并入本文)。可使用能分析样品(例如生物样品)和/或标准和目标分析物的任何流式细胞仪。此类流式细胞术技术包括,例如,coulter elite
‑
esp流式细胞仪(购自beckman
‑
coulter,inc.,
fullerton,california)、epcs
‑
xl mcl流式细胞仪(购自beckmancoulter,inc.)、facscan流式细胞仪(购自beckman coulter)、moflo流式细胞仪(购自cytomation,inc.,fort collins,colorado)、luminex 100xmap(购自luminex corp.,austin,texas)、luminex技术(购自luminex corp.)和bd流式细胞仪(例如,bd accuri
tm
、bdfacscalibur
tm
、bd facscanto
tm
、bd lsrfortessa
tm
、bdlsrfortessa
tm
x
‑
20等)。质谱流式细胞术是两个实验平台的融合:流式细胞术和元素质谱仪(matthew h.spitzer,第165卷,第4期,p780
‑
791,2016年5月5日)。可用的质谱流式细胞术仪器包括但不限于cytof(cytometry by time
‑
of
‑
flight)。在某些实施方式中,本文描述的方法利用质谱流式细胞术和流式细胞术的组合来分析分析物。
133.如本文所用,要通过本方法针对可能的目标分析物进行分析的样品可以为包含多肽、蛋白质、脂质和/或糖类的任何样品。在一个实施方式中,样品为生物样品。此类生物样品包括但不限于包含一种以上细胞的样品和来自任何生物体(包括但不限于任何动物、细菌、植物或病毒)的样品。生物样品还包括离体和体内样品。例如,生物样品可以包括血液、滑液、脑脊液、精液和组织样品。组织样品包括例如来自器官、肿瘤、淋巴结和血管组织(例如动脉)的样品。
134.在一些实施方式中,生物样品可以为生物流体(组织液体或体液)样品。生物流体样品可以包括但不限于血液、血浆、血清、尿液、痰液、脊髓液、脑脊液、胸膜液、乳头抽吸物、淋巴液、呼吸道液体、肠道液体、泌尿生殖道液体、泪液、唾液、母乳、淋巴系统液、精液、脑脊液、器官内系统液、腹水、肿瘤囊液、羊水及它们的组合。生物流体样品可以进行化学处理,例如生物素化。
135.许多生物流体含有循环生物大分子。这些生物流体的实例包括血液、血浆、血清、尿液、痰液、脊髓液、脑脊液、胸膜液、乳头抽吸物、淋巴液、呼吸道、肠道液体和泌尿生殖道液体、泪液、唾液、母乳、来自淋巴系统的液体、精液、脑脊液、器官系统内液、腹水、肿瘤囊液、羊水、组织和细胞裂解液或它们的组合。在一些实施方式中,生物流体样品获自基于组织或液体活检和/或手术或临床理由已被诊断患有癌症的受试者。
136.根据所公开的方法,捕获微粒可以包含捕获剂,所述捕获剂具有活性且能够与目标分析物特异性结合。可掺入微粒的试剂包括但不限于适体、抗体、结合蛋白、过敏原、药物、与靶核酸和/或标准核酸互补的寡核苷酸。与靶核酸和/或标准核酸互补的寡核苷酸或其部分包括与来自天然存在的核酸(即生物体中发现的核酸,例如基因组dna、互补dna(cdna)、染色体dna、质粒dna、mrna、trna和/或rrna)的序列互补的核酸。在一些实施方式中,与微粒偶联的寡核苷酸是修饰的寡核苷酸。“修饰的”寡核苷酸是包含修饰的核苷酸的寡核苷酸。如本文所用,修饰的核苷酸是结构上发生改变以使其不同于天然存在的核苷酸。此种修饰的核苷酸包括含有修饰的糖部分、修饰的磷酸部分和/或修饰的核碱基的核苷酸。修饰的核苷酸还包括缀合的核苷酸(例如缀合至部分的核苷酸)。此类修饰核苷酸的实例包括但不限于双脱氧核苷酸、生物素化的核苷酸、胺修饰的核苷酸、烷基化的核苷酸、荧光团标记的核苷酸、放射性标记的核苷酸、硫代磷酸酯、亚磷酰胺、亚磷酸酯、环原子修饰衍生物等。寡核苷酸可以进一步包括具有修饰骨架的寡核苷酸聚合物,例如用于产生修饰的核苷酸和/或具有修饰骨架的寡核苷酸聚合物的蛋白质
‑
核酸(pna)或pna杂合体,例如本领域技术人员公知的pna、pna杂合体。
137.在一些实施方式中,捕获剂选自:蛋白质、肽、细菌、病毒、细菌组分、病毒组分、毒素、激素、细胞因子、药物化合物、血液因子、免疫球蛋白、免疫球蛋白fab、多核苷酸、药物载体或赋形剂。
138.在一些实施方式中,对照微粒还可以包含捕获剂,但是此种捕获剂被阻断或以其他方式失活,使得对照颗粒将不能与目标分析物特异性结合。
139.捕获剂可通过化学键直接偶联到捕获微粒的基底上,或通过接头间接偶联,例如通过捕获剂和固定在基底上的表面官能团之间的特异性结合。在后一种情况下,例如,捕获剂(例如捕获抗体)可通过与首先化学固定到微粒基底的抗体特异性结合而掺入用于捕获分析物的微粒中。
140.在本方法中,微粒成对使用,每对微粒包括捕获微粒和相应(或相关联)的对照微粒,它们没有以任何方式物理偶联或连接。在实践中,当一起使用基本相同数量的捕获微粒和相应的对照微粒时,认为每个微粒具有成对的“对应物”。优选地,捕获微粒与相应微粒的数量之间的差异应小于5%或更优选小于1%。
141.对于样品中的每种分析物,可使用多对(例如,数千或数百万以上)相同的微粒对,其中,在每对微粒中,捕获微粒和对照微粒在它们的一般物理性质方面是不可区分的,例如基底材料、微粒大小和微粒表面结合位点。捕获微粒和对照微粒可以具有背景结合位点,其可以结合测试样品中的物质,最终给出检测信号。然而,捕获微粒的基底和对照微粒的基底可以用不同颜色或荧光染料标记,并且表面官能团会不同。在测试样品中有两种以上待检测分析物时,可使用许多不同系列(“物种”)的微粒对,每个系列用于不同的分析物。不同系列的微粒可以具有相同或不同的物理特性,但它们在细胞计数中应根据其内参信号进行区分,以便对不同分析物的检测信号进行适当的区分和分离。
142.如本文所用,检测剂可与分析物特异性结合或以其他方式偶联,可在荧光流式细胞术或质谱流式细胞术中发出检测信号。检测剂可包括结合部分和信号部分。信号部分可包括荧光标记、化学发光标记、金属或原子质谱标记或它们的组合。结合部分可包含抗原或其可特异性结合分析物的表位,所述分析物可以为抗体。在一些实施方式中,结合部分选自:免疫球蛋白分子(抗体)、抗体的抗原结合部分、抗体的fab区、抗体的fc部分、受体蛋白、分析物配体或适体。
143.可在将微粒与含有目标分析物的测试样品和/或含有已知量的分析物的标准溶液一起孵育之前、期间或之后,将检测剂引入到测试样品和微粒的混合物中。
144.在一些实施方式中,检测剂包含荧光染料。在此类的实施方式中,检测与每个微粒结合的检测剂产生的检测信号包括检测由微粒发出的荧光信号。在一些实施方式中,每个微粒的基底包含荧光染料。在此类的实施方式中,检测由每个微粒中的基底发出的内参信号包括检测由微粒发出的荧光信号。
145.在一些实施方式中,检测剂包含重金属离子标签。在此类的实施方式中,检测与每个微粒结合的检测剂产生的检测信号包括在质谱仪中检测代表包含在检测剂中的重金属离子标签的信号。在一些实施方式中,针对n种目标分析物中的每个被分析物的微粒的基底包含重金属离子标签,其中,捕获微粒与其相应对照微粒中的重金属离子标签不同,且各自不同于检测剂的重金属离子标签。在此类的实施方式中,检测由每个微粒中的基底发出的内参信号包括检测代表包含在质谱仪中的基底中的重金属离子标签的信号。
146.在一些实施方式中,检测剂包含化学发光染料。在此类的实施方式中,检测与每个微粒结合的检测剂产生的检测信号包括检测代表包含在检测剂中的化学发光信号的信号。
147.在一些实施方式中,检测剂包括放射性物质。在此类的实施方式中,检测与每个微粒结合的检测剂产生的检测信号包括检测代表包含在检测剂中的放射性信号的信号。
148.在一些实施方式中,待测试的样品为从个体获得的生物样品,分析物包括具有已知同种型并且对已知抗原具有特异性的人抗体。用于分析物的每对捕获微粒和对照微粒的捕获剂包含能够特异性结合已知人抗体同种型的fc部分或与已知人抗体同种型的fc部分的受体偶联的捕获抗体。用于分析物的对照微粒包含饱和量的阻断抗体,其结合对照微粒中可用的捕获抗体的量,其中,阻断抗体具有相同的已知同种型,但对已知抗原是非特异性的或对获得生物样品的个体的未经处理的抗原是特异性的。如此,捕获微粒保留了捕获具有已知同种型并且对已知抗原具有特异性的目标分析物的能力。第一分析物的检测剂包含已知抗原。
149.在一些实施方式中,已知抗原选自药物或靶抗体的天然过敏原的组分。如本文所用,过敏原是在人体内引起过敏反应的物质。过敏原的实例包括但不限于花粉、草、灰尘、药物、药物赋形剂和花生。在一些实施方式中,捕获抗体是单克隆或多克隆的抗fc抗体,例如与igm、igg(包括igg1、igg2、igg3)、iga(包括iga1、iga2)或ige特异性结合的抗体。在一些实施方式中,fc部分的受体可选自:fc
‑
μ受体(fcμr)、fc
‑
γ受体(fcγr)、fc
‑
α受体(fcαr)、fc
‑
α/μ受体(fcα/μr)、fc
‑
ε受体(fcεr)或fcrn。
150.在一些实施方式中,捕获抗体可以为多克隆抗体。在其他实施方式中,捕获抗体可以为单克隆抗体。
151.如本文所用,目标分析物是可能存在于待测样品中的分析物。目标分析物可能实际存在于或可能不存在于样品中。为了提供相关性的基础,所公开的方法可以首先应用于一系列标准溶液,这些标准溶液含有不同但已知浓度的被怀疑存在于测试样品中的分析物。该方法的所有微粒、其他试剂、条件和步骤均相同,只是使用分析物的标准溶液代替测试样品。此程序在每个已知分析物浓度下产生捕获微粒和对照微粒之间检测信号差异的参考值,可以建立源自此种信号差异的校准加权值与测试样品中可能存在的分析物的量之间的关系(例如,通过插值、拟合或其他数学或数值技术)。以此方式,获得标准曲线(或校准曲线),其可用于确定测试(未知)样品中分析物的量/丰度。
152.可通过稀释或连续稀释已知浓度的含有已知量分析物的标准储备溶液来制备多种已知浓度的分析物标准溶液。可根据要分析的生物样品或电解质缓冲液(例如,磷酸盐缓冲盐水,pbs)的类型来制备储备溶液。例如,如果测试样品为尿样,则可以将pbs样品用作标准储备溶液,其中,掺入特定量的目标分析物。如果测试样品为来自血液样品的血浆或血清,pbs或混合的人血清可以用作标准储备溶液,其中,掺入了特定量的目标分析物。在使用正常混合血清作为储备标准溶液的情况下,应验证储备标准溶液中没有预先存在的目标分析物,尽管它会在数据分析中和背景结合一并被消除。
153.当待测样品中存在两种或两种以上目标分析物时,可使用含有与每种目标分析物相应的已知浓度分析物的标准溶液,构建每种分析物的校准曲线,来定量测试样品中的相应分析物。
154.如本文所用,来自所获得的捕获微粒和对照微粒的检测信号的加权值可以为相应
类型微粒的相应检测信号(原始信号)的中值或平均值。流式细胞术的原始数据可以直观地显示为直方图,显示单个检测信号数量的分布。在正态分布中,均值和中位数是相同的。
155.在一些实施方式中,所公开的方法可用于确定分析物的存在或不存在(无需量化分析物),而无需参考此类分析物的标准曲线。相反,此确定可以基于捕获微粒和相应的对照微粒之间的信号差异的统计分析。例如,要使用t检验进行统计分析,首先设置假设:
156.零假设:平均而言,捕获微粒的检测信号不会比相应的对照微粒的检测信号具有更多的加权信号;或者,替代假设:平均而言,捕获微粒的检测信号将比相应的对照微粒的检测信号具有更多的加权信号。然后计算两个微粒群的检测信号的平均值和标准差μ
捕获
和μ
对照
(对于零假设,μ
捕获
=μ
对照
)、标准误差使用下式计算t值:用(n1+n2
‑
2)自由度的t分布的临界值评估t检验统计量(n1为捕获微粒的重复数量,n2为对照微粒的重复数量)。使用t表查找p值。如果p<0.05、更优选p<0.01、更优选p<0.001、甚至更优选p<0.0001或更小,拒绝原假设并接受备择假设,即与相应的对照微粒的检测信号相比,捕获微粒的检测信号具有更大的加权信号,相应分析物为阳性(确定存在)。否则,如果p>0.05,则接受原假设,即捕获微粒和对照微粒之间的检测信号没有显著差异,样品中相应的分析物为阴性(确定为不存在)。计算和假设检验可通过基于原始数据的统计软件(例如,spss、sas、jmp)进行,或者更实际地,使用流式细胞术分析软件(例如flowjo)。此种统计分析的选择和应用在本领域技术人员的技能范围内。
157.在一些实施方式中,当样品中有两种以上待检测的目标分析物时,一种分析物的检测剂不同于另一种分析物的检测剂。在其他实施方式中,针对n种目标分析物中的每种分析物的检测剂是相同的。
158.在一些实施方式中,当样品中有两种以上待检测的目标分析物时,针对n种目标分析物中的一种分析物的捕获微粒中包含的基底发出与针对n种目标分析物中的另一种分析物的捕获微粒中包含的基底不同的内参信号。在一些实施方式中,针对n种目标分析物中的一种分析物的包含在对照微粒中的基底发出与针对n种目标分析物中的另一种分析物的包含在对照微粒中的基底不同的内参信号。例如,为了检测样品中的三种目标分析物,可使用三对和六种不同类型的微粒,例如,(i,i
‑
ctrl)、(ii,ii
‑
ctrl)、(iii,iii
‑
ctrl),其中六种不同类型微粒中的每一种的基底均会发出不同于任何其他类型微粒的内参信号。
159.在所述方法中,应理解,当捕获微粒和对照微粒与测试样品混合时,在允许分析物和微粒之间结合的合适条件(例如,温度/持续时间、搅拌或其他混合条件)下进行混合。此外,在合适的条件下加入检测剂以允许分析物和检测剂之间结合。此种条件的选择在本领域技术人员的技能范围内。
160.通过使用对照微粒和去除非特异性结合信号的影响,可以去除非特异性结合信号;因此,本发明方法可以自校准,使得在检测目标分析物方面具有高特异性、高灵敏度和高准确度/精密度。此外,一旦制备了捕获微粒和相应的对照微粒,它们就可以以1:1的比例合并在一起用于所有下游操作。这可以最小化下游操作的操作错误和系统错误。而且,所公开的方法允许广泛范围的样品体积。在所有这些方面,它们均优于当前的免疫测定法(例
如,elisa、immunocap或微阵列)。
161.实施例
162.以下实施例用于说明要求保护的发明,但不对要求保护的发明构成限制。
163.实施例1:血清中抗peg抗体的检测
164.小鼠免疫血清:leading life technologies(llt),通过cro获得
165.捕获微珠:cba b4
‑
peg(由llt制备)
166.相关对照微珠:cba b8
‑
bsa(llt)
167.样品:peg免疫的小鼠血清样品(llt的cro)
168.分析物:小鼠血清中的抗peg ig
169.检测剂:pe标记的山羊抗小鼠ig、igg多克隆(bd biosciences)
170.收集聚乙二醇(peg)免疫的小鼠血清,使用一对捕获微粒和相应的对照微粒检测小鼠抗peg抗体效价。如图2e所示,通过将20kd peg与cba b4微珠(购自bd biosciences,sanjose,ca)缀合,制备捕获微粒;如图2e所示,通过将bsa与cba b8微珠(bd biosciences)结合,制备相应的对照微粒。b4和b8微珠大小相同,通过流式细胞术通过fsc和ssc无法区分,即它们在fsc
‑
ssc图中显示为相同区域(图4a),但可通过内部荧光进行区分(图4b)。捕获微粒和相应的对照微粒以1:1的比例进行混合,用阻断缓冲液(即,含有2%bsa的ph 7.4pbs(pbs
‑
bsa))在室温下孵育30分钟。免疫小鼠血清首先按1:80进行稀释,然后按2倍进行连续稀释。然后将混合的捕获微粒和对照微粒加入稀释的血清中,在室温下孵育2小时。然后,通过离心用pbs
‑
bsa洗涤微珠两次。测试样品中加入pe标记的山羊抗小鼠ig(bd biosciences)1:50稀释液,室温振荡孵育1小时,通过离心用pbs
‑
bsa洗涤两次。用荧光流式细胞仪检测试样的荧光强度。
171.如图4f和4g所示,捕获微粒和对照微粒均显示出依赖于滴定的荧光强度趋势。对照微粒趋势表明,背景结合在不同浓度下是不同的。捕获微粒信号包括特异性抗peg ig结合以及背景结合信号,特异性结合信号通过从捕获微粒的信号中减去背景信号(从对照微粒获得的信号)来计算,如图4h所示。此种自校准方法可以消除背景噪声(又名噪声消除),从而大大提高检测的特异性和灵敏度。
172.对照微粒趋势表明背景结合在不同滴定下是不同的,分界点范围指示(图4g,约100至1700强度单位)。假设没有制备和添加到测定中的对照微粒,可通过仅与“阴性样品”或仅与缓冲液一起孵育的捕获微粒来设置分界点,在此种情况下,它可以设置在如图4g所示的分界点范围内的任一点(假设具有背景的“阴性样本”处于仅缓冲液和测试样本之间的任何水平)。这可能会导致人为的高或低分界点设置和错误结果。捕获微珠信号包括特异性抗peg ig结合信号和背景结合信号,通过从每个独立滴定点捕获微珠的信号减去背景信号来计算特异性结合信号,如图4h所示,反映了真实的分界点设置和真实的分析物结合信号。这说明本发明的自校准方法可以正确地消除背景噪声(又名噪声消除),从而大大提高了特异性、灵敏度和精确度。
173.实施例2:人抗peg igg、igm和ige同种型的检测(嵌合抗人igg、igm和ige检测)
174.微粒(cba微珠和偶联缓冲液购自bd biosciences):捕获微粒1,e4
‑
ige,与抗人ige偶联的cba微珠e4;相关对照微粒1,b4
‑
ige,与抗人ige缀合的cba微珠b4。捕获微珠1和相关对照微珠1与ige的结合使用相同的程序(包括抗ige剂量)进行处理。两种微粒的fsc和
ssc无法区分(图9a)。
175.捕获微粒2,e6
‑
igm,与抗人igm偶联的cba微珠e6;相关对照微粒2,b6
‑
igm,与抗人igm缀合的cba微珠b6。捕获微珠2和相关对照微珠2与igm的结合使用相同的程序(包括抗igm剂量)进行处理,两个微珠的fsc和ssc无法区分(图9a)。
176.捕获微粒3,e8
‑
igg,与抗人igg偶联的cba微珠e8;相关对照微粒3,b8
‑
igg,与抗人igg缀合的cba微珠b8。捕获微珠3和相关对照微珠3与igg的结合使用相同的程序(包括抗igg剂量)进行处理,两个微珠的fsc和ssc无法区分(图9a)。
177.抗小鼠ig二抗的使用显示了小鼠抗人ig在捕获微珠和对照微珠上的结合,每对具有相同的荧光强度。
178.样品:通过leading life technologies(llt)(ca,usa)获得和/制备具有人ig fc(即igm、igg、ige)的嵌合小鼠抗peg抗体的不同稀释度。
179.分析物:抗peg igg、抗peg
‑
igm、抗peg ige(llt)
180.检测剂:pe标记的peg(llt)
181.非特异性人igm、igg和ige购自sigma。
182.在室温(rt)下用非特异性ige(20pg)孵育相关对照微珠1(100ul pbs
‑
bsa中的105个微珠)1小时;在室温下用非特异性igm(20pg)孵育相关对照微珠2(100ul pbs
‑
bsa中的105个微珠)1小时;在室温下用非特异性igg(20pg)孵育相关对照微珠3(100ul pbs
‑
bsa中的105个微珠)1小时。
183.洗涤,与捕获微粒混合,单独加入或一起混合,加入不同稀释度的样品,低温孵育过夜,用pbs
‑
bsa洗涤两次。每次检测加入pe标记的peg 5ul,室温孵育2小时,洗涤,用bd流式细胞仪进行检测。
184.结果:背景(基质)结合通过各对对照微粒的检测荧光信号来显示(图9c,分别为ige、igm和igg的蓝色直方图)。捕获微粒(图9c,分别为ige、igm、igg的红色直方图)显示了包含背景和分析物结合信号的结合信号。捕获微粒和相关对照微粒之间的荧光差异显示了真正的特异性结合并与测试样品中分析物的量相关(图9c信号差异)。
185.实施例3:通过质谱流式细胞术检测血清中的抗peg抗体
186.嵌合人抗peg igg(leading life technologies,购自institute of biomedical sciences academia sinica,taiwen)
187.捕获微粒:174yb标记的抗peg微粒,名为“cba b4
‑
抗
‑
peg
‑
174yb”,由偶联有抗
‑
小鼠i
‑
a/i
‑
e(m5/114.15.2)
‑
174yb(fluidigm,ca)和小鼠抗peg单克隆抗体(由life diagnostics,inc.,westchester,pa制备)的cba b4微珠制成。
188.相应对照微粒:209bi标记的抗peg微粒,名为“cba b8
‑
抗
‑
peg
‑
209bi”,由偶联有抗
‑
小鼠i
‑
a/i
‑
e(m5/114.15.2)
‑
209bi(fluidigm,ca)和小鼠抗peg单克隆抗体(life diagnostics,inc.,westchester,pa)的cba b8微珠制成。
189.经验证,颗粒大小、表面偶联的抗小鼠i
‑
a/i
‑
e和抗peg抗体的量与捕获微粒和相关对照微粒相同。
190.样品:分别在两种不同背景的人血清中稀释1pg和0.5pg的嵌合人抗peg igg。
191.分析物:人抗peg igg。
192.检测剂:抗人igg
‑
145nd(fluidigm,ca)
193.用在200ul pbs(含有2%bsa和2mm edta)(缓冲液)中的1.5pl peg(pegloticase,80mg/ml)孵育1
×
105捕获微粒1小时,用缓冲液孵育1
×
105对应对照微粒1小时。分别用pbs缓冲液洗涤和离心(900g
×
3分钟)5次后,将捕获微粒和相关对照微粒混合,加到测试样品中。在4℃振荡孵育两小时后,用缓冲液洗涤样品
‑
微粒混合物两次。在200ml缓冲液中加入1个测试/20pl检测剂,在室温下振荡孵育1小时。洗涤后,通过质谱流式细胞仪cytof(fluidigm)分析样品。cytof数据由flowjo软件进行分析。基于标记金属分离捕获微粒和相应对照微粒,然后分析捕获微粒和相应的对照微粒上的检测信号。
194.如图10a和10c所示,可根据标记金属174yb和209bl的质谱信号分离来自捕获微粒和对照微粒的信号。质谱145nd的检测信号与抗人igg相关,包括分析物(即抗人peg igg)和非特异性人igg结合。如图10b和10d所示,添加了分析物的两种不同的人血清样品表现出不同的背景结合信号,如对照微粒(蓝色直方图)所示。捕获微粒和相关对照微粒之间的检测信号差异显示了真正的特异性结合,其与测试样品中分析物的量相关。
195.如本文所用,术语“约”,特别是关于给定量,意在包括正负百分之五的偏差。
196.在本技术(包括所附权利要求)中,除非另有明确说明,单数形式“一个”、“一种”和“该”包括复数参考,并且可与“至少一个”和“一个以上”互换使用。
197.如本文所用,术语“包含”、“含有”、“包括”、“涵盖”、“具有”及其任何变体旨在涵盖非排他性的内含物,使得包括、包含或含有元素或元素列表的方法、过程产品(product
‑
by
‑
process)或物质组合物不仅包括这些元素,还可以包括未明确列出或固有存在于此类过程、方法、过程产品或物质组合物中的其他元素。
198.本文中标明引用的所有出版物、专利、专利申请和公开的专利申请的公开内容通过引用整体并入本文。
199.尽管为了清楚理解的目的已通过描述和实施例的方式描述了各种实施方式,但是对于本领域技术人员显而易见的是,可以在不脱离本发明的范围和精神的情况下做出改变和修改。此处的描述和实施例不应被解释为限制本发明的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1