亲和剂的制作方法
亲和剂
1.相关申请的交叉引用
2.本技术要求2019年5月24日提交的美国临时申请号62/852,717和2019年12月18日提交的美国临时申请号62/949,878的权益,其各自的内容在此以其全文形式通过引用并入本文。
背景技术:
3.生物生产的治疗剂的纯度受到当局的严格审查和监管,以确保安全性和有效性。因此,仍然需要将生物生产的治疗剂有效纯化至高纯度的手段。
技术实现要素:
4.为了支持治疗性蛋白质的临床努力,需要从重组来源有效纯化蛋白质的组合物和方法。亲和纯化是用几个步骤或一个步骤分离和/或实现所需蛋白质纯度的手段。然而,亲和剂(例如,包括亲和配体)的开发可能是资源密集型和耗时的任务,因此亲和剂只存在于极少数的蛋白质。在没有亲和剂的情况下,纯化通常涉及低效过程,例如多柱过程。
5.重组腺相关病毒(raav)是研究最多的用于人类基因治疗的病毒载体之一。aav血清型表现出不同的细胞趋向性和与细胞受体的相互作用,以允许进入细胞并将遗传物质递送到细胞核中进行表达。aav9是生物制药开发人员特别感兴趣的,因为据报道它具有穿越血脑屏障的能力,这对于潜在地解决一系列中枢神经系统(cns)疾病特别重要。除了应用于cns疾病外,由于其对肝脏、骨骼肌和肺组织的广泛趋向性,aav9还被用于解决非cns疾病。
6.raav的制造困难且昂贵。细胞培养生产率低,通常每升只能达到10
13
–
10
15
个病毒衣壳,相当于大约0.1
–
10mg/l。纯化主要通过使用亲和层析来完成。目前,只有3种亲和树脂可用于纯化aav:poros
tm captureselect
tm aav9、poros
tm captureselect
tm aavx和avb sepharose。这些树脂有两个主要缺点,它们不能用氢氧化钠清洗,并且只能重复使用几次。这增加了树脂消耗并因此导致用于纯化的树脂成本高。
7.本文描述了结合aav并且可用于分离和/或亲和纯化的亲和剂。
8.在一些实施方案中,本文提供了包含配体的亲和剂,所述配体包括seq id no:1-5的结合基序,或与seq id no:1-5相差不超过三个、不超过两个或不超过一个取代、添加或缺失的氨基酸序列。
9.在一些实施方案中,本文提供了包含配体的亲和剂,其中配体包括具有根据seq id no:5-20的氨基酸序列或与seq id no:5-20相差不超过三个、不超过两个或不超过一个取代、添加或缺失的氨基酸序列的多肽。
10.在一些实施方案中,本文提供了包含配体的亲和剂,其中配体包括具有根据seq id no:21-47的氨基酸序列或与seq id no:21-47相差不超过三个、不超过两个或不超过一个取代、添加或缺失的氨基酸序列的多肽。
11.在一些实施方案中,配体的n-末端被乙酰化。在一些实施方案中,配体进一步包括c-末端赖氨酸。在一些实施方案中,配体的c-末端赖氨酸被酰胺化。在一些实施方案中,配
体进一步包括至少一种聚乙二醇(peg)。在一些实施方案中,至少一种聚乙二醇是peg(3)。
12.在一些实施方案中,配体连接到固体表面。在一些实施方案中,固体表面是树脂或珠粒。在一些实施方案中,固体表面是膜。在一些实施方案中,固体表面是整料。在一些实施方案中,配体通过接头与固体表面缀合。在一些实施方案中,接头包括peg和/或赖氨酸。
13.在一些实施方案中,本公开提供的亲和剂和/或配体是或包括环状肽。在一些实施方案中,提供的亲和剂和/或配体包括环状部分。在一些实施方案中,本文提供了包含配体的亲和剂,所述配体在环状肽或肽的环状部分内包括seq id no:1的结合基序,或与seq id no:1相差不超过三个、不超过两个或不超过一个取代、添加或缺失的氨基酸序列。
14.在一些实施方案中,本文提供了用于纯化病毒颗粒的亲和剂。在一些实施方案中,本公开提供的亲和剂和/或配体是或包括环状肽。在一些实施方案中,提供的亲和剂和/或配体包括环状部分。在一些实施方案中,本文提供了包含配体的亲和剂,所述配体在环状肽或肽的环状部分内包括seq id no:1-5的结合基序,或与seq id no:1-5相差不超过三个、不超过两个或不超过一个取代、添加或缺失的氨基酸序列。
15.在一些实施方案中,本文提供了用于纯化病毒颗粒的亲和剂。
16.在一些实施方案中,本文提供了用于纯化腺相关病毒颗粒的亲和剂。
17.在一些实施方案中,本文提供了制备亲和剂的方法,包括:将根据本文所述的任何实施方案的配体缀合到固体表面。
18.定义
19.为了更容易理解本公开,以下定义了某些术语。除非本文另有定义,否则技术和科学术语与本领域普通技术人员通常理解的含义相同。
20.大约或约:如本文所使用的,术语“大约”或“约”应用于一个或多个目标值时,是指与规定的参考值相似的值。在某些实施方案中,术语“大约”或“约”是指在落入规定的参考值任一方向(大于或小于)25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少的范围内的值,除非另有说明或从上下文中明显看出(排除该数值将超过可能值的100%的情况)。
21.生物活性:如本文所使用的,术语“生物活性”是指在生物系统中,特别是在生物体中具有活性的任何试剂的特征。例如,当施用于生物体时,对该生物体具有生物学效应的试剂被认为具有生物活性。
22.保守和非保守取代:“保守”氨基酸取代是其中一个氨基酸残基被具有相似侧链的另一个氨基酸残基替换的取代。本领域已经定义了具有相似侧链的氨基酸残基家族,包括碱性侧链(例如,赖氨酸(k)、精氨酸(r)、组氨酸(h));酸性侧链(例如,天冬氨酸(d)、谷氨酸(e));不带电荷的极性侧链(例如,甘氨酸(g)、天冬酰胺(n)、谷氨酰胺(q)、丝氨酸(s)、苏氨酸(t)、酪氨酸(y)、半胱氨酸(c));非极性侧链(例如,丙氨酸(a)、缬氨酸(v)、亮氨酸(l)、异亮氨酸(i)、脯氨酸(p)、苯丙氨酸(f)、甲硫氨酸(m)、色氨酸(w));β-分支侧链(例如,苏氨酸(t)、缬氨酸(v)、异亮氨酸(i));和芳香族侧链(例如,酪氨酸(y)、苯丙氨酸(f)、色氨酸(w)、组氨酸(h))。例如,苯丙氨酸取代酪氨酸是保守取代。在一些实施方案中,配体序列中的保守氨基酸取代赋予或改善配体与感兴趣的靶标的特异性结合。在一些实施方案中,配体序列中的保守氨基酸取代不减少或消除配体与目标靶标的结合。在一些实施方案中,保守氨基酸取代不显著影响配体与目标靶标的特异性结合。鉴定赋予、改变或维持选择性结合亲
和力的核苷酸和氨基酸保守取代和非保守取代的方法是本领域已知的(参见例如brummell,biochem.32:1180-1187(1993);kobayashi,protein eng.12(10):879-884(1999);和burks,pnas 94:412-417(1997))。在一些实施方案中,配体序列中的非保守氨基酸取代赋予或改善配体与目标靶标的特异性结合。在一些实施方案中,配体序列中的非保守氨基酸取代不减少或消除配体与目标靶标的结合。在一些实施方案中,非保守氨基酸取代不显著影响配体与目标靶标的特异性结合。
23.接头:如本文所使用的,“接头”是指起到连接另外独立功能域的作用的肽或其他化学连接。在一些实施方案中,接头位于配体和含有另外独立功能域的另一多肽成分之间。在一些实施方案中,接头是位于配体和表面之间的肽或其他化学连接。
24.天然存在的:当与生物材料例如核酸分子、多肽和宿主细胞结合使用时,术语“天然存在的”是指那些在自然界中发现且未被人类改造的生物材料。相反,当与生物材料结合使用时,“非天然的”或“合成的”是指那些在自然界中未发现和/或已被人类改造过的生物材料。
[0025]“非天然氨基酸”、“氨基酸类似物”和“非标准氨基酸残基”在本文中可互换使用。可以在如本文提供的配体中取代的非天然氨基酸是本领域已知的。在一些实施方案中,非天然氨基酸是4-羟脯氨酸,其可以取代脯氨酸;5-羟赖氨酸,其可以取代赖氨酸;3-甲基组氨酸,其可以取代组氨酸;高丝氨酸,其可以取代丝氨酸;和鸟氨酸,其可以取代赖氨酸。可以在多肽配体中取代的非天然氨基酸的其他示例包括但不限于分子,例如:常见氨基酸的d-异构体、2,4-二氨基丁酸、α-氨基异丁酸、a-氨基丁酸、abu、2-氨基丁酸、γ-abu、ε-ahx、6-氨基己酸、aib、2-氨基异丁酸、3-氨基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺基丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸、环己基丙氨酸、β-丙氨酸、羊毛硫氨酸、脱氢丙氨酸、γ-氨基丁酸、硒代半胱氨酸和吡咯赖氨酸-氟代-氨基酸,设计氨基酸,例如甲基-β-氨基酸、c-甲基-α-氨基酸和n-甲基-α-氨基酸。
[0026]“多核苷酸”和“核酸分子”:如本文可互换使用的,多核苷酸和核酸分子是指任何长度的核苷酸(核糖核苷酸或脱氧核糖核苷酸)的聚合形式。这些术语包括但不限于dna、rna、cdna(互补dna)、mrna(信使rna)、rrna(核糖体rna)、shrna(短发夹rna)、snrna(核内小rna)、snorna(核仁小rna)、mirna(微小rna)、基因组dna、合成dna、合成rna和/或trna。
[0027]
可操作地连接:如本文所使用的,术语“可操作地连接”表示连接两个分子以各自保留功能活性。两个分子是“可操作地连接”的,无论它们是直接连接还是间接连接。
[0028]
肽标签:如本文所使用的,术语“肽标签”是指作为另一种蛋白质的一部分或与另一种蛋白质连接(例如通过基因工程)以向所得融合物提供功能的肽序列。和与它们融合的蛋白质相比,肽标签通常相对较短。在一些实施方案中,肽标签的长度为四个或更多个氨基酸,例如5、6、7、8、9、10、15、20或25或更多个氨基酸。在一些实施方案中,配体是含有肽标签的蛋白质。具有如本文提供的用途的许多肽标签是本领域已知的。可以是配体融合蛋白的成分或由配体(例如,配体融合蛋白)结合的靶标的肽标签的示例包括但不限于ha(血凝素)、c-myc、单纯疱疹病毒糖蛋白d(gd)、t7、gst、gfp、mbp、strep标签、his标签、myc标签、tap标签和flag标签(eastman kodak,rochester,n.y.)。同样,标签表位的抗体允许在例如亲和纯化、蛋白质印迹、elisa测定和细胞免疫染色中检测和定位融合蛋白。
[0029]
多肽:如本文所使用的,术语“多肽”是指通过肽键连接在一起的连续氨基酸链。该
术语用于指任何长度的氨基酸链,但本领域普通技术人员将理解该术语不限于长链,可以指包含通过肽键连接在一起的两个氨基酸的最小链。如本领域技术人员已知的,多肽可以是被加工的和/或修饰的。
[0030]
蛋白质:如本文所使用的,术语“蛋白质”是指一种或多种作为离散单元起作用的多肽。如果单个多肽是离散的功能单元并且不需要与其他多肽永久或暂时的物理结合以形成离散的功能单元,则术语“多肽”和“蛋白质”可以互换使用。如果离散的功能单元由一种以上彼此物理结合的多肽组成,则术语“蛋白质”是指物理偶联并一起作为离散单元起作用的多种多肽。
[0031]
特异性结合:如本文所使用的,关于配体,术语“特异性结合”或“对
……
具有选择性亲和力”是指与替代物质(包括无关的蛋白质)相比,配体更频繁、更迅速、以更长持续时间、以更高亲和力或以上的组合与特定的表位、蛋白质或靶标分子反应或结合。由于不同物种中同源蛋白质之间的序列同一性,特异性结合可以包括识别一个以上物种中的蛋白质或靶标的结合剂。同样,由于不同蛋白质的多肽序列的某些区域内的同源性,特异性结合可以包括识别一种以上蛋白质或靶标的结合剂。应当理解,在某些实施方案中,特异性结合第一靶标的结合剂可以或可以不特异性结合第二靶标。因此,“特异性结合”不一定需要(尽管它可以包括)排他性结合,即与单个靶标结合。因此,在某些实施方案中,配体或亲和剂可以特异性结合一个以上的靶标。在某些实施方案中,多个靶标可以被亲和剂上的相同抗原结合位点结合。
[0032]
基本上:如本文所使用的,术语“基本上”是指表现出目标特征或特性的全部或接近全部范围或程度的定性条件。生物学领域的普通技术人员将理解,生物和化学现象很少(如果不是从不)达到完成和/或进行到完全或实现或避免绝对的结果。因此,术语“基本上”在本文中用于体现(capture)许多生物和化学现象中固有的潜在不完全性。
附图说明
[0033]
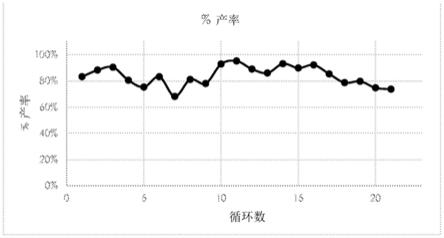
图1显示了柱循环研究的每个循环确定的产率,涉及aav纯化的连续循环,其中加入0.5m naoh清洁30分钟。
[0034]
图2显示了在整个柱循环研究中确定的残留hcp,涉及aav纯化的连续循环,其中加入0.5m naoh清洁30分钟。未测量第6个循环的残留hcp。
[0035]
图3显示了柱循环研究的每个循环确定的残留hcdna,涉及aav纯化的连续循环,其中加入0.5m naoh清洁30分钟。
[0036]
图4显示了使用不同洗脱条件确定的产率。洗脱缓冲液含有0.25m、0.5m或1m精氨酸,ph为4.5、5或5.5。
[0037]
图5显示了衣壳与seq id no:46(实线)和seq id no:47的配体结合的生物层干涉传感图。
具体实施方式
[0038]
从已鉴定和表征的肽配体制备的亲和剂显示为产生高度纯化的病毒颗粒制剂。本文所述的亲和树脂可用于去除蛋白质产物相关的杂质以及宿主细胞衍生的污染物。
[0039]
用于亲和剂的与目标靶标结合的配体
[0040]
可以使用本领域已知的用于评估这种活性的已知或改进的测定法、生物测定法和/或动物模型来确定配体与靶标结合的特征。
[0041]
如本文所使用的,诸如“对靶标的结合亲和力”、“与靶标的结合”等术语是指配体的特性,其可以例如通过亲和常数的测定(例如,在给定抗原浓度下结合和解离的配体的量)来直接测量。有几种方法可用于表征这种分子相互作用,例如,竞争分析、平衡分析和微量热分析以及基于表面等离子体共振相互作用的实时相互作用分析(例如使用biacore仪器)。这些方法是本领域技术人员熟知的,并且在诸如neri d et al.(1996)tibtech 14:465-470和jansson m et al.(1997)j biol chem 272:8189-8197的出版物中进行了讨论。
[0042]
给定配体结合事件的亲和力要求取决于多种因素,包括但不限于:结合基质的组分和复杂性、配体和靶标分子的化合价和密度、以及配体的功能应用。在一些实施方案中,配体以小于或等于5
×
10-3
m、10-3
m、5
×
10-4
m、10-4
m、5
×
10-5
m或10-5
m的解离常数(kd)结合目标靶标。在一些实施方案中,配体以小于或等于5
×
10-6
m、10-6
m、5
×
10-7
m、10-7
m、5
×
10-8
m或10-8
m的kd结合目标靶标。在一些实施方案中,配体以小于或等于5
×
10-9
m、10-9
m、5
×
10-10
m、10-10
m、5
×
10-11
m、10-11
m、5
×
10-12
m、10-12
m、5
×
10-13
m、10-13
m、5
×
10-14
m、10-14
m、5
×
10-15
m或10-15
m的kd结合目标靶标。在一些实施方案中,通过本文公开的方法产生的配体具有约10-4
m至约10-5
m、约10-5
m至约10-6
m、约10-6
m至约10-7
m、约10-7
m至约10-8
m、约10-8
m至约10-9
m、约10-9
m至约10-10
m、约10-10
m至约10-11
m或约10-11
m至约10-12
m的解离常数。
[0043]
可以在多种条件下进行确定kd和解离速率的结合实验,包括但不限于[ph6.0,0.01%吐温20],[ph 6.0,0.1%明胶],[ph 5.0,0.01%吐温20],[ph 9.0,0.1%吐温20],[ph 6.0,15%乙二醇,0.01%吐温20],[ph 5.0,15%乙二醇,0.01%吐温20],和[ph 9.0,15%乙二醇,0.01%吐温20]。本领域技术人员可以容易地确定制备这些溶液的缓冲液,并且缓冲液很大程度上取决于最终溶液的期望ph。例如,可以在柠檬酸盐缓冲液、甘氨酸-hcl缓冲液或琥珀酸缓冲液中制备低ph溶液(《ph 5.5)。例如,可以在tris-hcl、磷酸盐缓冲液或碳酸氢钠缓冲液中制备高ph溶液。为了确定例如最佳ph和/或盐浓度的目的,可以使用多种条件来确定kd和解离速率。
[0044]
在一些实施方案中,配体以0.1至10-7
sec-1
、10-2
至10-7
sec-1
或0.5
×
10-2
至10-7
sec-1
范围内的k
off
特异性结合目标靶标。在一些实施方案中,配体以小于5
×
10-2
sec-1
、10-2
sec-1
、5
×
10-3
sec-1
或10-3
sec-1
的解离速率(k
off
)结合目标靶标。在一些实施方案中,配体以小于5
×
10-4
sec-1
、10-4
sec-1
、5
×
10-5
sec-1
或10-5
sec-1
、5
×
10-6
sec-1
、10-6
sec-1
、5
×
10-7
sec-1
或10-7
sec-1
的解离速率(k
off
)结合目标靶标。
[0045]
在一些实施方案中,配体以约103至107m-1
sec-1
、103至106m-1
sec-1
或103至105m-1
sec-1
范围内的k
on
特异性结合目标靶标。在一些实施方案中,配体(例如,配体融合蛋白)以大于103m-1
sec-1
、5
×
103m-1
sec-1
、104m-1
sec-1
或5
×
104m-1
sec-1
的结合速率(k
on
)结合目标靶标。在另外的实施方案中,配体以大于105m-1
sec-1
、5
×
105m-1
sec-1
、106m-1
sec-1
、5
×
106m-1
sec-1
或107m-1
sec-1
的k
on
结合目标靶标。
[0046]
目标靶标
[0047]
被配体特异性结合的目标靶标可以是希望亲和剂的配体结合的任何分子。例如,被配体特异性结合的靶标可以是纯化、制造、配制、治疗、诊断或预后相关性或价值的任何靶标。本文通过举例提供了多个示例性靶标,并且旨在是说明性的而非限制性的。目标靶标
可以是天然存在的或合成的。在一些实施方案中,靶标是生物活性蛋白质。在一些实施方案中,目标靶标是细胞外成分或细胞内成分、可溶性因子(例如,酶、激素、细胞因子、生长因子、抗体等)或跨膜蛋白(例如,细胞表面受体)。在一些实施方案中,由配体特异性结合的目标靶标本身是具有不同序列的配体。
[0048]
接头
[0049]
术语“接头”和“间隔区”在本文中可互换使用,是指起到连接其他独立功能域的作用的肽或其他化学连接。在一些实施方案中,接头位于配体和含有另外独立的功能域的另一多肽成分之间。用于偶联两个或多个连接的配体的合适接头通常可以是本领域中用于连接肽、蛋白质或其他有机分子的任何接头。在一些实施方案中,这样的接头适合构建旨在用于药物用途的蛋白质或多肽。
[0050]
用于在单链氨基酸序列中可操作地连接配体和配体融合蛋白的另外成分的合适接头包括但不限于多肽接头,例如甘氨酸接头、丝氨酸接头、混合的甘氨酸/丝氨酸接头、富含甘氨酸和富含丝氨酸的接头或主要由极性多肽片段组成的接头。
[0051]
在一些实施方案中,接头包括选自甘氨酸、丙氨酸、脯氨酸、天冬酰胺、谷氨酰胺和赖氨酸的大多数氨基酸。在一些实施方案中,接头包括选自甘氨酸、丙氨酸、脯氨酸、天冬酰胺、天冬氨酸、苏氨酸、谷氨酰胺和赖氨酸的大多数氨基酸。在一些实施方案中,配体接头由不受空间阻碍的大多数氨基酸组成。在一些实施方案中,接头包括选自甘氨酸、丝氨酸和/或丙氨酸的大多数氨基酸。在一些实施方案中,肽接头选自聚甘氨酸(例如(gly)5和(gly)8)、聚(gly-ala)和聚丙氨酸。
[0052]
接头可以是任何大小或组分,只要它们能够以允许配体结合目标靶标的方式可操作地连接配体。在一些实施方案中,接头为约1至50个氨基酸、约1至20个氨基酸、约1至15个氨基酸、约1至10个氨基酸、约1至5个氨基酸、约2至20个氨基酸、约2至15个氨基酸、约2至10个氨基酸或约2至5个氨基酸。应该清楚的是,接头的长度、柔性程度和/或其他特性可能会影响用于亲和剂的配体的某些特性,例如对目标靶标、或者对一种或多种其他目标靶标蛋白质、或者对非目标蛋白质(即,非靶标蛋白质)的亲和性、特异性或亲合力。在一些实施方案中,使用两个或多个接头。在一些实施方案中,两个或多个接头是相同的。在一些实施方案中,两个或多个接头是不同的。
[0053]
在一些实施方案中,接头是非肽接头,例如烷基接头或peg接头。例如,可以使用烷基接头如-nh-(ch2)s-c(0)-,其中s=2-20。这些烷基接头可以进一步被任何非空间位阻基团取代,例如低级烷基,例如c1c6)低级酰基、卤素(例如cl、br)、cn、nh2、苯基等。示例性的非肽接头是peg接头。在一些实施方案中,peg接头具有约100至5000kda或约100至500kda的分子量。
[0054]
可以使用本文描述的和/或本领域已知的其他技术来评估接头。在一些实施方案中,接头不改变(例如,不破坏)配体结合靶标分子的能力。
[0055]
包含缀合配体的亲和剂
[0056]
促进与目标靶标特异性结合的配体可以与各种色谱组分(例如珠粒、树脂、凝胶、膜、整料等)进行化学缀合,以制备亲和剂。包含配体的亲和剂特别适用于纯化和制造应用。
[0057]
在一些实施方案中,配体(例如,配体融合蛋白)包含至少一个反应性残基。例如,反应性残基可用作连接缀合物(例如化疗药物)的位点。示例性的反应性氨基酸残基是赖氨
酸。反应性残基(例如,赖氨酸)可以添加到配体的任一端或在配体序列内,并且/或者可以取代配体序列中的另一个氨基酸。合适的反应性残基(例如,赖氨酸等)也可以位于经鉴定的配体的序列内而无需添加或取代。
[0058]
连接到固体表面
[0059]“固体表面”、“支持物”或“基质”在本文中可互换使用,是指但不限于任何柱(或柱材料)、珠粒、试管、微量滴定盘、固体颗粒(例如,琼脂糖)、微芯片(例如,硅、硅玻璃或金芯片)或膜(起源是合成的(例如过滤器)或生物的(例如,脂质体或囊泡)),配体、抗体或其他蛋白质可以直接或间接(例如,通过其他结合配偶体中间体,如其他抗体或蛋白质a)连接(即,偶联、连接或粘附)到其上,或者配体或抗体可以嵌入其中(例如,通过受体或通道)。用于将多肽连接到固体支持物(例如,基质、树脂、塑料等)的试剂和技术是本领域熟知的。合适的固体支持物包括但不限于色谱树脂或基质(例如,sepharose-4ff琼脂糖珠粒)、塑料微量滴定盘中孔的壁或底、基于二氧化硅的生物芯片、聚丙烯酰胺、琼脂糖、二氧化硅、硝化纤维、纸、塑料、尼龙、金属及其组合。可以使用本领域已知的试剂和技术通过非共价结合或通过共价键合将配体和其他组分连接到支持材料上。在一些实施方案中,使用接头将配体偶联至色谱材料。
[0060]
配体的产生
[0061]
可以使用本领域已知的各种化学合成、半合成方法和重组dna方法的标准技术来进行配体的产生,所述配体可用于实施所提供的方法。还提供了用于产生配体的方法,所述配体单独或作为多结构域融合蛋白的一部分作为可溶性试剂和细胞相关蛋白。在一些实施方案中,配体的总体产生方案包括获得参考蛋白质支架并鉴定支架内的多个残基以进行修饰。取决于实施方案,参考支架可以包括具有一个或多个α-螺旋区域的蛋白质结构或其他三级结构。一旦被鉴定,多个残基可以被修饰,例如通过取代一个或多个氨基酸。在一些实施方案中,进行了一个或多个保守取代。在一些实施方案中,进行了一个或多个非保守取代。在一些实施方案中,天然氨基酸(例如,丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸或缬氨酸)被取代到目标位置的参考支架中进行修饰。在一些实施方案中,修饰不包括取代半胱氨酸或脯氨酸。在特定实施方案中所需的经鉴定位置进行修饰后,所得的修饰的多肽(例如候选配体)可以例如在质粒、细菌、噬菌体或其他载体中重组表达(例如,以增加修饰的多肽中的每一个的数量)。然后可以纯化和筛选修饰的多肽以鉴定与特定的目标靶标具有特异性结合的那些修饰的多肽。与参考支架相比,修饰的多肽可以显示出对目标靶标的结合特异性增强,或者可以表现出对给定的目标靶标(或非靶标蛋白质)很少或没有结合。在一些实施方案中,取决于目标靶标,参考支架可以显示出与目标靶标的一些相互作用(例如,非特异性相互作用),而某些修饰的多肽将表现出对目标靶标的结合特异性增加至少约两倍、至少约5倍、至少约10倍、至少约20倍、至少约50倍或至少约100倍(或更多)。下面更详细地提供了关于配体的产生、选择和分离的额外细节。
[0062]
配体的重组表达
[0063]
在一些实施方案中,配体例如配体融合蛋白是“重组产生的”(即,使用重组dna技术产生)。可用于合成配体融合蛋白的示例性重组方法包括但不限于基于聚合酶链反应
(pcr)的合成、串联体化、无缝克隆和递归定向连接(rdl)(参见,例如meyer et al.,biomacromolecules 3:357-367(2002),kurihara et al.,biotechnol.lett.27:665-670(2005),haider et al.,mol.pharm.2:139-150(2005);and mcmillan et al.,macromolecules 32(11):3643-3646(1999)。
[0064]
还提供了包含编码配体的多核苷酸序列的核酸。这样的多核苷酸可选地进一步包括一种或多种表达控制元件。例如,多核苷酸可以包括一种或多种作为表达控制元件的启动子或转录增强子、核糖体结合位点、转录终止信号和聚腺苷酸化信号。多核苷酸可以插入任何合适的载体内,所述载体可以包含在任何合适的宿主细胞内用于表达。
[0065]
通常通过将编码配体的核酸与表达载体中的启动子可操作地连接来实现编码配体的核酸的表达。典型的表达载体包含转录和翻译终止子、起始序列和用于调控所需核酸序列表达的启动子。用于在大肠杆菌中表达的示例性启动子包括,例如,t7启动子。
[0066]
本领域已知的方法可用于构建含有编码配体的核酸序列以及合适的转录/翻译控制信号的表达载体。这些方法包括但不限于体外重组dna技术、合成技术和体内重组/基因重组。多核苷酸的表达可以在本领域已知的任何合适的表达宿主中进行,包括但不限于细菌细胞、酵母细胞、昆虫细胞、植物细胞或哺乳动物细胞。在一些实施方案中,编码配体的核酸序列与合适的启动子序列可操作地连接,使得核酸序列在宿主中被转录和/或翻译成配体。
[0067]
多种宿主表达载体系统可用于表达编码配体的核酸。含有编码配体(例如,单个配体亚基或配体融合体)或其部分或片段的核酸的载体包括质粒载体、单链和双链噬菌体载体、以及单链和双链rna或dna病毒载体。也可以使用已知的感染和转导技术以包装或封装的病毒形式将噬菌体和病毒载体引入宿主细胞。此外,病毒载体可以是有复制能力的,或者是有复制缺陷的。或者,无细胞翻译系统也可以用于使用源自dna表达构建体的rna产生蛋白质(参见,例如,wo86/05807和wo89/01036;和美国专利号5,122,464)。
[0068]
通常,任何类型的细胞或培养的细胞系可用于表达本文提供的配体。在一些实施方案中,用于产生工程化的宿主细胞的背景细胞系是噬菌体、细菌细胞、酵母细胞或哺乳动物细胞。多种宿主-表达载体系统可用于表达配体融合蛋白的编码序列。哺乳动物细胞可用作宿主细胞系统,用含有目的靶标的编码序列和融合多肽的编码序列的重组质粒dna或粘粒dna表达载体转染哺乳动物细胞。细胞可以是来自转化或转基因性质的生物体、培养物或细胞系的初级分离物。
[0069]
合适的宿主细胞包括但不限于微生物,例如用含有配体编码序列的重组噬菌体dna、质粒dna或粘粒dna表达载体转化的细菌(例如,大肠杆菌、枯草芽孢杆菌);用含有配体编码序列的重组酵母表达载体转化的酵母(例如,酵母属、毕赤酵母属);用含有配体编码序列的重组病毒表达载体(例如,杆状病毒)感染的昆虫细胞系统;用重组病毒表达载体(例如,花椰菜花叶病毒,camv;烟草花叶病毒,tmv)感染或用含有配体编码序列的重组质粒表达载体(例如,ti质粒)转化的植物细胞系统。
[0070]
在产生配体时用作宿主细胞的原核生物包括革兰氏阴性或革兰氏阳性生物,例如大肠杆菌和枯草芽孢杆菌。用于原核宿主细胞的表达载体通常包含一种或多种表型选择标记基因(例如,编码赋予抗生素抗性或提供自养需求的蛋白质的基因)。有用的原核宿主表达载体的示例包括pkk223-3(pharmacia,uppsala,sweden)、pgeml(promega,wis.,usa)、
pet(novagen,wis.,usa)和prset(invitrogen,calif.,usa)系列载体(参见,例如,studier,j.mol.biol.219:37(1991)和schoepfer,gene 124:83(1993))。经常用于原核宿主细胞表达载体的示例性启动子序列包括t7(rosenberg et al.,gene 56:125-135(1987))、β-内酰胺酶(青霉素酶)、乳糖启动子系统(chang et al.,nature 275:615(1978));和goeddel et al.,nature 281:544(1979))、色氨酸(trp)启动子系统(goeddel et al.,nucl.acids res.8:4057,(1980))和tac启动子(sambrook et al.,1990,molecular cloning,a laboratory manual,2d ed.,cold spring harbor laboratory,cold spring harbor,n.y.)。
[0071]
在一些实施方案中,使用真核宿主细胞系统,包括用含有配体编码序列的重组酵母表达载体转化的酵母细胞。可用于产生本发明的组分的示例性酵母包括来自酵母属、毕赤酵母属、放线菌属和克鲁维酵母菌属的酵母。酵母载体通常包含来自2mu酵母质粒的复制起点序列、自主复制序列(ars)、启动子区域、多聚腺苷酸化序列、转录终止序列和选择标记基因。酵母表达构建体中启动子序列的示例包括来自金属硫蛋白、3-磷酸甘油酸激酶(hitzeman,j.biol.chem.255:2073(1980))和其他糖酵解酶,例如烯醇酶、3-磷酸甘油醛脱氢酶、己糖激酶、丙酮酸脱羧酶、磷酸果糖激酶、葡萄糖-6-磷酸异构酶、3-磷酸甘油酸变位酶、丙酮酸激酶、磷酸丙糖异构酶、磷酸葡萄糖异构酶和葡萄糖激酶的启动子。用于酵母表达以及酵母转化方案的另外的合适载体和启动子是本领域已知的。参见,例如,fleer,gene 107:285-195(1991)和hinnen,pnas 75:1929(1978)。
[0072]
昆虫和植物宿主细胞培养系统也可以用于产生本发明的组分。这样的宿主细胞系统包括例如用含有配体编码序列的重组病毒表达载体(例如,杆状病毒)感染的昆虫细胞系统;用重组病毒表达载体(例如,花椰菜花叶病毒,camv;烟草花叶病毒,tmv)感染或用含有配体编码序列的重组质粒表达载体(例如,ti质粒)转化的植物细胞系统,包括但不限于美国专利号6,815,184;美国公开号60/365,769和60/368,047;和wo2004/057002、wo2004/024927和wo2003/078614中教导的表达系统。
[0073]
在一些实施方案中,可以使用宿主细胞系统,包括用重组病毒表达载体(例如,腺病毒、逆转录病毒、腺相关病毒、疱疹病毒、慢病毒)感染的动物细胞系统,包括被工程化为包含编码在双微染色体中稳定扩增(cho/dhfr)或不稳定扩增的配体的dna的多个拷贝的细胞系(例如,鼠细胞系)。在一些实施方案中,包含编码配体的多核苷酸的载体是多顺反子。用于产生这些组分的示例性哺乳动物细胞包括293细胞(例如293t和293f)、cho细胞、bhk细胞、ns0细胞、sp2/0细胞、yo骨髓瘤细胞、p3x63小鼠骨髓瘤细胞、per细胞、per.c6(crucell,netherlands)细胞very、hela细胞、cos细胞、mdck细胞、3t3细胞、w138细胞、bt483细胞、hs578t细胞、htb2细胞、bt20细胞、t47d细胞、crl7o30细胞、hss78bst细胞、杂交瘤细胞和其他哺乳动物细胞。可用于实施本发明的其他示例性哺乳动物宿主细胞包括但不限于t细胞。示例性的表达系统和选择方法是本领域已知的,包括在以下参考文献和其中引用的参考文献中描述的那些:borth et al.,biotechnol.bioen.71(4):266-73(2000),in werner et al.,arzneimittelforschung/drug res.48(8):870-80(1998),andersen et al.,curr.op.biotechnol.13:117-123(2002),chadd et al.,curr.op,biotechnol.12:188-194(2001),和giddings,curr.op.biotechnol.12:450-454(2001)。logan et al.,pnas 81:355-359(1984),birtner et al.methods enzymol.153:51-544(1987)中描述了表达系
统和选择方法的其他示例。哺乳动物宿主细胞表达载体的转录和翻译控制序列通常源于病毒基因组。哺乳动物表达载体中常用的启动子序列和增强子序列包括源自多瘤病毒、腺病毒2、猿猴病毒40(sv40)和人巨细胞病毒(cmv)的序列。用于哺乳动物宿主细胞的示例性的市售表达载体包括pcep4(invitrogen)和pcdna3(invitrogen)。
[0074]
将核酸引入宿主细胞(例如哺乳动物宿主细胞)的物理方法包括磷酸钙沉淀、脂质转染、粒子轰击、显微注射、电穿孔等。产生包含载体和/或外源核酸的细胞的方法是本领域熟知的。参见,例如,sambrook et al.(2001,molecular cloning:a laboratory manual,cold spring harbor laboratory,new york)。
[0075]
将目标多核苷酸引入宿主细胞的生物学方法包括使用dna和rna载体。病毒载体,尤其是逆转录病毒载体,已成为将基因插入哺乳动物(例如人类)细胞的最广泛使用的方法。其他病毒载体可以源自慢病毒、痘病毒、单纯疱疹病毒i、腺病毒和腺相关病毒等。参见,例如,美国专利号5,350,674和5,585,362。
[0076]
将目标dna和rna多核苷酸引入宿主细胞的方法包括细胞的电穿孔,其中向细胞施加电场以增加细胞膜的渗透性,从而允许将化学品、药物或多核苷酸引入细胞。可以使用电穿孔将含有dna或rna构建体的配体引入哺乳动物或原核细胞。
[0077]
在一些实施方案中,细胞的电穿孔导致配体-car在t细胞、nk细胞、nkt细胞表面上的表达。这种表达在细胞的整个生命周期中可能是瞬时的或稳定的。电穿孔可以用本领域已知的方法完成,包括maxcyte 和转染系统(maxcyte,gaithersburg,md,usa)。
[0078]
将多核苷酸引入宿主细胞的化学手段包括胶体分散系统,例如大分子复合物、纳米胶囊、微球、珠粒和基于脂质的系统,包括水包油乳液、胶束、混合胶束和脂质体。用作体外和体内递送载体的示例性胶体系统是脂质体(例如,人工膜囊泡)。在利用非病毒递送系统的情况下,示例性递送载体是脂质体。考虑使用脂质制剂将核酸引入宿主细胞(体外、离体或体内)。在一些实施方案中,核酸与脂质相关。与脂质相关的核酸可以被封装在脂质体的水性内部、散布在脂质体的脂质双层内、通过与脂质体和寡核苷酸相关的连接分子连接到脂质体、包埋在脂质体中、与脂质体复合、分散在含有脂质的溶液中、与脂质混合、与脂质结合、作为悬浮液包含在脂质中、包含或与胶束复合、或以其他方式与脂质结合。脂质、脂质/dna或脂质/表达载体相关组分不限于溶液中的任何特定结构。例如,它们可以以双层结构、胶束或“塌陷”结构存在。它们也可以简单地散布在溶液中,可能形成大小或形状不均匀的聚集体。脂质是脂肪物质,它们可以是天然存在的或合成的脂质。例如,脂质包括天然存在于细胞质中的脂肪滴以及包含长链脂肪烃及其衍生物的化合物类别,例如脂肪酸、醇、胺、氨基醇和醛。
[0079]
适合使用的脂质可以从商业来源获得。例如,二肉豆蔻酰磷脂酰胆碱(“dmpc”)可以从sigma,st.louis,mo获得;双十六烷基磷酸(“dcp”)可以从k&k实验室(plainview,ny)获得;胆固醇(“choi”)可以从calbiochem-behring获得;二肉豆蔻酰磷脂酰甘油(“dmpg”)和其他脂质可以从avanti polar lipids,inc.(birmingham,al)获得。脂质在氯仿或氯仿/甲醇中的储存溶液可以在约-20℃下储存。氯仿可以用作唯一的溶剂,因为它比甲醇更容易蒸发。“脂质体”是通用术语,包括通过产生封闭的脂质双层或聚集体而形成的各种单层和多层脂质载体。脂质体可以表征为具有囊泡结构,该结构具有磷脂双层膜和内部水性介质。多层脂质体具有由水性介质隔开的多个脂质层。当磷脂悬浮在过量的水溶液中时,它们会
自发形成。脂质成分在形成封闭结构之前进行自我重排,并在脂质双层之间包埋水和溶解的溶质(ghosh et al.,glycobiology 5:505-510(1991))。然而,也包括在溶液中具有与正常囊泡结构不同的结构的组分。例如,脂质可以假定具有胶束结构或仅作为脂质分子的非均匀聚集体存在。还预期了脂质体-核酸复合物。
[0080]
不管用于将外源核酸引入宿主细胞的方法如何,可以通过本领域已知的多种测定法来常规确认宿主细胞中重组核酸序列的存在。这样的测定法包括例如本领域已知的“分子生物学”测定法,例如southern和northern印迹、rt-pcr和pcr;“生物化学”测定法,例如检测特定肽的存在或不存在,例如通过免疫学手段(elisa和蛋白质印迹)或通过本文所述的测定法来鉴定落入本发明范围内的试剂。
[0081]
报告基因用于鉴定潜在的转染细胞和评估调控序列的功能。一般而言,报告基因是不存在于受体生物、组织或细胞中或不由受体生物、组织或细胞表达并且编码多肽的基因,该多肽的表达通过一些易于检测的特性例如酶活性来证明。在将dna引入受体细胞后,在合适的时间测定报告基因的表达。合适的报告基因包括但不限于编码荧光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌性碱性磷酸酶的基因或绿色荧光蛋白基因(例如,ui-tei et al.,febs lett.479:79-82(2000))。合适的表达系统是本领域已知的并且可以使用已知的技术制备或商业获得。一般而言,具有显示最高报告基因表达水平的最小5'侧翼区域的构建体被鉴定为启动子。这样的启动子区域常规可以与报告基因连接,并用于评估试剂调节启动子驱动的转录的能力。
[0082]
许多选择系统可用于哺乳动物宿主-载体表达系统,包括但不限于单纯疱疹病毒胸苷激酶、次黄嘌呤-鸟嘌呤磷酸核糖基转移酶和腺嘌呤磷酸核糖基转移酶(lowy et al.,cell 22:817(1980))基因。此外,抗代谢物抗性可用作选择例如dhfr、gpt、neo、hygro、trpb、hisd、odc(鸟氨酸脱羧酶)和谷氨酰胺合成酶系统的基础。
[0083]
配体纯化
[0084]
一旦配体或配体融合蛋白通过重组表达产生,其可以通过本领域已知的用于纯化重组蛋白的方法进行纯化,例如通过色谱法(例如,离子交换层析、亲和层析和分级柱层析(sizing column chromatography))、离心、差速溶解度或通过任何其他用于纯化蛋白质的标准技术。在一些实施方案中,配体可选地融合到本文具体公开的或本领域已知的异源多肽序列以促进纯化。在一些实施方案中,在使用本领域已知的技术最终制备配体之前,从组分中去除用于亲和纯化的配体亲和柱的配体(例如,抗体和其他亲和基质)以及可选地配体或由这些配体结合的配体融合组分的其他成分。
[0085]
配体的化学合成
[0086]
除了重组方法之外,还可以使用本领域已知的多种液相和固相化学过程,使用所需多肽的有机化学合成来进行配体产生。各种自动合成器是可商购的并且可以根据已知方案使用。参见,例如,tam et al.,j.am.chem.soc.,105:6442(1983);merrifield,science,232:341-347(1986);barany and merrifield,the peptides,gross and meienhofer,eds,academic press,new york,1-284;barany et al.,int.j.pep.protein res.,30:705 739(1987);kelley et al.in genetic engineering principles and methods,setlow,j.k.,ed.plenum press,ny.1990,vol.12,pp.1-19;stewart et al.,solid-phase peptide synthesis,w.h.freeman co.,san francisco,1989。这些方法的一个优点是它们
允许将非天然氨基酸残基加入配体序列中。
[0087]
本发明的方法中使用的配体可以在合成或翻译期间或之后进行修饰,例如通过糖基化、乙酰化、苄基化、磷酸化、酰胺化、聚乙二醇化、甲酰化、通过已知保护/封闭基团的衍生化、蛋白水解裂解、与抗体分子的键合、羟基化、碘化、甲基化、肉豆蔻酰化、氧化、聚乙二醇化、蛋白水解加工、磷酸化、异戊二烯化、外消旋化、硒酰化(selenoylation)、硫酸化、泛素化等。(参见,例如creighton,proteins:structures and molecular properties,2d ed.(w.h.freeman and co.,n.y.,1992);postranslational covalent modification of proteins,johnson,ed.(academic press,new york,1983),pp.1-12;seifter,meth.enzymol.,182:626-646(1990);rattan,ann.ny acad.sci.,663:48-62(1992)。)在一些实施方案中,肽在n末端乙酰化和/或在c末端酰胺化。
[0088]
许多化学修饰中的任何一种可以通过已知技术进行,包括但不限于乙酰化、甲酰化等。另外,衍生物可以包含一个或多个非经典氨基酸。
[0089]
在一些实施方案中,肽骨架的环化或大环化是通过侧链到侧链的键合形成来实现的。实现这一点的方法是本领域熟知的并且可以涉及天然和非天然氨基酸。方法包括二硫化物形成、羊毛硫氨酸形成或硫醇烷基化(例如迈克尔加成)、氨基和羧酸盐侧链之间的酰胺化、点击化学(例如叠氮化物-炔烃缩合)、肽缝合(peptide stapling)、闭环复分解和酶的使用。
[0090]
用于纯化的亲和剂
[0091]
在基于亲和层析的纯化中,根据目标靶标(例如蛋白质或分子)特异性和可逆结合到通常已经共价偶联到色谱基质的配体的能力来选择性分离目标靶标。在一些实施方案中,配体可用作来自重组来源或天然来源(例如,生物样品(例如血清))的目标靶标的亲和纯化试剂。
[0092]
在一些实施方案中,特异性结合目标靶标的配体被固定在珠粒上,然后用于亲和纯化靶标。
[0093]
将蛋白质共价偶联到表面的方法是本领域技术人员已知的,并且可用于将配体连接到固体表面的肽标签是本领域技术人员已知的。此外,可以使用本领域已知的任何试剂或技术将配体连接(即,偶联、连接或粘附)到固体表面。在一些实施方案中,固体支持物包括珠粒、玻璃、载玻片、芯片和/或明胶。因此,一系列配体可用于使用本领域已知的技术在固体表面上制造阵列(array)。例如,美国公开号2004/0009530公开了用于制备阵列的方法。
[0094]
在一些实施方案中,配体用于通过亲和层析分离目标靶标。在一些实施方案中,配体固定在固体支持物上。可以使用本文所述的或本领域已知的技术和试剂将配体固定在固体支持物上。合适的固体支持物在本文中进行了描述或者是本领域已知的,并且在具体实施方式中适合用于填充层析柱。然后可以在有利于在配体和目标靶标之间形成复合物的条件下对固定的配体进行上样或使固定的配体与溶液接触。未结合的材料可以被洗掉。本领域技术人员可以容易地确定合适的洗涤条件。在shukla and hinckley,biotechnol prog.2008 sep-oct;24(5):1115-21.doi:10.1002/btpr.50中描述了合适的洗涤条件的示例。
[0095]
在一些实施方案中,通过混合含有目标靶标和配体的溶液,然后分离目标靶标和
配体的复合物来进行层析。例如,将配体固定在固体支持物(例如珠粒)上,然后通过过滤与目标靶标一起从溶液中分离。在一些实施方案中,配体是包含肽标签的融合蛋白,例如多聚his尾或链霉亲和素结合区,其可用于在复合物形成后使用固定化金属亲和层析树脂或链霉亲和素涂覆的基底来分离配体。一旦分离,目标靶标可以在洗脱条件下从配体中释放出来,并以纯化的形式回收。
[0096]
实施例
[0097]
通过标准fmoc固相肽合成技术合成肽并通过制备型反相hplc纯化肽。通过rp hplc与uv和四极杆飞行时间质谱检测来评估肽的纯度。
[0098]
实施例1
[0099]
本实施例展示了包含本文鉴定和描述的配体的亲和剂的产生和表征。通过将配体与琼脂糖珠粒缀合来制备亲和树脂。用碳酸二琥珀酰亚胺酯活化rapid run 6%琼脂糖珠粒(abt,madrid,spain),并与配体密度为1
–
8mg/ml树脂的肽配体偶联。使用减法(subtractive)rp-hplc方法根据下式测量所有树脂的实际配体密度:
[0100]
实际配体密度=(进料中测得的[配体]
–
流出物中测得的[配体])。
[0101]
实施例2
[0102]
本实施例展示了包含本文所述的结合配体的亲和剂用于病毒颗粒的亲和纯化的用途。使用含有病毒衣壳的澄清的细胞培养进料流(cccf),病毒衣壳的滴度约为1e12总衣壳/ml。如表1所示操作0.66cm id
×
6cm柱。
[0103]
表1.柱操作参数
[0104][0105][0106]
总衣壳elisa用于量化衣壳量。使用elisa(cygnus technologies,southport,nc)确定hcp。使用picogreen测定法测量dna。分析纯化的病毒衣壳。亲和树脂性能度量如表2所示。
[0107]
表2.病毒衣壳纯化的性能参数
[0108][0109][0110]
实施例3
[0111]
本实施例展示了亲和剂在测试条件下的稳定性。使用静态结合实验确定由配体制备的树脂对氢氧化钠的稳定性,树脂浆料悬浮在0.1m naoh中预定时间。为了计算cip寿命,假设一个cip循环相当于暴露于0.1m naoh中15分钟。数据如表3所示。
[0112]
表3.树脂对0.1m naoh的稳定性
[0113][0114]
实施例4
[0115]
本实施例展示了亲和剂在使用条件下和暴露于0.1m naoh时的稳定性。除以下2个修改外,如实施例2中所述操作柱。
[0116]
1)在每个循环之间,将柱暴露于0.1m naoh中2小时。
[0117]
2)洗脱缓冲液是50mm甘氨酸,ph 2.5,1m精氨酸,10%丙二醇,0.1%triton x-100。
[0118]
下表显示了在整个研究中表现一致的结果。
[0119]
表4.在循环研究期间获得的总衣壳产率
[0120]
循环res-1230res-1233res-12521101%130%92%390%92%111%591%104%84%
[0121]
表5.在循环研究期间获得的hcp减少。残留hcp水平(ppm)显示在括号中
[0122]
循环res-1230res-1233res-12521》3.6(《700)》3.8(《600)》3.8(《600)3》3.6(《800)》3.6(《800)》3.8(《500)5》3.6(《800)》3.7(《700)》3.7(《600)
[0123]
表6.在循环研究期间获得的dna减少。残留dna水平(ppm)显示在括号中
[0124]
循环res-1230res-1233res-125210.3(1100)0.6(400)1.0(200)30.8(300)1.0(200)1.3(100)50.9(200)1.1(200)1.2(100)
[0125]
实施例5
[0126]
本实施例展示了包含本文所述的结合配体的亲和剂可用于aav9的不同变体的亲和纯化。使用来自不同aav9衣壳产生的澄清的细胞培养进料流(cccf),滴度约为1e12
–
3e12总衣壳/ml。如表7所示操作3mm id
×
100mm柱。树脂包含配体,该配体包含2mg/ml配体密度的seq id 32。
[0127]
表7.柱操作参数
[0128][0129]
总衣壳elisa用于量化衣壳量。使用elisa(cygnus technologies,southport,nc)确定残留hcp。使用quant-it picogreen
tm dsdna测定试剂盒测量残留hcdna。亲和树脂性能度量如表8所示。
[0130]
表8.病毒衣壳纯化的性能参数
[0131][0132]
实施例6
[0133]
本实施例展示了亲和剂在使用条件下和暴露于0.5m naoh时的稳定性。使用6.6mm id
×
100mm柱以表9中所示方法的重复循环操作来自实施例5的树脂。在每个循环过程中,柱暴露于0.5m naoh中总共30分钟(用5个cv洗涤,然后静态保持20分钟)。aav9衣壳是第三个变体。
[0134]
表9.每个循环的柱操作参数
[0135]
[0136][0137]
图1-3显示了在整个研究中表现一致的结果,表明柱可以承受0.5m naoh。
[0138]
实施例7
[0139]
本实施例展示了亲和试剂能够实现更温和的洗脱条件。用2e14 vp/ml树脂对3mm id
×
25mm柱进行挑战,并用含有0.25m、0.5m或1m精氨酸(ph 4.5、5或5.5)的缓冲液洗脱。测得的产率如图4所示。产率在ph 5.5时略有下降。
[0140]
实施例8
[0141]
本实施例使用生物层干涉测量法(fortebio,menlo park,ca)展示了生物素化的配体与aav衣壳的结合。包含固定的sed id no:46-47配体的传感器在5ug/ml aav衣壳中温育。传感图如图5所示。
[0142]
可以预期,可以进行以上公开的实施例的特定特征和方面的各种组合或子组合并且它们仍然落入本发明。此外,本文公开的与实施方案相关的任何特定特征、方面、方法、特性、特点、质量、属性、元素等可以用于本文阐述的所有其他实施方案中。因此,应当理解,所公开的实施方案的各种特征和方面可以彼此组合或替代。因此,本文描述的本发明的范围不应被上述具体公开的实施方案限制。此外,虽然本发明易于进行各种修改和替代形式,但其具体实施例已在附图中示出并在此详细描述。然而,应当理解,本发明不限于所公开的特定形式或方法,相反,本发明涵盖落入描述的各种实施方案的精神和范围内的所有修改、等同物和替代物。
[0143]
本文公开的任何方法不需要按所述顺序进行。本文公开的方法包括从业者采取的某些行为;但是,它们也可以包括任何第三方对这些行为的指示,无论是明示的还是暗示的。
[0144]
序列
[0145]
[0146]
[0147][0148]
·
ac-表示n末端乙酰化
[0149]
·-amide表示c末端酰胺化
[0150]
·
%或5分别表示谷氨酸或天冬氨酸残基,其中羧基侧链与由$表示的赖氨酸残基的ε氨基或由j表示的2,3-二氨基丙酸残基的β氨基缀合
[0151]
·
(peg)
3-表示12-氨基-4,7,10-三氧十二烷酸亚基
[0152]
·
半胱氨酸残基可能形成分子内二硫键
[0153]
·
xn表示半胱氨酸、二氨基丙酸、天冬氨酸、赖氨酸或谷氨酸,x1和x2可能形成分子内键
[0154]
·
d*表示天冬氨酸残基,其中羧基侧链与由j表示的2,3-二氨基丙酸残基的β氨基缀合
[0155]
·
(peg)
3-表示12-氨基-4,7,10-三氧十二烷酸亚基
[0156]
·
半胱氨酸残基可能形成分子内二硫键
[0157]
·
a*表示丙氨酸残基,其α氨基与由d**表示的天冬氨酸残基的羧基侧链相连
[0158]
·
&表示琥珀酰基,其与由j表示的2,3-二氨基丙酸残基的β氨基缀合
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1