一种基于LC-MS的生物样品中壳寡糖的高灵敏度检测分析方法
一种基于lc
‑
ms的生物样品中壳寡糖的高灵敏度检测分析方法
技术领域
1.本发明属于食品及生物检测领域,具体涉及一种基于lc
‑
ms的生物样品中壳寡糖的高灵敏度检测分析方法。
背景技术:
2.壳寡糖(chitooligosaccharide,cos)是壳聚糖的降解产物,是由2
‑
10个n
‑
乙酰氨基葡萄糖通过β
‑
1,4糖苷键连接而成的低聚糖。壳寡糖是自然界中唯一的阳离子糖类,安全无毒,功能作用广,具有降低体重、降胆固醇、免疫调节、抗肿瘤、抑制腐败菌、调节胃肠道等功能。壳寡糖分子量小,易溶于水,可被人体、动物及植物机体吸收,具有良好的生理活性。
3.壳寡糖由于自身没有紫外吸收基团,又无发色基团,导致其定量检测困难,尤其在生物样品中易受到生物源成分干扰,使得微量检测更为困难。目前对壳寡糖的定量检测方法主要有高效液相色谱法、高效阴离子交换色谱
‑
安培法、毛细管电泳法、荧光光度法等。
4.壳寡糖的分离检测技术一直是研究者的关注点之一,尽管壳寡糖分析方法多种多样,但改进现有方法,使其具有更好的专属性与灵敏度一直是研究的热点和难点问题。在壳寡糖的液相分离中,由于壳寡糖自身含有氨基和羟基两种官能团,一方面自身极性很强,难以直接在反相c18柱上得到良好的保留,另一方面紫外吸收弱,难以在紫外检测器上得到高灵敏响应。为改善壳寡糖的保留与检测问题,通常使用氨基柱进行分离,采用示差折光法检测器进行检测,但是氨基柱的使用寿命不长,示差折光法的灵敏度不高且不适合应用梯度洗脱分离样品,很难实现在复杂体系中实现壳寡糖的快速、微量检测。
5.专利cn109884209a公开了一种保健品中壳寡糖(聚合度dp=2~7)的高效液相色谱串联质谱的检测方法,其中包括步骤:(1)制备标准溶液并进行高效液相色谱串联质谱检测,得到不同浓度的混合标准溶液谱图;(2)将步骤(1)所得的标准谱图按壳寡糖不同聚合度(dp=2~7)分别制作浓度与色谱峰面积关系曲线图;(3)壳寡糖样品的预处理及高效液相色谱串联质谱检测;(4)样品中壳寡糖含量的确定,将步骤(3)中获得的样品谱图的保留时间确定壳寡糖聚合度并与步骤(2)中得到的标准曲线比对,用外标法确定壳寡糖的含量。该方法壳二糖检测的线性范围为0.5
‑
20ug/ml,壳三糖的线性范围为0.5
‑
20ug/ml,壳四糖的线性范围为0.5
‑
20ug/ml;本方法中壳二糖的检测定量范围为0.002
‑
2.56ug/ml,壳三糖的线性范围为0.02
‑
5.12ug/ml,壳四糖的线性范围为0.2
‑
25.6ug/ml,定量下限低于该方法,表明本方法的灵敏度更高。该方法仅适用于保健品中壳寡糖的测定,本方法能够在复杂生物体系中对壳寡糖进行测定,通过样品前处理消除生物样品中内源性物质的干扰,实现在复杂生物体系中的微量检测。
技术实现要素:
6.本发明的目的就是提供一种基于lc
‑
ms对生物样品中壳寡糖的检测分析方法,可用于具有不同聚合度的壳寡糖的含量测定,也可用于具有单一聚合度的壳寡糖的含量测
定。
7.本发明的目的通过以下技术方案实现:
8.一种基于lc
‑
ms的生物样品中壳寡糖的高灵敏度检测分析方法,所述壳寡糖包括壳二糖、壳三糖、壳四糖和壳五糖,壳二糖的分子量:341.1545,壳三糖的分子量502.2243,壳四糖的分子量663.2931,壳五糖的分子量为824.3619,所述检测分析方法包括以下步骤:
9.(a)取生物样品进行前处理,得到样品滤液,后进行lc
‑
ms分析,得到样品lc
‑
ms信号;
10.(b)称取壳寡糖标准物并分别将其配成标准储备液,再将标准储备液用水逐级稀释,配制一系列浓度的标准溶液,之后与空白试剂混合,按照生物样品前处理的操作进行处理,随后进行lc
‑
ms分析,得到标准曲线;
11.(c)根据步骤(b)得到的标准曲线对步骤(a)得到的样品lc
‑
ms信号进行分析,得到生物样品中壳寡糖的含量。
12.步骤(a)和步骤(b)中,lc
‑
ms分析所采用的条件参数为:
13.所述色谱条件为:流动相a为含氨水的水,流动相b为含氨水的乙腈;洗脱采用梯度洗脱或者等比例洗脱;
14.所述质谱条件为:采用电喷雾电离离子源进行电离(esi),正离子靶向选择离子扫描模式(t
‑
sim)进行扫描。
15.步骤(a)和步骤(b)中,lc
‑
ms分析所采用的条件参数为:
16.所述色谱条件为:
17.色谱柱采用waters acquity uplc glycan beh amide,型号为2.1
×
100mm,1.7um,柱温为45℃,进样量为2ul,流速为0.2ml/min,流动相a为含0.1%(v/v)氨水的水,流动相b为含0.1%(v/v)氨水的乙腈,采用梯度洗脱时,洗脱梯度为:
[0018][0019]
所述质谱条件为:
[0020]
电喷雾电离离子源(esi),正离子扫描模式;选择离子扫描模式(sim)(具体为壳二糖m/z 341.1545[m+h]
+
,壳三糖m/z 502.2243[m+h]
+
,壳四糖663.1931[m+h]
+
,壳五糖824.3619[m+h]
+
),设置选择扫描参数为:壳二糖:340.1545~342.1545,壳三糖:501.2233~503.2233,壳四糖:662.2931~664.2931,壳五糖:823.3619~825.3619;分辨率为70000;鞘气流速为40arb,混合气流速为10arb,混合气加热温度为350℃,离子源温度为320℃,正离子喷雾电压3.5kv,s
‑
lens rf为电压50v,离子源和碰撞气都为高纯氮气。
[0021]
步骤(a)中,所述生物样品包括液体样本和固体样本,所述生物样品包括液体样本和固体样本,所述液体样本包括血清、血浆、血液、体液、组织匀浆和尿液,所述固体样本包括粪便、肝脏、肾脏、心脏、肺、脾、胰腺、大脑、小脑和肠道内容物。
[0022]
当生物样品为液体样本时,样品前处理过程具体为:在液体样本中加入甲醇
‑
乙腈
溶剂,涡旋混匀后静置,之后离心取上清液,上清液经过滤后得到样品滤液,后装入带内插管的液相小瓶中进行lc
‑
ms分析。
[0023]
液体样本和甲醇
‑
乙腈溶剂的体积比为1∶1~1∶5,优选为1∶3,甲醇
‑
乙腈溶剂中,甲醇和乙腈的体积比为1∶3~3∶1,优选为1∶1,涡旋的转速为2500~3200rpm,优选为3200rpm,涡旋的时间为30~90s,优选为30s,静置的温度为
‑
20℃,静置的时间为10~30min,优选为15min,离心的温度为4℃,离心的转速为12000~15000rpm,优选为13000rpm,离心的时间为5~15min,优选为10min,过滤采用0.22um的滤膜。
[0024]
当生物样品为固体样品时,样品前处理过程具体为:先将固体样本和水混合进行研磨,之后依次进行第一次涡旋、第一次静置、超声、第二次静置和第一次离心,得到一号上清液,取一号上清液并加入甲醇
‑
乙腈溶剂,第二次涡旋混匀后进行第三次静置,之后第二次离心得到二号上清液,取二号上清液经过滤后得到样品滤液,后装入带内插管的液相小瓶中进行lc
‑
ms分析。
[0025]
固体样本和水的质量体积比为100mg:300ul~100mg:900ul,优选为100mg:500ul,研磨时加入预冷研磨珠(将研磨珠事先在4℃冰箱中放置预冷)2粒,研磨的频率为30~90hz,优选为60hz,研磨的时间为90~180s,优选为120s,第一次涡旋的转速为2500~3200rpm,优选为3200rpm,第一次涡旋的时间为30~90s,优选为30s,第一次静置的温度为
‑
20℃,第一次静置的时间为10~30min,优选为10min,超声在冰水浴中进行,超声的功率为300w,超声的时间为10~30min,优选为10min,第二次静置的温度为
‑
20℃,第二次静置的时间为10~30min,优选为10min,第一次离心的温度为4℃,第一次离心的转速为3000~6000rpm,优选为4000rpm,第一次离心的时间为5~15min,优选为10min,一号上清液和甲醇
‑
乙腈溶剂的体积比为1∶1~1∶5,优选为1∶3,甲醇
‑
乙腈溶剂中,甲醇和乙腈的体积比为1∶3~3∶1,优选为1∶1,第二次涡旋的转速为2500~3200rpm,优选为3200rpm,第二次涡旋的时间为30~90s,优选为30s,第三次静置的温度为
‑
20℃,第三次静置的时间为10~30min,优选为10min,第二次离心的温度为4℃,第二次离心的转速为12000~15000rpm,优选为13000rpm,第二次离心的时间为5~15min,优选为10min,过滤采用0.22um的滤膜。
[0026]
步骤(b)中,当壳寡糖标准物为壳二糖时,壳二糖的系列标准溶液的浓度为0.04~51.2ug/ml,取系列标准溶液,加入到空白血清或空白组织匀浆上清液中,涡旋混匀得到加标血清/组织样品,所述加标血清/组织样品中壳二糖的浓度为0.002~2.56ug/ml,此浓度为本方法能检测到的实际样品中浓度的范围,下同;
[0027]
当壳寡糖标准物为壳三糖时,壳三糖的系列标准溶液的浓度为0.4~102.4ug/ml,取系列标准溶液,加入到空白血清或空白组织匀浆上清液中,涡旋混匀得到加标血清/组织样品,所述加标血清/组织样品中壳三糖的浓度为0.02~5.12ug/ml;
[0028]
当壳寡糖标准物为壳四糖时,壳四糖的系列标准溶液的浓度为4~512ug/ml,取系列标准溶液,加入到空白血清或空白组织匀浆上清液中,涡旋混匀得到加标血清/组织样品,所述加标血清/组织样品中壳四糖的浓度为0.2~25.6ug/ml;
[0029]
当壳寡糖标准物为壳五糖时,壳五糖的系列标准溶液的浓度为20~1280ug/ml,当壳寡糖标准物为壳五糖时,壳五糖的系列标准溶液的浓度为20
‑
1280ug/ml,取系列标准溶液,加入到空白血清或空白组织匀浆上清液中,涡旋混匀得到加标血清/组织样品,所述加标血清/组织样品中壳五糖的浓度为1~64ug/ml。
[0030]
步骤(b)中,进行lc
‑
ms分析过程具体为:取标准溶液和空白试剂混合,第一次涡旋混匀后加入甲醇
‑
乙腈溶剂,再第二次涡旋混匀后静置,之后离心取上清液,上清液经过滤后得到样品滤液,后装入带内插管的液相小瓶中进行lc
‑
ms分析。
[0031]
标准溶液、空白试剂和甲醇
‑
乙腈溶剂的体积比为5∶95∶300,第一次涡旋的转速为2500~3200rpm,优选为3200rpm,第一次涡旋的时间为30~90s,优选为30s,第二次涡旋的转速为2500~3200rpm,优选为3200rpm,第二次涡旋的时间为30s,静置的温度为
‑
20℃,静置的时间为15min,离心的温度为4℃,离心的转速为13000rpm,离心的时间为10min,过滤采用0.22um的滤膜。步骤(b)中,当空白试剂为不含壳寡糖的血清时,壳二糖的标准曲线方程为y=10000000x+789150,r2=0.9992;
[0032]
当空白试剂为不含壳寡糖的血清时,壳三糖的标准曲线方程为y=3000000x
‑
200043,r2=0.9998;
[0033]
当空白试剂为不含壳寡糖的肾脏匀浆上清时,壳二糖的标准曲线方程为y=20000000x+859579,r2=0.9989;
[0034]
当空白试剂为不含壳寡糖的盲肠内容物时,壳四糖的标准曲线为y=1000000x
‑
371077,r2=0.9975;
[0035]
当空白试剂为不含壳寡糖的盲肠内容物时,壳五糖的标准曲线为y=569254x
‑
1000000,r2=0.9991。
[0036]
本发明采用lc
‑
ms技术,以外标法进行定量,采用所述色谱和质谱进行质谱信号、色谱信号以及线性关系考察,通过使用超高效液相色谱
‑
静电离子轨道阱质谱联用仪,建立壳二糖、壳三糖、壳四糖和壳五糖的定性与定量方法,利用四种化合物的标准品进行仪器分析方法优化,包括液相色谱条件、质谱检测条件及质谱参数优化,达到准确、快速、灵敏的测定复杂体系中的壳寡糖的检测要求。
[0037]
本发明的原理具体为:
[0038]
针对现有技术中壳寡糖检测灵敏度低、色谱柱平衡时间较长、在复杂体系中易受杂峰干扰、容易发生保留时间漂移、样品前处理对杂质的去除效果不理想从而对色谱柱寿命影响较大、无法同时检测多个项目等不足,本发明利用超高效液相色谱
‑
静电离子轨道阱质谱系统开发了针对组成复杂的生物样品中壳寡糖的高灵敏度检测分析方法,改善了壳寡糖在色谱中保留的问题,并极大提高了检测灵敏度。
[0039]
本发明利用超高效液相色谱
‑
静电离子轨道阱高分辨质谱技术的高灵敏度和强抗干扰能力的特点,通过选择离子扫描模式精确提取目标化合物的精确质量数,在一定程度上消除了基质干扰,且样品前处理方式简单快速,适合大批量处理样品。
[0040]
本发明对样品前处理以及色谱条件进行了优化,使样品前处理能够去除更多的杂质,在待测样品前处理过程中采用甲醇
‑
乙腈混合有机溶剂高效的减少待测样品中的蛋白质等大分子物质干扰。选择使用分离效果更好的色谱条件,使壳二糖、壳三糖、壳四糖和壳五糖都达到与杂质的有效分离,从而保证检测数据的准确性,可得到良好的分离结果。
[0041]
本发明与现有技术相比较,具有如下显而易见的突出实质性特点和显著优点:
[0042]
1.本发明通过利用壳二糖、壳三糖、壳四糖的标准品进行仪器分析方法优化包括液相色谱条件优化、质谱检测条件优化及质谱参数优化,使得质谱能够准确定性,且定量灵敏度达到最优。
[0043]
2.本发明采用lc
‑
ms技术,使用超高效液相色谱
‑
静电离子轨道阱质谱联用仪,建立了壳二糖、壳三糖、壳四糖、壳五糖在血清、肝脏、肾脏、心脏、肺、脾、胰腺、大脑、小脑、肠道内容物中的定性和定量方法,该方法具有简单快速、样品量少、检测限低、重复性好且灵敏度高的优势。
[0044]
3.本方法简单易行,大大降低了前处理时间和成本,可以同时检测复杂体系中的壳二糖、壳三糖、壳四糖、壳五糖的含量,也可只测定其中一种物质的含量。
[0045]
本发明具有简单快速、检测限低、检测灵敏度高和重复性好的优点,用于生物样本中壳寡糖含量的测定,能够满足生物样本中目标物的检测要求,具有高灵敏度和高选择性,抗干扰能力强,可以成为壳寡糖定性定量分析的有效工具。
附图说明
[0046]
图1为实验例1中血清样品中壳二糖的色谱图;
[0047]
图2为实验例1中由标准溶液得到的壳二糖在血清中的线性关系图;
[0048]
图3为实验例2中血清样品中壳三糖的色谱图;
[0049]
图4为实验例2中由标准溶液得到的壳三糖在血清中的线性关系图;
[0050]
图5为实验例3中肾脏匀浆样品中壳二糖的色谱图;
[0051]
图6为实验例3中由标准溶液得到的壳二糖在肾脏匀浆中的线性关系图;
[0052]
图7为实验例4中盲肠内容物匀浆样品中壳四糖的色谱图;
[0053]
图8为实验例4中由标准溶液得到的壳四糖在盲肠内容物匀浆中的线性关系图;
[0054]
图9为实验例5中盲肠内容物匀浆样品中壳五糖的色谱图;
[0055]
图10为实验例5中由标准溶液得到的壳五糖在盲肠内容物匀浆中的线性关系图;
[0056]
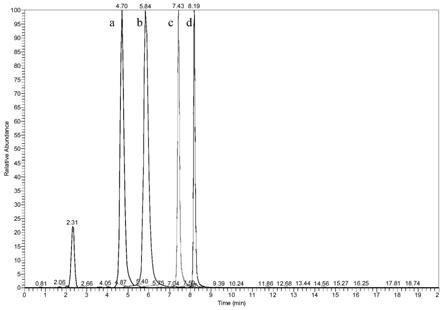
图11为标准品壳二糖、壳三糖、壳四糖和壳五糖在空白试剂中的色谱图。
具体实施方式
[0057]
下面结合附图和具体实施例对本发明进行详细说明。
[0058]
一种基于lc
‑
ms的生物样品中壳寡糖的高灵敏度检测分析方法,所述壳寡糖包括壳二糖、壳三糖、壳四糖和壳五糖,所述检测分析方法包括以下步骤:
[0059]
(a)取生物样品进行前处理,得到样品滤液,后进行lc
‑
ms分析,得到样品lc
‑
ms信号;
[0060]
(b)称取壳寡糖标准物并分别将其配成标准储备液,再将标准储备液用水逐级稀释,配制一系列浓度的标准溶液,之后与空白试剂混合,按照生物样品前处理的操作进行处理,随后进行lc
‑
ms分析,得到标准曲线;
[0061]
(c)根据步骤(b)得到的标准曲线对步骤(a)得到的样品lc
‑
ms信号进行分析,得到生物样品中壳寡糖的含量。
[0062]
步骤(a)和步骤(b)中,lc
‑
ms分析所采用的条件参数为:
[0063]
所述色谱条件为:流动相a为含氨水的水,流动相b为含氨水的乙腈;洗脱采用梯度洗脱或者等比例洗脱;
[0064]
所述质谱条件为:采用电喷雾电离离子源进行电离,正离子靶向选择离子扫描模式进行扫描。
[0065]
步骤(a)和步骤(b)中,lc
‑
ms分析所采用的条件参数为:
[0066]
所述色谱条件为:
[0067]
色谱柱采用waters acquity uplc glycan beh amide,型号为2.1
×
100mm,1.7um,柱温为45℃,进样量为2ul,流速为0.2ml/min,流动相a为含0.1%(v/v)氨水的水,流动相b为含0.1%(v/v)氨水的乙腈,采用梯度洗脱时,洗脱梯度为:
[0068][0069]
所述质谱条件为:
[0070]
采用正离子模式,靶向
‑
选择离子扫描,扫描参数为:壳二糖:340.1545~342.1545,壳三糖:501.2233~503.2233,壳四糖:662.2931~664.2931,壳五糖:823.3619~825.3619;分辨率为70000,鞘气流速为40arb,混合气流速为10arb,混合气加热温度为350℃,离子源温度为320℃,正离子喷雾电压为3.5kv,s
‑
lens rf为电压50v,离子源和碰撞气都为高纯氮气。
[0071]
步骤(a)中,所述生物样品包括液体样本和固体样本,所述液体样本包括血清、血浆、血液、体液、组织匀浆和尿液,所述固体样本包括粪便、肝脏、肾脏、心脏、肺、脾、胰腺、大脑、小脑和肠道内容物。
[0072]
当生物样品为液体样本时,样品前处理过程具体为:在液体样本中加入甲醇
‑
乙腈溶剂,涡旋混匀后静置,之后离心取上清液,上清液经过滤后得到样品滤液,后装入带内插管的液相小瓶中进行lc
‑
ms分析,其中,液体样本和甲醇
‑
乙腈溶剂的体积比为1∶1~1∶5,甲醇
‑
乙腈溶剂中,甲醇和乙腈的体积比为1∶3~3∶1,涡旋的转速为2500~3200rpm,涡旋的时间为30~90s,静置的温度为
‑
20℃,静置的时间为10~30min,离心的温度为4℃,离心的转速为12000~15000rpm,离心的时间为5~15min,过滤采用0.22um的滤膜。
[0073]
当生物样品为固体样品时,样品前处理过程具体为:先将固体样本和水混合进行研磨,之后依次进行第一次涡旋、第一次静置、超声、第二次静置和第一次离心,得到一号上清液,取一号上清液并加入甲醇
‑
乙腈溶剂,第二次涡旋混匀后进行第三次静置,之后第二次离心得到二号上清液,取二号上清液经过滤后得到样品滤液,后装入带内插管的液相小瓶中进行lc
‑
ms分析,其中,固体样本和水的质量体积比为100mg:300ul~100mg:900ul,研磨时加入预冷研磨珠,研磨的频率为30~90hz,研磨的时间为90~180s,第一次涡旋的转速为2500~3200rpm,第一次涡旋的时间为30~90s,第一次静置的温度为
‑
20℃,第一次静置的时间为10~30min,超声在冰水浴中进行,超声的功率为300w,超声的时间为10~30min,第二次静置的温度为
‑
20℃,第二次静置的时间为10~30min,第一次离心的温度为4℃,第一次离心的转速为3000~6000rpm,第一次离心的时间为5~15min,一号上清液和甲醇
‑
乙腈溶剂的体积比为1∶1~1∶5,甲醇
‑
乙腈溶剂中,甲醇和乙腈的体积比为1∶3~3∶1,第二次涡旋的转速为2500~3200rpm,第二次涡旋的时间为30~90s,第三次静置的温度为
‑
20℃,第三次静置的时间为10~30min,第二次离心的温度为4℃,第二次离心的转速为12000~
15000rpm,第二次离心的时间为5~15min,过滤采用0.22um的滤膜。
[0074]
步骤(b)中,当壳寡糖标准物为壳二糖时,壳二糖的系列标准溶液的浓度为0.04~51.2ug/ml,取系列标准溶液,加入到空白血清或空白组织匀浆上清液中,涡旋混匀得到加标血清/组织样品,所述加标血清/组织样品中壳二糖的浓度为0.002~2.56ug/ml;
[0075]
当壳寡糖标准物为壳三糖时,壳三糖的系列标准溶液的浓度为0.4~102.4ug/ml,取系列标准溶液,加入到空白血清或空白组织匀浆上清液中,涡旋混匀得到加标血清/组织样品,所述加标血清/组织样品中壳三糖的浓度为0.02~5.12ug/ml;
[0076]
当壳寡糖标准物为壳四糖时,壳四糖的系列标准溶液的浓度为4~512ug/ml,取系列标准溶液,加入到空白血清或空白组织匀浆上清液中,涡旋混匀得到加标血清/组织样品,所述加标血清/组织样品中壳四糖的浓度为0.2~25.6ug/ml;
[0077]
当壳寡糖标准物为壳五糖时,壳五糖的系列标准溶液的浓度为20~1280ug/ml,取系列标准溶液,加入到空白血清或空白组织匀浆上清液中,涡旋混匀得到加标血清/组织样品,所述加标血清/组织样品中壳五糖的浓度为1~64ug/ml。
[0078]
实施例1
[0079]
一种基于lc
‑
ms对生物样品中壳寡糖的检测分析方法,该方法用来分析壳二糖灌胃后大鼠血清中壳二糖的含量,即生物样品为血清样品。具体步骤如下:
[0080]
1、给药取血
[0081]
8周零雄性wistar大鼠(230
±
10g),七天适应性喂养并禁食12h后灌胃壳二糖溶液,分别于0.5h(n=3,即在该时间点分别对三只大鼠取样,下同)和2h(n=3,该三只大鼠与0.5h时取样的大鼠一一对应,下同)后尾静脉取血200ul,4℃静置过夜后取血清。
[0082]
2、血清样品处理方法
[0083]
样品前处理方法:在100ul血清样本中加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm剧烈涡旋30s混匀,
‑
20℃静置15min,随后4℃13000rpm下离心10min,取上清液200ul,过0.22um滤膜后得到样品滤液,装入带内插管的液相小瓶中,对样品滤液进行上机检测(检测参数在下文),图1为0.5h时鼠1的血清样本中壳二糖的色谱图(0.5h时其余两只大鼠的血清样本色谱图和2h时三只大鼠的血清样本色谱图同图1类似,不另做展示),图1可以说明壳二糖在正离子选择离子扫描模式下能得到清晰且峰形良好的色谱信号。
[0084]
3、标准曲线样品配制方法
[0085]
称取10mg壳二糖(购自上海源叶生物科技有限公司)溶于1ml超纯水中,得到终浓度为10mg/ml的壳二糖储备液;用超纯水稀释配制成0.1mg/ml壳二糖工作液,避光储存于4℃冰箱中,备用。将壳二糖工作液用超纯水稀释成为系列标准溶液,壳二糖的浓度范围为0.04~51.2ug/ml(具体为0.04ug/ml、0.16ug/ml、0.8ug/ml、3.2ug/ml、12.8ug/ml、25.6ug/ml、51.2ug/ml),分别取5ul标准溶液加入95ul空白血清中,血清中壳二糖的浓度为0.002~2.56ug/ml(具体为0.002ug/ml、0.008ug/ml、0.04ug/ml、0.16ug/ml、0.64ug/ml、1.28ug/ml、2.56ug/ml),3200rpm涡旋30s混匀,随后加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm剧烈涡旋30s混匀,
‑
20℃静置15min,随后4℃13000rpm下离心10min,取上清液200ul,过0.22um滤膜后装入带内插管的液相小瓶中,对滤液进行上机检测(检测参数在下文),得到如图11中a所示的色谱图。
[0086]
4、技术条件:
[0087]
色谱条件:waters acquity uplc glycan beh amide色谱柱,2.1
×
100mm,1.7um;柱温:45℃;进样量为2ul;流速为0.2ml/min;流动相a:含0.1%(v/v)氨水的水,b:含0.1%(v/v)氨水的乙腈;洗脱梯度为:
[0088][0089]
质谱条件:电喷雾电离离子源(esi),正离子扫描模式;选择靶向选择离子扫描模式(t
‑
sim)(具体为壳二糖m/z 341.1545[m+h]
+
,壳三糖m/z 502.2243[m+h]
+
,壳四糖663.1931[m+h]
+
,壳五糖824.3619[m+h]
+
),设置选择扫描参数为:壳二糖:340.1545~342.1545,壳三糖:501.2233~503.2233,壳四糖:662.2931~664.2931,壳五糖:823.3619~825.3619;分辨率为70000;鞘气流速为40arb,混合气流速10arb,混合气加热温度350℃,离子源温度320℃,正离子喷雾电压3.5kv,s
‑
lens rf为电压50v,离子源和碰撞气都为高纯氮气。
[0090]
5、在正离子模式选择离子扫描模式下进行lc
‑
ms分析,测定血清中壳二糖含量,壳二糖用于定量分析的离子为m/z=341.1545([m+h]
+
)(离子偏差<6
×
10
‑6)。
[0091]
6、测定结果
[0092]
在空白血清中壳二糖的标准曲线方程:y=10000000x+789150,r2=0.9992,如图2所示(其中,横坐标为壳二糖在血清中的浓度,单位为ug/ml,纵坐标为壳二糖的峰面积),图2表明采用本方法定量分析得到的壳二糖在血清中的线性关系良好。
[0093]
壳二糖灌胃后大鼠血清中壳二糖含量具体结果见表1,其中横行为同一只大鼠在两个时间点分别取血得到的检测结果,下同。
[0094]
表1血清中壳二糖的含量
[0095][0096]
实施例2
[0097]
一种基于lc
‑
ms对生物样品中壳寡糖的检测分析方法,该方法用来分析壳三糖灌胃后大鼠血清中壳三糖的含量,即生物样品为血清样品。具体步骤如下:
[0098]
1、给药取血
[0099]
8周零雄性wistar大鼠(230
±
10g),七天适应性喂养并禁食12h后灌胃壳三糖溶液,分别于0.5h(n=3)和2h(n=3)后尾静脉取血200ul,4℃静置过夜后取血清。
[0100]
2、血清样品处理方法
[0101]
样品前处理方法:在100ul血清样本中加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,
3200rpm剧烈涡旋30s混匀,
‑
20℃静置15min,随后4℃13000rpm下离心10min,取上清液200ul,过0.22um滤膜后得到样品滤液,装入带内插管的液相小瓶中,对样品滤液进行上机检测(检测参数在下文),图3为0.5h时鼠1的血清样本中壳三糖的色谱图(0.5h时其余两只大鼠的血清样本色谱图和2h时三只大鼠的血清样本色谱图同图3类似,不另做展示),图3可以说明壳三糖在正离子选择离子扫描模式下能得到清晰且峰形良好的色谱信号。
[0102]
3、标准曲线样品配制方法
[0103]
称取10mg壳三糖(购自上海源叶生物科技有限公司)溶于1ml超纯水中,得到终浓度为10mg/ml的壳三糖储备液;用超纯水稀释配制成1mg/ml壳三糖工作液,避光储存于4℃冰箱中,备用。将壳三糖工作液用超纯水稀释成为系列标准溶液,壳三糖的浓度范围为0.4
‑
102.4ug/ml(具体为0.4ug/ml、1.6ug/ml、6.4ug/ml、12.8ug/ml、25.6ug/ml、51.2ug/ml、102.4ug/ml),分别取5ul标准溶液加入95ul空白血清中,血清中壳三糖的浓度为0.02~5.12ug/ml(具体为0.02ug/ml、0.08ug/ml、0.32ug/ml、0.64ug/ml、1.28ug/ml、2.56ug/ml、5.12ug/ml),3200rpm涡旋30s混匀,随后加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm剧烈涡旋30s混匀,
‑
20℃静置15min,随后4℃13000rpm下离心10min,取上清液200ul,过0.22um滤膜后装入带内插管的液相小瓶中,对滤液进行上机检测(检测参数在下文),得到如图11中b所示的色谱图。
[0104]
4、技术条件:
[0105]
色谱条件:waters acquity uplc glycan beh amide色谱柱,2.1
×
100mm,1.7um;柱温:45℃;进样量为2ul;流速为0.2ml/min;流动相a:含0.1%(v/v)氨水的水,b:含0.1%(v/v)氨水的乙腈;洗脱梯度为:
[0106][0107]
质谱条件:电喷雾电离离子源(esi),正离子扫描模式;选择离子扫描模式(sim)(具体为壳二糖m/z 341.1545[m+h]
+
,壳三糖m/z 502.2243[m+h]
+
,壳四糖663.1931[m+h]
+
),壳五糖824.3619[m+h]
+
),设置选择扫描参数为:壳二糖:340.1545~342.1545,壳三糖:501.2233~503.2233,壳四糖:662.2931~664.2931,壳五糖:823.3619~825.3619;分辨率为70000;鞘气流速为40arb,混合气流速10arb,混合气加热温度350℃,离子源温度320℃,正离子喷雾电压3.5kv,s
‑
lens rf为电压50v,离子源和碰撞气都为高纯氮气。
[0108]
5、在正离子模式选择离子扫描模式下进行lc
‑
ms分析,测定血清中壳三糖的含量壳三糖用于定量分析的离子为m/z=502.2243([m+h]+)(离子偏差<6
×
10
‑
6),壳三糖在血清中的色谱图见图3。
[0109]
6、测定结果
[0110]
在空白血清中壳三糖的标准曲线方程:y=3000000x-200043,r2=0.9998,如图4所示(其中,横坐标为壳三糖在血清中的浓度,单位为ug/ml,纵坐标为壳三糖的峰面积),图4表明采用本方法定量分析得到的壳三糖在血清中的线性关系良好。
[0111]
壳三糖灌胃后大鼠血清中壳三糖含量具体结果见表2。
[0112]
表2血清中壳三糖的含量
[0113][0114]
实施例3
[0115]
一种基于lc
‑
ms对生物样品中壳寡糖的检测分析方法,该方法用来分析壳二糖灌胃大鼠后肾脏中壳二糖的含量,即生物样品为肾脏。具体步骤入下:
[0116]
1、给药取肾脏
[0117]
8周龄雄性wistar大鼠(230
±
10g),七天适应性喂养后灌胃壳二糖溶液,于1h断颈处死大鼠(n=3),解剖取肾脏,用生理盐水洗净表面浮血,滤纸吸干水分。
[0118]
2、肾脏样品处理方法
[0119]
准确称取100mg肾脏样品于ep管中,加入2粒预冷研磨珠(将研磨珠事先在4℃冰箱中放置预冷)和500ul预冷生理盐水,组织研磨仪60hz研磨120s。随后3200rpm涡旋30s,于
‑
20℃静置10min后,冰水浴以300w功率超声10min。于
‑
20℃静置10min后,4000rpm离心10min。取上清100ul,加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm涡旋混匀30s,随后
‑
20℃静置10min,取出后13000rpm离心10min。取上清200ul过0.22um滤膜后装入液相小瓶待检测。
[0120]
3、标准曲线样品配制方法
[0121]
称取10mg壳二糖(购自上海源叶生物科技有限公司)溶于1ml超纯水中,得到浓度为10mg/ml的壳二糖储备液,用超纯水稀释成0.1mg/ml的壳二糖工作液,避光储存于4℃冰箱中,备用。将壳二糖工作液用超纯水稀释成为系列标准溶液,壳二糖的浓度范围为0.04
‑
51.2ug/ml(具体为0.04ug/ml、0.16ug/ml、0.8ug/ml、3.2ug/ml、12.8ug/ml、25.6ug/ml、51.2ug/ml),分别取5ul标准溶液加入95ul空白肾脏组织匀浆上清液中,肾脏组织匀浆上清液中壳二糖的浓度为0.002
‑
2.56ug/ml(具体为0.002ug/ml、0.008ug/ml、0.04ug/ml、0.16ug/ml、0.64ug/ml、1.28ug/ml、2.56ug/ml),随后加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm剧烈涡旋30s混匀,
‑
20℃静置15min,随后4℃13000rpm下离心10min,取上清液200ul,过0.22um滤膜后装入带内插管的液相小瓶中,对滤液进行上机检测(检测参数在下文),得到如图11中a所示的色谱图。
[0122]
4、技术条件:
[0123]
色谱条件:waters acquity uplc glycan beh amide色谱柱,2.1
×
100mm,1.7um;柱温:45℃;进样量为2ul;流速为0.2ml/min;流动相a:含0.1%(v/v)氨水的水,b:含0.1%(v/v)氨水的乙腈;洗脱梯度为:
[0124][0125]
质谱条件:电喷雾电离离子源(esi),正离子扫描模式;选择离子扫描模式(sim)(具体为壳二糖m/z 341.1545[m+h]
+
,壳三糖m/z 502.2243[m+h]
+
,壳四糖663.1931[m+h]
+
),壳五糖824.3619[m+h]
+
),设置选择扫描参数为:壳二糖:340.1545~342.1545,壳三糖:501.2233~503.2233,壳四糖:662.2931~664.2931,壳五糖:823.3619~825.3619;分辨率为70000;鞘气流速为40arb,混合气流速10arb,混合气加热温度350℃,离子源温度320℃,正离子喷雾电压3.5kv,s
‑
lens rf为电压50v,离子源和碰撞气都为高纯氮气。
[0126]
5、在正离子模式选择离子扫描模式下进行lc
‑
ms分析,测定肾脏中壳二糖的含量,cos 2用于定量分析的离子为m/z=341.1555([m+h]
+
)(离子偏差<6
×
10
‑6),壳二糖在肾脏组织匀浆中的色谱图见图5,图5可以说明壳二糖在正离子选择离子扫描模式下能得到清晰且峰形良好的色谱信号。
[0127]
6、在空白肾脏中壳二糖的标准曲线方程:y=20000000x+859579,r2=0.999,如图6所示(其中,横坐标为壳二糖在肾脏组织匀浆中的浓度,单位为ug/ml,纵坐标为壳二糖的峰面积);图6表明采用本方法定量分析得到的壳二糖在肾脏样品中的线性关系良好。
[0128]
标曲中浓度为壳二糖在大鼠肾脏匀浆中的浓度,肾脏匀浆由100mg肾脏组织(体积约为100ul)加500ul生理盐水后匀浆制得,因此肾脏中浓度为肾脏匀浆中浓度的6倍。壳二糖灌胃后大鼠肾脏中壳二糖含量具体结果见表3。
[0129]
表3肾脏中壳二糖的含量
[0130][0131]
实施例4
[0132]
一种基于lc
‑
ms对生物样品中壳寡糖的检测分析方法,该方法用来分析壳四糖灌胃大鼠后盲肠内容物中壳四糖的含量,及生物样品为盲肠内容物。具体步骤入下:
[0133]
1、给药取盲肠内容物
[0134]
8周龄雄性wistar大鼠(230
±
10g),七天适应性喂养后灌胃壳四糖溶液,于4h断颈处死大鼠(n=3),解剖取盲肠内容物。
[0135]
2、盲肠内容物样品处理方法
[0136]
准确称取100mg盲肠内容物于ep管中,加入2粒预冷研磨珠(将研磨珠事先在4℃冰箱中放置预冷)和500ul预冷生理盐水,组织研磨仪60hz研磨120s。随后3200rpm涡旋30s,于
‑
20℃静置10min后,冰水浴以300w功率超声10min。于
‑
20℃静置10min后,4000rpm离心
10min。取上清100ul,加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm涡旋混匀30s,随后
‑
20℃静置10min,取出后13000rpm离心10min。取上清200ul过0.22um滤膜后装入液相小瓶待检测。
[0137]
3、标准曲线样品配制方法
[0138]
称取10mg壳四糖(购自上海源叶生物科技有限公司)溶于1ml超纯水中,得到浓度为10mg/ml的壳四糖储备液,用超纯水稀释成1mg/ml的壳四糖工作液,避光储存于4℃冰箱中,备用。将壳四糖工作液用超纯水稀释成为系列标准溶液,壳四糖的浓度范围为4
‑
512ug/ml(具体为4ug/ml、16ug/ml、32ug/ml、64ug/ml、128ug/ml、256ug/ml、512ug/ml),分别取5ul标准溶液加入95ul盲肠内容物匀浆上清液中,3200rpm涡旋30s混匀,得到浓度范围为0.2
‑
25.6ug/ml的加标肾脏样品(具体为0.2ug/ml、0.8ug/ml、1.6ug/ml、3.2ug/ml、6.4ug/ml、12.8ug/ml、25.6ug/ml)。随后加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm剧烈涡旋30s混匀,
‑
20℃静置15min,随后4℃13000rpm下离心10min,取上清液200ul,过0.22um滤膜后装入带内插管的液相小瓶中,对滤液进行上机检测(检测参数在下文),得到如图11中c所示的色谱图。
[0139]
4、技术条件:
[0140]
色谱条件:waters acquity uplc glycan beh amide色谱柱,2.1
×
100mm,1.7um;柱温:45℃;进样量为2ul;流速为0.2ml/min;流动相a:含0.1%(v/v)氨水的水,b:含0.1%(v/v)氨水的乙腈;洗脱梯度为:
[0141][0142]
质谱条件:电喷雾电离离子源(esi),正离子扫描模式;选择离子扫描模式(sim)(具体为壳二糖m/z=341.1545[m+h]
+
,壳三糖m/z=502.2243[m+h]
+
,壳四糖m/z=663.1931[m+h]
+
),壳五糖m/z=824.3619[m+h]
+
),设置选择扫描参数为:壳二糖:340.1545~342.1545,壳三糖:501.2233~503.2233,壳四糖:662.2931~664.2931,壳五糖:823.3619~825.3619;分辨率为70000;鞘气流速为40arb,混合气流速10arb,混合气加热温度350℃,离子源温度320℃,正离子喷雾电压3.5kv,s
‑
lens rf为电压50v,离子源和碰撞气都为高纯氮气。
[0143]
5、在正离子模式选择离子扫描模式下进行lc
‑
ms分析,测定盲肠内容物中壳四糖的含量,壳四糖用于定量分析的离子为m/z=663.2931([m+h]
+
)(离子偏差<6
×
10
‑6),壳四糖在盲肠内容物中的色谱图见图7,图7可以说明壳四糖在正离子选择离子扫描模式下能得到清晰且峰形良好的色谱信号。
[0144]
6、在空白盲肠内容物中壳四糖的标准曲线方程:y=1000000x
‑
371077,r2=0.9975,如图8所示(其中,横坐标为壳四糖在盲肠内容物匀浆中的浓度,单位为ug/ml,纵坐标为壳四糖的峰面积);图8表明采用本方法定量分析得到的壳四糖在盲肠内容物样品中的线性关系良好。
[0145]
标曲中浓度为壳四糖在大鼠盲肠结内容物匀浆中的浓度,盲肠结内容物匀浆由100mg盲肠结内容物(体积约100ul)加500ul生理盐水后匀浆制得,因此盲肠结内容物中浓度为盲肠结内容物匀浆中浓度的6倍。壳四糖灌胃后大鼠盲肠结内容物匀浆中壳四糖含量具体结果见表4。
[0146]
表4盲肠内容物中壳四糖的含量
[0147][0148]
实施例5
[0149]
一种基于lc
‑
ms对生物样品中壳寡糖的检测分析方法,该方法用来分析壳五糖灌胃大鼠后盲肠内容物中壳五糖的含量,及生物样品为盲肠内容物。具体步骤入下:
[0150]
1、给药取盲肠内容物
[0151]
8周龄雄性wistar大鼠(230
±
10g),七天适应性喂养后灌胃壳五糖溶液,于5h断颈处死大鼠(n=3),解剖取盲肠内容物。
[0152]
2、盲肠内容物样品处理方法
[0153]
准确称取100mg盲肠内容物于ep管中,加入2粒预冷研磨珠和500ul预冷生理盐水,组织研磨仪60hz研磨120s。随后3200rpm涡旋30s,于
‑
20℃静置10min后,冰水浴以300w功率超声10min。于
‑
20℃静置10min后,4000rpm离心10min。取上清100ul,加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm涡旋混匀30s,随后
‑
20℃静置10min,取出后13000rpm离心10min。取上清200ul过0.22um滤膜后装入液相小瓶待检测。
[0154]
3、标准曲线样品配制方法
[0155]
称取10mg壳五糖(购自上海源叶生物科技有限公司)溶于1ml超纯水中,得到浓度为10mg/ml的壳五糖储备液,用超纯水稀释成5mg/ml的壳五糖工作液,避光储存于4℃冰箱中,备用。将壳五糖工作液用超纯水稀释成为系列标准溶液,壳五糖的浓度范围为20
‑
1280ug/ml(具体为20ug/ml、40ug/ml、80ug/ml、160ug/ml、320ug/ml、640ug/ml、1280ug/ml),分别取5ul标准溶液加入95ul盲肠内容物匀浆上清液中,3200rpm涡旋30s混匀,得到浓度范围为1
‑
64ug/ml的加标盲肠内容物样品(具体为1ug/ml、2ug/ml、4ug/ml、8ug/ml、16ug/ml、32ug/ml、64ug/ml、)。随后加入300ul甲醇
‑
乙腈(v/v=1∶1)溶剂,3200rpm剧烈涡旋30s混匀,
‑
20℃静置15min,随后4℃13000rpm下离心10min,取上清液200ul,过0.22um滤膜后装入带内插管的液相小瓶中,对滤液进行上机检测(检测参数在下文),得到如图11中d所示的色谱图。
[0156]
4、技术条件:
[0157]
色谱条件:waters acquity uplc glycan beh amide色谱柱,2.1
×
100mm,1.7um;柱温:45℃;进样量为2ul;流速为0.2ml/min;流动相a:含0.1%(v/v)氨水的水,b:含0.1%(v/v)氨水的乙腈;洗脱梯度为:
[0158][0159]
质谱条件:电喷雾电离离子源(esi),正离子扫描模式;选择离子扫描模式(sim)(具体为壳二糖m/z=341.1545[m+h]
+
,壳三糖m/z=502.2243[m+h]
+
,壳四糖m/z=663.1931[m+h]
+
),壳五糖m/z=824.3619[m+h]
+
),设置选择扫描参数为:壳二糖:340.1545~342.1545,壳三糖:501.2233~503.2233,壳四糖:662.2931~664.2931,壳五糖:823.3619~825.3619;分辨率为70000;鞘气流速为40arb,混合气流速10arb,混合气加热温度350℃,离子源温度320℃,正离子喷雾电压3.5kv,s
‑
lens rf为电压50v,离子源和碰撞气都为高纯氮气。
[0160]
5、在正离子模式选择离子扫描模式下进行lc
‑
ms分析,测定盲肠内容物中壳五糖的含量,壳五糖用于定量分析的离子为m/z=824.3619([m+h]
+
)(离子偏差<6
×
10
‑6),壳五糖在盲肠内容物中的色谱图见图9,图9可以说明壳五糖在正离子选择离子扫描模式下能得到清晰且峰形良好的色谱信号。
[0161]
6、在空白盲肠内容物中壳五糖的标准曲线方程:y=569254x
‑
1000000,r2=0.9991,如图10所示(其中,横坐标为壳五糖在盲肠内容物匀浆中的浓度,单位为ug/ml,纵坐标为壳五糖的峰面积);图10表明采用本方法定量分析得到的壳五糖在盲肠内容物样品中的线性关系良好。
[0162]
标曲中浓度为壳五糖在大鼠盲肠内容物匀浆中的浓度,盲肠内容物匀浆由100mg盲肠内容物(体积约为100ul)加500ul生理盐水后匀浆制得,因此盲肠内容物中浓度为盲肠内容物匀浆中浓度的6倍。壳五糖灌胃后大鼠盲肠内容物匀浆中壳五糖含量具体结果见表5。
[0163]
表5盲肠内容物中壳五糖的含量
[0164][0165]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1