基于无金属光ATRP信号放大策略的电致化学发光肺癌检测试剂盒及使用方法和应用
基于无金属光atrp信号放大策略的电致化学发光肺癌检测试剂盒及使用方法和应用
技术领域
1.本发明涉及一种基于无金属光诱导原子转移自由基聚合(photo-atrp)信号放大策略的电致化学发光肺癌检测试剂盒及使用方法和应用,属于生物分析技术领域。
背景技术:
2.cyfra21-1被认为是一种主要用于检测肺癌的肿瘤标记物,尤其对非小细胞肺癌(non-small cell lung cancer,nsclc)的诊断具有重要价值。如果肺部存在不清晰的环形阴影,同时血清cyfra21-1浓度》30ng/ml,原发性支气管肺癌的可能性非常高。cyfra21-1对各类非小细胞肺癌阳性检出率为70%~85%。cyfra21-1的血清浓度水平高低与肿瘤临床分期正相关,也可作为肺癌手术和放化疗后追踪早期复发的有效指标。因此,cyfra21-1检测对nsclc的临床诊断具有重要意义。目前已经报道了几种检测cyfra21-1的方法:酶联免疫吸附测定(elisa)、放射免疫测定(ria)、化学发光免疫测定和化学发光酶免疫测定等。但是,在检测过程中仍存在假阳性、耗时长、需要专门仪器和专业的操作人员等缺点。
3.利用链式杂交反应、滚轮扩增反应、纳米材料和聚合反应等信号放大技术可以提高传感器的检测性能。其中,原子转移自由基聚合反应(atrp)具有单体原料广泛,聚合反应可控等优点而广泛应用于生物传感领域。但是,传统atrp反应由于聚合速度较慢,需要加入大量的重金属(例如铜)离子作为催化剂,重金属离子具有一定的生物毒性,需要繁琐的去除和回收过程,而且重金属离子自带的颜色会干扰传感器的检测结果。与传统金属催化剂相比,光诱导atrp具有以下优点:1)无需添加重金属催化剂;2)反应条件温和;3)光诱导聚合过程可控。因此研究一种基于光atrp信号放大策略的cyfra21-1检测的超灵敏电化学传感平台具有重要意义。
技术实现要素:
4.针对现有技术的不足,本发明的目的是提供一种基于无金属光诱导原子转移自由基聚合(photo-atrp)信号放大策略的电致化学发光肺癌检测试剂盒及使用方法和应用,避免了传统atrp反应中重金属离子催化剂的使用,且信号得到成倍的放大,提高检测的灵敏度,稳定性和重现性。
5.为了实现上述目的,本发明的技术方案之一是:
6.一种基于无金属光atrp信号放大策略的电致化学发光肺癌检测试剂盒,包括以下原料:bmp、金电极、mpa、edc、nhs、ab1、bsa、ab2、me6tren、ey、nas、鲁米诺、超纯水、h2o2、dmso、乙醇。
7.进一步,部分原料使用时需配制成溶液,其中,bmp溶液的浓度为3mm,mpa溶液的浓度为10mm,用于活化bmp的nhs溶液的浓度为3mm,edc溶液的浓度为3mm,用于活化mpa的edc和nhs混合溶液中edc和nhs的浓度分别为0.2m和0.05m,ab1溶液的浓度为1μg/ml,bsa溶液的浓度为1%,ab2溶液的浓度为1μg/ml,me6tren溶液的浓度为10mm,ey溶液的浓度为5mm,
nas溶液的浓度为12mm,鲁米诺溶液的浓度为15mm。
8.本发明的技术方案之一是:一种电致化学发光肺癌检测试剂盒的使用方法,包括以下步骤:
9.(1)ab2-bmp(ab2*)合成
10.①
将bmp溶解在乙醇溶液中,得到bmp溶液;
11.②
在bmp溶液中加入nhs溶液和edc溶液,搅拌,得到羧基活化的bmp溶液;
12.③
将羧基活化的bmp溶液加入到ab2溶液中,搅拌,得到ab2*溶液;
13.(2)电极预处理
14.裸金电极进行打磨获得抛光镜面;
15.(3)电极修饰
16.①
将预处理的电极在mpa溶液中浸泡,洗涤,吹干;
17.②
将步骤
①
的电极在edc和nhs混合溶液中浸泡;
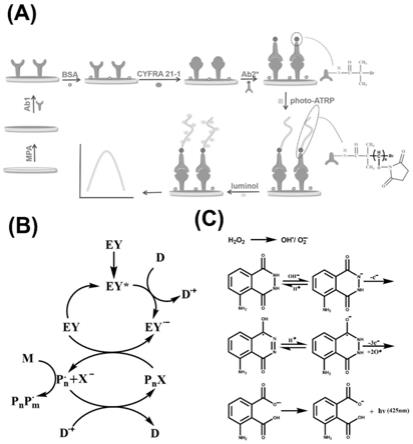
18.③
将ab1溶液直接滴到步骤
②
的电极表面,反应,然后在bsa溶液中浸泡;
19.④
将待测样品滴到步骤
③
的电极表面,反应,洗涤;
20.⑤
将ab2*溶液滴到步骤
④
的电极表面,反应;
21.⑥
将步骤
⑤
的电极放置在me6tren溶液、ey溶液、nas溶液、h2o和dmso组成的混合溶液中,反应;
22.⑦
将步骤
⑥
的电极放置在鲁米诺溶液中,反应;
23.⑧
将步骤
⑦
的电极放置在h2o2中测量鲁米诺的发光强度。
24.进一步,步骤(1)中乙醇溶液的浓度为50%~80%(v/v);bmp溶液、nhs溶液和edc溶液的体积比为1:1:1;羧基活化的bmp溶液的浓度为1mm,ab2溶液的浓度为1μg/ml,羧基活化的bmp溶液和ab2溶液的体积比为1:1。
25.进一步,步骤(1)中的搅拌温度为37℃,时间为1~3h。
26.进一步,步骤(2)中
①
的浸泡温度为37℃,时间为2~8h;
②
的浸泡温度为37℃,时间为1~2h;
③
的反应温度为37℃,时间为1~3h;
④
的反应温度为37℃,时间为1~3h;
⑤
的反应温度为37℃,时间为1~3h;
⑥
的反应条件为室温,470nm光照射,2~5h;
⑦
的反应温度为37℃,1~3h。
27.进一步,me6tren溶液、ey溶液、nas溶液、h2o和dmso的体积比为5:5:1000:5000:3990。
28.本发明的技术方案之一是:一种上述检测试剂盒在cyfra21-1检测中的应用。
29.本发明的技术方案之一是:一种上述检测试剂盒在肺癌检测中的应用。
30.本发明检测方法原理示意图如图1所示。
31.本发明采用photo-atrp和ecl信号放大策略。首先,将mpa探针通过自组装的极性共价键连接到电极表面,将ab1通过氨基缩合反应作为捕获探针连接到电极表面。用牛血清白蛋白(bsa)关闭残余结合位点后,通过抗原与抗体的相互作用,将cyfr21-1和ab2
*
依次连在金电极表面。bmp中的溴基被nas的双键识别,通过photo-atrp将一定数量的nas接枝到电极表面。photo-atrp的单体nas可以为发光材料鲁米诺提供许多结合位点,从而明显地放大了ecl信号。最后,许多鲁米诺分子通过氨基缩合反应与大量的nas紧密相连。
32.无金属光atrp过程以bmp为引发剂、ey为催化剂、me6tren为配体,在470nm光照射
下进行了nas的聚合。还原猝灭途径在特定波长的蓝光激发下开始,随着光子的吸收,电子从基态(ey)过渡到激发态(ey
*
)。之后,ey
*
在剥夺电子供体(d,me6tren)的同时产生ey
·-和d
·
+
,同时产生d
·
+
。基于三种催化剂(ey、ey
*
和ey
·-),建立了一个可逆循环来调节photo-atrp的还原和猝灭途径。激活photo-atrp的引发剂(bmp),同时产生初级自由基(po
·
)、卤素原子(x-)和ey。通过单体双键,启动自由基加成反应,进行链转移,产生聚合链,达到活化/失活平衡。通过上述还原猝灭反应,将大量的单体接枝到电极表面。然后,将单体与鲁米诺结合进行ecl检测。过氧化氢在鲁米诺ecl反应中是一种有效的共反应物,它倾向于分解为超氧自由基(oh
·
)和超氧阴离子自由基(o2·-)。在施加一定的电压下,鲁米诺和共反应物过氧化氢同时被氧化,然后过氧化氢迅速分解生成高能自由基中间体,参与鲁米诺的氧化反应,使鲁米诺成为激发态,后鲁米诺从激发态回到基态同时产生相应波长的光。
33.本发明利用无金属光诱导原子转移自由基聚合(photo-atrp)策略,避免了目前常用信号放大策略中的纳米材料和生物酶(易受到外界环境和温度影响等)的使用,信号得到成倍的放大,提高检测的灵敏度,稳定性和重现性。
34.本发明采用无金属光诱导原子转移自由基聚合(photo-atrp)策略,避免了传统atrp反应中重金属离子催化剂的使用,不需要对重金属离子进行回收和去除,克服了重金属离子固有的颜色对检测结果的干扰,且不会产生生物毒性,更加环保。
附图说明
35.图1为本发明检测方法的原理示意图。
36.图2a为不同条件下的电致化学发光强度。其中,曲线a为不含mpa,曲线b为不含ab1,曲线c为不含cyfra 21-1,曲线d为不含ab2*,曲线e为不含nas,曲线f为没有光照,曲线g为不含ey,曲线h为不含me6tren,曲线i为鲁米诺/nas/ab2*/cyfra 21-1/ab1/mpa/au。
37.图2b为从裸金电极每个步骤修饰后电极(曲线a
→
h)的阻抗曲线的演化过程,插图是eis的等效电路图。rs为溶液电阻,cpe为恒相元件,zw为warburg阻抗和r
ct
是电荷转移电阻。
38.图2c为从裸金电极每个步骤修饰后电极(曲线a
→
h)的cv曲线。
39.图3为电极表面修饰nas前后的原子力显微镜照片。其中,a为修饰nas前,b为修饰nas后。
40.图4为不同修饰状态电极表面的接触角照片。其中,a为photo-atrp前,b为photo-atrp后的。
41.图5为photo-atrp反应时间的优化(a),nas浓度的优化(b),鲁米诺反应时间的优化(c),鲁米诺浓度的优化(d)。
42.图6为电致化学发光(ecl)强度与cyfra 21-1浓度的关系图(a)以及相应的线性相关曲线(b)。
43.图7a为10pg/ml cyfra 21-1以及相同浓度的bsa、cea、ctni在相同检测条件下的电致发光强度对比图。
44.图7b为pbs和10%血清样本中不同浓度cyfra21-1的信号强度。
(10mm,pbs缓冲液ph=7.4)中,利用mpi-e型电致化学发光检测仪,测量鲁米诺的发光强度。
66.实施例3、可行性验证
67.为了证明建立本发明检测方法的可行性,进行了9组空白对照实验并记录了ecl(增强化学发光法)反应。如图2a所示,在没有mpa(曲线a)、ab1(曲线b)、cyfra 21-1(曲线c)、ab2*(曲线d)、nas(曲线e)、光照(曲线f)、ey(曲线g)、me6tren(曲线h)或鲁米诺(曲线i)的情况下,ecl信号均很弱,而完全修饰后的电极会明显观察到显著的ecl响应(曲线j),综上所述,以上实验结果表明每步修饰物存在的必要性以及该方法检测cyfra 21-1的可行性。
68.实施例4、表征
69.电化学阻抗谱(eis)可以灵敏地监测从电极表面到电解质的微观变化,用于验证电极修饰的每个步骤。如图2b所示,当电极未改性时,r
ct
相对较低(~240ω);当小分子mpa与金电极结合后,r
ct
增加(~401ω),在电极表面形成一层薄膜;在ab1、bsa、cyfra21-1和ab2*修饰后,r
ct
持续上升,这与蛋白质大分子结构使之前形成的膜不断增厚有关。经过photo-atrp后,r
ct
显著增加(~5726ω),这是大量nas成功接枝到引发剂上形成聚合物链的结果。最后,当最后一步完成时,r
ct
进一步增加(~6875ω),是由于鲁米诺的连接增加了空间电阻。这些结果表明,本发明每个连接都是成功的。
70.采用循环伏安法(cv)监测电极每个固定步骤的表面特征(图2c)。当mpa通过自组装连接到裸电极上时,峰值电流较裸金电极降低。此外,在电极表面依次修饰ab1、bsa、cyfra21-1、ab2*、nas、鲁米诺时,峰值电流依次下降,与上述eis结果一致。结果表明,本发明全电极的制备是成功的。
71.通过原子力显微镜(afm)和水接触角(wca)对电极表面进行了表征。修饰nas前后电极表面厚度分别为12.2nm和30.5nm,说明photo-atrp反应成功(图3)。电极表面的润湿性随反应变化而变化,因此,可以用wca来进行表征(图4)。图4a聚合反应发生前其wca为96.6
°
,图4b聚合后其wca为99.9
°
。这些表征结果说明本发明全电极构建成功。
72.实施例5、检测条件优化
73.为了提高检测的灵敏度,本发明研究了photo-atrp反应时间和nas浓度以及鲁米诺的反应时间和浓度对反应的影响。
74.(1)photo-atrp反应时间的优化
75.图5a显示ecl信号在前150min内随反应时间几乎呈线性增加。逐渐地,增长速度减慢,最终在180min后达到零。这是由于电子转移效率差或自由基终止的影响。因此,photo-atrp的最佳反应聚合时间为180min。
76.(2)nas浓度优化
77.图5b显示了nas浓度和发光强度的变化,电致发光信号随浓度逐渐增加并在12mm时达到最大值,证实nas已饱和。因此,选择12mm作为nas的最佳浓度。
78.(3)鲁米诺的反应时间和浓度
79.如图5c所示,电致发光信号在60min内随着鲁米诺的反应时间逐渐增加,并在90min的时候停止增长。因此,鲁米诺反应的最佳时间选择为90min。图5d显示了电致发光信号随着鲁米诺浓度在15mm内的增加而增加。随后,随着鲁米诺浓度的进一步增加,电致发光信号逐渐趋于平稳。因此,在实验中鲁米诺的浓度设置为15mm。
80.实施例6、分析性能
81.在最佳条件下,通过ecl评估了cyfra 21-1检测试剂盒的检测限(lod)和线性响应范围。如图6a所示,当cyfra 21-1的浓度在10fg/ml-1ng/ml的区间内时,ecl信号线性增加。图6b进一步显示i
ecl
的对数值与cyfra 21-1浓度之间呈正相关。相应的线性方程为i=1458log(c
cyfra 21-1
/pg ml-1
)+3320(r2=0.9914),计算的lod为5.8fg/ml(s/n=3)。
82.与其他几种方法相比,本发明所提出的方法检测cyfra 21-1,由于ecl的灵敏度和无金属光atrp信号放大的优势相结合,具有相对较低的检测限(下表)。这表明本发明试剂盒在肺癌的早期检测中具有潜在的应用价值。
[0083][0084]
实施例7:电致发光传感器的选择性、抗干扰能力和稳定性
[0085]
为了验证该信号放大方法的选择性,本发明选择不同的检测物质,包括心肌肌钙蛋白i(ctni、10pg/ml)、癌胚抗原(cea、10pg/ml)和bsa(10pg/ml),在相同的实验条件下(cyfra 21-1、10pg/ml)进行选择性试验。由图7可知,bsa、cea和ctni的光信号强度分别为cyfra21-1的6.16%、6.78%和9.61%。因为电极上的ab1可以被cyfra21-1特异性识别,这使得ab1可以被识别并与cyfra21-1结合。这导致了实验中不同抗原与ab1结合效率的差异,表明本发明方法能够有效区分cyfra21-1。
[0086]
为了验证该信号放大方法的稳定性,本发明选择了5个修饰完全的电极(鲁米诺/nas/ab2*/cyfra 21-1/ab1/mpa/au)并保存在4℃的冰箱中。三周后,ecl信号的强度可达到初始信号的91%左右。这些结果表明,该电极(鲁米诺/nas/ab2*/cyfra21-1/ab1/mpa/au)在存储过程中具有良好的稳定性。
[0087]
为了检测试剂盒的抗干扰作用,采用ecl检测pbs和10%血清样本中不同浓度的cyfra21-1(1ng/ml、10pg/ml、100fg/ml)。如图7b所示,在10%血清样本中1ng/ml、10pg/ml、100fg/ml cyfra21-1的信号强度分别为在pbs中的96.89%、96.28%和82.63%。这些结果表明,本发明方法在复杂患者血清中具有良好的抗干扰能力,具有显著的临床应用潜力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1