一种化妆品内抗感染类药物的测定方法与流程
1.本发明涉及化妆品成分测定技术领域,尤其涉及一种化妆品内抗感染类药物的测定方法。
背景技术:
2.青春痘也称痤疮、粉刺,是一种发生在人体毛囊皮脂腺及其周围组织的炎症性病变,为消除痤疮,消费者通常会购买使用一些宣称具有祛痘/抗粉刺效果的化妆品。然而部分厂家为了追求快速杀菌及祛痘的良好效果,可能会在祛痘类化妆品中非法添加抗感染类药物。已有研究表明,抗感染类药物具有细胞诱变性和动物致癌毒性,长期使用抗感染药物会引起严重的后果,可能会诱发人体菌群失调,造成接触性皮炎等过敏现象,严重时会造成内脏损伤、细菌基因结构发生突变和产生耐药性。
3.目前化妆品中非法添加抗感染类药物的检测方法主要有高效液相色谱(hplc)二极管阵列检测器法、气相色谱法(gc)、气相色谱-串联质谱法(gc-ms/ms)和高效液相色谱-串联质谱法(lc-ms/ms)等,测定种类偏少,未涵盖某些临床常用药物,且前处理方法过于简单,容易产生假阳性结果。化妆品基质复杂,需对不同基质类型的化妆品建立相应的前处理方法以减少干扰,提高测定准确度。基于此,我们提出了一种化妆品内抗感染类药物的测定方法。
技术实现要素:
4.本发明的目的是为了解决现有技术中存在的缺点,而提出的一种化妆品内抗感染类药物的测定方法。
5.为了实现上述目的,本发明采用了如下技术方案:
6.一种化妆品内抗感染类药物的测定方法,包括如下步骤:
7.s1:准备测定材料和测定仪器;
8.s2:配制测定标准溶液;
9.s3:制备测定3种空白基质溶液;
10.s4:确定仪器测定参考条件:色谱条件和质谱条件;
11.s5:采用qc样品进行参数验证;
12.s6:样品测定:对化妆品中抗感染类药物进行筛查;
13.s7:计算并建立数据库:建立化妆品中可能添加的抗感染类药物的化合物库。
14.进一步地,所述测定物质为易在祛痘/抗粉刺类化妆品中添加的抗感染类药物;
15.所述测定仪器包括1920lc泵、采样器、配备液相色谱仪/高分辨率的质谱仪(q-tof质谱仪、),配有双ajsesi源,正、负离子模式,采用masshunter工作站软件进行数据采集和处理,并进行定性和定量分析、采用p300h型超声波清洗机进行超声处理。
16.进一步地,所述测定标准溶液的配制方法为采用甲醇制备各标准储备液(0.5mg/ml),储存在-20℃暗处。
17.进一步地,所述测定3种空白基质溶液包括水剂类空白基质、乳液剂类空白基质和膏霜剂类空白基质;
18.所述水剂类空白基质和乳液剂类空白基质的制备方法,包括以下内容:
19.a1:取0.2g样品,置于15ml离心管中,加入3ml饱和氯化钠溶液,涡旋30s分散均匀;
20.a2:再加入含0.5%甲酸的乙腈溶液10ml,涡旋30s后超声提取30min,涡旋混合摇匀;
21.a3:于0℃温度环境下以8000r/min冷冻离心5min,收集上清液a,将上清液a过0.22μm有机滤膜后,即得待测定溶液。
22.进一步地,所述膏霜剂类空白基质的制备方法,包括以下内容:
23.b1:取0.2g样品,置于50ml离心管中,加入3ml饱和氯化钠溶液,涡旋30s分散均匀;
24.b2:再加入含0.1%甲酸的乙腈溶液25ml,涡旋30s后超声提取30min,涡旋混合摇匀;
25.b3:于0℃温度环境下以8000r/min冷冻离心5min,收集上清液b;
26.b4:向上清液b中加入4ml正己烷溶液后,充分振荡摇匀得到混合液a;
27.b5:将混合液a于0℃温度环境下以8000r/min冷冻离心5min,收集下层溶液,并将之过0.22μm有机滤膜,即得待测定溶液。
28.进一步地,所述色谱条件包括以下内容:
29.①
色谱柱为agilenteclipseplusc18柱(100mm
×
2.1mm,1.8μm);
30.②
采用二元流动相,流动相a为ph4.0的5mmol/l乙酸铵缓冲溶液,流动相b为含0.1%甲酸的乙腈;
31.③
梯度洗脱:0.0-14.0min(a:95-40%,b:5-60%),14.0-14.1min(a:40-5%,b:60-95%),14.1-17.0min(a:5%,b:95%),17.0-17.1min(a:5-95%,b:95-5%),1 7.1-2 0.0m i n(a:9 5%,b:5%);
32.④
流动相流速为0.2ml/min,进样量为1μl,柱温为30℃,进样盘温度为10℃。
33.进一步地,所述质谱条件包括以下内容:
34.1)在ms扫描模式及目标ms/ms模式下,质谱的质量范围均为m/z50-800;
35.2)毛细管电压、雾化气体和碎裂电压依次设置为3.5kv、45psi和380v;
36.3)干燥温度为350℃,干燥气流速为8l/min,鞘气温度为350℃,鞘气流量为11l/min;
37.4)采用碰撞诱导离解(cid)碰撞,将碰撞能(ce)设为10、20、40ev;
38.5)q-tof质谱仪的参比离子分别为正离子模式:m/z121.0509和m/z922.0098和负离子模式:m/z112.9856和m/z1033.9881。
39.进一步地,所述验证参数包括选择性、校准曲线、准确度和精密度、基质效应、回收率和稳定性。
40.本发明的有益效果为:
41.1.本发明采用飞行时间扫描质谱法,根据保留时间(rt)和碎片离子精确质量,筛选出疑似阳性样品;然后通过与建立的数据库中参考样品的特征片段进行比较,进一步识别出疑似阳性样品;通过ms/ms模式,对于新的类似化合物,其结构可以由所建立的化合物库中的特征片段离子来估计,分子式可由精确且快速地直接推导出来,较为方便,通过建立
并验证了一种化妆品内添加抗感染类药物的测定方法,准确度较高,且检测范围广。
42.2.本发明的提取溶剂选用甲酸乙腈,可有效提高目标化合物的离子化效率;采用正己烷溶液进行净化,可有效提高定性和定量分析的准确性,减少膏霜剂类中的基质干扰;流动相中加入0.1%甲酸和0.5mol/l乙酸铵可有效促进正离子模式下的离子化效率,以获得较好的响应和更好的峰形。
43.3.本发明能够同时对大范围添加的化合物进行鉴定、确证和定量,具有较高的选择性、准确度和精密度,测定方法的建立在一定程度上扩大了可能添加的抗感染类药物的检测范围,对保障化妆品质量安全、保护消费者健康具有重要的现实意义。
44.4.本发明以膏霜剂、乳剂、水剂3种空白基质溶液为研究对象,制备了37种化合物的3种浓度水平(低、中、高)的qc样品进行检测限、定量限、准确度和精密度、回收率和稳定性等方面的测定,结果表明,q-tof质量误差在1.86ppm以下,具有较高的质量精度;所有测定系数(r2)均大于0.9953,线性关系良好;检测限与定量下限分别在0.0001~0.1085μg/g和0.0004~0.3618μg/g的范围内;平均准确度为70.8%~122.8%,日内和日间精密度低于15%,测定方法较为准确可靠;提取回收率在70.1%~117.7%之间,标准差小于10.9%,可为不同样品中绝大多数分析物提供优秀的提取效率;绝对基质效应为60.2%~136.1%,相对基质效应范围为0.9%~21.9%,使用基质匹配曲线以减少基质诱导的信号抑制或增强;稳定性为0.5%~12.6%,所有化合物在10℃自动进样器中保存24小时均稳定。
附图说明
45.图1为本发明提出的一种化妆品内抗感染类药物的测定方法的流程示意图;
46.图2为本发明提出的空白基质中前14个化合物代表性提取离子色谱图;
47.图3为本发明提出的空白基质中中14个化合物代表性提取离子色谱图;
48.图4为本发明提出的空白基质中后9个化合物代表性提取离子色谱图;
49.图5为本发明提出的标准溶液中前14个化合物代表性提取离子色谱图;
50.图6为本发明提出的标准溶液中中14个化合物代表性提取离子色谱图;
51.图7为本发明提出的标准溶液中后9个化合物代表性提取离子色谱图;
52.图8为本发明提出的一种化妆品内抗感染类药物的测定方法中阳性样品的提取离子色谱图。
具体实施方式
53.下面结合具体实施方式对本专利的技术方案作进一步详细地说明。
54.下面详细描述本专利的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本专利,而不能理解为对本专利的限制。
55.实施例1:
56.一种化妆品内抗感染类药物的测定方法,如图1-7所示,包括如下步骤:
57.s1:准备测定材料和测定仪器;
58.s2:配制测定标准溶液;
59.s3:制备测定3种空白基质溶液;
60.s4:确定仪器测定参考条件:色谱条件和质谱条件;
61.s5:采用qc样品进行参数验证;
62.s6:样品测定:对化妆品中37种抗感染类药物进行筛查;
63.s7:计算并建立数据库:建立化妆品中可能添加的37种抗感染类药物的化合物库。
64.所述测定物质包括可能在祛痘/抗粉刺类化妆品中添加的37种抗感染类药物;
65.优选的,所述37种抗感染类药物包括甲硝唑(100%)、磺胺吡啶(100%)、磺胺甲噻二唑(99.7%)、磺胺甲噁唑(99.8%)、沙拉沙星(100%)、培氟沙星(71.3%)、氟罗沙星(99.2%)、盐酸莫西沙星(98%)、环丙沙星(83.1%)、恩诺沙星(100%)、林可霉素(87.7%)、克林霉素(87.2%)、克林霉素磷酸酯(82.7%)、四环素(100%)、土霉素(88.8%)、金霉素(94.1%)、阿奇霉素(94.3%)、氯霉素(99.2%)、灰黄霉素(99%)、氯霉素二醇物(99.5%)、吡哌酸(84.3%)、磺胺二甲嘧啶(100%)、替硝唑(99.8%)、洛美沙星(90.4%)、硝酸益康唑(99.6%)、司帕沙星(99.4%)、盐酸萘替芬(100%)、硝酸咪康唑(99.6%)、磺胺甲氧哒嗪(98%)、联苯苄唑(99%)、磺胺多辛(98%)、磺胺二甲氧嘧啶(100%)、磺胺氯哒嗪(98%)、磺胺甲基嘧啶(99%)、螺内酯(100%)、磺胺间甲氧嘧啶(93%)和那氟沙星(98%),其中,甲硝唑(100%)、磺胺吡啶(100%)、磺胺甲噻二唑(99.7%)、磺胺甲噁唑(99.8%)、沙拉沙星(100%)、培氟沙星(71.3%)、氟罗沙星(99.2%)、盐酸莫西沙星(98%)、环丙沙星(83.1%)、恩诺沙星(100%)、林可霉素(87.7%)、克林霉素(87.2%)、克林霉素磷酸酯(82.7%)、四环素(100%)、土霉素(88.8%)、金霉素(94.1%)、阿奇霉素(94.3%)、氯霉素(99.2%)、灰黄霉素(99%)、氯霉素二醇物(99.5%)、吡哌酸(84.3%)、磺胺二甲嘧啶(100%)、替硝唑(99.8%)、洛美沙星(90.4%)、硝酸益康唑(99.6%)、司帕沙星(99.4%)、盐酸萘替芬(100%)、硝酸咪康唑(99.6%)购自中国食品药品检定研究院,磺胺甲氧哒嗪(98%)、联苯苄唑(99%)、磺胺多辛(98%)、磺胺二甲氧嘧啶(100%)购自上海安谱实验科技股份有限公司,磺胺氯哒嗪(98%)购自上海麦克林生化科技有限公司,磺胺甲基嘧啶(99%)购自美国sigma公司,螺内酯(100%)购自多伦多研究化学品公司,磺胺间甲氧嘧啶(93%)购自上海阿拉丁生化技术有限公司,那氟沙星(98%)购自德国dr.ehrenstorfer公司。
66.进一步的,所述测定仪器包括美国安捷伦公司1290超高效液相色谱仪(uhplc)/6545高分辨率(q-tof),配有双ajsesi源,正、负离子模式,采用masshunter工作站软件进行数据采集和处理,并进行定性和定量分析;采用德国埃尔马公司p300h型超声波清洗机进行超声处理。
67.所述测定标准溶液的配制方法为采用甲醇制备各标准储备液(约0.5mg/ml),储存在-20℃暗处,精密吸取各标准储备液适量混合,用甲醇配制成一定浓度的混合对照品储备溶液(1μg/ml)。
68.所述测定3种空白基质溶液包括水剂类空白基质、乳液剂类空白基质和膏霜剂类空白基质,其中,水剂类空白基质和乳液剂类空白基质的制备方法,包括以下内容:
69.a1:取约0.2g样品,置于15ml离心管中,加入3ml饱和氯化钠溶液,涡旋30s分散均匀;
70.a2:再加入含0.5%甲酸的乙腈溶液10ml,涡旋30s后超声提取30min,涡旋混合摇匀;
71.a3:于0℃温度环境下以8000r/min冷冻离心5min,收集上清液a,将上清液a过0.22μm有机滤膜,即得待测定溶液。甲醇与饱和氯化钠溶液互溶,不利于除盐,而乙腈不与饱和氯化钠溶液互溶,且具有沉淀蛋白质的作用,有利于除去样品中蛋白质等杂质,同时在甲酸乙腈中加入一定量的甲酸可提高目标化合物的离子化效率。
72.优选的,所述膏霜剂类空白基质的制备方法,包括以下内容:
73.b1:取约0.2g样品,置于50ml离心管中,加入3ml饱和氯化钠溶液,涡旋30s分散均匀;
74.b2:再加入含0.1%甲酸的乙腈溶液25ml,涡旋30s后超声提取30min,涡旋混合摇匀;
75.b3:于0℃温度环境下以8000r/min冷冻离心5min,收集上清液b;
76.b4:向上清液b中加入4ml正己烷溶液后,充分振荡摇匀得到混合液a;
77.b5:将混合液a于0℃温度环境下以8000r/min冷冻离心5min,收集下层溶液,并将之过0.22μm有机滤膜,即得待测定溶液。采用正己烷溶液进行净化,有效提高定性和定量分析的准确性,以减少基质的干扰。
78.所述色谱条件包括以下内容:
79.①
色谱柱为agilenteclipseplusc18柱(100mm
×
2.1mm,1.8μm);
80.②
采用二元流动相,流动相a为ph4.0的5mmol/l乙酸铵缓冲溶液,流动相b为含0.1%甲酸的乙腈;流动相中加入0.1%甲酸和0.5mol/l乙酸铵可有效促进正离子模式下的离子化效率,以获得较好的响应和更好的峰形。
81.③
梯度洗脱:0.0-14.0min(a:95-40%,b:5-60%),14.0-14.1min(a:40-5%,b:60-95%),14.1-17.0min(a:5%,b:95%),17.0-17.1min(a:5-95%,b:95-5%),1 7.1-2 0.0m i n(a:9 5%,b:5%);
82.④
流动相流速为0.2ml/min,进样量为1μl,柱温为30℃,进样盘温度为10℃。
83.进一步的,所述质谱条件包括以下内容:
84.1)在ms扫描模式及目标ms/ms模式下,质谱的质量范围均为m/z50-800;
85.2)毛细管电压、雾化气体和碎裂电压依次设置为3.5kv、45psi和380v;
86.3)干燥温度为350℃,干燥气流速为8l/min,鞘气温度为350℃,鞘气流量为11l/min;
87.4)采用碰撞诱导离解(cid)碰撞,将碰撞能(ce)设为10、20、40ev;
88.5)q-tof质谱仪的参比离子分别为正离子模式:m/z121.0509和m/z922.0098和负离子模式:m/z112.9856和m/z1033.9881。
89.具体的,选择适用范围较广的电喷雾离子源作为该实验的离子源,采用正、负离子同时扫描分析的方法,在目标ms/ms模式下,同时应用10、20和40ev三种碰撞方法获得碎片离子;
90.氯霉素选择负离子模式,其余目标化物在正离子模式下易形成稳定的[m+h]+分子离子峰,所以选择正离子模式。
[0091]
所述验证参数包括选择性、校准曲线、准确度和精密度、基质效应、回收率和稳定性等方面,以膏霜剂、乳剂、水剂3种空白基质溶液为研究对象,制备了37种化合物的3种浓度水平(低、中、高)的qc样品进行检测限、定量限、准确度和精密度、回收率和稳定性等方面
的测定;
[0092]
所述计算结果表示为平均值
±
标准偏差。
[0093]
本实施例在使用时,首先采用飞行时间扫描质谱法,根据保留时间(rt)和碎片离子精确质量,筛选出疑似阳性样品;然后通过与建立的数据库中参考样品的特征片段进行比较,进一步识别出疑似阳性样品;通过ms/ms模式,对于新的类似化合物,其结构可以由所建立的化合物库中的特征片段离子来估计,可精确且快速地推导出分子式,较为方便。本发明测定方法的建立在一定程度上扩大了可能添加的抗感染类药物的检测范围,对保障化妆品质量安全、保护消费者健康具有重要的现实意义。
[0094]
实施例2:
[0095]
一种化妆品内抗感染类药物的测定方法,如图1-7所示,为了减少基质的干扰,提高测定准确性,本实施例在实施例1的基础上作出以下补充:所述选择性的验证方法,包括以下步骤:
[0096]
aa:分别选取3种具有代表性的膏霜剂类空白基质、乳液剂类空白基质和水剂类空白基质,进样测定;
[0097]
ab:同时在空白样品中添加37种化合物对照品溶液,结果需表明,空白基质中其他成分不干扰上述待测物的测定。
[0098]
优选的,所述校准曲线的验证方法,包括以下步骤:
[0099]
ba:制备测定样品得到各剂型的空白基质溶液,分别取不同体积的混合对照品储备溶液;
[0100]
bb:用各自的空白基质溶液稀释成一系列浓度的基质标准曲线溶液,并按色谱条件和质谱条件进行检测,以每个标准化合物的峰面积为纵坐标(y轴),相应的浓度为横坐标(x轴),绘制膏霜剂、乳剂、水剂三种空白基质的基质标准曲线,即回归方程为y=a+bx。具体的,分别取各剂型的阴性样品约0.2g,加入适量混合对照品储备溶液,按测定空白基质溶液的制备方法制备成空白基质溶液样品,并按色谱条件和质谱条件进样分析,计算信噪比。
[0101]
检测限(lod)和定量下限(lloq)定义为信号-噪声比(s/n),分别为至少3倍和10倍。
[0102]
优选的,所述准确度和精密度的验证为取基质相对复杂的膏霜类进行准确度和精密度评价;
[0103]
进一步优选的,所述准确度的表述为qc样品在3种浓度水平(低、中、高)下测得的平均检出浓度与各分析物的标称浓度之间的关系;且准确度需进行三次重复计算,并以带有标准偏差(sds)的平均值计算;
[0104]
进一步优选的,所述精密度用峰面积相对标准偏差(rsd)表示,对37种化合物在3个浓度水平下6次重复的qc样品进行预处理,通过在同一天重复分析来检查日内精密度,而日间精密度以连续测定3天为准。
[0105]
优选的,所述基质效应包括绝对基质效应和相对基质效应,其中,绝对基质效应的计算方法为将配制好的标准溶液用空白基质溶液和0.1%甲酸乙腈分别稀释至3个浓度水平(低、中、高);通过比较空白基质中每种化合物的峰面积与溶剂中的峰面积来计算绝对基质效应,并以百分比表示;
[0106]
进一步优选的,所述绝对基质效应的计算公式为:绝对基质效应(%)=目标化合
物在基质中的响应/目标化合物在溶剂中的响应
×
100%;
[0107]
进一步优选的,所述相对基质效应(rsd)为使用相对标准差来评估,由在相同浓度下不同类型基质中分析物的峰面积的rsd进行计算。
[0108]
优选的,所述回收率的验证方法为:采用基质匹配标准溶液计算,以减少基质的干扰,提取回收率通过目标物添加到空白基质中测得的含量与目标物直接添加到空白基质溶液中测得的含量进行比较。
[0109]
优选的,所述稳定性的验证方法为:通过重复测定24小时内保存在自动进样盘(10℃)中的回收率项下的各样品溶液来评估,以各目标物峰面积的相对标准偏差进行计算。
[0110]
本实施例在使用时,建立并验证了一种有效的化妆品内添加抗感染类药物的测定方法,准确度较高,检测范围广。
[0111]
对比例1:
[0112]
一、测定实验:在声称具有祛痘/抗粉刺作用的200批化妆品中,对可能添加的37种抗感染类药物进行了鉴定、确证和定量分析。
[0113]
二、测定条件:以5mmol/l乙酸铵溶液,含0.1%甲酸的乙腈为流动相,梯度洗脱,流速为0.2ml/min,质谱分析采用正负esi模式。
[0114]
三、验证数据如下表1-4:所有测定系数(r2)均大于0.9953;其中,lod和lloq值分别在0.0001~0.1085μg/g和0.0004~0.3618μg/g的范围内;准确率在70.8%~122.8%之间;日内和日间准确率分别在0.2%~12.8%和0.7%~13.4%之间;平均回收率能够达到70.1%~117.7%;绝对基质效应为60.2%~136.1%;相对基质效应范围为0.9%~21.9%;在3种浓度水平(低、中、高)下的稳定性结果,rsds为0.5%~12.6%,表明所有的化合物在10℃自动进样器中保存24小时均稳定。
[0115]
四、测定结果(阳性样品结果和色谱图见表5和附图8):通过在ms扫描模式下获取前体离子的精确质量以及分析物的保留时间,用于对疑似阳性样品进行快速、高通量筛选,然后在目标ms/ms模式下获得碎片离子,用于进一步鉴定,比较样品与对照品的保留时间、母离子和碎片离子,判断样品是否含有添加的药物。若样品的质量误差小于5ppm,保留时间误差小于0.35min,同位素比小于5%,在库中得分大于80,则将该样本视为阳性样本。在本次实验中,发现有3批次阳性样品,检出的化学成分涉及甲硝唑、林可霉素、克林霉素、替硝唑和硝酸咪康唑;
[0116]
表1:
[0117]
[0118]
[0119]
[0120]
[0121][0122]
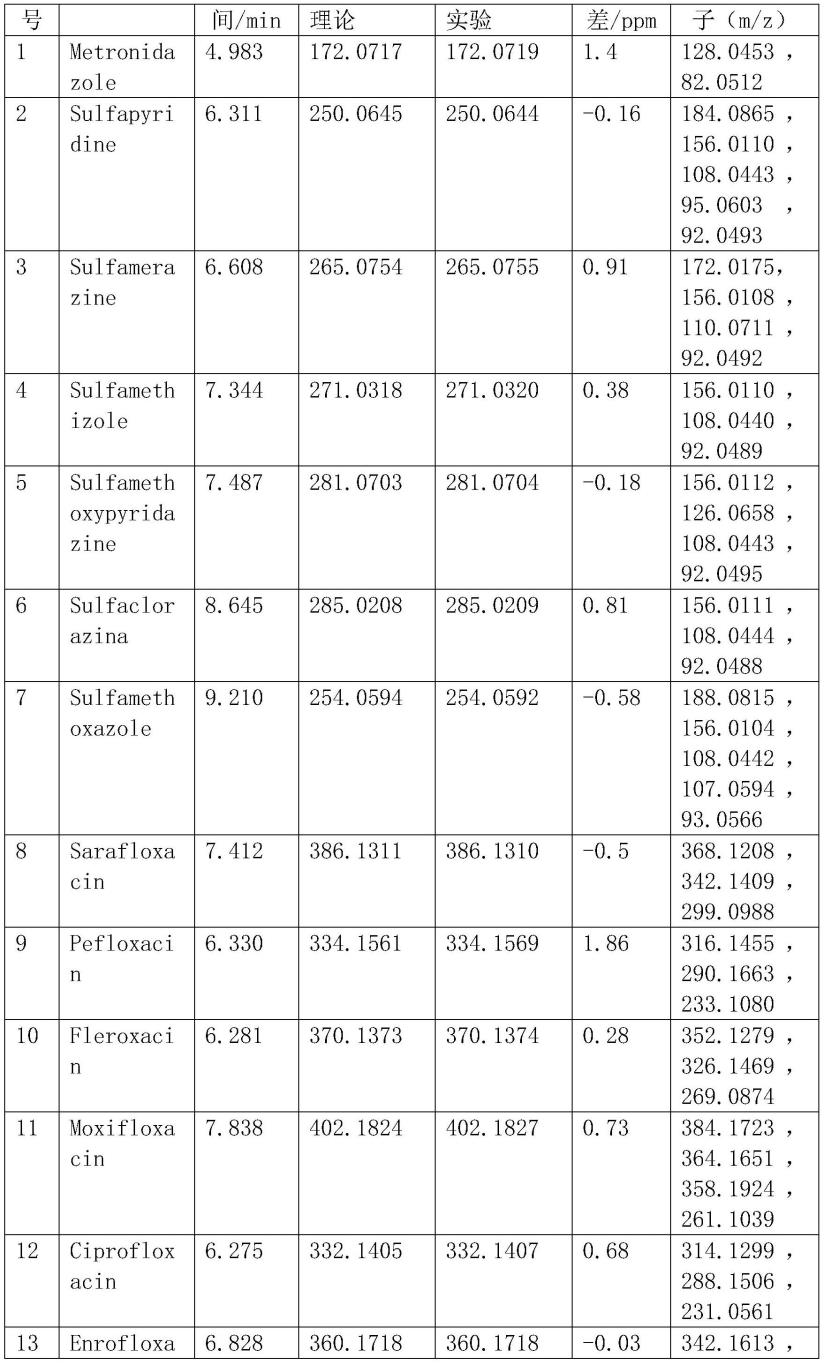
表1为37种化合物的保留时间(rt)、准确的质量、质量误差和主要碎片离子参数。由上可知,37种化合物的质量误差在1.86ppm以下,表明q-tof具有较高的质量精度。
[0123]
表2:
[0124]
[0125]
[0126][0127]
表2为37种化合物的线性范围、相关系数(r2)、lod和lloq参数。由上可知,校准曲线显示出良好的线性关系,所有化合物的r2值均高于0.9953,lod和lloq值的范围为0.0001~0.1085μg/g,0.0004~0.3618μg/g。
[0128]
表3:
[0129]
[0130]
[0131]
[0132]
[0133]
[0134][0135]
表3为37种化合物在3种浓度水平(低、中、高)下进行的准确度和日内、日间精密度、提取回收率分析结果。由上可知,平均准确度为70.8%~122.8%,日内和日间精密度低于15%,表明所建立的测定方法是可靠的,可重现和准确的;提取回收率在70.1%~117.7%之间,标准差小于10.9%,可为不同样品中绝大多数分析物提供优秀的提取效率。
[0136]
表4:
[0137]
[0138]
[0139]
[0140][0141]
表4为37种化合物在3种浓度水平(低、中、高)下进行的绝对基质效应和相对基质效应分析结果。由上可知,3种空白基质的绝对基质效应范围为60.2%~136.1%,相对基质效应范围为0.9%~21.9%(由于在质谱中基质对不同化合物的离子抑制或离子增强作用程度不同,因此不同剂型采用各自的基质匹配标准曲线来考察回收率)。
[0142]
表5:
[0143][0144]
表5为200批次宣称祛痘/抗粉刺化妆品中检出的3批次阳性样品结果。其中,一批样品中同时检出替硝唑和克林霉素,浓度分别为213.3μg/g和415.7μg/g;另一批样品中也同时检出甲硝唑、林可霉素和克林霉素,浓度分别为314μg/g、76.6μg/g和80.9μg/g;一批样品中检出硝酸咪康唑,但浓度较低,为3.18μg/g。
[0145]
本实施例在使用时,开发了一种快速、灵敏和高选择性的uhplc/q-tofhrms方法,用于筛选、鉴定和定量37种可能在声称具有祛痘/抗粉刺作用的化妆品中添加的抗感染类药物,通过对方法验证结果表明,该方法能够同时对大范围添加的化合物进行鉴定、确证和定量,具有较高的选择性、准确度和精密度。不同分析物的lod和lloq分别在0.0001~0.1085μg/g和0.0004~0.3618μg/g范围内,回收率在70.1%~117.7%之间,准确度在70.8%~122.8%之间,日内和日间精密度分别为0.2%~12.8%和0.7%~13.4%。化妆品基质干扰较大,绝对基质效应在60.2%~136.1%之间,因此使用基质匹配曲线以减少基质诱导的信号抑制或增强。
[0146]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1