维生素D及其代谢物的质谱检测用配制品、方法及其应用与流程
维生素d及其代谢物的质谱检测用配制品、方法及其应用
技术领域
1.本发明涉及生物检测技术领域,尤其涉及维生素d及其代谢物的质谱检测用配制品、方法及其应用。
背景技术:
2.目前用于维生素d质谱检测的校准品和质控品多采用处理后人的血清作为空白基质,加入维生素d的标准溶液,再稀释成不同浓度的校准品和质控品,进行临床维生素d检测。此法需对人血进行存储和复杂的前处理过程,才能得到空白基质,耗时费力。也有采用包含多种复杂成分的自配基质,加入维生素d的标准溶液,再稀释成不同浓度的校准品和质控品,进行临床维生素d检测。此法采用的自配基质成分复杂,配制过程繁琐,对配制过程的浓度控制要求较高。
3.本技术旨在建立一种维生素d及其代谢物的质谱检测用配制品以解决上述问题。
技术实现要素:
4.为了实现根据本发明的上述目的和其他优点,本发明的第一个目的是提供一种维生素d及其代谢物的质谱检测用配制品,所述配制品包括校准品和/或质控品,所述校准品或质控品包括:复配基质和选自维生素d及其代谢物中的一种或多种;所述复配基质包括牛血清白蛋白、非离子表面活性剂。
5.优选地,所述非离子表面活性剂为聚乙二醇辛基苯基醚。
6.优选地,所述维生素d包括25-羟基维生素d2、25-羟基维生素d3。
7.优选地,所述25-羟基维生素d2的浓度为2-320ng/ml,25-羟基维生素d3的浓度为2-320ng/ml。
8.本发明的第二个目的是提供一种维生素d及其代谢物的质谱检测用配制品的制备方法,包括以下步骤:
9.第一步:制备复配基质:将牛血清白蛋白、非离子表面活性剂加入到容器中,加入超纯水,得到所需复配基质;
10.第二步:配制维生素d溶液标品:通过甲醇稀释标准品维生素d溶液;
11.第三步:将复配基质与维生素d溶液标品混合。
12.优选地,还包括步骤:将所述第三步的混合物在-60℃低温预冻3小时,升华干燥阶段在-50℃持续30h;解析干燥阶段采用10℃/h升温速率,在30℃下持续7小时,真空压盖,得到冻干粉。
13.优选地,所述第二步中配制维生素d溶液为维生素d的混合溶液,分别采用25-羟基维生素d2、25-羟基维生素d3标准品溶液配制不同浓度的含25-羟基维生素d2和25-羟基维生素d3的混合溶液。
14.优选地,所述第一步中制备复配基质时,通过超声波清洗机进行超声,直至牛血清白蛋白完全溶解。
15.优选地,所述第三步中复配基质和维生素d溶液标品按照9:1的体积比例进行混合。
16.本发明的第三个目的是提供一种如上所述的维生素d及其代谢物的质谱检测用配制品在制备利用质谱检测系统检测维生素d及其代谢物含量的试剂盒中的应用。
17.相比现有技术,本发明的有益效果在于:
18.本发明提供了种维生素d及其代谢物的质谱检测用配制品、制备方法、应用。配制品包括:校准品和/或质控品,所述校准品或质控品包括:复配基质和选自维生素d及其代谢物中的一种或多种;所述复配基质包括牛血清白蛋白、非离子表面活性剂。通过复配基质替代真实血清,在真实样本的液质检测中可以消除基质效应,以提高检测的准确度。
19.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。本发明的具体实施方式由以下实施例及其附图详细给出。
附图说明
20.此处所说明的附图用来提供对本发明的进一步理解,构成本技术的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
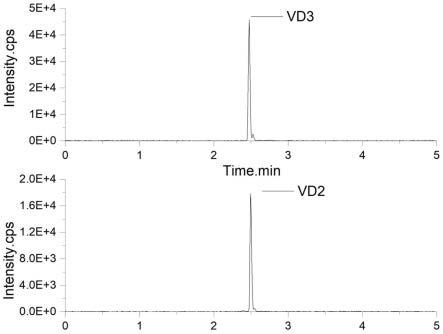
21.图1为本发明在一实施例中的质谱图;
22.图2为本发明在一实施例中的质谱图;
23.图3位本发明在一实施例中的质谱图;
24.图4为本发明在一实施例中的质谱图。
具体实施方式
25.下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
26.下述实施例中,所采用的试剂如下:
27.(1)试剂:
28.标准品25-羟基维生素d2、25-羟基维生素d3均购自西格玛奥德里奇(上海)贸易有限公司;
29.牛血清白蛋白:购自西格玛奥德里奇(上海)贸易有限公司,ph为7,纯度≥98%,
30.甲醇:购自天津康科德科技有限公司,纯度为lc/ms级,常温密封储存;
31.超纯水:密理博纯水机制备的电阻率为18.25mω*cm的超纯水。
32.本发明涉及一种维生素d的质谱检测用配制品,该配制品包括校准品和/或质控品,校准品或质控品包括:复配基质和选自维生素d及其代谢物中的一种或多种;复配基质包括牛血清白蛋白、非离子表面活性剂;其中,牛血清白蛋白为替代血清基质及冻干的保护剂,非离子表面活性剂用于调节牛血清白蛋白水溶液和维生素d标准品的甲醇溶液的互溶性。本发明的复配基质相当于真实血清的替代基质,在真实样本的液质检测中可以消除基质效应,以提高检测的准确度;该用于替代的基质的配方简单、原料来源广泛、价格便宜。
33.在一些实施例中,非离子表面活性剂为聚乙二醇辛基苯基醚,即triton x-100;
tritonx-100相较于其他非离子表面活性剂能够和基质中其它组分复配,保持基质的稳定性,同时还能保持整体校准品和质控品的体系稳定。
34.在一些实施例中,维生素d包括25-羟基维生素d2、25-羟基维生素d3;相较于其他类型的维生素d,维生素d包括25-羟基维生素d2和25-羟基维生素d3作为维生素d的主要代谢物,能够全面反应维生素d在体内的代谢过程。
35.在一些实施例中,25-羟基维生素d2的浓度为2-320ng/ml,25-羟基维生素d3的浓度为2-320ng/ml;该浓度范围宽,完全能够覆盖维生素d的生理及病理检测范围。
36.本发明还涉及一种维生素d及其代谢物的质谱检测用配制品的制备方法,包括以下步骤:
37.第一步:制备复配基质:将牛血清白蛋白、非离子表面活性剂加入到容器中,加入超纯水,得到所需复配基质;
38.第二步:配制维生素d溶液标品:通过甲醇稀释标准品维生素d溶液;
39.第三步:将复配基质与维生素d溶液标品混合。
40.在一些实施例中,为了延长配制品的保质期,方便运输;制备的校准品和质控品采用冻干粉的形式进行保存,稳定性好,延长了校准品和质控品的效期,解决了其在运输和保存过程中的问题。具体地,还包括步骤:将所述第三步的混合物在-60℃低温预冻3小时,升华干燥阶段在-50℃持续30h;解析干燥阶段采用10℃/h升温速率,在30℃下持续7小时,真空压盖,得到冻干粉。
41.在一些实施例中,第二步中配制维生素d溶液为维生素d的混合溶液,分别采用25-羟基维生素d2、25-羟基维生素d3标准品溶液配制不同浓度的含25-羟基维生素d2和25-羟基维生素d3的混合溶液。
42.在一些实施例中,第一步中制备复配基质时,通过超声波清洗机进行超声,直至牛血清白蛋白完全溶解,以保证复配基质的质量。
43.在一些实施例中,第三步中复配基质和维生素d溶液标品按照9:1的体积比例进行混合;相较于其他体积比,该体积比的复配基质、维生素d能够更好的模拟真实血清样本的基质。
44.应当理解,基质指的是样品分析中被分析物以外的组分。lc-ms/ms分析中非目标分析物作为样品中的共流出物,对目标分析物的离子化会产生影响,这些影响和干扰就是基质效应。
45.基质效应主要来源于生物样品的内源性组分,经处理后仍然存在于提取液中。包括离子颗粒物成分(电解质、盐类)、强极性化合物和各种有机化合物(糖类、脂类、肽类及其分析目标物的同类物及其代谢物)。其中林芝是最主要的内源性组分,其对电喷雾电离(esi)和大气压化学电离(apci)均会产生离子抑制作用。含样品处理过程中引入的外源性组分,同样会产生基质效应。
46.本发明自配的复配基质仅含牛血清白蛋白和triton x-100,因而配方成分简单,不包含各种颗粒物和强极性化合物,再经过前处理的提取过程,能有效减少提取液中的基质成分。因而本方案能提高检测强度,有效降低基质效应的影响。
47.检测实验:
48.(1)将校准品和质控品进行复溶,分别吸取各浓度的校准品和质控品以及待测样
本100μl,加入到不同的离心管中。按照如下前处理过程进行操作,加入300μl沉淀剂(需要加入10μl的内标),涡旋2min;加入500μl萃取液,涡旋混匀1min,4℃高速离心5min,取上清500μl氮吹;加入100μl复溶液,涡旋混匀1min,在lc-ms上进样检测。
49.(2)将校准品的标示浓度(x)与校准品实际检测峰面积和内标峰面积的比值(y)拟合线性方程,相关系数(r)应不小于0.9900。
50.(3)样本结果的计算:将样本的实际检测峰面积和内标峰面积的比值(y)代入校准曲线,计算出样本的浓度(x)。
51.本发明还涉及维生素d及其代谢物的质谱检测用配制品在制备利用质谱检测系统检测维生素d及其代谢物含量的试剂盒中的应用。
52.实施例一
53.(1)复配基质的配制
54.准确量取5g浓度为50g/l的牛血清白蛋白和0.1g浓度为1g/l的triton-100加入到烧杯中,加入适量的超纯水,用玻璃棒搅拌混匀,然后放入到超声波清洗机中进行超声,直至牛血清白蛋白完全溶解,溶液澄清。然后用100ml的容量瓶进行定容,得到所需空白基质。
55.(2)25-羟基维生素d2和d3不同浓度标品溶液的配制
56.分别采用50μg/ml的25-羟基维生素d2和100μg/ml的25-羟基维生素d3标准品溶液配制含10ng/ml的25-羟基维生素d2和10ng/ml的25-羟基维生素d3的混合溶液。
57.(3)复配基质和维生素d标品溶液的混合
58.将复配基质和维生素d标品溶液按照9:1的体积比例进行混合,在超声波清洗器中超声30min,使其充分混匀。
59.(4)冻干
60.将步骤(3)中混合物分装到5ml的西林瓶中,准备进行冻干。在-60℃低温预冻3小时,升华干燥阶段在-50℃持续30h;解析干燥阶段采用10℃/h升温速率,在30℃下持续7小时,真空压盖,得到冻干粉。
61.实施例二
62.(1)复配基质的配制
63.准确量取5g浓度为50g/l的牛血清白蛋白和0.1g浓度为1g/l的triton-100加入到烧杯中,加入适量的超纯水,用玻璃棒搅拌混匀,然后放入到超声波清洗机中进行超声,直至牛血清白蛋白完全溶解,溶液澄清。然后用100ml的容量瓶进行定容,得到所需空白基质。
64.(2)25-羟基维生素d2标品溶液的配制
65.采用50μg/ml的25-羟基维生素d2标准品溶液配制含10ng/ml的25-羟基维生素d2的溶液。
66.(3)复配基质和维生素d标品溶液的混合
67.将复配基质和维生素d标品溶液按照9:1的比例进行混合,在超声波清洗器中超声30min,使其充分混匀。
68.(4)冻干
69.将步骤(3)中混合物分装到5ml的西林瓶中,准备进行冻干。在-60℃低温预冻3小时,升华干燥阶段在-50℃持续30h;解析干燥阶段采用10℃/h升温速率,在30℃下持续7小时,真空压盖,得到冻干粉。
70.实施例三
71.(1)复配基质的配制
72.准确量取5g浓度为50g/l的牛血清白蛋白和0.1g浓度为1g/l的triton-100加入到烧杯中,加入适量的超纯水,用玻璃棒搅拌混匀,然后放入到超声波清洗机中进行超声,直至牛血清白蛋白完全溶解,溶液澄清。然后用100ml的容量瓶进行定容,得到所需空白基质。
73.(2)25-羟基维生素d3标品溶液的配制
74.采用100μg/ml的25-羟基维生素d3标准品溶液配制含10ng/ml的25-羟基维生素d3的溶液。
75.(3)复配基质和维生素d标品溶液的混合
76.将复配基质和维生素d标品溶液按照9:1的比例进行混合,在超声波清洗器中超声30min,使其充分混匀。
77.(4)冻干
78.将步骤(3)中混合物分装到5ml的西林瓶中,准备进行冻干。在-60℃低温预冻3小时,升华干燥阶段在-50℃持续30h;解析干燥阶段采用10℃/h升温速率,在30℃下持续7小时,真空压盖,得到冻干粉。
79.对比例一
80.(1)血清的制备
81.量取100ml备用血清,称取磷钨酸,使其在血清中的最终浓度为(pta沉淀剂)1.0g/l,先用少量纯化水溶解后,多次少量加入血清中,低速搅拌均匀;然后称取适量氯化镁(引入二价阳离子)加入,使mg
2+
浓度达到30mmol/l,低速搅拌,放置12小时后,离心3000r/min、10min,温度10℃,取上层无沉淀血清备用。
82.将血清装进洗净的透析袋中并放于6g/l nacl、磷酸盐缓冲液(15mmol/l)中进行透析,透析时间48小时,中间更换透析液6-8次,使血清中mg2+浓度水平恢复到血清正常水平范围内(成人体内含镁0.823-1.234mol)。
83.(2)25-羟基维生素d2和d3不同浓度标品溶液的配制
84.分别采用50μg/ml的25-羟基维生素d2和100μg/ml的25-羟基维生素d3标准品溶液配制含10ng/ml的25-羟基维生素d2和10ng/ml的25-羟基维生素d3的混合溶液。
85.(3)血清和维生素d标品溶液的混合将血清和维生素d标品溶液按照9:1的比例进行混合,在超声波清洗器中超声30min,使其充分混匀。
86.(4)冻干
87.将步骤(3)中混合物分装到5ml的西林瓶中,准备进行冻干。在-60℃低温预冻3小时,升华干燥阶段在-50℃持续30h;解析干燥阶段采用10℃/h升温速率,在30℃下持续7小时,真空压盖,得到冻干粉。
88.经过实施例一-三、对比例一结合图1-4所示,本发明的用于维生素d及其代谢物的质谱检测用配制品相较于其他配制品的检测强度能提升5%-10%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1