Cf48肾损伤生物标志物及在肾损伤治疗药物中的用途
cf48肾损伤生物标志物及在肾损伤治疗药物中的用途
技术领域
1.本发明涉及肾脏疾病医学领域,特别是涉及一种c4orf48(简称cf48)小肽作为待测目标对象肾脏损伤情况的标志物,以及在作为肾脏损伤情况诊断标志物及干预靶点药物方面以及肾脏损伤情况评估系统的用途。
背景技术:
2.肾病特别是慢性肾脏病(ckd)对世界成年人口的影响越来越大。在我国,ckd的患病率为10.8%,且其中有相当一部分病人会进入终末期肾功能衰竭(esrd),需要肾脏替代治疗。
3.慢性肾脏病(chronic kidney disease,ckd)是指各种原因导致的肾脏结构和功能障碍,肾功能呈进行性下降,主要表现为肾单位进行性不可逆地丢失、肾再生能力降低、代谢变化、氧化应激和炎症,最终导致肾脏纤维化。肾脏纤维化是多种ckd的最终结果,也是导致终末期肾脏病(end stage renaldisease,esrd)的主要原因之一。纤维化本是肾脏正常修复过程的一部分。在损伤条件下,成纤维细胞可产生适量的细胞外基质(ecm)以保持组织结构和功能的完整性。当损伤因素持续存在,修复过程失调,肾脏的成纤维细胞活化或上皮细胞转分化为肌成纤维细胞,大量增殖并产生过多的ecm,替代原有的肾实质组织,导致肾脏纤维化。如足细胞丢失被ecm替代称为肾小球硬化(glomerulosclerosis),肾小管细胞损伤和随后的ecm病理性沉积称为肾间质纤维化(renal interstitial fibrosis,rif)。而其中与肾小球硬化相比,肾间质纤维化与患者的蛋白尿和疾病严重程度的相关性更强。
4.急性肾损伤(acute kidney injury,aki)是指短期内肾功能的快速下降,其主要特征是肾脏固有细胞的程序性死亡及过度的炎症性反应。ckd患者发生aki的风险增加,越来越多的流行病学研究表明,衰老和ckd显着增加了aki发生的风险及其严重程度。同样,严重或反复发作的aki可向ckd甚至esrd 转变(称为aki-to-ckd transition)。一项研究报告称,不需要透析的aki患者每年有超过5,000例/百万,其中有很大一部分会进展为ckd或esrd。aki的严重程度、发作频率和持续时间与随后的ckd发病率有关,即使是轻微的aki也有可能发展为肾脏纤维化,因此,aki现在被认为是ckd和esrd的一个重要危险因素。然而,目前除支持治疗外,仍缺乏有效和特异性延缓aki疾病进程的治疗方法。
5.肾脏病特别是慢性肾脏病(ckd)的疾病进程复杂且具有异质性,目前肾脏疾病的临床评估和诊断很大程度上仅依赖于肾小球功能,即通过对肾小球滤过功能的评估来反映肾功能情况。在过去一个世纪的时间里,肾脏疾病的诊断主要依赖于血清肌酐含量的检测,其作为肌酸/磷酸肌酸的代谢产物,在肾小球滤过功能正常的情况下可被肾小球自由滤过。然而随着临床诊断对敏感度要求的不断增高,血肌酐及其他一些评估小球滤过功能的分子作为肾脏损伤生物标志物存在局限性。这包括(1)诊断敏感度不足:血肌酐是肾脏损伤的间接标志物,会导致诊断的延迟;(2)诊断特异性不足:血肌酐在小球或小管没有损伤的情况下也会升高;(3)诊断指向性不足:血肌酐升高无法区别是小管损伤还是小球损伤导致;(4)对于有良好肾脏储备功能的患者,即使存在严重的小管损伤,血肌酐也不会升高。
6.为了解决这些局限性,提供一种能在血液或尿液中与肾脏损伤相关的生物标志物,特别是提供由肾脏直接产生或者是在肾脏损伤后由于肾功能异常而导致在血液或尿液中含量升高的生物标志物非常必要。寻找在肾脏损伤发生发展过程中具有特异性的生物标志物及潜在治疗靶点的作用药物对肾脏损伤的治疗均具有重要的意义。
技术实现要素:
7.本发明的目的在于提供一种cf48小肽作为肾脏损伤情况的标志物及诊断试剂盒、以及作为药物干预靶点在制备治疗肾脏损伤药物中的用途以及基于cf48生物标志物评估待测目标对象肾脏损伤情况的系统。
8.本发明的上述目的通过以下技术措施实现。
9.本发明的第一个技术方案是提供cf48小肽生物标志物在用于判断待测目标对象肾脏损伤情况的标志物的用途,cf48小肽生物标志物的序列为seq id no:1。
10.进一步的,cf48小肽作为肾病诊断的标志物;或者
11.cf48小肽作为肾脏损伤程度判断的标志物;或者
12.cf48小肽作为目标对象预后预测的标志物;或者
13.cf48小肽作为肾脏纤维化程度的标志物;或者
14.cf48小肽作为肾脏纤维化活动度的标志物;或者
15.cf48小肽作为肾病患者治疗效果监测的标志物中的一种或者多种。
16.本发明第二个技术方案提供cf48小肽作为生物标志物在用于判断待测目标对象肾脏损伤情况的诊断试剂或者试剂盒盒中的用途。所述试剂或者试剂盒可为采用质谱法或者为采用免疫检测方法包括但不限于酶联免疫吸附法、化学发光免疫分析法、免疫芯片法、荧光免疫法、免疫组化、免疫层析、应激免疫、免疫比浊法等的试剂或者试剂盒。
17.进一步的,通过检测生物样本中cf48小肽的表达水平(就是含量),表达水平高于参照水平提示存在肾脏损伤;所述样本为肾组织或者血清或者血浆或者全血。
18.进一步的,通过检测生物样本中cf48小肽的表达水平判断目标对象是否患有肾病;或者
19.通过检测生物样本中cf48小肽的表达水平判断肾脏损伤程度;或者
20.通过检测生物样本中cf48小肽的表达水平进行目标对象预后预测;或者
21.通过检测生物样本中cf48小肽的表达水平判断肾脏纤维化程度;或者
22.通过检测生物样本中cf48小肽的表达水平判断肾脏纤维化活动度;或者
23.通过检测生物样本中cf48小肽的表达水平进行肾病患者治疗效果监测中的至少一种。
24.进一步的,根据所检测生物样本中cf48小肽的含量判断肾小管存在损伤。
25.进一步的,所检测生物样本中cf48小肽的含量越高,提示肾脏损伤程度越高;
26.所检测生物样本中cf48小肽的含量越高,提示目标对象预后预测越高,即肾病有朝着更严重方向发展的能力越强;
27.所检测生物样本中cf48小肽的含量越高,提示肾脏纤维化活动度越高,即待测对象肾脏正在进行纤维化的程度越高。
28.进一步的,将所检测生物样本中cf48小肽的含量与第一阈值比较,当所检测生物
样本中cf48小肽的含量大于等于第一阈值时,提示肾脏纤维化活动度为强活动度,表示肾脏正在进行的纤维化活动程度高,需要干预;
29.当所检测生物样本中cf48小肽的含量小于第一阈值时且大于第二阈值时,再检测生物样本中是否存在tgf-β1,在待测生物样本中存在tgf-β1时,提示肾脏纤维化活动度为强活动度;
30.当所检测生物样本中cf48小肽的含量小于第二阈值时,提示肾脏纤维化活动度为弱活动度,表示肾脏正在进行的纤维化活动度低,肾脏纤维化不具备发展能力;
31.其中第一阈值大于第二阈值。
32.本发明的第三个技术方案是提供以cf48小肽标志物作为干预靶点在制备治疗肾脏损伤药物中用途。
33.优选的,所述治疗肾脏损伤药物通过靶向抑制或者消除cf48小肽的表达治疗或者延缓肾脏损伤发展。
34.进一步的,所述治疗肾脏损伤药物通过靶向抑制cf48小肽的表达,避免cf48小肽抑制成纤维细胞中氨基酸通道slc3a而出现的成纤维细胞活化的现象发生。
35.进一步的,所述治疗肾脏损伤药物通过靶向抑制cf48小肽的表达,避免cf48通过抑制小管细胞中氨基酸通道slc3a2和抑制小管细胞能量代谢而出现的诱导emt的发生、促进肾脏纤维化形成的现象发生。
36.进一步的,所述治疗肾脏损伤药物通过抑制cf48小肽与transferrin receptor protein 1(tfrc)的结合,避免cf48通过激活tfrc下游的信号通路而出现的诱导emt的发生、促进肾脏纤维化形成的现象发生。
37.进一步的,所述治疗肾脏损伤药物通过靶向抑制cf48小肽的表达,避免cf48与其他促进肾脏纤维化形成的因素协同作用促进肾脏纤维化形成的现象发生。
38.本发明的第四个技术方案是提供一种基于cf48生物标志物评估待测目标对象肾脏损伤情况的系统,设置有,
39.数据采集模块,至少采集待测目标对象的生物样本中cf48的量;
40.评估模块,根据生物样本中的cf48的含量与对照参数进行比较,根据比较结果得出待测目标对象肾脏损伤情况对应的等级结果。
41.优选的,所述评估模块设置有参数存储单元和分析单元,所述参数存储单元存有第一参考值、第二参考值;
42.所述分析单元将所述数据采集模块输送的所检测生物样本中的cf48的含量与第一参考值、第二参考值比较,当所检测生物样本中cf48小肽的含量大于等于第一参考值时,分析单元给出第一等级结果,第一等级表示肾脏肾脏损伤情况严重,需要干预;
43.当所检测生物样本中cf48小肽的含量小于第二参考值时,分析单元给出低等级结果,低等级表示肾脏损伤情况轻微,不需要干预;
44.其中,第一参考值大于第二参考值。
45.优选的,所述数据采集模块还采集待测生物样本中是否存在tgf-β1;
46.所述分析单元将所述数据采集模块输送的所检测生物样本中的cf48的含量与第一参考值、第二参考值比较,当所检测生物样本中cf48小肽的含量小于第一参考值且大于第二参考值时,
47.所述分析单元获取数据采集模块中采集的待测生物样本中是否存在tgf-β1的结果,在待测生物样本中存在tgf-β1时,所述分析单元给出第二等级结果,第二等级表示肾脏损伤情况严重,需要干预。
48.本发明提供了一种能够标识肾脏损伤情况的标志物cf48小肽及其诊断试剂盒,可通过检测肾脏组织、血液中的cf48含量,判断肾脏损伤情况。特异性强,解决了现有技术中基本靠活检结合病理,判断肾脏损伤情况的缺陷。同时,本发明的标志物还能够标识肾脏损伤情况的变化度,弥补了现有技术中不能对肾脏损伤情况的变化能力进行判断的技术缺陷。通过cf48小肽作为标志物进行肾脏损伤情况表征,可以实现在没有活检指征情况下对肾脏损伤情况进行判断,克服了现有技术中临床诊断的各种要求限制,可作为体检的一项指标来进行检测。
49.本发明提供的以cf48小肽标志物作为干预靶点的治疗肾脏损伤药物的用途,可通过靶向抑制cf48小肽的表达实现对肾脏损伤情况的抑制或者治疗。
50.本发明提供的基于cf48生物标志物评估待测目标对象肾脏损伤情况的系统,通过采集待测目标对象的生物样本中的cf48的量,来评估给出肾脏损伤情况等级,具有检测方便,结果精确的特点。
51.说明书附图
52.利用附图对本发明作进一步的说明,但附图中的内容不构成对本发明的任何限制。
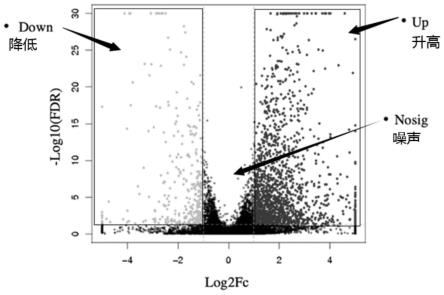
53.图1-1是进展性糖尿病肾病小鼠dn组小鼠和正常对照小鼠nc组小鼠的差异表达基因火山图。
54.图1-2是cf48 mrna在dn患者肾组织中表达升高的结果图,图1-2a是免疫荧光原位杂交检测cf48mrna 在正常肾组织中的表达,图1-2b是检测cf48mrna在糖尿病肾病患者肾小管间质中的表达,图1-2c是检测cf48mrna在糖尿病肾病患者肾小球中的表达情况,比例尺:50μm。
55.图1-3是cf48条件培养基增强tgf-β1诱导的成纤维细胞活化反应结果,图1-1-3a是免疫印迹检测cf48条件性培养基(mscv-cf48)及对照培养基(mscv)在含或不含tgf-β1(1ng/ml)的条件下对nrk-49f细胞α-sma表达量的影响结果;图1-3b是统计分析3次独立重复实验cf48条件性培养基对nrk-49f细胞α-sma 表达量的影响,n=3,
**
p《0.01。
56.图2-1是cf48 mrna在dn患者肾组织中表达升高的结果图,其中图2-1a、图2-1b、图2-1c分别是免疫荧光原位杂交检测cf48mrna在正常肾组织、糖尿病肾病患者肾小管间质及糖尿病肾病患者肾小球中的表达情况,比例尺:50μm。
57.图2-2是cf48在dn患者肾组织中表达升高的结果,其中图2-2a、图2-2b分别是免疫组化检测cf48在正常肾组织及dn患者肾组织中的表达情况,比例尺:500μm;图2-2c是统计分析免疫组化染色中cf48在肾小管间质中的表达强度,
***
p《0.001,正常肾组织(ctl,n=9),糖尿病肾病肾组织(dn,n=13)。
58.图2-3是cf48在ckd患者肾组织中表达升高的结果,其中图a、b、c、d、e分别是免疫荧光检测cf48在正常肾组织、微小病变性肾病、狼疮性肾炎、iga肾病及糖尿病肾病患者肾组织中的表达情况,比例尺:50μm。图2-4是分泌性cf48在正常志愿者(ctl)、糖尿病不伴有糖尿病肾病的疾病对照(dm)、糖尿病肾病患者 (dn)、iga肾病患者(igan)及狼疮性肾炎患
者(ln)外周血血清中的含量;ns=not significant;
****
p《0.0001。
59.图2-5是ckd患者血清cf48含量与临床指标的相关性分析结果,其中图2-5a、图2-5b分别是 ckd患者血清cf48含量与egfr及ckd分级的关系,n=73。
60.图2-6是dn患者血清cf48含量与肾组织α-sma染色阳性面积的关系,n=16。
61.图2-7是dn患者血清cf48含量与病理分级的相关性分析,n=33。
62.图2-8是ln患者血清cf48含量与临床指标的相关性分析结果,其中a、b、c、d分别是ln患者血清cf48含量与血尿素氮、血肌酐、egfr及ckd分级的关系,n=20。
63.图2-9是igan患者血清cf48含量与患者lee病理分级的相关性分析,n=20。
64.图2-10是cf48在小鼠肺和心脏的表达结果,图2-10a、b分别是masson trichrome染色显示正常小鼠肺和belomycin诱导4周后的纤维化肺。图2-10c、d、e、f分别是免疫组化显示在正常小鼠肺、belomycin 诱导4周后的纤维化肺、正常小鼠心脏(e)和angiotensin诱导4周后的纤维化心脏、中cf48的表达。
65.图3-1是cf48在糖尿病肾病小鼠肾脏组织中表达上调结果示意图,其中图3-1a是(a)免疫印迹分析正常溶剂对照(nc)小鼠和stz诱导的糖尿病肾病(dn)小鼠肾组织中cf48的表达情况;图3-1b是统计分析(a)中两组小鼠肾组织中cf48的表达情况,
****
p《0.0001,n=6;图3-1c是qrt-pcr检测nc小鼠和 dn小鼠肾组织cf48 mrna表达水平,
***
p《0.001,n=6;图3-1d是免疫荧光检测nc小鼠肾组织中cf48 和α-sma的表达情况;图3-1e是免疫荧光检测dn小鼠肾组织中cf48和α-sma的表达情况,比例尺:50μm。
66.图3-2是cf48过表达糖尿病肾病小鼠肾功能进展加重的示意图;其中,图3-2a是造模2周后各组小鼠空腹血糖的情况,
****
p《0.0001,ns=not significant,n≥6;图3-2b是造模4周后各组小鼠糖化血红蛋白的情况,
****
p《0.0001,ns=not significant,n≥6;图3-2c是杀检时糖尿病肾病小鼠肾脏体重比,
***
p《0.001,n=7;图3-2d是糖尿病小鼠造模成功后(0w)各时间点随机尿尿白蛋白/肌酐比值,
*
p《0.05,
**
p《0.01;n≥6;图3-2e是杀检时(12w)各组小鼠随机尿尿白蛋白/肌酐比值,
**
p《0.01,
****
p《0.0001,n≥6;图3-2f是杀检时(12w)各组小鼠血清胱抑素c的情况,
*
p《0.05,n≥6。
67.图3-3是cf48过表达糖尿病肾病小鼠肾脏病理损伤加重的示意图,图中,各组小鼠肾脏pas染色,比例尺:50μm。
68.图3-4是cf48过表达糖尿病肾病小鼠肾脏纤维化程度加重的结果示意图,其中图3-4a是免疫荧光检测各组小鼠肾组织中纤维化指标的表达情况,比例尺:50μm;图3-4b是免疫印迹分析糖尿病肾病小鼠肾组织α-sma的表达情况;图3-4c是统计分析(b)中两组小鼠肾组织中α-sma的表达情况,
***
p《0.001,n=6。
69.图3-5是cf48过表达糖尿病肾病小鼠肾脏炎症反应加重的结果示意图,其中图3-5a是统计分析各组小鼠肾组织中f4/80
+
巨噬细胞的个数,
****
p《0.0001,n=6;图3-5b是qrt-pcr检测各组小鼠肾组织中炎症指标 mcp-1、tnf-αmrna表达水平,
####
p《0.0001vs wt-nc小鼠,
*
p《0.05vs wt-dn小鼠,
#
p《0.05vs wt
–
nc 小鼠,
**
p《0.01vs wt-dn小鼠。
70.图3-6是cf48在叶酸性肾病小鼠肾脏组织中表达上调的结果示意图;其中图3-6a是qrt-pcr检测溶剂对照正常小鼠(con)及叶酸性肾病不同时间点小鼠肾组织cf48 mrna表达水平,
*
p《0.05,
****
p《0.0001;图 3-6b是统计分析叶酸性肾病28d和溶剂对照正常小鼠肾组织中cf48的表达情况,
****
p《0.0001,n=6;图3-6c 是免疫印迹分析叶酸性肾病28d小鼠
和溶剂对照正常小鼠肾组织cf48的表达情况;图3-6d、图3-6e分别是荧光检测正常小鼠、叶酸性肾病小鼠肾组织中cf48的表达情况,比例尺:50μm。
71.图3-7是cf48过表达叶酸性肾病小鼠肾功能进展加重的结果示意图;其中,图3-7a是fa造模2天后各组小鼠血cysc的情况,
****
p《0.0001,ns=not significant,n≥6;图3-7b是fa造模28天后各组小鼠血 cysc以及(c)血肌酐的情况,
**
p《0.01,
***
p《0.001,
****
p《0.0001,n≥6。
72.图3-8是cf48过表达叶酸性肾病小鼠肾脏纤维化程度加重结果示意图;其中,图3-8a是免疫荧光检测各组小鼠肾组织中纤维化指标的表达情况,比例尺:50μm;图3-8b是免疫印迹分析叶酸性肾病小鼠肾组织 coli,α-sma的表达情况;图3-8c是统计分析(b)中两组小鼠肾组织中coli,α-sma的表达情况,
***
p《0.001, n=6。
73.图3-9是cf48过表达叶酸性肾病小鼠肾脏炎症反应加重的结果图;其中图3-9a是统计分析各组小鼠肾组织中f4/80
+
巨噬细胞的个数,
**
p《0.01,
****
p《0.0001,n=6;图3-9b是qrt-pcr检测各组小鼠肾组织中炎症指标mcp-1、tnf-α、il-1βmrna表达水平,
#
p《0.05vs wt-nc小鼠,
***
p《0.001vs wt-fa小鼠。图3-10是cf48敲除叶酸性肾病小鼠肾功能受损程度减轻结果图;图3-10a是fa造模2天后各组小鼠血 cystatin c的情况,
****
p《0.0001,ns=not significant,n≥6;图3-10b、c、d分别是是造模28天后各组小鼠血cystatin c、血肌酐、血尿素氮的情况,
*
p《0.05,
**
p《0.01,
****
p《0.0001,n≥7。
74.图3-11是cf48敲除敲除叶酸性肾病小鼠肾脏病理损伤减轻的示意图,其中图3-11a是各组小鼠肾脏 masson染色结果,比例尺:500μm;图3-11b是各组小鼠masson染色胶原沉积的比例,original magnification:
ꢀ×
400,
**
p《0.01,
****
p《0.0001,n=6。
75.图3-12是cf48敲除叶酸性肾病小鼠肾脏纤维化程度减轻的结果图;其中,图3-12a是免疫荧光检测各组小鼠肾组织中纤维化指标的表达情况,比例尺:50μm;图3-12b是免疫印迹分析叶酸性肾病小鼠肾组织coli,α-sma的表达情况;图3-12c是统计分析(b)中两组小鼠肾组织中coli,α-sma的表达情况,
**
p《0.01, n=6。
76.图3-13是cf48敲除叶酸性肾病小鼠肾脏炎症反应减轻的结果图;其中图3-13a是统计分析各组小鼠肾组织中f4/80
+
巨噬细胞的个数,
****
p《0.0001,n=6;图3-13b是qrt-pcr检测各组小鼠肾组织中炎症指标 mcp-1、tnf-αmrna表达水平,
####
p《0.0001vs wt-nc小鼠,
**
p《0.01,
****
p《0.0001vs wt-fa小鼠。图3-14是qrt-pcr检测假手术组小鼠(sham)及uuo手术组小鼠肾组织cf48 mrna表达水平结果,
****
p《0.0001;n=6。
77.图3-15是cf48敲除uuo小鼠各组小鼠肾脏masson染色结果图,比例尺:500μm。
78.图3-16是cf48敲除uuo小鼠肾脏炎症反应减轻的结果示意图,其中,图3-16a是免疫组化检测各组小鼠肾组织中炎症细胞标志物f4/80的表达情况,比例尺:500μm;图3-16b是统计分析(a)中各组小鼠肾组织中f4/80
+
巨噬细胞的个数,
**
p《0.01,
****
p《0.0001,n=6;图3-16c是qrt-pcr检测各组小鼠肾组织中炎症指标mcp-1、tnf-αmrna表达水平,
####
p《0.0001vs wt-sham小鼠,
***
p《0.001,
****
p《0.0001vswt-uuo小鼠。
79.图3-17是免疫印迹显示cf48在假手术组(sham)和uuo术后行lna ctl或lna cf48治疗后在肾组织中的表达结果。
80.图3-18是免疫印迹显示cf48,collagen i,和
ɑ-sma在假手术组(sham)和uuo术后行lna ctl或lna cf48 治疗后在肾组织中的表达结果。
81.图3-19是lna cf48抑制糖尿病肾病的发生和发展示意图;图3-19a是免疫荧光显示collagen iv在 nos3-/-buffer处理(对照组)和nos3-/-+stz诱导dm 2周后行lna ctl或lna cf48治疗6周后在肾组织中的表达情况。图3-19b、图3-19c、图3-19d分别是nos3-/-buffer处理(对照组)和nos3-/-+stz诱导dm 2周后行lna ctl或lna cf48治疗6周后蛋白尿、血creatinine和血cystatin c的水平。data表达为mean
±
sd.one-way anova,*p《0.05;****p《0.0001。
82.图4-1是nrk-49f细胞在伴或不伴tgf-β1(1ng/ml)的条件下加入分泌性cf48(scf48)和细胞内cf48 (ccf48)刺激48小时后α-sma的表达情况。
83.图4-2是分泌性cf48呈浓度依赖性促进成纤维细胞活化结果;其中,图4-2a是nrk-49f细胞在伴或不伴 tgf-β1(1ng/ml)的条件下加入不同浓度的分泌性cf48(scf48)刺激48小时对α-sma表达量的影响;
84.图4-2b是nrk-49f细胞在伴或不伴tgf-β1(1ng/ml)的条件下加入40ng/ml的分泌性cf48(scf48) 刺激48小时后α-sma的表达情况;图4-2c是统计分析3次独立重复实验,40ng/ml分泌性cf48(scf48) 对nrk-49f细胞α-sma表达量的影响,
*
p《0.05,
**
p《0.01,n=3。
85.图4-3是nrk-49f细胞加入不同浓度的分泌性cf48(scf48)刺激48h后slc3a2的表达情况。
86.图4-4是slc3a2的表达下调促进成纤维细胞活化的结果图,其中,图4-4a是免疫印迹检测nrk-49f细胞感染ctl-sgrna和slc3a2-sgrna后slc3a2和α-sma的蛋白水平的结果;图4-4b是免疫印迹检测 nrk-49f细胞转染ctl-sirna和不同浓度的slc3a2-sirna后slc3a2和α-sma的蛋白水平。
87.图4-5是slc3a2的表达下调增强scf48的促纤维化作用的结果示意图,其中图4-5a是免疫印迹检测 nrk-49f细胞转染ctl-sgrna和slc3a2-sgrna,40ng/ml scf48刺激48h后slc3a2和α-sma的蛋白水平;图4-5b是统计分析3次独立重复试验α-sma的蛋白水平,
*
p《0.05,
**
p《0.01,
****
p《0.0001,n=3。
88.图4-6是slc3a2的表达下调增强tgf-β1活化成纤维细胞的作用结果;其中,图4-6a是免疫印迹检测 nrk-49f细胞转染ctl-sgrna和slc3a2-sgrna,1ng/ml tgf-β1刺激48h后slc3a2和α-sma的蛋白水平;图4-6b是统计分析3次独立重复试验α-sma的蛋白水平,
*
p《0.05,
**
p《0.01,n=3。
89.图4-7是nrk-52e细胞加入不同浓度的分泌性cf48(scf48)刺激5天后slc3a2和α-sma的表达情况。
90.图4-8是免疫印迹检测nrk-52e细胞转染ctl-sirna和slc3a2-sirna 48小时后slc3a2、e-cadherin 和α-sma的蛋白水平。
91.图4-9是slc3a2的表达下调导致小管细胞线粒体功能下降的示意图;其中图4-9a是在ctl-sirna和 slc3a2-sirna处理后的大鼠肾小管细胞中用寡霉素、fccp和鱼藤酮处理后耗氧率(ocr)的实时变化情况;图4-9b是定量分析两组细胞的基础呼吸量、最大呼吸量、atp产生能力以储备用呼吸能力结果,
*
p《0.05,
**
p《0.01。
92.图4-10是scf48导致小管细胞线粒体功能下降示意图,图4-10a是正常对照(nc)、scf48刺激、tgf-β1 刺激及tgf-β1+scf48刺激后的大鼠肾小管细胞中用寡霉素、fccp和鱼藤酮处理后耗氧率(ocr)的实时变化情况;图4-10b是定量分析四组细胞的基础呼吸量、最
大呼吸量、atp产生能力以储备用呼吸能力,
*
p《0.05,
**
p《0.01,
****
p《0.0001,n=6。
93.图4-11是免疫印迹分析cf48-tg和wt小鼠在正常对照小鼠和叶酸性肾病模型肾组织中slc3a2、α-sma、 cf48的表达情况。
94.图4-12是免疫印迹分析cf48-ko和wt小鼠在假手术组(sham)和梗阻性肾病(uuo)模型肾组织中 slc3a2、α-sma的表达情况。
95.图4-13是tfrc介导cf48的作用在nrk49f细胞用tfrc sirna敲低内源性tfrc的表达,免疫印迹显示减低了cf48诱导的
ɑ-sma的表达,显示tfrc介导cf48的纤维化反应的示意图。
具体实施方式
96.结合以下实施例对本发明作进一步说明。
97.实施例1。
98.本实施例提供cf48小肽生物标志物在用于判断待测目标对象肾脏损伤情况的标志物的用途,cf48小肽生物标志物的序列为seq id no:1。
99.cf48小肽是c4orf48小肽的简称,人的基因c4orf48(ncbi gene id:401115)位于4号染色体第48 位开放阅读框(chr4:2,035,610-2,043,970),由9个外显子组成,可翻译氨基酸长度为90aa的小肽,氨基酸序列如下。
100.人c4orf48的氨基酸序列为:
101.mapppacrspmspppppllllllslallgararaepagsavpaqsrpcvdchafefmqralqdlrktacsl dartetlllqaerralcacwpagh(95aa)。
102.人c4orf48的cdna序列为:
103.atggcccccccgcccgcgtgccggtccccgatgtcaccgccgccgccgccgctgctgctgctgctgctgagtctggcgctgctgggcgcccgggcccgcgccgagcccgccgggagtgccgtccccgcgcagag ccgcccatgcgtggactgccacgccttcgagttcatgcagcgcgccctgcaggacctgcggaagaca gcctgcagcctggacgcgcggacggagaccctactgctgcaggcagagcgccgtgccctgtgtgcct gctggccagcggggcactgag。
104.(注:下划线:信号肽,其余序列:分泌肽)。
105.实验发现,cf48小肽可作为肾病诊断的标志物;通过检测目标对象样本中cf48小肽的含量,可以判断目标对象是否患有肾病。具体通过检测目标对象组织或者血液中的cf48小肽表达,判断目标对象是否患有肾病。
106.cf48小肽还可作为肾脏损伤程度判断的标志物,通过检测目标对象组织或者血液中的cf48小肽表达,根据所检测到的cf48小肽的含量判断肾脏损伤程度,包括肾脏结构损伤情况(如结构变化等)、肾脏功能损伤情况(如滤过功能损伤等)、肾脏炎症程度情况。
107.cf48小肽还可作为目标对象预后预测的标志物,目标对象预后预测是代表目标对象当前肾脏损伤情况的发展能力,如果当前肾脏损伤情况发展能力高,代表程度转向严重方向的能力大,如果当前肾脏损伤情况发展能力低,代表当前肾病肾脏损伤情况不具备转向严重方向的能力,当前肾脏损伤情况基本上将会维持现状或者降低。可通过检测目标对象组织或者血液中的cf48小肽表达,判断肾脏损伤情况发展度,获得目标对象预后预测结果。
108.cf48小肽还可作为肾脏纤维化程度的标志物,肾脏纤维化是肾脏损伤情况特别是
肾脏病症的一个重要表征。
109.cf48小肽还可作为肾脏纤维化活动度的标志物。肾脏纤维化活动度是表征肾脏当前正在纤维化的程度的一个表征,当前纤维化活动度高,代表肾脏进行当前进行纤维化的程度高,目标对象将迅速纤维化,提示需要及时干预。如果当前纤维化活动度低,代表肾脏当前进行纤维化的能力较低,肾脏将不容易进行纤维化转变,要么维持现状要么纤维化能力降低,此种情况,提示多数情况下不需要干预。
110.cf48小肽还可作为肾病患者治疗效果监测的标志物,通过cf48小肽,可实现对患者治疗效果进行监测。
111.本实施例的以cf48小肽作为肾脏的标志物,提供了一种新的标志物。可通过检测肾脏组织、血液中的cf48含量,判断肾脏损伤情况。解决了现有技术中基本靠活检加病理,判断肾脏损伤情况的缺陷。同时,本发明的标志物还能够标识肾脏损伤情况的变化度,弥补了现有技术中不能对肾脏损伤情况的变化能力进行判断的技术缺陷。通过cf48小肽作为标志物进行肾脏损伤情况表征,可以实现在没有活检指征情况下对肾脏损伤情况进行判断,克服了现有技术中临床诊断的各种要求限制,可作为体检的一项指标来进行检测。
112.实施例2。
113.提供一种cf48小肽作为生物标志物在用于判断待测目标对象肾脏损伤情况的诊断试剂或者试剂盒中的用途。通过检测生物样本中cf48小肽的表达水平,表达水平高于参照水平提示存在肾脏损伤风险;样本可选择肾组织或者血清或者血浆或者全血。
114.具体的,cf48小肽可作为肾病诊断的标志物,通过检测生物样本中cf48小肽的表达水平判断目标对象是否患有肾病;或者cf48小肽作为肾脏损伤程度判断的标志物,通过检测生物样本中cf48小肽的表达水平判断肾脏损伤程度;或者cf48小肽作为肾脏损伤的目标对象预后预测的标志物,通过检测生物样本中cf48小肽的表达水平进行患者预后预测;或者cf48小肽作为肾脏纤维化程度的标志物,通过检测生物样本中cf48小肽的表达水平判断肾脏纤维化程度;或者cf48小肽作为肾脏纤维化活动度的标志物,通过检测生物样本中cf48小肽的表达水平判断肾脏纤维化活动度;或者cf48小肽作为肾病患者治疗效果监测的标志物,通过检测生物样本中cf48小肽的表达水平进行肾病患者治疗效果监测。
115.具体的,检测生物样本中cf48小肽的表达水平,可根据所检测生物样本中cf48小肽的含量判断。
116.实验发现,所检测生物样本中cf48小肽的含量越高,提示肾脏损伤的严重程度越高;所检测生物样本中cf48小肽的含量越高,提示肾脏损伤程度越高。所检测生物样本中cf48小肽的含量越高,提示目标对象预后预测越高,即肾病有朝着更严重方向发展的能力越强。所检测生物样本中cf48小肽的含量越高,提示肾脏纤维化活动度越高,即待测对象肾脏正在进行纤维化的程度越高。当所检测生物样本中cf48小肽的含量高时,肾小管存在损伤。
117.在实际使用过程中可以根据具体对象及检测要求设置相应的阈值范围,通过阈值范围判断肾脏损伤情况。例如,可将所检测生物样本中cf48小肽的含量与第一阈值比较,当所检测生物样本中cf48小肽的含量大于等于第一阈值时,提示肾脏纤维化活动度为强活动度,表示肾脏正在进行的纤维化活动程度高,需要干预。
118.当所检测生物样本中cf48小肽的含量小于第一阈值时且大于第二阈值时,再检测
生物样本中是否存在tgf-β1,在待测生物样本中存在tgf-β1时,提示肾脏纤维化活动度为强活动度。
119.当所检测生物样本中cf48小肽的含量小于第二阈值时,提示肾脏纤维化活动度为弱活动度,表示肾脏正在进行的纤维化活动度低,肾脏纤维化不具备发展能力
120.其中第一阈值大于第二阈值。需要说明的是,第一阈值、第二阈值可根据不同的目的需求相应进行设置。例如第一阈值的取值范围不小于40ng/ml;第二阈值的取值范围为0ng/ml-6ng/ml。
121.本发明的能够通过cf48小肽标识肾脏损伤情况诊断试剂盒,可通过检测肾脏组织、血液中的cf48含量,判断肾脏损伤情况。解决了现有技术中基本靠活检加病理,判断肾脏损伤情况的缺陷。同时,还能够标识肾脏损伤情况的变化度,弥补了现有技术中不能对肾脏损伤情况的变化能力进行判断的技术缺陷。通过cf48小肽作为标志物进行肾脏损伤情况表征,可以实现在没有活检指征情况下对肾脏损伤情况进行判断,克服了现有技术中临床诊断的各种要求限制,可作为体检的一项指标来进行检测。可作为本发明的试剂盒可以为各种免疫学诊断试剂盒,如免疫组化法、化学发光法、elisa、免疫印迹法等。
122.实施例3。下面结合具体实验过程,对本发明作详细说明。
123.第一部分,cf48的获取
124.1.1研究目的
125.利用翻译组学测序的手段,筛选由sorf编码的在ckd发生发展中具有特异性的新型小肽。
126.1.2实验材料
127.(1)nrk-49f细胞系及人胚胎肾细胞(293t)细胞系购于atcc(american type culture collection,美国);(2)链脲霉素,sigma,美国;(3)重组tgf-β1刺激因子,peprotech,美国;(4)无血清表达培养基 (expression medium),thermo,美国;(5)ripa细胞裂解液,milipore,美国;(6)bca试剂盒,thermo,美国;(7)抗体:α-sma抗体购于sigma公司(美国),gpadh抗体购于sab公司(中国),山羊抗兔抗体购于cell signaling technology公司(美国)。
128.1.3研究方法
129.1.3.1.实验动物
130.c57bl/6背景的enos-/-小鼠,购自江苏集萃药康生物科技有限公司。在中山大学实验动物中心(北校园)进行糖尿病肾病模型造模。
131.1.3.2动物模型制备
132.诱导进展性糖尿病小鼠模型:enos-/-小鼠予链脲霉素(stz)诱导糖尿病肾病小鼠。采用低剂量腹腔连续注射5天的方法,造成小鼠胰岛细胞的部分损伤。造模成功后12w(w指周)杀检成功诱导出dn的小鼠(dn组),enos-/-小鼠予同等剂量的溶剂于相同的时间杀检作为正常对照组(nc组)。
133.1.3.3测序对象
134.取5只enos-/-,stz诱导的进展性糖尿病肾病小鼠的肾组织及4只年龄匹配的enos-/-正常对照小鼠的肾组织进行翻译组学测序。
135.1.3.4翻译组学测序
136.翻译组学测序及分析委托广州基底奥生物科技有限公司完成。主要流程包括翻译抑制固定(加入防线菌酮)、rna酶消化、去除核糖体、核糖体足迹提取、反转录、建库、质检及测序。
137.1.3.5分析步骤
138.(1)计算核糖体足迹翻译丰度
139.a)核糖体足迹(rfs)比对与识别:
140.核糖体足迹为核糖体复合物在翻译时在rna上滑动停留的位置。当翻译中止,用低浓度的rna酶处理核糖体-新生肽链复合物时仅有被核糖体覆盖的mrna片段可以保留,在去除核糖体后,这些被核糖体保护的长度约30bp的rna小片段称为核糖体足迹。每个rfs代表一个核糖体位置,代表正在翻译的转录本。通过二代测序的方法直接对rfs进行测序得到rf reads,通过软件bowtie2将rf reads比对到小鼠基因组中,仅保留能唯一比对到某个基因的rf reads进行后续的定量分析。
141.b)开放阅读框(orf)翻译表达量计算:
142.基于rfs比对结果,进一步统计落在各个orf内的rf reads的丰度(与orf有重叠的rf reads的数量),以 rpkm(reads per kilobase per million mapped reads)值表示orf的表达量。
143.(2)orf组间差异分析
144.计算rf reads在各类orf中的丰度(rpkm)后,使用edger软件比较dn及nc组间具有表达差异的 orf,计算差异倍数(fold change,fc)。利用fdr与log2fc来筛选具有翻译差异的基因(differentiallytranslated gene,dtg),筛选条件为|log2fc|》1且fdr《0.05。
145.(3)sorf编码潜能评估
146.通过以下三种标准来综合判断sorf编码潜力:
147.a)orfscore:
148.rfs符合三碱基节律的特性,核糖体在翻译过程中在rna上会以三个碱基构成的密码子为单位进行停顿,因此具有翻译潜能的rfs信号会集中在一段orf序列的主阅读框内(也称为frame1)。根据具有翻译潜能的rfs这一特性进行orf score评分。
149.b)rrsscore:
150.核糖体在遇到终止密码子时会从rna上释放,因此具有翻译潜能的rfs在终止密码子后的丰度会显著低于上游的orf区。根据具有翻译潜能的rfs这一特性进行rrs score评分。
151.c)fickett score:
152.每个物种其编码序列和非编码序列在序列组成特性上有所差异,因此可以通过该物种已知的编码序列作为参考数据库,来评估未编注序列是否具有编码能力。根据这一方法进行fickett score评分,一般以fickettscore 0.74作为rfs具有编码潜能的标准。
153.以同时满足orfscore大于阈值、rrsscore大于阈值以及fickett score≥0.74作为标准,筛选出可能具有翻译潜能的sorf。
154.(4)orf注释
155.将两组间翻译差异倍数大于2且具有翻译潜能的orf进行注释,以及将sorf潜在编码的蛋白序列比对到 pfam数据库中(,版本号26.0)以期发现sorf潜在含有的蛋白结构域。
156.1.3.6分泌型小肽过表达条件培养基刺激成纤维细胞
157.筛选出来的分泌型小肽过表达及对照质粒所用载体为pmscv-ires-gfp,质粒合成委托金唯智生物科技有限公司完成。合成的分泌型小肽过表达质粒为:
158.cf48-pmscv-ires-gfp,hilpda-pmscv-ires-gfp,apoc1-pmscv-ires-gfp。
159.合成的对照质粒为pmscv-ires-gfp。
160.(1)转染分泌型小肽过表达及对照质粒,按照lipofectamine3000的操作流程进行转染,具体步骤如下:
161.a)用细胞生长培养基(dmem/f12+10%fbs)将293t工具细胞均匀种在六孔细胞板中;
162.b)细胞贴壁均匀稳定生长后将细胞生长培养基换成无血清培养基,每孔0.5ml;
163.c)按每个孔500μlopti-mem+2.5μgdna+3.75μllipofetamine3000+5μlp3000的量配置反应液,室温混匀放置15min后在每个孔分别加入500μl含过表达或对照质粒的反应液;
164.d)反应12h后换成细胞生长培养基(dmem/f12+10%fbs),于细胞培养箱中继续培养;
165.(2)收集分泌型小肽过表达及对照条件性培养基:转染质粒后24h,于正置荧光显微镜下观察细胞,可见细胞亮绿色荧光,表达绿色荧光的细胞密度约为70%。将细胞生长培养基换成无血清表达培养基(expressionmedium),反应36h后分别收集分泌型小肽过表达及空白对照条件性培养基,离心后弃去细胞碎片;
166.(3)用细胞生长培养基(dmem/f12+10%fbs)将nrk-49f细胞均匀种在六孔细胞板中;
167.(4)将收集的分泌型小肽过表达及对照条件性培养基分别加或不加入1ng/mltgf-β1后加入nrk-49f细胞中,反应48h后收集细胞蛋白,免疫印迹观察α-sma的表达量。
168.1.3.7细胞蛋白提取
169.(1)裂解蛋白:将六孔细胞板置于冰上,吸取培养基上清,用干净预冷的pbs洗去细胞碎片,每孔加入60μl细胞裂解液,冰上反应15min;
170.(2)用细胞刮板在每孔中按照一定的方向刮下蛋白,将细胞裂解液转移至1.5mlep管;
171.(3)15,000rpm,4℃,离心30min;吸取裂解液上清备用。
172.1.3.8bca法测蛋白浓度
173.依据bca试剂盒(thermo)操作流程,具体步骤如下:
174.(1)蛋白原液稀释相应的倍数后,在对应的96孔板中,每孔加入5μl蛋白以及5μl蛋白标准品;
175.(2)配置工作液(a液:b液=50:1),按照每孔200μl工作液加入至蛋白及标准品中;
176.(3)37℃反应30min;
177.(4)多功能酶标仪中测定562nm波长的吸光度,根据标准品绘制标准曲线计算出蛋白浓度。
178.1.3.9蛋白免疫印迹检测(westernblot)
179.(1)灌制page凝胶
180.依据page凝胶快速制备试剂盒(雅酶)的操作流程,制备10%的分离胶及积层胶,具体步骤如下:
181.a)洗净1.5mm的玻璃板,夹紧于配胶架上,固定于灌胶胶条上后,加入ddh20检查玻璃板是否漏水及液面是否水平;
182.b)配置下层胶缓冲液,按照操作流程的比例:4ml下层胶溶液+4ml下层胶缓冲液,充分混匀后加入80μl 促凝剂,混匀后加入玻璃板后缓慢加入无水乙醇,压平下层胶。静置等待约15min,可见下层胶和无水乙醇之间清晰的分界即下层胶凝结。倒去无水乙醇,室温下挥发晾干;
183.c)配置上层胶缓冲液,按照操作流程的比例:2ml上层胶溶液+2ml上层胶缓冲液,充分混匀后加入40μl 促凝剂,混匀后加入玻璃板,缓慢倾斜插入1.5mm 15孔梳,静置等待约15min,直至上层胶凝结。配置好的page凝胶湿润状态下存于4备用;
184.(2)sds-page电泳
185.将配置好的page凝胶用电泳夹夹于垂直电泳槽内,取出配平变性后的蛋白,于100℃空气浴中加热5min,待蛋白完全融解后,取出备用。在电泳槽内倒满配置好的1x电泳液,缓慢轻柔地拔出梳子,每孔中加入 30μl蛋白,于page凝胶的两端分别加入5μl蛋白分子量指示剂。开启电泳,先90v恒压缓慢跑胶,待蛋白样品全部进入分离胶,蛋白条带呈宽度较窄的水平线后调高电压,转为120v恒压,直至蛋白指示剂全部跑入电泳液后才停止电泳;
186.(3)转膜
187.甲醇浸泡激活pvdf膜。制备转膜“三明治”装置:从负极到正极依次是厚滤纸、分离胶、pvdf膜、厚滤纸,用滚轮赶走气泡,盖上电极盖,冰浴装置。恒压100v,转膜120min;
188.(4)封闭:配置5%牛奶(脱脂奶粉in tbst),转膜结束后将pvdf膜于ddh20清洗后于5%牛奶中常温封闭1h;
189.(5)一抗孵育:5%牛奶稀释一抗(1:1000),4℃摇床孵育过夜;
190.(6)洗膜:回收一抗后,于tbst摇床上洗10min,3次;
191.(7)二抗孵育:5%牛奶稀释二抗(1:5000),常温孵育1h;
192.(8)洗膜:回收二抗后,于tbst摇床上洗10min,3次;
193.(9)显影:在避光条件下,将发光液均匀滴在pvdf膜上,室温反应3分钟,将pvdf膜置于全自动化学发光成像仪,于自动曝光模式显影,若信号过强或过弱,改为手动曝光模式显影;
194.(10)蛋白剥离:pvdf膜加入蛋白剥离缓冲液,置于摇床上洗15min,后用tbst洗5min,加入5%牛奶常温封闭1h,继续孵育下一个抗体;
195.(11)结果分析:利用全自动化学发光成像系统定量分析目标蛋白条带的灰度值,分别与内参蛋白作为内对照计算目的蛋白的相对含量,进行统计分析。
196.1.4实验结果
197.1.4.1进展性糖尿病肾病小鼠和正常对照小鼠差异表达的基因
198.在具有编码潜能的orf中,通过筛选条件(fdr《0.05,|log2fc|》1)在进展性糖尿病肾病小鼠(dn)和正常对照小鼠(nc)组间筛选差异表达基因。结果发现两组显著差异基因数目有1981个,其中1622个为显著上调基因,359个为显著下调基因。dn及nc组小鼠基因的总体表达模式存在较大差异。如图1-1所示,在dn组中,多数基因呈现上调的表达模式,而nc组
则正好相反。属于nc组的各个样本(nc1-nc4) 和属于dn组的各个样本(dn1-dn5)的表达模式相近,说明nc小鼠及dn小鼠样本各自具有较好的重复性。
199.1.4.2目标基因的筛选条件
200.根据以下筛选条件筛选目标基因:
201.(1)目标基因需具有较好的保守性:由于实验在小鼠肾组织中进行测序,为了有更好的临床应用价值,研究目标需具有较好的保守性,需能同时在人及小鼠中表达。通过查阅数据库,在1981个差异表达基因中有39个基因具有较好的保守性,能同时在人及小鼠中表达(39/1981)。
202.(2)目标基因能翻译出小肽:鉴于翻译组学测序的优势,期望能筛选出与疾病相关的新型小肽,在39个保守性较好的基因中,有11个基因可翻译出氨基酸长度《100aa的小肽(11/39)。
203.(3)目标基因要为分泌型小肽:通过软件(signalp-5.0)进一步预测,在11个小肽中有3个为分泌型小肽 (3/11)。
204.(4)目标基因有潜在的生物学功能:在3个差异表达的分泌型小肽中,先通过体外实验初步验证该分泌型小肽是否具有生物学功能。
205.1.4.3分泌型小肽的促纤维化作用验证
206.通过1.4.2的筛选条件获得的cf48分泌型小肽均在糖尿病肾病小鼠肾组织中表达升高:
207.(1)cf48(mgi:2686519,dn/nc:log2(fc)=2.96,fdr=0.046,90aa)。
208.考虑到小肽分泌性的特点,设计了以下的体外实验。通过转染对照及cf48在糖肾小鼠中表达升高的分泌型小肽的过表达质粒于工具细胞,待充分表达后收集空白载体及小肽过表达条件性培养基上清,在含或不含tgf-β1的条件下刺激成纤维细胞(nrk-49f),观察成纤维细胞α-sma的表达情况,结果如图1-2、1-3 所示。根据图1-2、1-3,可见,与空白对照载体的条件性培养基相比,含cf48的过表达条件性培养基上清可增强tgf-β1诱导的成纤维细胞活化反应,α-sma的表达升高。
209.1.4.4小肽cf48具有高度保守性
210.小鼠基因cf48(gene name:gm1673 in mice,mgi:2686519,ncbi gene id:381633)位于5号染色体 (chr5:34,140,777-34,142,353),由4个外显子组成,可翻译氨基酸长度为90aa的小肽,氨基酸序列为seq:2。人的基因cf48(ncbi gene id:401115)位于4号染色体第48位开放阅读框(chr4:2,035,610-2,043,970),由 9个外显子组成,可翻译氨基酸长度为90aa的小肽,氨基酸序列为seq:1。比对小鼠和人的cf48的基因结构,cf48在人和小鼠中基因结构相似,基因同源性较好。根据cf48的蛋白序列在多个物种间的多重序列比对结果,得到小肽cf48在物种间具有高度进化保守性。
211.小鼠cf48的氨基酸序列:
212.mapalrsllsprtllllllslallgaraepatgsavpaqsrpcvdchafefmqralqdlrktaysldarte tlllqaerralcacwpagr(90aa)。
213.小鼠cf48的cdna序列:
214.atggcccccgcgctcaggtccttgctgtcgccacggactttactgctgctgctgctgagcctggcgctgctgggcgcccgcgccgagcccgccaccgggagcgctgtccccgctcagagccgcccgtgcgtgga ttgccacgc
atttgaattcatgcagcgcgcccttcaggacctacggaaaaccgcctacagcctggac gcacggacggagaccctcctgctgcaggctgagcgccgggctctgtgtgcctgctggccagctgga cgctga。
215.(注:下划线:信号肽,其余序列:分泌肽)。
216.1.4.5小肽cf48为分泌型小肽
217.通过signalp-5.0(http://www.cbs.dtu.dk/services/signalp-5.0/)对小肽cf48的分泌潜能进行预测,得到如下结果:小肽cf48在小鼠和人中均为分泌型小肽,且两者信号端和分泌端断裂的位点相同。小鼠的裂解位置在28和29位氨基酸之间,人的裂解位置在34和35位氨基酸之间,可裂解为位于细胞内的信号肽及分泌到细胞外的分泌肽。
218.1.4.6 cf48过表达条件培养基增强tgf-β1诱导的成纤维细胞活化反应
219.如前所述,根据图1-3的结果,与空白对照相比,cf48过表达条件性培养基可增强tgf-β1诱导的α-sma 的表达量,促进成纤维细胞活化。分泌性cf48具有促纤维化的生物学功能。
220.1.4.7通过上述实验,可以得出:
221.通过糖尿病肾病小鼠的翻译组学测序,发现小肽cf48在进展性糖尿病肾病小鼠肾组织中表达显著升高;含有分泌性cf48的过表达条件培养基可增强tgf-β1诱导的成纤维细胞活化反应,促进成纤细胞活化。第二部分,小肽cf48在慢性肾脏病患者中的表达情况
222.2.1研究目的
223.分析不同病因ckd患者肾组织及血清中cf48的表达情况,探讨cf48的与疾病活动度和肾损伤严重程度的相关性。
224.2.2实验材料
225.2.2.1实验主要仪器和设备
226.(1)多功能酶标仪,molecular devices,美国;(2)全自动洗板机,biorad,美国;(11)涡旋混合器xw-80a,上海医科大学仪器厂,中国。
227.2.2.2实验主要耗材
228.(1)免疫组化笔,中杉金桥,中国;(2)正电荷粘附玻片,thermo,美国;(3)盖玻片,广州威佳科技有限公司,中国。
229.2.2.3实验主要试剂
230.(1)pbs粉末,广州威佳科技有限公司;(2)bsa粉末,广州威佳科技有限公司;(3)30%过氧化氢,广州威佳科技有限公司;(4)免疫组化试剂盒,dako,丹麦;(5)mayer苏木素,abcam,美国;(6)中性树脂,合思生物,中国;(7)dapi,thermo,美国;(8)荧光封片剂,dako,丹麦;(9)50x抗原修复液,广州威佳科技有限公司;(10)cf48 elisa试剂盒,cusabio,中国;(11)抗体:抗cf48抗体购于abcam公司(美国),直标α-sma-cy3抗体,抗α-sma抗体购于sigma公司(美国),alexa fluro 488
‑ꢀ
标记山羊抗兔-igg购于life technology(美国)。
231.2.3研究方法
232.2.3.1研究对象
233.2.3.1.1临床研究伦理
234.本研究通过中山大学附属第一医院伦理委员会批准,所有患者及疾病、健康对照都签署知情同意书,伦理批件号为《中山大学附属第一医院伦审(2016)215号》。
235.2.3.1.2ckd患者的纳入和排除标准
236.纳入中山大学附属第一医院肾内科通过肾活检证实为ckd的病例进行肾组织cf48表达量和血清中游离 cf48含量的检测。所选的ckd病种包括:糖尿病肾病(dn)、狼疮性肾炎(ln)和iga肾病(igan)。患者的纳入标准:纳入2018年9月至2021年9月在中山大学附属第一医院肾内科行肾穿刺活检的患者;肾穿结果符合dn、ln或igan其中一种;年龄18-65岁,男女不限,ckd1-5期,愿意签署知情同意书。
237.患者的排除标准:合并严重并发症,如恶性肿瘤、心力衰竭、恶性高血压、脑血管意外等。
238.2.3.1.3疾病对照组及健康对照组的纳入标准
239.糖尿病肾病疾病对照组(dm)纳入标准:年龄18-65岁,诊断符合美国糖尿病协会(american diabetesassociation,ada)2020年修订的糖尿病诊断标准,同时不伴有任何程度的肾损害表现。愿意签署知情同意书。
240.健康对照组纳入标准:年龄18-65岁,肾功能正常,无镜下血尿及蛋白尿,近期无感染,无重大疾病史。愿意签署知情同意书。
241.2.3.1.4样本采集
242.所有ckd患者和对照采集外周静脉血5ml,离心分离得血清,冻存于-80℃待用。ckd患者肾组织切片来源于肾活检石蜡切片,正常对照切片来源于肾癌患者癌旁正常肾组织石蜡切片。
243.2.3.1.5临床信息采集
244.(1)人口学资料:采集入选ckd患者、dm疾病对照及健康对照的性别、年龄等人口学资料;
245.(2)疾病严重程度指标:采集入选ckd患者原发病病程、既往高血压病史、糖尿病病史、心血管疾病病史;采集血清尿素氮(bun)、血肌酐、血白蛋白、血尿酸、空腹血糖、糖化血红蛋白、24h尿蛋白指标; egfr计算采用简化mrdr计算公式。
246.(3)病理指标:
247.a)糖尿病肾病患者:根据肾活检组织病理学诊断,采用tervaet等提出的病理分型将dn患者分为2级、3 级、4级。
248.b)狼疮性肾炎患者:根据肾活检组织病理学诊断,采用isn/rps病理分型。
249.c)iga肾病患者:根据肾活检组织病理学诊断,采用lee氏分级将iga肾病患者分为lee氏分级≤3组和 lee氏分级》3组。lee氏分级标准主要参照1982年lee氏分级标准。
250.2.3.2荧光原位杂交染色(cf48)
251.采用dn患者及肾癌癌旁正常肾组织石蜡切片(5μm)进行荧光原位杂交染色,探针合成及原位杂交染色委托广州赛维尔生物科技有限公司完成。
252.2.3.3免疫组化染色(cf48,α-sma)
253.(1)烤片:5μm厚的石蜡切片,60℃烤箱烤片1h,直至切片上的蜡完全脱去;
254.(2)脱蜡水化:按以下顺序进行:二甲苯(20min,2次),无水乙醇(10min,2次),95%乙醇(10min, 2次),75%乙醇(10min,2次),pbs缓冲液(5min,1次);
255.(3)抗原修复:配置1x抗原修复液(柠檬酸钠盐,0.01mol/l,ph=6),高压锅修复,煮沸至高压锅最高沸点后自然冷却至室温,整个过程约3h。pbs缓冲液5min洗去抗原修复液;
256.(4)组化笔画圈:擦干组织周围的水份,用免疫组化笔轻柔地画圈,完整围住组织后置入湿盒上,期间应避免组织干片;
257.(5)灭活过氧化氢酶:于每个组化圈中滴加3%过氧化氢溶液50μl,室温避光孵育15min后,置于pbs 缓冲液中于摇床上5min,洗3次;
258.(6)封闭:于每个组化圈中滴加5%bsa(pbs配置)溶液50μl,室温封闭10min;
259.(7)一抗孵育:将一抗以相应的浓度稀释(cf48,1:100,α-sma,1:1000)于pbs缓冲液中,室温避光孵育1h;
260.(8)二抗孵育:置于pbs缓冲液中于摇床上10min,洗3次,于每个组化圈中滴加免疫组化试剂盒中的 a液(鼠兔联用二抗)50μl,室温避光孵育1h;
261.(9)dab显色:置于pbs缓冲液中于摇床上10min,洗3次,将免疫组化试剂盒中的b液、c液以50:1 的比例配置成dab反应工作液,滴加于组化圈中,于显微镜下观察反应速度,反应完全后,予ddh20冲尽;
262.(10)苏木素复染:将切片浸于mayer苏木素中染色3min,予ddh20冲尽;
263.(11)常规脱水封片:按以下顺序进行:75%乙醇(5min,2次),95%乙醇(5min,2次),无水乙醇(5min, 2次),二甲苯(5min,2次),予中性树脂封片;
264.(12)于正置显微镜下观察拍照。
265.2.3.4免疫荧光染色(cf48,α-sma)
266.(1)5μm厚的石蜡切片常规烤片,脱蜡水化,抗原修复,组化笔画圈步骤同2.3.3(1)-(4);
267.(2)封闭:于每个组化圈中滴加1%bsa(pbs配置)溶液50μl,室温封闭1h;
268.(3)一抗孵育:将一抗以相应的浓度稀释(cf48,1:50,α-sma,1:5000)于1%bsa液中,4℃避光孵育过夜;
269.(4)二抗孵育:置于pbs缓冲液中于摇床上10min,洗3次,将相应的二抗以1:1000稀释于1%bsa液中,常温孵育1h;
270.(5)dapi复染:置于pbs缓冲液中于摇床上10min,洗3次,dapi以1:100的浓度常温孵育5min;
271.(6)封片:置于pbs缓冲液中于摇床上10min,洗3次,甩干水份后滴加封片剂,盖上盖玻片后常温闭光干燥过夜;
272.(7)于激光共聚焦显微镜下观察拍照。
273.2.3.5免疫组化染色面积计量
274.需要定量的玻片于全自动扫描仪中进行扫描。通过单盲的方法,在高倍镜(
×
200)视野下随机选择 10个肾皮质视野。通过image j(http://www.imagej.nih.gov/ij/)对阳性信号的表达强度进行定量。将每个视野的阳性表达强度占一个视野面积的百分比作为目标分子表达量,取10个视野的表达量平均值作为目标分子(cf48、α-sma)的表达量。
275.2.3.6血清cf48含量的检测
276.根据cf48elisa试剂盒的操作流程进行操作,具体步骤如下:
277.(1)所有试剂提前30min恢复至室温;
278.(2)配置标准品:通过样品稀释液将标准品溶解为浓度为40ng/ml的母液浓度,对倍稀释,获得浓度分别为40、20、10、5、2.5、0.625和0ng/ml的标准品;
279.(3)加板孵育:每孔分别加入100μl标准品及各个实验组血清,贴上贴膜轻轻摇匀,37℃恒温箱孵育2h;
280.(4)直接弃去上清,在纸上拍干残余液体,每孔加入100μl带生物素的一抗稀释液(biotin-antibody),贴上贴膜轻轻摇匀,37℃恒温箱孵育1h;
281.(5)洗板:通过自动洗板机,每孔加入300μl洗涤液后吸去洗涤液,重复3次后在纸上拍干残余液体。
282.(6)每孔加入100μl辣根过氧化物酶-生物素结合物(hrp-avidin),贴上贴膜轻轻摇匀,37℃恒温箱孵育 1h;
283.(7)洗板:同步骤(6),重复5次后在纸上拍干残余液体。
284.(8)每孔加入90μl tmb底物显色液,37℃恒温箱避光孵育30min,直至样品及标准品孔中液体逐渐显出蓝色;
285.(9)每孔加入50μl终止液,轻轻混匀,直至液体由蓝色转为黄色;
286.(10)酶标仪在450nm波长处读取吸光度(od值);
287.(11)绘制标准曲线,计算样品浓度。
288.2.3.7统计分析
289.数据以均数
±
标准差表示,数据分析采用spss 26.0软件,graphpad prism 8.0版(graphpad software,sandiego,ca)进行。两组间比较采用t检验(student’s t test),多组间比较采用方差分析(anova),而后通过tukey’s post-test进行三组或多组间的多重比较。相关性分析采用sperman相关性分析。p值《0.05 被定义为具有统计学意义。
290.2.4实验结果
291.2.4.1 cf48 mrna在dn患者肾组织中表达量升高
292.为了明确cf48在临床患者中的表达情况,通过dn患者肾穿组织及肾癌癌旁正常组织进行荧光原位杂交 (fluorescence in situ hybridization,fish)染色,以明确dn患者中cf48mrna的定位及表达情况。结果如图2-1所示,与正常肾组织相比,dn患者cf48mrna表达量显著升高,主要位于肾小管,在显著损伤、扩张的小管中表达量更高,而在肾小球中未见cf48mrna的表达。cf48 mrna的表达在糖肾患者损伤的肾小管中显著升高,在糖肾患者的肾小球及正常肾组织中均未见cf48 mrna的表达,证实了小肽cf48由损伤的小管细胞产生。
293.2.4.2 cf48在dn患者肾组织中表达量升高
294.通过免疫组化染色,检测dn患者及正常肾组织中cf48的表达情况。如图2-2可见,cf48在dn患者肾组织中显著升高,且阳性信号集中在肾小管间质。进一步统计分析cf48在小管间质的表达强度,结果如图2-2c所示,结果显示cf48在dn患者肾小管间质区域的表达强度显著高于正常肾组织,差异具有统计学意义(p《0.001)。
295.2.4.3 cf48在ckd患者肾组织中表达量升高
296.进一步检测cf48在其他病因的ckd患者肾组织中的表达情况,以明确小肽cf48在肾组织中的表达升高是糖尿病肾病特异性的还是非特异性的。选择了肾癌癌旁正常肾组织作为正常对照,微小病变性肾病(mcd) 患者肾穿组织作为疾病对照,以及ckd患者(包括ln、igan及dn)的肾穿组织,通过免疫荧光检测cf48 的表达情况。结果如图2-3所示,根据图2-3的结果可见,cf48在正常对照及mcd患者肾组织中表达量较低,未见显著表达,α-sma染色也未见升高。而ckd患者,包括ln、igan及dn患者的肾组织中cf48的表达量显著升高,信号主要
位于小管上皮细胞,且在α-sma表达量高的部位,升高更为显著。由此可见,小肽 cf48在不同病因的ckd患者的肾组织中表达量升高,且与纤维化指标α-sma的表达有的相关性。小肽cf48 可作为肾病的标志物,表征肾病及纤维化程度。
297.2.4.4分泌性cf48在ckd患者血清中含量升高由于cf48为分泌型小肽,先通过elisa试剂盒检测正常志愿者(ctl)、糖尿病不伴有糖尿病肾病的疾病对照(dm)及糖尿病肾病(dn)患者血清中cf48的含量。如图2-4所示,dn患者的血清cf48含量与正常对照相比显著升高(9.678
±
4.661vs1.243
±
1.566,p《0.0001),且与dm患者相比也显著升高 (9.678
±
4.661vs 1.626
±
1.150,p《0.0001),而正常对照及dm患者两者的血清cf48含量没有显著性差异。这一结果表明,分泌型小肽cf48是促进肾脏病进展的关键,其水平与患者的糖耐量水平无关。因此进一步检测了其他非dn病因的ckd患者的血清中cf48的含量,结果表明,igan及ln患者血清中cf48含量分别为7.131ng/ml及8.752ng/ml,与正常对照相比均显著升高(p《0.0001)。以上结果表明,血清中小肽cf48在不同病因的ckd患者中含量升高,其表达量的上调与肾脏疾病的进展相关,与其发病原因无关,因此可能参与ckd进展的共同机制。
298.2.4.5 ckd患者血清分泌性cf48含量与egfr呈显著负相关
299.对ckd患者的血清分泌性cf48含量与egfr进行相关性分析,结果见图2-5a。根据图2-5a可见,ckd患者的血清分泌性cf48含量与egfr呈显著负相关(相关系数r=-0.496,p《0.0001,n=73)。图2-5b是ckd患者的血清分泌性cf48含量与ckd分级的关系,可见,ckd患者中血清cf48含量可反映患者的ckd分期,呈显著正相关(相关系数r=0.625,p《0.0001,b=73),cf48含量越高,ckd分期越高。可见,血清中分泌性cf48 含量可表征肾病的程度及患者的ckd分期。
300.2.4.6血清分泌性cf48含量与肾组织纤维化程度呈显著正相关
301.为了探讨血清cf48的含量与患者肾组织纤维化程度的关系,调取了其中在中山大学附属第一医院肾内科进行肾穿刺活检的dn患者的肾穿病理玻片,通过α-sma免疫组化染色来反映患者肾组织纤维化程度并与患者血清cf48的含量进行相关性分析。结果如图2-6所示,dn患者血清中cf48的含量与患者肾组织α-sma的表达强度呈显著正相关(相关系数r=0.815,p《0.0001,n=16)。列举其中代表性的2个患者,患者一的血清cf48的含量为15.128ng/ml,α-sma染色阳性面积为14.94%,而患者二的cf48的含量为3.718 ng/ml,α-sma染色阳性面积为3.78%。可见,cf48的含量可以表征肾组织的纤维化程度,可作为肾组织纤维化程度表征的标志物。
302.2.4.7 dn患者血清分泌性cf48含量与临床指标相关性分析
303.接着对本次纳入的ckd患者按照病种进行分层分析。对dn患者的血清分泌性cf48含量与临床指标进行相关性分析,结果见表2-1。根据表2-1可见,dn患者血清中分泌性cf48含量与患者的血尿素氮、血肌酐呈显著正相关(相关系数r=0.514,p=0.002;相关系数r=0.446,p=0.009),与患者的egfr呈显著负相关(相关系数r=-0.446,p=0.009),与ckd分期呈显著正相关(相关系数r=0.669,p《0.0001),血清中分泌性cf48含量越高,dn患者ckd分期越高,如图2-7所示。进一步对dn患者血清cf48含量与患者的病理分级进行相关性分析,发现dn患者血清cf48含量越高,患者肾组织病理分级越重,两者呈显著正相关(相关系数 r=0.385,p=0.027)。
304.表2-1 dn患者血清cf48含量与临床指标的相关性分析
[0305][0306][0307]
注:n=33,
*
p《0.05,
**
p《0.01,
****
p《0.0001。
[0308]
2.4.8 ln患者血清分泌性cf48含量与临床指标相关性分析
[0309]
对ln患者的血清分泌性cf48含量与临床指标进行相关性分析,结果见表2-2、图2-8。如图2-8所示,ln患者血清分泌性cf48含量与患者的血尿素氮、血肌酐呈显著正相关(相关系数r=0.610,p=0.004;相关系数 r=0.669,p=0.002),与患者的egfr呈显著负相关(相关系数r=-0.609,p=0.004),与ckd分期呈显著正相关 (相关系数r=0.693,p《0.0001)。对ln患者的血清cf48含量与isn/rps病理分级做相关性分析,两者未见显著的相关性(相关系数r=-0.097,p=0.731)。
[0310]
表2-2 ln患者血清cf48含量与临床指标的相关性分析
[0311][0312]
注:n=20,
**
p《0.01,
****
p《0.0001。
[0313]
2.4.9 igan患者血清分泌性cf48含量与临床指标相关性分析
[0314]
对igan患者的血清分泌性cf48含量与临床指标进行相关性分析,结果见表2-3。结
果可见,igan患者血清分泌性cf48含量与患者的肾组织穿刺活检结果中的lee氏分级呈显著正相关(相关系数r=0.564, p=0.023),患者血清中cf48含量越高,患者的肾穿结果lee氏分级越高,如图2-9所示。
[0315]
表2-3 iga肾病患者血清cf48含量与临床指标的相关性分析
[0316][0317]
注:n=20,
*
p《0.05。
[0318]
2.4.10 cf48在小鼠肺,心脏纤维化组织的表达
[0319]
为了进一步明确cf48在其他纤维化脏器组织的表达情况,我们在bleomycin诱导4周后的小鼠肺纤维化组织中检测cf48的表达。masson chrome染色显示正常肺(图2-10a)和纤维化的肺(图2-10b)。免疫组化显示正常小鼠肺检测不到cf48的表达,如图2-10c所示;肺组织中纤维化明显的部分仅可以检测少许散状点样cf48的表达,如图2-10d所示。免疫组化显示正常小鼠心脏检测不到cf48的表达,如图2-10e所示,纤维化的心脏cf48的表达也很低(如图2-10f所示),只见少许散状点样表达。
[0320]
2.4.11 cf48在肺疾病患者外周血中的表达水平
[0321]
为了进一步明确cf48在肺纤维化病人外周血中是否升高,我们用cf48 elisa试剂盒检测kl-6检测值在 800以上的样本(kl-6是间质性肺病的指标,代表2型肺泡上皮细胞的增生,正常人通常在500以下)。elisa 显示kl-6值800以上的病人外周血中cf48的水平为1.07
±
0.64ng/ml(mean
±
sd,n=57),而肺部其它疾病对照(包括肺炎,肺栓塞,肺癌等)cf48的水平为0.72
±
0.52ng/ml(mean
±
sd,n=32)。强烈提示肾纤维化患者外周血中cf48的水平比肺疾病患者,包括肺纤维化和非肺纤维化相比明显增高,提示cf48升高可以作为肾纤维化的一个特异性指标。
[0322]
2.5小结
[0323]
综上,小肽cf48的表达量在不同病因的ckd患者肾组织中显著升高。分泌型小肽cf48含量在ckd 患者血清中显著升高,且与患者的egfr呈显著负相关,与患者肾组织纤维化程度及肾脏病理严重程度呈显著正相关。正常小鼠肺和心脏,cf48的表达量免疫组化几乎检测不到,bleomycin诱导的肺纤维化组织可以检测到微量到近乎可以忽略的cf48的表达,而angiotensin ii诱导的心脏纤维化组织cf48可见少许表达。肺疾病患者外周血中
cf48的水平没有升高,cf48升高可以作为肾纤维化的一个特异性指标。
[0324]
第三部分,小肽cf48在小鼠肾脏纤维化和炎症中的作用和机制
[0325]
3.1.1研究目的:探讨cf48过表达对小鼠疾病进展中肾脏纤维化和炎症的作用。
[0326]
3.1.2实验材料
[0327]
3.1.2.1实验动物:c57bl/6购自江苏集萃药康生物科技有限公司,cf48转基因亲本小鼠委托广州赛页生物科技有限公司培育。
[0328]
3.1.2.2主要实验试剂
[0329]
(1)链脲霉素,sigma,美国;(2)叶酸,sigma,美国;(3)小鼠基因型快速鉴定试剂盒,广州诺维赞生物科技有限公司;(4)50xtae溶液,广州晶欣生物科技有限公司;(5)琼脂糖,sigma,美国;(6)核酸染色剂,广州诺维赞生物科技有限公司;(7)page凝胶快速制备试剂盒,雅酶,中国;(8)10x电泳溶液:144g甘氨酸(glycine)+30.2gtrisbase+10gsdsin1000mlddh20;(9)10x转膜溶液:144g甘氨酸(glycine)+30.2gtrisbasein1000mlddh20;(10)1xtbst溶液:tbst粉末(广州威佳生物科技有限公司)in2000mlddh20+2mltween-20;(11)tween-20,sigma,美国;(12)蛋白剥离缓冲液,thermo,美国;(13)脱脂奶粉,bd,美国;(14)bsa粉末,广州威佳生物科技有限公司;(15)2
×
sds上样缓冲液,sigma,美国;(16)预染蛋白质分子量标记,thermo,美国;(17)ripa蛋白裂解液,millipore,美国;(18)蛋白酶抑制剂,cellsignalingtechnology,美国;(19)ecl发光液,millipore,美国;(20)辣根过氧化物酶(hrp)标记驴抗小鼠igg,cellsignalingtechology,美国;(21)辣根过氧化物酶(hrp)标记羊抗兔igg,cellsignalingtechnology,美国;(22)pvdf膜,millipore,美国;(23)trizolreagent,invitrogen,美国;(24)depc水,广州威佳生物科技有限公司;(25)化学试剂:氯仿、异丙醇、无水乙醇、95%乙醇、75%乙醇、甲醇、二甲苯等均为分析纯试剂,购于广州化学试剂二厂;(26)transcriptorfirststrandcdnasynthesiskit,roche,瑞士;(27)sybrgreenreal-timepcr试剂盒,roche,瑞士;(28)alexafluro488标记山羊抗小鼠igg,lifetechnology,美国;(29)alexafluro488标记山羊抗兔igg,lifetechnology,美国;(30)alexafluro488标记驴抗山羊igg,lifetechnology,美国;(31)alexafluro555标记山羊抗兔igg,lifetechnology,美国;(32)alexafluro647标记山羊抗兔igg,lifetechnology,美国;(33)dapi,thermo,美国;(34)荧光封片剂,dako,丹麦;(35)免疫组化试剂盒,dako,丹麦;(36)中性树脂,合思生物,中国;(37)cystatin-celisakit,abcam,美国;(38)albuminelisakit,abcam,美国;(39)cretanineelisakit,r&d,美国;(40)masson染色试剂盒,sigma,美国;(41)pas染色试剂盒,武汉博尔夫生物科技有限公司;(42)抗体:抗coliv抗体购于southernbiotech公司(美国);抗coli抗体购于boster公司(中国);抗fn抗体购于abcam公司(美国);抗f4/80抗体,抗α-tubulin抗体购于cellsignalingtechnology公司(美国);直标抗α-sma-cy3抗体,抗α-sma抗体购于sigma公司(美国);(43)用于免疫印迹实验的兔抗-小鼠cf48抗体委托杭州铭研生物科技有限公司定制完成。识别的抗原序列为:ralqdlrktaysldartetlllqae。
[0330]
3.1.3研究方法
[0331]
3.1.3.1转基因小鼠繁育
[0332]
c57bl/6背景的cf48转基因小鼠(cf48-tg)公鼠和母鼠一对,由赛页生物科技公司制备。通过载体构建、纯化与感染试剂一起注射到受精卵后移植到代孕母鼠输卵管中,经
pcr鉴定后获得阳性首建鼠。后在中山大学实验动物中心进行繁殖,采用cf48-tg与cf48-wt小鼠进行交配,所得子代进行pcr鉴定后获得适用于实验的cf48-tg与cf48-wt小鼠。
[0333]
用于实验的tg及wt小鼠为8-10周龄,体重25-30g的雄鼠,饲养于中山大学实验动物中心。环境为无特定病原体动物级(spf),饲予标准饲料与清洁水,予12h/12h昼夜循环,环境维持20-25℃。在实验过程中小鼠均可自由进食、饮水。本实验经中山大学实验动物伦理委员会审核通过,实验批准编号《sysu-iacuc-2022-000134》。
[0334]
3.1.3.2转基因小鼠基因型鉴定
[0335]
剪取4周龄断奶小鼠的鼠尾组织,按照小鼠基因型快速鉴定试剂盒(广州诺维赞生物科技有限公司)说明书进行操作,步骤如下:
[0336]
(1)提取组织dna:每只小鼠的鼠尾组织用100μl的裂解液加入2μl的蛋白酶k,56℃热水水浴煮30min 裂解组织后用98℃热水水浴煮5min灭活蛋白酶k,吸上清保存于-20℃待用;
[0337]
(2)配置pcr体系
[0338]
按照以下体系,每只小鼠的鼠尾组织需要:
[0339][0340]
tg小鼠鉴定pcr引物序列如下:预计转基因小鼠pcr产物大小:232bp;
[0341]
primer f:ggcaacgtgctggttattgtg;
[0342]
primer r:gtattgcctctgaaagcatgttc。
[0343]
(3)pcr程序
[0344]
按以下pcr程序进行反应:
[0345][0346]
(4)配置琼脂糖水平电泳胶
[0347]
将配置的模具放置于水平台面,插上25孔梳。配置1xtae溶液,每个中型模具需
200ml溶液,加入2%的琼脂糖,混匀。微波炉高温加热直至溶液沸腾,取出用力摇匀,再次放入微波炉加热,至沸腾后再次取出用力摇匀,直至溶液变澄清透明,琼脂糖完全溶解。加入核酸染色剂6μl,混匀后倒入模具。待溶液冷却凝固成胶待用;
[0348]
(5)水平电泳
[0349]
将琼脂糖胶置于水平电泳槽中,加入1xtae溶液。将pcr产物混匀后每孔10μl加入琼脂糖胶中,120v 恒压跑20min后,于紫外下观察拍照。
[0350]
3.1.3.3动物模型制备,分组
[0351]
3.1.3.3.1链脲霉素诱导的糖尿病肾病小鼠模型(dn)的建立和分组
[0352]
链脲霉素(stz)诱导dn的方法同1.3.2,c57bl/6背景的cf48-tg及wt小鼠空腹4h后以55mg/kg的 stz溶解于0.1mmol/l,ph为4.5的柠檬酸钠溶液中,腹腔注射,连续注射5天。stz诱导后2周,测量空腹血糖,空腹血糖大于16.7mmol/l的小鼠为造模成功,成功诱导出糖尿病(dm)模型,处死空腹血糖未达标的小鼠。dm造模后2周测量糖化血红蛋白,糖化血红蛋白》7%的小鼠为造模成功,处死糖化血红蛋白未达标的小鼠。剩余小鼠为造模成功,于dm造模后12w处死(dn组)。对照小鼠予同样剂量的柠檬酸钠溶液作为溶剂对照组(nc组)。dm造模后分别在第3周、第6周、第8周、第10周、第12周通过代谢笼留取4h随机尿用于尿白蛋白的检测。
[0353]
tg及wt小鼠采用随机数字表法随机分为4组,每组8-15只,具体如下
[0354]
(1)cf48野生型,溶剂组(wt-nc组);
[0355]
(2)cf48野生型,糖尿病肾病组(wt-dn组);
[0356]
(3)cf48转基因,溶剂组(tg-nc组);
[0357]
(4)cf48转基因,糖尿病肾病(tg-dn组)。
[0358]
3.1.3.2.2叶酸诱导的叶酸性肾病小鼠模型(fan)的建立和分组
[0359]
叶酸(fa)诱导叶酸性肾病小鼠(fan),具体过程是:采用大剂量一次注射的方法,由叶酸诱导出中毒性小管坏死性叶酸性肾病模型。以0.25mg/g的fa溶解于0.3mol/l的碳酸氢钠溶液中,腹腔注射,注射1 次。叶酸诱导后2天称量体重,叶酸诱导后2天采用麻醉后眼眶内眦静脉采血的方法采取微量血,离心得血清用于血cysc的测量。叶酸诱导后2天血清cysc含量大于1500μg/l为造模成功,处死造模失败的小鼠。
[0360]
tg及wt小鼠采用随机数字表法随机分为4组,每组8-15只,具体如下:
[0361]
(1)cf48野生型,溶剂组(wt-nc组);cf48野生型,叶酸性肾病组(wt-fan组);cf48转基因,溶剂组(tg-nc组);cf48转基因,叶酸性肾病组(tg-fan组)。
[0362]
3.1.3.4肾组织总蛋白的提取
[0363]
(1)取每组小鼠肾组织在冷台上切取约3mg大小,置于1.5mlep管内,每个ep管加入200μl蛋白裂解液(1x ripa+蛋白酶抑制剂);
[0364]
(2)每个ep管加入1颗直径3mm的研磨珠,于研磨仪中,以0℃,60hz,15s的参数研磨2次,其间间隔8s;
[0365]
(3)冰上置30min后,15,000rpm,4℃,离心30min;
[0366]
(4)吸取蛋白上清液,用ddh20稀释20倍后,通过bca法测蛋白浓度;
[0367]
(5)每组小鼠肾组织配平蛋白,每次电泳的体系为50ug蛋白,20ul总体积;
[0368]
(6)加入2x loading buffer,98℃空气浴,10min,裂解变形蛋白。变性后蛋白保存
于-20℃备用。
[0369]
3.1.3.5 bca法测蛋白浓度:步骤同1.3.8。
[0370]
3.1.3.6蛋白免疫印迹检测(western blot)
[0371]
小分子量的指标如cf48用分离胶浓度为15%的page凝胶进行sds-page电泳,转膜采用半干转。小分子量目标蛋白(cf48)采用半干转转膜。按照说明书,配置半干转专用转膜液,每块胶配置100ml,配方为:20ml 5x半干转转膜液,20ml无水乙醇,60ml ddh20。提前30min将厚滤纸泡于半干转专用转膜液中,使滤纸浸透转膜液,甲醇浸泡激活pvdf膜。从负极到正极依次是厚滤纸、pvdf膜、分离胶、厚滤纸,用滚轮赶走气泡,盖上电极盖,恒流2.5a,限压25v,转膜7min。其余步骤同1.3.9。
[0372]
3.1.3.7肾组织总rna提取
[0373]
(1)每组小鼠肾组织在冷台上切取约3mg大小,置于1.5mlep管,每个ep管加入500μltrizol溶液;(2) 每个ep管加入1颗直径3mm的研磨珠,于研磨仪中,以4℃,60hz,15s的参数研磨4次,其间间隔8s; (3)每个ep管补加500μltrizol后,加入200μl氯仿后上下剧烈混匀30s,静置10min,直至可见混合物清晰分为水相(rna,dna)和氯仿相(蛋白);
[0374]
(4)15,000rpm,4℃,离心30min;(5)每个ep管加入500μl异丙醇,将离心后的混合物吸取最上层的水相,加入异丙醇中,上下颠倒混匀,于冰上静置2h;(6)15,000rpm,4℃,离心30min;(7)离心后可见沉淀,弃去上清;(8)用无水乙醇及无酶水(depc水)配置70%的乙醇,每管加入1ml无酶的70%乙醇,吹打;(9)15,000rpm,4℃,离心5min;
[0375]
(10)重复(7)-(9);(11)弃去上清,确保无乙醇残留,冰上静置晾干;(12)待沉淀周围变透明,每管加入20μl无酶水,溶解rna;(13)于分光光度计测量rna浓度,冻存于-80℃待用或者逆转录为cdna。
[0376]
3.1.3.8逆转录反应
[0377]
按照逆转录试剂盒的操作说明书(roche)操作,采用两步法,具体步骤如下:
[0378]
(1)配置第一步反应的试剂,每份rna需要以下用量:
[0379][0380]
(2)pcr仪反应:65℃加热反应10min;
[0381]
(3)配置第二步反应的试剂,每孔7μl,加入已反应的体系中,混匀:
[0382][0383]
(4)pcr仪反应:按以下程序进行反应:
[0384][0385]
(5)逆转录完成后的cdna于分光光度计测量浓度后,冻存于-20℃待用。
[0386]
3.1.3.9实时荧光定量pcr(qrt-pcr)
[0387]
按照实时荧光定量pcr试剂盒的操作说明书(roche)操作,具体步骤如下:
[0388]
(1)稀释cdna:将cdna用无酶水稀释20倍,使最终体系内cdna的总量为20ng;
[0389]
(2)配置反应混合物:每孔混合物的用量如下:
[0390][0391]
(3)加板:按每孔4μl cdna及6μl反应混合物的量加入96孔板或384孔板;
[0392]
(4)实时荧光定量pcr仪反应:反应体系如下:
[0393][0394]
qrt-pcr引物合成委托深圳华大科技基因有限公司完成,具体序列如下:
[0395][0396][0397]
3.1.3.10小鼠血糖、糖化血红蛋白检测
[0398]
小鼠禁食空腹6h后,于安静的环境中,剪去小部分鼠尾组织。
[0399]
空腹血糖测量:将血糖试纸插入血糖仪中,待仪器显示待检测的提示后,于尾尖挤取血液一滴,滴于血糖试纸中等待3s,显示记录结果。
[0400]
糖化血红蛋白测量,按照糖化血红蛋白分析仪的操作流程(三诺),具体如下:
[0401]
(1)试剂复温30min;
[0402]
(2)开机:将试剂盒附带密码牌插入糖化血红蛋白仪,核对密码牌信息;
[0403]
(3)样本采集:用取样器于小鼠鼠尾尖挤取血液至血液达到毛细管顶端,将取样器插入r1试剂容器中,用力将毛细管中血样甩入r1试剂,充分摇匀,静置2min;
[0404]
(4)加样:将r1混合物滴入糖化血红蛋白试纸条上,避免产生气泡,再将r2试剂垂直滴加于试纸条上,静置15s,确保r2试剂充分渗入试纸条膜内;
[0405]
(5)测试读取结果:将试纸条插入糖化血红蛋白仪中,等待30s后显示记录结果。
[0406]
3.1.3.11小鼠肾功能检测
[0407]
fa诱导后2d,通过内眦静脉采集小鼠全血200μl,室温下静置1小时后,3000rpm常温离心10分钟,取上层血清用于小鼠血cysc检测。
[0408]
杀检小鼠时,通过麻醉后腹主动脉采血的方法收集小鼠全血,室温下静置1小时后,3000rpm常温离心10 分钟,取上层血清用于小鼠疾病终点血肌酐、血尿素氮及血cysc检测。小鼠血肌酐、血尿素氮通过全自动生化仪检测,小鼠血cysc通过elisa(abcam,美国)检测,根据操作说明书,血清稀释2000倍,具体的步骤同2.3.6。
[0409]
3.1.3.12小鼠尿白蛋白检测
[0410]
过代谢笼收集dn及对照小鼠在疾病的第3、6、8、10、12w的4h随机尿,通过elisa检测小鼠尿白蛋白(albumin,abcam,美国)和尿肌酐(cretanine,r&d,美国),根据操作说明书,尿白蛋白的检测尿液稀释2000倍,尿肌酐的检测用原液,具体的步骤同2.3.6。用尿白蛋白/尿肌酐(urine albumin/cretanine) 的比值来反映小鼠尿白蛋白情况。
[0411]
3.1.3.13小鼠肾组织病理染色
[0412]
(1)pas染色:根据操作说明书,具体的步骤如下:
[0413]
a)5μm厚的石蜡玻片常规脱蜡水化,步骤同2.3.3(1)-(2);b)蒸馏水洗1-2min;c)高碘酸溶液氧化 10min;d)蒸馏水洗去浮色;e)雪夫试剂染色30min;f)蒸馏水洗去浮色;g)mayer苏木素染核3min;h)蒸馏水洗去浮色;i)常规脱水透明,中性树脂封片,步骤同2.3.3(11);
[0414]
k)于正置显微镜下观察拍照或于全自动扫片机中扫片。
[0415]
(2)masson染色:根据操作说明书(sigma),具体的步骤如下:
[0416]
a)5μm厚的石蜡玻片常规脱蜡水化,步骤同2.3.3(1)-(2);b)配置1%乙酸溶液(200ml inddh20),含铁苏木素溶液(100ml a液+100ml b液),磷酸盐溶液(50ml c液+50ml d液+100mlddh20);e)含铁苏木素溶液染色5min;f)流水冲洗5min洗去浮色,ddh20涮洗;g)品红溶液染色5min;h)ddh20涮洗洗去浮色;i)磷酸盐溶液染色5min;j)ddh20涮洗洗去浮色;
[0417]
k)anline blue溶液染色20min;l)ddh20涮洗洗去浮色;m)1%乙酸溶液中上下涮洗2次;洗去浮色;n)常规脱水透明,中性树脂封片,步骤同2.3.3(11);o)于正置显微镜下观察拍照或于全自动扫片机中扫片。
[0418]
3.1.3.14小鼠肾组织免疫组化/免疫荧光染色
[0419]
取5μm厚的石蜡玻片,步骤同2.3.3,2.3.4。
[0420]
3.1.3.15免疫组化f4/80
+
巨噬细胞计量
[0421]
将在全自动扫描仪中进行扫描的片子,通过单盲的方法,在高倍镜(
×
400)下随机
选择10个肾皮质视野。所选的视野需要避开小球及血管,对每个视野中f4/80
+
的细胞数目进行定量,取10个视野的细胞数平均值作为该小鼠肾小管间质区域f4/80
+
巨噬细胞的数量。
[0422]
3.1.3.16统计学方法:统计分析方法同2.3.7。
[0423]
3.1.4实验结果
[0424]
3.1.4.1 cf48转基因小鼠的鉴定
[0425]
对新生小鼠进行基因鉴定,根据小鼠的基因型鉴定结果,pcr结果显示表达232bp大小产物的即为cf48tg 小鼠。免疫印迹结果显示,与wt组相比,cf48tg小鼠肾组织中cf48蛋白表达显著增加。
[0426]
3.1.4.2 cf48在dn小鼠肾脏组织中表达升高
[0427]
通过免疫印迹,qrt-pcr,免疫荧光检测dn小鼠肾组织中cf48的表达情况。结果显示,dn小鼠cf48 的mrna表达水平,蛋白表达水平与nc小鼠肾组织相比均显著升高。免疫荧光显示cf48在dn小鼠肾组织中高表达,且主要表达在肾小管及肾间质,通过共染,可见cf48与α-sma阳性的肌成纤维细胞有共定位,如图3-1所示。
[0428]
3.1.4.3 cf48过表达糖尿病肾病小鼠肾功能进展加重
[0429]
血糖的测量的结果表明,dn小鼠的血糖和糖化血红蛋白较nc小鼠显著升高,达到糖尿病的标准。wt 以及tg 2组小鼠的空腹血糖及糖化血红蛋白无显著差异。以上结果表明,cf48过表达不能改变小鼠糖耐量情况,如图3-2a,b所示。tg-dn小鼠的肾重/体重比值与wt-dn小鼠相比显著升高,表明cf48过表达的糖尿病肾病小鼠肾脏超滤量更高,如图3-2c所示。
[0430]
动态观察wt-dn及tg-dn两组小鼠在糖尿病肾病进展过程中尿白蛋白情况。结果发现,dn小鼠随着糖尿病肾病的进展尿白蛋白排泄量逐渐升高,表明糖尿病肾病模型建立成功。2组小鼠在糖尿病肾病的早期 (3w)尿白蛋白/肌酐比没有显著差异,在糖尿病肾病进展的中期(6w),tg小鼠的尿白蛋白显著高于wt 小鼠,tg小鼠更严重的尿白蛋白一直持续到了杀检时的糖尿病肾病晚期(12w),如图3-2d、e所示。
[0431]
通过检测小鼠血cystatinc(cysc)的情况来反映小鼠的肾功能。如图3-2f显示,在杀检时,dn小鼠的血清cysc显著高于正常对照小鼠,表明该模型小鼠肾功能进展严重。nc组中tg小鼠与wt小鼠血清 cysc水平差异无统计学意义,dn组中tg小鼠的血cysc显著高于wt小鼠。以上结果表明,cf48过表达在不改变糖耐量的情况下,可加重糖尿病肾病小鼠的肾功能进展。
[0432]
3.1.4.4 cf48过表达糖尿病肾病小鼠肾脏病理损伤加重
[0433]
pas结果显示,与nc相比,dn小鼠的肾小球基底膜增厚,肾小球系膜细胞增殖,系膜区增厚,病变符合糖尿病肾病的改变。与wt小鼠相比,tg小鼠的糖尿病肾病损伤表现更为显著,还可见显著的肾小管基底膜增厚,小管外细胞间质显著增多的表现,如图3-3所示。
[0434]
3.1.4.5 cf48过表达糖尿病肾病小鼠肾脏纤维化程度加重
[0435]
免疫荧光结果显示,dn小鼠的细胞外基质iv型胶原(collageniv,coliv),纤连蛋白(fibronectin,fn),肌成纤维细胞标志物α-平滑肌肌动蛋白(α-sma)与nc小鼠相比显著增多。dn模型中,tg小鼠与wt 小鼠相比coliv,fn和α-sma的增多更为显著,表明tg-dn小鼠的肾间质纤维化加重。tg-dn小鼠与 wt小鼠相比肾小球中coliv的沉积显著增多,表明cf48
过表达也可以加重dn小鼠的肾小球硬化。免疫印迹的结果显示tg与wt小鼠相比,α-sma显著增多,与免疫荧光的结果一致,如图3-4所示。
[0436]
3.1.4.6 cf48过表达糖尿病肾病小鼠肾脏炎症反应加重
[0437]
f4/80是巨噬细胞的标记物,为了观察小鼠肾脏炎症情况,通过免疫组化计数各组小鼠肾皮质中f4/80
+
巨噬细胞的数量。实验结果发现,未造模的正常小鼠中,仅有少量巨噬细胞,wt和tg两组小鼠巨噬细胞数量没有显著差别。dn小鼠的肾皮质区域f4/80
+
巨噬细胞数量与nc小鼠相比显著增多,tg-dn小鼠与wt-dn 小鼠相比,f4/80
+
巨噬细胞数量显著增多,具有统计学差异,如图3-5a所示。
[0438]
为了进一步观察各组小鼠肾脏炎症反应的情况,利用qrt-pcr检测肾组织中炎性相关因子mcp-1、tnf-α mrna 水平。结果表明dn小鼠与nc小组相比,mcp-1、tnf-αmrna表达水平显著升高,tg-dn小鼠与 wt-dn小鼠相比,炎症因子的表达量进一步升高,如图3-5b所示。
[0439]
3.1.4.7 cf48在fan小鼠肾脏组织中表达升高
[0440]
通过qrt-pcr检测注射叶酸后2d、7d、14d、28d的肾组织中cf48的mrna表达情况。实验发现,在叶酸诱导后的第2d,cf48的mrna水平即显著升高,且随着疾病的进展,cf48的mrna水平逐渐升高,在fan第28d,cf48的表达水平最高。选择fan 28d的模型作为研究对象。
[0441]
通过免疫印迹显示fan-28d的肾组织中cf48的蛋白表达水平较正常肾组织显著升高。免疫荧光的结果显示在fan模型中cf48的表达显著升高,主要表达于肾小管,且在严重扩张,受损较为严重的肾小管中表达更为显著,如图3-6所示。
[0442]
3.1.4.8 cf48过表达叶酸性肾病小鼠肾功能进展加重
[0443]
叶酸造模后2天,fa小鼠的血cysc显著升高,符合急性肾损伤的改变。叶酸造模后28天,fa小鼠的血cysc,血肌酐(creatinine,cr),血尿素氮(bun)与nc小鼠相比显著升高,表明叶酸性肾病模型造模成功。fa 组中,tg小鼠与wt小鼠相比,血cysc,血cr显著升高,差异有统计学差异,血bun有升高的趋势,以上结果表明,cf48过表达可加重fa诱导28d后小鼠的肾功能进展,如图3-7所示。
[0444]
3.1.4.9 cf48过表达叶酸性肾病小鼠肾脏病理损伤加重
[0445]
fa诱导后28天后可见小鼠肾脏显著缩小,表面颗粒状明显,凹凸不平。masson染色结果显示,叶酸性肾病小鼠的肾小管明显扩张,小管排列紊乱,小管发生坏死,部分坏死的小管向管腔脱落,形成细胞管型,肾间质水肿明显,伴有炎症细胞浸润。masson染色中可见fa小鼠胶原沉积显著增多,肾组织纤维化明显。 fa组中,tg与wt小鼠相比,小管损伤程度更为严重,可见大量小管细胞坏死,细胞管型增多,胶原沉积显著增多。masson染色下计算胶原沉积的比例结果显示,fa小鼠的肾脏胶原沉积比例显著高于nc小鼠,fa小鼠中,tg小鼠胶原沉积比例显著高于wt小鼠,肾脏纤维化程度更重。
[0446]
3.1.4.10 cf48过表达叶酸性肾病小鼠肾脏纤维化程度加重
[0447]
免疫荧光结果显示,nc小鼠的col iv,fn主要表达在基底膜,形态规则,α-sma主要表达在血管。fa 小鼠肾组织中coliv,fn,α-sma染色显著增多增厚,排列紊乱,主要分布在肾间质。fa模型中,tg小鼠与wt小鼠相比肾组织纤维化相关因子的增多更为显著。免疫印迹的结果显示fa组中,tg小鼠的coli,α-sma表达显著增多,与免疫荧光的结果一致,如图3-8所示。
[0448]
3.1.4.11 cf48过表达叶酸性肾病小鼠肾脏炎症反应加重
[0449]
免疫组化的结果显示,fa小鼠与nc小鼠相比,f4/80
+
巨噬细胞数量显著增多,叶酸性肾病小鼠肾组织炎症反应显著加重。fa小鼠模型中,tg小鼠与wt小鼠相比,f4/80
+
的巨噬细胞数量显著增多,差异具有统计学差异。qrt-pcr的结果显示,fa小鼠的炎性相关因子mcp-1、tnf-α、il-1β的mrna表达水平均较nc小鼠显著升高,tg小鼠的炎症相关因子的表达量较wt小鼠进一步升高,如图3-9所示。
[0450]
3.2 cf48基因敲除在叶酸性肾病及梗阻性肾病小鼠模型中的作用
[0451]
3.2.1研究目的:验证cf48基因敲除对小鼠疾病进展中肾脏炎症和纤维化的作用。
[0452]
3.2.2实验材料:c57bl/6购自江苏集萃药康生物科技有限公司,cf48基因敲除亲本小鼠委托赛页生物科技有限公司培育。
[0453]
3.2.3研究方法
[0454]
3.2.3.1 cf48基因敲除小鼠繁育
[0455]
c57bl/6背景的cf48+/-小鼠(hz)公鼠和母鼠一对,由赛页生物科技公司制备。通过crispr/cas9技术,设计sgrna,通过高通量电转受精卵方式,经pcr鉴定后获得cf48+/-首建鼠。后在中山大学实验动物中心(北校园)进行繁殖,采用cf48-hz公鼠和母鼠进行交配,所得子代进行pcr鉴定后获得适用于实验的cf48-/-(ko)与cf48+/+(wt)小鼠。
[0456]
用于实验的ko及wt小鼠为8-10周龄,体重25-30g的雄鼠,饲养于中山大学实验动物中心。本实验经中山大学实验动物伦理委员会审核通过,实验批准编号《sysu-iacuc-2022-000134》。
[0457]
3.2.3.2 cf48基因敲除小鼠基因型鉴定
[0458]
鼠尾dna提取、pcr反应、制胶、水平电泳步骤同3.1.3.2。
[0459]
ko小鼠鉴定pcr引物序列如下:预计ko小鼠pcr产物大小:246bp;
[0460]
primer f1:ttggtctcccacacgaatgg;primer r1:ccagagctcagcttccacaa。
[0461]
wt小鼠鉴定pcr引物序列如下预计wt小鼠pcr产物大小:265bp;:
[0462]
primer f2:gagcaggcatccactccttt;primer r2:agagctctcctccttcccag。
[0463]
pcr程序如下:
[0464][0465]
3.2.3.3动物模型制备,分组和研究计划
[0466]
3.2.3.3.1叶酸诱导的叶酸性肾病小鼠模型(fan)的建立和分组
[0467]
叶酸性肾病的造模方法同3.1.3.2.2。ko及wt小鼠采用随机数字表法随机分为4组,每组8-15只,具体如下:(1)cf48野生型,溶剂组(wt-nc组);(2)cf48野生型,叶酸性肾病组(wt-fan组);(3)cf48 基因敲除,溶剂组(ko-nc组);(4)cf48基因敲除,叶酸性肾病组
(ko-fan组)。
[0468]
3.2.3.3.2单侧输尿管结扎小鼠模型(uuo)的建立和分组
[0469]
单侧输尿管结扎小鼠模型(uuo)的建模,具体过程是:手术组小鼠(uuo)予戊巴比妥麻醉(45mg/kg),常规手术消毒备皮,在小鼠右侧大腿根部上靠近腹中线处开口,依次游离皮肤,肌层组织,暴露腹腔,沿后腹壁找到斜行的小鼠输尿管,游离输尿管后在近心端及远心端分别结扎输尿管后剪断输尿管。回纳腹腔脏器,依次缝合肌层及皮肤层。假手术组(sham)游离输尿管后不进行结扎,余操作同uuo组。手术后 7d,予杀检小鼠。
[0470]
ko及wt小鼠采用随机数字表法随机分为4组,每组8-15只,具体如下:(1)cf48野生型,sham组(wt-sham 组);(2)cf48野生型,uuo组(wt-uuo组);(3)cf48基因敲除,sham组(ko-sham组);(4)cf48 基因敲除,uuo组(ko-uuo组)。
[0471]
3.2.3.4其余研究方法同3.1.3中研究方法
[0472]
3.2.4实验结果
[0473]
3.2.4.1 cf48基因敲除小鼠的鉴定
[0474]
根据新生小鼠的基因型凝胶电泳图结果,cf48-/-小鼠通过p1f1(ko)引物可扩增出长度为246bp的目标产物,而通过p2f2(wt)不能扩增出产物。cf48+/+小鼠通过p1f1(ko)引物不能扩增出产物,而通过 p2f2(wt)能扩增出长度为265bp的目标产物。cf48+/-小鼠通过p1f1(ko)引物和p2f2(wt),均能扩增出相应的产物,由此鉴定小鼠基因型。
[0475]
3.2.4.2 cf48敲除叶酸性肾病小鼠肾功能受损程度减轻
[0476]
叶酸造模后2天,fa小鼠的血cysc显著升高,符合急性肾损伤的改变,与前述结果一致。叶酸造模后 28天,fa小鼠的血cysc,血cr,血bun与nc小鼠相比显著升高。fa组中,ko小鼠与wt小鼠相比,升高的血cysc,血cr,血bun显著下降,差异有统计学差异,但下降未能回落至正常肾功能水平,如图 3-10所示。
[0477]
3.2.4.3 cf48敲除叶酸性肾病小鼠肾脏病理损伤减轻
[0478]
通过masson染色,从光镜下可观察到nc小鼠的肾脏形态基本正常,小管细胞排列规律整齐。叶酸造模后28d的小鼠masson染色形态改变于前述一致,光镜下可见肾间质纤维化明显,大量炎性细胞浸润,小管上皮细胞坏死,小管塌陷,可见细胞管型。ko-fa较wt-fa小鼠小管损伤严重程度减轻,肾间质纤维化面积显著减少,如图3-11所示。
[0479]
3.2.4.4 cf48敲除叶酸性肾病小鼠肾脏纤维化程度减轻
[0480]
免疫荧光染色与前述结果一致,nc小鼠的细胞外基质主要表达在基底膜,形态规则,α-sma主要表达在血管。fa小鼠肾组织中coliv,fn,α-sma染色显著增多增厚,排列紊乱,主要分布在肾间质。而ko 与wt小鼠相比纤维化相关指标染色强度及面积减少。免疫印迹的结果可见,fa模型中,ko与wt小鼠相比coli,α-sma表达量显著降低,与免疫荧光结果一致,如图3-12所示。
[0481]
3.2.4.5 cf48敲除叶酸性肾病小鼠肾脏炎症反应减轻
[0482]
免疫组化的结果显示,fa小鼠的f4/80
+
巨噬细胞数目显著增多,叶酸性肾病小鼠肾皮质炎症浸润显著。 ko小鼠和wt小鼠在nc组中f4/80
+
细胞比例差异无统计学意义,在fa模型中,ko小鼠f4/80
+
巨噬细胞比例较wt小鼠降低,差异有统计学意义。qrt-pcr的结果显示,fa小鼠的炎症相关因子mcp-1、tnf-α表达水平均较nc小鼠显著升高,ko小鼠的炎症相关因子的mrna表达量较wt小鼠显著降低,如图3-13 所示。
[0483]
3.2.4.6 cf48在uuo小鼠肾脏组织中表达升高
[0484]
我们通过qrt-pcr检测uuo小鼠肾组织中cf48的表达情况。结果显示,uuo小鼠cf48的mrna表达水平与sham小鼠肾组织相比显著升高,如图3-14所示。
[0485]
3.2.4.7 cf48敲除uuo小鼠肾脏病理损伤减轻
[0486]
通过masson染色,在光镜下可见sham组小鼠小管细胞排列整齐,基底膜完整,肾间质无水肿,无细胞外基质沉积。uuo小鼠肾小管高度扩张,部分细胞出现坏死脱落,细胞外基质显著增多,胶原大量沉积,肾组织纤维化明显。sham小鼠中,wt及ko小鼠形态没有显著差异,uuo组小鼠中可见ko小鼠与wt 小鼠相比,肾间质胶原沉积显著下降,如图3-15所示。
[0487]
3.2.4.8 cf48敲除uuo小鼠肾脏纤维化程度减轻
[0488]
通过免疫荧光染色,发现sham组小鼠细胞外基质水平正常,主要分布在基底膜与血管。uuo小鼠肾间质 coliv,fn,α-sma表达显著增多,基底膜显著增厚,肾间质纤维化显著。ko小鼠与wt小鼠相比,细胞外基质表达量显著减少,纤维化程度减轻。
[0489]
3.2.4.9 cf48敲除uuo小鼠肾脏炎症反应减轻
[0490]
免疫组化的结果显示,sham小鼠肾间质形态正常,仅在血管周围可见少量f4/80
+
巨噬细胞浸润。uuo小鼠可见小管显著扩张,炎症细胞显著增多,呈片状聚集,ko小鼠的炎症细胞较wt小鼠显著减少,具有统计学差异。qrt-pcr的结果显示,uuo小鼠的炎性相关因子mcp-1、tnf-α表达水平均较nc小鼠显著升高。uuo模型组中,ko小鼠的炎症相关因子的表达量较wt小鼠显著降低,如图3-16所示。
[0491]
3.3.1研究目的:探讨在uuo和stz-dkd(nos3-/-小鼠)模型,通过体内注射lna c4orf48,干预肾脏 c4orf48的表达是否能减轻肾纤维化和延缓dkd的进展。
[0492]
本研究先建立小鼠纤维化模型:uuo和进展型stz-dkd模型(nos3-/-小鼠),然后给小鼠注射locked nucleiacid(lna)anti-sense oligonucleotide c4orf48(lna c4orf48)降低肾脏內源性c4orf48。通过干预c4orf48的表达,观察能否减轻uuo和stz-dkd的纤维化,延缓stz-dkd的进展。
[0493]
3.3.2实验材料对照lna(lna ctl):5
’‑
aacacgtctatacgc-3’,最前面一个“a”和最后面一个“c”都是lna,全股序列皆含有phosphorothioate骨架。lna1 c4orf48:5
’‑
cgctgcatgaattcaa-3’,最前面一个“a”和最后面一个“c”都是lna,全股序列皆含有phosphorothioate骨架。lna2 c4orf48:5
’‑
ccgtaggtcctgaagg-3’,最前面一个“a”和最后面一个“c”都是lna,全股序列皆含有 phosphorothioate骨架。lna由上海genebiogist合成。
[0494]
3.3.3研究方法8-12周龄c57bl6/j公小鼠行假手术(sham)或uuo手术。uuo组再随机分为腹腔注射 lna ctl(10mg/kg)组,lna1 c4orf48 10mg/kg组,lna2 c4orf48 10mg/kg组,lna1 c4orf48 10mg/kg+ lna2 c4orf48 10mg/kg组。每组8只小鼠。手术后第6天再腹腔注射相同剂量一次,第7天处死小鼠取肾脏组织做各种分析。wb显示lna1 c4orf48 10mg/kg+lna2 c4orf48 10mg/kg组取得明显抑制uuo肾脏 c4orf48的表达。lna1 c4orf48 10mg/kg+lna2 c4orf48 10mg/kg每周腹腔注射一次作为stz-dkd的治疗方法。在10-12周龄nos3-/-公小鼠给予stz 55mg/kg连续5天腹腔注射。2周后测定小鼠空腹血糖,大于250mg/dl诊断为糖尿病。糖尿病小鼠随机分为两组,一组给予腹腔注射lna ctl(20mg/kg),每周一次;一组给予腹腔注射lna1 c4orf48 10mg/kg+lna2 c4orf48 10mg/kg,每周一次,连续6周之后,第
七周处死小鼠。另外10-12周龄nos3-/-公小鼠给予同体积溶媒连续5天腹腔注射作为对照组。12-14只/组。材料收集,如血,尿,肾,肝,脾,心脏等组织的收集如3.1.3。
[0495]
3.3.4实验结果
[0496]
3.3.4.1 lna cf48注射减少uuo肾脏cf48的表达
[0497]
免疫印迹显示sham组肾脏cf48的表达量很低,7天的uuo组,cf48的表达量明显增加,注射lna1 cf48 或lna2 cf48可减少cf48的表达。lna1 cf48和lna2 cf48联合注射进一步抑制cf48的表达,抑制率达90%以上。说明lna1 cf48和lna2 cf48每周联合注射一次足以抑制肾脏内源性cf48的表达,如图 3-17的所示。
[0498]
3.3.4.2 lna cf48注射减少uuo肾脏纤维化
[0499]
免疫印迹显示联合注射lna1 cf48和lna2 cf48减少uuo细胞外基质
ɑ-sma和collagen i的产生,说明通过注射lna1 cf48和lna2 cf48可以减少肾脏纤维化,提示通过干预cf48的表达可以达到抑制肾脏纤维化的目的,如图3-18所示。
[0500]
3.3.4.3 lna cf48注射减少stz-dkd蛋白尿的产生,减少肾脏纤维化和延缓肾功能恶化
[0501]
stz-dkd+lna ctl组和stz-dkd+lna cf48组之间空腹血糖和糖化血红蛋白没有差别。collagen iv免疫组化显示lna cf48治疗减少stz-dkd肾脏纤维化。与stz-dkd+lna ctl组相比,stz-dkd+lnacf48组减少蛋白尿的产生。lna cf48治疗也减少stz-dkd血cr和cystatin-c的水平,说明lna cf48 治疗可以延缓stz-dkd肾功能恶化,如图3-19所示。
[0502]
总之,通过注射lna cf48可以减少肾脏纤维化,延缓stz-dkd的发生和发展。证明了cf48可以作为靶向物质,通过调控cf48的含量的药物,可以作为控制肾病、肾病纤维化等用途。
[0503]
第四部分,小肽cf48促进肾脏纤维化的分子机制
[0504]
4.1研究目的:在体外探讨小肽cf48对成纤维细胞和小管细胞的直接作用,筛选cf48的下游作用分子以探讨cf48促进成纤维细胞活化及小管细胞emt作用的分子机制。
[0505]
4.2实验材料
[0506]
4.2.1实验细胞
[0507]
大鼠肾脏成纤维细胞(nrk-49f),大鼠肾脏小管细胞(nrk-52e),人胚胎肾细胞(293t)购于atcc 公司(american type culture collection,美国)。
[0508]
4.2.2主要实验仪器和设备
[0509]
(1)超净工作台,esco,新加坡;(2)5%二氧化碳培养箱,thermoeclectron corporation,美国;(3)细胞计数仪,thermo,美国;(4)高压灭菌锅,hirayama,日本;(5)电热恒温干燥箱,广州东方电热干燥设备厂;(6)颠倒混匀反应架,thermo,美国;(7)超声破碎仪,helser up200s,德国;(8)seahorsexfe/xf 分析仪,agilent安捷伦,美国;(9)其他:同3.1.2.2。
[0510]
4.2.3.主要实验耗材
[0511]
(1)细胞培养瓶,75cm2,corning,美国;(2)细胞培养皿,corning,美国;(3)96孔细胞板,六孔细胞板,corning,美国;(4)细胞计数板,thermo,美国;(5)细胞筛网(22μm),corning,美国;(6)2ml 冻存管,corning,美国;(7)chamber slide,thermo,美国;(8)其他:同3.1.2.3。
[0512]
4.2.4主要实验试剂
[0513]
(1)胎牛血清,gibco,美国;(2)dmem/f12培养基,gibco,美国;(3)0.25%胰蛋白酶,gibco,美国;(4)青霉素/硫酸链霉素,gibco,美国;(5)tgf-β1重组蛋白,r&d,美国;(6)lipofectamine3000, thermo,美国;(7)opti-mem培养基,gibco,美国;(8)protein a/g agarose,santa cruz,美国;(9) 杀稻瘟菌素s(blasticidin s),索莱宝,中国;
[0514]
(10)puromycin,sigma,美国;(11)polybrene促转染试剂,吉满生物,中国;(12)seahorse相关试剂:包括rpmi培养基,丙酮酸,谷氨酰胺,葡萄糖,寡霉素,fccp,鱼藤酮/抗霉素a购于安捷伦公司(美国);(13)抗体:直标抗α-sma-cy3抗体,抗α-sma抗体购于sigma公司(美国);抗his抗体,抗pax8 抗体购于abcam公司(美国);抗α-tubulin抗体购于cell signalingtechnology公司(美国);抗slc3a2 抗体分别购于thermo公司(美国),cell signalingtechnology公司(美国);(14) slc3a2-sgrna-crispr/cas9病毒及对照病毒委托上海吉满生物科技有限公司合成;(15)slc3a2-sirna 及ctl-sirna委托上海吉荧生物科技有限公司合成;(16)cf48重组蛋白委托武汉普健生物科技有限公司完成;(17)hcf48-his-gfp质粒合成委托金唯智生物科技有限公司合成,(18)其他:同3.1.2.4。
[0515]
4.3研究方法
[0516]
4.3.1 cf48重组蛋白的合成
[0517]
cf48重组蛋白委托普健生物(武汉)科技有限公司完成,具体的流程如下:
[0518]
(1)基因合成及表达载体克隆
[0519]
a)合成带标签fc段的fc-cf48的cdna序列,并连接到表达载体patx1(克隆位点:ecori/noti)上;
[0520]
b)将表达载体fc-cf48-patx1转化到cho细胞(工具细胞:中国仓鼠卵巢细胞)中,大规模扩增cho 细胞,以期获得尽量多的表达氨基酸,预期获得的表达氨基酸序列如下:
[0521]
mkhlwfflllvaaprwvlscpapellggpsvflfppkpkdqlmisrtpevtcvvvdvshedpevkfnwyv dgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqv ytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwq qgnvfscsvlhealhnhytqkslslspgkddddksrepatgsavpaqsrpcvdchafefmqralqdlrktaysldartetlllqaerralcacwpagr*。
[0522]
注释:cf48信号肽【1:19】,fc标签【20:238】,酶切位点【239:245】,cf48分泌肽【246:307】。
[0523]
(2)表达氨基酸的亲和纯化
[0524]
通过蛋白树脂a亲和纯化含fc标签的cf48。由于合成的cf48为分泌端,收集细胞裂解液(clb,cell lysate) 及细胞培养上清(medium)进行亲和纯化,分别获得细胞内fc-cf48(cfc-cf48,isolated from cell lysate) 以及细胞外分泌性cf48(sfc-cf48,isolated from cell culture medium)。获得的蛋白通过sds-page胶及考马染色进行验证。
[0525]
(3)蛋白酶切,去除fc段
[0526]
通过肠激酶(enterokinase)消化裂解酶切位点,通过蛋白树脂a粘附去除游离的fc标签,分别获得不带 fc标签的c-cf48及s-cf48,获得的蛋白通过sds-page胶及考马染色进行验证。
[0527]
4.3.2细胞培养
[0528]
nrk-49f及nrk-52e细胞株培养于含10%胎牛血清的dmem/f12培养基中,培养条件为37℃,95%空气,5%co2。
[0529]
4.3.3 cf48重组蛋白刺激成纤维细胞
[0530]
(1)用生长培养基(dmem/f12+10%fbs)将nrk-49f细胞均匀种在六孔细胞板中;
[0531]
(2)细胞贴壁均匀稳定生长至70%的密度时,以含0.5%fbs的培养基(dmem/f12)稀释不同类型的cf48 重组蛋白(s-cf48,c-cf48)或者是将cf48稀释为不同浓度后加入nrk-49f细胞中。nc组不加入tgf-β1, tgf-β1刺激组加入总浓度为1ng/ml的tgf-β1,细胞共刺激48h。
[0532]
4.3.4细胞蛋白提取:同1.3.7。
[0533]
4.3.5细胞蛋白免疫印迹检测(western blot):同1.3.9。
[0534]
4.3.6细胞免疫荧光
[0535]
(1)用生长培养基(dmem/f12+10%fbs)将nrk-52e细胞以5000个/孔的数量种于chamber slide 中;(2)细胞刺激:待细胞贴壁后,以含0.5%fbs的培养基(dmem/f12)将s-cf48以0ng/ml,20ng/ml, 40ng/ml,80ng/ml的浓度,在伴或不伴tgf-β1(1ng/ml)的条件下刺激nrk-52e,刺激48h;(3)吸去chamber slide中的培养基,用预冷的pbs洗3次;(4)固定:用4%多聚甲醛常温固定细胞5min;(5) 置于pbs缓冲液中于摇床上10min,洗3次;(6)组化笔画圈:拆去chamber slide的细胞分隔板,擦干细胞周围的水份,用免疫组化笔轻柔地画圈,完整围住细胞后置入湿盒上,期间应避免组织干片;(7)封闭:于每个组化圈中滴加1%bsa(in pbs)溶液50μl,室温封闭1h;(8)一抗孵育:将一抗以相应的浓度稀释 (α-sma-cy3,1:5000)于1%bsa液中,4℃避光孵育过夜;(9)置于pbs缓冲液中于摇床上10min,洗3次;(10)dapi复染:dapi以1:100的浓度常温孵育5min;(11)封片:置于pbs缓冲液中于摇床上 10min,洗3次,甩干水份后滴加封片剂,盖上盖玻片后常温闭光干燥过夜;(12)于激光共聚焦显微镜下观察拍照。
[0536]
4.3.7免疫共沉淀及蛋白混合物的鉴定
[0537]
(1)hcf48-his-ires-gfp质粒转染及蛋白表达
[0538]
hcf48-his-ires-gfp质粒合成委托金唯智生物科技有限公司合成,具体合成方法:
[0539]
a)293t细胞均匀种在3个10cm的细胞培养皿中,待细胞密度为80%时,换成无血清培养基。
[0540]
b)按每个大皿67.5μgdna,33.75ul lipofectamine 3000,45ulp3000的比例配置转染混合物,在室温混匀放置15min后,加入细胞。转染12h后换成含10%fbs的细胞培养基,继续培养36h,在正置荧光显微镜下观察可见细胞状态可,形态正常,约70%的细胞表达绿色荧光。
[0541]
(2)裂解蛋白
[0542]
每个大皿用干净的预冷pbs清洗3遍后,加入300ul含蛋白酶抑制剂的ripa蛋白裂解液,冰上反应15min 后用细胞刮板刮下细胞,吸取蛋白裂解液到1.5mlep管。超声破碎仪破碎蛋白后高速离心(15,000rpm, 4℃)30min,吸蛋白上清,去除沉淀。
[0543]
(3)特异性一抗与琼脂糖反应
[0544]
每100ul的蛋白裂解液加入400ul的pbs使总反应体系达到500ul。每个混合物按1:100加入anti-his抗体,4度颠倒混匀反应1h。随后每个混合物加入50ul蛋白a/gagarose,4度颠倒混匀反应过夜。
[0545]
(4)琼脂糖沉淀
[0546]
将反应过夜的混合物高速(10,000rpm,4℃)离心1min,可见琼脂糖沉淀,弃上清,用干净的pbs洗3遍,高速(10,000rpm,4℃)离心1min,去上清。
[0547]
(5)蛋白变性
[0548]
直接在去除上清后的沉淀物中加入2xloadingbuffer,100℃煮沸15分钟,高速离心(15,000rpm,4℃)30min,取上清蛋白裂解液跑胶。
[0549]
(6)蛋白跑胶,考马染色
[0550]
取煮沸变性后的蛋白裂解液100ul,在sds-page胶中电泳跑胶,待蛋白跑入分离胶约1.5cm长度后,停止电泳,进行考马染色,看清蛋白条带后,切胶面积约1cm2。
[0551]
(7)蛋白混合物鉴定
[0552]
将切下的跑胶样品送景杰生物科技公司,蛋白混合物的质谱鉴定委托景杰生物科技公司完成。
[0553]
4.3.8慢病毒转染构建slc3a2敲低细胞系
[0554]
(1)slc3a2目的基因敲除采用crispr/cas9系统,cas9选择带blasticidins(杀稻菌素s)抗性载体,grna选择带puromycin(嘌呤霉素)抗性载体(pgmlv-gm1:u6-grna-ef1a-puro),2种慢病毒及对照慢病毒的合成委托上海吉满生物科技有限公司完成。
[0555]
设计合成的slc3a2sgrna寡聚单链oligo序列如下(rat):
[0556]
primer-t2caccgagcagcagcagcgcccagc;
[0557]
primer-b2aaacgctgggcgctgctgctgctc。
[0558]
(2)nrk-49f细胞感染cas9-blasticidins病毒
[0559]
a)用细胞生长培养基(dmem/f12+10%fbs)以105个/孔的数量将nrk-49f细胞均匀种在六孔细胞板中;
[0560]
b)细胞贴壁后待细胞长满至60%的密度,换为含polybrene转染辅助试剂(工作浓度:6μg/ml)的无血清培养基,加入cas9-blasticidins病毒液(moi1:100)感染细胞,24h后换成细胞生长培养基(dmem/f12+10%fbs),空白对照细胞仅加入含同样浓度polybrene的无血清培养基;c)blasticidins筛选阳转细胞:转染后48h,用含有工作浓度为25μg/mlblasticidins的新鲜培养基将细胞传代,其后每3-4天去除培养基,加入含抗生素的新鲜培养基,直至空白对照孔细胞全部死净。
[0561]
(3)带cas9工作系统的nrk-49f感染slc3a2-sgrna及ctl-sgrna
[0562]
a)用细胞生长培养基(dmem/f12+10%fbs)以105个/孔的数量将上述筛选后阳转成功表达cas9工作系统的nrk-49f细胞均匀种在六孔细胞板中;b)同(2b)的方法感染slc3a2-sgrna及ctl-sgrna病毒;c)puromycin筛选阳转细胞:转染后48h,用含有工作浓度为8μg/mlpuromycin的新鲜培养基将细胞传代,其后每3-4天去除培养基,加入含抗生素的新鲜培养基,直至空白对照孔细胞全部死净。d)免疫印迹法验证成纤维细胞中slc3a2的敲低效率。
[0563]
4.3.9转染slc3a2-sirna及ctl-sirna
[0564]
slc3a2-sirna及ctl-sirna委托上海吉荧生物科技有限公司合成。
[0565]
所使用的slc3a2-sirna(rat)序列为:
[0566]
primer-f:gaggcauagcuggucugaa;primer-r:uucagaccagcuaugccuc;
[0567]
按照lipofectamine 3000的操作流程转染slc3a2-sirna及ctl-sirna,具体步骤如下:
[0568]
(1)用细胞生长培养基(dmem/f12+10%fbs)以105个/孔的数量nrk-49f细胞均匀种在六孔细胞板中;
[0569]
(2)细胞贴壁均匀稳定生长后将细胞生长培养基换成无血清培养基,每孔1.5ml;(3)用无酶水溶解sirna,配置为储存浓度为20μm储存液;(4)按每个孔500μl opti-mem+10μl sirna储存液+6μl lipofectamine 3000的量配置sirna工作液,使sirna的工作浓度为100nm,每个孔加入500μl含100nm sirna的工作液;(5)反应48h后换液,作下一步处理。
[0570]
4.3.10细胞线粒体压力测试(seahorse xf)
[0571]
(1)细胞铺板:用细胞生长培养基(dmem/f12+10%fbs)以5000个/孔的数量将nrk-52e细胞接种到 seahorse xf细胞培养微孔板中。
[0572]
(2)细胞刺激:在细胞贴壁后(约6h),用无血清培养基在各个实验孔中按实验分组加入相应的刺激(nc, 40ng/ml cf48,1ng/mltgf-β1,1ng/mltgf-β1+40ng/ml cf48),共刺激48h;转染ctl-sirna及 slc3a2-sirna的方法同4.3.9;
[0573]
(3)按照安捷伦seahorse xf细胞线粒体压力测试实验流程操作,具体步骤如下:
[0574]
a)传感器水化:将传感器探针板置于ddh20中,于37℃,无co2培养箱中水化过夜;
[0575]
b)传感器校准:传感器水化过夜后,将探针置于校准液中,于37℃,无co2培养箱中静置45-60min进行校准;
[0576]
c)配置基础检测液:往rpmi培养基中补充添加剂配置成含1mmol/l丙酮酸钠、2mmol/l谷氨酰胺和10 mmol/l葡萄糖的基础检测液;
[0577]
d)配置工作液:用基础检测液溶解配置工作液:寡霉素(oligomycin),fccp及鱼藤酮/抗霉素a (rotenone/antimycin a);
[0578]
e)加板:在校准后的传感器探针板内按照a、b、c孔的顺序分别加入寡霉素、fccp和鱼藤酮/抗霉素a,使反应时孔内终浓度分别为2μm、1μm和0.5μm;
[0579]
f)按照细胞线粒体压力程序上机。
[0580]
4.4实验结果
[0581]
4.4.1分泌性cf48促进成纤维细胞活化
[0582]
在体外合成小肽cf48过程中,分别从工具细胞的培养基上清及细胞裂解液中进行富集提纯,以此获得了2 种类型的重组小肽cf48:来自培养基上清的scf48(分泌性cf48)以及来自细胞裂解液的ccf48(细胞内 cf48)。
[0583]
为了观察合成的cf48对成纤维细胞可能的作用,在伴或不伴tgf-β1(1ng/ml)的条件下在大鼠成纤维细胞(nrk-49f)中加入两种类型的重组cf48刺激48小时。如图4-1所示,在不含有tgf-β1的条件下,加入分泌性cf48(scf48)的成纤维细胞α-sma的表达量升高,而加入细胞内cf48(ccf48)的成纤维细胞α-sma的表达量没有显著变化。加入tgf-β1后,溶剂组的α-sma的表达量升高,表明tgf-β1可促进成纤维细胞活化,在含有tgf-β1的条件下,加入scf48的成纤维细胞α-sma的表达量进一步升高,而加入ccf48的成纤维细胞与加入溶剂
组相比没有显著差异。这一结果与第一部分中证实的cf48过表达条件性培养基可促进成纤维细胞活化的结果一致,进一步证实了分泌性cf48具有生物学效应,可促进成纤维细胞活化。也因此选择在细胞培养基上清中纯化获得的分泌性cf48(scf48)来进行下一步的实验。
[0584]
4.4.2分泌性cf48呈浓度依赖性促进成纤维细胞活化
[0585]
进一步在nrk-49f细胞中,在伴或不伴tgf-β1的条件下,加入不同浓度的scf48,通过免疫印迹,观察α-sma的表达情况。如图4-2a所示,如图4-2a所示,在不含有tgf-β1的情况下,scf48 5ng/ml以下不引起α-sma的表达量的改变,随着scf48浓度的增加,α-sma的表达量逐渐增多,scf48高浓度本身具有促成纤维细胞活化的作用,在40ng/ml时效应比较显著。在伴tgf-β1的条件下,scf48的促成纤维细胞活化的作用显著增强,scf48的浓度为5ng/ml以上可见α-sma的表达量显著增多,表明scf48与tgf-β1 的促纤维化作用具有协同性。
[0586]
通过三次独立实验,结果如图4-2b、c所示,40ng/ml的sc4orf48在伴或不伴tgf-β1的条件下可显著增强α-sma的表达,具有统计学差异。因此在成纤维细胞上选择scf48,40ng/ml的浓度来进行进一步的实验。
[0587]
4.4.3 cf48免疫共沉淀混合物鉴定
[0588]
为了进一步研究cf48促进纤维化反应的分子机制,在293t细胞中转染cf48的表达质粒,通过免疫共沉淀及蛋白质谱的方法寻找cf48可能作用的分子。根据与cf48相互作用的蛋白混合物的sds-page胶图,发现三次生物学重复的一致性较好,蛋白混合物的分布较为一致。在三次的混合物鉴定中都能检测到目标蛋白cf48,可见cf48成功转染以及在免疫共沉淀过程中被成功拉下,并用质谱鉴定免疫共沉淀下来的蛋白分子。
[0589]
cf48与细胞表面受体结合后传递信息至细胞内,并引起一系列的生物效应。为寻找cf48受体,以分子具有cytoplasmic domain,transmembrane和extracellular domain为筛选标准。在三次的混合物鉴定中,发现蛋白tfrc和slc3a2都能被检测出,符合筛选标准,且都有较高的蛋白打分值。表面等离子体共振 (surface plasmon resonance,spr)检测cf48与tfrc和slc3a2的浓度梯度结合曲线显示cf48与tfrc和 slc3a2d解离平衡常数,也叫亲和力常数[kd(m)]分别为5.71e-7和3.52e-8。
[0590]
tfrc是transferrin receptor protein 1(转铁蛋白受体1),有介导铁吸收和铁死亡(ferroptosis)等功能。减少tfrc的表达可以减缓uuo和stz诱导的糖尿病肾病纤维化(yasumura et al.hypertension.2020 feb;75(2):413-421).
[0591]
slc3a2是位于细胞膜的氨基酸转运通道蛋白的重链,它通过二硫键与各种轻链结合,发挥将氨基酸转运通道蛋白稳定锚定在质膜上的作用。由于氨基酸的跨质膜转运在细胞能量代谢及其他细胞正常功能的维持中发挥着重要的作用,且slc3a2在肾组织尤其是肾小管上皮细胞中广泛表达,参与肾小管的重吸收功能。以上信息提示,tfrc和slc3a2参与cf48的作用机制,tfrc和slc3a2有可能是cf48的受体或/和靶目标。
[0592]
4.4.4分泌性cf48降低成纤维细胞中slc3a2的表达量
[0593]
为了观察cf48对slc3a2可能的作用,在成纤维细胞中加入0、5ng/ml、10ng/ml、20ng/ml浓度的scf48 刺激48h,来观察其对slc3a2的影响。通过免疫印迹,发现scf48可呈浓度依赖地降低slc3a2的表达量,且在较低浓度时(5ng/ml)就能起到降低slc3a2表达的作用,如图4-3所示。
[0594]
4.4.5 slc3a2的表达下调促进成纤维细胞活化
[0595]
为了探究slc3a2的表达量下降对成纤维细胞的作用,通过慢病毒感染及sirna转染两种方式沉默 slc3a2的表达,以观察其对成纤维细胞的影响。如图4-4a所示,感染slc3a2-sgrna与感染对照病毒相比可部分敲低slc3a2的表达,感染slc3a2-sgrna的成纤维细胞随着slc3a2的表达降低,细胞α-sma的表达增多。
[0596]
接着通过转染对照sirna以及不同浓度的slc3a2-sirna来敲低slc3a2的表达,如图4-4b所示,可见随着slc3a2-sirna的浓度增高,slc3a2的表达逐渐降低,在slc3a2-sirna的浓度为100nmol/l时, slc3a2可达到完全敲除的效果。随着slc3a2的表达降低,成纤维细胞的α-sma表达量逐渐增多。由此可见,slc3a2的表达量下降可增加成纤维细胞α-sma的表达,促进成纤维细胞活化。
[0597]
4.4.6 slc3a2的表达下调增强分泌性cf48活化成纤维细胞的作用
[0598]
分别在转染了ctl-sgrna及slc3a2-sgrna的成纤维细胞中加或不加scf48刺激以观察成纤维细胞α-sma的表达情况,结果如图4-5所示,结果显示,转染ctl-sgrna的成纤维细胞中加scf48刺激可导致slc3a2的表达量下降,同时α-sma的表达量升高,与前述结果一致。转染slc3a2-sgrna的成纤维细胞,slc3a2的表达量下降,α-sma的表达量升高,进一步加入scf48,可见slc3a2的表达量进一步下降,伴随着α-sma的表达量进一步升高,由此可见,slc3a2的表达下调可进一步增强scf48的促成纤维细胞活化作用,说明slc3a2的表达下调与scf48在活化成纤维细胞的作用上有协同作用。
[0599]
4.4.7 slc3a2的表达下调增强tgf-β1活化成纤维细胞的作用
[0600]
由于tgf-β1可促进成纤维细胞活化,为了明确slc3a2的表达下调与tgf-β1有无协同作用,分别在转染了ctl-sgrna及slc3a2-sgrna的成纤维细胞中加或不加tgf-β1刺激以观察其对成纤维细胞活化情况的影响。
[0601]
结果如图4-6所示,转染ctl-sgrna的成纤维细胞中加tgf-β1刺激,α-sma的表达量升高,表明tgf-β1本身可促进成纤维细胞活化。转染了slc3a2-sgrna的成纤维细胞与ctl-sgrna相比,slc3a2 的表达量下降,α-sma的表达量升高,与前述结果一致。敲低slc3a2的表达后加tgf-β1刺激可见α-sma 的表达量进一步升高,由此可见,slc3a2的表达下调可进一步增强tgf-β1的促成纤维细胞活化作用,提示scf48可能通过降低slc3a2的表达来增强tgf-β1的促纤维化作用。
[0602]
4.4.8分泌性cf48促进小管细胞转分化
[0603]
为了观察分泌性cf48对其他细胞的作用,在大鼠肾小管上皮细胞(nrk-52e)中,在伴或不伴tgf-β1 (1ng/ml)的条件下加入不同浓度的scf48刺激48h,通过细胞免疫荧光染色,观察小管细胞α-sma的表达情况。
[0604]
结果显示,在不含有tgf-β1的条件下,加入溶剂组的小管细胞不表达α-sma,表明小管细胞在正常情况下未发生转分化。在加入scf48刺激48h后,在浓度为20ng/ml时就可观察到小管细胞表达α-sma,且随着scf48的浓度增高,表达α-sma的小管细胞也增多,表明scf48可呈浓度依赖地促进小管细胞转分化。加入1ng/ml的tgf-β1刺激48h后,可见小管细胞可表达α-sma,表明tgf-β1可促进小管细胞转分化。同时加入不同浓度(1ng/ml、5ng/ml、10ng/ml、15ng/ml、20ng/ml)的scf48,可见小管细胞α-sma 的表达量进一步加强,表明scf48可呈浓度依赖地加强tgf-β1对小管细胞的转分化作用。
[0605]
4.4.9 cf48转基因叶酸性肾病小鼠发生转分化的小管细胞显著增多
[0606]
由于在体外实验中观察到cf48可促进小管细胞发生转分化,为了进一步明确cf48这一作用,在cf48 过表达及对照小鼠的叶酸性肾病在体模型中,通过pax8染色标记小管细胞,通过α-sma染色作为间充质细胞标志物。由于pax8为小管细胞细胞核标志物,因此通过pax8及dapi的共定位来识别肾组织中的小管细胞。
[0607]
实验发现野生型的叶酸性肾病小鼠有少量表达pax8的小管细胞其胞质中可见α-sma的染色,表示该小管细胞发生转分化。而cf48过表达的叶酸性肾病小鼠,同时表达pax8及α-sma的小管细胞数量显著增多。表明在体内,cf48的表达上调可促进疾病状态下小管细胞的转分化,这与在体外实验中的发现结果一致。
[0608]
4.4.10分泌性cf48降低小管细胞中slc3a2的表达量
[0609]
为了观察分泌性cf48在小管细胞中对slc3a2表达量的影响,在nrk-52e细胞中加入不同浓度的 scf48,共刺激5天,来观察slc3a2表达量的变化。通过免疫印迹,发现scf48可呈浓度依赖地降低slc3a2 的表达量,在浓度为40ng/ml时,降低slc3a2表达的作用较为明显。同时,观察到随着加入scf48浓度的增加,伴随着slc3a2表达的下降,α-sma的表达量逐渐增强,这与之前的结果一致,如图4-7所示。
[0610]
4.4.11 slc3a2的表达下调促进小管细胞转分化为了探究slc3a2的下调本身对小管细胞转分化的作用,在nrk-52e中转染对照sirna以及 slc3a2-sirna来沉默slc3a2的表达。如图4-8所示,转染slc3a2-sirna后,slc3a2的表达下降,小管细胞的标志物e-cadherin的表达降低,而间质细胞的标志物α-sma的表达增多,以上结果表明,slc3a2表达的降低可导致小管细胞发生转分化。
[0611]
4.4.12 slc3a2的表达下调导致小管细胞线粒体功能下降
[0612]
在肾小管上皮细胞中敲低slc3a2的表达,检测其线粒体功能。具体用ctl-sirna和slc3a2-sirna 处理大鼠肾小管细胞48h后通过seahorse检测细胞线粒体功能,结果如图4-9所示,敲低slc3a2表达的小管细胞的ocr曲线显著降低。表示线粒体功能的基础呼吸量、最大呼吸量、atp产生能力以及储备呼吸能力在slc3a2表达量减少的小管细胞中均显著降低。由于slc3a2参与构成氨基端转运通道,正常的氨基酸代谢过程是能量供给的必要条件,肾小管细胞本身的高能量需求特性和对有氧代谢的依赖,故 slc3a2的表达量下降导致小管细胞能量代谢能力异常。
[0613]
4.4.13分泌性cf48导致小管细胞线粒体功能下降
[0614]
在小管细胞中直接加入scf48,在伴或不伴tgf-β1的条件下检测线粒体功能。从结果可见,与正常对照(nc) 相比,加入scf48刺激后的小管细胞的ocr曲线显著降低,其基础呼吸量、最大呼吸量、atp产生能力以及储备呼吸能力均显著降低,具有统计学差异。tgf-β1刺激后的小管细胞ocr曲线与nc相比显著降低,水平与加入scf48刺激的小管细胞的ocr曲线基本持平,说明scf48与tgf-β1有相似的降低小管细胞线粒体功能的作用。在tgf-β1刺激的条件下加入scf48,可见小管细胞的ocr曲线进一步降低,小管细胞的基础呼吸量、atp产生能力以及储备呼吸能力均显著降低。以上结果可见,scf48可导致小管细胞线粒体功能下降,且可进一步加重tgf-β1导致的小管细胞线粒体功能障碍,如图4-10所示。
[0615]
4.4.14 slc3a2在叶酸性肾病小鼠中的表达量降低
[0616]
在体外实验中观察到小肽cf48通过slc3a2而发挥的作用,为了进一步在体内实验中观察小肽cf48与 slc3a2的关系,先通过叶酸性肾病小鼠及正常对照小鼠的肾组织,进行
slc3a2的免疫荧光染色,以观察slc3a2在体内的表达情况。实验结果显示,在正常小鼠的肾小球及肾小管中均可见slc3a2的高表达,而在fan小鼠肾组织中,slc3a2在肾小球及肾小管中的表达量显著降低。
[0617]
4.4.15 cf48过表达小鼠slc3a2的表达下调纤维化程度加重
[0618]
为了在体内观察cf48的表达与slc3a2以及纤维化程度的关系,在cf48转基因小鼠的叶酸性肾病模型中检测slc3a2以及纤维化指标α-sma的表达情况。由图4-11免疫印迹的结果可见,在正常对照小鼠中,tg小鼠与wt小鼠相比,cf48的表达升高,同时可见slc3a2的表达下降,伴随着α-sma的表达量轻微增高。在fan模型的wt小鼠中可见cf48的表达量升高,slc3a2的表达量与正常小鼠相比显著下降,同时α-sma的表达量显著升高,这与前述结果一致。tg-fan小鼠与wt-fan小鼠相比,cf48的表达进一步升高,同时可见slc3a2的表达显著下降,α-sma的表达量显著升高。
[0619]
4.4.16 cf48基因敲除小鼠slc3a2的表达升高纤维化程度减轻
[0620]
进一步检测cf48基因敲除小鼠的uuo模型中slc3a2以及纤维化指标α-sma的表达情况。结果如图4-12所示,在假手术组中,cf48-ko小鼠与wt小鼠相比,slc3a2的表达有轻微地升高。uuo手术后, wt小鼠中可见slc3a2的表达显著下降以及α-sma的表达显著升高。ko-uuo小鼠与wt-uuo小鼠相比,slc3a2的表达升高,伴随着α-sma的表达下降,ko-uuo小鼠的肾脏纤维化程度减轻。
[0621]
4.5对本实施中获得的通过脲链霉素诱导的进展型糖尿病肾病小鼠采用cf48锁核酸治疗。在糖尿病诱导的糖尿病肾病小鼠4周后,小鼠腹腔注射lna-ctl或lna-c4orf48(20mg/kg),每周1次,连续6周,然后处死小鼠。年龄匹配的正常小鼠也接受lna-ctl或lna-c4orf48(20mg/kg)作为对照。结果发现,cf48锁核酸治疗,敲低了小鼠内源性cf48的表达,延缓了进展型糖尿病肾病小鼠的发生和发展。可见,可以通过抑制目标对象肾脏中cf48的表达,抑制或者治疗肾脏损伤。可靶向抑制目标对象肾脏中cf48的产生,实现药物治疗作用。
[0622]
4.4.17 tfrc介导cf48降低slc3a2的表达和促纤维化的作用
[0623]
为了进一步明确tfrc在cf48引起的生物效应中的作用,我们在大鼠肾纤维细胞,用sirna技术敲低tfrc,结果发现敲低tfrc,cf48促进tgf-β1诱导的
ɑ-sma的表达明显减轻,说明cf48引起的促纤维化反应明显减弱,提示tfrc是介导cf48促纤维化反应的受体,如图4-13所示。
[0624]
4.6结论
[0625]
正常肾功能的维持取决于众多肾实质细胞之间复杂而精确的相互作用。这种细胞间微妙的平衡主要依赖于细胞间通讯因子的作用。当这种平衡被诸如代谢紊乱、血流动力学异常、毒性作用因子等因素打乱时,肾小管细胞往往最先受到打击,导致细胞间通讯因子异常分泌。若损伤因素持续存在,通讯因子进行性作用,将不可逆地损伤肾实质细胞,最终导致肾脏纤维化。
[0626]
本部分通过体外实验证实了在损伤状态下由肾小管细胞分泌产生的小肽cf48可作为一种细胞间通讯因子。分泌性cf48(scf48)可通过旁分泌途径作用于成纤维细胞,使其α-sma表达量升高,活化为可产生 ecm的肌成纤维细胞。分泌性cf48也可通过自分泌途径促进小管细胞发生转分化(emt)从而加重纤维化进展,且在体内实验中,也观察到cf48的表达
上调可导致疾病状态下小鼠发生转分化的小管细胞显著增多。
[0627]
小肽cf48的作用机制与已经被充分研究的tgf-β1相似,均可由损伤的小管细胞产生后通过体液通讯作用于肾实质细胞,从而促进纤维化进程。tgf-β1在体内许多组织及细胞中均可表达,参与众多生物信号通路。多项临床前研究表明,针对tgf-β1通路的治疗策略具有抗纤维化作用,然而,由于其参与的信号通路众多,在抗纤维化的同时也可对肾脏和心血管系统产生其他不利影响。tgf-β1信号传导阻滞剂在局灶节段性肾小球硬化和糖尿病肾病的临床试验中未见对肾功能保护的有益作用,因此目前已暂停了抗 tgf-β1中和抗体在肾脏疾病中的临床开发。与tgf-β1不同的是,小肽cf48分子量小,靶向抗体特异性强。在cf48基因全身敲除小鼠中,暂未发现显著的表型异常。鉴于小肽cf48在活化成纤维细胞及促进小管细胞emt中与tgf-β1相似的作用,针对cf48的靶向治疗药物将具有较大的应用前景。
[0628]
通过免疫共沉淀蛋白质谱鉴定,发现了与cf48相互作用的蛋白分子包括tfrc和slc3a2。spr检测 cf48与tfrc和slc3a2的kd分别为5.71e-7m和3.52e-8m,tfrc和slc3a2是cf48的受体或/和靶目标;且小肽cf48可降低成纤维细胞及小管上皮细胞中slc3a2的表达。slc3a2属于slc3家族成员,该家族蛋白组成氨基酸转运通道的重链。氨基酸是所有活细胞和生物体正常功能发挥所必需的原料,因而有专门的转运通道介导氨基酸跨质膜的转运。slc3家族及slc7家族共同组成了异聚氨基酸转运蛋白 (heteromeric amino acid transporters,hat)。hat由轻链及重链组成,slc3家族成员组成hat的重链, slc7家族成员组成hat的轻链。其中,slc3a2通过二硫键与各种轻链结合,将hat锚定在质膜上从而发挥维持氨基酸转运通道结构稳定性的作用。hat是许多氨基酸底物的交换通道,因此对于肾脏及小肠的重吸收功能及细胞的氧化还原反应至关重要。lc3a2作为氨基酸转运通道的重链,在细胞能量供应及组织代谢平衡中发挥着重要的作用。通过体内实验发现叶酸性肾病小鼠的肾组织中,slc3a2的表达显著下降。通过体外实验,发现沉默成纤维细胞中slc3a2的表达,成纤维细胞可活化为表达α-sma的肌成纤维细胞。同样,在肾小管上皮细胞中沉默slc3a2的表达,小管细胞可发生emt。因此,slc3a2本身可参与纤维化的发生和发展,那么,slc3a2是通过什么机制介导肾实质细胞促纤维化改变的呢?
[0629]
肾脏在正常的生理过程中是一个高耗能的器官,其对能量的大量需求主要是由于近端小管的重吸收功能,包括原尿中的na
+
,k
+
,葡萄糖,氨基酸等,其中特别是钠的转运,需要能源供需之间的密切协调。有研究发现,能量代谢缺陷可促进肾脏纤维化的发生发展,ckd的进展与脂肪酸氧化(fatty acid oxidation, fao)异常及葡萄糖代谢受损有关。现已有大量的研究证实,小管细胞能量供应不足将导致其难以维持小管的形态及功能,从而发生转分化。如在小管细胞中沉默与能量代谢相关的酶ampk(amp活化相关的蛋白激酶)可抑制小管细胞能量代谢,从而促使小管细胞发生emt,加重纤维化进程。研究发现,当抑制氨基酸通道slc3a2的表达,小管细胞线粒体功能显著下降,细胞能量供应不足,因此导致了emt的发生。小肽cf48可抑制小管细胞线粒体功能,且能进一步加重tgf-β1介导的线粒体功能下降,从而抑制小管细胞能量代谢。由于小肽cf48可降低slc3a2表达,因此可以得出,小肽cf48可通过减少氨基酸通道slc3a2的表达,抑制小管细胞能量代谢进而促进emt的发生,促进纤维化进展。
[0630]
实验发现小肽cf48也可导致成纤维细胞中slc3a2的下降,且随着成纤维细胞中
slc3a2表达量的降低,α-sma的表达量逐渐升高,因此小肽cf48可通过导致slc3a2的下降来活化成纤维细胞。
[0631]
在体内实验中,观察到在肾脏纤维化小鼠模型中,slc3a2的表达显著下降。且通过基因工程小鼠观察到随着cf48的表达上调,slc3a2的表达量降低,小鼠纤维化程度增高。同样,随着cf48的表达下调, slc3a2的表达增高,小鼠纤维化程度也随之降低。
[0632]
综上所述,本部分的研究发现小肽cf48可导致成纤维细胞活化以及促进小管细胞发生emt,从而加重肾脏纤维化进展。小肽cf48也可降低成纤维细胞氨基酸通道slc3a2的表达,促进成纤维细胞活化。小肽cf48可降低小管细胞氨基酸通道slc3a2的表达,抑制小管细胞能量代谢从而促进emt的发生。
[0633]
综上分析,可以得到:
[0634]
a.分泌性cf48促进成纤维细胞活化及肾小管上皮细胞转分化(emt)。
[0635]
b.分泌性cf48降低成纤维细胞及肾小管上皮细胞中slc3a2的表达量。
[0636]
c.分泌性cf48可抑制氨基酸通道slc3a2促进成纤维细胞活化。
[0637]
d.分泌性cf48可抑制氨基酸通道slc3a2导致小管细胞线粒体功能下降促进emt。
[0638]
e.体内实验中,cf48的表达上调可导致slc3a2的表达量下降,纤维化程度加重;cf48的表达下调可导致slc3a2的表达升高纤维化程度减轻。
[0639]
实施例4。
[0640]
提供以cf48小肽标志物作为干预靶点的肾脏损伤药物用途。肾脏损伤药物通过靶向抑制或者消除 cf48小肽的表达治疗或者延缓肾脏损伤发展。
[0641]
具体的,肾脏损伤药物通过靶向抑制cf48小肽的表达,避免cf48小肽抑制成纤维细胞中氨基酸通道slc3a而出现的成纤维细胞活化的现象发生。
[0642]
治疗肾脏损伤药物通过靶向抑制cf48小肽的表达,避免cf48通过抑制小管细胞中氨基酸通道 slc3a2和抑制小管细胞能量代谢而出现的诱导emt的发生、促进肾脏纤维化形成的现象发生。
[0643]
实验还发现,肾脏损伤药物通过靶向抑制cf48小肽的表达,还可避免cf48与其他促进肾脏纤维化形成的因素(如tgf-β1等)协同作用促进肾脏纤维化形成的现象发生。
[0644]
需要说明的是,抑制cf48小肽的表达的药物可以是锁核酸或者其他能够实现cf48抑制的药物,在此不一一列举。
[0645]
实施例5。
[0646]
一种基于cf48生物标志物评估待测目标对象肾脏损伤情况的系统,设置有,
[0647]
数据采集模块,至少采集待测目标对象的生物样本中的cf48的量;
[0648]
评估模块,根据生物样本中的cf48的含量与对照参数进行比较,根据比较结果得出待测目标对象肾脏损伤情况对应的等级结果。
[0649]
具体的,评估模块设置有参数存储单元和分析单元,参数存储单元存有第一参考值、第二参考值。
[0650]
分析单元将所述数据采集模块输送的所检测生物样本中的cf48的含量与第一参考值、第二参考值比较,当所检测生物样本中cf48小肽的含量大于等于第一参考值时,分析单元给出第一等级结果,第一等级表示肾脏肾脏损伤情况严重,需要干预;
[0651]
当所检测生物样本中cf48小肽的含量小于第二参考值时,分析单元给出低等级结
果,低等级表示肾脏损伤情况轻微,不需要干预;其中,第一参考值大于第二参考值。需要说明的是,第一参考值、第二参考值的具体数值或者数值范围可以根据具体用途和使用场合灵活选择设置。
[0652]
进一步的,该数据采集模块还采集待测生物样本中是否存在tgf-β1;
[0653]
分析单元将所述数据采集模块输送的所检测生物样本中的cf48的含量与第一参考值、第二参考值比较,当所检测生物样本中cf48小肽的含量小于第一参考值且大于第二参考值时,分析单元获取数据采集模块中采集的待测生物样本中是否存在tgf-β1的结果,在待测生物样本中存在tgf-β1时,所述分析单元给出第二等级结果,第二等级表示肾脏损伤情况严重,需要干预。
[0654]
该基于cf48生物标志物评估待测目标对象肾脏损伤情况的系统,通过采集待测目标对象的生物样本中的cf48的量,来评估给出肾脏损伤情况等级,具有检测方便,结果精确的特点。
[0655]
通过该系统,可以跟进需要进行肾病情况、肾脏损伤程度、目标对象预后预测、肾脏纤维化程度、肾脏纤维化活动度、肾病患者治疗效果监测等多种用途的情况登记评估。配合不同的需求,设置相应的第一参考值、第二参考值,就可实现多种用途的评估。
[0656]
实施例6。
[0657]
采用实施例5的基于cf48生物标志物评估待测目标对象肾脏损伤情况的系统进行肾脏纤维活动度的判断。参数存储单元中存储的第一参考值、第二参考值分别为第一阈值、第二阈值。
[0658]
分析单元将数据采集模块输送的所检测生物样本中的cf48的含量与第一阈值、第二阈值比较,当所检测生物样本中cf48小肽的含量大于等于第一阈值时,提示肾脏纤维化活动度为强活动度,分析单元给出第一等级结果,第一等级表示肾脏正在进行的纤维化活动程度高,需要干预;
[0659]
当所检测生物样本中cf48小肽的含量小于第二阈值时,提示肾脏纤维化活动度为弱活动度,分析单元给出低等级结果,低等级表示肾脏正在进行的纤维化活动度低,肾脏纤维化不具备发展能力;其中,第一阈值大于第二阈值,第一阈值、第二阈值可以根据实际检测的目的和对象相应设置。
[0660]
该基于cf48生物标志物评估待测目标对象肾脏损伤情况的系统,数据采集模块还采集待测生物样本中是否存在tgf-β1;
[0661]
分析单元将所述数据采集模块输送的所检测生物样本中的cf48的含量与第一阈值、第二阈值比较,当所检测生物样本中cf48小肽的含量小于第一阈值且大于第二阈值时,分析单元获取数据采集模块中采集的待测生物样本中是否存在tgf-β1的结果,在待测生物样本中存在tgf-β1时,提示肾脏纤维化活动度为强活动度,所述分析单元给出第二等级结果,第二等级表示肾脏正在进行的纤维化活动程度高,需要干预。
[0662]
该系统,通过采集待测目标对象的生物样本中的cf48的量,来评估给出肾脏纤维度等级,具有检测方便,结果精确的特点。
[0663]
实施例7。
[0664]
下面提供几种本发明的标志物的使用场景。
[0665]
李某某,48岁,男,肾脏没有明显异常感觉,不符合临床肾脏疾病检查和处理指征。
在常规体检中,通过检测血液样本中cf48含量,含量低于0.1ng/ml,提示其不存在肾脏损伤风险。
[0666]
王某某,53岁,男,肾脏没有明显异常感觉,不符合临床肾脏疾病检查和处理指征。在常规体检中,通过检测血液样本中cf48含量,含量高于10ng/ml但是低于30ng/ml,提示其存在轻度肾脏损伤。通过一段时间给予降低cf48含量的针对性措施,再次复检血液样本中cf48含量,明显降低,说明治疗有效。
[0667]
陈某某,49岁,女,肾脏尿白蛋白/肌酐偏高,但是还达不到临床肾脏活检的处理指征。在通过检测血液样本中cf48含量,含量高达32ng/ml,说明肾脏损伤严重,且朝着更严重发展方向的能力强,肾脏先维化程度高,肾脏纤维化的活动度也高,需要尽快抑制发展。提示需要在临床上及时处理,可在治疗一段时间后通过对血液样本中cf48含量的检测判断治疗效果。
[0668]
实施例8。
[0669]
为了验证c4orf48在肾病、肾脏纤维化的特异性表达。本实施例采用elisa方法对健康人(为到中山中医院、宜昌中心医院进行健康体检且检测结果正常的的人群)血清样本中的c4orf48进行检测,试剂购自 cusabio公司,按厂家说明书进行操作,以表一中的6个不同浓度水平的标准品建立标准曲线,得到吸光度值(od)和浓度的换算公式,将样本测得od值代入公式计算得到样本浓度值。对178例正常人的全血样本进行检测,得到的均值mean等于2.48ng/ml,标准差sd等于1.01ng/ml。表二是178例样本中的样本1-10、90-99的检测结果。从检测结果可以看出,cf48在健康人血清中的含量很低。通过检测cf48的含量可以区分健康人与肾损伤患者。
[0670]
表一
[0671] od浓度(ng/ml)s61.077420s50.681710s40.47395s30.25872.5s20.17621.25s10.09700.625s00.05290
[0672]
表二
[0673]
[0674][0675]
实施例9。
[0676]
为了验证血清c4orf48在肾病、肾脏纤维化诊断的特异性,本实施例采用与实施例8相同的elisa方法对有肺纤维化发展趋向的肺部疾病患者进行血清cf48含量检测,其中间质性肺病57例、肺部感染、重症肺炎、肺癌、慢阻肺等其它肺病33例,表三随机抽取其中10例间质性肺病患者、10例其它肺病样本的检测结果展示。
[0677]
根据检测结果,计算得到肺损伤疾病患者血清样本cf48的均值为0.95ng/ml,标准差为0.62ng/ml;实验结果说明,cf48的含量不能表征肺部损伤的情况,证明cf48对肾病的特异性标识作用。
[0678]
表三
[0679]
样本od浓度间质性肺病40.30211.9188间质性肺病80.29831.8940间质性肺病190.34992.2376间质性肺病250.15870.9982间质性肺病270.32652.0797间质性肺病300.20241.2815间质性肺病340.08980.4998间质性肺病350.11170.6707间质性肺病510.06200.2439间质性肺病560.05840.2047肺部感染10.25531.6175肺部感染20.17211.0863肺部感染30.18931.1976肺部感染40.29371.8641肺部感染50.06140.2375肺部感染60.06350.2597肺部感染70.12010.7322肺部感染80.11950.7279肺部感染90.13150.8133肺部感染100.21611.3687
[0680]
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1