一种竞争性比率式SERS适配体传感器的制备方法及其应用
一种竞争性比率式sers适配体传感器的制备方法及其应用
技术领域
1.本发明属于安全检测领域,尤其是公开了一种竞争性比率式sers适配体传感器的制备方法及其应用。
背景技术:
2.表面增强拉曼散射(sers)是一种超灵敏的振动指纹技术,具有指纹识别、高分辨率、抗干扰能力强等显著特点,在检测领域展现了巨大的应用前景。然而,由于sers信号的低稳定性与重复性,sers传感器在检测复杂环境中的目标物质仍面临巨大的挑战。这主要是由于sers响应的强度不仅取决于分析物的浓度,而且还取决于增强的基底。事实上,由于复杂的基质效应,几乎不可能控制增强基底的电磁场的均匀性,从而难以获得稳定一致的sers光谱。这意味着仍然需要做出很多努力来完善基于sers的策略,以获得高鲁棒性和准确性的sers传感器。
技术实现要素:
3.为了解决现有技术存在的问题,本发明提供一种用于冈田酸检测的竞争性比率式sers适配体传感器的制备方法及其应用,将sers报告分子嵌入sers基底内部作为内部标准对传感器的拉曼信号进行效正,以解决上述现有sers技术存在的低重现性问题,从而实现对冈田酸的快速、便捷检测。
4.本发明解决上述技术问题的技术方案如下:
5.一种竞争性比率式sers适配体传感器的制备方法,包括以下步骤:
6.步骤一,制备四氨基苯硫酚嵌入的核壳纳米材料:
7.(1)将氯金酸水溶液加入水中混合,加热煮沸后加入二水合柠檬酸三钠水溶液,搅拌得到混合溶液,保持溶液沸腾,直到溶液变成酒红色,停止加热,得到金纳米溶液;
8.(2)待金纳米溶液冷至室温后,加入四氨基苯硫酚溶液,在室温下进行第一次搅拌反应,反应后将溶液煮沸,煮沸后加入二水合柠檬酸三钠溶液,继续搅拌一段时间,得到的四氨基苯硫酚修饰的金纳米溶液;最后将硝酸银滴加到四氨基苯硫酚修饰的金纳米溶液中,进行第二次搅拌反应,得到四氨基苯硫酚嵌入的金银核壳纳米溶液;
9.优选的,步骤一的(1)中所述氯金酸水溶液、水和二水合柠檬酸三钠水溶液的体积比为1:100:1.5;所述氯金酸水溶液的质量浓度为1%;所述二水合柠檬酸三钠水溶液的质量浓度为1%。
10.优选的,步骤一的(2)中所述四氨基苯硫酚修饰的金纳米溶液中的金纳米溶液、四氨基苯硫酚溶液、二水合柠檬酸三钠溶液和硝酸银的体积比为100:0.4~0.8:4:4;所述四氨基苯硫酚溶液的浓度为0.1mm,二水合柠檬酸三钠溶液的质量浓度为1%,硝酸银的浓度为4-8mm;
11.所述进行第一次搅拌反应的时间为1h,继续搅拌一段时间为5-10min;所述第二次搅拌反应的时间为1h。
12.步骤二,制备具有磁性的复合sers活性基底:
13.将六水氯化铁、聚乙二醇6000、乙酸钠与乙二醇混合,搅拌后将溶液冷却到室温后通过磁力分离得到磁纳米微球;将磁纳米微球加入聚乙烯亚胺乙醇溶液中,获得溶液超声溶解,通过磁分离获得氨基修饰的磁纳米微球;随后,将氨基修饰的磁纳米微球与步骤一合成的四氨基苯硫酚嵌入的金银核壳纳米溶液混合,机械振荡后通过磁分离得到的物质,用去离子水和乙醇洗涤分别洗涤数次,然后进行真空干燥,得到具有磁性的复合sers活性基底;
14.优选的,步骤二中所述六水氯化铁、聚乙二醇6000、乙酸钠和乙二醇的用量关系为2.7g:1g:8g:80ml;所述磁纳米微球与聚乙烯亚胺乙醇溶液的用量比为0.04g:20ml,聚乙烯亚胺乙醇溶液的质量浓度为3-8%;所述磁性微球溶液与四氨基苯硫酚嵌入的金银核壳纳米溶液的用量比为4g:10ml;所述搅拌的时间为1h,超声溶解的时间为2h,机械振荡的时间为3h,真空干燥温度为60℃。
15.步骤三,合成sers适配体传感器:
16.(1)将步骤二中得到的具有磁性的复合sers活性基底、链霉亲和素和磷酸盐缓冲液混合,并摇晃一段时间后进行磁分离,获得链霉亲和素修饰的复合sers基底;
17.(2)将链霉亲和素修饰的复合sers基底、生物素修饰的冈田酸适配体单链和磷酸盐缓冲溶液混合,孵育后将产物进行磁分离,并用吐温20水溶液洗涤数次,获得适配体单链修饰的复合sers基底;
18.(3)最后,将适配体单链修饰的复合sers基底、亚甲基蓝修饰的适配体互补链和磷酸盐缓冲溶液混合,第一次孵育后冷却至室温,并进行第二次孵育,磁分离后最终得到sers适配体传感器。
19.优选的,步骤三的(1)中所述具有磁性的复合sers活性基底、链霉亲和素和磷酸盐缓冲液用量比为2g:0.1~0.3g:2ml;所述摇晃温度为4℃,摇晃时间为6h。
20.优选的,步骤三的(2)中所述链霉亲和素修饰的复合sers基底、生物素修饰的冈田酸适配体单链、磷酸盐缓冲溶液和吐温20水溶液的用量比为1g:80~120μl:1ml:1ml;所述生物素修饰的冈田酸适配体单链浓度为8-12μm;所述孵育时间为8h,孵育温度为25℃;所述吐温20水溶液的质量浓度为0.02%。
21.优选的,步骤三的(3)中适配体单链修饰的复合sers基底、亚甲基蓝修饰的适配体互补链和磷酸盐缓冲溶液用量比为1g:80~120μl:1ml;所述亚甲基蓝修饰的适配体互补链浓度为8-12μm;所述第一次孵育时间为3min,孵育温度为95℃,冷却时间为1h;第二次孵育时间为30min,孵育温度为25℃。
22.优选的,步骤三使用的磷酸盐缓冲液的ph皆为7.4,浓度皆为10mmol/l。
23.本发明还提供一种竞争性比率式sers适配体传感器在检测冈田酸中的应用,包括以下步骤:
24.(1)冈田酸标准曲线的建立:
25.将步骤三制备的sers适配体传感器与不同浓度的冈田酸标准溶液混合,传感器与冈田酸标准溶液为一一对应的关系,得到的混合液经孵育后进行磁分离,收集反应后sers适配体传感器重溶于水溶液中,并进行sers光谱采集;记录光谱中sers强度信号特征值,并与冈田酸浓度拟合建立标准曲线;
26.优选的,所述(1)中sers适配体传感器、冈田酸标准溶液和水溶液的用量比为1g:1ml;
27.所述冈田酸标准溶液的浓度范围为0-200ng/ml;所述孵育时间为50min,孵育温度为25℃;所述磁分离后收集反应后sers适配体传感器与水溶液的用量比为1g:1ml。
28.优选的,所述(1)中所述记录光谱中sers强度信号特征值的步骤为:分别记录传感器在785nm激发光激发下在1612cm-1
与1570cm-1
处的sers强度值,前者与后者的比值i
1612/1570
为光谱中sers强度信号特征值。
29.(2)食品和环境样本中冈田酸含量的检测:
30.将食品或环境样本预处理,提取得到含有冈田酸的提取液;将步骤三制备的sers适配体传感器与提取液混合,孵育后,磁分离后收集反应后sers适配体传感器重溶于水溶液中,并进行sers光谱采集;录光谱中sers强度信号特征值,将所得结果带入步骤(1)所得标准曲线中,实现样本中冈田酸含量的检测。
31.优选的,所述(2)中sers适配体传感器与冈田酸的提取液的用量比为1g:1ml;
32.所述孵育时间为50min,孵育温度为25℃;所述磁分离后收集反应后sers适配体传感器与水溶液的用量比为1g:1ml。
33.优选的,步骤(2)中所述环境样本包括水和土壤,所述食品或环境样本的预处理方法为:如是液体,则将液体样本经粗滤直接进行检测;如是固体,首先将固体样本均质,加入甲醇混合摇晃,离心后取上清液记为溶液a,剩余残留物与甲醇重新混合摇晃,离心后取上清液记为溶液b,混合溶液a与溶液b并用甲醇定容,取混合液经过氮气吹干后加入甲酸和水溶液复溶;
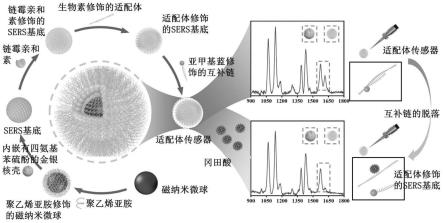
34.所述预处理方法中固体样本、a溶液中甲醇、b溶液甲醇用量比为2g:9ml:9ml;所述摇晃时间为1分钟;所述混合溶液a与溶液b定容体积为20ml;所述混合液、甲酸与水的体积比为5:0.1:0.99ml;所述溶液a与溶液b的离心转速为12000rpm,离心时间为3min。
35.有益效果:
36.1、本发明将比率探针与磁分离特征集成在同一传感器中,使得构建的传感器既具有良好的自我校正能力,又可以在复杂基质中快速分离传感器,简化反应步骤。
37.2、本发明将核壳结构应用到sesr传感器的构件中,放大了传感器表面的sers增强效果。
38.3、本发明将使用四氨基苯硫酚作为内标分子,将其嵌入基底的核壳结构中,不仅有效地避免了通过与目标分析物的间接接触而产生的竞争性吸附,而且补偿了由不同程度的基底聚集和测量条件所造成的信号波动。
39.4、本发明使用四氨基苯硫酚与亚甲基蓝分别作为内标分子与响应分子,两者皆具有明显的sers响应,且两者的sers之间部分峰不重叠,有利于比率传感器的构建。
40.5、本发明中适配体通过链霉亲和素-生物素相互作用结合在基底表面,其结合紧密,性质稳定。
41.6、本发明提出了一种用于冈田酸检测的竞争性比率式sers适配体传感器,该传感器操作简单、检测时间短、结果准确,具备良好的应用前景。
附图说明
42.图1为实施例1中竞争性比率式sers适配体传感器的构建以及检测原理图。
43.图2为实施例1构建的四氨基苯硫酚嵌入的金银核壳的透射电镜及元素分布图;
44.其中a图为四氨基苯硫酚嵌入的金银核壳纳米的透射电镜,b-c图分别为au、ag和s的元素分布图。
45.图3为实施例1构建的具有磁性的复合sers活性基底的透射电镜及元素分布图;
46.其中a图为磁性的复合sers活性基底的透射电镜图,b-e分别是相对应得fe、au、s、ag元素分布图。
47.图4为实施例1中制备的sers传感器自校准能力表征图;
48.其中,a为检测任意15组传感器在1612cm-1
拉曼位移处的sers强度;b为检测任意15组传感器在1612和1570cm-1
拉曼位移处的比率sers强度。
49.图5为实施例1中检测待测物的不同浓度标准溶液后建立的标准曲线;
50.其中,a为实施例1中检测海水样本不同浓度冈田酸的sers适配体传感器拉曼信号图;b为实施例1中检测海水样本不同浓度冈田酸的sers适配体传感器建立的标准曲线。
具体实施方式
51.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
52.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
53.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
54.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
55.生物素修饰的冈田酸适配体单链为常规公知试剂材料,购自生工生物工程(上海)股份有限公司,序列为:
56.5'biotin-ggtcaccaacaacagggagcgctacgcgaagggtcaatgtgacgtcatgcggatgtgtgg-3';
57.亚甲基蓝修饰的适配体互补链为常规公知试剂材料,购自生工生物工程(上海)股份有限公司,序列为:5'methylene blue-cccttcgcgtagcgctccctgttgttggtg-3'。
58.实施例1:海水中冈田酸的检测
59.图1为实施例1中竞争性比率式sers适配体传感器的构建以及检测原理图;
60.步骤一,制备四氨基苯硫酚嵌入的核壳纳米材料:
61.将质量浓度为1%氯金酸水溶液加入100ml水里煮沸,加热煮沸后加入1.5ml质量浓度为1%的二水合柠檬酸三钠水溶液,保持溶液沸腾,直到溶液变成酒红色,停止加热,得到金纳米溶液;待金纳米溶液冷至室温后,加入0.4ml浓度为0.1mm的四氨基苯硫酚溶液,在室温下搅拌1h,反应后将溶液煮沸,煮沸后加入4ml质量浓度为1%的二水合柠檬酸三钠溶液,继续搅拌5min,得到的四氨基苯硫酚修饰的金纳米溶液;最后将4ml浓度为4mm的硝酸银滴加到四氨基苯硫酚修饰的金纳米溶液中,搅拌1h,得到四氨基苯硫酚嵌入的金银核壳纳米材料;
62.图2为实施例1构建的四氨基苯硫酚嵌入的金银核壳纳米的透射电镜及元素分布图,其中中a图为四氨基苯硫酚嵌入的金银核壳纳米的透射电镜,b-c图分别为au、ag和s的元素分布图;从图2可以看出,金银核壳结构为直径27.50
±
3.00nm的球形;将s元素作为内标分子(四氨基苯硫酚)的代表,结果表明,四氨基苯硫酚分子均匀地分布在金核和银壳之间。
63.步骤二,制备具有磁性的复合sers活性基底:
64.将2.7g的六水氯化铁、1g的聚乙二醇6000和8g的乙酸钠与80ml的乙二醇混合,搅拌1小时后将溶液冷却到室温后通过磁力分离得到磁纳米微球;将0.04g磁纳米微球加入20ml质量浓度为3%聚乙烯亚胺乙醇溶液中,获得溶液超声溶解2h,通过磁分离获得氨基修饰的磁纳米微球;随后,将4g氨基修饰的磁纳米微球与步骤一合成的10ml的四氨基苯硫酚嵌入的金银核壳纳米溶液混合,机械振荡3h后通过磁分离得到的物质,用去离子水和乙醇洗涤分别洗涤3次,然后在60℃真空炉中干燥,得到具有磁性的复合sers活性基底;
65.图3为实施例1构建的具有磁性的复合sers活性基底的透射电镜及元素分布图,其中a图为磁性的复合sers活性基底的透射电镜图,b-e分别是相对应得fe、au、s、ag元素分布图;从图3的元素分布可以看出,金银核壳已经均匀地固定在磁纳米微球的表面。
66.步骤三、合成sers适配体传感器:
67.(1)将2g具有磁性的复合sers活性基底、0.1g链霉亲和素和2ml磷酸盐缓冲液(ph=7.4,10mmol/l)混合,并在4℃摇晃6h后磁分离,获得链霉亲和素修饰的复合sers基底;
68.(2)将1g链霉亲和素修饰的复合sers基底、80μl浓度为8μm生物素修饰的冈田酸适配体单链和1ml磷酸盐缓冲溶液(ph=7.4,10mmol/l)混合,在25℃孵育8h后将产物进行磁分离,并用1ml质量浓度为0.02%的吐温20水溶液洗涤两次,获得适配体单链修饰的复合sers基底;
69.(3)最后,将1g适配体单链修饰的复合sers基底、80μl浓度为8μm亚甲基蓝修饰的适配体互补链和1ml磷酸盐缓冲溶液(ph=7.4,10mmol/l)混合,在95℃孵育3min,冷却1h后,在25℃孵育30min,磁分离后最终得到sers适配体传感器;
70.图4为实施例1中制备的sers适配体传感器自校准能力表征图;a图为15批sers适配体传感器在1612cm-1
拉曼位移处的sers强度柱状图,b为15批sers适配体传感器自校准在1612cm-1
拉曼位移处的sers强度柱状图;从图四可以看出,自校准前后传感器任意15条光谱的峰强度的rsd从9.54%降低到4.6%,这大大提高了所构建的sers适配体传感器的重现性。
71.海水样本中冈田酸含量的检测:
72.(1)冈田酸标准曲线的建立:
73.配制0,0.5,5,10,20,40,60,80,100,200ng/ml冈田酸标准溶液,将1g步骤三制备的sers适配体传感器与1ml不同浓度的冈田酸标准溶液混合,混合液在25℃孵育50min后,磁分离后收集反应后sers适配体传感器重溶于1ml水溶液中,并进行sers光谱采集(图5a);记录光谱中sers强度信号特征值,并与冈田酸浓度拟合建立标准曲线(图5b);
74.其中光谱中sers强度信号特征值的步骤为:分别记录传感器在785nm激发光激发下在1612cm-1
与1570cm-1
处的sers强度值,前者与后者的比值i
1612/1570
为光谱中sers强度信号特征值。
75.图5a为实施例1中检测海水样本不同浓度冈田酸的sers适配体传感器拉曼信号图;图5b为实施例1中检测海水样本不同浓度冈田酸的sers适配体传感器建立的标准曲线;从图5可以看出,在0.5-100ng/ml的范围内,i
1612/1570
的比值与冈田酸浓度的关系图显示出负相关(y=0.7005-0.0042x),r2=0.9866;此外,检测极限(lod)估计为0.21ng/ml(s/n=3);
76.(2)海水样本中冈田酸含量的检测:
77.取0.9ml海水样本与0.1ml浓度为500ng/ml的冈田酸标准溶液混合,将混合后溶液经过初步过滤得到预处理后的海水样本;将1g步骤三制备的sers适配体传感器与1ml预处理后的海水样本混合,25℃孵育50min后,磁分离后收集反应后sers适配体传感器重溶于1ml水溶液中,并进行sers光谱采集;记录光谱中sers强度信号特征值,将所得结果带入步骤(1)所得标准曲线中,得到待测物的量50ng/ml。
78.实施例2:贝肉中冈田酸的检测
79.步骤一,制备四氨基苯硫酚嵌入的核壳纳米材料:
80.将质量浓度为1%氯金酸水溶液加入100ml水里煮沸,加热煮沸后加入1.5ml质量浓度为1%的二水合柠檬酸三钠水溶液,保持溶液沸腾,直到溶液变成酒红色,停止加热,得到金纳米溶液;待金纳米溶液冷至室温后,加入0.6ml浓度为0.1mm的四氨基苯硫酚溶液,在室温下搅拌1h,反应后将溶液煮沸,煮沸后加入4ml质量浓度为1%的二水合柠檬酸三钠溶液,继续搅拌7min,得到的四氨基苯硫酚修饰的金纳米溶液;最后将4ml浓度为4mm的硝酸银滴加到四氨基苯硫酚修饰的金纳米溶液中,搅拌1h,得到四氨基苯硫酚嵌入的金银核壳纳米材料;
81.步骤二,制备具有磁性的复合sers活性基底:
82.将2.7g的六水氯化铁、1g的聚乙二醇6000和8g的乙酸钠与80ml的乙二醇混合,搅拌1小时后将溶液冷却到室温后通过磁力分离得到磁纳米微球;将0.04g磁纳米微球加入20ml质量浓度为5%聚乙烯亚胺乙醇溶液中,获得溶液超声溶解2h,通过磁分离获得氨基修饰的磁纳米微球;随后,将4g氨基修饰的磁纳米微球与步骤一合成的10ml的四氨基苯硫酚嵌入的金银核壳纳米溶液混合,机械振荡3h后通过磁分离得到的物质,用去离子水和乙醇洗涤分别洗涤3次,然后在60℃真空炉中干燥,得到具有磁性的复合sers活性基底;步骤三、合成sers适配体传感器:将2g复合sers活性基底分散在2ml磷酸盐缓冲液(ph=7.40)中,并加入200μl、0.5mg/ml的链霉亲和素,混合溶液在4℃下连续摇动6小时后磁分离;最后,将1ml,10μm适配体pbs缓冲溶液(ph=7.4)加入1ml,1mg/ml链霉亲和素修饰的复合sers基底中,孵育8小时;磁分离后,用0.02%吐温20水溶液洗涤两次,以去除未交联的适配体,并将所得颗粒均匀地分散在pbs缓冲溶液中(ph=7.4),浓度为1mg/ml;最后,将含有100μl的亚
甲基蓝修饰的适配体互补链的pbs缓冲溶液(ph=7.4)加入上述溶液中,95℃孵育3分钟,1h内冷却到室温;之后,将混合物在室温下孵育30分钟,最终得到sers适配体传感器;
83.步骤三、合成sers适配体传感器:
84.(1)将2g具有磁性的复合sers活性基底、0.2g链霉亲和素和2ml磷酸盐缓冲液(ph=7.4,10mmol/l)混合,并在4℃摇晃6h后磁分离,获得链霉亲和素修饰的复合sers基底;
85.(2)将1g链霉亲和素修饰的复合sers基底、100μl浓度为10μm生物素修饰的冈田酸适配体单链和1ml磷酸盐缓冲溶液(ph=7.4,10mmol/l)混合,在25℃孵育8h后将产物进行磁分离,并用1ml质量浓度为0.02%的吐温20水溶液洗涤两次,获得适配体单链修饰的复合sers基底;
86.(3)最后,将1g适配体单链修饰的复合sers基底、100μl浓度为10μm亚甲基蓝修饰的适配体互补链和1ml磷酸盐缓冲溶液(ph=7.4,10mmol/l)混合,在95℃孵育3min,冷却1h后,在25℃孵育30min,磁分离后最终得到sers适配体传感器;
87.贝肉样本中冈田酸含量的检测:
88.(1)冈田酸标准曲线的建立:
89.配制0,0.5,5,10,20,40,60,80,100,200ng/ml冈田酸标准溶液,将1g步骤三制备的sers适配体传感器与3ml不同浓度的冈田酸标准溶液混合,混合液在25℃孵育50min后,磁分离后收集反应后sers适配体传感器重溶于1ml水溶液中,并进行sers光谱采集;记录光谱中sers强度信号特征值,并与冈田酸浓度拟合建立标准曲线;在0.5-100ng/ml的范围内,i
1612/1570
的比值与冈田酸浓度的关系图显示出负相关(y=0.7000-0.0050x),r2为0.9896;此外,检测极限(lod)估计为0.18ng/ml(s/n=3);
90.(2)贝肉样本中冈田酸含量的检测:
91.加入0.1ml浓度为200ng/ml的冈田酸标准溶液加入2g贝类样本中,将获得的样本均质,随后将均质后的贝类样品与9ml甲醇混合,然后将混合物旋转1分钟,并在4℃下以12000g离心3min、获得上清液a,将剩余残留物重新提取至9ml甲醇中,然后将混合物旋转1分钟,并在4℃下以12000g离心3min、获得上清液b;将上清液a与b混合,混合液使用甲醇定容至20ml,取5ml混合液在氮气下蒸发至干燥,然后加入0.1ml的甲酸和0.9ml的水溶液复溶获得预处理后的贝肉样本;将1g步骤三制备的sers适配体传感器与1ml预处理后的贝肉样本混合,25℃孵育50min后,磁分离后收集反应后sers适配体传感器重溶于1ml水溶液中,并进行sers光谱采集;记录光谱中sers强度信号特征值,将所得结果带入步骤(1)所得标准曲线中,得到贝肉中冈田酸含量为51ng/ml。
92.实施例3:鱼肉中冈田酸的检测
93.步骤一,制备四氨基苯硫酚嵌入的核壳纳米材料:
94.将质量浓度为1%氯金酸水溶液加入100ml水里煮沸,加热煮沸后加入1ml质量浓度为1%的二水合柠檬酸三钠水溶液,保持溶液沸腾,直到溶液变成酒红色,停止加热,得到金纳米溶液;待金纳米溶液冷至室温后,加入0.8ml浓度为0.1mm的四氨基苯硫酚溶液,在室温下搅拌1h,反应后将溶液煮沸,煮沸后加入4ml质量浓度为1%的二水合柠檬酸三钠溶液,继续搅拌10min,得到的四氨基苯硫酚修饰的金纳米溶液;最后将4ml浓度为4mm的硝酸银滴加到四氨基苯硫酚修饰的金纳米溶液中,搅拌1h,得到四氨基苯硫酚嵌入的金银核壳纳米材料;
95.步骤二,制备具有磁性的复合sers活性基底:
96.将2.7g的六水氯化铁、1g的聚乙二醇6000和8g的乙酸钠与80ml的乙二醇混合,搅拌1小时后将溶液冷却到室温后通过磁力分离得到磁纳米微球;将0.04g磁纳米微球加入20ml质量浓度为8%聚乙烯亚胺乙醇溶液中,获得溶液超声溶解2h,通过磁分离获得氨基修饰的磁纳米微球;随后,将4g氨基修饰的磁纳米微球与步骤一合成的10ml的四氨基苯硫酚嵌入的金银核壳纳米溶液混合,机械振荡3h后通过磁分离得到的物质,用去离子水和乙醇洗涤分别洗涤3次,然后在60℃真空炉中干燥,得到具有磁性的复合sers活性基底;
97.步骤三、合成sers适配体传感器:
98.(1)将2g具有磁性的复合sers活性基底、0.3g链霉亲和素和2ml磷酸盐缓冲液(ph=7.4,10mmol/l)混合,并在4℃摇晃6h后磁分离,获得链霉亲和素修饰的复合sers基底;
99.(2)将1g链霉亲和素修饰的复合sers基底、120μl浓度为12μm生物素修饰的冈田酸适配体单链和1ml磷酸盐缓冲溶液(ph=7.4,10mmol/l)混合,在25℃孵育8h后将产物进行磁分离,并用1ml质量浓度为0.02%的吐温20水溶液洗涤两次,获得适配体单链修饰的复合sers基底;
100.(3)最后,将1g适配体单链修饰的复合sers基底、120μl浓度为12μm亚甲基蓝修饰的适配体互补链和1ml磷酸盐缓冲溶液(ph=7.4,10mmol/l)混合,在95℃孵育3min,冷却1h后,在25℃孵育30min,磁分离后最终得到sers适配体传感器;
101.鱼肉样本中冈田酸含量的检测:
102.(1)冈田酸标准曲线的建立:
103.配制0,0.5,5,10,20,40,60,80,100,200ng/ml冈田酸标准溶液,将1g步骤三制备的sers适配体传感器与3ml不同浓度的冈田酸标准溶液混合,混合液在25℃孵育50min后,磁分离后收集反应后sers适配体传感器重溶于1ml水溶液中,并进行sers光谱采集;记录光谱中sers强度信号特征值,并与冈田酸浓度拟合建立标准曲线;在0.5-100ng/ml的范围内,i
1612/1570
的比值与冈田酸浓度的关系图显示出负相关(y=0.7005-0.0042x),r2为0.9866;此外,检测极限(lod)估计为0.21ng/ml(s/n=3);
104.(2)鱼肉样本中冈田酸含量的检测:
105.加入0.1ml浓度为200ng/ml的冈田酸标准溶液加入2g鱼肉样本中,将获得的样本均质,随后将均质后的贝类样品与9ml甲醇混合,然后将混合物旋转1分钟,并在4℃下以12000g离心3min、获得上清液a,将剩余残留物重新提取至9ml甲醇中,然后将混合物旋转1分钟,并在4℃下以12000g离心3min、获得上清液b;将上清液a与b混合,混合液使用甲醇定容至20ml,取5ml混合液在氮气下蒸发至干燥,然后加入0.1ml的甲酸和0.9ml的水溶液复溶获得预处理后的鱼肉样本;将1g步骤三制备的sers适配体传感器与1ml预处理后的鱼肉样本混合,25℃孵育50min后,磁分离后收集反应后sers适配体传感器重溶于1ml水溶液中,并进行sers光谱采集;记录光谱中sers强度信号特征值,将所得结果带入步骤(1)所得标准曲线中,得到贝肉中冈田酸含量为49ng/ml。
106.说明:以上实施例仅用以说明本发明而并非限制本发明所描述的技术方案;因此,尽管本说明书参照上述的各个实施例对本发明已进行了详细的说明,但是本领域的普通技术人员应当理解,仍然可以对本发明进行修改或等同替换;而一切不脱离本发明的精神和范围的技术方案及其改进,其均应涵盖在本发明的权利要求范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1