一种缬沙坦氨氯地平药物组合物中有关物质的检测方法与流程
1.本发明属于药物分析领域,具体涉及一种缬沙坦氨氯地平药物组合物中有关物质的检测方法。
背景技术:
2.缬沙坦氨氯地平片为缬沙坦和苯磺酸氨氯地平的复方制剂,适应症为治疗原发性高血压,主要用于那些单独采用氨氯地平或缬沙坦或其他降血压药物治疗后效果不佳的高血压患者。缬沙坦氨氯地平片可以减少外周血阻力,通过阻滞钙通道和抑制血管紧张素ii,而降低血压,疗效好。
3.缬沙坦氨氯地平片的制备工艺通常采用标准的干法制粒技术,包括以下步骤:预混合和过筛,第二次混合,干法制粒和过筛,总混、压片,最后包衣。在制备缬沙坦氨氯地平片的过程中,若杂质的含量超过限量标准,其药效及用药安全会受到影响。因此,需要开发检测缬沙坦氨氯地平药物组合物中有关物质含量的方法来对其进行质量控制。
4.现有技术中,文献(荆小燕等.高效液相色谱法测定缬沙坦氨氯地平片中的有关物质.中国新药杂志,2013年第22卷第19期)中记载了一种缬沙坦氨氯地平片中的有关物质hplc检测方法,检测条件为:采用kromasil c
18
(250mm
×
4.6mm,5μm)色谱柱,流动相为20mmol
·
l-1
庚烷磺酸钠溶液(含0.7%三乙胺,用磷酸调ph值至3.0)(a)-乙腈(b),梯度洗脱;柱温35℃;流速1.0ml min-1
;进样量20μl;检测波长237nm。该方法主要用于检测缬沙坦杂质b、缬沙坦杂质c和氨氯地平杂质d。
5.公开号为cn114814060a的中国专利文献公开了一种缬沙坦氨氯地平片中有关物质的检测方法,检测条件为:十八烷基硅烷键合硅胶色谱柱phenomenex luna c18,以ph 2.6~3.0的三乙胺-磷酸缓冲溶液为流动相a,以乙腈为流动相b,流速0.9~1.1ml/min,柱温33℃~37℃,该方法主要用于检测杂质ⅰ~
ⅸ
共9种杂质。
6.基于上述存在的不足,缬沙坦氨氯地平药物组合物中有关物质的检测方法仍有待进一步优化。
技术实现要素:
7.本发明提供了一种缬沙坦氨氯地平药物组合物中有关物质的检测方法,能够同时定量检测缬沙坦氨氯地平片中的氨氯地平降解杂质、缬沙坦降解杂质、缬沙坦工艺杂质等,本发明方法易于操作、对仪器要求低,分离度高,灵敏度好、专属性良好、准确度良好、重复性好,非常适用于缬沙坦氨氯地平药物组合物中有关物质的检测。
8.具体采用的技术方案如下:
9.一种缬沙坦氨氯地平药物组合物中有关物质的检测方法,采用高效液相色谱法进行梯度洗脱,以乙二胺四醋酸二钠水溶液-三乙胺为流动相a,异丙醇为流动相b,对缬沙坦氨氯地平药物组合物待测品制成的供试品溶液中有关物质杂质进行分析检测;
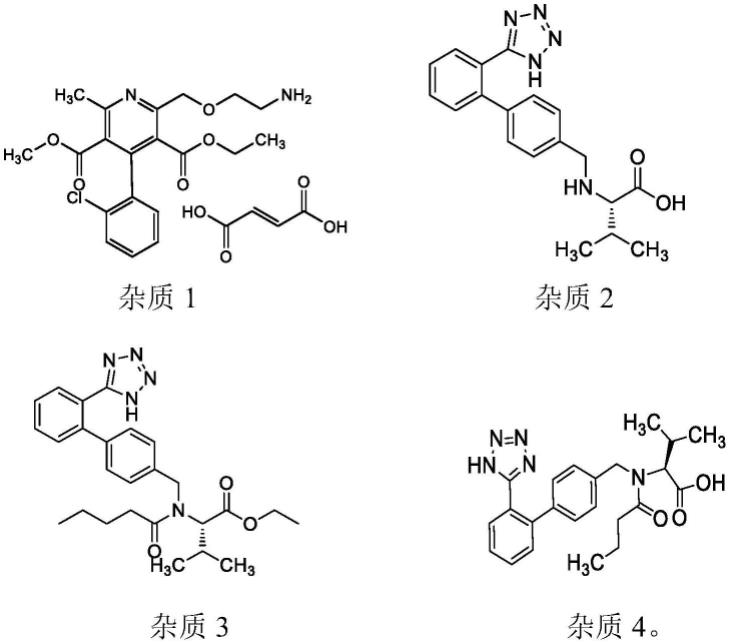
10.缬沙坦氨氯地平药物组合物的药效成分包括缬沙坦和氨氯地平,所述的有关物质
为杂质1、杂质2、杂质3或杂质4,结构式分别如下:
[0011][0012]
所述的高效液相色谱法的测试条件为:色谱柱选用waters symmetry c18,3.9mm
×
150mm,5μm或waters xbridge c18,4.6mm
×
150mm,3.5μm;柱温为30~35℃,进样量为10~20μl,流速为1.0~1.3ml/min,检测波长为237nm。
[0013]
进一步优选的,柱温为30℃,进样量为10μl,流速为1.0ml/min。
[0014]
优选的,所述的流动相a中,乙二胺四醋酸二钠水溶液和三乙胺的体积比为1~5:95~99。
[0015]
优选的,所述的乙二胺四醋酸二钠水溶液浓度为0.03~0.06mol/l。
[0016]
优选的,梯度洗脱参数为:0~5.0min,40%~60%流动相a和40%~60%流动相b洗脱;5.01~13.0min,60%~80%流动相a与20%~40%流动相b洗脱;13.01~21.0min,40%~60%流动相a和40%~60%流动相b洗脱;21.01~30.0min,40%~60%流动相a和40%~60%流动相b洗脱。
[0017]
本发明采用乙二胺四醋酸二钠水溶液和三乙胺的混合溶液作为流动相a,异丙醇作为流动相b,保证了杂质在溶剂中的稳定性,同时结合梯度洗脱程序的优化,使得药效成分和杂质的分离度高,可以有效地促进缬沙坦氨氯地平药物组合物中有关物质杂质的充分洗脱。
[0018]
优选的,供试品溶液包括供试品溶液1和供试品溶液2,所述的供试品溶液1中,氨氯地平的浓度为0.09-0.11mg/ml,所述的供试品溶液2中,缬沙坦的浓度为0.15-0.17mg/ml。
[0019]
进一步优选的,供试品溶液2由供试品溶液1稀释10倍得到,供试品溶液的溶剂为体积比60~70:30~40的流动相a和流动相b的混合溶剂。
[0020]
与现有技术相比,本发明的有益效果在于:
[0021]
(1)本发明采用高效液相色谱法以乙二胺四醋酸二钠水溶液-三乙胺为流动相a,异丙醇为流动相b,实现了缬沙坦氨氯地平药物组合物中氨氯地平降解杂质、缬沙坦降解杂质、缬沙坦工艺杂质的定量检测,且本发明方法操作简单,几种杂质均能够达到基线分离,各杂质间以及杂质和药效成分间分离度大,在237nm的检测波长下,各杂质均有较大的吸收,且对仪器设备要求低,灵敏度良好,进样精密度和重复性好。
[0022]
(2)本发明检测方法的专属性良好、准确度良好、测试速度快,符合相关法规和指导原则的要求,实际检测效果良好。
附图说明
[0023]
图1为本发明实施例1的缬沙坦氨氯地平药物组合物中有关物质的检测中的混合对照品溶液1的色谱图。
[0024]
图2为本发明实施例1的缬沙坦氨氯地平药物组合物中有关物质的检测中的供试品溶液1的色谱图。
[0025]
图3为本发明实施例1的缬沙坦氨氯地平药物组合物中有关物质的检测中的供试品溶液2的色谱图。
[0026]
图4为本发明对比例1的缬沙坦氨氯地平药物组合物中有关物质的检测中的混合溶液的色谱图。
具体实施方式
[0027]
下面结合实施例与附图,进一步阐明本发明。应理解,这些实施例仅用于说明本发明,而不用于限制本发明的范围。
[0028]
在以下实施例中,高效液相色谱仪选用agilent 1260,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0029]
1.供试品
[0030][0031]
2.对照品
[0032][0033]
3.杂质
[0034][0035][0036]
本发明缬沙坦氨氯地平药物组合物中的苯磺酸氨氯地平原料,根据其起始物料的
合成路线、中间体、副反应、降解途径等,已经对产生的工艺杂质严格控制,评估其在本发明制剂制备过程中增长的可能性较低,因此本发明制剂不对其工艺杂质等进行研究,此外,在苯磺酸氨氯地平原料合成过程中可能产生的基因毒性杂质为苯磺酸甲酯、苯磺酸乙酯、β-氨基巴豆酸甲酯,采用准确度较高的hplc法和gc法,已制定严格限度控制,评估在制剂过程中没有引入的风险,且不产生,则不在制剂中控制,残留溶剂乙醇在制剂过程中不使用,也无增加的可能性,制剂中无需控制。缬沙坦中的缬沙坦杂质ⅱ为工艺杂质,在缬沙坦原料中已控制,现只进行研究即可,但本发明方法能够达到定量检测缬沙坦杂质ⅱ的目的,另外,缬沙坦原料中可能存在的基因毒性杂质及残留溶剂,在制剂过程没有引入的风险,均不在制剂中控制。
[0037]
4.标准规定
[0038]
(1)系统适用性
[0039]
系统适用性溶液色谱图中,出峰顺序依次为氨氯地平、杂质4和缬沙坦,氨氯地平和杂质4、缬沙坦和杂质4分离度均应不低于4.0;混合对照品溶液色谱图中,出峰顺序依次为杂质2、杂质1、氨氯地平、缬沙坦和杂质3,各峰之间的分离度均应大于1.5;灵敏度溶液色谱图中,氨氯地平峰和缬沙坦峰的信噪比均应不小于10。
[0040]
(2)供试品溶液中有关物质杂质含量计算公式(为了测试准确性,杂质含量的计算公式里利用2份对照品溶液来计算):
[0041][0042][0043][0044][0045][0046][0047][0048]
各杂质的和(%)=缬沙坦总杂(%)+氨氯地平总杂(%)
[0049]
式中:w
水对
混合对照品溶液中缬沙坦水解杂质的称样量(mg)
[0050]w乙对
混合对照品溶液中缬沙坦乙酯杂质的称样量(mg)
[0051]w杂a对
混合对照品溶液中氨氯地平杂质a的称样量(mg)
[0052]w缬对
对照品溶液中缬沙坦的称样量(mg)
[0053]w氨对
对照品溶液中苯磺酸氨氯地平的称样量(mg)
[0054]w供
供试品的称样量(mg)
[0055]a水对
/a
水供
混合对照品溶液中/供试品溶液中缬沙坦水解杂质的峰面积
[0056]a乙对
/a
乙供
混合对照品溶液中/供试品溶液中缬沙坦乙酯杂质的峰面积
[0057]a杂a对
/a
杂a供
混合对照品溶液中/供试品溶液中氨氯地平杂质a的称峰面积
[0058]a缬对
/a
缬沙坦
对照品溶液中/供试品溶液中缬沙坦的峰面积
[0059]a氨对
/a
氨氯地平
对照品溶液中/供试品溶液中氨氯地平的峰面积
[0060]a缬总
/a
氨总
缬沙坦供试品溶液/氨氯地平供试品溶液各峰峰面积总和
[0061]a缬单杂
/a
氨单杂
缬沙坦供试品溶液/氨氯地平供试品溶液中未知单个杂质的峰面积
[0062]d缬供
/d
氨供
缬沙坦供试品溶液/氨氯地平供试品溶液的稀释倍数
[0063]d对
混合对照品溶液/对照品溶液中各成分的稀释倍数
[0064]
0.721氨氯地平与苯磺酸氨氯地平的换算因子
[0065]
c杂质对照品/对照品的含量(%)
[0066]
实施例1
[0067]
(1)溶液配制
[0068]
供试品溶液1:取缬沙坦氨氯地平药物组合物,研细后精密称取细粉175.37mg,置于50ml量瓶中,加体积比为60:40的流动相a与流动相b适量,超声15min使主成分溶解,放冷至室温,而后加体积比为60:40的流动相a与流动相b至刻度,摇匀过滤制成供试品溶液1,其中,氨氯地平的浓度为0.1mg/ml;
[0069]
供试品溶液2:精密量取1ml供试品溶液1置于10ml量瓶中,用体积比为60:40的流动相a与流动相b稀释至刻度制成供试品溶液2,其中,缬沙坦的浓度为0.16mg/ml;
[0070]
对照品溶液:分别精密称取苯磺酸氨氯地平对照品14.73mg和缬沙坦对照品16.48mg置于同一100ml量瓶中,先加5ml甲醇使溶解,而后用体积比为60:40的流动相a与流动相稀释至刻度制成对照品溶液1;分别精密称取苯磺酸氨氯地平对照品15.89mg和缬沙坦对照品17.27mg,同法制成对照品溶液2;
[0071]
灵敏度溶液:精密量取对照品溶液1,用体积比为60:40的流动相a与流动相b配制成每1ml含0.05μg氨氯地平、0.08μg缬沙坦的溶液;
[0072]
系统适用性溶液:精密称取苯磺酸氨氯地平对照品7.48g、缬沙坦对照品8.27g、缬沙坦杂质ⅱ对照品4.13mg置同一50ml量瓶中,先加2.5ml甲醇使溶解,而后用体积比为60:40的流动相a与流动相b稀释至刻度,摇匀;
[0073]
杂质贮备液:精密称取氨氯地平杂质a对照品10.28mg,加甲醇溶解并定量稀释制成杂质1贮备液;精密称取缬沙坦水解杂质对照品9.11mg和缬沙坦乙酯对照品8.07mg,分别加甲醇溶解并定量稀释制成杂质2贮备液和杂质3贮备液;
[0074]
混合对照品溶液:精密量取杂质1贮备液2.5ml、杂质2贮备液和杂质3贮备液各2ml,置50ml量瓶中,精密加入1ml对照品溶液1,用体积比为60:40的流动相a与流动相b稀释至刻度,摇匀,精密量取1ml,置10ml量瓶中,用溶剂稀释至刻度制成混合对照品溶液1,同法
制成混合对照品溶液2;
[0075]
苯磺酸定位溶液:精密称取苯磺酸10.21mg置于100ml量瓶中,加甲醇5ml溶解,用体积比为60:40的流动相a与流动相b稀释至刻度制成苯磺酸定位溶液;
[0076]
氨氯地平杂质归属溶液:精密称取苯磺酸氨氯地平原料药14.67mg置于100ml量瓶中,加甲醇5ml溶解,用体积比为60:40的流动相a与流动相b稀释至刻度制成氨氯地平杂质归属溶液;
[0077]
缬沙坦杂质归属溶液:精密称取缬沙坦原料药80.12mg置于50ml量瓶中,加甲醇2.5ml溶解,用体积比为60:40的流动相a与流动相b稀释至刻度制成缬沙坦杂质归属溶液。
[0078]
(2)色谱条件
[0079]
色谱柱:waters symmetry c18,3.9mm
×
150mm,5μm;
[0080]
流动相:流动相a为0.03mol/l乙二胺四醋酸二钠水溶液-三乙胺(2:98);流动相b为异丙醇;
[0081]
柱温:30℃;
[0082]
流速:1.0ml/min;
[0083]
检测波长:237nm;
[0084]
洗脱程序如下:
[0085]
时间(min)流动相a(v/v)流动相b(v/v)0~5.050505.01~13.0703013.01~21.0505021.01~30.05050
[0086]
(3)样品测试
[0087]
精密量取灵敏度溶液、系统适用性溶液、混合对照品溶液1和2、苯磺酸定位溶液、氨氯地平杂质归属溶液、缬沙坦杂质归属溶液各10μl注入高效液相色谱仪,按照上述色谱条件分别进行hplc检测,记录色谱图;
[0088]
精密量取供试品溶液1、供试品溶液2、对照品溶液1和对照品溶液2各10μl注入高效液相色谱仪,按照上述色谱条件分别进行hplc检测,再测得有关物质的含量。
[0089]
(4)实验结果
[0090]
(4.1)系统适用性
[0091][0092]
由上述结果可知,系统适用性溶液色谱图中,氨氯地平、缬沙坦杂质ⅱ和缬沙坦依次出峰,且分离度均大于4.0;混合对照品溶液1和2色谱图中(混合对照品溶液1的色谱图如图1所示),缬沙坦水解杂质、氨氯地平杂质a、氨氯地平、缬沙坦和缬沙坦乙酯杂质依次出峰,且各峰之间的分离度均大于1.5;同时灵敏度溶液色谱图中,氨氯地平峰和缬沙坦峰的信噪比均大于10;同说明本发明的方法可用于缬沙坦氨氯地平药物组合物中有关物质的检测。
[0093]
(4.2)供试品溶液和对照品溶液的色谱图
[0094][0095]
供试品溶液1的色谱图如图2所示,氨氯地平、缬沙坦依次出峰且分离度良好,供试品溶液2的色谱图如图3所示,归属缬沙坦单杂、氨氯地平和缬沙坦同样依次出峰且分离度良好,进一步计算得到供试品溶液中有关物质的含量结果如下:
[0096][0097]
由上述数据可知,本实施例供试品溶液中的杂质符合企业内控标准。
[0098]
实施例2
[0099]
(1)溶液配制
[0100]
供试品溶液1:称取本品,研细后精密称取本品细粉168.03mg,置于50ml量瓶中,加体积比为70:30的流动相a与流动相b适量,超声15min使主成分溶解,放冷至室温,而后加体积比为70:30的流动相a与流动相b至刻度,摇匀过滤制成供试品溶液1,其中,氨氯地平的浓度为0.095mg/ml;
[0101]
供试品溶液2:精密量取1ml供试品溶液1置于10ml量瓶中,用体积比为70:30的流动相a与流动相b稀释至刻度制成供试品溶液2,其中,缬沙坦的浓度为0.152mg/ml;
[0102]
对照品溶液:分别精密称取苯磺酸氨氯地平对照品14.73mg和缬沙坦对照品16.48mg置于同一100ml量瓶中,先加5ml甲醇使溶解,而后用体积比为70:30的流动相a与流动相稀释至刻度制成对照品溶液1;分别精密称取苯磺酸氨氯地平对照品15.89mg和缬沙坦对照品17.27mg,同法制成对照品溶液2;
[0103]
(2)色谱条件
[0104]
色谱柱:waters xbridge c18,4.6mm
×
150mm,3.5μm;
[0105]
流动相:流动相a为0.06mol/l乙二胺四醋酸二钠水溶液-三乙胺(5:95);流动相b为异丙醇;
[0106]
柱温:35℃;
[0107]
流速:1.3ml/min;
[0108]
检测波长:237nm;
[0109]
洗脱程序:
[0110]
时间(min)流动相a(v/v)流动相b(v/v)0~5.040605.01~13.0604013.01~21.0604021.01~30.04060
[0111]
(3)样品测试
[0112]
精密量取供试品溶液1、供试品溶液2、对照品溶液1和对照品溶液2各10μl注入高效液相色谱仪,按照上述色谱条件分别进行hplc检测,再测得有关物质的含量。
[0113]
(4)实验结果
[0114]
(4.1)供试品溶液和对照品溶液的色谱图
[0115][0116]
(4.2)供试品溶液中有关物质的含量
[0117][0118]
由上述数据可知,本实施例供试品溶液中的杂质符合企业内控标准。
[0119]
实施例3
[0120]
(1)溶液配制
[0121]
供试品溶液1:称取本品,研细后精密称取本品细粉167.45mg,置于50ml量瓶中,加体积比为65:35的流动相a与流动相b适量,超声15min使主成分溶解,放冷至室温,而后加体积比为65:35的流动相a与流动相b至刻度,摇匀过滤制成氨氯地平供试品溶液1,其中,氨氯地平的浓度为0.105mg/ml;
[0122]
供试品溶液2:精密量取氨氯地平供试品溶液1ml置于10ml量瓶中,用体积比为65:35的流动相a与流动相b稀释至刻度制成供试品溶液2,其中,缬沙坦的浓度为0.168mg/ml;
[0123]
对照品溶液:分别精密称取苯磺酸氨氯地平对照品14.73mg和缬沙坦对照品16.48mg置于同一100ml量瓶中,先加5ml甲醇使溶解,而后用体积比为65:35的流动相a与流动相稀释至刻度制成对照品溶液1;分别精密称取苯磺酸氨氯地平对照品15.89mg和缬沙坦对照品17.27mg,同法制成对照品溶液2;
[0124]
(2)色谱条件
[0125]
色谱柱:waters xbridge c18,4.6mm
×
150mm,3.5μm;
[0126]
流动相:流动相a为0.05mol/l乙二胺四醋酸二钠水溶液-三乙胺(1:99);流动相b为异丙醇;
[0127]
柱温:30℃;
[0128]
流速:1.2ml/min;
[0129]
检测波长:237nm;
[0130]
洗脱程序:
[0131]
时间(min)流动相a(v/v)流动相b(v/v)0~5.060405.01~13.0802013.01~21.0604021.01~30.06040
[0132]
(3)样品测试
[0133]
精密量取供试品溶液1、供试品溶液2、对照品溶液1和对照品溶液2各10μl注入高效液相色谱仪,按照上述色谱条件分别进行hplc检测,再测得有关物质的含量。
[0134]
(4)实验结果
[0135]
(4.1)供试品溶液和对照品溶液的色谱图
[0136][0137]
(4.2)供试品溶液中有关物质的含量
[0138][0139]
由上述数据可知,本实施例供试品溶液中的杂质符合企业内控标准。
[0140]
对比例1
[0141]
(1)溶液配制
[0142]
杂质定位溶液:分别称取杂质2、杂质3、杂质4、杂质1约5mg,置不同10ml量瓶中,加甲醇适量溶解并稀释至刻度制成杂质定位溶液;
[0143]
苯磺酸氨氯地平定位溶液:称取苯磺酸氨氯地平约10mg,置20ml量瓶中,加2.3g/l乙酸铵溶液-甲醇-乙腈(50:35:15)适量溶解并稀释至刻度制成苯磺酸氨氯地平定位溶液;
[0144]
缬沙坦定位溶液:称取缬沙坦约10mg,置20ml量瓶中,加.3g/l乙酸铵溶液-甲醇-乙腈(50:35:15)适量溶解并稀释至刻度制成缬沙坦定位溶液;
[0145]
混合溶液:分别称取缬沙坦及苯磺酸氨氯地平约10mg,置同一20ml量瓶中,加2.3g/l乙酸铵溶液-甲醇-乙腈(50:35:15)适量溶解,加入各杂质定位溶液0.2ml,用2.3g/l乙酸铵溶液-甲醇-乙腈(50:35:15)稀释至刻度制成混合溶液。
[0146]
(2)色谱条件
[0147]
色谱柱:kromasil c
18
(250mm
×
4.6mm,5um);
[0148]
流动相:20mmol
·
l-1
庚烷磺酸钠溶液(含0.7%三乙胺,用磷酸调ph值至3.0)(a)-乙腈(b);
[0149]
柱温:35℃;
[0150]
流速:1.0ml/min;
[0151]
检测波长:237nm;
[0152]
洗脱程序:
[0153]
时间(min)流动相a(v/v)流动相b(v/v)0~5.075255.01~30.05050
30.01~50.0208050.1~70.07525
[0154]
(3)样品测试
[0155]
精密量取上述定位溶液及混合溶液各10μl,注入液相色谱仪中,记录色谱图(混合溶液的色谱图如图4所示),结果如下:
[0156][0157]
(4)实验结果
[0158]
从上述数据可以看出,采用此方法的色谱条件,氨氯地平及杂质1出峰时间较早且出峰位置相近,杂质3出峰时间较晚,检测速度慢,说明该色谱条件不适用。
[0159]
方法分析
[0160]
为了验证本发明的缬沙坦氨氯地平药物组合物中有关物质的检测方法,进行系统的方法验证,包含专属性、精密度、准确度、重复性等,其验证结果如下:
[0161]
(1)专属性:缬沙坦氨氯地平药物组合物在碱、氧化、光照条件下较稳定,未产生较大杂质;在高湿条件下,易降解生成杂质3;在酸性条件下,易降解生成杂质1;在高温条件下,易降解生成杂质2。各破坏条件下,空白溶剂、空白辅料对有关物质测定无干扰,且在各强制破坏试验前后物料守恒,说明该色谱条件能够将降解产物有效分离,专属性良好。
[0162]
①
苯磺酸氨氯地平原料
[0163]
名称杂质个数纯度角纯度阈值分离度物料守恒未破坏00.0490.248//光照破坏10.0440.24616.470.98高温破坏00.0450.247/0.99高湿破坏10.0470.25037.551.01酸破坏50.0470.2485.020.96碱破坏10.0530.24526.520.98
氧化破坏20.0420.24813.151.00
[0164]
②
缬沙坦原料
[0165]
名称杂质个数纯度角纯度阈值分离度物料守恒未破坏10.0730.2624.33/光照破坏10.0700.26012.450.95高温破坏70.0750.2644.161.03高湿破坏00.0700.265/1.02酸破坏30.0900.2663.771.02碱破坏10.0530.2674.001.03氧化破坏20.0690.2664.141.05
[0166]
(2)中间精密度:采用向供试品溶液中定量添加杂质的考察方式,6份供试品溶液中,各已知杂质含量的rsd均小于10%,归属于缬沙坦的最大单杂含量小于15%,总杂含量的rsd小于5%,说明该方法中间精密度良好。
[0167][0168][0169]
(3)准确度:3个浓度9份供试品溶液中各杂质的回收率均在90%~108%之间,说明本方法准确度良好。
[0170][0171]
(4)重复性:采用向供试品溶液中定量添加杂质的考察方式,6份供试品溶液中,各已知杂质含量的rsd均小于10%,归属于缬沙坦的最大单杂含量小于15%,总杂含量的rsd小于5%,说明该方法重复性良好。
[0172]
综上,通过系统适用性、专属性、精密度、准确度、重复性等系统的方法验证结果表明,本发明的缬沙坦氨氯地平药物组合物中有关物质的检测方法满足本品有关物质检测要求,可以有效评价本品质量。
[0173]
以上所述的实施例对本发明的技术方案进行了详细说明,应理解的是以上所述的
仅为本发明的具体实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充或类似方式替代等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1