通过纳米孔捕获对分析物的结构分析
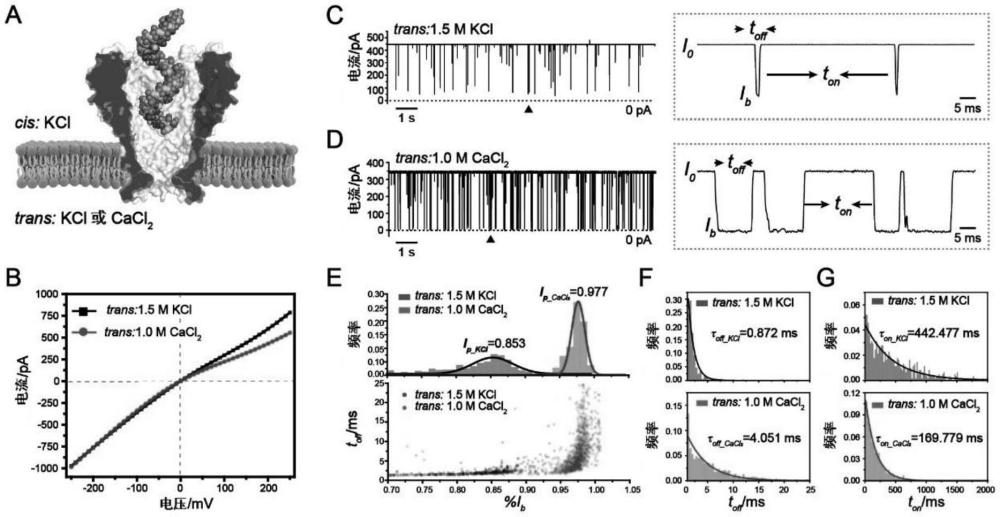
本发明一般性地涉及纳米孔的用途,特别是通过纳米孔捕获对分子(例如生物分子,如rna或蛋白质)进行结构分析。
背景技术:
1、rna的功能多样性部分源于它能折叠成复杂的三级结构的能力,这种三级结构可以与配体特异性结合以调节细胞活动1,2。已发现了rna的许多新生物学作用3,4,使得对测定rna三级结构的需求日益增长。包括x射线晶体学5和nmr波谱6,7在内的经典结构生物学技术对rna三级结构测定做出了最大贡献,尤其是那些具有小rna结构的8。作为补充,冷冻电镜(cryoem)在揭示较大(>50kda)rna分子的结构方面发挥着越来越重要的作用9,10。诸如单分子共振能量转移(smfret)11和单分子力谱12等新兴技术也已应用于在分子水平上探测rna结构和相互作用动力学。然而,需要高端设备并进行费力的样品制备,并且还存在干扰rna结构内非共价相互作用的风险。因此,直接探究原生态rna的三级结构仍然是一项挑战。
2、rna结构可以通过固态纳米孔进行探测13-17,并且临床应用,例如定量检测严重急性呼吸系统综合征冠状病毒2,也得到了证实14。然而,固态纳米孔的厚度使其无法产生精细的传感信息,从而限制了其分辨率,无法清晰解析结构相似的rna结构。此外,固态纳米孔的几何再现性仍然是一个技术瓶颈,当使用不同批次的纳米孔时,会降低传感的一致性。生物纳米孔代表了一个不断壮大的用于单分子传感的通道蛋白家族18。新出现的纳米孔,例如异羟肟酸铁盐摄取组分a(fhua)或气单胞菌溶素,能够以高准确度和一致性对核酸19、蛋白质-蛋白质相互作用20或氨基酸21进行传感。此前使用生物纳米孔对转移rna(trna)进行的研究是用野生型α-溶血素(α-hl)进行的22。然而,这需要与前导链进行化学连接,并且所获得的信息反映的是不同trna的展开动力学或一级序列的差异,而不是整体的三级结构差异,这主要是由于孔缢缩处的尺寸有限造成的。为了让大型生物分子通过,最近人们努力开发具有大缢缩部位的新型生物纳米孔。这些纳米孔包括细胞溶素a(clya)23、phi29连接蛋白24、fragaceatoxin c(frac)25、fhua20和侧耳溶血素a(plya)/侧耳溶血素b(plyb)26,用它们深入研究了dsdna、蛋白质或蛋白质小分子复合物。然而,据我们所知,尚未对这种具有rna三级结构的复合物进行研究。这些大型纳米孔还与各种问题相关联,例如储存时间短23、孔组装不均匀27或施加大电位时自发门控27。
3、蛋白质的作用通常涉及构象变化,101-104例如侧链波动、环动力学、结构域运动或变构运动。105,106诸如傅里叶变换红外光谱(ftir)、107超快二维红外光谱(2d ir)108和nmr波谱109等方法已广泛应用于此类结构变化的分析。然而,通过这些方法获得的信息仅反映了所研究蛋白质的总体平均行为,而不能解析单个分子的活动。单分子技术,例如基于afm的单分子力谱(smfs)、110-112扫描隧道显微镜(stm)、113单分子共振能量转移(smfret)、114,115光镊、116-118磁镊、119-121热泳阱122和静电流体阱123,可以直接检查单个蛋白质的大小、电荷、迁移率、折叠、配体结合或变构现象。这些单分子工具提供了大量有关单个蛋白质的内在功能机制的信息,但不可避免地受到蛋白质荧光标记或表面固定化要求的限制。一些基于成像的技术显示出的时间分辨率也有限,这可能会导致忽略蛋白质构象变化的短暂性事件。
4、纳米孔技术(其中单分子分析物在移位通过纳米孔传感器期间被直接探测),已被用于研究蛋白质。使用纳米孔可以直接研究蛋白质的单分子性质,例如结构折叠/展开、124-28聚集、129大小、130电荷、131几何形状、132偶极矩、133酶动力学134或柔性135。这类技术不需要对所述蛋白质进行化学标记,并实现~μs的时间分辨率。136蛋白质的纳米孔传感是用基于蛋白质、137固态的137或基于dna的纳米孔138进行的。固态纳米孔的孔径更大,孔尺寸是高度可调的,这在探测大尺寸蛋白质时有优势。124,130-133,135,136,139-141然而,固态纳米孔通常存在再现性较差和额外噪声源142的问题,这限制了令人满意的测量一致性和进一步精细的传感分辨率。
5、蛋白质纳米孔提供了原子级精确的结构和高度精细的传感分辨率,但传统蛋白质纳米孔(例如fhua143、ompg144和α-溶血素145)的缢缩处通常小于大多数感兴趣的蛋白质分析物。因此,蛋白质分析物必须通过电泳或酶解方式展开才能实现纳米孔移位,因此,对原生形式蛋白质进行探测变得不可行。126,146,147然而,通过将受体模块缀合到纳米孔的外缘,可以对折叠蛋白质进行纳米孔传感,从而报告了在单通道记录期间由分析物-受体相互作用引起的电流扰动143-145,148。在所述纳米孔和所述受体之间进行缀合的难度很大,传感分辨率也受到限制,因为感兴趣的蛋白质距离所述纳米孔缢缩处较远。
6、最近对大型蛋白质纳米孔例如细胞溶素a(clya)、149fragaceatoxin c(frac)150和侧耳溶血素ab(plyab)151的研究提供了一种鼓舞人心的策略,其中直接将蛋白质分析物放置在所述纳米孔的大内腔中,从而实现了对蛋白质生物标记物、152,153蛋白质-配体相互作用、154,155催化过程中的构象体互换、134翻译后蛋白修饰156的直接传感。然而,这些纳米孔通常与自发孔插入困难、139纳米孔组装不均匀、157结构不稳定158以及高电压下自发门控157等问题有关。尽管为克服这些缺点,人们在通过定向进化进行纳米孔工程化方面做出了巨大努力,但这些新开发纳米孔的一致性和稳定性仍不能令人满意。最近一份关于自下而上制造多组分纳米孔传感器以研究蛋白质分析物的报告令人振奋147,但相关的蛋白质工程挑战却远远超出了大多数学术实验室的能力范围。
7、在分子水平上识别蛋白质对于疾病的早期诊断和治疗重要。通常,蛋白质可以通过免疫测定法或质谱法(ms)进行识别。然而,在ms检测前进行复杂的预处理,包括纯化、变性、烷基化、酶解和脱盐,对于在更丰富的背景环境中检测靶蛋白至关重要。193-195至于免疫测定法,需要针对所述靶蛋白的高度特异性抗体,这就需要成本高昂地反复制备靶向不同底物的抗体。196此外,这两种方法都不能从整体中提取单个蛋白质的特征。单分子荧光蛋白质指纹可以解决这些限制,197但也面临其他问题,例如单分子荧光检测中常见的暗读数。194此外,这些策略具备的分辨率都无法直接解析蛋白质构象变化。开发一种蛋白质组学方法,能够识别不同的蛋白质,并区分由配体/药物结合和融合等过程引起的同一蛋白质不同结构状态,仍然是基础研究中的一项挑战。
8、已经开发出多种用于单个蛋白分析的纳米孔技术。198-202这些技术通常报告的优点是具有单分子分辨率且配置简单。还可以以高通量和便携的方式进行。203样品预处理的要求也是最低的。原则上,在外部电位的作用下,蛋白质会以移位的形式被检测到,在此过程中,会观察到通过纳米孔的离子电流受到扰动。通常可以实现微秒级的时间分辨率。204与核酸不同,蛋白质具有不同的电荷性质和不均匀的电荷分布、结构紧凑,形状各异。据报道,一种策略涉及使用带负电荷的聚合物来包裹蛋白质。这种聚合物有助于捕获分析物,并可作为纳米孔可寻址条形码,从而简化蛋白质识别。205-208也有许多无标记尝试,通过在纳米孔内腔中引入带电氨基酸来产生eof。eof对通过纳米孔的分子输运有很大影响,因为它对分析物的电荷没有偏好。209-221然而,通过定点突变进行的电荷修饰可能会导致纳米孔的结构严重紊乱,并可能导致纳米孔制备的产量显著降低。222-223此外,带负电荷的蛋白质和带正电荷的纳米孔内表面之间不利的静电和空间相互作用可能会限制纳米孔在同时传感电荷性质相冲突的蛋白质方面的应用。219使用纳米孔同时高分辨率地区分电荷性质相冲突的不同蛋白质分析物仍然是一项挑战。
技术实现思路
1、本发明的第一方面提供了在纳米孔系统中表征分析物的方法,其中所述纳米孔系统包含设置在将第一导电液体介质与第二导电液体介质隔开的膜中的蛋白质纳米孔,其中所述蛋白质纳米孔是mspa、mspa同源物或其变体,其中所述分析物具有构象,并且具有所述构象的分析物可以容纳在所述mspa、所述mspa同源物或其变体的前庭中,但不能移位通过所述mspa、所述mspa同源物或其变体,所述方法包含:
2、i)在所述第一导电液体介质和所述第二导电液体介质之间施加电位差以将所述分析物驱动到所述纳米孔中;
3、ii)测量通过所述蛋白质纳米孔的离子电流以提供测试电流模式,所述模式至少含有在所述分析物处于所述mspa、所述mspa同源物或其变体的前庭内期间测量的离子电流;
4、iii)将所述测试电流模式与所述分析物的至少一种特征相关联。
5、在一些实施方案中,所述分析物选自由以下组成的组:核酸,蛋白质,多糖,聚合物,酶和核酸、蛋白质、肽、多糖、聚合物、酶,以及能够与它们相互作用的试剂的复合物。
6、在一些实施方案中,所述核酸选自由以下组成的组:lmw rna,核酸双链体,适体,核酶或具有吻环(kissing loop)、三向接合(three-way junction)、假结(pseudoknot)、扭结转角(kink-turn)或g-四链体结构(g-quadruplex)的核酸。
7、在一些实施方案中,所述lmw rna包含具有突出端或平端的sirna、trna、mirna和/或rrna。
8、在一些实施方案中,所述核酸双链体具有突出端或平端。
9、在一些实施方案中,所述核酸双链体由mirna和核酸探针组成,并且所述核酸探针是rna、dna或核酸类似物。
10、在一些实施方案中,所述蛋白质分析物选自由以下组成的组:带正电荷的、中性的或带负电荷的。
11、在一些实施方案中,所述分析物包含两种或更多种不同的分析物,并且这些分析物的表征在一次测量中完成。
12、在一些实施方案中,步骤iii)包含将所述测试电流模式与选自由以下组成的组的至少一种特征相关联:存在或不存在所述分析物、所述分析物的身份、所述分析物的序列、所述分析物的突变、所述分析物的构象、所述分析物的局部结构、所述分析物的含量、所述分析物总体尺寸、所述分析物的电荷和极性。
13、在一些实施方案中,所述分析物是由靶分子和辅助分子的组合形成的复合物。
14、在一些实施方案中,步骤iii)包含将所述测试电流模式与所述靶分子的至少一种特征相关联。
15、在一些实施方案中,所述靶分子是mirna。
16、在一些实施方案中,步骤iii)是通过将所述测试电流模式与参考电流模式进行比较或者通过使用机器学习算法来进行。
17、在一些实施方案中,所述mspa、所述mspa同源物或其变体前庭侧的导电液体介质含有单价阳离子,而所述mspa、所述mspa同源物或其变体缢缩部位侧的导电液体介质包含二价阳离子。
18、在一些实施方案中,所述单价阳离子是碱金属离子,优选选自k+、na+和li+。
19、在一些实施方案中,所述二价阳离子是碱土金属离子,优选选自ca2+、mn2+、mg2+和ba2+。
20、本发明的第二方面提供了用于在纳米孔系统中表征分析物与试剂之间的相互作用的方法,其中所述纳米孔系统包含设置在将第一导电液体介质与第二导电液体介质隔开的膜中的蛋白质纳米孔,其中所述蛋白质纳米孔是mspa、mspa同源物或其变体,其中所述分析物具有构象,并且具有所述构象的分析物可以容纳在所述mspa、所述mspa同源物或其变体的前庭中,但不能移位通过所述mspa、所述mspa同源物或其变体,所述方法包含:
21、i)使所述分析物与所述试剂接触,并通过所述第一导电液体介质和所述第二导电液体介质之间的电位差将所述分析物驱动到所述纳米孔中;
22、ii)测量通过所述蛋白质纳米孔的离子电流以提供测试电流模式,所述模式至少含有在所述分析物处于所述mspa、所述mspa同源物或其变体的前庭内期间测量的离子电流;
23、iii)将所述电流模式与所述分析物和所述试剂之间的相互作用相关联。
24、本发明的第二方面还提供了一种用于在纳米孔系统中表征能够与分析物相互作用的试剂的方法,其中所述纳米孔系统包含设置在将第一导电液体介质与第二导电液体介质隔开的膜中的蛋白质纳米孔,其中所述蛋白质纳米孔是mspa、mspa同源物或其变体,其中所述分析物具有构象,并且具有所述构象的分析物可以容纳在所述mspa、所述mspa同源物或其变体的前庭中,但不能移位通过所述mspa、所述mspa同源物或其变体,所述方法包含:
25、i)使所述分析物与所述试剂接触,并通过所述第一导电液体介质和所述第二导电液体介质之间的电位差将所述分析物驱动到所述纳米孔中;
26、ii)测量通过所述蛋白质纳米孔的离子电流以提供测试电流模式,所述模式至少含有在所述分析物处于所述mspa、所述mspa同源物或其变体的前庭内期间测量的离子电流;
27、iii)将所述电流模式与所述试剂相关联。
28、在步骤i)中,对“使所述分析物与所述试剂接触”和“通过所述第一导电液体介质和所述第二导电液体介质之间的电位差将所述分析物驱动到所述纳米孔中”的顺序没有限制,每一个都可以先进行。例如,可以首先使所述分析物与所述试剂接触,然后通过所述第一导电液体介质和所述第二导电液体介质之间的电位差将所述分析物驱动到所述纳米孔中。还可以首先通过所述第一导电液体介质和所述第二导电液体介质之间的电位差将所述分析物驱动到所述纳米孔中,然后使所述分析物与所述试剂接触。
29、在一些实施方案中,所述分析物选自由以下组成的组:核酸、蛋白质、多糖、聚合物和酶。
30、在一些实施方案中,所述核酸是适体或核酶。
31、在一些实施方案中,所述分析物可以与离子、小分子、配体、受体或底物相互作用。
32、在一些实施方案中,所述试剂是离子、小分子、配体、受体或底物。
33、在一些实施方案中,所述试剂是多糖,优选肽聚糖、壳聚糖或甲壳素。
34、在一些实施方案中,所述分析物是溶菌酶。
35、在一些实施方案中,步骤iii)是通过将所述测试电流模式与参考电流模式进行比较或者通过使用机器学习算法来进行。
36、在一些实施方案中,所述mspa、所述mspa同源物或其变体前庭侧的导电液体介质含有单价阳离子,而所述mspa、所述mspa同源物或其变体缢缩处侧的导电液体介质含有二价阳离子。
37、在一些实施方案中,所述单价阳离子是碱金属离子,优选选自k+、na+和li+。
38、在一些实施方案中,所述二价阳离子是碱土金属离子,优选选自ca2+、mn2+、mg2+和ba2+。
39、本发明的第三方面提供了一种用于在纳米孔系统中检测样品中的感兴趣的分析物的方法,其中所述纳米孔系统包含设置在将第一导电液体介质与第二导电液体介质隔开的膜中的蛋白质纳米孔,其中所述蛋白质纳米孔是mspa、所述mspa同源物或其变体,其中所述感兴趣的分析物具有构象,并且具有初始构象的感兴趣的分析物可以容纳在所述mspa、所述mspa同源物或其变体的前庭中,但不能移位通过所述mspa、所述mspa同源物或其变体,所述方法包含:
40、i)将所述样品添加到所述第一导电液体介质和第二导电液体介质中的所述至少一种,并在所述第一导电液体介质和所述第二导电液体介质之间施加适于将所述感兴趣的分析物驱动到所述纳米孔中的电位差;
41、ii)在一段时间内测量通过所述蛋白质纳米孔的离子电流,以提供测试电流模式;
42、iii)将所述测试电流模式与参考电流模式进行比较,所述参考电流模式至少包含在所述感兴趣的分析物处于所述mspa、所述mspa同源物或其变体的前庭内期间测量的离子电流迹线;
43、iv)通过iii)的比较来确定所述样品中存在或不存在所述感兴趣的分析物和/或所述样品中所述感兴趣的分析物含量。
44、在步骤i)中,对“将所述样品添加到所述第一导电液体介质和第二导电液体介质的所述至少一种中”和“在所述第一导电液体介质和所述第二导电液体介质之间施加适于将所述感兴趣的分析物驱动到所述纳米孔中的电位差”的顺序没有限制,每一个都可以先进行。例如,可以首先将所述样品添加到所述第一导电液体介质和第二导电液体介质中的至少一种参考电流模式,然后在所述第一导电液体介质和所述第二导电液体介质之间施加适于将所述感兴趣的分析物驱动到所述纳米孔中的电位差。还可以首先在所述第一导电液体介质和所述第二导电液体介质之间施加适于将所述感兴趣的分析物驱动到所述纳米孔中的电位差,然后将所述样品添加到所述第一导电液体介质和第二导电流体介质的所述至少一种中。
45、在一些实施方案中,所述感兴趣的分析物选自由以下组成的组:核酸、蛋白质、多糖、聚合物和酶。
46、在一些实施方案中,所述分析物是乳清蛋白。
47、在一些实施方案中,所述分析物是α-乳白蛋白和/或β-乳球蛋白。
48、在一些实施方案中,其中所述样品是乳品或蛋白粉。
49、在一些实施方案中,所述mspa、所述mspa同源物或其变体前庭侧的导电液体介质含有单价阳离子,而所述mspa、所述mspa同源物或其变体缢缩处侧的导电液体介质含有二价阳离子。
50、在一些实施方案中,所述单价阳离子是碱金属离子,优选选自k+、na+和li+。
51、在一些实施方案中,所述二价阳离子是碱土金属离子,优选选自ca2+、mn2+、mg2+和ba2+。
- 还没有人留言评论。精彩留言会获得点赞!