测定丙戊酸钠缓释片体外溶出的方法及应用与流程
本发明涉及药物分析,具体涉及一种测定丙戊酸钠缓释片体外溶出的方法及应用。
背景技术:
1、对化学仿制药口服固体制剂而言,与参比制剂的溶出曲线一致或具有相似性,是评价仿制药与参比制剂质量一致性的重要指标之一。而口服固体制剂的体外溶出行为受到原料的晶型和粒度、辅料的种类和用量、原料微粉化技术、片剂制备工艺等诸多因素的影响。制剂中的辅料一般较难与主药发生化学反应,但可以通过吸附药物、改变颗粒表面性质、改变溶出介质的ph值或黏度等影响口服固体制剂的溶出行为。
2、丙戊酸钠是一种抗癫痫药物,也用于治疗躁狂症。既可用于癫痫单药治疗,也可作为添加治疗。用于治疗全面性癫痫:包括失神发作、肌阵挛发作、强直阵挛发作、失张力发作及混合型发作,特殊类型综合征(west,lennox-gastaut综合征)等。用于治疗部分性癫痫:局部癫痫发作,伴有或不伴有全面性发作。也可用于治疗与双相情感障碍相关的躁狂发作。
3、申请号为cn202110486115.6的中国专利公开了一种丙戊酸钠缓释片的制备方法,采用中国药典2020年版附录xd释放度测定法第一法,分别以900ml磷酸盐缓冲溶液(ph6.8)、900ml盐酸溶液(ph1.2)、900ml醋酸盐缓冲液(ph4.5)和纯化水为释放介质,转速为60转/分,对实施例样品与参比制剂的关键释放曲线进行了检测。该方法在区分力方面具有一定的局限性。
4、因此,开发一种测定丙戊酸钠缓释片体外溶出的方法,对于医药企业来说具有重要的意义。
技术实现思路
1、为解决上述技术问题,本发明的目的在于提供一种测定丙戊酸钠缓释片体外溶出的方法及应用,通过测定不同厂家、不同制备工艺的丙戊酸钠缓释片溶出浓度,具有高区分力,适合作为丙戊酸钠缓释片的溶出度的质量控制方法。
2、为实现上述目的,本发明采用如下技术方案:
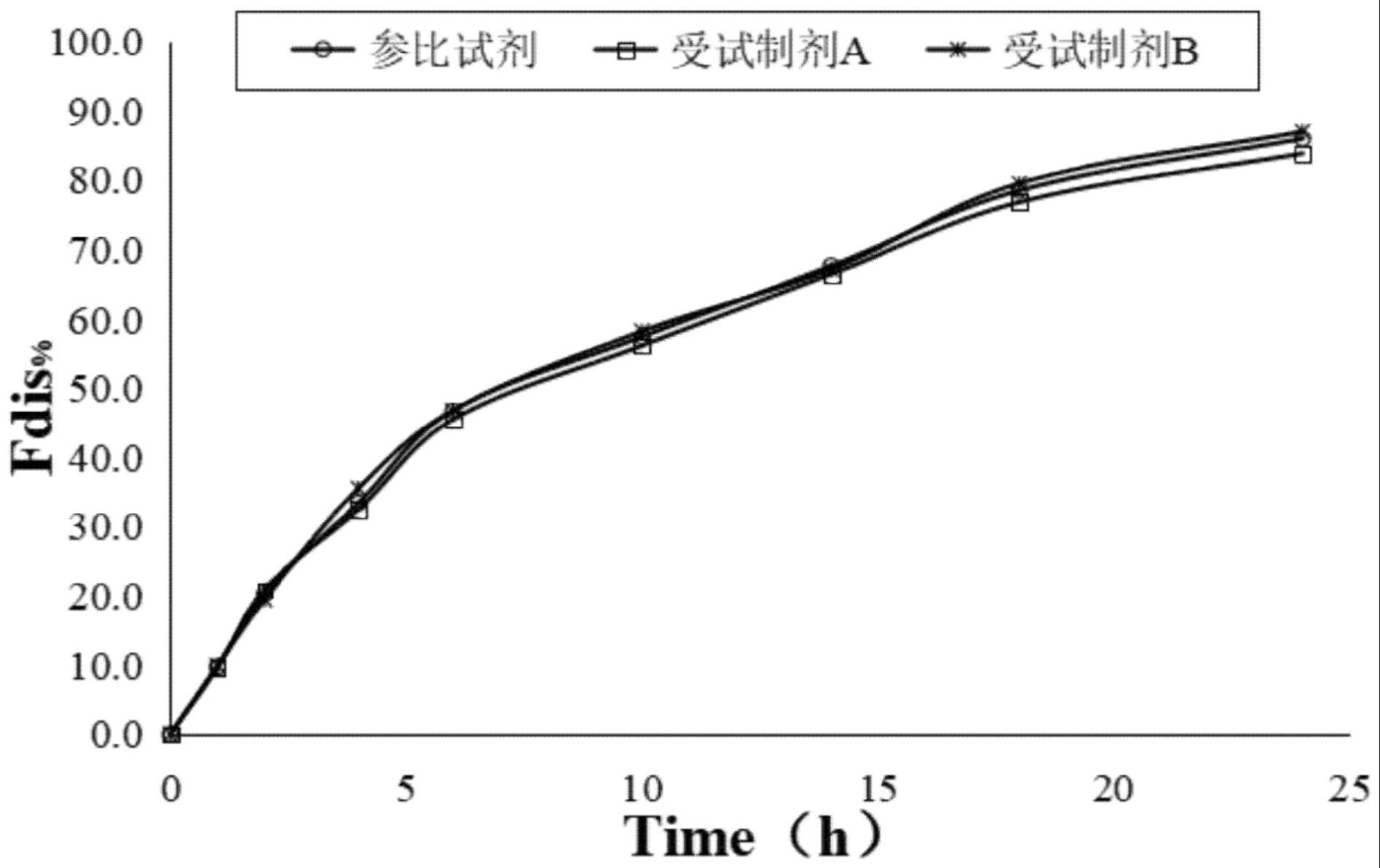
3、一方面,本发明提供一种测定丙戊酸钠缓释片体外溶出的方法,将丙戊酸钠缓释片置于盛有溶出介质的微分溶出仪中进行溶出,在溶出过程中,分别在不同溶出时间点取样,过滤后以滤液为供试品,采用高效液相色谱法测定供试品中丙戊酸钠的浓度,计算丙戊酸钠缓释片的累积溶出度,并绘制溶出曲线。
4、其中,在本发明中所述微分溶出仪是指cn210863698u记载的“模拟口服药物制剂体内溶出和吸收的微分溶出装置”,具体装置结构请参见该专利。
5、进一步地,所述溶出介质为水或ph4~7的磷酸盐缓冲液。
6、进一步地,所述溶出介质为水或ph6.8的磷酸盐缓冲液。
7、进一步地,所述高效液相色谱法的检测条件为:色谱柱:c18色谱柱,12.5cm×4.0mm,5μm;流速:0.2ml/min;流动相:流动相a为含0.1%甲酸的水溶液;流动相b为乙腈溶液;采用流动相a和流动相b体积比60:40,进行洗脱;
8、柱温:35℃;检测波长为:260nm;进样量:2μl。
9、进一步地,所述溶出液的提取速度与溶出介质的补充速度均为3~12ml/min。
10、进一步地,所述溶出液的提取速度与溶出介质的补充速度为3ml/min、4ml/min、5ml/min、6ml/min、8ml/min、10ml/min或12ml/min。
11、进一步地,所述溶出介质的循环速度为10~100ml/min,优选为10ml/min、20ml/min、30ml/min、40ml/min、50ml/min、60ml/min、70ml/min、80ml/min、90ml/min或100ml/min。
12、进一步地,所述溶出时间点为30、60、120、180、240、300、360、420、480、600min等等,进一步地,所述溶出时间点为30、60、120、180、240、300、360、420、480、600、720、840min等等,直至丙戊酸钠缓释片溶出完成。所述丙戊酸钠缓释片完全溶出,在溶出杯中没有残留物,大大提升片溶出的质量可控性和溶出度的稳定性。
13、进一步地,所述溶出介质的温度控制在(37±0.5)℃。通过实验证明,溶出介质的温度利于模拟人体内温度,测得的溶出曲线更接近体内吸收的趋势。
14、进一步地,所述微分溶出仪的溶出杯体积为5~200ml,优选为5ml、10ml、15ml、20ml、30ml、40ml、50ml、60ml、70ml、80ml、90ml、100ml、120ml、150ml或200ml。
15、进一步地,所述丙戊酸钠缓释片包括参比制剂和受试制剂,采用相似因子法,利用丙戊酸钠缓释片的参比制剂和受试制剂的平均溶出浓度数据,计算相似因子f2,所述相似因子f2用于比较丙戊酸钠缓释片的参比制剂和受试制剂的溶出曲线的相似性;利用相似因子f2的值判断相似性时,相似因子f2≥50时,丙戊酸钠缓释片的参比制剂和受试制剂的溶出度曲线相似,相似因子f2<50时,丙戊酸钠缓释片的参比制剂和受试制剂的溶出度曲线不相似。
16、进一步地,所述丙戊酸钠缓释片的规格为10mg。
17、另一方面,本发明提供一种丙戊酸钠缓释片质量的评价与控制方法,利用本发明所述溶出的方法测定受试制剂丙戊酸钠缓释片的累积释放度,若所述受试制剂的累积释放度符合所述参比制剂的累积释放度,评价受试制剂的质量。
18、一方面,本发明提供一种测定丙戊酸钠缓释片溶出的方法或丙戊酸钠缓释片质量的评价在丙戊酸钠缓释片参比制剂和受试制剂一致性评价中的应用。
19、与现有技术相比,本发明具有如下的有益效果:
20、本发明提供的体外溶出方法对丙戊酸钠缓释片具有更高的区分力;
21、提供多个受试制剂的体内pk实验进行验证;
22、建立了体外试验和体内吸收间的数学模型,可以相互转化;
23、在进行生物等效性试验前,可以通过该数学模型进行仿制药与原研制剂的等效性分析,也为生物等效性做出预测,提高生物等效性实验的成功率,保证药品上市后的生物有效性,降低研发风险;
24、利于有效评价仿制受试制剂的质量,为药品批间质量的一致性提供保证。
25、本发明体外溶出方法通过模拟体内吸收过程,保证体外溶出实验的准确性,实现体外溶出实验测定的溶出曲线与体内吸收过程一致,为实现良好预测人体生物等效性提供保障。
技术特征:
1.一种测定丙戊酸钠缓释片体外溶出的方法,其特征在于,将丙戊酸钠缓释片置于盛有溶出介质的微分溶出仪中进行溶出,在溶出过程中,分别在不同溶出时间点取样,过滤后以滤液为供试品,采用高效液相色谱法测定供试品中丙戊酸钠的浓度,计算丙戊酸钠缓释片的累积溶出度,并绘制溶出曲线。
2.根据权利要求1所述方法,其特征在于,所述溶出介质为水或ph6.8的磷酸盐缓冲液。
3.根据权利要求1所述方法,其特征在于,所述溶出液的提取速度与溶出介质的补充速度均为3~12ml/min。
4.根据权利要求1所述方法,其特征在于,所述溶出介质的循环速度为10~100ml/min。
5.根据权利要求1所述方法,其特征在于,所述溶出时间点为30、60、120、180、240、300、360、420、480、600、720、840min。
6.根据权利要求1所述方法,其特征在于,所述微分溶出仪的溶出杯体积为5~200ml。
7.根据权利要求1所述方法,其特征在于,所述高效液相色谱法的检测条件为:色谱柱:c18色谱柱,12.5cm×4.0mm,5μm;流速:0.2ml/min;流动相:流动相a为含0.1%甲酸的水溶液;流动相b为乙腈溶液;采用流动相a和流动相b体积比60:40,进行洗脱;
8.根据权利要求1所述方法,其特征在于,所述丙戊酸钠缓释片包括参比制剂和受试制剂,采用相似因子法,利用丙戊酸钠缓释片的参比制剂和受试制剂的平均溶出浓度数据,计算相似因子f2,所述相似因子f2用于比较丙戊酸钠缓释片的参比制剂和受试制剂的溶出曲线的相似性;利用相似因子f2的值判断相似性时,相似因子f2≥50时,丙戊酸钠缓释片的参比制剂和受试制剂的溶出度曲线相似,相似因子f2<50时,丙戊酸钠缓释片的参比制剂和受试制剂的溶出度曲线不相似。
9.一种丙戊酸钠缓释片质量的评价与控制方法,利用权利要求1-8任一项所述溶出的方法测定受试制剂丙戊酸钠缓释片的累积释放度,若所述受试制剂的累积释放度符合所述参比制剂的累积释放度,评价受试制剂的质量。
10.一种权利要求1-8任一项所述方法在丙戊酸钠缓释片参比制剂和受试制剂一致性评价中的应用。
技术总结
本发明属于药物分析技术领域,提供一种测定丙戊酸钠缓释片体外溶出的方法,将丙戊酸钠缓释片置于盛有溶出介质的微分溶出仪中进行溶出,在溶出过程中,分别在不同溶出时间点取样,过滤后以滤液为供试品,采用高效液相色谱法测定供试品中丙戊酸钠的浓度,计算丙戊酸钠缓释片的累积溶出度,并绘制溶出曲线。通过测定不同厂家、不同制备工艺的丙戊酸钠缓释片溶出浓度,具有高区分力,适合作为丙戊酸钠缓释片的溶出度的质量控制方法。
技术研发人员:贺劲杰,李俊芬,潘佳玲,易木林
受保护的技术使用者:湖南慧泽生物医药科技有限公司
技术研发日:
技术公布日:2024/1/16
- 还没有人留言评论。精彩留言会获得点赞!