合成生物学设计及宿主细胞模拟系统和方法与流程
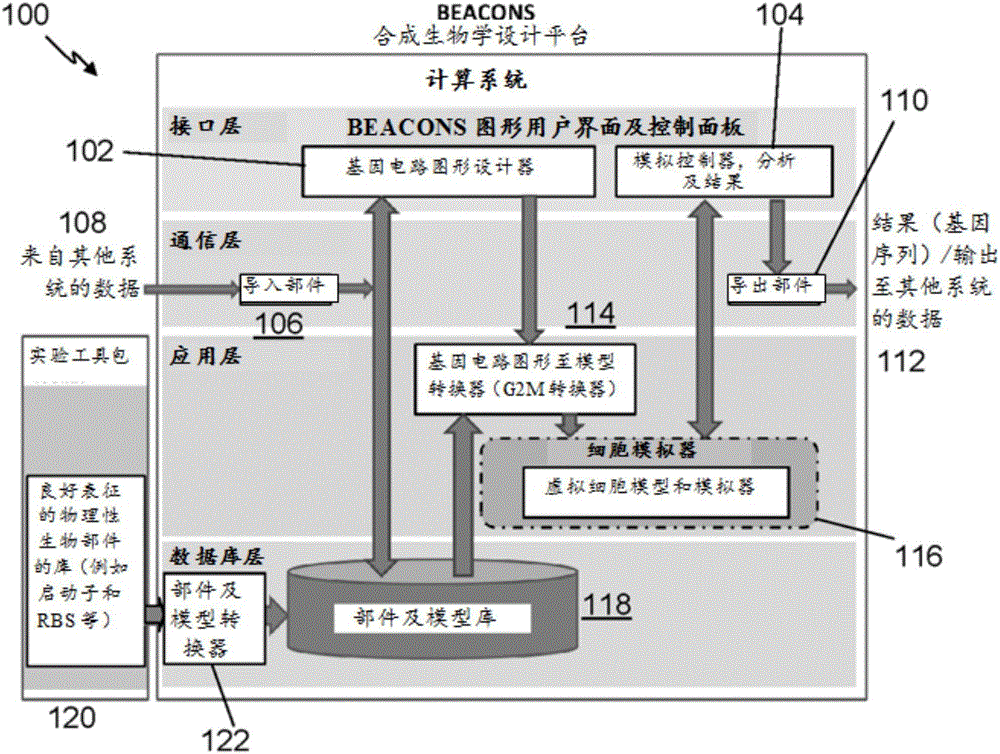
本发明涉及合成生物学领域,尤其涉及用于辅助合成生物学基因电路设计的计算方法和系统。
背景技术:
:合成生物学通过构建新的生物部件、器件、系统并重新设计细胞机构和途径,在生物学和生物
技术领域:
创造了以服务特定目标为目的(1~3)的典范式改变。虽然生物途径和过程的“从头合成”工程已成为一种可能(4,5),但具有可预测功能的合理合成基因电路设计仍然具有挑战性。生物工程师面临的艰巨挑战在于:承载工程设计的系统复杂性、不可预测性和行为可变性。在宿主底盘内,异源系统的功能直接或间接地取决于宿主的细胞资源和细胞机构。这种对细胞资源的依赖性可影响宿主细胞的正常稳态,从而诱发宿主接口内电路的电路行为可变性和电路故障(6)。异源系统的基因表达因消耗宿主正常功能所需的资源而对宿主细胞造成负担。因此,其可能干扰宿主细胞的关键过程,从而影响其生长和其他参数。所述负担造成的影响主要取决于异源系统的电路拓扑结构和宿主细胞的环境(6)。已经表明,此类电路与宿主的连接可对基因表达在生理学上产生重要的全局效应,该效应主要通过影响生长速度改变细胞的状态(7)。此外,生产宿主不需要的异源蛋白质将消耗宿主合成有益蛋白所需的细胞资源,从而部分降低其生长速度(8)。已经表明,在大肠杆菌中,当其不需要的蛋白质的浓度接近总蛋白质浓度的30%时,其生长完全停止(9)。对于生物工程师而言,了解宿主细胞与合成电路之间错综复杂的关系对改进合成电路行为的可靠预测极其重要。在厘清异源基因表达对宿主系统的各种影响方面,一个主要挑战在于宿主本身的功能复杂性。这是因为,宿主系统为一种由多种通过调控机制相互联系的分子和反应组成的动态系统。因此,对置身于宿主环境中的合成电路行为进行预测是一项极其困难的工作。目前,合成电路设计通常依赖于试错式的重新设计,这要求需要大量费力且耗时的实验评价(10)。因此,通常认为拥有宿主细胞的数学和/或计算系统模型较为有利。此外,还认为这可在机制层面上促进合成电路的设计和评价(11)。然而,由于针对大肠杆菌等生物体缺乏综合完整的细胞模型,因此,迄今为止,很多建模方面的努力集中于孤立条件下的合成电路设计,或仅将有限的宿主参数纳入考虑(12,13)。最近,Karr等人开发了一种生殖道支原体(一种具有小基因组的生物体)全细胞模型(14)。此模型随后并用于阐明合成电路对宿主细胞网络的影响(10)。然而,此模型为一种包括28个独立子模型的计算密集型模型,这使得其极其难于扩大化至可应用于作为合成生物学中最常用宿主之一的大肠杆菌等较大生物体。因此,需要提供一种可克服或减轻上述一个或多个问题,或者至少可作为已知系统的有用替代方案的宿主细胞建模系统和基因电路设计系统。技术实现要素:本发明的一些实施方式涉及一种合成生物学设计系统,包括:模型转换部件,配置为:接收表示用户自定义的基因电路设计的基因电路数据;从所述基因电路数据中识别所述基因电路设计的组成部件以及所述组成部件之间的连接;获得与所述组成部件相对应的数学模型;以及将所获得的数学模型组合为复合模型,该复合模型配置为根据一输入数据生成基因电路输出数据,所述输入数据表示游离RNA聚合酶浓度、游离核糖体浓度和rRNA浓度中的一个或多个;以及宿主细胞模拟部件,配置为将所述复合模型的基因电路输出数据作为输入接收,以及根据所述基因电路输出数据生成表示宿主生理状态的宿主细胞输出数据。一些实施方式涉及一种宿主细胞模拟系统,包括:代谢部件,用于根据至少表示输入葡萄糖浓度的输入刺激数据,对氨基酸和核苷酸的生产进行模拟;转录部件,用于根据所模拟的核苷酸的生产,对mRNA和rRNA的合成进行模拟;翻译部件,用于根据所模拟的氨基酸的生产,对蛋白质和RNA聚合酶的合成进行模拟;以及复制部件,用于根据所模拟的核苷酸的生产,对DNA的合成进行模拟,其中,所述翻译部件内的RNA聚合酶的合成与所述转录部件内的rRNA的合成相连接。还有一些实施方式涉及一种合成生物学设计方法,包括:由至少一个计算机处理器接收表示用户自定义的基因电路设计的基因电路数据;由所述至少一个计算机处理器从所述基因电路数据中识别所述基因电路设计的组成部件以及所述组成部件之间的连接;由所述至少一个计算机处理器获得与所述组成部件相对应的数学模型;由所述至少一个计算机处理器将所获得的数学模型组合为复合模型,该复合模型配置为根据输入数据一生成基因电路输出数据,所述输入数据表示游离RNA聚合酶浓度、游离核糖体浓度和rRNA浓度中的一个或多个,以及将所述复合模型的基因电路输出数据输入宿主细胞模拟部件,以生成表示宿主生理状态的宿主细胞输出数据。还有一些实施方式涉及一种宿主细胞模拟方法,包括:生成分别表示游离RNA聚合酶、游离核糖体和核糖体RNA初始浓度的初始细胞资源数据;接收至少表示时间依赖性葡萄糖浓度的营养物数据;以及根据所述营养物数据和初始细胞资源数据,确定表示所述宿主细胞的细胞资源的时间依赖性浓度的输出细胞资源数据,所述细胞资源包括:游离RNA聚合酶;游离核糖体;核糖体RNA;核苷酸;以及氨基酸。附图说明以下参考附图,描述本发明的一些实施方式。这些实施方式仅作为非限制性示例,附图中:图1为例示合成生物学设计系统的系统结构框图;图2为图1系统的宿主细胞模拟模块框图;图3为连接于宿主细胞模拟模块的基因电路部件框图;图4为基因电路部件和宿主细胞模拟模块之间的另一种连接方式框图;图5为合成生物学设计系统实施方式框图;图6(A)为虚拟大肠杆菌细胞模型示意图;图6(B)为使用图6(A)模型的宿主细胞模拟过程流程和相互作用示意图;图7为合成生物学设计过程实施方式流程图;图8为宿主细胞模拟过程流程图;图9是掺入组成型基因电路的宿主细胞模拟过程的另一个实例的流程图;图10(A)至图10(C)为生长于补充有不同葡萄糖浓度和不同水平利福平(6μM,8μM和10μM)的M9培养基中的野生型大肠杆菌Top10的生长速度下降图,其中,由宿主细胞模拟系统实施方式生成的模拟结果以圆点标示,实验实测结果由倒三角形(利福平)和正方形(野生型)标示;图10(D)为由宿主细胞模拟系统实施方式所预测的作为野生型(圆点)和不同利福平水平(6μM–菱形,8μM–正方形,10μM–倒三角)下生长速度函数的游离RNA聚合酶浓度图;图10(E)为由宿主细胞模拟系统实施方式所预测的作为野生型(圆点)和不同利福平水平(6μM–菱形,8μM–正方形,10μM–倒三角)下生长速度函数的转录抑制期间核糖体RNA浓度图;图11(A至C)所示为生长于补充有不同葡萄糖浓度和不同水平四环素(1μM,2μM和4μM)的M9培养基中的野生型大肠杆菌Top10的生长速度下降,其中,以圆点标示的模型结果与以倒三角形标示的实验结果具有良好相关性,平均|r|=0.981;图11(D)所示为由宿主细胞模拟系统实施方式所预测的翻译抑制期间游离核糖体浓度,图11(E)所示为预测的该期间天然主体蛋白质浓度;图12所示为在营养物限制条件下组成型表达基因的非必要蛋白生产对生长的影响的预测和实测结果;图13所示为在营养物限制条件下诱导型表达基因的非必要蛋白生产对生长的影响的预测和实测结果;图14所示为生长速度对双稳拨动开关电路和诱发阈值的影响的预测结果;图15为不同转录速度下的双稳性展示图;图16所示为所预测的不同生长条件下阻遏振荡器动力学;图17所示为生长和对称阻遏振荡器的振荡周期随降解速度大幅变动;图18为宿主细胞模拟系统内转录抑制条件下的细胞组成估算图:(A)游离核糖体浓度;(B)ppGpp水平;(C)氨基酸浓度;图19为翻译抑制条件下的细胞组成估算图:(A)游离核糖体浓度;(B)ppGpp水平;(C)氨基酸浓度;图20为组成型基因表达条件下的细胞组成估算图:(A)游离RNA聚合酶浓度;(B)ppGpp水平;(C)氨基酸浓度;图21为诱导型基因表达条件下的细胞组成估算图:(A)游离RNA聚合酶浓度;(B)ppGpp水平;(C)氨基酸浓度;图22所示为使用带不同启动子强度的组成型器件时的时间系列RFP荧光值;图23所示为使用带不同诱导物浓度的诱导型器件时的时间系列RFP荧光值;图24所示为外部葡萄糖=20mM时生长速度对双稳拨动开关电路和诱发阈值的影响的预测结果:(A至C)不同阻遏协同率(n=2(A),n=3(B),n=4(C))下的拨动开关动力学。系统诱发后,拨动开关以半不连续方式切换至较高状态(合成相对阻遏物2并抑制活性阻遏物1)。此状态在较高诱导物水平下一直保持。在所运行的模拟中,阻遏物mRNA和蛋白质的合成速度和降解速度相互平衡。活性阻遏物1的初始条件高于其相对阻遏物2,因此完全抑制其下游表达。(D至F)不同诱导物水平下的细胞生长状况。模型所预测的细胞生长速度在拨动切换过程中处于变化状态;图25所示为外部葡萄糖=0.1mM时生长速度对双稳拨动开关电路和诱发阈值的影响的预测结果:(A至C)各图所示为不同阻遏协同率(n=2(A),n=3(B),n=4(C))下的拨动开关动力学。系统诱发后,拨动开关以半不连续方式切换至较高状态(合成相对阻遏物2并抑制活性阻遏物1)。此状态在较高诱导物水平下一直保持。在所运行的模拟中,阻遏物mRNA和蛋白质的合成速度和降解速度相互平衡。活性阻遏物1的初始条件高于其相对阻遏物2,因此完全抑制其下游表达。(D至F)不同诱导物水平下的细胞生长状况。模型所预测的细胞生长速度在拨动切换过程中处于变化状态;图26所示为不同生长条件下阻遏振荡器动力学的预测结果。模型所得为第三阻遏蛋白水平的振荡周期。针对三个不同阻遏协同率值,在不同葡萄糖浓度的虚拟细胞内对所述阻遏振荡器进行模拟,以研究其生长效应及振荡行为(根据峰间间隔分布计算)。每次模拟仅运行一代;图27为拨动开关电路方案示意图;以及图28为阻遏振荡器电路方案示意图。具体实施方式以下描述了一种以虚拟细胞模型为核心技术的合成生物学设计平台的实施方式。所述设计平台可包括计算系统,该计算系统与实验工具包(一种良好表征且可重复使用的物理性生物部件库)集成,以促进新生物系统的合理工程化。这解决了对于如下合成生物学设计平台的需求:可辅助工业和学术研究人员对基因电路及构建体进行设计和优化;并在实验工作之前,针对外源构建体的可行性及其对宿主系统的影响进行计算机内评估。首先参考图1,该图为例示合成生物学设计系统100的框图。系统100通常实施为下文中详细描述的计算机系统。该计算机系统可例如为单个已编程计算机,或者为多个联网的计算机或计算机处理器,其中,各个计算机或计算机处理器用于执行合成生物学设计过程700(图7)的一个或多个操作。系统100的各种部件可实施为经数据交换而彼此相互作用的软件模块或组件,所述数据例如可与细胞模拟当中生化物质的时间依赖性浓度相关。举例而言,代谢部件可接收与外部葡萄糖浓度相关的输入信号,并产生与游离氨基酸和游离核苷酸浓度相关的输出信号。该输出信号又可以作为输入传递给转录部件等其它部件,该转录部件随后例如生成含mRNA物质浓度的输出信号。在一些实施方式中,所述部件的部分或全部可在专用硬件中实施,此类专用硬件例如为用于执行合成生物学设计过程的一个或多个操作的ASIC、FPGA或其他专用电子部件。系统100包括宿主细胞模拟模块116,该模块以可通信方式连接于一个或多个基因电路部件。宿主细胞模拟模块116可在模拟控制部件104的控制下单独执行。如下所述,宿主细胞模拟模块116可包括对宿主细胞的各个方面进行模拟的多个部件。宿主细胞模拟模块116可接收输入数据并生成输出数据,所述输入数据例如为输入葡萄糖浓度等输入刺激数据,所述输出数据与生化物质浓度,细胞生长速度等相关。或者,当宿主细胞模拟模块116连接于基因电路部件时,模拟控制部件104可配置为执行将基因电路的资源需求纳入考虑的宿主细胞模拟。例如,宿主细胞模拟模块116可从基因电路部件接收资源需求数据,该数据表示核糖体、RNA聚合酶、rRNA、核苷酸和氨基酸等生化物质的所需浓度。因此,该宿主细胞模拟可就是否可在真实生物系统中实施基因电路方面向用户提供见解。例如,当所述宿主细胞模拟所产生的细胞生长速度低至不可接受时,则所述基因电路将不适于实施。所述模拟的输出包括基因电路性能以及基因电路的基因序列,该序列可用于实际的构建和合成工作,例如使用生物自动化制造公司(BioAutomationManufacturing)(德克萨斯州欧文市)的MerMade192X合成仪等DNA和/或RNA合成仪进行合成。系统100包括用户界面部件,该部件提供基因电路图形设计部件102与模拟控制部件104的界面。基因电路图形设计部件102允许用户利用输入设备(如鼠标、键盘、触摸板、触摸屏等)指定基因电路(在本领域中也称合成生物电路)布局。通常,基因电路布局包括基因、启动子等生物部件,以及这些部件之间的连接。电路布局(如部件识别符、部件之间的相互作用关系以及相互作用强度)可保存于部件和模型注册数据库118等数据库内。数据库118可以为系统100的非易失性存储器上的本地数据库。或者,其也可以位于与系统100经LAN或WAN通信的数据库服务器内。或者,用户可输入合成生物电路设计的基因序列图,并由系统114对该基因序列图进行自动转换。模拟控制部件104可接收与模拟参数(例如模拟时间,或者虚拟细胞模拟中的转录速度和翻译速度等与生物部件对应的数学模型的参数)相关的用户输入,并且可允许用户对模拟的执行进行控制。模拟控制部件104还可将模拟结果输出至显示装置,并且/或者可允许经导出部件110导出结果112。该结果可包括基因电路的核苷酸序列,以及动态行为(生长速度和基因表达)等与基因电路和/或宿主细胞性能相关的参数。通常,所述输出参数可采取时间序列数据形式,可选地,该数据可作图并经所述用户界面部件显示于用户。结果112也可保存于数据库中(未图示)。以lasQS器件为例,可对分别获取自模型参数的AHL与LasR的缔合常数、LasR和RFP的转录/翻译速度等参数进行变更。举例而言,转录速度与启动子相关,而翻译速度与RFPmRNA的核糖体结合位点相关。图形设计部件102可向用户提供界面,以对这些参数值进行修改。类似地,用户也可以类似方式对LasR的转录速度和翻译速度进行修改,以对lasQS器件的计算机内行为进行研究。在一些实施方式中,系统100可包括实验工具包120,该工具包包括一个良好表征的标准生物部件库,设计工程师可利用该库创建基因电路。此类生物部件(如启动子,核糖体结合位点等)为基因电路的基本构建模块。表示这些生物部件特征的生物部件数据可例如通过部件和模型转换器122导入,并存储于部件和模型注册数据库118中。所述生物部件数据包括参数值和其他数据,该数据例如为与相应部件的相应数学模型的微分方程中的浓度表示项或浓度导数相关的数据。部件和模型转换器122可包括一个或多个部件,该部件可实现从实验结果转换基因部件和模型,并将此基因部件和模型保存于部件和模型注册数据库118内。举例而言,可对来自酶标仪等的已调整至与元数据具有相同标准化格式的基因部件表征实验数据进行分析,从而确定模型参数。之后,可将这些参数与元数据一起存入部件数据库118。在另一实施例中,部件和模型转换器122可将多个基因部件从部件数据表中批量载入数据库118。在另一实施例中,可将由SBML(系统生物学标记语言)等其他语言表示的已知基因电路模型转换至系统100可使用的格式,并将其存入数据库118。需要重点注意的是,“模型”一词并不局限于基因或启动子的数目,事实上,系统100可将整个基因组/生物体规模的路径图视为一个大的模型。每个生物部件可具有与其相关联的标准化的模块化数学模型。每个生物部件模型可具有标准的输入和输出,以实现与宿主细胞模拟模块116以及其相互之间的连接性,并实现在由图形设计部件102生成的用户构建基因电路等不同基因电路内的可重复使用性。具体而言,每个生物部件模型可具有游离RNA聚合酶浓度、游离核糖体浓度和rRNA浓度等一个或多个生化物质相应浓度形式的标准输入,还可具有游离RNA聚合酶浓度、游离核糖体浓度、rRNA浓度、核苷酸浓度和氨基酸浓度等一个或多个生化物质相应浓度形式的标准输出。举例而言,每个生物部件模型可包括将输入浓度联系于输出浓度的一个或多个耦合微分方程,其中,这些微分方程的各项系数作为其他输入获得(例如,获取自部件和模型注册数据库118或实验工具包120)。在一些实施方式中,可将用户经基因电路图形设计部件102输入的图形形式的基因电路布局或FASTA、GenBank等格式的基因序列由模型转换部件114自动转换为表示数学模型的数据。图形设计部件102展示给用户的的每个图标均可具有映射至数据库118的条目的唯一ID或标签。模型转换部件114可从基因电路图形设计部件102接收表示基因电路布局的数据,并可对基因电路的组成部件及其之间的相互作用关系和/或连接进行识别。之后,模型转换部件114可通过查询数据库118获得与所述组成部件对应的数学模型,并利用表示相应模型的标准化输入和输出将获得的所述模型组合为复合模型。生物部件的每个模型均可以标准化方式保存为类格式,并可通过数据库118中针对该生物部件的相应条目的适当参数获得补充。在从数据库118中获得所有部件后,并可将其组合为所述复合模型。举例而言,一个简单的复合模型可包括启动子(pBAD),以及随后的RBS和目标基因(例如绿色荧光蛋白)。所述复合模型的生成可由算法(模型转换部件114的部件)自动完成,该算法获取生物部件的模型并将其组合为所述复合模型。可以与软件编程类似的方式,利用面向对象的方法,根据输入和输出关系将部件组合为复合模型。每个部件模型均视为具有输入、输出和函数的对象实体。上述算法的输出为表示基因电路及其他相关生化反应(如代谢途径)的复合数学模型。该算法如下:1.每个单独部件的模型具有0个或多个输入。例如组成型启动子具有0个输入,而RBS具有1个输入(mRNA)。2.每个单独部件的模型具有1个或多个输出,通常为1个输出。例如,启动子将mRNA作为输出。3.每个单独部件具有0个或多个已命名ODE(当前,终止子不产生ODE)4.表示模型中每个部件的函数均各自单独生成。各函数均以python等编程语言编写。以LasR传感器为例(构建体:pTetR–RBS1–LasR–Term1),将生成以下ODE函数:a.mRNA_pTetR<随机数>;例如,来自pTetR的mRNA_pTetR21543b.肽_RBS1<随机数>;例如,来自RBS1的肽_RBS152643c.蛋白质_LasR<随机数>;例如,来自LasR的蛋白质_LasR584745.每个单独部件的模型具有作为变量的自身输出项。例如,pTetR的输出为mRNA。6.前一部件的输出项用作后一部件的输入。例如,RBS1将pTetR的mRNA输出作为输入。这一过程持续进行至所有部件均已根据输入/输出被连接。7.相互作用关系(如LasR和AHL结合为复合物)需要2个或更多个输入,并给出1个或更多个输出。所述相互作用关系表示于ODE中。受相互作用产物诱导或阻遏的启动子通过将该相互作用产物作为诱导物或阻遏物的方式表示于ODE中。之后,对ODE函数中的变量做出相应替换。如此,便可利用相互作用关系将BBB/诱导物/相互作用联系于一起。8.最终结果为,根据各个部件形成表示基因电路及相关生化反应(如代谢途径)的模型。在一些实施方式中,可利用外部数据源的标准生物部件,例如标准部件登录库(www.partregistry.org)中定义的部件构建基因电路。例如,导入部件108可从外部数据源接收具体描述部件特征的XML数据和/或FASTA格式的序列数据等生物部件数据,并将该生物部件数据重新格式化为适于保存在部件和模型注册数据库118中的形式。导入部件108例如可与其他软件通信并从该软件中导入数据。在一个实施例中,可将原始Genbank格式中或源自VectorNTI、Geneious等其他软件工具的输出的带注释载体图转换为基因电路模型并存入数据库118。需要重点注意的是,基因电路并不局限于工程质粒载体,还可包括整个基因组。例如,系统100可将整个染色体或基因组视为一个高度复杂的基因电路。当提供载体图时,导入部件108可直接从DNA序列或间接从注释中提取基因电路组成部件的信息。直接从DNA序列鉴别组成部件可能需要对数据库进行查询(例如通过使用BLAST算法)。模型转换部件114可获取上述信息,并自动生成基因电路模型及相关生化反应。此过程可由用户通过基因电路图形设计部件102启动。基因电路复合模型组装完成后,便可将其与宿主细胞模拟过程的宿主细胞模拟模块116相接合,以确定基因电路对宿主细胞的生长速度等参数的影响。如图3所示,基因电路部件300用于接收表示细胞资源的输入数据(例如宿主细胞模拟模块116输出的生化物质浓度),根据所述复合模型处理该输入数据,并根据该处理结果生成输出数据。该输出数据表示基因电路部件300所产生生化物质的浓度,而且作为输入传递至宿主细胞模拟模块116。所述基因电路的输出数据还可包括与基因电路性能相关的参数。宿主细胞模拟模块116的输出数据可包括表示宿主细胞生理状态的数据。在一个实施例中,可通过五种细胞资源(生化物质),具体为核苷酸、氨基酸、游离RNA聚合酶、游离核糖体及rRNA的共享将基因电路部件300与宿主细胞模拟模块116相连接。例如,外源基因表达系统可表示为具有以下四个子系统的基因电路部件:(1)转录部件A;(2)转录部件B;(3)翻译部件A;(4)翻译部件B。转录部件A阐明转录的起始,即游离RNA聚合酶与启动子的结合。该结合导致mRNA开始合成。转录部件B模拟mRNA的延长。翻译部分A阐明翻译的起始,即游离核糖体与mRNA的结合。该结合导致蛋白质开始合成。翻译部件B模拟蛋白质肽链的延长。基因电路部件300可从宿主细胞模拟模块116接收细胞资源,以实施基因表达。在一个实施例中,所述资源为:核苷酸(在转录部件B中建模,mRNA的形成),以及氨基酸(在翻译部件B中建模,蛋白质肽链的形成)。基因电路部件300还接收与用于实施基因表达的输入细胞成分相关的数据。这些细胞成分为:游离RNA聚合酶(在转录部件A中建模),游离核糖体以及rRNA(在翻译部件A中建模)。宿主细胞模拟模块116共享细胞成分(输出至基因电路部件300,以及从基因电路部件300输入),这些细胞成分,尤其游离RNA聚合酶、游离核糖体和rRNA还用于其自身的转录和翻译。根据核苷酸和氨基酸的消耗量,可对宿主细胞模拟模块116内的ATP消耗量进行估算。本实施例中连接基因电路部件300和宿主细胞模拟模块116的输出和输入总结于表1A。表1A输入输出宿主细胞模拟模块116游离RNA聚合酶游离RNA聚合酶游离核糖体游离核糖体rRNArRNA核苷酸氨基酸基因电路300游离RNA聚合酶游离RNA聚合酶游离核糖体游离核糖体rRNArRNA核苷酸氨基酸各种部件的输入和/或输出可通过耦合微分方程等耦合方程进行计算。下文中以“宿主细胞模拟和基因电路的例示数学模型”为标题的部分对一系列的此类计算进行了描述。现在参考图5,该图所示为采用合成生物学设计系统100的例示计算机系统。该合成生物学设计系统可以为标准计算机系统,例如,如图5所示,基于IntelIA-32的计算机系统100,而且由系统100执行的相应模拟和设计过程实施为一个或多个软件模块或组件202的编程指令的形式,如图5所示,所述模块或组件保存于与计算机系统100相关联的有形非易失性存储器204(如固态磁盘或硬盘)内。然而,显而易见的是,所述过程还可例如部分或全部实施为一个或多个专用集成电路(ASIC)等专用硬件部件的形式,以及/或者现场可编程门阵列(FPGA)等可配置硬件部件的配置数据的形式。包含用于执行宿主细胞模拟过程和合成生物学设计过程的软件指令的软件模块或组件202可包括所述宿主细胞模拟模块116、图形设计部件102、模拟控制部件104、导入部件106、导出部件110、模型转换部件114(如图1所示)以及一个或多个基因电路部件300(图3)。如图2所示,宿主细胞模拟模块116可包括多个子部件,例如代谢部件130(其又可包括全局调控部件132)、复制部件138、转录部件134和翻译部件136。如图5所示,系统100可包括标准计算机部件,这些部件包括随机存取存储器(RAM)206、至少一个处理器208以及外部接口210,212,214,并且由总线216全部相互连接。举例而言,所述外部接口包括:通用串行总线(USB)接口210,这些USB接口中的至少一个连接于键盘218以及鼠标等指点设备;以及网络接口连接器(NIC)212,该NIC将系统200连接于因特网等通信网络220,通过该通信网络,系统100可对含有生物部件数据的外部数据库108进行访问。系统100还包括:显示适配器214,该适配器连接于LCD面板显示器222等显示装置;以及多个标准软件模块,这些模块包括Linux或MicrosoftWindows等操作系统224。系统200可包括MySQL(http://www.mysql.com)等结构化查询语言(SQL)支持230,其允许数据存入SQL数据库118以及从该数据库获取数据,这些数据包括表示上述生物部件参数和其他数学模型细节的数据。图7所示为例示工作流程700,该工作流程涉及系统100的使用。在使用所述系统的设计过程的开始阶段,用户可通过若干手段利用该系统的图形界面102构建702基因电路。如果待构建基因电路所需的器件和部件存在于库118中,则用户仅需在库118中选择器件/部件便可构建所述基因电路,该选择例如通过将所选部件拖放至画布上并在各部件之间绘制连线的方式完成。否则,用户可例如根据对文献或其他可用数据源的搜索从头开始构建基因电路。用户还可从其他数据源108直接导入其基因电路设计。在用户利用图形设计部件102构建一个或多个基因电路之后,在步骤704中,用户可为所述基因电路部件的模型定义其自身的参数值,或者使用库118中已有的预定义参数值。系统100可具有一套不同的虚拟宿主细胞模型(例如,原核、真核、哺乳动物等),这些模型建模于不同的抽象级别,以解决不同实验问题。所述虚拟宿主细胞模型中可包括仅具有关键生物过程的简单模型,或可包括更复杂的基因组规模模型。在步骤706中,用户可选择特定宿主细胞模型,例如下文所述的大肠杆菌宿主细胞模型。当用户按上述方式完成基因电路构建、参数定义及宿主细胞模型选择后,系统100可自动生成基因电路的复合模型(例如通过模型转换部件114),并将该基因电路连接于虚拟宿主细胞模型——步骤708。之后,用户可通过模拟部件104运行采用所述复合模型的模拟过程,以对基因电路在宿主环境中的预期行为进行模拟——步骤710。该模拟的结果允许用户对宿主生理状态(如细胞组成、细胞质量、生长速度、代谢等)以及基因电路性能进行分析和解读——步骤712。在步骤714中,用户可检查所述基因电路性能是否满足其预期。如果是,用户可表明(例如通过模拟控制部件102)该所述性能可满足要求,之后可由系统100在步骤720中生成待真实构建的包含所述核苷酸序列及电路拓扑结构的最终设计。用户可通过变更基因电路的各种参数(步骤716)或改变基因电路的拓扑结构(步骤718)对基因电路做出微调。在此优化过程716,718中,系统100可通过图形设计部件102提供设计规则列表,以对用户进行指导。所述设计规则可保存于数据库118或其他数据库,而且其中可包括关于应纳入何种生物部件的布置方式才能对性质已知的何种物事进行复制的规则。例如,上述规则之一可以为,每个基因的电路应该在该基因上游包含至少一个核糖体结合位点,以及在该核糖体结合位点和基因上游包含至少一个启动子。如果,在存在违反一个或多个规则的情况下,图形设计部件102可对用户警告,或者可拒绝允许设计被最终完成。之后,可再次运行(712)所述模拟过程,而且所述微调操作可反复执行至最终实现满意的设计。如果所述基因电路的最终设计包含实验工具包120中没有的新合成部件,则可利用正向工程工具来设计满足所期望标准的合成部件。这些正向工程预测工具可包括,根据DNA序列预测启动子强度,根据核糖体结合位点预测翻译速度等等。宿主细胞模拟和基因电路的例示数学模型宿主细胞模拟模块116中采用的数学模型通过描述代谢、转录、翻译和复制这四个生物过程及其相互作用而确定细胞参数和生长。本文公开的模型基于普通微分方程对导致主体mRNA和蛋白质的合成以及核糖体、ppGpp、ATP、氨基酸、核苷酸和DNA的合成的细胞过程进行定义。然而,还可使用其他方法对这些过程进行建模。如列出了模型中参数的所有初始条件的下表2所示,所假设的初始条件为构建大肠杆菌虚拟细胞(18)时所使用初始浓度为2.1μM的游离RNA聚合酶,初始浓度为4.1μM的游离核糖体等机构。构建虚拟细胞模型116时使用的所有参数列于表3。游离RNA聚合酶活性和信使RNA的合成大肠杆菌中天然RNA的合成采用描述游离RNA聚合酶的合成及其与主体mRNA和rRNA启动子间相互作用的表达式进行建模。游离RNA聚合酶与游离启动子结合后形成的活化复合物可启动转录并通过添加核苷酸的方式得到延长,从而形成天然RNA。以下微分方程描述了游离RNA聚合酶浓度的变化速度,其中,fRa由其启动子结合作用和合成速度给出:所述启动子可在以下两种功能状态之间转换:(1)与RNA聚合酶结合形成活化复合物的状态;(2)游离状态。天然启动子的守恒原则如下:Pm=PCm+fPm(2)Pr=PCr+fPr(3)游离启动子表示为fpm和fpr,而PCm和PCr表示与RNA聚合酶结合的启动子。mRNA启动子分为组成型,停顿型和可阻遏型三类,而且总mRNA启动子浓度(Pm)为2.09μM(19)。下标“m”和“r”用于表示与mRNA和rRNA启动子相关的变量。αm为主体mRNA的转录速度,其值为0.05s-1(19),而αr为核糖体基因的转录速度,其值为1.83s-1(19,20)。游离RNA聚合酶浓度定义为已合成RNA聚合酶的一小部分,而且当生长速度的增大时,此部分因RNA聚合酶合成的增多而增大(21)。因此,在本发明模型中,游离RNA聚合酶的动态供应量在任何给定时间均基于总活性RNA聚合酶的约20%(19,22),而且表示为0.2×已合成RNA聚合酶。αp=0.07s-1为主体mRNA的翻译速度,而且假设为与核心RNA聚合酶亚基mRNA的翻译速度类似。游离RNA聚合酶/启动子复合物的形成基于mRNA的启动子强度,而且可由以下动力学方程表示:其中,kf1和kf2=106M-1s-1;kb1=0.65s-1及kb2=2.57s-1分别为mRNA和rRNA转录起始时的正向和逆向速度常数(19,23,24)。天然系统中主体mRNA浓度的变化速度为其合成速度与降解速度的差值,而该合成速度基于RNA聚合酶/启动子复合物的形成以及延长mRNA链的核苷酸的添加。βm=2.9×10-3s-1为天然mRNA的降解速度(7)。其中,表示活性转录RNA聚合酶的比例。Arp表达式中的分母表示与带添加核苷酸的延长复合物结合的游离“延长复合物”位点的比例。带核苷酸的延长复合物(分子)以随游离核苷酸浓度增大而增大的米氏(Michaelis-Menten)项表达。“N”为游离核苷酸浓度,KN=2μM为核苷酸解离常数(25)。核糖体RNA,ppGpp和主体蛋白质的合成我们通过修改Marr(20)的数学模型令其描述核糖体的合成及其在虚拟细胞系统中的调控。与mRNA的合成类似,游离RNA聚合酶通过与rrn启动子结合而形成活化复合物,表示为fPr。rrn启动子分为rrnP1和rrnP2,且总rrn启动子浓度(Pr)为0.08μM(19)。据认为,rrnP2启动子为组成型启动子,而且决定该启动子活性的因素为游离RNA聚合酶浓度的供应情况以及因营养物匮乏而导致ppGpp合成增加的应急响应效应(21)。还有人提出,rrnP1启动子具有极高强度的原因可能在于核心启动子区域之外的序列,主要为上游侧翼序列,而且其活性可因氨基酸匮乏导致的应急响应而受到强烈抑制(26)。核糖体浓度rRNA的变化速度为核糖体的合成速度与其降解速度之差,如式(7)所示。其中,αr=1.83s-1为核糖体基因的最大转录速度(19,20)。“βr”为核糖体降解速度,而且假设为与天然主体蛋白质的降解速度相似。表示核糖体和非核糖体基因之间的转录资源分配,其为ppGpp(G)的函数。核糖体基因的转录速度由ppGpp(G)的浓度控制,而且由希尔(Hill)方程式给出(20)。Kg=40μM为ppGpp的解离常数,而且h=2为结合协同率。ppGpp对RNA聚合酶启动子的相互作用具有直接影响,而且已证实,rRNA启动子开放复合物的形成速度受ppGpp影响(27)。本模型中假设ppGpp浓度为调控信号。该方程的核心假设为,某些氨酰tRNA在A位点与不带电荷的tRNA竞争。根据氨基酸库的供应情况,氨酰tRNA向正在生长的肽链添加氨基酸,而不带电荷的tRNA抑制rrn操纵子的转录(20)。ppGpp(G)的浓度变化速度表达为其合成速度与分解速度之差。其中,k1=1s-1及k2=0.035s-1为速度常数(20)。表示滞留核糖体的比例。“C”和“U”分别为氨酰tRNA和不带电荷的tRNA的浓度,而KC=2.75μM和KU=10μM为相应的解离常数。SR表达式中的分母表示与不带电荷的tRNA和带电荷的tRNA结合的游离“A”位点的比例。分子表示不带电荷的tRNA,而且如果其增大,则ppGpp浓度成比例增大。“C”的形成以随游离核苷酸浓度增大而增大的米氏项表达:其中,“A”为游离氨基酸浓度,Ka=20μM为氨基酸解离常数(20)。“T”为结合了带电荷的和不带电荷的tRNA浓度的总tRNA浓度。T=U+C(10)之前已有人提出,T和核糖体浓度之间的摩尔比与生长速度无关(28),因此:T=Cr·rRNA(t)(11)其中,Cr=0.25。类似地,已合成mRNA的翻译也由游离核糖体供应情况决定。游离核糖体通过结合至mRNA的核糖体结合位点而与mRNA形成复合物,而且通过向正在生长的肽链添加氨基酸而启动肽链延长。游离核糖体的浓度变化速度根据其因与天然mRNA形成复合物而导致的消耗以及其自模型中合成的总核糖体的生成,由以下动力学方程表达:之前已经假设,游离核糖体库小于总核糖体库且与生长速度成比例(29)。此外,各核糖体的肽链延长速度为常数,与生长速度无关。在缓慢生长条件下,游离RNA聚合酶的水平较高(30)。因此,动态添加的游离核糖体设计为模型中合成的已合成核糖体的20%。主体天然蛋白质浓度的变化速度表达为其合成速度与降解速度之差。其中,“Bp”为天然蛋白质浓度,βp=0.15×10-3s-1为天然蛋白质的稀释速度(7),MRp为mRNA/核糖体延长复合物,表示活性翻译核糖体的比例。营养物的流入及单体的合成大肠杆菌生长于带任何碳源的基本培养基中,所述碳源用于支持代谢反应以合成代谢物,并用于通过细胞呼吸触发ATP的合成。细菌生长速度取决于所述碳源,在此情况中,该碳源为葡萄糖。在本模型中,葡萄糖的摄取基于简单的米氏动力学。外部葡萄糖浓度(Glu)的变化速度等于每单位时间消耗的葡萄糖。其中,βglu=1.7×10-5g/hcm2为单个细胞的最大葡萄糖摄取速度(31)。KM=1.75μM为表观饱和常数(31,32)。我们假设单个细胞具有最大葡萄糖摄取速度,以为生长提供驱动力。此外,还假设外部葡萄糖浓度随生长速度的下降而降低。在大肠杆菌中,葡萄糖摄取能力在生长速度范围内保持恒定,而且摄取速度受限于外部葡萄糖的供应情况(33)。在此之后,需将被消耗的葡萄糖量转化为ATP分子。ATP的形成速度遵循葡萄糖浓度(Glu)的非竞争性希尔动力学。ATP浓度的变化速度为以葡萄糖为底物的生成速度减去因单体(氨基酸和核苷酸)合成的消耗速度再减去其降解速度之差。其中,因代谢通量以ATP浓度表示(20,34),所以Vs=15mMmin-1及Ks=3×10-3M定义为葡萄糖至ATP的转化动力学参数。K3=10-4M为ATP反馈抑制的表观解离常数。fA=0.01为蛋白质中氨基酸的摩尔分数,而fN=1为RNA中核苷酸的摩尔分数(20)。n=2为希尔系数。βatp=0.035s-1为ATP分解速度(31)。我们通过类似方法对蛋白质和RNA合成中所需的游离氨基酸(A)和核苷酸(N)库的速度进行建模。产生的ATP用作单体合成的底物。ATP促进代谢物合成及单体自代谢物衍生的酶反应(36)。然而,ATP和其他核苷酸的浓度是生长速度的弱函数。代谢反应和大分子合成之间的可能联系由代谢物自这些代谢物合成的单体的浓度给出(20)。据认为,控制大分子合成的控制单体为由调控化合物感测和控制的氨基酸(37)。游离核苷酸浓度的变化速度表达为以ATP为底物的核苷酸形成速度与用于RNA和DNA合成的消耗速度之差。其中,Vs=10μMs-1及Ks=4×10-4M为ATP至核苷酸的转化动力学参数。K2=10μM为核苷酸反馈抑制的解离常数,βn=0.03h-1为核苷酸分解速度(31)。此处假设,所合成ATP的2/5用于核苷酸的合成。同样的,游离氨基酸的变化速度表示为其以ATP为底物的形成速度与用于蛋白质合成的消耗速度之差。其中,Vs=25μMs-1及Ks=5×10-4M为ATP至氨基酸的转化动力学参数(20)。K1=10μM为氨基酸反馈抑制的解离常数。βa=0.025h-1为氨基酸分解分解速度(31)。在氨基酸的情况下,假设ATP水平的1/5用于氨基酸合成。等于ATP水平的2/5的总余量(即,不用于单体合成的ATP)用于脂质形成等其他主要反应。RNA聚合酶的合成细胞内的转录速度取决于RNA聚合酶的浓度(19,24)。我们对以游离RNA聚合酶的动态供应为目的的RNA聚合酶的合成进行建模,所述动态供应的目的在于RNA的合成。RNA聚合酶合成的建模通过先利用游离RNA聚合酶形成RNA聚合酶mRNA,然后通过由游离核糖体翻译这些mRNA而合成RNA聚合酶的方式实现。其中假设,总启动子浓度的1%由负责生成RNA聚合酶mRNA的基因构成。RNA聚合酶mRNA生成的变化速度基于转录复合物的延长速度与降解速度之差,如下式所示:类似地,RNA聚合酶合成的变化速度表达为mRNA/核糖体复合物的延长速度与稀释速度之差,如下所示:RNA聚合酶的浓度随生长速度的增加而增加,而且此细胞内补充物分为:活性(转录)RNA,在任何时刻占补充物的百分比均为约17%至30%;以及非活性(非特异性结合、游离及装配中间体)RNA(19,24)。DNA合成大肠杆菌的细胞周期包括复制起始阶段“B”,DNA合成阶段“C”,以及DNA复制完成后及细胞分裂恰开始前的阶段。在基本培养基条件下,倍增时间为细菌DNA复制所需的时间。在大肠杆菌中,DNA复制被严格调控,以与生长相协调且对营养物的供应情况有响应(38)。当氨基酸匮乏时,DNA复制的启动受到抑制,其发生的征兆为ppGpp的合成(39)。在最近的一项研究中,得出如下结论:为了保持基因组的完整性,ppGpp主要根据匮乏条件对复制延长速度进行调控,从而实现对复制延长的可调控制(40)。本发明模型中的主要假设在于,在模拟开始前,染色体起点oriC处的DNA复制已经开始,而且在应急响应期间仍然不受抑制,这是因为我们仅对需要倍增的单个细胞进行调查,以研究细胞组成及其对生长的影响。此外,该模型还假设,染色体复制(或DNA合成)完成后,细胞分裂并倍增,从而指示出用于细胞生长速度预测的倍增时间。DNA浓度并不限制生长(24),而且假设其在单个细胞中为恒定值。DNA浓度的变化速度表达为通过添加核苷酸而合成并延长DNA的速度,该速度受控于调控化合物ppGpp的积累。其中,αd=1/1250s-1用于染色体单链的复制,表示活性复制DNA聚合酶。DNA浓度假设为等于4nM的恒定值(41)。该模型提取DNA浓度饱和于4nM所花费的时间,并按照下式根据倍增时间(td)计算细胞的单位生长速度(倍增次数/小时),单位生长速度:该模型算出的倍增时间再次导入系统,以确定游离RNA聚合酶、核糖体、ppGpp、氨基酸、核苷酸、ATP、mRNA和蛋白质等所有生长依赖性参数的浓度。转录和翻译抑制在本节中,我们利用本发明虚拟细胞模型给出转录和翻译抑制的动力学。这是因为,在该虚拟细胞模型中,游离RNA聚合酶和核糖体均用于转录和翻译过程。此处假设,转录和翻译抑制剂仅竞争性地结合于游离酶,从而相应阻断启动子和mRNA的结合。转录抑制剂利福平抑制大肠杆菌RNA聚合酶,并经证实可有效阻止RNA合成的启动,但不阻止RNA链的延长(42)。类似地,四环素(翻译抑制剂)通过结合于核糖体的30S亚基而防止带电荷的tRNA在A位点的结合(43)。游离RNA聚合酶与所述抑制剂(利福平)的结合表示为:其中,ka=106M-1s-1(44)和kb=10-3M为抑制剂(利福平)结合的正向和逆向速度常数,I为抑制剂浓度,n=2为结合协同率。游离RNA聚合酶的动力学即为:类似地,游离核糖体与抑制剂(四环素)的结合表示为:其中,kc=106M-1s-1(45)和kd=10-3M为抑制剂(四环素)结合的正向和逆向速度常数,I为抑制剂浓度,n=2为结合协同率。游离核糖体的动力学即为:游离RNA聚合酶的减少导致RNA合成的减少,而且蛋白质合成也因较低的rRNA合成水平而最终受到影响。在翻译抑制的情形下,游离核糖体的减少量导致rRNA水平和主体蛋白质量降低。此外,主体蛋白质水平的立即降低意味着分别改变氨基酸和核苷酸合成浓度的促进反应的速度降低,从而明显改变ATP合成的水平。氨基酸和核苷酸合成速度因抑制而发生的立即下降表示为:其中,KI为抑制效力。本发明模拟中使用的利福平和四环素的抑制效力分别为KI=10-9M(44)和KI=10-6M(45)。所使用的转录抑制剂(利福平)的浓度为10μM,8μM和6μM,而所使用的翻译抑制剂(四环素)的浓度为4μM,2μM和1μM。上述抑制剂浓度发生相应变化,而且其对细胞的组成和生长速度的总体影响也根据特定量下DNA合成达到饱和的时间进行相应计算。异源基因表达当完成天然系统的建模和评价后,即将异源系统纳入该模型中,以对生长效应和细胞组成进行评价。该数学模型始自宿主内的转化质粒。在本研究中,我们对简单的组成型和诱导型器件进行调查。对于此两种器件,合成电路的mRNA和蛋白质生成均与宿主类似。游离RNA聚合酶与游离质粒结合后形成活化复合物,从而引发转录和mRNA生成。其中,kfa和kba为游离RNA聚合酶与游离外源启动子结合的正向和逆向速度常数。fPfm=(总质粒浓度–PCfm)。类似地,所合成的游离核糖体与游离外源mRNA结合后形成活化复合物,从而引发翻译和外源蛋白质的合成。其中,kfb和kbb为游离核糖体与游离外源mRNA结合的正向和逆向速度常数。因外源mRNA和蛋白质的生成而发生的游离RNA聚合酶、核苷酸、游离核糖体以及氨基酸的消耗更新于上述宿主细胞模型方程式内。在组成型表达的情形中,我们研究了具有不同强度(高,中,低)的三种启动子。我们以实验方式构建电路,并获得所研究启动子的相对启动子单位。利用这些相对启动子单位,我们根据参考启动子(rrnB)计算出上述器件的转录速度,如表1B所示。表1B:组成型器件模拟所使用的参数本发明的诱导型电路具有两个部件,一个组成型ON启动子,该启动子合成LasR转录因子,该转录因子与外源添加的诱导物结合后形成复合物,该复合物激活下游报告蛋白RFP的合成。利用以上方程式,对所述生成LasR的组成型启动子的活性进行建模。接下来,将所述诱导物和LasR的结合表示为:其中,kf=106M-1s-1和kb=10-3M为诱导物与LasR结合的正向和逆向速度常数。游离LasR的守恒方程式为总量(Fp)减去诱导物/LasR复合物(IFp)再减去启动子结合诱导物/LasR复合物(PIFp)。本研究中使用的AHL浓度为10-7M至10-9M。n=2为诱导物结合协同率。启动子结合诱导物/LasR复合物(PIFp)的变化速度为:其中,kf1=108M-1s-1及kb1=0.1M为诱导物/LasR复合物与启动子为了下游报告基因的合成而结合的正向和逆向速度常数。所述报告蛋白合成的建模类似于上述外源蛋白质合成方程(31~34)。为了确定生长速度和上述其他参数,在模拟运行过程中,将上述外源电路方程在宿主中实施。拨动开关该拨动开关由以可相互阻遏方式设置的两个可阻遏型启动子(在此情况下为X和Y)构成(图7)。如之前文献所述(16),拨动开关按照如下方式建模:(1)拨动系统的双稳性取决于协同指数;(2)两种阻遏物的合成速度均需平衡化;(3)任何一种阻遏物的初始条件均需达到临界线以上。所述阻遏物(X和Y)的mRNA和蛋白质生成通过以下方程建模:其中,XmRNA和YmRNA分别为各阻遏物的mRNA浓度,X为阻遏物1的浓度,Y为阻遏物2的浓度,PCm1及PCm2为转录起始复合物,αmf为阻遏物的转录速度,βm为mRNA降解速度,RXmRNA及RYmRNA为翻译起始复合物,αfp为阻遏物的翻译速度,βp为蛋白质降解速度,n为阻遏物的阻遏协同率,K为阻遏物的解离常数,KI为诱导物(IPTG)的解离常数,IA和IB为诱导物浓度,m为IPTG结合的协同率。用于理论分析的模型参数分别为:X(0)=2×10-5M,Y(0)=0,αmf=2.4s-1,βm=0.0083s-1,αfp=0.4mRNA-1s-1,βp=0.0017s-1,K=4×10-5M,m=2,KI=3×10-5M。通过该模型,我们同时变化外部葡萄糖水平(20mM和0.1mM)及阻遏协同率(n=2~4),以对生长效应和拨动开关系统行为进行模拟。为此,以上各参数除诱导物水平(IA=0且IB=0.01~10-6M)发生变化,其他均保持不变。最后,我们在存在(IB=10-3M)和不存在诱导物且所述两阻遏物的转录速度发生变化(0.05~3s-1)的条件下对生长效应和双稳性进行了研究。其中,所使用的外部葡萄糖水平为20mM和0.1mM。阻遏振荡器一种环形振荡器(图28),其中,第一阻遏蛋白(X)阻遏第二阻遏蛋白(Y)的合成,而该第二阻遏蛋白进一步阻遏第三阻遏蛋白(Z)的合成。最终,第三阻遏蛋白(Z)阻遏第一阻遏物(X)的合成。与原始文献中的做法相同,我们将mRNA和阻遏蛋白(17)合成中的转录和翻译速度分别保持为相同速度。所述阻遏物(X,Y,Z)的mRNA和蛋白质生成通过以下方程建模:其中,XmRNA,YmRNA和ZmRNA分别为各阻遏物的mRNA浓度,X为阻遏物1的浓度,Y为阻遏物2的浓度,Z为阻遏物3的浓度,PCm1,PCm2和PCm3为转录起始复合物,αmf为阻遏物的转录速度,βm为mRNA降解速度,RXmRNA,RYmRNA和RZmRNA为翻译起始复合物,αfp为阻遏物的翻译速度,βp为蛋白质降解速度,n为阻遏物的阻遏协同率,K为阻遏物的解离常数。用于理论分析的模型参数分别为:X(0)=2×10-5M,Y(0)=0,Z(0)=0,αmf=2.4s-1,βm=0.0083s-1,αfp=0.4mRNA-1s-1,βp=0.0017s-1,K=4×10-5M。与拨动开关类似,我们通过模型中的阻遏振荡器变化外部葡萄糖水平(20mM至0.001mM)及阻遏系数(n=2~4),以对生长效应和阻遏振荡器行为进行模拟。每次模拟均运行为仅针对一次生成。最后,我们通过变化阻遏物mRNA(0.05~10-5s-1)及蛋白质(0.05~10-5s-1)的降解速度,对生长速度和阻遏振荡器的振荡周期进行了研究。我们以处于两个不同浓度(20mM及0.1mM)的固定外部葡萄糖水平对系统进行了模拟,其中阻遏协同率保持为n=2。表2.本发明模型所使用初始条件一览表3.本发明模型所使用参数一览实施例菌株和培养基使用大肠杆菌Top10(Invitrogen)菌株对所有BioBrick部件的序列进行克隆和测试,所述部件均为上述标准生物部件登录库中的部件。使用标准装配技术构建由受控于所研究启动子的红色荧光蛋白(RFP)组成的系统,该RFP作为报告蛋白。所有本发明构建体均在pBbE8K(美国JBEI)载体上构建,该载体为一种带ColE1复制起点(每细胞约50至70个分子)及卡那霉素抗性标记的高拷贝数质粒。使用补给性基本培养基对构建体进行表征,该基本培养基包括(每1L):M9盐(12.8gNa2HPO4〃7H2O,3gKH2PO4,0.5gNaCl,1gNH4Cl),1MMgSO4,1MCaCl2,0.2%(w/v)酪蛋白氨基酸,30μg/ml卡那霉素,以及作为唯一碳源且变化于20mM至0.1mM的葡萄糖。生长条件和测量将菌种培养物从新鲜转化板转移生长于补充有30μg/ml卡那霉素的LB培养基中,10至12小时过夜生长后,将预培养物接种于稀释100倍的新鲜LB培养基中,以进行2至3小时的指数生长(OD600=0.7~1)。在pBbE8K载体中表征启动子时,将细胞培养物生长于预热的5mLLB培养基中,该培养基置于摇动速度为225rpm且温度为37℃条件下的50mL培养试管中。将该培养试管在冰中保持约5分钟,以停止进一步生长,然后通过在4℃下3300g离心2分钟使其沉淀。沉淀后,将其洗涤,并通过在补充有20mM至0.1mM不同葡萄糖浓度的预热基本培养基中重悬浮的方式将其稀释至OD600=0.1。之后,将培养物以300μL体积的三等分试样转化至透明的平底96孔板中。将该板在37℃下振荡温育8分钟,然后通过测量600nm波长的吸光度监测生长速度,并以SynergyHT酶标仪(Biotek)在激发535nm波长和发射600nm波长下经时测量RFP的方式监测荧光。每10分钟收集时间系列的OD600和RFP数据,总运行时间为6小时。在pBbE8K载体中表征诱导型系统(lasQS器件)时,首先将细胞在LB培养基中过夜生长至稳定生长期,然后在新鲜LB培养基中将其稀释100倍。将稀释后的细胞生长至指数生长期(OD600=1)后,将其洗涤并重悬浮于上述补充有不同葡萄糖浓度(20~0.1mM)的基本培养基中。在进行微板荧光测定前,将N-(3-氧代十二酰基)-L-高丝氨酸内酯(3-Oxo-C12-HSL,Sigma-Aldrich)加至10-7M至10-9M不同摩尔浓度的预培养物(Top10/pTetR-LasR-pLuxR-RFP)中。对细胞培养物进行6小时OD600和RFP荧光测量。类似地,在对转录和翻译抑制剂条件下的生长速度进行表征时,将不同浓度的利福平(12μM,10μM,8μM)和四环素(4μM,2μM,1μM)加至野生型(Top10/E8K)预培养物中。对细胞进行6小时微板测定,以测量其OD600。以上所有实验均以生物学三重复的形式实施。生长速度及RFP表达分析对于每种启动子,均将其三个OD600和RFP数据平均,并从原始测量值中减去背景吸光度(仅含培养基的板孔)及荧光值(Top10/E8K),以获得OD600和RFP的时间系列值。所述测量值得自指数生长中期,而且生长速度计算为OD曲线的时间导数μ=d1n(OD)/dt。启动子活性(每细胞的合成速度)通过d(RFP)/dt/OD600计算。每种所研究启动子的相对启动子单位计算为其中使用的参照启动子为天然大肠杆菌rrnB启动子,该参照启动子的相对启动子单位等于1。虚拟细胞模型该虚拟细胞模型设计成四个单独模块,这些模块定义了代谢、转录、翻译和复制这些关键生物过程及其相互作用,以确定指数生长条件下的细胞组成和生长(图6(A))。我们将此模型设计为具有一定的抽象程度,以对导致主体mRNA和蛋白质的合成以及核糖体、ppGpp(全局调控物)、ATP、氨基酸、核苷酸和DNA的合成的细胞过程进行定义。该模型设计为可在不消耗过度计算成本的同时,对各种葡萄糖浓度,合成电路或转录/翻译抑制的效应进行研究。每个核心模块均含有带不同变量和参数组的ODE,所述变量和参数组取决于其他核心模块。所述核心模块包括不同子模型,这些子模型通过对其方程的平衡及其对输入和输出的连接而在结构上集成于一起。所述模型将葡萄糖作为单一碳源。模拟以循环方式运行,其中,每个所述模块在相同时间步骤内均取决于来自其他模块的变量和参数。基于ODE的所述模型在Maple15中实施,而且各ODE以数字方式连为一体并始自一系列空值和特定初始条件。大肠杆菌虚拟细胞构建中所采取的初始条件为初始浓度为2.1μM的游离RNA聚合酶,游离核糖体=4.1μM等机构。所使用模型参数中的大多数基于最初报道的实验观察值或自文献中数学模型获得的值。模拟中所使用模型和参数的更详细描述见上文。图6(A)为单个虚拟大肠杆菌细胞内子模型的示意图,其中,各子模型分为代谢(蓝色)、转录(绿色)、翻译(红色)和DNA复制(紫色)。所述虚拟细胞摄取外部葡萄糖并将其转化为ATP,该ATP用作合成氨基酸和核苷酸等单体的底物。游离RNA聚合酶与启动子结合,并通过添加核苷酸获得延长,从而合成天然主体mRNA、RNA聚合酶mRNA及rRNA(绿色箭头)。游离核糖体与mRNA结合,并通过添加氨基酸(红色箭头)合成天然主体蛋白质和总RNA聚合酶。该模型中合成的总rRNA和RNA聚合酶分别以动态方式为翻译和转录提供可获得核糖体和RNA聚合酶的条件(点状灰色箭头)。与此同时,还加入DNA合成(紫色箭头)所需的核苷酸,DNA的合成用作该模型的时钟,用于表示倍增时间。重要的是,该模型根据氨基酸库的供应情况合成控制rRNA和DNA合成速度的全局调控物(ppGpp)。图6(B)为细胞生长速度预测流程及图6(A)中每个子模型内各变量之间的相互作用示意图。系统初始化后,代谢子模型摄入外部葡萄糖,并通过大量合成关键细胞成分及DNA、RNA和蛋白质等大分子开始虚拟构建大肠杆菌。系统一直迭代至DNA复制完成,并对倍增时间进行更新,以计算细胞生长速度,并获其该生长速度下的细胞组成。其中,假设外部葡萄糖浓度控制细胞的生长速度。当通过模型内部的质粒表达异源系统时,为了预测对宿主生长速度的影响,须对对单体(点状蓝色箭头)等细胞资源的夺取以及游离RNA聚合酶(点状绿色箭头)和核糖体(点状红色箭头)等机构的水平进行监测。图6(C):对虚拟细胞模型在营养物限制条件下的生长速度预测能力的验证。生长于补充有M9的培养基中且以不同浓度的葡萄糖(20mM至0.1mM)为单一碳源的野生型大肠杆菌Top10的单位生长速度(绿色倒三角)发生下降。暗红色圆点所示为模型的生长预测结果,所得相关系数为|r|=0.985。图6(D):葡萄糖限制条件下每10分钟所测得的OD测量值(600nm)。转录和翻译抑制模型转录和翻译抑制通过酶抑制动力学模型建模。模拟中所使用模型和参数的更详细描述见上文。转录抑制剂(利福平)与游离RNA聚合酶结合,翻译抑制剂(四环素)与游离核糖体结合,使得野生型主体mRNA/蛋白质的转录下降,这又使得ATP的合成发生下降,从而导致生长抑制。模拟中所使用的所有参数示于表2和表3中。合成基因电路模型合成基因电路模型与宿主转录和翻译模型类似。模拟中所使用模型和参数的更详细描述见上文。简言之,游离RNA聚合酶和游离核糖体等宿主机构以及核苷酸和氨基酸等资源用于外源mRNA和蛋白质的合成(图6(B))。各合成电路与所述核心模块连成一体,以抵消合成中消耗的机构和资源。在本研究中,我们使用简单的组成型器件以及lasQS诱导型器件研究营养限制条件下的生长效应。质粒浓度按照之前的研究(24,47)进行计算,而且根据之前已算出的相对启动子单位获得组成型ON启动子的转录速度。在诱导型电路模型情形下,组成型ON启动子生成LasR,而且所述诱导物(AHL)与LasR形成复合物,从而激活下游启动子合成报道基因。每一步骤均表示为从宿主模型获得输入(游离RNA聚合酶/核糖体、氨基酸及核苷酸)的ODE方程以及输出(外源mRNA和蛋白质)。每次模拟均以循环方式运行,以计算DNA浓度的倍增时间,从而推导出细胞生长速度。我们通过实施两个完善的基准电路对本发明模型进行测试,以评价其在所述虚拟细胞内的功能。我们将双稳拨动开关电路(16)选为第一基准电路,该电路由设置于相互抑制网络内的两种可阻遏型启动子组成,而且可使用诱导诱导物对拨动状态进行翻转。作为另一基准电路,我们对阻遏振荡器(17)进行了模拟,其中,第一基因抑制第二基因的转录,第二基因抑制第三基因的转录,而第三基因又反过来阻遏第一基因。这些电路的性能取决于组成型转录启动子的阻遏协同率,以及阻遏物mRNA和蛋白质的转录、翻译速度和降解速度等因素。我们通过变更20mM至0.001mM的外部葡萄糖水平和阻遏协同率(n=2~4)研究所述拨动开关的生长效应及切换阈值,其中各阻遏物保持相同的转录和翻译速度。之后,我们通过变更转录速度,以对拨动开关的双稳性以及虚拟细胞在两种外部葡萄糖水平(20mM和0.1mM)及有无1mM诱导物浓度条件下的生长状况进行研究。对于所述阻遏振荡器,通过变更外部葡萄糖浓度(20mM,0.1mM,0.005mM)和阻遏协同率(n=2~4)以及在相同转录/翻译速度和mRNA/蛋白质降解速度下对电路进行模拟,对生长动力学及范围或周期(峰到峰)进行了研究。此外,还通过改变阻遏物降解速度,确定了振荡周期和两种外部葡萄糖浓度(20mM和0.1mM)下的生长状况。模拟中所使用模型和参数的更详细描述见上文。结果虚拟细胞的建模和构建我们通过将大肠杆菌的总细胞过程分为代谢、转录、翻译和复制四个关键模块,开发出一种综合细胞模型(图6(A))。模型的过程流程和模块间的相互作用示于示意图6(B)。代谢模块130包括葡萄糖摄取速度,ATP合成,氨基酸和核苷酸等单体的合成,大肠杆菌全局调控物及ppGpp形成等变量。由于细胞对葡萄糖的摄取代表着将碳源转化为细胞成分(32)的代谢过程的第一步骤,所述单虚拟细胞模型116具有细胞外葡萄糖浓度输入,该葡萄糖用于ATP形成和后续氨基酸和核苷酸等单体的合成。有人提出,生长速度并不取决于ATP合成速度,而且已证实ATP和其他核苷酸的浓度对生长速度(20)的影响极小。模型中,主体RNA(mRNA和rRNA)及蛋白质合成系统分别置于转录模块134和翻译模块136之下。游离功能性RNA聚合酶通过从单体库提取核苷酸而与启动子转录mRNA和rRNA形成复合物。类似地,游离功能性核糖体通过从代谢模块130所合成的资源库提取氨基酸而与生成主体蛋白质和RNA聚合酶的mRNA形成复合物。该模型中合成的RNA聚合酶和rRNA恒定地供应用于合成主体mRNA和蛋白质的游离RNA聚合酶及游离核糖体。当核糖体活性为次最大值时,或当核糖体的A位点在应急响应期间与有不带电荷的tRNA结合时(20),形成全局调控物132,即ppGpp。ppGpp的作用在于,调控复制过程中的rRNA合成和DNA延长(40,51)。此前的研究试图根据以下两个假设对rRNA表达的调控进行建模:ppGpp和NTP的供应状况控制rrn启动子的活性;其次,这些因素的总体活性基于核糖体翻译导致氨基酸消耗的条件下氨基酸的供应状况(20,21)。本模型沿用此结合上述两假设的调控系统,以研究对生长及其细胞组分的总体效应。复制模块138中的DNA合成从资源库中提取核苷酸,并作为指示细胞倍增时间的计时器,以确定模型中各种细胞组分的生长速度和浓度。可模拟野生型大肠杆菌细胞状态的虚拟细胞模型。通过该虚拟细胞模型,我们确定了野生型虚拟细胞的生长速度和细胞组成,以验证我们是否可以再现实验所测细胞状态。为此,我们采用两种不同的策略对该野生型虚拟细胞模型的预测能力进行评价。首先,我们通过改变外部葡萄糖水平以模拟虚拟细胞,然后通过在不同葡萄糖水平下引入转录和翻译抑制剂而对生长效应进行监测。营养物限制条件每次模拟运行中,模型的外部葡萄糖浓度从20mM变化至0.1mM,而其他参数保持不变,并且获取DNA浓度加倍时间作为虚拟细胞倍增时间,以用于生长速度的推导。之后,我们测量了生长于补充有酪蛋白氨基酸及不同浓度碳源的M9基本培养基内的野生型大肠杆菌的生长曲线(图6(D)),所述不同浓度碳源为从限制水平0.1mM到饱和水平20mM的葡萄糖。当葡萄糖浓度高于5mM时,野生型大肠杆菌的生长速度与葡萄糖浓度的变化无关。随着葡萄糖浓度变化至2.5mM和1mM,生长速度仅发生微小变化(图6(C))。在1mM至20mM的浓度下,细胞以更快的速度指数式生长,从而具有更快的生长速度,但由于外部葡萄糖浓度的供应状况,这些浓度之间生长曲线的饱和情况迥异(图6(D))。葡萄糖浓度越低,曲线饱和越快。在0至0.5mM范围,大肠杆菌的长速度取决于葡萄糖浓度。在0.1mM葡萄糖条件下,生长速度降至每小时0.78倍增倍数(图6(C))。需要注意的是,在指数生长期间,各生长速度下的细胞的大分子组成取决于培养基的营养物含量(24)。实验证据指出,增加培养基中碳源的浓度时,细胞的生长速度变大,这与之前的报道相类似(20,52)。细胞在不同葡萄糖浓度下的预测生长速度及实验所测生长速度示于图6(C),如图所示,预测生长速度与实验数据具有更高相关性(|r|=0.985)。上述模型还可对难以通过实验方法研究的细胞内主要部件的组成进行预测。之前,已有许多研究工作尝试对RNA聚合酶,核糖体和蛋白质合成系统(19,20,48)等各个部件的活性进行预测,本虚拟细胞模型可预测所有此类部件的动力学,例如,总游离RNA聚合酶/核糖体供应状况,天然RNA和主体蛋白质组成,氨基酸和核苷酸的消耗,以及ppGpp在营养物匮乏器件的全局效应。游离RNA聚合酶浓度随生长速度的增大而升高,这与早前的预测研究工作一致(19,53)。在野生型细胞内所预测的游离RNA聚合酶浓度从每小时0.78倍增倍数生长速度下的1.78μM提升至每小时0.96倍增倍数生长速度下的1.96μM(图10(D))。所预测的总RNA聚合酶浓度范围基本上类似于Bremer等人利用基于启动子活性数据评价的模型并针对每小时1.0倍增倍数生长速度所得的7.4μM的预测结果(19)。同样地,在图19中,与先前预测一致,本模型也证明,在较高生长速度下,生长速度的饱和依赖于游离RNA聚合酶浓度(53)。对于野生型细胞,所预测的游离核糖体浓度随生长速度的增大基本保持恒定(图11(D))。已有数据显示,游离核糖体库的大小与蛋白质合成速度成比例,而且各生长速度下的蛋白质浓度保持恒定(24)。在野生型细胞内所预测的游离游离核糖体浓度为每小时0.96倍增倍数生长速度下的2.35μM及每小时0.78倍增倍数生长速度下的2.39μM。生长速度由核糖体和聚合酶等大分子合成机构设定,对该机构的控制基于由小核苷酸ppGpp调控的单体库的供应状况(20)。本发明模型采用上述假设,对根据单体供应状况受控于ppGpp浓度的rRNA合成进行预测。与先前预测结构一致,如图10(E)所示,所计算的rRNA浓度为生长速度的函数且随生长速度(20,24)的加快而增大。本发明模型的预测(图18至图21)重演了之前的实验和模拟发现,即低生长速度下ppGpp浓度增大的原因在于,氨基酸库供应受限,而氨基酸可通过与游离RNA聚合酶结合而对rRNA转录中的合成进行调控(20,54,55)。转录和翻译抑制在此之后,为了验证在转录和翻译此两细胞过程受抑制情况下所预测的生长速度效应,我们以不同剂量的转录抑制剂(利福平)和翻译抑制剂(四环素)对暴露于不同葡萄糖浓度下的野生型大肠杆菌进行测试。在图10(A至C)和图11(A至C)中,我们比较了转录和翻译抑制期间各种亚抑制剂量和葡萄糖浓度下的预测生长速度。当以10μM亚抑制水平的利福平对转录进行抑制时,最大葡萄糖浓度下的生长速度降低量为每小时0.55倍增倍数(图10(A))。与所预期的一致,当利福平浓度降至8μM和6μM时,生长速度分别增大至0.68和0.79每小时倍增倍数。类似地,以4μM亚抑制水平的四环素对翻译进行抑制时,生长速度大幅降低至每小时0.19倍增倍数(图11(A))。在2μM和1μM四环素浓度下,所测生长速度增大至0.38和0.66每小时倍增倍数(图11(B和C))。采用上述抑制剂参数的野生型模型与实验中所观察到的生长速度极其相符,相关性平均高达|r|=0.98。上述模型还可对虚拟细胞分别处于转录(图10(D))抑制和翻译抑制(图19(A))时游离RNA聚合酶浓度的动态响应进行预测。在转录抑制期间,抗生素利福平通过与游离RNA聚合酶特异性结合而阻断RNA的合成(56)。该模型考虑10μM抑制剂浓度下RNA聚合酶与抑制剂的结合情况,预测结果显示,与野生型细胞相比,每小时0.1倍增倍数生长速度下游离RNA聚合酶浓度降低0.88μM,而每小时0.69倍增倍数生长速度下游离RNA聚合酶浓度降低1.54μM(图10(D))。每小时0.76倍增倍数的生长速度下,转录抑制浓度下降6μM时,游离RNA聚合酶浓度的比例增加6%。作为翻译抑制抗生素,四环素通过防止氨酰tRNA与细菌核糖体结合而抑制细菌的蛋白质合成(43)。同样的,在抑制剂浓度为4μM的翻译抑制期间,与野生型细胞相比,所预测的游离RNA聚合酶浓度在每小时0.1倍增倍数生长速度下降低0.91μM,在每小时0.19倍增倍数生长速度下降低1.12μM(图19(A))。此外,需要注意的是,模型所预测的游离RNA聚合酶浓度范围随翻译抑制的减弱而增大。图18(A)和图11(D)所示分别为转录和翻译抑制期间的游离核糖体浓度。在转录和翻译抑制两情形中,该模型预测结果为,游离核糖体浓度在较低生长速度下升高,随生长速度加快而逐渐下降,并在每小时0.5至1.0倍增倍数下保持恒定。本发明模型的此预测结果与如下研究结论相一致:在缓慢生长的细胞中,即较低生长速度下,存在过量的未结合游离核糖体(37)。当以10μM浓度利福平进行转录抑制时,所预测游离核糖体浓度为每小时0.1倍增倍数生长速度下4.24μM及每小时0.69倍增倍数生长速度下2.35μM。类似地,当以4μM浓度四环素进行翻译抑制时,所预测游离核糖体浓度为每小时0.1倍增倍数生长速度下4.01μM及每小时0.19倍增倍数生长速度下3.73μM。此外,转录和翻译抑制使得RNA和蛋白质水平均下降,从而印证了所述抗生素的抑制机制。在较低生长速度下,mRNA和蛋白质水平均较低,而且该此两水平随生长速度的增大而逐渐增大。此外,根据所述模型的预测结果,在转录和翻译抑制期间,因游离RNA聚合酶和核糖体这两种机构形成抑制剂复合物而减少了rRNA的合成,因此rRNA浓度下降(图10(E))。对于翻译抑制期间的蛋白质浓度,当生长速度为每小时0.1至0.5倍增倍数时,蛋白质浓度增加,在每小时0.5倍增倍数及更高生长速度下,蛋白质浓度变为恒定值(图11(E))。模型中的一项令人感兴趣的发现在于,抑制期间,在较低生长速度下,ppGpp和氨基酸浓度较低,而该浓度随rRNA合成的提高而增大(图18(B),图19(B))。例如,在10μM浓度的转录抑制期间,所预测的每小时0.1倍增倍数生长速度下ppGpp浓度为6.78μM。此外,在4μM浓度的翻译抑制期间,所预测的每小时0.1倍增倍数生长速度下ppGpp浓度为0.5μM。这些结果凸显出以下事实:对于缓慢生长的细胞,ppGpp水平因较低的rRNA浓度而受限,并随生长速度的增加而增加,直至因氨基酸库的限制而在每小时0.5倍增倍数下达到阈值(图18(C),图19(C))。因rRNA随生长速度提高而增加,ppGpp水平在每小时0.5倍增倍数下因氨基酸库的供应增加而下降。异源电路对宿主细胞行为的影响在野生型虚拟细胞模型得到验证之后,我们希望通过在不同外部葡萄糖浓度下以组成型和诱导型系统表达非必要蛋白的方式确定其对大肠杆菌生长的影响。组成型基因表达在实验分析中,我们对在暴露于一系列葡萄糖浓度的条件下以不同强度的各种组成型ON启动子对携带pBbE8K的大肠杆菌内的报告蛋白RFP进行表达时的结果进行了研究。我们以每10分钟一次的时间分辨率,对该动态表达进行6小时监测。我们发现,在营养物限制条件下的指数生长期间,无论葡萄糖水平为何,启动子均具有中等活性(相对于其强度),然而在稳定生长或缓慢生长条件下,表达突然增加。当降低葡萄糖水平时,RFP表达水平因葡萄糖供应量较低而下降(图22)。在所测试的各种启动子中,如图4(B)所示,P67启动子所导致的表达量最大,其后为rrnB和J23105启动子。如上所述,启动子活性通过基于OD600的RFP合成速度测量。如图10(C~E)所示,启动子强度的增加导致细胞生长的减弱,而且由于外部葡萄糖水平的降低,与野生型细胞相比,生长速度进一步停滞。当暴露于最大葡萄糖浓度下时,低强度启动子(J23105)导致生长速度下降4%,而中等强度启动子(rrnBp)和高强度启动子(P67)使得生长速度下降16%和21%。本发明虚拟细胞模型以J23105启动子为|r|=0.988且rrnBp和P67启动子均为|r|=0.943的高相关性实现了实验结果的重现。如图20(A)所示,在异源表达情况下,细胞资源的负载量较大,对生长具有影响,因此使得游离RNA聚合酶浓度随组成型启动子强度的增大而降低。对于低强度启动子的异源表达,与野生型细胞相比,所预测的游离RNA聚合酶浓度在每小时0.57倍增倍数的生长速度及最低葡萄糖浓度下大幅下降1.28μM,在每小时0.92倍增倍数的生长速度及最高葡萄糖浓度下大幅下降1.8μM。对于中等强度启动子,所预测的游离RNA聚合酶浓度在每小时0.54倍增倍数的生长速度下下降1.18μM,在每小时0.91倍增倍数的生长速度下下降1.79。对于高强度启动子,与野生型细胞相比,所预测的游离RNA聚合酶浓度的下降幅度更大,为每小时0.54倍增倍数的生长速度下1.14μM,及每小时0.88倍增倍数的生长速度下1.79μM。图12所示为在营养物限制条件下通过组成型表达基因生产非必要蛋白时对生长的影响的预测和实测结果。(A):使用三种具有不同启动子强度的组成型ON启动子(获取自BioBricks部件库的J23105,rrnBp和P67)表达不同水平的RFP(红色箭头)。J23105为低强度启动子(相对启动子单位=0.3),其后为中等强度的rrnBp启动子(天然rRNA启动子)及高强度启动子P67(相对启动子单位=1.4),该rrnBp启动子为相对启动子单位为1.00的标准启动子。(B):根据组成型启动子的表达特征(记为RFP/OD600)对其进行的表征。(C~E):低强度启动子(J23105),中等强度启动子(rrnBp)和高强度启动子(P67)表达所致生长速度下降。数据收集自生长于补充有不同葡萄糖浓度(20mM至0.1mM)的M9培养基中的细胞,该细胞携带内置具有不同启动子强度的组成型器件的质粒。模型预测结果(深绿色圆点(J23105),深蓝色圆点(rrnBp)以及黑色圆点(P67))与实验所测生长速度(浅绿色倒三角(J23105),浅蓝色倒三角(rrnBp)和红色倒三角(P67))具有良好的一致性,平均|r|=0.966。(F)本发明模型所预测组成型基因表达期间的游离核糖体浓度。当在宿主中引入异源表达后,预测结果为,游离核糖体浓度较图12(F)所示野生型细胞状态为低。有人提出,游离核糖体浓度为决定给定mRNA翻译产率的主要限制因素(37)。对于低强度启动子,游离核糖体浓度在每小时0.92倍增倍数的生长速度下降至36%。对于中等和高强度启动子,游离核糖体浓度在每小时0.91和0.88倍增倍数的生长速度下降低49%和65%。诱导型基因表达本研究中使用的lasQS器件包括三个关键部件(图5(A)):AHL合成酶LasI,转录因子LasR及lasI启动子。LasI生成信号分子3-O-C12-HSL(或AHL),且LasR-AHL复合物激活lasI启动子。首先,为了检验lasQS器件的特性,我们利用获取自BioBrick部件库(www.partregistry.org/Part:pSB1K3)的σ-70启动子J23105对LasR进行组成型表达。该器件的活性以红色荧光蛋白(RFP)指示,该蛋白置于lasI启动子的控制下。含有该lasQS器件的大肠杆菌外源性地暴露于10-9M至10-7M的AHL浓度及各种葡萄糖浓度下。图13所示为在营养物限制条件下通过诱导型表达基因生产非必要蛋白时对生长的影响的预测和实测结果。(A):由组成型表达LasR的启动子(J23105)组成的诱导型器件。LasR与诱导物AHL(3OC12HSL)结合后形成复合物LasR-3OC12HSL,该复合物激活lasI启动子,从而导致报告蛋白RFP的生成(红色箭头)。所有构建体都由带卡那霉素抗性(黄色箭头)的中等拷贝数质粒pBbE8K(绿色框)携带。(B)以不同诱导物浓度对所述诱导型电路进行表征后所得的表达特性,记为RFP/OD600。(C~E)以不同AHL(诱导物)浓度异源表达诱导型器件所致的生长速度下降。数据收集自生长于补充有不同葡萄糖浓度(20mM至0.1mM)及不同AHL(诱导物)浓度水平(10-7M至10-9M)的M9培养基中的细胞,该细胞携带内置诱导型器件的质粒。本发明模型预测结果(深红色圆点(10-7MAHL),深绿色圆点(10-8MAHL)以及深蓝色圆点(10-9MAHL))与实验所测因营养物限制而导致的诱导型基因表达的生长速度依赖性(绿色倒三角(10-7MAHL),浅绿色倒三角(10-8MAHL)和浅蓝色倒三角(10-9MAHL))具有良好的一致性,平均|r|=0.976。(F)本发明模型所预测诱导型基因表达期间的游离核糖体浓度。如图23所示,当增加AHL浓度时,RFP表达的输出持续增加。当AHL浓度为10-7M时,所测RFP表达水平增大,一旦AHL浓度达到其纳摩尔阈值时,输出表达达到最低(图13(B))。类似地,在指数生长期间,RFP表达水平中等(相对于诱导物水平)且与葡萄糖水平无关,然而在稳定生长或缓慢生长条件下,表达水平突然增大。如图13(C~E)所示,AHL浓度越高,细胞生长速度越低。在葡萄糖浓度为20mM的条件下,当AHL诱导浓度为10-7M时,生长速度下降率为23%,而当AHL浓度为10-8M和10-9M时,其下降至13%和7%。该模型可对不同诱导物和葡萄糖浓度下的累积生长速度下降量进行预测,平均相关性高达|r|=0.976。类似地,当在带可导致最高表达水平的诱导型器件的宿主中使用较高的AHL浓度时,可观察到游离RNA聚合酶浓度发生最大程度的下降,且诱导型启动子的诱导物浓度上升(图19(B))。相应地,在低AHL水平下,所预测的游离核糖体浓度在每小时0.92倍增倍数的生长速度下下降36%。根据预测结果,在10-8M和10-7M两较高AHL浓度下,游离核糖体浓度发生66%和71%的最大程度下降。早前的研究已表明,异源蛋白质的表达可夺取游离核糖体,从而降低天然细胞中功能性核糖体的数量,并减少其他天然蛋白质的表达(9,57)。模型的实施为了演示上述虚拟细胞模型的使用情况,我们在本发明建模框架中实施并测试了双稳拨动开关和阻遏振荡器这两种完善的合成基因电路。其主旨在于识别可调实验参数,以获得上述两电路的动态行为。双稳拨动开关图14所示为生长速度对双稳拨动开关电路和诱发阈值的影响的预测结果。(A~C)各图所示为不同阻遏协同率(n=2(A),n=3(B),n=4(C))下的拨动开关动力学。所运行的模拟中,阻遏物mRNA和蛋白质的合成速度和降解速度相互平衡。活性阻遏物1的初始条件高于其相对阻遏物2,因此完全抑制其下游表达。(D)在系统诱发后,在固定阻遏协同率(n=2)及外部葡萄糖=20mM条件下,所述拨动开关以半不连续方式切换至较高状态(合成相对阻遏物2并抑制活性阻遏物1)。此状态在较高诱导物水平下一直保持。上述拨动开关系统由两个相互阻遏的阻遏物基因(组成型启动子)组成。在该系统中,当不存在诱导物时,可实现两种稳定状态:启动子1转录阻遏物1,且启动子2转录阻遏物2。通过瞬时引入当前活性阻遏物的诱导物,可在此两状态间切换。该诱导物允许相对阻遏物的积极转录,直至之前处于活性状态下的阻遏物得到稳定阻遏(16)。我们通过在变更外部葡萄糖浓度和阻遏系数(n≥2)的同时将各阻遏物的转录/翻译速度和降解速度保持于相近值的方式,对所述拨动开关电路的功能进行了测试。该模型显示,在生长速度因营养限制条件而降低的同时,阻遏物浓度也发生下降,而且在所有的生长速度下,活性阻遏物1完全阻遏相对阻遏物2的合成(图14(A~C))。随后,我们通过提高阻遏系数(n≥2)研究拨动开关的活性,而且在更高n值下观察到阻遏程度的最大提升(图14(A~C)。已有证据表明,降低阻遏协同率将使得双稳区域的大小变小(16)。理想地,当在模型中引入可改变两启动子之间动态平衡的诱导物时,所述拨动系统进入单稳状态。我们通过引入不同浓度的诱导物以恢复活性阻遏物阻遏功能的方式对此进行了测试。在诱导物浓度到达10μM之前,所述拨动开关的诱发曲线未受到任何影响,而在10μM的点上,该曲线穿过分叉点并以半不连续的方式跳至更高的表达速度(图14(D))。此拨动电路行为中的切换阈值与实验结果一致,而且该实验结果表现出类似趋势(16)。类似地,我们通过改变两种阻遏物的转录速度及外部葡萄糖浓度(20mM和0.1mM)对上述拨动开关的行为及宿主细胞的生长速度进行了测试(图15)。图15为不同转录速度下的双稳状况示意图。(A~D)模拟中,外部葡萄糖保持为等于20mM。(E~H)模拟中,外部葡萄糖保持为等于0.1mM。(A)和(E):在分别使用20mM和0.1mM外部葡萄糖的条件下,变更两种阻遏物转录速度时的生长效应。(B)和(F):在给定葡萄糖浓度下变更阻遏物转录速度时的阻遏物水平。(C)和(G):当分别以20mM和0.1mM的外部葡萄糖诱发且变更两种阻遏物转录速度时的生长效应。在模拟中使用的诱导物浓度为1mM。(D)和(H):20mM和0.1mM葡萄糖及不同阻遏物转录速度下稳定状况和转换动力学。图中刻度表示阻遏物水平。在高低外部葡萄糖浓度下,任何阻遏物的转录速度越快,对相对阻遏物进行阻遏的相应阻遏物的合成速度就越快(图15)。在较高葡萄糖浓度下,生长曲面从每小时0.96倍增倍数小幅下降至每小时0.94倍增倍数。该生长速度的下降发生于较高的阻遏物转录速度下,在该速度下,由于合成的增加而消耗更多的资源。在低外部葡萄糖浓度情况下,由于有限的资源及拨动开关系统导致的负担,生长曲面的下降更为陡峭。令人感兴趣的是,生长曲面在两种阻遏物处于较高的不相等转录速度下时产生多个不连续的离峰。此结果的原因在于,阻遏物因转录速度不相等而发生相互阻遏,该相互阻遏的反平衡效应使得细胞生长得以恢复。诱发后,在较高的阻遏物2转录速度下,活性阻遏物1被完全抑制,此拨动状态一直持续至阻遏物2的转录速度变得极低。在上述两种外部葡萄糖浓度下,宿主的生长状况均发生变化,从而导致在较高的阻遏物2转录速度下,生长速度较低。阻遏振荡器在此之后,我们对阻遏振荡器进行模拟,该振荡器为一种由三个阻遏物基因组成的环形振荡器,其中,第一阻遏蛋白抑制第二阻遏蛋白的转录,第二阻遏蛋白抑制第三阻遏蛋白的转录,而该第三阻遏蛋白反过来抑制第一阻遏蛋白的转录。首先,通过改变外部葡萄糖浓度和阻遏强度(希尔系数,n)分析所述对称阻遏振荡器的行为,即三个阻遏物基因具有相同的mRNA和蛋白质转录/翻译速度和降解速度。结果显示,该对称阻遏振荡器在生长速度下降时振荡行为增加,而且根据峰间间隔分布计算的周期范围大小随生长速度的增大而增大(图16)。图16所示为不同生长条件下所预测的阻遏振荡器动力学。模型所得为第三阻遏蛋白水平的振荡。针对三个不同阻遏协同率值,在不同葡萄糖浓度的虚拟细胞内对所述阻遏振荡器进行模拟,以研究其生长效应及振荡行为(根据峰间间隔分布计算)。每次模拟均运行1000分钟。此外,当增大阻遏系数(n≥2)时,由于阻遏性能提升,峰间间隔增大(振荡行为变少)且细胞生长速度降低。所预测的阻遏振荡器行为,即平均峰间分布为160±40分钟左右,这与Elowitz等人的实验数据非常一致(17)。我们注意到,在较高的葡萄糖浓度下,所述阻遏振荡器并不影响细胞的生长,这主要是因为其相互阻遏作用较强,而且积累程度因降解速度较快而更低。在低葡萄糖水平下,生长速度因营养限制而变慢,另一方面,阻遏振荡器特性的改变(抑制系数增大)也使得细胞生长速度下降。这一观察结果说明,宿主细胞的状态不仅受外部环境干扰,而且还受到所使用电路的物理特性的干扰。在此之后,我们使用上述模型对mRNA和阻遏蛋白降解速度变化时的影响进行了研究(图17)。如图17所示,生长速度和对称阻遏振荡器的振荡周期随降解速度显著变化。(A)和(C):20mM和0.1mM的外部葡萄糖浓度下,不同阻遏物mRNA和蛋白质降解速度对生长的影响。(B)和(D):不同阻遏物降解速度对应的振荡周期。每次模拟均运行1000分钟,并计算总振荡数。图中刻度表示1000分钟时间内的振荡数。我们在不同外部葡萄糖浓度下对上述模型进行了模拟。当外部葡萄糖浓度较高时,细胞(类似于野生型大肠杆菌)生长速度在一系列较快的mRNA和蛋白质降解速度下保持稳定;当降解速度较低时,细胞生长因较高的非必要mRNA/蛋白质累积而承受负担。根据上述模型的预测结果,降解速度较快时,振荡周期较高,而当降解速度降低时,振荡状态消失。我们发现,在类似的参数设置情况下,外部葡萄糖浓度较高时,细胞生长较快(每小时0.96倍增倍数),外部葡萄糖浓度较低时,细胞生长较慢(每小时0.79倍增倍数)。与上述情况类似,该模型显示,在低葡萄糖浓度及高降解速度下,生长曲面较为稳定。我们发现,即使在较低生长速度下,振荡周期仍保持稳定,但是在较慢降解速度下,细胞生长速度从每小时0.75倍增倍数快速大幅下降至每小时0.5倍增倍数。以上展示的宿主细胞模拟系统和方法的实施方式具有可加速对合成电路行为及合成电路在宿主细胞环境内影响的预测的优点。有利地,所述宿主细胞模拟系统可正确预测宿主系统行为,从而可使工程师以较少的实验试错快速地对不同合成电路进行测试并观察细胞行为。如此,通过整合宿主细胞生理学,可实现合成电路的精确设计和优化,从而最终有助于更好地理解其相互关系及改善生物设计周期。如上所述,在一些实施方式中,所述宿主细胞模拟方法和系统通过ODE实现。然而,在一些实施方式中,通过标准输入和输出对虚拟细胞(宿主)和基因电路(载体)进行模块化的做法可能更为有利。如上所述,这些输入和输出包括聚合酶、核糖体等细胞资源。除了直接修改ODE之外,还可通过框图将所述宿主和基因电路可视化,并且可例如通过图形设计部件102和模拟控制部件104将不同模块相互连接。通过这种方式,可将上述基因电路以标准化的方式“连接”至宿主细胞。如此,可实现模型的重复利用,从而更为有效。因此,可通过构建此类基因电路的标准化模型库的方式促进基因电路的后续设计和建模。参考文献1.LeeGN,NaJ(2013),合成生物学的影响;ACS合成生物学,2(5):210~212。2.KhalilAS,CollinsJJ(2010),合成生物学:应用时代来临;自然综述:遗传学,11(5):367~379。3.TavassoliA,(2010)合成生物学;有机与生物分子化学,8(1):24~28。4.BoylePM,SilverPA(2012),部件加管道:代谢工程的合成生物学方法,代谢工程,14(3):223~232。5.RolliéS,MangoldM,SundmacherK(2012),生物系统设计:系统工程学与合成生物学的碰撞,化学工程科学,69(1):1~29。6.CardinaleS,ArkinAP(2012),合成生物学背景的情景化——找出合成生物系统失败的原因,生物技术杂志,7(7):856~866。7.KlumppS,ZhangZ,HwaT(2009),细胞中对基因表达的生长速度依赖性全局效应,细胞:139(7):1366~1375。8.ShachraiI,ZaslaverA,AlonU,DekelE(2010),指数生长若干代后大肠杆菌的非必要蛋白质成本下降,分子细胞,38(5):758~767。9.DongH,NilssonL,KurlandCG(1995),大肠杆菌基因的无端过表达导致生长抑制和核糖体降解,细菌学杂志,177(6):1497~1504。10.PurcellO,JainB,KarrJR,CovertMW,LuTK(2013),合成生物学的全细胞模型建模方法初探,混沌,23(2)。11.ChandranD,CopelandWB,SleightSC,SauroHM(2008),数学建模与合成生物学,今日药物发现:疾病模型,5(4):299~309。12.MarguetP,TanouchiY,SpitzE,SmithC,YouL(2010),最小细菌自杀电路的振荡行为揭示宿主电路生理学的隐藏事实,公共科学图书馆·综合,5(7):e11909。13.CarreraJ,RodrigoG,SinghV,KirovB,JaramilloA(2011),合成基因表达的细菌响应经验模型和体内表征显示核糖体分配限制生长速度,生物技术杂志,6(7):773~783。14.KarrJR等(2012),根据基因型预测表型的全细胞计算模型,细胞,150(2):389~401。15.GramelsbergerG(2013),合成生物学中的模拟方法,历史与科学哲学研究C卷:历史与生物及生物医学科学哲学研究,44(2):150~157。16.GardnerTS,CantorCR,CollinsJJ(2000),大肠杆菌内基因拨动开关的构建,自然,403(6767):339~342。17.ElowitzMB,LeiblerS(2000),转录调控物的合成振荡网络,自然,403(6767):335~338。18.MarchisioMA,StellingJ(2008),籍于籍助于可组合部件的合成基因电路计算设计,生物信息学,24(17):1903~1910。19.BremerH,DennisP,EhrenbergM(2003),大肠杆菌内的游离RNA聚合酶和全局转录建模,生物化学,85(6):597~609。20.MarrAG(1991),大肠杆菌的生长速度,微生物学综述,55(2):316~333。21.DennisPP,EhrenbergM,BremerH(2004),大肠杆菌内的rRNA合成控制:一种系统生物学方法,微生物学与分子生物学综述(MMBR),68(4):639~668。22.ShepherdN,DennisP,BremerH(2001),大肠杆菌内的细胞质RNA聚合酶,细菌学杂志,183(8):2527~2534。23.LewinB(2000),基因VII(英国牛津大学出版社).24.BremerH,Dennis,P.P.(1996),大肠杆菌与沙门氏菌(华盛顿美国微生物学会出版社)第二版。25.MuiseO,HollerE(1985),大肠杆菌DNA聚合酶I与核苷酸的相互作用:单链多核苷酸均聚物的拮抗作用,生物化学,24(14):3618~3622。26.CondonC,SquiresC,SquiresCL(1995),大肠杆菌内的rRNA转录控制,微生物学综述,59(4):623~645。27.WagnerR(2002),大肠杆菌内的核糖体RNA合成调控:全局调控物鸟苷四磷酸(ppGpp)的作用,分子微生物学与生物技术杂志,4(3):331~340。28.BremerH,BaracchiniE,LittleR,RyalsJ(1987),翻译基因学:新方法),14卷,14页。29.GausingK(1974),大肠杆菌内的核糖体蛋白质:不同生长速度下的合成速度及库的大小,分子普通遗传学,129(1):61~75。30.NomuraM(1999),大肠杆菌和酿酒酵母内的核糖体生物合成调控:多样性和共同原则,细菌学杂志,181(22):6857~6864。31.DomachmM,LeungSK,CahnRE,CocksGG,ShulerML(1984),大肠杆菌B/r-A单细胞葡萄糖受限生长的计算机模型,生物技术与生物工程,26(3):203~216。32.NatarajanA,SriencF(1999),大肠杆菌单细胞的葡萄糖摄取动力学,代谢工程,1(4):320~333。33.NatarajanA,SriencF(2000),生长于葡萄糖受限恒化培养物中的大肠杆菌单细胞葡萄糖摄取速度,微生物学方法杂志,42(1):87~96。34.VarmaA,BoeschBW,PalssonBO(1993),各种氧合速率下大肠杆菌葡萄糖代谢的化学计量分析,应用与环境微生物学,59(8):2465~2473。35.PedrenoS,PiscoJP,Larrouy-MaumusG,KellyG,deCarvalhoLP(2012),ATP磷酸核糖转移酶的反馈变构抑制机制,生物化学,51(40):8027~8038。36.SchneiderDA,GourseRL(2004),大肠杆菌生长速度与ATP浓度之间的关系:细胞ATP供应状况的生物测定,生物化学杂志,279(9):8262~8268。37.JensenKF,PedersenS(1990),大肠杆菌内的代谢生长速度可能是带底物和催化部件的大分子生物合成装置的亚饱和所导致的结果,微生物学综述,54(2):89~100。38.KatayamaT(2001),反馈控制抑制大肠杆菌染色体复制的启动,分子微生物学,41(1):9~17。39.PotrykusK&CashelM(2008),(p)ppGpp:依然如此神奇吗?,微生物学年度综述,62:35~51。40.DenapoliJ,TehranchiAK,WangJD(2013),大肠杆菌和枯草芽孢杆菌内(p)ppGpp所导致的复制延长速度的剂量依赖性下降,分子微生物学,88(1):93~104。41.CooperS,HelmstetterCE(1968),大肠杆菌B/r的染色体复制和分裂周期,分子生物学杂志,31(3):519~540。42.KassavetisGA,KayaKM,ChamberlinMJ(1978),结合于启动子位点的大肠杆菌RNA聚合酶/利福平复合物阻止大肠杆菌/RNA聚合酶和T7特异性RNA聚合酶对RNA链的延长,生物化学,17(26):5798~5804。43.ChopraI,RobertsM(2001),四环素抗生素:作用方式,应用,分子生物学和细菌耐药流行病学,微生物学与分子生物学综述(MMBR),65(2):232~260;第二页目录。44.WehrliW(1977),利福平和大肠杆菌DNA依赖性RNA聚合酶间相互作用的动力学研究,欧洲生物化学杂志/FEBS,80(2):325~330。45.OlsonMW等(2006),替加环素抗细菌活性的功能,生物物理和结构基础,抗菌剂与化疗,50(6):2156~2166。46.KellyJR等(2009),利用体内参考标准测量BioBrick启动子的活性,生物工程杂志,3:4。47.KlumppS(2011),生长速度依赖性揭示质粒拷贝数控制的设计原理,公共科学图书馆·综合,(5):e20403。48.TadmorAD,TlustyT(2008),大肠杆菌的粗粒生物物理模型及其在干扰rRNA操纵子拷贝数中的应用,公共科学图书馆·计算生物学,4(4):e1000038。49.ThomenP等(2008),通过力测量值变化的辅因子浓度研究T7RNA聚合酶,生物物理杂志,95(5):2423~2433。50.GaoYQ,YangW,KarplusM(2006),第13章——F0F1-ATP酶的热力学和动力学分析,现代理论生物高分子物理化学方法,StarikovEB,LewisJP,TanakaS编(阿姆斯特丹爱思唯尔科学公司),pp249~XVI。51.MagnussonLU,FarewellA,NystromT(2005),ppGpp:大肠杆菌内的全局调控物,微生物学进展,13(5):236~242。52.ShehataTE,MarrAG(1971),营养浓度对大肠杆菌生长的影响,细菌学杂志,107(1):210~216。53.KlumppS,HwaT(2008),细菌内RNA聚合酶的生长速度依赖性分配,美国国家科学院院刊,105(51):20245~20250。54.DalebrouxZD,SwansonMS(2012),ppGpp:比RNA聚合酶还神奇,自然综述:微生物学,10(3):203~212。55.MurrayHD,SchneiderDA,GourseRL(2003),小分子对rRNA表达的控制为动态非冗余控制,分子细胞,12(1):125~134。56.CampbellEA等(2001),细菌RNA聚合酶的利福平抑制结构机制,细胞,104(6):901-912。57.VindJ,SorensenMA,RasmussenMD,PedersenS(1993),大肠杆菌内的蛋白质合成受限于游离核糖体浓度:报告基因的表达并不总反映功能性mRNA水平,分子生物学杂志,231(3):678~688。58.SrivatsanA,WangJD(2008),(p)ppGpp的细菌转录,翻译和复制控制,当前微生物学观点,11(2):100~105。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1