图像数据处理方法、装置及设备与流程
本申请涉及图像处理技术领域,尤其涉及一种图像数据处理方法、装置及设备。
背景技术:
为了辅助医生对结节进行诊断与筛查,相关平台提供了计算机辅助诊断系统,医生根据该系统的处理结果不能直接得出疾病的诊断结果或健康状况,但是可以作为一项参考数据。
相关计算机辅助诊断系统,可以对肺部医学图像进行预处理,再检测出预处理后的肺部医学图像中,可能疑似结节的组织(本申请称为候选结节),然后,根据候选结节在肺部医学图像中的形状、面积、体积等形态特征中的一项或多项,筛选出假阳性的候选结节。这里的假阳性指实际不具备结节症状特征的组织被检测为候选结节的情况。
相关计算机辅助诊断系统进行假阳性筛选后,虽然对医生进一步综合判断筛选后的候选结节的属性有一定的帮助。但是,实际的医疗诊断过程中,结节本身的判断过程非常复杂,除结节的形态特征外,还需要结合结节与血管的伴生关系、医生的临床经验等其他很多因素(这些因素因被检对象情况或临床医生而异)。可是相关计算机辅助诊断系统难以检测出结节与血管的伴生关系。
技术实现要素:
本申请提供一种医学图像处理方法、装置及设备,以解决相关计算机辅助诊断系统难以检测出结节与血管的伴生关系的问题。
根据本申请实施例的第一方面,提供一种图像数据处理方法,包括步骤:
获取肺部医学图像中被检测到的候选结节的像素位置;
获取所述肺部医学图像中被检测到的血管组织的像素位置;
基于所获取的像素位置,在同一坐标系中构建用于体现所述血管组织的空间特征的管状模型,及用于体现所述候选结节的空间特征的壳体模型;
通过定位所述壳体模型与所述管状模型,得到所述候选结节与所述血管组织的位置关系。
在一个实施例中,获取肺部医学图像中被检测到的候选结节的像素位置前,所述方法还包括:
初步检测所述肺部医学图像中的结节;
将初步检测的结节区分为假阳性结节与候选结节。
在一个实施例中,初步检测所述肺部医学图像中的结节,包括:
从所述肺部医学图像分割出肺部的左肺与右肺;
对所述左肺与所述右肺中的每个像素点分别构建海森矩阵,并获得所述海森矩阵的特征值;
基于所述海森矩阵的特征值,初步检测所述肺部医学图像中的结节。
在一个实施例中,将初步检测的结节区分为假阳性结节与候选结节,包括:
计算初步检测的结节的最小外接矩形;
根据所述最小外接矩形的长宽比,将初步检测的结节区分为假阳性结节与候选结节。
在一个实施例中,获取肺部医学图像中被检测到的候选结节的像素位置,包括:
确定所述候选结节的几何中心;
计算所述候选结节的每个像素与所述几何中心的距离;
基于所述候选结节的每个像素与所述几何中心的距离,计算出所述候选结节的最小直径与最大直径。
在一个实施例中,获取所述肺部医学图像中被检测到的血管组织的像素位置,包括:
从所述肺部医学图像分割出肺部的左肺与右肺;
基于frangi多尺度滤波器,为所述左肺与所述右肺中每个像素点构建海森矩阵,并获得每个像素点的海森矩阵的三个特征值λ1、λ2和λ3,且|λ1|≤|λ2|≤|λ3|;
获取三个特征值满足如下条件的像素点的位置坐标,为血管组织在所述肺部图像中的位置坐标:
λ1约等于0,λ2约等于λ3,λ3小于0,且|λ1|≤|λ2|;
根据血管组织中像素点的特征值λ1的特征向量,确定血管组织的方向。
在一个实施例中,所述壳体模型的外形为球形或椭球形。
在一个实施例中,所述壳体模型包括内壳体与包络在所述内壳体外围的外壳体;所述内壳体的直径与所述候选结节的最小直径匹配,所述外壳体的直径与所述候选结节的最大直径匹配。
在一个实施例中,通过定位所述壳体模型与所述管状模型,得到所述候选结节与所述血管组织的位置关系,包括:
在所述外壳体与所述内壳体上定位并标记与所述管状模型的相交点;
通过墨卡托投影算法,将标记相交点后的所述内壳体与所述外壳体分别投影成圆柱,并将投影成的圆柱展开,得到两个矩形平面;
通过分别查找两个矩形平面中被标记的点,统计每个矩形平面含有的标记区的个数;所述标记区为查找到的点构成的环形区域;
根据每个矩形平面含有的标记区的个数,确定所述候选结节与所述血管组织的位置关系。
在一个实施例中,在确定所述候选结节与所述血管组织的位置关系前,所述方法还包括:
通过hessian矩阵判定每个标记区在三维空间的几何特征,与所述血管组织的横截面是否匹配;如果不匹配,则舍弃该标记区。
根据本申请实施例的第二方面,提供一种图像数据处理装置,包括:
结节定位模块,用于获取肺部医学图像中被检测到的候选结节的像素位置;
血管定位模块,用于获取所述肺部医学图像中被检测到的血管组织的像素位置;
模型构建模块,用于基于所获取的像素位置,在同一坐标系中构建用于体现所述血管组织的空间特征的管状模型,及用于体现所述候选结节的空间特征的壳体模型;
关系确定模块,用于通过定位所述壳体模型与所述管状模型,得到所述候选结节与所述血管组织的位置关系。
在一个实施例中,所述装置包括:
结节初检模块,用于初步检测所述肺部医学图像中的结节;
结节区分模块,用于将初步检测的结节区分为假阳性结节与候选结节。
在一个实施例中,所述结节初检模块还被配置为:
从所述肺部医学图像分割出肺部的左肺与右肺;
对所述左肺与所述右肺中的每个像素点分别构建海森矩阵,并获得所述海森矩阵的特征值;
基于所述海森矩阵的特征值,初步检测所述肺部医学图像中的结节。
在一个实施例中,所述结节区分模块还被配置为:
计算初步检测的结节的最小外接矩形;
根据所述最小外接矩形的长宽比,将初步检测的结节区分为假阳性结节与候选结节。
在一个实施例中,所述结节定位模块还被配置为:
确定所述候选结节的几何中心;
计算所述候选结节的每个像素与所述几何中心的距离;
基于所述候选结节的每个像素与所述几何中心的距离,计算出所述候选结节的最小直径与最大直径。
在一个实施例中,所述血管定位模块还被配置为:
从所述肺部医学图像分割出肺部的左肺与右肺;
基于frangi多尺度滤波器,为所述左肺与所述右肺中每个像素点构建海森矩阵,并获得每个像素点的海森矩阵的三个特征值λ1、λ2和λ3,且|λ1|≤|λ2|≤|λ3|;
获取三个特征值满足如下条件的像素点的位置坐标,为血管组织在所述肺部图像中的位置坐标:
λ1约等于0,λ2约等于λ3,λ3小于0,且|λ1|≤|λ2|;
根据血管组织中像素点的特征值λ1的特征向量,确定血管组织的方向。
在一个实施例中,所述壳体模型的外形为球形或椭球形。
在一个实施例中,所述壳体模型包括内壳体与包络在所述内壳体外围的外壳体;所述内壳体的直径与所述候选结节的最小直径匹配,所述外壳体的直径与所述候选结节的最大直径匹配。
在一个实施例中,所述关系确定模块被配置为:
在所述外壳体与所述内壳体上定位并标记与所述管状模型的相交点;
通过墨卡托投影算法,将标记相交点后的所述内壳体与所述外壳体分别投影成圆柱,并将投影成的圆柱展开,得到两个矩形平面;
通过分别查找两个矩形平面中被标记的点,统计每个矩形平面含有的标记区的个数;所述标记区为查找到的点构成的环形区域;
根据每个矩形平面含有的标记区的个数,确定所述候选结节与所述血管组织的位置关系。
在一个实施例中,所述关系确定模块被配置为:
在确定所述候选结节与所述血管组织的位置关系前,通过hessian矩阵判定每个标记区在三维空间的几何特征,与所述血管组织的横截面是否匹配;如果不匹配,则舍弃该标记区。
根据本申请实施例的第三方面,提供一种计算机设备,包括:
处理器;
存储处理器可执行指令的存储器;
其中,所述处理器耦合于所述存储器,用于读取所述存储器存储的程序指令,并作为响应,执行如上所述方法中的操作。
根据本申请实施例的第四方面,提供一个或多个机器可读存储介质,其上存储有指令,当由一个或多个处理器执行时,使得计算机设备执行如上所述方法中的操作。
应用本申请实施例,通过定位候选结节与血管组织在肺部医学图像中的像素位置;在同一坐标系中构建用于体现所述血管组织的空间特征的管状模型,及用于体现所述候选结节的空间特征的壳体模型;然后鉴于壳体模型与管状模型在同一坐标系,且分别能提现候选结节与血管组织的空间特征,可以通过定位所述壳体模型与所述管状模型,得到所述候选结节与所述血管组织的位置关系。
进而,应用到医生诊断候选结节属性的场景下,能作为中间结果,由医生结合难以预知的其他因素对候选结节的属性进行综合判断。
应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本申请。
附图说明
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本申请的实施例,并与说明书一起用于解释本申请的原理。
图1a与图1b是本申请一示例性实施例示出的ct系统的结构示意图;
图2a是本申请一示例性实施例示出的图像数据处理方法的流程图;
图2b至图2e是本申请一示例性实施例示出的结节与血管的伴生关系图;
图2f是本申请一示例性实施例示出的壳体模型的示意图;
图3a是本申请另一示例性实施例示出的图像数据处理方法的流程图;
图3b至图3c是本申请另一示例性实施例示出的结节与血管的伴生关系图;
图3d至图3e是本申请一示例性实施例示出的壳体模型与管状模型的相交点的示意图;
图4是本申请一示例性实施例示出的计算机设备的硬件结构示意图;
图5是本申请一示例性实施例示出的图像数据处理装置的框图。
具体实施方式
在本申请使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本申请。在本申请和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。还应当理解,本文中使用的术语“和/或”是指并包含一个或多个相关联的列出项目的任何或所有可能组合。
在医学领域,肺部疾病已逐渐成为严重威胁人类生命健康的病症。其中肺癌以其不易发现,而发现后不易治疗,死亡率高等特点已成为癌症中非常大的威胁。病人患肺癌出现显著症状时,基本已错过最佳诊断与治疗时期,所以肺癌的早期诊断及筛查至关重要。目前临床主要采用肺部ct图像进行肺结节的诊断与筛查。
相关计算机辅助诊断系统,可以检测出肺部医学图像中可能存在结节的组织(本申请称为候选结节),并筛选出假阳性的候选结节。这对医生进一步综合判断剩余的候选结节的属性有一定的帮助。但是,实际的医疗诊断过程中,结节本身的判断过程非常复杂,除结节的形态特征外,还需要结合结节与血管的伴生关系、医生的临床经验等其他很多因素,如果相关计算机辅助诊断系统检测出结节与血管的伴生关系,可以在医生进一步综合判断剩余的候选结节的属性时,提供更高的辅助力度,可是相关计算机辅助诊断系统难以检测出结节与血管的伴生关系。有鉴于此,本申请实施例提出一种可以得到结节与血管的位置关系的图像数据处理方法。
该图像数据处理方法,通过定位候选结节与血管组织在肺部医学图像中的像素位置;在同一坐标系中构建用于体现所述血管组织的空间特征的管状模型,及用于体现所述候选结节的空间特征的壳体模型;然后鉴于壳体模型与管状模型在同一坐标系,且分别能体现候选结节与血管组织的空间特征,可以通过定位所述壳体模型与所述管状模型,得到所述候选结节与所述血管组织的位置关系。进而,应用到医生诊断候选结节属性的场景下,能作为中间结果,由医生结合难以预知的其他因素对候选结节的属性进行综合判断。
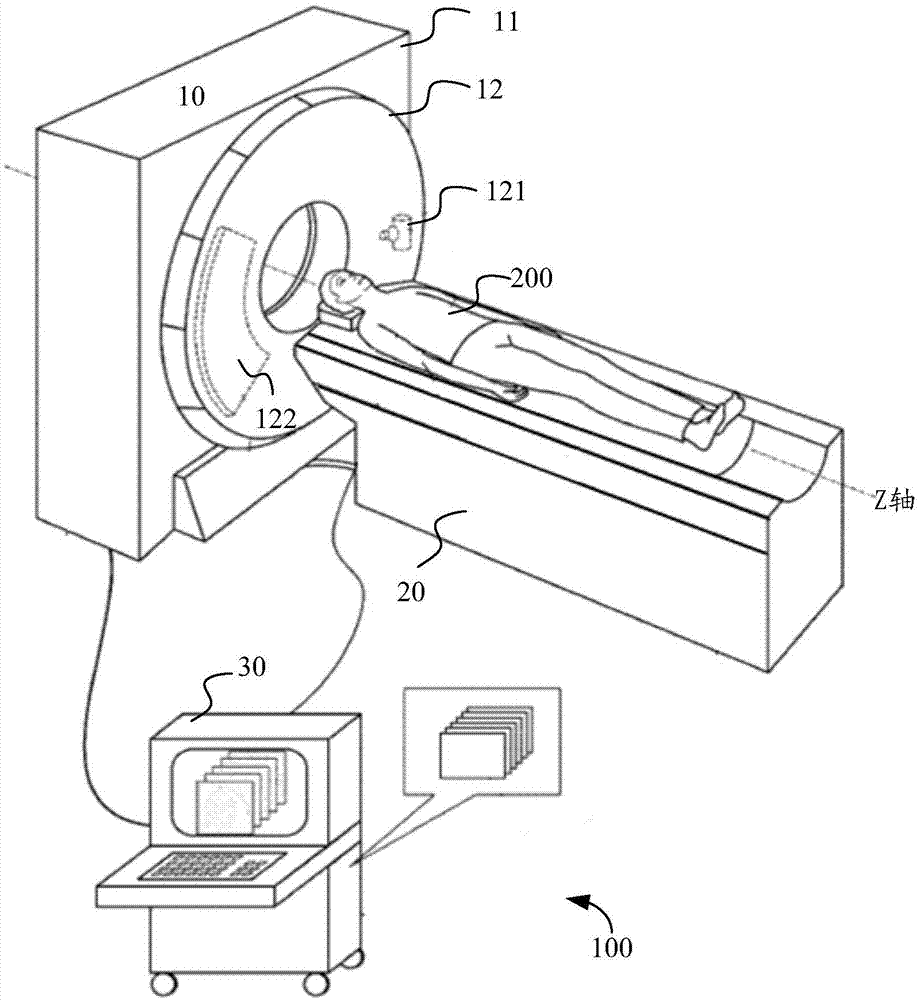
需要说明的是,本申请实施例涉及的肺部医学图像,可以是肺部的ct图像,如多排螺旋ct图像。这提到的ct图像可以通过ct系统实时生成,也可以从图像服务器获取,以下结合一实施例介绍下生成ct图像的ct系统:
图1a为ct系统的结构示意图,图1b详细的示意了图1a中的部分组成部分的结构。可以结合图1a和图1b来看,该ct系统100可以包括:机架10、检查床20和计算机系统30。
其中,机架10,其作用可以是用来完成特定扫描方式的扫描,以获得患者200扫描层面的原始数据,供计算机系统30进行图像处理,得到ct图像。
机架10可以包括固定机架11和旋转机架12。固定机架11可以用于控制机架倾斜角度,控制扫描架旋转。如图1b所示,旋转机架12可以安装有球管121,用于在垂直于轴线z的方向上发射x射线;在旋转机架12上与球管121相对的位置可以安装探测器122,用于检测x射线强度。需要说明的是,某些ct设备的x射线探测器位于固定机架上。
检查床20,其作用是准确地把患者200送到预定或者适当的位置。此处需要说明的是,在一些ct系统中,检查床并不一定是必须的。
计算机系统30,可以用于实现三种功能:其一,控制机架10和检查床20:当操作者选用适当的扫描参数启动扫描之后,安排扫描期间内各种事件顺序。其二、数据处理,包括数据预处理和图像重建。其三、图像显示。
为了实现上述的三种功能,该计算机系统30可以包括如下组成部分:控制设备13、图像重建设备34、计算机35、显示器31、操作台32和存储设备33。
其中,控制设备13,可以用于控制机架10带动球管121和探测器122绕z轴旋转,控制球管121在旋转过程中发射x射线。本例中,控制设备13可以包括以下几个模块:
x射线控制器131,用于为球管121提供能量和时序信号。
机架驱动控制器132,用于控制旋转机架的转速和起始位置。
数据采集系统133(dataacquisitionsystem,das),用于从探测器122中采集模拟信号,并将上述模拟信号转换为用于后续图像处理的数字信号,将所述数字信号输出给与其相连的图像重建设备34。
图像重建设备34,可以用于根据数据采集系统133输出的扫描数据进行图像重建,获得ct重建图像。
某些场景下,机架10随时间变化旋转时,可以带动球管121从不同角度向被检对象200的肺部发射x射线,由数据采集系统133对应从探测器122中采集模拟信号,并将上述模拟信号转换为用于后续图像处理的数字信号,将所述数字信号输出给与其相连的图像重建设备34,图像重建设备34重建出一系列的ct图像。可以将这一系列的ct图像,称为肺部医学图像序列。
计算机35,可以用于将操作者通过操作台32输入的命令和参数转化为控制信号或信息发送给控制设备13和/或检查床驱动控制器21;该计算机30还可以接收并存储图像重建设备34重建的ct图像。
显示器31,用于显示重建图像和相关数据;
操作台32,用于接收操作者输入的命令和扫描参数;
存储设备33,用于存储大量的重建图像。某些场景下,计算机35还可以将ct图像以dicom格式或其他格式,发送至存储ct图像的服务器,以便与其他计算机终端共享ct图像。这里提到的dicom为医学数字成像和通信(digitalimagingandcommunicationsinmedicine),是医学图像和相关信息的国际标准(iso12052),定义了质量能满足临床需要的可用于数据交换的医学图像格式。
某些实施例中,本申请的图像数据处理方法可以应用于计算机系统30,在图像重建设备24重建出肺部ct图像后,由图像重建设备24或计算机35以肺部ct图像为肺部医学图像,获取候选结节与血管组织在肺部医学图像中的像素位置;然后构建壳体模型与管状模型,再根据两个模型的交点确定候选结节与血管组织的位置关系。在其他实施例中,本申请的图像数据处理方法可以应用于计算机系统30外的其他计算机设备,该计算机设备可以实时从计算机系统30或图像服务器获取肺部ct图像,也可以预存肺部ct图像,然后以肺部ct图像为肺部医学图像,获取像素位置、重建模型,进而确定候选结节与血管组织的位置关系。以下结合附图详细介绍下本申请实施例的图像数据处理过程:
请参阅图2a,图2a是本申请一示例性实施例示出的图像数据处理方法的流程图,可以应用于计算机设备,包括步骤s201至步骤s204:
步骤s201、获取肺部医学图像中被检测到的候选结节的像素位置。
步骤s202、获取所述肺部医学图像中被检测到的血管组织的像素位置。
步骤s203、基于所获取的像素位置,在同一坐标系中构建用于体现所述血管组织的空间特征的管状模型,及用于体现所述候选结节的空间特征的壳体模型。
步骤s204、通过定位所述壳体模型与所述管状模型,得到所述候选结节与所述血管组织的位置关系。
本申请实施例应用的计算机设备,如上所述,可以是计算机系统30中的图像重建设备24或计算机35,也可以是计算机机系统30外具有图像处理能力的计算设备。
本申请实施例可以预存各肺部医学图像的候选结节及血管组织的像素位置,在需要候选结节与血管组织的位置关系时,实时调取肺部医学图像中被检测到的候选结节的像素位置,及肺部医学图像中被检测到的血管组织的像素位置。
其他例子中,在图像重建设备24重建出肺部ct图像,或接收图像重建设备24发出的肺部ct图像,或从图像服务器获取肺部ct图像后,某些情况下,本申请实施例可以对肺部医学图像进行标准化预处理,然后实时以预处理后的肺部ct图像为肺部医学图像,采用相关的肺部分割技术,对肺部医学图像进行分割,得到肺实质区域,再实时识别肺实质区域中的血管组织、及疑似结节的组织(候选结节),然后获取血管组织与候选结节的像素位置。这里的像素位置,可以指血管组织与候选结节在肺部医学图像序列中,每个序列的肺部医学图像中对应的像素点的坐标,也可以指血管组织与候选结节,在肺部医学图像序列重建出的三维医学图像中对应的像素点的坐标,还可以指血管组织或候选结节对应的像素点的几何中心(质心),血管组织的半径及长度,候选结节的每个像素与其几何中心的距离,或者,候选结节的最小直径与最大直径。
针对肺部医学图像的分割需要说明的是,ct系统生成肺部ct图像时,直接对胸部进行拍摄,因此,重建出的ct图像中包括肺部以外其他组织的图像,可以从重建的ct图像中提取出肺实质区域,并且确定左肺区域和右肺区域的边界。其中,提取肺实质区域时,可以基于肺部的形态、灰度等特征进行提取,也可以采用自适应阈值算法或本领域的其他相关方法提取。
某些例子中,还可以利用区域生长法排除提取的肺实质区域中的体外区域,进而,将肺实质内的空洞填充后剔除肝脏部分,再通过形态学平滑方法,平滑剔除肝脏部分的肺实质区域,最终分离出左肺区域与右肺区域。
然后,从左肺区域与右肺区域初步检测出血管组织与候选结节,再根据检测结果,获取血管组织的像素位置与候选结节的像素位置。
考虑到通过图像特征初步检测的候选结节中存在大量假阳性的候选结节,因此,本申请实施例可以在获取候选结节的像素位置前,对初步检测的候选结节进行假阳性筛选。一例子中,可以在获取肺部医学图像中被检测到的候选结节的像素位置前,通过以下操作筛选假阳性候选结节:
初步检测所述肺部医学图像中的结节。
将初步检测的结节区分为假阳性结节与候选结节。
其中,在初步检测所述肺部医学图像中的结节时,考虑到肺部医学图像中结节呈椭球形或者圆球形,截面也是类圆形,一例子中,可以通过以下操作检测图像中的结节:
从所述肺部医学图像分割出肺部的左肺与右肺;
对所述左肺与所述右肺中的每个像素点分别构建海森矩阵,并获得所述海森矩阵的特征值;
基于所述海森矩阵的特征值,初步检测所述肺部医学图像中的结节。
另外,考虑到肺部医学图像中的结节即使是椭球形,最长直径与最短直径的比值也在一定范围内,本申请实施例,可以通过以下操作,将初步检测的结节区分为假阳性结节与候选结节:
计算初步检测的结节的最小外接矩形;这里的最小外接矩形指能将结节包络在其内部的最小矩形。
根据所述最小外接矩形的长宽比,将初步检测的结节区分为假阳性结节与候选结节。
某些例子中,可以将初步检测的结节中,最小外接矩形的长宽比小于3的结节定位假阳性结节,剩余的定位候选结节。
确定好候选结节后,某例子中,可以通过以下操作,获取肺部医学图像中被检测到的候选结节的像素位置:
确定所述候选结节的几何中心。
计算所述候选结节的每个像素与所述几何中心的距离。
基于所述候选结节的每个像素与所述几何中心的距离,计算出所述候选结节的最小直径与最大直径。
其中,可以通过以下公式计算几何中心三维坐标:
其中,1~n为结节内的像素点的编号。
基于所述候选结节的每个像素与所述几何中心的距离,计算所述候选结节的最小直径与最大直径时,可以先选取最小距离与最大距离,然后将最小距离的两倍、最大距离的两倍作为最小直径与最大直径。另一例子中,也可以参照各像素点的相对位置,确定经过几何中心的任意直线上的任意两个边界像素点,将确定的任意两个边界像素点到几何中心的距离相加,然后找出距离相加值中的最大值与最小值,为最大直径与最小直径。在其他实例中,也可以采取其他方式,在此不再赘述。
为了确定血管与结节的伴生关系,本申请实施例,可以在获取到候选结节的像素位置之前或之后,鉴于血管的形态特征,通过海森(hessian)矩阵识别肺部医学图像中的血管组织,并获取其像素位置。另外考虑到血管容易被噪声干扰,导致其特征被掩改,本申请实施例可以基于hessian矩阵特征值的frangi多尺度滤波器将大小、形态各异的血管组织进行增强,然后识别肺部医学图像中的血管组织与获取其像素位置。
一例子中,本申请实施例,可以通过以下操作,获取所述肺部医学图像中被检测到的血管组织的像素位置:
从所述肺部医学图像分割出肺部的左肺与右肺。
基于frangi多尺度滤波器,为所述左肺与所述右肺中每个像素点构建海森矩阵,并获得每个像素点的海森矩阵的三个特征值λ1、λ2和λ3,且|λ1|≤|λ2|≤|λ3|。
获取三个特征值满足如下条件的像素点的位置坐标,为血管组织在所述肺部图像中的位置坐标:
λ1约等于0,λ2约等于λ3,λ3小于0,且|λ1|≤|λ2|。
根据血管组织中像素点的特征值λ1的特征向量,确定血管组织的方向。
某些例子中,海森矩阵如下:
其中,σ为高斯滤波器的尺度,该尺度与血管直径相关,fxx为图像在x方向上的二阶导数。假如矩阵特征值λ1、λ2和λ3,计算并排序使得|λ1|≤|λ2|≤|λ3|。血管方向由绝对值最小的特征值λ1所对应的特征向量给出。
其中,特征向量为
血管满足的条件如下:
λ1约等于0,λ2约等于λ3,λ3小于0,且|λ1|<<|λ2|。
在其他例子中,也可以通过其他方式识别肺部医学图像中的血管组织,并获取其像素位置,本申请实施例对此不做限制。
在获取到候选结节与血管组织在肺部医学图像中的像素位置后,本申请实施例,考虑到仅根据像素位置或肺部医学图像,直接确定候选结节与血管组织的位置关系,出错率较高。为降低出错率,可以基于获取的像素位置,通过图形编辑软件或建模软件,构建出能反应候选结节的空间特征的壳体模型,能反应血管的空间特征的管状模型。
需要说明的是,之所以构建管状模型与壳体模型,是考虑到血管通常称管状,大部分结节的外形接近球形或椭球形。而管状模型的外形为管状,壳体模型的外形为球形或椭球形,这两者可以很好的模拟血管与结节。某些例子中,壳体模型能够包络单个候选结节的所有像素点。
此外,壳体模型可以为单个壳体;也可以两个以上壳体的组合,各壳体嵌套构成壳体模型,如由两个壳体构成时,所述壳体模型可以包括内壳体与包络在所述内壳体外围的外壳体;所述内壳体的直径与所述候选结节的最小直径匹配,所述外壳体的直径与所述候选结节的最大直径匹配。这里提到的每个壳体,可以是厚度远小于中面最小曲率半径和平面尺寸的片状结构,是薄壳、中厚壳的总称。
在构建好模型后,由于壳体模型与管状模型分别表征候选结节与血管组织的空间特征,因此,本申请实施例可以模拟出壳体模型的模型函数,及管状模型的模型函数,然后通过定位两个模型,确定两个模型是否相交,以及在相交时计算两个模型函数的相交点,得到所述壳体模型与所述管状模型的相交点,进而根据相交点的个数或相交点构成的相交区域的个数,得到所述候选结节与所述血管组织的位置关系。这里之所以分相交点的个数与相交区域,是考虑到某些情况下,相交点指模型相交处单个坐标点,另一些情况下相交点指相交的多个坐标点构成相交面。
为了便于根据相交点的个数或相交点构成的相交区域的个数,得到所述候选结节与所述血管组织的位置关系,本申请实施例可以预先搜集候选节点与血管组织的多种位置关系,如图2b至图2e所示,为其中四种,图2b中候选结节(虚线圆环中的白色亮点),为i型,孤立结节,没有任何血管组织与其相交;图2c中候选结节(虚线圆环中的白色亮点),为ⅱ型,单支血管进入结节,且血管走行正常;图2c中候选结节(虚线圆环中的白色亮点),为ⅲ型,单支血管进入结节,且血管走行僵直、血管变形;图2d中候选结节(虚线圆环中的白色亮点),为ⅳ型,多支血管进入候选结节。
然后构建各种位置关系对应的候选结节与血管组织的模型,根据模型函数计算相交点,建立相交点的个数或相交点构成的相交区域的个数,与所述候选结节与所述血管组织的位置关系间的对应关系。
在实际处理肺部医学图像时,可以定位所述壳体模型与所述管状模型的相交点后,根据预先建立的对应关系,对应得到所述候选结节与所述血管组织的位置关系。
在其他例子中,还可以采取其他方式确定候选结节与血管组织间的位置关系,以下壳体模型为图2f所示为例,介绍一些确定位置关系的方式:
图2f中的壳体模型可以包括内壳体j2与包络在内壳体j2外围的外壳体j3;内壳体j2的直径与候选结节j1的最小直径匹配,外壳体j3的直径与候选结节ji的最大直径匹配。其他例子中,如果内壳体与外壳体都为椭圆形壳体,内壳体的最小直径与候选结节的最小直径匹配,外壳体的最小直径与候选结节的最大直径匹配,这里提到的匹配,可以指差值在预定的差值范围内。
一实施例中,考虑到模拟壳体模型与管状模型的模型函数计算量比较大,可以通过投影的方式确定相交点,具体可以参见图3a,图3a所示的图像数据处理方法可以包括步骤s301-s304:
步骤s301、在所述外壳体与所述内壳体上定位并标记与所述管状模型的相交点。
步骤s302、通过墨卡托投影算法,将标记相交点后的所述内壳体与所述外壳体分别投影成圆柱,并将投影成的圆柱展开,得到两个矩形平面。
步骤s303、通过分别查找两个矩形平面中被标记的点,统计每个矩形平面含有的标记区的个数;所述标记区为查找到的点构成的环形区域。这里之所以查找环形区域,是考虑到血管组织的横截面近似为圆形,投影后为椭圆或圆形。
步骤s304、根据每个矩形平面含有的标记区的个数,确定所述候选结节与所述血管组织的位置关系。
本申请实施例之所以对相交点进行标记,是为了便于在投影后查找相交点的投影,实际标记时,可以采用不同的颜色特征值或透明度值进行标记。
实际应用中,墨卡托投影,可以称为正轴等角圆柱投影,由荷兰地图学家墨卡托(g.mercator)于1569年创拟。该投影假设地球被套在一个圆柱中,赤道与圆柱相切,然后在地球中心放一盏灯,把球面上的图形投影到圆柱体上,再把圆柱体展开,就形成以一幅墨卡托投影的矩形区域。
一例子中,壳体模型与管状模型如图3b所示,表示单个血管进入候选结节,另一例子中,壳体模型与管状模型如图3c所示,表示多个血管进入候选结节。
在进行墨卡托投影后,图3b所示壳体模型的投影如图3d所示,图3c所示的壳体模型的投影如图3e示,在图3d与图3e中,黑色原点表示管状模型与内壳体的交点,白色原点表示管状模型与外壳体的交点。
此外,考虑到投影的局限性,矩形区域中的某些环形区域可能并非管状模型与壳体模型的交点构成,本申请实施例,鉴于血管横截面的特性,可以在确定所述候选结节与所述血管组织的位置关系前,筛选出不能代表管状模型与壳体模型的相交的标记区:
通过hessian矩阵判定每个标记区在三维空间的几何特征,与所述血管组织的横截面是否匹配;如果不匹配,则舍弃该标记区。
然后,可以统计每个矩形平面含有的标记区的个数,分别代表管状模型与内壳体的相交次数,与外壳体的相交次数,某些情况下,可以根据如下关系,得到与统计结果对应的位置关系:
若两个矩形区域上均没有标记区,则候选结节为孤立性结节,没有血管组织与其相交。
若内壳体投影得到的矩形区域内有两个标记区,外壳体投影得到的矩形区域内有两个标记区,则候选结节内有一血管组织穿入穿出;如图3b与图3d所示。
若内壳体投影得到的矩形区域内有三个以上标记区,外壳体投影得到的矩形区域内有有三个以上标记区,则有多条血管穿入穿出候选结节;如图3c与图3e所示。
需要说明的是,本申请实施例中血管组织与候选结节的位置关系,只用于作为结节病变诊断的中间结果,提供一定帮助,如减少医生阅片的速度,不能代替医生做出结节病变诊断,医生需要结合其他信息进行综合诊断,综合诊断依据的信息难以预知,因被检对象与医生而异。
与本申请图像数据处理方法的示例相对应,本申请还提供了图像数据处理装置的示例。图像数据处理装置可以应用于各种计算机设备,如个人计算机、膝上型计算机、蜂窝电话、相机电话、智能电话、平板计算机、智能交互平板、智能家居设备或者这些设备中的任意几种设备的组合。
如图4所示,为本申请图像数据处理装置应用的计算机设备的硬件结构示意图,该计算机设备可以包括处理器410、内存420、非易失性存储器430。其中,内存420和非易失性存储器430为机器可读存储介质,处理器410和机器可读存储介质420、430可借由内部总线440相互连接。在其他可能的实现方式中,所述计算机设备还可能包括网络接口450,以能够与其他设备或者部件进行通信。除了图4所示的处理器410、内存420、网络接口450、以及非易失性存储器430之外,该设备根据实际功能需要还可以包括其他硬件,图4中不再一一示出。
在不同的例子中,所述机器可读存储介质420、430可以是rom(read-onlymemory,只读存储器)、易失存储器、非易失性存储器、闪存、存储驱动器(如硬盘驱动器)、固态硬盘、任何类型的存储盘(如光盘、dvd等),或者类似的存储介质,或者它们的组合。
进一步,机器可读存储介质、可具体为内存420上存储有与图像数据处理装置对应的机器可执行指令。从功能上划分,如图5所示,图像数据处理装置可包括结节定位模块510、血管定位模块520、模型构建模块530和关系确定模块540。
其中,结节定位模块510,用于获取肺部医学图像中被检测到的候选结节的像素位置。
血管定位模块520,用于获取所述肺部医学图像中被检测到的血管组织的像素位置。
模型构建模块530,用于基于所获取的像素位置,在同一坐标系中构建用于体现所述血管组织的空间特征的管状模型,及用于体现所述候选结节的空间特征的壳体模型。
关系确定模块540,用于通过定位所述壳体模型与所述管状模型,得到所述候选结节与所述血管组织的位置关系。
一例子中,本申请的图像数据处理装置可以包括:
结节初检模块,用于初步检测所述肺部医学图像中的结节。
结节区分模块,用于将初步检测的结节区分为假阳性结节与候选结节。
作为例子,所述结节初检模块还被配置为:
从所述肺部医学图像分割出肺部的左肺与右肺;
对所述左肺与所述右肺中的每个像素点分别构建海森矩阵,并获得所述海森矩阵的特征值;
基于所述海森矩阵的特征值,初步检测所述肺部医学图像中的结节。
作为例子,所述结节区分模块还被配置为:
计算初步检测的结节的最小外接矩形;
根据所述最小外接矩形的长宽比,将初步检测的结节区分为假阳性结节与候选结节。
另一例子中,结节定位模块510还可以被配置为:
确定所述候选结节的几何中心;
计算所述候选结节的每个像素与所述几何中心的距离;
基于所述候选结节的每个像素与所述几何中心的距离,计算出所述候选结节的最小直径与最大直径。
另一例子中,血管定位模块520可以被配置为:
从所述肺部医学图像分割出肺部的左肺与右肺;
基于frangi多尺度滤波器,为所述左肺与所述右肺中每个像素点构建海森矩阵,并获得每个像素点的海森矩阵的三个特征值λ1、λ2和λ3,且|λ1|≤|λ2|≤|λ3|;
获取三个特征值满足如下条件的像素点的位置坐标,为血管组织在所述肺部图像中的位置坐标:
λ1约等于0,λ2约等于λ3,λ3小于0,且|λ1|≤|λ2|;
根据血管组织中像素点的特征值λ1的特征向量,确定血管组织的方向。
另一例子中,所述壳体模型的外形为球形或椭球形。
另一例子中,所述壳体模型包括内壳体与包络在所述内壳体外围的外壳体;所述内壳体的直径与所述候选结节的最小直径匹配,所述外壳体的直径与所述候选结节的最大直径匹配。
作为例子,所述关系确定模块被配置为:
在所述外壳体与所述内壳体上定位并标记与所述管状模型的相交点;
通过墨卡托投影算法,将标记相交点后的所述内壳体与所述外壳体分别投影成圆柱,并将投影成的圆柱展开,得到两个矩形平面;
通过分别查找两个矩形平面中被标记的点,统计每个矩形平面含有的标记区的个数;所述标记区为查找到的点构成的环形区域;
根据每个矩形平面含有的标记区的个数,确定所述候选结节与所述血管组织的位置关系。
作为例子,所述关系确定模块被配置为:
在确定所述候选结节与所述血管组织的位置关系前,通过hessian矩阵判定每个标记区在三维空间的几何特征,与所述血管组织的横截面是否匹配;如果不匹配,则舍弃该标记区。
本实施例的装置中各个单元(或模块)的功能和作用的实现过程,具体详见上述图像数据处理装置中对应的单元或模块,在此不再赘述。
本领域技术人员在考虑说明书及实践这里公开的内容后,将容易想到本申请的其它实施方案。本申请旨在涵盖本申请的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本申请的一般性原理并包括本申请未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本申请的真正范围和精神由下面的权利要求指出。
应当理解的是,本申请并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。本申请的范围仅由所附的权利要求来限制。
- 还没有人留言评论。精彩留言会获得点赞!