基于遗传算法的乳腺肿瘤轮廓动态提取方法与流程
本发明属于图像处理技术领域,特别涉及一种图像轮廓的提取方法,可用于提取乳腺肿瘤的二维轮廓形状。
背景技术:
微波成像用微波照射被测物体,通过物体外部散射场的测量数据来重构物体的电磁参数分布。在特定的电磁波频率范围内,肿瘤组织的介电常数和电导率明显区别于邻近正常组织的介电常数和电导率。如频率为6ghz时,正常组织的相对介电常数为9.8,电导率为0.4s/m,肿瘤组织对应的参数分别为50.74,4.82s/m。因此,利用微波照射和散射场的测量数据可以反演出物体组织的电磁参数分布,实现肿瘤成像。
目前常见的方法是利用遗传算法来优化微波成像的结果。例如2000年,r.olmi等人在文献“olmir,binim,prioris.ageneticalgorithmapproachtoimagereconstructioninelectricalimpedancetomography[j].kieeinternationaltransactionsonelectrophysics&applications,2000,4-c(3):309-320”中实现了利用遗传算法重建成像区域的电磁参数。其特点是将圆形成像区域剖分成96个三角型小格,遗传迭代次数为1000次。该方法的计算代价比较大,而且肿瘤轮廓的像素大于1cm。
2007年,abassabouni等人在文献“sabounia,xum,noghanians,etal.efficientmicrowavebreastimagingtechniqueusingparallelfinitedifferencetimedomainandparallelgeneticalgorithms[c]//antennas&propagationsocietyinternationalsymposium.ieee,2007”中同样提出了利用遗传算法优化微波成像的结果,并使用并行计算加快遗传算法的迭代速度,在一个直径为12cm的圆形成像区域中实现了7.5mm像素的肿瘤成像。
上述利用遗传算法进行微波成像的方法都是对全肿瘤区域进行成像,均存在成像分辨率较低的缺点,分辨率不足以用来进一步观察肿瘤的具体轮廓。如果利用上述方法直接进行高分辨率成像,则遗传算法的染色体长度会明显变长,数据量和迭代次数显著增大,无法用目前的计算设备在合理的时间内输出结果。
技术实现要素:
本发明的目的在于针对现有技术的不足,提出一种基于遗传算法的乳腺肿瘤轮廓动态提取方法,减少遗传算法的染色体长度,提升迭代效率,提高肿瘤的成像分辨率。
本发明的技术方案是:通过将遗传算法与集成算法相结合,实现对截面积为100mm2左右的二维乳腺肿瘤提取其边缘轮廓,得到1mm像素的二维乳腺肿瘤的图像,具体步骤如下:
1.一种基于遗传算法的乳腺肿瘤轮廓动态提取方法,其特征在于:
(1)构建初始肿瘤模型
1a)获取现有的乳腺肿瘤超声图;
1b)根据图像中的灰度值差别区分肿瘤组织和正常组织,并将图像转换为二值图,分别标记肿瘤组织和正常组织;
1c)按照设定的分辨率将1b)中的二值图网格化,生成网格图像,得到组织矩阵a:
其中,aij表示网格图像中位置为(i,j)的组织信息,若aij=0,表示此位置为正常组织,若aij=1,表示此位置为肿瘤组织;
1d)根据1c)得到的组织矩阵a,在xfdtd电磁仿真软件中建立初始肿瘤模型xa,并在模型周围设置n根天线,每根天线轮流发射电磁波辐射肿瘤,所有天线同时接收并记录电磁回波,n≥8;
1e)拷贝初始肿瘤模型xa,并将其中的肿瘤组织替换为正常组织,得到无肿瘤模型xb;
(2)构建初始评估函数f:
式中,n表示天线总数,m为每一根天线的电流采样总数,
(3)利用共焦成像获得肿瘤的中心位置,及最优的肿瘤矩形轮廓:
3a)在1d)建立的初始肿瘤模型xa中,用共焦成像确定肿瘤基本区域;
3b)在1e)建立的无肿瘤模型xb中,使用边长为8mm的肿瘤组织小格遍历肿瘤基本区域,得到带肿瘤组织小格的模型xo,通过初始适应度函数f计算该模型的适应度值,选取模型xo中适应度值最高的小格位置作为肿瘤的中心位置;
3c)调整中心位置上小格的长和宽,得到矩形肿瘤模型xs,通过初始评估函数f迭代计算该模型的适应度值,直到适应度值不再增加,此时模型xs中的矩形轮廓就是最优的肿瘤矩形轮廓;
(4)修改初始适应度函数f,获得距离补偿适应度函数f′;
(5)调整步骤(3)得到的矩形肿瘤的位置,获得初始轮廓模型序列,利用距离补偿适应度函数f′计算初始轮廓模型序列的适应度值,对初始轮廓模型序列进行编码,依次通过遗传算法与集成算法训练经过编码的初始轮廓模型序列,用1mm的变化量不断演进肿瘤轮廓的形状,得到演进轮廓模型序列;
(6)将演进轮廓模型序列的距离补偿适应度值序列f1′,f2′...,fl′的最大值f′max与预设的适应度阈值f作比较:
若f′max≥f,则表示步骤(5)得到的演进轮廓模型序列中有最优模型,训练结束,输出此模型的肿瘤轮廓图像;
若f′max<f,则表示未得到最优模型,需要对演进轮廓模型序列再次编码,继续依次通过遗传算法与集成算法进行迭代训练,若达到设置的最大迭代次数时仍未得到最优模型,则输出适应度值最高的肿瘤轮廓图像。
本发明与现有技术相比,具有以下优点:
第一,本发明在利用遗传算法进行高分辨率成像时,充分考虑了数据量级和天线位置的因素,构建了新的评估函数,计算出的适应度值可以更好的评估迭代结果的优劣,提高了迭代效率。
第二,本发明注重提取肿瘤的轮廓,而不关心肿瘤内部组织结构,这样在使用遗传算法时,对组织进行编码,编码长度会缩小50%左右,可以大大提高遗传算法的迭代速度,同时也有利于提高肿瘤成像的分辨率。
第三,本发明结合集成算法,利用遗传算法结果的不确定性,采用集成后的结果作为每一轮迭代的最终结果,大大提高了成像的精确度。
附图说明
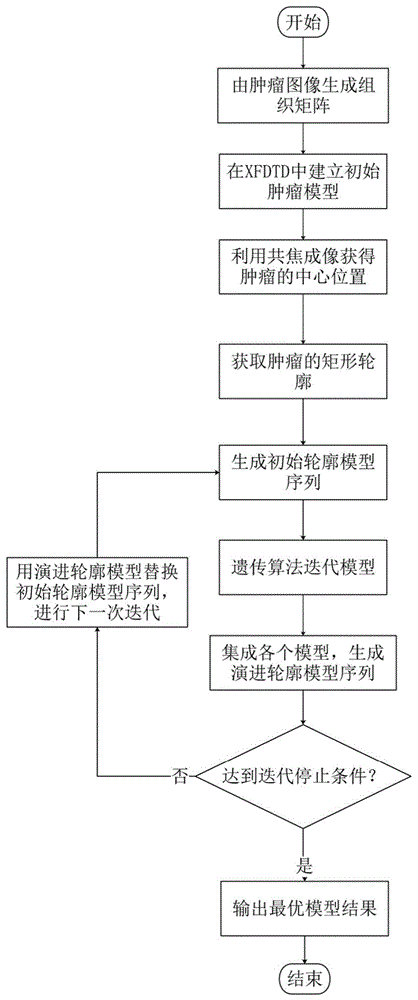
图1为发明实现流程图;
图2为本发明实施例使用的乳腺肿瘤超声图像;
图3为用本发明对图2乳腺肿瘤图像进行二值化的轮廓图;
图4为用本发明对图3的二值化轮廓图进行1mm网格化的轮廓图;
图5为本发明根据图4的网格化轮廓图在xfdtd中建模的初始肿瘤模型图;
图6为本发明迭代训练得到的肿瘤轮廓演进图;
图7为用xfdtd软件对初始肿瘤模型网格化的网格图。
具体实施方式
结合附图对本发明的实施例和效果进行详细描述。
参照图1,本实施例的实现如下:
步骤1,构建初始肿瘤模型。
1.1)获取现有的乳腺肿瘤超声图,如图2所示;
1.2)根据图2中的灰度值差别区分肿瘤组织和正常组织,并将其转换为二值图,分别进行标记,即黑色表示正常组织,白色表示肿瘤组织,如图3所示;
1.3)设定分割网格的分辨率为1mm,将图3按照设定的分辨率进行网格化生成网格图像,如图4所示,并生成组织矩阵a:
其中aij表示网格图像中位置为(i,j)的组织信息,若aij=0,表示此位置为正常组织,若aij=1,表示此位置为肿瘤组织;
1.4)根据1.3得到的组织矩阵a,在xfdtd电磁仿真软件中建立初始肿瘤模型xa,如图5所示,其中,
正常组织的中心在坐标原点,正常组织的半径为50mm,肿瘤组织设置在正常组织内,肿瘤组织的面积为104mm2,组织周围均匀分布8根天线,每根天线轮流发射电磁波辐射肿瘤,所有天线同时接收并记录电磁回波;选取单频正弦波作为天线的发射信号,发射频率为6ghz,相位为0°,在该频率,正常组织的相对介电常数为9.8,电导率为0.4s/m,肿瘤组织对应的参数分别为50.74和4.82s/m;
1.5)拷贝初始肿瘤模型xa,并将其中的肿瘤组织替换为正常组织,得到无肿瘤模型xb。
步骤2,构建初始适应度函数。
2.1)通过xfdtd仿真软件对初始肿瘤模型xa和无肿瘤模型xb进行仿真,得到xa的第i根天线在t时刻接收回波的电流值为
2.2)逐时刻、逐天线累加xa和xb的电流平方误差
式中,n为天线总数,m为每一根天线的电流采样总数;
2.3)将e取倒数得到适应度函数f:
无肿瘤模型中添加肿瘤后,与初始肿瘤模型越相似,则f的取值越大。
步骤3,利用共焦成像获得肿瘤的中心位置,及最优的肿瘤矩形轮廓。
3.1)在1.4)建立的初始肿瘤模型xa中用共焦成像确定肿瘤基本区域,该肿瘤基本区域为矩形区域,此区域的中心坐标为(-2mm,15mm),长为14mm,宽为10mm;
3.2)在1.5)建立的无肿瘤模型xb中,使用边长为8mm的肿瘤小格遍历整个共焦成像区域得到带肿瘤小格的模型xo,通过初始评估函数f计算该模型的适应度值,选取模型xo中适应度值最高的小格位置作为肿瘤的中心位置,小格中心位置为(-3mm,15mm);
3.3)调整中心位置上小格的长和宽,得到矩形肿瘤模型xs,通过初始评估函数f迭代计算该模型的适应度值,直到适应度值不再增加,此时模型xs中的矩形轮廓就是最优的肿瘤矩形轮廓,得到最优的矩形轮廓的中心坐标为(-3mm,15.5mm),长为12mm,宽为9mm。
步骤4,修改初始适应度值函数f,得到距离补偿适应度函数f′。
4.1)计算每一根天线的调节系数ai:
ai=li-2/max(l1-2,l2-2,...,li-2...,ln-2),
式中,li表示为第i根天线与肿瘤中心位置的距离,n为天线总数;
4.2)计算每一根天线的总电流误差ei:
式中,
4.3)根据每一根天线的总电流误差ei和它的调节系数ai,得到距离补偿适应度函数f′:
步骤5,获得初始轮廓模型序列,并依次通过遗传算法与集成算法训练该模型序列,得到演进轮廓模型序列。
5.1)在1mm的范围内移动矩形肿瘤模型xs中肿瘤的位置,生成初始轮廓模型序列为x1,x2,...,xi,...,xk;
5.2)提取初始轮廓模型序列x1,x2,...,xi,...,xk中任一模型xi中肿瘤的边缘,对边缘内外的区域网格化,得到边长为1mm、与边缘相切的内外双层网格s,网格s中的任一小格表示为si;
5.3)将网格s编码在一条染色体g上,染色体的每一个基因与小格si对应,表示为gi,对于每一个基因gi:
若gi=0,则小格si为正常组织;
若gi=1,则小格si为肿瘤组织;
5.4)对初始轮廓模型序列x1,x2,...,xi,...,xk中未进行编码的模型继续进行编码,得到编码后的初始轮廓模型序列x1,x2,…,xi,…,xk;
5.5)设置遗传算法的交叉概率为0.9,遗传算法的变异概率为0.01,遗传算法的种群个数为100,遗传算法的最大迭代次数为100;利用遗传算法训练编码后的模型序列x1,x2,…,xi,…,xk,得到组织矩阵序列为:a1,a2,…,ai,…,ak;
5.6)利用距离补偿适应度函数f′计算编码后的初始轮廓肿瘤模型序列x1,x2,…,xi,…,xk的适应度值,得到编码后的初始轮廓肿瘤模型的适应度值序列为:f1,f2,…,fi,…,fk;
5.7)将组织矩阵序列a1,a2,…,ai,…,ak与编码后的初始轮廓肿瘤模型的适应度值序列f1,f2,…,fi,…,fk分别相乘,得到编码后的初始轮廓模型序列x1,x2,…,xi,…,xk对应的带权重组织矩阵序列b1,b2,…,bi,…,bk,该序列的任一矩阵bi表示为:
bi=fi×ai(i=1,2,...,k),
式中,fi表示编码后的初始模型序列的适应度值序列f1,f2,…,fi,…,fk的任一值,ai表示组织矩阵序列a1,a2,…,ai,…,ak的任一矩阵;
5.8)将带权重的组织矩阵序列b1,b2,…,bi,…,bk累加并归一化,得到集成后的权重矩阵
式中,函数max取矩阵的最大元素;
5.9)将集成后的权重矩阵
式中
5.10)根据集成后的组织矩阵序列
步骤6,对演进轮廓模型序列x1′,x2′,...,xk′,...,xl′进行迭代训练,输出最优模型的肿瘤轮廓图。
对于演进轮廓模型序列x1′,x2′,...,xk′,...,xl′迭代训练可以使用静态轮廓迭代和动态轮廓迭代;
静态轮廓迭代是指在对演进轮廓模型序列x1′,x2′,...,xk′,...,xl′进行训练时,对该序列不进行编码,迭代的肿瘤轮廓区域相对于步骤5不会发生变化,所以称为静态轮廓迭代;
动态轮廓迭代是指对演进轮廓模型序列x1′,x2′,...,xk′,...,xl′进行训练时,会对该序列进行编码,迭代的肿瘤轮廓区域相对于步骤5会发生变化,所以称为动态轮廓迭代;
本实例使用动态轮廓迭代,实现过程如下:
6.1)将演进轮廓模型序列的适应度值序列f1′,f2′,...,fl′的最大值fm′ax与预设的适应度阈值f=32作比较:
若f′max≥f,则表示步骤(5)得到的演进轮廓模型序列中有最优模型,训练结束,输出此模型的肿瘤轮廓图像;
若f′max<f,则表示未得到最优模型,需要对演进轮廓模型序列再次编码,继续依次通过遗传算法与集成算法进行迭代训练。若达到设置的最大迭代次数d=8时仍未得到最优模型,则输出适应度值最高的肿瘤轮廓图像,迭代训练过程中的肿瘤轮廓演进图如图6所示;
6.2)用xfdtd软件对初始肿瘤模型xa进行网格化,得到初始肿瘤模型的肿瘤网格图,如图7所示;
6.3)对比图6中的最优肿瘤轮廓与图7,发现肿瘤的轮廓完全匹配,证明该实施例对截面积为104mm2的二维乳腺肿瘤具有良好的成像结果。
以上描述仅是本发明的一个具体实例,并未构成本发明的任何限制,显然对于本领域的专业人员来说,在了解了本发明内容和原理后,都可能在不背离本发明原理、结构的情况下,进行形式和细节上的各种修改和改变,但是这些基于本发明思路的修正和改变仍在本发明的权利要求保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!