用于包括金属燃料的电化学电池的杂离子芳族添加剂的制作方法
本申请要求于2013年3月13日提交的第61/780,662号美国临时专利申请的权益,其全部内容作为整体通过引用并入本文。
技术领域
本发明涉及用于发电的电化学电池,更具体地涉及使用电沉积燃料的电池。该电池的离子传导介质包含杂离子芳族添加剂。
本说明书中引用的所有出版物、专利和专利申请均作为整体通过引用并入本文。
背景技术:
已知电化学电池使用金属作为燃料。也已知电化学电池使用电解液(一种溶剂分子和溶质离子的溶液)作为离子传导介质。由于溶剂分子与溶质离子之间的热力学作用,溶剂分子使溶质离子形成溶剂化物,从而使电解液保持离子传导性。取决于期望的操作特征和化学性质,使用金属作为燃料的电化学电池可以是“原”(即,不可再充电的)电池或“蓄”(即,可再充电的)电池。在使用金属作为燃料的电化学电池中,金属燃料在放电过程中在充当阳极的燃料电极处被氧化。被氧化的金属燃料离子可以以可还原的形式保留在电解质溶液中(作为溶剂化的离子,或是与其他离子结合,如在分子或络合物中)。
在电化学蓄电池的充电过程中,可还原的金属燃料离子在电解液和现充当阴极的燃料电极之间的界面处被还原为金属燃料,从而通过该方法(称为电沉积)将金属燃料镀覆在燃料电极上。
包含金属燃料的电化学电池的一个明显问题是在空闲模式(例如,贮藏)过程中倾向于发生腐蚀或自放电。这在很多时候表现为可用容量的损失。在更极端的情况下,自放电可导致气体释放,而过度的压力可破坏电池密封,最终导致电池失效。例如,在包含锌金属燃料的碱性电池中,天然的氧化层不足以使经常导致电池性能损失的腐蚀进程停止。
对于蓄电池而言,在充电-放电循环中产生的一个明显问题是丝状物(filament)或枝状物(dendrite)的形成。这些形成物通常是不均匀的、分散的沉积物,这可能是因为绒毛状(mossy)或枝状生长,和/或是因为丝状物、节状物(nodule)等的生长。通常,这类金属沉积可在电极之间引起不期望的短路,导致电池失效。理想地,电沉积的金属在整个燃料电极表面上积聚为光滑层,由此在从一次充电-放电循环到下一次充电-放电循环的过程中保持电极表面形态。
与常规水性电解液电池相关的另一个问题是充电过程中的水电解。在充电过程中,电流通过电池以在燃料电极处还原被氧化的燃料。然而,如以下方程式所表示的,在碱水溶液中一些电流将水电解,导致在燃料电极处析氢(即,还原作用)和在氧化剂电极处析氧(即,氧化作用):
2H2O(1)+2e-→H2(g)+2OH-(aq)和 (1)
2OH-(aq)→1/2O2(g)+H2O(l)+2e-。 (2)
以这种方式,水性电解液从电池中损失。此外,在还原氢时消耗的电子不再可用于在燃料电极处还原燃料。因此,水性电解液的寄生性电解(parasitic electrolysis)降低了蓄(即,可再充电的)电池的循环效率。
为缓解这些问题,电解质溶液可包含添加剂。使用添加剂的电化学电池是已知的。这种装置的实例在例如美国专利第3,945,849;4,479,856;6,027,827;和6,395,422;6,927,000;7,169,504;和7,563,537号中示出,其全文并入本文。不同电化学系统的添加剂可包括表面活性剂、金属离子、有机化合物及其组合。在电化学电池中使用添加剂的益处可以是,例如,通过各种手段(如在电极上形成离子传导层,吸附到金属表面并阻止腐蚀,减少电极的润湿性问题,或者充当螯合剂)来增进电化学反应。不过,添加剂可能因此阻碍电化学电池的功能或效率。例如,再生电池中促进快速电镀的电解液可以同时促进金属燃料在电极上较不致密的电镀。又比如,添加剂的强吸附可能要求蓄电池充电过程中更高的超电势,因而降低效率。
附图说明
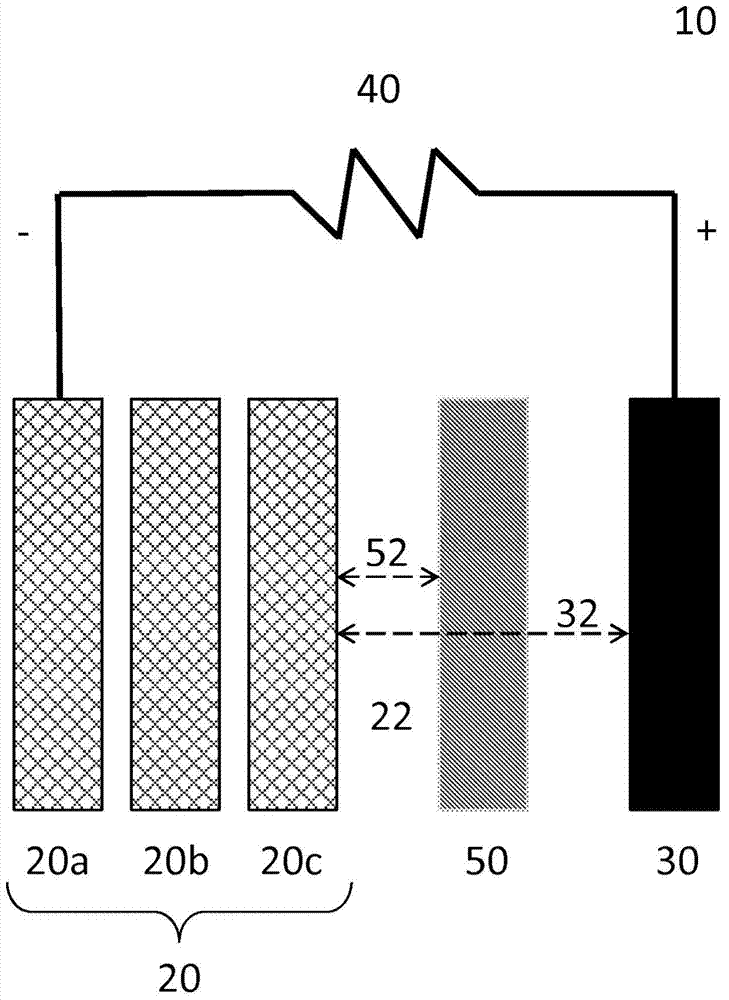
图1是用于在放电过程中发电的带有一叠可渗透电极本体的电化学电池示意图。
图2是用于通过电极本体上的电沉积燃料生长来充电的带有一叠可渗透电极本体的电化学电池示意图。
图3示出了在电解液和一叠可渗透电极本体中的电极之间的界面处的电沉积,其中电解液包含2.0mM 1-苄基-4-氮杂-1-氮鎓二环[2,2,2]辛烷氢氧化物和0.25mM氯化铟InCl3。
具体实施方式
本发明的实施方式提供了电化学电池,其包括:包含金属燃料的燃料电极,第二电极和连通电极的离子传导介质,该离子传导介质包含杂离子芳族添加剂。燃料电极和第二电极可在放电模式下操作,其中金属燃料在充当阳极的燃料电极处被氧化,从而产生从燃料电极通过负载传导到第二电极的电子。
本发明的实施方式还提供了电化学电池放电方法,其通过在充当阳极的燃料电极处氧化金属燃料,从而产生从燃料电极通过负载传导到第二电极的电子,之后使燃料电极和第二电极与负载断开以中断放电。而且,本发明的实施方式还提供了电化学电池充电方法,其通过在充电电极和充当阴极的燃料电极之间施加电流,使得可还原的金属燃料离子被还原,并在第一电极上电沉积为可氧化形式的金属燃料,之后切断电流以中断充电。
此外,本发明提供了在产生电流的电化学电池中使用的离子传导介质,其包含杂离子芳族添加剂。
附图说明了要求保护的本发明各种方面的实施方式。这些实施方式并非旨在作出限制,而是仅仅旨在作为便利理解所要求保护的本发明的原理的实例。
当前所描述的实施方式的原理可广泛地应用于任何包括金属燃料的电化学电池。该电化学电池可以是原电池(例如,原金属-空气、碱性锌-锰氧化物、银-锌等)或蓄电池(例如,可再充电的金属-空气、镍-镉、镍金属氢化物等)。本发明原理可用于其中的电化学电池的非限制性实例公开于美国专利或专利申请第8,168,337、8,309,259、11/962,803、12/385,217、12/549,617、12/631,484、12/776,962、12/885,268、12/901,410、13/019,923、13/028,496、13/083,929、13/085,714、13/096,851、13/105,794、13/167,930、13/185,658、13/220,349、13/229,444、13/230,549、13/277,031、13/299,167、13/362,775、13/448,923、13/526,342、13/526,432、13/531,962、13/532,374、13/553,269、13/566,948、13/653,830、13/666,864、13/668,180、13/668,185、61/557,490、和61/726,134号中;这些全部通过引用并入本文。
根据本发明的实施方式,现对包括金属燃料的电化学电池的操作进行描述,其可采用本文所述的杂离子芳族添加剂。然而,应当认识到该描述仅仅是作为实例提供,而非旨在以任何方式作出限制。众多其他电池化学和电池设计可根据本发明的各种实施方式而采用杂离子芳族添加剂。
图1说明了根据本发明实施方式的电化学电池10的实例。电化学电池10具有燃料电极20和第二电极30。在一个实施方式中,系统的燃料在放电过程中可在燃料电极20处被氧化。燃料电极20可包括电沉积在电传导电极本体上的固体燃料形式的燃料,但通常可被称作燃料电极20,甚至是在没有燃料存在时。在第二电极30处,系统的氧化剂在放电过程中被还原。每个电池10的第二电极30可被提供为是较小的、单独的且单个的第二电极,而非较大的单一“阴极”或者任何其他适合的构造。
如图1中所示,燃料电极20和第二电极30可以被间隔开,以界定其间的间隙32。间隙32通常可以是基本上空的间隙,以使离子传导介质的流体从燃料电极20流动到第二电极30,或者在两个电极之间流动。优选地,间隙32的宽度沿着电极的垂直长度是基本上恒定的(如图1所示),但在一些构造中,它可以被改变。在一个实施方式中,燃料电极20和第二电极30之间的间隙32可具有促进离子传导介质和被氧化的燃料流动的通道或其它特征。在一些实施方式中,可存在离子交换膜或其他任何适合的隔离体。
总的标示为22的离子传导介质与燃料电极20和第二电极30同时连通。在一些实施方式中,离子传导介质可以以任何适合的方向流动,而在其他实施方式中,离子传导介质可以是基本上静态的。对于离子传导介质22的可能流动特征的具体细节,参考美国专利申请第11/962,803、12/631,484、12/901,410、13/019,923、13/028,496、13/362,775、13/532,374、和13/668,021号,均已在上文并入。离子传导介质22可以是电解质溶液。在下文中,离子传导介质22可以被称为电解液22。在一个实施方式中,电解液22是水溶液。适合的电解液的实例包括包含硫酸、磷酸、三氟甲磺酸、硝酸、氢氧化钾、氢氧化钠、氯化钠、硝酸钾或氯化锂的水溶液。如美国专利申请第12/776,962、13/448,923、13/526,058、13/526,432、13/526,342、61/557,490和61/726,134号中公开的(这些全部已通过引用并入本文),电解液可包含非水性溶剂、离子液体和/或离子交换物质。任何离子传导介质均可使用。在本文所述非限制性实施方式中,电解液是氢氧化钾水溶液。
在一个实施方式中,第二电极30包括在其外侧上覆盖有气体可渗透层的多孔体,氧化剂可通过该气体可渗透层扩散,但离子传导介质22不可通过。在一些实施方式中,氧化剂可被布置为被包含的氧化剂(contained oxidizer)。在其他实施方式中,氧化剂可作为钝化或活化体系递送,以将氧从环境空气递送到第二电极30。对于涉及根据各种实施方式的第二电极30的进一步具体细节,可参考已在上文引用的美国专利申请第13/531,962、13/668,180和13/668,185号。在放电过程中,当第一电极20和第二电极30连接到外部负载40时,至少氧化剂与流动到第二电极30的电子之间的反应可以在第二电极30处发生,从而使氧化剂还原。被还原的氧化剂离子可以与被氧化的燃料离子反应,以完成电化学电池反应。
如图1所说明的,燃料电极20可包括分别描述为电极本体20a、20b和20c的多个电极本体。每个本体可配置为允许电解液22流经该本体,并同时使燃料在充电过程中能够电沉积到该本体上,如美国专利或专利申请第12/885,268、13/230,549、13/299,167、和8,309,259号所述。一个或多个本体与燃料颗粒的组合构成第一电极20。如图1所示,第一电极20具有基本上矩形的构型,然而,该构型并非旨在作出限制,其他任何形状或构型也是可能的。
在图1所说明的放电过程中,燃料在燃料电极20处发生氧化,提供通过电解液22离子传导的被氧化的燃料离子。发生燃料氧化以使燃料氧化为可保留在电解液22中的至少被氧化的燃料离子,和通过外部负载40从燃料电极20传导到第二电极30的电子。
在图1的简化且非限制性的示意图中,外部负载40一般描述为连接到第一电极本体20a。然而,应理解可基于期望的操作条件,许多其他连接构造也是可能的。举个例子,金属燃料电沉积物可在一些或全部电极本体20之间建立电连接(例如,由于在先的充电操作)。这样的连接可在端部电极本体20a和后续的可渗透电极本体20b之间存在。此外,电极本体20b可通过这样的金属燃料电沉积物而进一步连接到电极本体20c。在端部电极本体20a连接到外部负载40的情况下,因为这样的内部连接,金属燃料的氧化可以在邻近第二电极30的电极本体20c处开始。在一些实施方式中,还期望的是在电极本体20c和外部负载40之间通过开关建立外部电路连接。除了由于金属燃料电沉积物的内部连接之外,或者不存在该内部连接的情况下,基于期望的操作条件,可建立该外部连接。连接可以基于感知的条件,基于或不基于经过时间而选择性地、程序性地建立。对于涉及连接方案及其控制的具体细节,可参考美国专利或专利申请第12/885,268、13/083,929、13/230,549、13/277,031、13/299,167、和8,309,259号;这些全部已通过引用并入本文。
燃料可以是金属,例如,铁、锌、铝、镁或锂。对于金属,该术语意在包括聚集在电极本体上时为原子形式、合金形式或分子形式的在周期表中视为金属或半金属的所有元素,包括但不限于碱金属、碱土金属、镧系元素、锕系元素、过渡金属和后过渡金属,并且金属燃料可具有任何形态。然而,本发明并非旨在限制于任何特定的燃料,因此,可以使用其他任何燃料。为了说明本发明的操作原理,本文描述了其中锌是金属燃料的实施例;然而这并非旨在成为限制性实施方式。
对于一个非限制性实施方式中的具体反应,使用氢氧化钾作为电解液22。使用锌颗粒作为燃料,使用来自环境空气的氧作为氧化剂。在放电过程中,根据方程式(3),锌在第一电极20处被氧化,产生锌的正离子Zn2+,该正离子负载于四个氢氧根离子,产生锌酸盐络合阴离子:
在放电过程中,根据方程式(4),氧在第二电极30处被还原:
O2+2H2O+4e-——→4OH- (4)
在电解质溶液22中,发生由方程式(5)表示的以下反应:
电解液22中的氢氧根离子浓度可通过氧化剂在第二电极20处的还原反应(方程式4)和从锌酸盐阴离子的化学反应释放的氢氧根离子(方程式5)来维持。电解液22流可将相对不稳定的锌酸盐阴离子运离第一电极20,从而防止锌离子在第一电极20处还原回锌,由于电子自由地流经外部负载40而非被锌酸盐离子的还原所消耗,这进而提高效率。在一些实施方式中,取决于与电解液22组成相关的各种因素,锌可保持为溶解状态而非沉淀为ZnO。
金属燃料电池的前述说明仅作为参考而并非旨在作出限制。本发明可用于具有各种化学性质与布置的各种不同电化学电池。在一些实施方式中,电化学电池可以是原电池,因而以下充电操作描述与之不相关。
在一些实施方式中,电化学电池可以是蓄(即,可再充电的)电化学电池。以下示例性描述涉及在充电电极和燃料电极之间施加电流时在充电模式下可操作的电化学电池。根据本发明的实施方式,可还原的金属燃料离子可被还原,并在充当阴极的燃料电极上电沉积为可氧化形式的金属燃料。电沉积于燃料电极20上的技术可用于上述电池或其他任何类型的电池中,包括其中第一电极是单个本体的实施方式。然而如前所述,在一些实施方式中,电化学电池可以是原电池,因而电沉积方法可以与之不相关。因此,本文所提供的蓄电池的描述并非旨在作出限制。
在图2中,示意性地描述电化学电池10并在某种程度上以与图1相同的方式扩大了其尺寸,使得可以更好地理解各种运行方式。这并非旨在作出限制,而仅仅是出于说明的目的。如图2所示,电化学电池10还包括与第一电极20间隔开的充电电极。在所说明的实施方式中,充电电极是在第二电极30的同侧上的与第一电极20间隔开的第三电极50,例如通过在间隙32中。在一些实施方式中,第三电极50可以布置在第一电极20的相对侧上(即,邻近电极本体20a),或者任何其它适合的布置。第三电极50可以与第一电极20间隔开,形成包括离子传导介质22的间隙52。在一些实施方式中,第二电极30可以在充电过程中作为充电电极使用,用于充电的单独的电极(例如,第三电极50)的存在是不必要的。本发明并非旨在作出限制,选择具有“双功能”的第二电极30是可能的,这意味着它可以同时在电流产生过程中充当空气呼吸阴极并在充电过程中充当阳极充电电极。因此,在本文中任意地方提到的充电电极都可认为是在充电过程中应用或充当阳极的第二电极30或第三电极50。更具体地,尽管所说明的实施方式是参考充电电极为第三电极50的情况进行描述,但应理解同样的描述也可用于第二电极30是充电电极时的情况。
因此,可以从同一物理组件或其部件在一些实施方式中可以发挥不同的电极功能的事实认识到,当在本文中提到电极时,应理解根据装置的操作模式,同一实施方式中的各种结构可以以不同方式充当一个或多个电极。例如,在其中氧化剂电极具有双功能并作为充电电极的一些实施方式中,同一电极结构在放电过程中充当氧化剂电极,而在放电过程中充当充电电极。又比如,在放电过程中,燃料电极的所有本体都可以充当燃料电极,但在充电过程中,这些本体中的一个或多个通过接收电沉积的燃料而充当燃料电极,其他一个或多个本体充当充电电极以释放氧化剂(例如,氧气),并且当电沉积的生长连接到更多本体时,燃料电极生长。因此,提到的电极被明确定义为独特的电极结构或者具有多种电极功能的结构可在不同电池操作模式过程中充当的功能性角色,并因此同一多功能结构可被认为因该原因而符合多个电极的要求。
在一个实施方式中,第一电极20的可渗透本体可通过惰性非传导隔离体和/或离子交换膜来隔开。作为一种选择,隔离体也可包括在该内部区域中帮助维持可渗透电极本体的分隔而不明显阻碍电解液22流经的结构。作为另一种非限制性选择,隔离体也可包括在该内部区域中帮助和引导金属燃料沉积的生长形态的结构如网格状布置。
虽然所说明的实施方式中描述的是三个电极本体(即20a、20b和20c),但是任何适合数量的电极本体都是可能的。此外,任何适合的电极本体构型也都是可能的。例如,在一个实施方式中,第一电极20可包括以对称构型布置的电极本体,其中中心电极本体20a是对称轴,因而作为最里面的电极位于电极本体20b和电极本体20b'(未作描述,但一般是电极本体20b的镜像复制)之间。在这样的实施方式中,构型还可包括任意适合数量的额外的第一电极本体、第二电极30和第三电极50。
对于涉及电池构造的进一步具体细节,可参考美国专利或专利申请第13/019,923、13/167,930、13/185,658、13/531,962、13/532,374、13/566,011、13/666,948、和8,309,259号;这些全部在上文通过引用并入本文。
如图2的说明性实施方式所描述的,来自外部电源60的电流在充电模式过程中被施加到第三电极50和第一电极20之间。在这种情况下,第三电极50充当阳极,端部可渗透电极本体20a充当阴极。应认识到,说明性实例中通向端部电极本体20a的一般性连接仅仅是其他众多连接构型中可基于期望操作特征选择的一种可能构型。对于涉及充电/放电过程、开关及其控制的具体细节,可参考美国专利或专利申请第12/885,268、13/083,929、13/230,549、13/277,031、13/299,167、和8,309,259号;这些全部通过引用并入本文。
在一个非限制性实例中,金属燃料是锌,电解液22是含有氢氧化钾的水溶液,其可以是上述图1的实施方式中使用的相同燃料和电解液22。在电解液22中,锌离子可以以任何适合的可还原形式提供,优选以氧化锌ZnO的形式提供。由于氧化锌是先前实施方式的上文所述的电流产生操作的副产物,这样是有利的,并且因此电化学电池10可以使用其自身的电流产生操作的可逆副产物来充电。由于电流产生操作已经在电解液22中产生了可还原的氧化锌,这可以使每次充电供应新鲜来源燃料的需要最小化。在这样的实施方式中,根据方程式(6),在还原位置发生还原反应:
其中,根据方程式(7),相应氧化作用在在所说明的实施方式中充当充电电极并充当阳极的第三电极50处发生,
4OH-——→O2+2H2O+4e- (7)
根据方程式(7),充电电极也可被称为析氧电极。氧气的产生可任选地被以任何适合的方式排气。例如,可以如美国专利申请第12/549,617、13/532,374、13/566,948、和13/666,864号所述(全文并入本文)所述便利地管理氧气产生。
燃料不需要被限制为锌,包括本申请中的上述金属燃料中任一种的其他任何金属燃料也可以使用。类似地,在各种实施方式中,电解液22可以不同,且可以是碱性或酸性的。同样,可还原的金属燃料离子也不必然地通过电流产生操作的副产物提供,在一些实施方式中使用由不容易逆转的产物产生的燃料也在本发明的范围内。因此,从具有用于还原和电沉积的适合形式的燃料离子的单独的燃料来源供应用于充电的电解液22是在本发明的范围内,该燃料来源与在电流产生过程中使用并积聚副产物的电解液22分开。类似地,同一电解液22可同时用于两种过程,但是燃料可在充电操作过程中从其自身来源单独提供。
在充电操作过程中,电沉积可引起或促进金属燃料在可渗透电极本体20中以流动可渗透形态生长,使得电沉积的金属燃料在端部可渗透本体20a和每个后续可渗透电极本体之间建立电连接(例如,连接到电极本体20b,之后连接到电极本体20c)。由于该连续生长,每个后续可渗透电极本体20在通过金属燃料生长建立电连接时在其上发生还原作用和电沉积。在一些实施方式中,当在每个后续可渗透电极本体20上发生生长时,也可在包括外部电源60的电路上通过开关建立外部连接。该连接可以选择性地通过感知的条件在经过时间之后,程序性地或非程序性地来建立。对于涉及连续或渐进燃料生长方法、连接方案及其控制的具体细节,可参考美国专利或专利申请第12/885,268、13/083,929、13/230,549、13/277,031、13/299,167、和8,309,259号;这些全部已通过引用并入本文。
在一个实施方式中,电沉积物的生长可以以使得产生具有流动可渗透形态的总体均匀镀层生长的方式来控制。术语流动可渗透形态是指电极本体20中的金属生长的形态被构造为使得电解液22仍然能够流经电极本体20。因此,在一些实施方式中,允许流动持续,且生长不表现出会导致可渗透电极本体20的孔或开口完全堵塞或阻塞的主要侧向特征(lateral characteristics)。允许的流动可以是任何方向。虽然优选流动,但是也可能在没有任何流动的情况下发生生长。在优选实施方式中,可以在侧向生长关闭第一电极20基底的孔或开口前停止电沉积。沉积的优选形态可基于用途、电池构造、期望操作特征而改变或不改变。因此,实施例的形态并非旨在作出限制,而是由本文所述的本发明提供使用下文所述的杂离子芳族添加剂来调整形态的系统和方法。
在优选实施方式中,生长可作为总体均匀镀层生长而发生。燃料电沉积形态可由离子传导介质22中的添加剂的组成来控制。可受添加剂组成影响的性质包括生长密度、颗粒尺寸、边缘效应以及电沉积镀层电势和电流密度。
可以认识到添加剂可旨在以基本上恒定的速率引入到电沉积物中,由此便利部分循环(即,短充电/放电循环)。如果添加剂以逐渐降低的速率引入到电沉积物中,则将形成不均匀的电沉积物,并且电解液中的有效添加剂浓度将降低。在部分循环的条件下,降低浓度的添加剂可不期望地改变电沉积物的形态,并且每次额外的部分循环可加重不利影响,最终导致短路或其他故障。
不受任何特定理论的约束,但是杂离子芳族添加剂可以具有导致在燃料电极表面处吸附,由此抑制腐蚀的理化性质。这对普遍受到高自放电速率损害的原电池特别有用。添加剂的理化性质可基于芳香性、官能团、电子密度、空间效应等选择。再次地,不受任何特定理论的约束,但是提供离域π电子的芳族官能团可通过与金属电极表面的d轨道之间的相互作用而提供有效的腐蚀抑制。又比如,包含与氮原子相连的未成对电子的杂离子化合物可提供与金属电极表面之间的期望的相互作用。
在一个实施方式中,杂离子芳族添加剂可具有根据下式的结构:
其中A代表可选自下组的电荷中心:季铵、环铵、多环铵、季鏻、环鏻、多环鏻、膦嗪、环膦嗪、多环膦嗪及其衍生物;
其中R代表可选自下组的有机连接键:(C1-C20)直链烷基、支链烷基、芳基、烷基氨基、吡啶基、吡咯基、亚氨基、吡啶基吡嗪基、嘧啶基、噻吩基、噻唑基,及其衍生物;和
其中B代表可选自下组的芳族基团:苯、吖丙因(azirine)、二吖丙因(diazirine)、氮杂环丁二烯(azete)、吡咯、咪唑、吡唑、三唑、吡啶、吡嗪、二嗪、三嗪、吖庚因(azepine)、二吖庚因、吖辛因(azocine)、1-磷杂环戊-2,4-二烯(phosphole)、磷苯(phosphinine)、噁唑、噻吩,及其衍生物。
在一个实施方式中,杂离子芳族添加剂可具有根据下式的结构:
在一个实施方式中,杂离子芳族添加剂结构可旨在通过确保无β质子的碱稳定性连接键来避免电化学还原性裂解。可以认识到碱稳定性连接键可阻止杂离子芳族添加剂的电化学还原性裂解。例如,包含β质子的苄基三甲基铵对于抗电化学还原性裂解比包含无β质子的碱稳定性连接键的三甲基-2-苯基-2-丙铵(propanaminium)较不稳定。在一些实施方式中,邻近芳族基团的连接键可设计为具有多于一个碳来抑制与芳族环相连的共振,由此进一步提供稳定性。
根据一个实施方式,杂离子芳族添加剂可具有根据下式的结构:
其中A代表可选自下组的电荷中心:季铵、环铵、多环铵、季鏻、环鏻、多环鏻、膦嗪、环膦嗪、多环膦嗪及其衍生物;
其中R1代表可选自下组的提供相对于电荷中心A的β碳原子的支链连接:支链烷基、芳基、新戊基、叔丁醇,及其衍生物;
其中R2代表可选自下组的包含至少两个碳原子的有机连接键:(C1-C20)直链烷基、支链烷基、芳基、烷基氨基、吡啶基、吡咯基、亚氨基、吡啶基吡嗪基、嘧啶基、噻吩基、噻唑基,及其衍生物;和
其中B代表可选自下组的芳族基团:苯、吖丙因、二吖丙因、氮杂环丁二烯、吡咯、咪唑、吡唑、三唑、吡啶、吡嗪、二嗪、三嗪、吖庚因、二吖庚因、吖辛因、1-磷杂环戊-2,4-二烯、磷苯、噁唑、噻吩,及其衍生物。
在一个实施方式中,杂离子芳族添加剂可具有选自下组的结构:
及其衍生物。
在一个实施方式中,与特定杂离子芳族阳离子相连的阴离子可基于溶解度、化学稳定性、电化学稳定性或其他任何适合的性质而作出选择。阴离子的非限制性实例包括氢氧根、甲基碳酸根、四氟硼酸根(BF4-)、六氟磷酸根(PF6-)、卤根、磷酸根、硫酸根,及其组合。
在一个实施方式中,本文所述杂离子芳族添加剂可与前述专利或专利申请中公开的其他添加剂组合。可以认识到个体添加剂没有观察到协同效应也许对于操作包括金属燃料的电化学电池是有利的。
在一些实施方式中,离子传导介质22可包含聚(乙二醇)四氢糠基(PEG-THF)和/或铟盐、锡盐、铅盐、锗盐、铜盐、汞盐、铋盐、酒石酸盐、磷酸盐、柠檬酸盐、琥珀酸盐、铵盐或其他析氢反应(HER)抑制添加剂,如已在上文中通过引用并入的美国专利申请第13/028,496号所述。这些是可选的,且可被省略。在一些实施方式中,离子传导介质22可包含不同于金属燃料的金属的金属盐。例如,离子传导介质22可包含铟、锡、铅、锗、铜、汞或其他适合的金属或半金属的金属盐。PEG-THF和金属盐是任选的,且可被省略。
在一些实施方式中,离子传导介质22可包含不同于金属燃料的金属的金属氧化物。例如,离子传导介质22可包含铟、锡、铅、锗、铜、汞或其他适合的金属或半金属的金属盐。金属氧化物是任选的,且可被省略。
在一些实施方式中,离子传导介质可包含已在上文中通过引用并入的美国专利申请第13/526,432号公开的杂离子化合物。例如,杂离子化合物阳离子可选自1-甲基-4-氮杂-1-氮鎓二环[2,2,2]辛烷、甲基-3-奎宁环鎓(quinuclidinolium),它们的衍生物,及其组合。杂离子化合物是任选的,且可被省略。
在一些实施方式中,离子传导介质可包含在与本申请同日提交且共同转让予Fluidic,Inc.的共同未决申请“用于具有电沉积燃料的电化学电池的协同性添加剂(Synergistic additives for electrochemical cells with electrodeposited fuel)”中描述的添加剂。例如,离子传导介质可进一步包含大杂环化合物、季鏻盐、氨基鏻盐及其衍生物与组合。然而,本文提及的任意添加剂均可自身单独使用。
杂离子芳基添加剂浓度可以在0.0001mol/L至0.4mol/L的范围内。电流密度范围可以是110mA/cm2或者在低于110mA/cm2的范围内。在优选实施方式中,电流密度可以在5-100mA/cm2的范围内。这些范围是实例,而非旨在作出限制。
为了维持电解质溶液中添加剂的期望水平或目标水平,可以使用美国专利申请第13/220,349号中公开的添加剂调节剂。该申请的全文通过引用并入本文。
实施例
在本发明的示例性实施方式中,对8.0M KOH和1.25M ZnO电解质溶液中的第一电极20施加50mA/cm2的电流密度。图3中的不同放大倍数图像显示出在电解液和一叠可渗透电极本体中的电极之间的界面处的电沉积,其中电解液包含2.0mM 1-苄基-4-氮杂-1-氮鎓二环[2,2,2]辛烷氢氧化物和0.25mM氯化铟InCl3。光滑的电沉积物示出电沉积的金属在整个燃料电极表面上积聚为总体光滑、微糙的层。形成了可忽略的枝状物,由此在从一次充电-放电循环到下一次充电-放电循环的过程中保持电极表面形态。
上文说明的实施方式仅提供以说明本发明的结构和功能原理,而非旨在作出限制。例如,可以使用不同的燃料、不同的氧化剂、不同的电解液,和/或不同的整体结构性配置或材料来实施本发明。因此,本发明旨在涵盖所有修改、替换、改变和等效物。
- 还没有人留言评论。精彩留言会获得点赞!