锂电极的预处理方法和锂金属电池与流程
本申请要求于2016年11月24日向韩国知识产权局提交的韩国专利申请10-2016-0157341号的优先权和权益,通过参考将其全部内容并入本文中。
本发明涉及一种预处理锂电极的方法和锂金属电池,特别地涉及一种通过将锂电极浸入用于形成固体电解质界面的组合物中的预处理来稳定锂电极的方法、以及包含这样的锂电极的锂金属电池。
背景技术:
已知使用锂金属和非水电解质作为基础的电化学体系是热力学不稳定的,结果在锂电极表面上形成由因锂与电解质组分之间的相互作用得到的产物而形成的膜。该膜的性质由形成电解质体系的组分的化学性质决定,并且在各种电解质中,可以在锂电极表面上形成钝化膜,这对于电解质本身具有有利的保护性能并对于锂离子具有高离子传导率。
通常,在二次电池中,在使用锂金属作为负极的锂金属电池的运行期间,锂离子在锂电极表面上被还原,并且根据形成电解液的溶剂和锂盐的组合,具有各种组成的固体电解质界面(sei)在锂电极上形成,并不可逆地发生。然而,当形成在锂电极表面上的sei层不稳定时,电解液与锂电极之间的直接反应一直发生,产生额外的不可逆性,这导致电池的充电和放电效率降低。另外,不稳定的sei层的形成起到缩短电池寿命的因素的作用,例如引起电解液耗尽和产生作为副产物的气体。
[现有技术文献]
(专利文献1)韩国专利申请公开公报第2016-0050222号,“electrolytesolutionforlithiummetalbatteryandlithiummetalbatteryincludingthesame(用于锂金属电池的电解液和包含其的锂金属电池)”
技术实现要素:
技术问题
因此,本发明的一个方面提供一种在锂电极上形成稳定的固体电解质界面(sei)的预处理方法。
技术方案
根据本发明的一个方面,提供一种预处理锂电极的方法,所述方法通过将锂电极浸入用于形成固体电解质界面(sei)的组合物中来预处理锂电极。用于形成固体电解质界面的组合物可以仅使用醚类溶剂,可以将锂盐混合到醚类溶剂中,或者可以合并醚类溶剂、锂盐和添加剂三种组分。
根据本发明的另一方面,提供一种包含稳定的锂电极的锂金属电池。
有益效果
根据本发明,当使用锂电极的预处理工序预先在锂电极上形成这样的固体电解质界面(sei),然后将形成有sei层的锂电极用于锂金属电池时,获得降低界面电阻并提高li充电和放电效率的效果。
附图说明
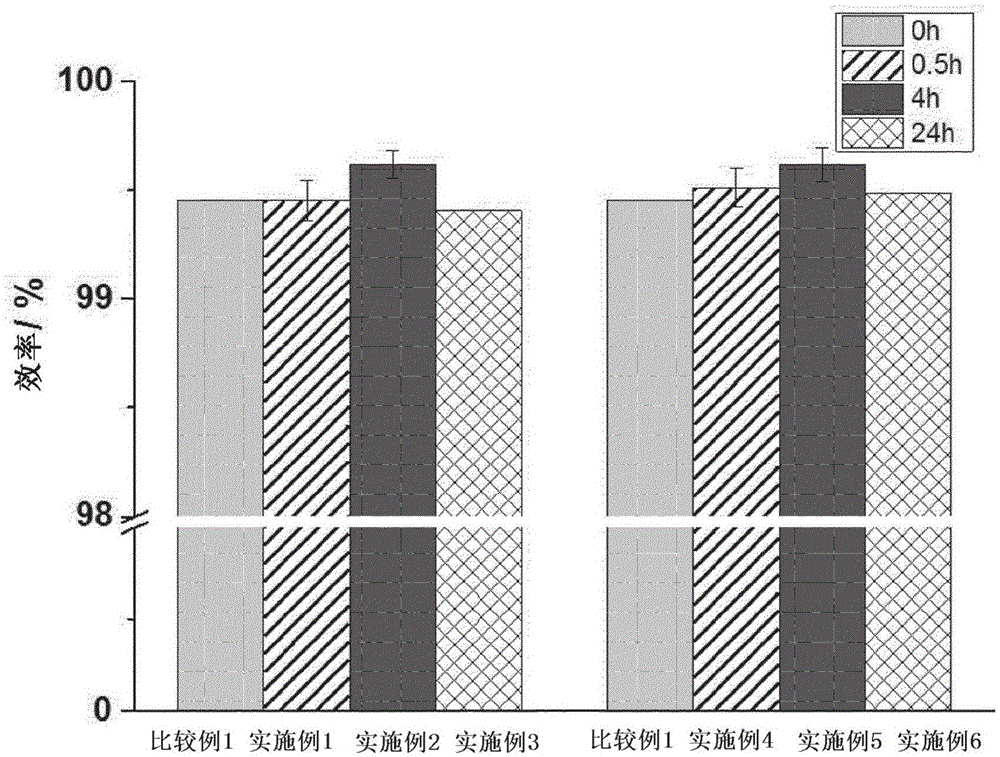
图1显示了本发明实施例1~6和比较例1的效率随浸渍时间而变化的数据。
图2显示了本发明实施例4~9和比较例1的浸渍预处理的锂金属电极的界面电阻随老化时间而变化的数据。
图3显示了对本发明的比较例1、实施例5、实施例11和13进行比较的效率随sei层形成效果而变化的数据。
图4显示了本发明实施例10~13和比较例1和2的浸渍预处理的锂金属的界面电阻随老化时间而变化的数据。
具体实施方式
本发明提供一种预处理锂电极的方法,所述方法通过将锂电极浸入用于形成固体电解质界面(sei)的组合物中来预处理锂电极。在下文中,将对本发明进行具体描述。
用于形成固体电解质界面(sei)的组合物
在本发明中,用于形成sei的组合物用于在制造锂金属电池之前浸渍并由此预处理锂金属,并且是基于非水有机溶剂的。所述非水有机溶剂是参与电池的电化学反应的离子能够迁移通过的介质。另外,sei层抑制电解质在锂电极表面上的分解,从而降低电极与电解质之间的界面电阻,并起到使电极稳定的保护层的作用。
根据本发明的一个实施方案,可以使用一种或多种类型的醚类溶剂作为所述非水有机溶剂。通过在降低用于形成sei的组合物的粘度的同时,将锂阳离子与醚的对称结构螯合来增加添加的锂盐的离解度,并显著提高锂离子在用于形成sei的组合物中的传导率,从而在激发用于形成sei层的氧化还原反应方面,醚类溶剂是优选的。离子传导率通常取决于离子在电解液中的迁移率,因此,溶剂粘度和溶液中的离子浓度是影响离子传导率的因素。随着用于形成sei的组合物的粘度降低,离子迁移在溶液中不受限制并且离子传导率增加,并且随着用于形成sei的组合物中的离子浓度增加,离子(电荷转移剂)的量增加,结果提高了离子传导率。由于这样的原因,醚类溶剂有助于在锂电极上形成更稳定的sei层,结果,获得更高的充电和放电效率,并且界面电阻降低。
在此,醚类溶剂包括:无环醚、环醚、聚醚或它们的混合物,优选环醚或c4~c10醚,更优选c4~c10环醚。当环开环时,环醚容易形成聚合物,特别地,在c4~c10环醚中形成具有适当厚度的sei层。因为li金属是活性材料,所以使用不具有反应性的溶剂是有利的,然而,使用溶剂一致地制造薄的sei层有助于防止由副反应引起的锂金属耗尽,并且稳定地运行电池。
环醚的非限制性实例可以选自:二氧戊环(dol)、甲基二氧戊环、
无环醚的非限制性实例可以选自:二乙醚、二丙醚、二丁醚、二甲氧基甲烷(dmm)、三甲氧基甲烷(tmm)、二甲氧基乙烷(dme)、二乙氧基乙烷(dee)和二甲氧基丙烷(dmp)。
聚醚的非限制性实例可以选自:二乙二醇二甲醚、三乙二醇二甲醚、四乙二醇二甲醚、乙二醇二乙烯基醚、乙二醇乙基甲基醚、二乙二醇二乙烯基醚、三乙二醇二乙烯基醚、二丙二醇二亚甲基醚和丁二醇醚。
更具体地,醚类溶剂可以是1,3-二氧戊环、1,2-二甲氧基乙烷、呋喃、2-甲基呋喃、2,5-二甲基呋喃、四氢呋喃、环氧乙烷、1,4-二
优选地,可以从无环醚和环醚中各自选择一种类型并混合,更优选地,以一定的混合比例将1,3-二氧戊环和1,2-二甲氧基乙烷混合,并且作为一个实例,可以使用以1:1的重量比将这些物质混合的溶液。
同时,根据本发明一个实施方案的用于形成sei的组合物包含分散在非水有机溶剂中的锂盐。
锂盐没有特别限制,只要其通常用于锂金属电池中即可。例如,锂盐可以是选自如下中的一种或多种化合物:liscn、licl、libr、lii、lipf6、libf4、lisbf6、liasf6、lib10cl10、lich3so3、licf3so3、licf3co2、liclo4、lialcl4、li(ph)4、lic(cf3so2)3、lin(fso2)2、lin(cf3so2)2、lin(c2f5so2)2、lin(sfo2)2、lin(cf3cf2so2)2、氯硼烷锂、低级脂族羧酸锂、四苯基硼酸锂、亚氨基锂和它们的组合。优选使用lin(fso2)2(lifsi)。通过在锂电极表面上形成上述固态且稳定的sei层,这种锂盐改善了初始输出性能以及低温和高温输出性能。
锂盐浓度可以考虑离子传导率等来确定,并且在0.05m~5.0m的范围内,优选为0.2m~2.0m,或0.5m~1.6m。换句话说,为了确保用于形成稳定的sei层的离子传导率,锂盐浓度优选为0.05m以上。然而,当过量添加锂盐时,电解液粘度增加,降低锂离子迁移率,结果,因为氧化还原反应可能不会平稳地发生,所以可能不会形成稳定的sei层。因此,锂盐浓度优选为5.0m以下。
在根据本发明一个实施方案的用于形成sei的组合物中,与上述锂盐一起分散的添加剂包含在醚类溶剂中。特别地,添加剂可以是硝酸盐(或酯)化合物。硝酸盐(或酯)化合物在锂电极上形成稳定的sei层方面是有效的,并大大提高充电和放电效率。这样的硝酸盐(或酯)化合物在本发明中没有特别限制,然而,可以使用选自如下中的一种或多种:无机硝酸盐化合物如硝酸锂(lino3)或亚硝酸锂(lino2);有机硝酸酯化合物如硝基甲烷(ch3no2)或硝酸甲酯(ch3no3);和它们的组合,并且优选使用硝酸锂(lino3)。
在100重量%的电解质组合物整体中,以0.01重量%~10重量%并优选0.1重量%~5重量%的量使用包含在用于形成sei的组合物中的添加剂。当含量小于上述范围时,可能无法充分获得增强电池性能的效果,并且当含量大于上述范围时,组合物粘度增加,降低锂离子迁移率,并且电阻可能由于膜而升高,降低电池性能。因此,将含量适当地控制在上述范围内。
如上所述,对于根据本发明一个实施方案的用于形成sei的组合物,作为第一实施方案,仅使用醚类溶剂;作为第二实施方案,将锂盐混合到醚类溶剂;或者作为第三实施方案,合并醚类溶剂、锂盐和添加剂三种组分,并且在增强锂金属稳定性方面,制备根据第三实施方案的用于形成sei的组合物是最优选的。
形成在锂电极上的sei层的厚度相对于锂电极的厚度优选在0.025%~2.5%的范围内形成,并且具体地,可以为10nm~10μm。当厚度小于上述范围时,保护锂电极的效果不明显,并且当厚度大于上述范围时,得到增加界面电阻的不利效果。
随着将锂电极浸入用于形成sei的组合物中的时间增加,形成的sei层变厚,例如当基于室温将锂电极浸渍0.5小时~24小时、优选1小时~12小时且更优选2小时~8小时时,可以在锂电极表面上稳定地形成sei层。此外,室温可以是在5℃~35℃范围内的任意温度。如上形成的sei层在使用锂电极的电池运行时起到降低界面电阻并提高效率的作用。
锂金属电池
通过将锂电极浸入上述用于形成sei的组合物中而预处理的锂电极可以用于使用锂金属作为负极的各种锂金属电池中。更具体地,锂金属电池可以是锂硫电池、锂空气电池、全固态电池等。在根据本发明的锂金属电池中,本领域技术人员可以通过已知技术来制备除上述负极之外的构成,并且在下文中,将提供具体说明。
根据本发明的一个实施方案,锂金属电池包含:壳;电极组件,所述电极组件位于所述壳内部并包含正极、负极和设置在所述正极与所述负极之间的隔膜;以及注入到所述壳中的电解质。
另外,根据本发明的一个实施方案,锂金属可以以薄膜形式以其一个表面邻接负极集电器的方式用作锂金属电池的负极。
负极集电器没有特别限制,只要其具有高导电性而不会引起电池的化学变化即可,并且可以是选自如下中的任意一种金属:铜、铝、不锈钢、锌、钛、银、钯、镍、铁、铬、它们的合金和它们的组合。不锈钢可以具有经碳、镍、钛或银处理的表面,并且可以将铝-镉合金用作合金,除此之外,还可以使用焙烧碳、表面经导电材料处理的不导电聚合物、导电聚合物等。通常将铜薄板用作负极集电器。
负极集电器通常具有3μm~500μm的厚度范围。当负极集电器的厚度小于3μm时,集电效果降低,并且厚度大于500μm时,在通过折叠来组装电池时存在加工性下降的问题。根据需要,可单独使用锂负极而不使用集电器。
对于根据本发明的正极,可以将包含正极活性材料、导电材料和粘合剂的组合物以膜的形式形成在正极集电器上并制备成正极形式。
正极活性材料可以包含元素硫(s8)、硫系列化合物或它们的混合物,并且这些材料也可与导电材料复合,因为硫材料本身不具有导电性。硫系列化合物可具体选自li2sn(n≥1)、有机硫化合物、碳-硫聚合物((c2sx)n:x=2.5~50,n≥2)等。导体可以没有限制地使用,只要其具有孔隙率和导电性即可,例如可以使用具有多孔性的碳类材料。
作为正极活性材料,可以使用选自如下中的任意一种或它们的两种以上的混合物:licoo2、linio2、limno2、limn2o4、li(niacobmnc)o2(0<a<1,0<b<1,0<c<1,a+b+c=1)、lini1-ycoyo2、lico1-ymnyo2、lini1-ymnyo2(0≤y<1)、li(niacobmnc)o4(0<a<2,0<b<2,0<c<2,a+b+c=2)、limn2-znizo4、limn2-zcozo4(0<z<2)、licopo4和lifepo4。另外,除了这样的氧化物之外,也可以使用硫化物、硒化物、卤化物等。
导体是用于进一步提高正极活性材料的导电性的组分,其非限制性实例可以包括:石墨如天然石墨或人造石墨;炭黑类如炭黑、乙炔黑、科琴黑、槽法炭黑、炉黑、灯黑和热裂法炭黑;导电纤维如碳纤维或金属纤维;氟碳化合物;金属粉末,如铝粉和镍粉;导电晶须如氧化锌和钛酸钾;导电金属氧化物如钛氧化物;导电材料如聚亚苯基衍生物等。
粘合剂具有将正极活性材料保持在正极集电器上并且有机连接正极活性材料的功能,其实例可以包括:聚偏二氟乙烯(pvdf)、聚丙烯酸(paa)、聚乙烯醇(pva)、羧甲基纤维素(cmc)、淀粉、羟丙基纤维素、再生纤维素、聚乙烯基吡咯烷酮、四氟乙烯、聚乙烯、聚丙烯、乙烯-丙烯-二烯聚合物(epdm)、磺化epdm、丁苯橡胶、氟橡胶、它们的各种共聚物等。
正极集电器与关于负极集电器所述的相同,并且通常可以使用铝薄板作为正极集电器。
根据本发明的隔膜在材料上没有特别限制,并且作为物理地隔开正极和负极并且具有电解质和离子渗透性的材料,可以使用通常用作电化学装置中的隔膜的那些材料,而没有特别限制。然而,作为多孔、不导电且绝缘的材料,特别优选在对液体电解质的离子迁移的阻力低的同时具有优异的液体电解质含湿能力的那些材料。例如,可以使用聚烯烃类多孔膜或无纺布,然而,隔膜不特别地限制于此。
作为聚烯烃类多孔膜的实例,可以包括利用单独使用聚烯烃类聚合物的聚合物形成的膜或利用将这些聚烯烃类聚合物混合而得的聚合物形成的膜,所述聚烯烃类聚合物为例如:聚乙烯如高密度聚乙烯、线性低密度聚乙烯、低密度聚乙烯和超高分子量聚乙烯;聚丙烯;聚丁烯;和聚戊烯。
作为上述聚烯烃类无纺布之外的无纺布,可以使用利用单独使用例如如下物质的聚合物形成的无纺布或利用将这些物质混合而得的聚合物形成的无纺布:聚苯醚、聚酰亚胺、聚酰胺、聚碳酸酯、聚对苯二甲酸乙二醇酯、聚萘二甲酸乙二醇酯、聚对苯二甲酸丁二醇酯、聚苯硫醚、聚缩醛、聚醚砜、聚醚醚酮、聚酯等,并且作为形成多孔布的纤维形式,这样的无纺布包括由长纤维形成的纺粘或熔喷形式。
隔膜的厚度没有特别限制,但优选在1μm~100μm的范围内,更优选在5μm~50μm的范围内。当隔膜的厚度小于1μm时,可能无法保持机械性能,并且当厚度大于100μm时,隔膜充当电阻层,从而降低电池性能。
隔膜的孔径和孔隙率没有特别限制,然而,孔径优选为0.1μm~50μm,且孔隙率优选为10%~95%。当隔膜的孔径小于0.1μm或孔隙率小于10%时,隔膜充当电阻层,且当孔径大于50μm或孔隙率大于95%时,可能不能保持机械性能。
能够用于本发明的电解质可以是液体非水电解质、或聚合物电解质如固体电解质或凝胶电解质。在前者中,非水电解质电池可以形成为锂离子二次电池,并且在后者中,非水电解质电池可以形成为聚合物电解质电池如聚合物固体电解质或聚合物凝胶电解质。
包含在非水液体电解质中的电解质盐是锂盐。作为锂盐,可以没有限制地使用通常用于锂二次电池用液体电解质中的锂盐。例如,锂盐的阴离子可以包含选自如下中的任意一种或其两种以上的阴离子:f-、cl-、br-、i-、no3-、n(cn)2-、bf4-、clo4-、pf6-、(cf3)2pf4-、(cf3)3pf3-、(cf3)4pf2-、(cf3)5pf-、(cf3)6p-、cf3so3-、cf3cf2so3-、(cf3so2)2n-、(fso2)2n-、cf3cf2(cf3)2co-、(cf3so2)2ch-、(sf5)3c-、(cf3so2)3c-、cf3(cf2)7so3-、cf3co2-、ch3co2-、scn-和(cf3cf2so2)2n-。
包含在非水液体电解质中的锂盐的浓度优选为0.1mol/l~5mol/l,更优选0.5mol/l~3.0mol/l。
作为包含在非水液体电解质中的有机溶剂,可以没有限制地使用通常用于锂二次电池用液体电解质中的有机溶剂,例如可以单独或作为其两种以上的混合物使用如下物质:醚、酯、酰胺、链状碳酸酯、环状碳酸酯等。其中,通常可以包含碳酸酯化合物,所述碳酸酯化合物为环状碳酸酯、链状碳酸酯或其混合物。
环状碳酸酯化合物的具体实例可以包括选自如下中的任意一种或其两种以上的混合物:碳酸亚乙酯(ec)、碳酸亚丙酯(pc)、碳酸-1,2-亚丁酯、碳酸-2,3-亚丁酯、碳酸-1,2-亚戊酯、碳酸-2,3-亚戊酯、碳酸亚乙烯酯、乙烯基碳酸亚乙酯和它们的卤化物。其卤化物的实例可以包括氟代碳酸亚乙酯(fec)等,但不限于此。
此外,链状碳酸酯化合物的具体实例通常可以包括选自如下中的任意一种或其两种以上的混合物:碳酸二甲酯(dmc)、碳酸二乙酯(dec)、碳酸二丙酯、碳酸甲乙酯(emc)、碳酸甲丙酯和碳酸乙丙酯,但不限于此。
特别地,在碳酸酯类有机溶剂中,作为环状碳酸酯的碳酸亚乙酯和碳酸亚丙酯是高粘性有机溶剂并且具有高介电常数,因此,可以更有利地将锂盐离解在电解质中,并且当将具有低粘度和低介电常数的链状碳酸酯如碳酸二甲酯和碳酸二乙酯以适当的比例与这样的环状碳酸酯混合并使用时,可以制备具有更高导电性的液体电解质。
另外,作为有机溶剂中的醚,可以使用选自如下中的任意一种或其两种以上的混合物:二甲醚、二乙醚、二丙醚、甲基乙基醚、甲基丙基醚和乙基丙基醚,然而,醚不限于此。
作为有机溶剂中的酯,可以使用选择如下中的任意一种或其两种以上的混合物:乙酸甲酯、乙酸乙酯、乙酸丙酯、丙酸甲酯、丙酸乙酯、丙酸丙酯、γ-丁内酯、γ-戊内酯、γ-己内酯、σ-戊内酯和ε-己内酯,然而,酯不限于此。
根据制造工序和最终产品的所需性能,可以在电化学装置制造工序中的适当阶段注入非水液体电解质。换句话说,非水液体电解质可以在组装电化学装置之前的阶段或在电化学装置组装的最后阶段注入。
除了作为普通工序的卷绕之外,根据本发明的锂金属电池还可以经历隔膜和电极的层叠(堆叠)和折叠工序。另外,电池壳可以是圆柱型、方型、袋型、硬币型等。
如上所述,根据本发明的锂金属电池稳定地表现出优异的放电容量、输出性能和容量保持率,因此可以用于如下领域:便携式装置如移动电话、笔记本电脑或数码照相机;电动车辆如混合动力电动车辆(hev)等。
根据本发明的另一实施方案,提供了一种包含锂金属电池作为单元电池的电池模块、以及包含所述电池模块的电池组。电池模块或电池组可以用作诸如如下的任意一种或多种中型到大型装置的电源:电动工具;电动车辆类,包括电动车辆(ev)、混合动力电动车辆(hev)和插电式混合动力电动车辆(phev);或用于电力存储的系统。
优选实施方案
在下文中,将参考实施例对本发明进行详细描述,以具体描述本发明。然而,根据本发明的实施例可以修改为各种不同的形式,并且本发明的范围不应解释为限于下面描述的实施例。提供本发明的实施例是为了将本发明更全面地描述给本领域的普通技术人员。
<实施例1~3>
使用通过在1,2-二甲氧基乙烷(dme)中分别浸渍30分钟、4小时和24小时来进行预处理的锂电极作为负极制造了锂金属电池。
作为正极,使用以相同方式预处理的锂金属形成li对称电池。作为电解质,使用将lifsi盐溶解在醚类溶剂中的液体电解质,并且作为隔膜,使用聚乙烯类隔膜来制造硬币电池形式的电池。
<实施例4~6>
使用通过在1,3-二氧戊环(dol)中分别浸渍30分钟、4小时和24小时来进行预处理的锂电极,以与实施例1相同的方式制造了锂金属电池。
<实施例7~9>
使用通过在以1:1的重量比(w/w)将1,3-二氧戊环(dol)和1,2-二甲氧基乙烷(dme)进行混合而得的溶剂中分别浸渍30分钟、4小时和24小时来进行预处理的锂电极,以与实施例1相同的方式制造了锂金属电池。
<实施例10>
使用通过在1,3-二氧戊环(dol)中包含1mlifsi和1重量%lino3而得的组合物中浸渍4小时进行预处理的锂电极,以与实施例1相同的方式制造了锂金属电池。
<实施例11>
使用通过在1,3-二氧戊环(dol)中包含1mlifsi和2重量%lino3而得的组合物中浸渍4小时进行预处理的锂电极,以与实施例1相同的方式制造了锂金属电池。
<实施例12>
使用通过在1,3-二氧戊环(dol)中包含1mlifsi和3重量%lino3而得的组合物中浸渍4小时进行预处理的锂电极,以与实施例1相同的方式制造了锂金属电池。
<实施例13>
使用通过在1,3-二氧戊环(dol)中包含1mlifsi和4重量%lino3而得的组合物中浸渍4小时进行预处理的锂电极,以与实施例1相同的方式制造了锂金属电池。
<比较例1>
使用未经预处理的锂电极以与实施例1相同的方式制造了锂金属电池。
<比较例2>
使用通过在1,3-二氧戊环(dol)中包含1重量%lino3而得的组合物中浸渍4小时进行预处理的锂电极,以与实施例1相同的方式制造了锂金属电池。
<实验例1>效率随浸渍时间的变化的评价
在通过使用实施例1~6和比较例1的各种浸渍预处理的锂金属形成li对称电池来制造硬币电池之后,重复li镀敷/剥离以评价锂负极的效率,直到锂被完全消耗,并将结果示于图1中。
实施例1、2和3显示了浸渍在dme溶剂中的锂电极的效率随浸渍时间的变化,且实施例4、5和6显示了浸渍在dol溶剂中的锂电极的效率随浸渍时间的变化。根据实验结果确认,当在预处理中浸渍约4小时时,提高效率的效果大大增加。
<实验例2>界面电阻随浸渍时间的变化的评价
在通过使用实施例4~9和比较例1的各种浸渍预处理的锂金属形成li对称电池来制造硬币电池之后,使用电化学阻抗谱(eis)法测量了界面电阻随时间的变化,并将结果示于图2中。
图2显示了在分别浸渍在dol和dol/dme(1:1v/v)溶剂中的锂金属的实际组合物中进行老化的同时对界面电阻的变化进行观察的数据。如图1所示,确认了,在浸渍约4小时的实施例5和实施例8中获得了锂金属的低且稳定的界面电阻的结果。
<实验例3>效率随锂盐和添加剂浓度的变化的评价
在通过使用比较例1、实施例5和实施例10~13的各种浸渍预处理的锂金属形成li对称电池来制造硬币电池之后,重复li镀敷/剥离以评价锂负极的效率,直到锂被完全消耗,并将结果示于图3中。
当参考图3时,与未进行预处理的比较例1相比,在浸渍在1,3-二氧戊环(dol)中的实施例5中,锂负极的效率进一步提高,相比之下,确认了,在浸渍在包含锂盐和添加剂的组合物中的实施例11和13中,锂负极的效率大大提高。特别地,包含2%添加剂的实施例11具有最大的效率增加。
<实验例4>界面电阻随锂盐和添加剂浓度的变化的评价
在通过使用实施例10~14和比较例1和2的各种浸渍预处理的锂金属形成li对称电池来制造硬币电池之后,使用电化学阻抗谱(eis)法测量了界面电阻随时间的变化,并将结果示于图4中。
当参考图4时,确认了,实施例11和12(组合物包含锂盐和1重量%~4重量%的添加剂)的界面电阻测量为最低,而比较例2(组合物不含锂盐而包含添加剂)比没有预处理的比较例1具有增加的界面电阻。因此,可以看出,为了降低锂电极的界面电阻,需要将锂电极浸渍在包含锂盐并且除此之外还包含合适量的添加剂的组合物中。
- 还没有人留言评论。精彩留言会获得点赞!