二次电池和包含二次电池的装置的制作方法
本发明涉及可以通过充放电反应反复使用的二次电池。此外,本发明涉及包含该二次电池的装置。
背景技术:
铅蓄电池作为二次电池之一被广泛使用。该二次电池是使用氧化铅作为正极活性物质、金属铅作为负极活性物质、硫酸作为电解液的电池。随着铅蓄电池的放电反应,作为正极活性物质的氧化铅与电解液中的硫酸根离子反应,变成硫酸铅的同时失去结合氧。该结合氧与电解液中的氢离子反应生成水。此外,同时负极的金属铅也同样地发生金属铅与硫酸根离子的反应,生成硫酸铅。该硫酸铅在作为负极活性物质的金属铅的表面生成。由于在这些正·负极活性物质表面上生成的硫酸铅难溶于硫酸,因此留在两种活性物质上。
另一方面,通过铅蓄电池的充电反应,在正极表面上产生的硫酸铅被氧化为氧化铅,在负极表面上产生的硫酸铅被还原为金属铅,返回到放电反应前的状态。
因此,可以说铅蓄电池的特征在于:(1)作为正极活性物质的氧化铅和作为负极活性物质的金属铅是良好的电子传导体;(2)作为电解液的硫酸是水性电解液,与锂离子二次电池中使用的非水溶类(有机类电解液)相比,离子传导率高;以及(3)通过与硫酸根离子的反应而在两种活性物质表面上产生的硫酸铅难溶于硫酸,均保持在电极表面析出的状态。
如上所述,由于电极活性物质的电子传导性高和电解液的离子传导性高、放电时的反应生成物与电极表面密合,铅蓄电池具备具有高放电倍率(放電レート)特性这样的特征。
与作为二次电池一种的锂离子二次电池不同,铅蓄电池由于铅蓄电池的反应机制而在满充电状态下具有高电池稳定性,通常能够适用于在满充电下使用的用途。例如,适合于在行驶时通常处于充电状态并且在发动机启动时需要获得高电力的汽车和摩托车的用途中的使用。再加上铅和硫酸是廉价的材料,铅蓄电池作为二次电池在今天也被广泛使用。
作为使用铅以外的金属材料的电池的例子,例如,在专利文献1中记载了一种印刷电池,其特征在于:该印刷电池为将印刷氧化锰浆而制作的阳极和印刷锌浆而形成的阴极经由浸渗有电解液的隔膜层叠而构成的印刷电池,上述电解液含有2重量%~25重量%的磷酸。
此外,在专利文献2中记载了一种碱性电池,其特征在于:在使用含有铝的锌合金作为负极活性物质的碱性电池中,作为含有该负极活性物质的凝胶状锌负极的电解液,使用含有由磷酸或磷酸的碱盐形成的磷酸根离子的电解液。
此外,在专利文献3中记载了由容器(12)、再充电型锌负电极(14)、离子导电水性电解质、二氧化锰·正电极(18)、隔膜(16)、密封栓部件(22)和端子装置(ターミナル手段)(26、28)构成的再充电型电化学电池。
现有技术文献
专利文献
专利文献1:日本特开2012-209048号公报
专利文献2:日本特许第2609609号公报
专利文献3:日本特表平8-508847号公报
技术实现要素:
发明要解决的技术问题
铅蓄电池具有由其反应机制所带来的特征的电池特性(高倍率放电、满充电状态下的稳定性);另一方面,铅和铅化合物的毒性、硫酸的危险性广为人知。
关于铅化合物引起的铅中毒,以前有因从含铅的水管中溶出铅而发生铅中毒的情况。此外,随着铅的毒性,禁止将作为防爆剂(アンチノッキング剤)使用的烷基铅化合物添加到原动机用汽油中。此外,以电子元件行业中的例子而言,被广泛使用的铅焊料正在向无铅化发展。此外,根据rohs指令,由于铅的毒性,认为对电子设备中使用的铅的管制是必然的。另一方面,在铅蓄电池中,由于其优异的性能,存在必须继续使用铅化合物这样的状况,即使在现在,它也仍作为用于启动原动机的电动机用电源等而被广泛使用。
此外,作为铅蓄电池的电解液使用的硫酸与其它代表性的无机酸不同,其具有极强的脱水作用且具有不挥发性,因此,作为能引起严重化学性伤害(化学烧伤)的物质而广为人知。综上所述,可以说构成铅蓄电池的活性物质和电解液材料都是仅由对人体和生态系统产生极大影响的物质构成的蓄电池。
另一方面,在专利文献1中记载了一种涉及电动势大且电池寿命长的可挠性(可撓性)锌/二氧化锰类印刷电池及其制造方法的发明。此外,在专利文献1中记载了将印刷氧化锰浆而制作的阳极和印刷锌浆而形成的阴极经由浸渗有电解液的隔膜层叠而构成的印刷电池,前期电解液含有2重量%~25重量%的磷酸。
此外,在专利文献1中记载了,发现在电解液中使用磷酸水溶液的情况下,虽然不满足无负荷放电(無負荷放電)特性,但初始电动势达到2v,特别是通过在氯化锌/氯化铵(塩化亜鉛/塩化アンモン)类电解液、氯化锌类电解液中添加磷酸,得到显著的电动势提高效果以及无负荷放电特性也良好的印刷电池(一次电池)。
然而,在专利文献1中记载的电池是涉及作为一次电池的一种的锰电池的发明。此外,在专利文献1中记载的电池中,提倡使氯化锌和磷酸在电解液中共存。由于磷酸锌难溶于电解液,因此可以推测,若向含有氯化锌的电解液中添加磷酸,则会变成磷酸锌而沉淀、难溶。此外,在专利文献1中记载的电池中,在电解液中使用氯化物盐的情况下,假设如果进行充电,则结果会产生氯气。这是因为,与电解液中含有的通过水的解离所产生的氢氧化物离子(水酸化物イオン)相比,在电解液中的氯化物离子优先被氧化。所产生的氯气导致电池内压的上升,也有强制泄漏的危险性,同时所产生的氯气不会再次离子化并返回电解液中。因此表明该反应是不可逆的(不可充电)。因此,在专利文献1中记载的电池不能作为二次电池使用。
在专利文献2中记载了使用含有铝的锌合金作为负极活性物质的碱性电池。具体而言,在专利文献2中记载了一种碱性电池,其特征在于,作为凝胶状锌负极的电解液含有由磷酸或磷酸的碱盐形成的磷酸根离子。在碱性电池的情况下,作为电解液中使用的碱性溶液,通常使用氢氧化钾水溶液。置于碱下的正极活性物质和负极活性物质中的放电反应的生成物成为化合价降低的锰氧化物和氧化锌。
因此,专利文献1和专利文献2均都停留在与一次电池的改良相关,没有提及作为二次电池的功能。需要具有与铅蓄电池同样的性能,同时减少铅等有害物质的使用量或不使用铅等有害物质的二次电池。
在专利文献3中记载了包含再充电型锌负电极、离子导电水性电解质和二氧化锰·正电极的再充电型电化学电池。此外,在专利文献3中记载了,特别地,水性电解质的主要成分可以选自于由碱金属氢氧化物(例如koh);或者h2so4、h3bo3或h3po4这样的酸或它们的混合物;或者可为zncl2、nh4cl、nacl或kcl的盐的溶液或它们的混合物组成的组。另一方面,在专利文献3中记载了通常这样的电池是碱性二氧化锰/锌电池,实施例也仅记载了碱性二氧化锰/锌电池。因此,可以说专利文献3中记载的再充电型电化学电池基本上是使用碱性成分作为水性电解质的碱性二氧化锰/锌电池。另外,专利文献3所示的二氧化锰的放电时的反应式也是通常所示的碱性锰一次电池中的反应式。
本发明的目的在于提供减少了铅的使用量或者不使用铅的高电动势的二次电池。具体而言,本发明的目的在于提供能够在使用水性电解液的同时产生高电动势,用于减少对环境·生态系统造成不良影响的铅化合物和硫酸的使用量或者不使用铅化合物和硫酸(无铅)的二次电池。
解决技术问题的技术手段
本发明人为了在减少铅等有害物质的使用量或不使用铅等有害物质的同时得到具有与铅蓄电池同样的构造且具有与铅蓄电池同样的充放电反应机制的电池,进行了专心努力。其结果是发现了如下的二次电池,从而完成了本发明:代替正极活性物质中使用的氧化铅,使用锰氧化物作为同样的无机氧化物氧化剂;在负极活性物质中使用贱金属或含有贱金属的合金;在电解液中,作为含有与正极活性物质或负极活性物质反应、形成相对于电解液的不溶性物质的阴离子的电解液,使用含有作为无机含氧酸的一种的磷酸化合物和/或有机含氧酸(例如作为有机含氧酸的一种的对甲苯磺酸、苯磺酸、对苯酚磺酸、苯基膦酸和5-磺基水杨酸等)的电解液。通过形成这样的构成,作为铅蓄电池的正极活性物质使用的氧化铅可以替换为锰氧化物,可以减少作为有害物质的铅化合物的使用量。此外,在负极活性物质中,也可以使用贱金属来代替金属铅,因此可以制成完全无铅的二次电池。在负极使用金属锌或含有锌的合金或者锡或含有锡的合金的情况下,可以得到其电动势与铅蓄电池同样性能的二次电池。进而,该电池是能够充放电的二次电池。
本发明人对上述记载的铅蓄电池工作的技术要件进行了仔细研究,结果发现,作为与铅蓄电池的正极同样地具有氧化力的金属氧化物氧化剂,锰氧化物是合适的。例如,就二氧化锰以氧化剂发挥功能时的反应而言,二氧化锰中含有的四价锰在放电时接受电子,化合价变为四价以下,释放该氧化物中的氧,同时直接从外部电路或还原剂来接收电子。该现象与作为铅蓄电池中的正极活性物质的氧化铅相同,铅蓄电池通过同样的机制进行工作。
然而,在使用锰氧化物作为正极活性物质、将电解液的电解质设为硫酸的情况下,存在锰氧化物溶解于硫酸的技术问题。为了解决该技术问题,本发明人发现可以使用磷酸、以及由磷酸和碱金属(li、na、k)离子或铵离子构成的盐或者它们的混合物来代替硫酸。此外,本发明人发现,可以使用对甲苯磺酸等这样的有机含氧酸来代替硫酸。
进而,本发明人发现,此时使用的负极活性物质金属适宜是氢超电压高、能够在水溶液中进行电解电镀的金属,并且是通过与电解液中的阴离子反应而产生的化合物相对于电解液难溶而在电极表面析出的金属。具体的候选物是金属锰、金属锡、金属锌、金属镓、金属铅或包含它们的合金。本发明人发现,从这些负极活性物质候选物中选择规定的金属(合金),将其用于该电池的负极,通过在磷酸水溶液中进行放电反应,上述金属(合金)被氧化,同时可以使金属磷酸盐在负极活性物质表面上析出。在负极表面产生的上述金属(合金)的磷酸金属化合物固着在金属表面。此外,发现在使用有机含氧酸(例如对甲苯磺酸等)水溶液的情况下,也产生了同样的现象。
即,为了解决上述技术问题,本发明具有以下构成。
(构成1)
本发明的构成1为一种二次电池,所述二次电池包含:包含含有锰氧化物的正极活性物质的正极;包含含有选自锌、镓和锡中的至少一种的负极活性物质的负极;以及包含选自磷酸和有机含氧酸中的至少一种、ph小于7的电解液,所述二次电池在完全充电时的开路电压大于1.6v。
根据本发明的构成1,能够得到减少了铅的使用量或者不使用铅的高电动势的二次电池。
(构成2)
本发明的构成2是25℃下的电解液的ph为5以下的构成1的二次电池。
根据本发明的构成2,能够更可靠地得到减少了铅的使用量或者不使用铅的高电动势的二次电池。
(构成3)
本发明的构成3是电解液中所含的磷酸和/或有机含氧酸引起的阴离子的量比通过放电反应与正极活性物质和负极活性物质反应所需的该阴离子的总量多的构成1或构成2的二次电池。
根据本发明的构成3,通过电解液含有规定的物质,能够更可靠地得到高电动势的二次电池,同时由于电解质中含有允许与电解液接触的电极表面上的活性物质与电解质中的阴离子充分反应的量的阴离子,因此成为高容量的二次电池。
(构成4)
本发明的构成4是负极活性物质含有锌的构成1~构成3中任一项的二次电池。
根据本发明的构成4,通过使负极活性物质含有锌,能够得到更高电动势的二次电池。
(构成5)
本发明的构成5是在完全充电时的开路电压为2.0v以上的构成4的二次电池。
根据本发明的构成5,在负极活性物质含有锌、含有规定的电解液的情况下,在完全充电时,能够得到2.0v以上的开路电压。
(构成6)
本发明的构成6是有机含氧酸选自于对甲苯磺酸、苯磺酸、对苯酚磺酸、苯基膦酸和5-磺基水杨酸中的至少一种的构成1~构成5中任一项所述的二次电池。
根据本发明的构成6,当有机含氧酸为对甲苯磺酸、苯磺酸、对苯酚磺酸、苯基膦酸和/或5-磺基水杨酸时,可以确保作为规定的二次电池的工作。
(构成7)
本发明的构成7是磷酸含有正磷酸(h3po4)的构成1~构成6中任一项所述的二次电池。
通过使电解液含有正磷酸(h3po4),能够可靠地得到高电动势的二次电池。
(构成8)
本发明的构成8是电解液还含有磷酸盐的构成1~构成7中任一项所述的二次电池。
通过使电解液含有磷酸盐,能够在不降低电解液中的磷酸根离子浓度的情况下调节ph。
(构成9)
磷酸盐是选自于k3po4、li3po4、na3po4和(nh4)2hpo4中的至少一种碱金属磷酸盐的构成8所述的二次电池。
通过使电解液含有规定的碱金属磷酸盐,能够调整适于二次电池的电解液的液体性质(例如ph),抑制由磷酸盐引起与负极金属的过度反应。
(构成10)
本发明的构成10是包含构成1~构成9中任一项的二次电池的装置。
通过包含本发明的二次电池,能够得到性能更高的装置。
有益效果
根据本发明,能够提供减少了铅的使用量或者不使用铅的高电动势的二次电池。即,根据本发明,能够提供可以在使用水性电解液的同时产生高电动势,用于减少对环境·生态系统造成不良影响的铅化合物和硫酸的使用量或者不使用铅化合物和硫酸(无铅)的二次电池。
附图说明
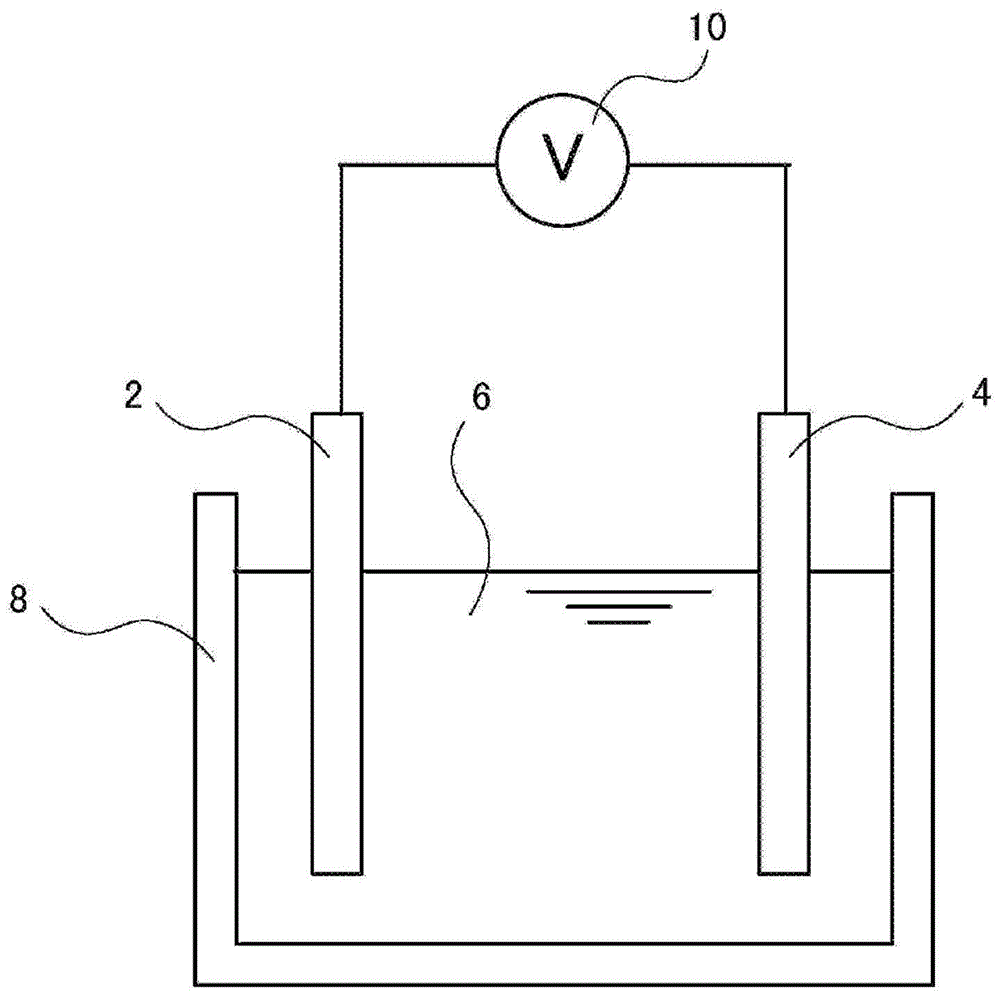
图1是二次电池的开路电压测定时的示意图。
图2是本发明的实施例中使用的二氧化锰包覆碳电极的放电前表面的扫描电子显微镜(sem)图像。
图3是本发明的实施例中使用的二氧化锰包覆碳电极通过能量分散谱仪(eds)的放电前的表面分析结果。
图4是本发明的实施例(实验2-1)中使用的二氧化锰包覆碳电极的完全放电后的表面sem图像。
图5是本发明的实施例(实验2-1)中使用的二氧化锰包覆碳电极通过能量分散谱仪(eds)的完全放电后的表面分析结果。
图6是示出了本发明的实施例(实验2-1)的充放电试验时的电压变化的图。
图7是示出了本发明的实施例(实验3-1)和比较例(实验3-4)的充放电试验时的电压变化的图。
图8是示出了本发明的实施例(实验5-1)的长期充放电试验时的第100次、第200次、第400次、第600次、第800次循环的充放电曲线的图。
具体实施方式
以下,对本发明的实施方式进行具体说明。另外,以下的实施方式是将本发明具体化时的方式,并不将本发明限定在其范围内。
本发明是包含含有正极活性物质的正极、含有负极活性物质的负极和电解液的二次电池。本发明的二次电池的正极活性物质含有锰氧化物。负极活性物质含有选自锌、镓和锡中的至少一种。电解液含有选自磷酸和有机含氧酸中的至少一种,且ph小于7。本发明的二次电池的完全充电时的开路电压大于1.6v。
本发明的二次电池是具有大于1.6v的高开路电压且减少了铅的使用量或者不使用铅的二次电池。因此,根据本发明,能够得到一种作为减少了铅的使用量或者不使用铅的二次电池的使用不需要使用硫酸的水性电解液的安全的二次电池。
<正极活性物质>
本发明的二次电池包含含有正极活性物质的正极。正极活性物质含有锰氧化物。
作为正极活性物质使用的锰氧化物不一定必须是化学计量的。只要锰氧化物发挥作为金属氧化物氧化剂的功能,构成正极活性物质的锰与氧的原子数之比也可以不同于整数比。通常,金属氧化物不一定是化学计量的,锰氧化物中的锰示出各种化合价。进而,只要作为正极活性物质使用的锰氧化物发挥作为金属氧化物氧化剂的功能,也可以将锰氧化物中的锰元素的一部分替换为其它元素。在将锰氧化物中的锰元素的一部分适当地替换为其它元素的情况下,可以作为本发明的电池的正极活性物质发挥功能。
从电子传导性的观点来看,适合作为正极活性物质使用的锰氧化物优选为二氧化锰。作为正极活性物质的二氧化锰的制造方法不受特别限定。作为二氧化锰,列举化学合成二氧化锰、电解二氧化锰等。另外,二氧化锰被用作锰干电池的正极活性物质。
作为使用含有二氧化锰的正极活性物质的正极,可以使用将处于粉末状的二氧化锰与高分子粘合剂和/或辅助导电物质(碳等)的混合物适当涂布在不直接有助于电池反应的金属板上的物质。此外,通过将该混合物直接涂布在碳这样的集电体上,可以制作正极。此外,在制作附着有电解二氧化锰化合物的正极的情况下,可以如下所述来制作。例如,在硫酸酸化的水溶液中溶解硫酸锰后,将该锰溶解液加热至70℃以上并搅拌。接着,在该锰溶解液中浸渍两根碳棒电极,在该两个碳电极间持续施加电压(约2.0v~2.5v左右)。其结果,能够在将电位设定为高侧(貴側)的碳电极表面得到电子传导性高的电解二氧化锰。
<负极活性物质>
本发明的二次电池包含含有负极活性物质的负极。负极活性物质含有选自锌、镓和锡中的至少一种。
作为负极活性物质,列举金属锡、金属镓、金属锌、金属锰、金属铅及它们的合金。这些金属与磷酸根离子反应而生成难溶性盐,同时作为还原剂适当地发挥作用。此外,由于是金属,因此电子传导性良好。在上述金属中,作为本发明的二次电池中使用的负极活性物质,特别地,可以优选使用含有选自锌、镓和锡中的至少一种的材料。
作为负极活性物质优选的金属和金属合金可以作为将粉末与媒介物、辅助导电物质等混合的合剂使用。或者,可以直接将作为负极活性物质优选的金属和金属合金的金属板作为负极的负极活性物质使用。
本发明的二次电池优选负极活性物质含有锌。在本发明的二次电池中,通过使负极活性物质含有锌,能够得到更高电动势的二次电池。
在本发明的二次电池中,在负极活性物质含有锌的情况下,在完全充电时能够得到1.85v以上的开路电压。此外,在负极活性物质含有锌的情况下,通过与规定的电荷液组合,能够得到2.0v以上的开路电压。此外,在本发明的二次电池中,负极活性物质优选仅由锌构成。
在本发明的二次电池中,负极活性物质可以含有锡。具体而言,作为含有锡的负极活性物质,可以优选使用金属锡单质(単体);锡和铅的合金;锡、银和金的合金等。在负极活性物质为锡和铅的合金的情况下,铅的含量优选为50重量%以下,较优选为40重量%以下。通过使铅的含量为规定量以下,能够降低二次电池的铅的使用量。此外,在负极活性物质为锡、银和金的合金的情况下,可以得到不使用铅的二次电池。
<正极和负极的形状>
包含正极活性物质的正极和包含负极活性物质的负极优选尽可能增大比表面积。本发明的二次电池的反应与在正极中使用锰氧化物的一次电池的通过负极金属溶解进行的反应不同;随着放电的进行,各活性物质表面被与电解液阴离子的反应物覆盖。其结果,由于这些缺乏电子传导性的反应物覆盖在电极表面,因此有可能导致电池的内部电阻增大。另外,在铅蓄电池中也可以看到同样的现象。为了增大电极每单位体积(单位重量)的电极表面积,可以使用比表面积大的粉末状的活性物质。此外,通过对活性物质表面进行化学蚀刻等来实现表面积的增大,由此能够增大电极表面积。
<电解液>
本发明的二次电池包含电解液。电解液含有磷酸或有机含氧酸。作为有机含氧酸,例如可以使用对甲苯磺酸、苯磺酸、对苯酚磺酸、苯基膦酸和/或5-磺基水杨酸等。
假设在使用作为正极活性物质使用的锰氧化物的电池中,与铅蓄电池同样地使用硫酸作为电解液的情况下,在硫酸根离子与正极活性物质的反应中产生的硫酸锰容易溶解于硫酸中。此外,也与作为负极活性物质的金属反应,容易产生可溶性物质。因此,在使用硫酸作为电解液的情况下,不作为二次电池发挥功能。该现象在使用硝酸、盐酸作为电解液的情况下也同样。硝酸和盐酸特别容易溶解负极金属,因此在使用这样的电解液的情况下,不作为二次电池发挥功能。由于本发明的二次电池的电解液含有磷酸根离子且为酸性(ph<7),在放电反应时,可以在正极电极表面产生对电解液而言难溶的磷酸锰化合物。因此,本发明的二次电池能够可靠地作为二次电池来工作。
在铅蓄电池的情况下,其两个电极中含有的铅通过放电反应与电解液中的硫酸根离子反应,生成的硫酸铅难溶于电解液中。通常磷酸根离子通过与金属离子反应产生难溶性盐的情况较多。本发明的正极中使用的锰氧化物和负极中使用的负极金属或合金也同样。铅蓄电池通过放电反应与两极活性物质(pbo2、pb)通过放电反应产生硫酸铅时,电解液中含有的硫酸根离子的浓度降低,电解质比重下降。此外,放电反应时,如果不含有比与铅蓄电池的正极活性物质中含有的pbo2反应的硫酸根离子的总量和与负极活性物质中含有的铅反应的硫酸根离子的总量的合计多的硫酸根离子,则不能使所有活性物质有助于放电反应。在这种情况下,进一步导致电解质ph上升和铅蓄电池显著的电压降低。因此,铅蓄电池含有即使在放电反应时与两种活性物质反应也充分或过剩的硫酸根离子。
本发明的二次电池也是电解液中含有的阴离子(例如磷酸根离子)通过放电反应与两极活性物质反应从而难溶性盐固着在活性物质上的反应。即,在电解质中的磷酸根离子浓度因放电反应而降低这一点上,与铅蓄电池的放电机制相同。因此,为了使本发明的电池良好地发挥功能,与铅蓄电池同样地,需要使电解液中含有在放电时与正极活性物质和负极活性物质反应的磷酸根离子的总量以上的磷酸根离子。
无论是在铅蓄电池的正极活性物质中使用的pbo2,还是在本发明的二次电池中使用的mno2,其与金属离子的平衡电位(分别为pbo2/pb2+,mno2/mn2+)取决于浸渍它们的电解液的ph。铅蓄电池和本发明的二次电池均是电解液ph越低,平衡电位越高。因此,能够制作产生高电压的二次电池。然而,在降低电解液的ph而将二次电池的电压设计为高电压的情况下,充电所需要的电压也变高。另一方面,电解液中含有的水的电解比充电反应更显著地进行。因此,降低电解液的ph,使二次电池的电压成为高电压,未必是库仑效率良好的充电。这里所说的库仑效率是指正极活性物质的氧化中使用的电荷相对于为了充电而投入到二次电池中的电荷的比。当所有的电荷用于正极活性物质的氧化时,库仑效率为100%。在使用含有水的电解液的二次电池中,在电动势为1.23v以上的电池的情况下,充电时投入到电池中的电荷的一部分用于水的电解。因此,在使用了含有水的电解液的二次电池中,库仑效率一般不为100%。
在铅蓄电池的情况下,使用作为强酸的硫酸溶液。因此,在制作产生期望电压的电池的情况下,仅能够通过改变电解液中的硫酸浓度来控制电动势。然而,铅蓄电池随着放电反应而消耗电解液中的硫酸根离子,因此电解液的ph上升。随着电解液的ph随着放电而上升,由于上述理由,铅蓄电池的电动势随着放电而降低。
另一方面,在本发明的电池的情况下,通过在以规定的比例混合磷酸和磷酸盐的电解液中使用,能够在不降低电解液中的磷酸根离子浓度的情况下调节ph。其结果,可以设计成得到在抑制电解液中的水的电解的电压下工作的二次电池。磷酸和磷酸盐的混合水溶液具有缓冲作用。因此,在本发明的二次电池中,在电解液中使用磷酸和磷酸盐的混合水溶液的情况下,由于通过放电反应电解液中的磷酸根离子与两个电极的活性物质的反应,即使电解液中的磷酸根离子被消耗,电解液的ph上升也被抑制得少。因此,在本发明的二次电池中,能够抑制伴随放电的电池电压的降低。进而,通过调整磷酸和磷酸盐的混合比例,能够实现期望的ph和离子浓度,因此用于得到期望的凝固点温度的调整也容易。
进而,在本发明的电池的情况下,可以使用磷酸溶液或有机含氧酸作为电解液。在使用磷酸溶液或有机含氧酸作为电解液的情况下,不存在在铅蓄电池的电解液中使用的浓硫酸那样的对有机物的脱水作用。因此,在本发明的电池的情况下,作为控制电解液的凝固点温度的方法,可以使具有凝固点下降作用的二醇(グリコール)类、醇(アルコール)类以及丙三醇(グリセリン)类等有机化合物在电解液中共存。
本发明的二次电池是基于通过放电反应两极活性物质与电解质中的阴离子反应而产生难溶性盐的反应这样的铅蓄电池的工作原理的机制而成的发明。因此,只要是满足上述条件的含有阴离子的电解液,就可以作为本发明的二次电池的电解液使用。作为电解液,不管是有机还是无机,只要使用含氧酸,就可以构成本发明的二次电池。作为有机含氧酸水溶液,可以使用对甲苯磺酸、苯磺酸、对苯酚磺酸、苯基膦酸和5-磺基水杨酸等的水溶液。
本发明的二次电池的电解液的ph小于7。本发明的二次电池的电解液的ph优选为5以下,较优选为4以下。
在本发明的二次电池中,通过使电解液的ph小于7、优选为5以下、较优选为4以下,通过磷酸根离子与锰的反应而产生难溶的盐。因此,通过使电解液的ph在规定的范围内,能够更可靠地得到减少了铅的使用量或者不使用铅的高电动势的二次电池。另一方面,ph为7以上时,与正极活性物质的锰氧化物的磷酸化反应相比,氢氧化反应优先进行,因此不是作为本发明目的的反应。
电解液中使用的磷酸可以使用正磷酸(h3po4)和多磷酸中的任一种或两种。此外,在使用的电解液中,除了磷酸以外,还可以含有磷酸盐。此外,作为电解液中含有的磷酸盐,可以含有选自于由磷酸根离子和碱金属构成的盐,例如磷酸钾化合物(例如k3po4、kh2po4和k2hpo4)、磷酸钠化合物(例如na3po4、nah2po4和na2hpo4)、磷酸锂化合物(例如li3po4和lih2po4)和磷酸氢钾化合物(例如kh2po4和k2hpo4)、磷酸氢钠化合物(例如nah2po4和na2hpo4)、磷酸锂(lih2po4)等磷酸氢化合物等中的至少一种。或者,可以含有选自于由铵离子和磷酸根离子构成的盐,例如磷酸二氢铵((nh4)2hpo4)、磷酸氢二铵((nh4)h2po4)中的至少一种。另外,即使是上述以外的情况,为了使电解液的ph成为能够得到必要的电压的电池,也可以使用含有碱性高的k离子、na离子、li离子、铵离子等的物质。通过将这些碱金属离子、铵离子添加到电解液中,调整适于本发明的二次电池的电解液的液体性质(例如ph),能够抑制电解液中的磷酸盐引起的与负极金属的过度反应。
优选在本电池中使用的电解液中不含有卤素离子。通常,与水性电解液中含有的氢氧化物离子相比,含氧酸离子的离子化倾向大;与此相对,卤素离子的离子化倾向小。即,在电解液中含有卤素离子的情况下,在电池充电时,在正极侧的电极表面,电解液中的卤素离子的氧化消耗电力。因此,不能实现高库仑效率,同时产生具有腐蚀性的卤素气体,导致电池内压上升。在电解液中仅含有氢氧化物离子和含氧酸离子作为阴离子的情况下,与含氧酸离子相比,氢氧化物离子的离子化倾向低。因此,含氧酸离子不被氧化,氢氧化物离子被氧化而产生氧。由于上述原因,如果进行食盐水电解,则从高电压侧的电极产生氯气;与此相对,如果电解稀硫酸水溶液,则从高侧电极产生氧,硫酸根离子的电氧化不产生生成物。在产生了氧的情况下,通过燃烧催化剂(催化剂栓),能够使氧与在负极侧产生的氢反应,形成水而返回电解液中。然而,难以使在正极产生的卤素气体再次返回至离子,不能保持电解液的稳态。在本发明的二次电池中也同样。即,在电解液中含有卤素离子的情况下,充电电力的一部分用于卤素离子的氧化,导致库仑效率降低和不可逆性。因此,可以说本发明的二次电池优选使用技术上尽可能除去了卤素离子的电解液。
<电池单元>
在二次电池中,为了得到规定的电压和电流,可以将具有一对正极和负极的单位电池(単位電池)串联和并联连接。在本说明书中,将这种情况下的单位电池也称为电池单元。
本发明的二次电池中使用的电池单元的构造可以使用与铅蓄电池的电池单元相同的构造。本发明的二次电池是伴随放电反应,电解液中的阴离子与正极活性物质和负极活性物质反应,各活性物质成为磷酸化合物或有机含氧酸化合物的反应。因此,在本发明的二次电池的放电反应中,电解液中的阴离子浓度降低,同时从正极产生水。在本发明的二次电池中,需要即使由于伴随放电反应产生水而电解液中的磷酸浓度或有机含氧酸浓度降低,也使本发明的电池适当地发挥功能的量的电解液。
此外,本发明的二次电池与铅蓄电池同样,由于是放电反应中产生的生成物留在各电极表面的反应,即使正极和负极之间的电解液不被隔膜等分隔,也作为电池工作。然而,在实用上,为了防止因施加于二次电池的振动而引起上述反应生成物从电极表面脱落、由于振动而使正极和负极物理·电短路,优选在正极和负极之间的电解液中设置隔膜等。
即,在本发明的二次电池的情况下,隔膜是为了防止正·负极两个电极短路的目的而设置,或者为了防止活性物质从电极板剥离而发挥功能。因此,在设置即使不使用隔膜也可以尽可能防止正极和负极两个电极短路的电极间距离、或者活性物质与集电电极维持充分的密合而防止剥离的情况下,隔膜的使用不是必须的。
本发明的二次电池能够产生比水的电解电压(1.23v)高的电压,因此特别是在充电时,在各电极的表面有时产生氢气或者氧气。这种现象也见于铅蓄电池,目前市售的铅蓄电池多采用密闭型构造。为了抑制由产生的氢和氧引起的电池单元的内压上升,有时在电池单元内设置燃烧催化剂。在该铅蓄电池中使用的燃烧催化剂通常被称为催化剂栓。作为具体的燃烧催化剂的例子,列举在具有高比表面积的氧化铝载体的表面以高分散状态吸附贵金属成分(铂、钯的离子等)后,通过还原或烧成使金属析出而得到的物质。为了使在本发明的二次电池的充放电时或自然产生的氢气和氧气燃烧,与铅蓄电池中使用的燃烧催化剂同样地,能够在该电池单元内设置燃烧催化剂。通过使用燃烧催化剂,与铅蓄电池同样,通过电解产生的氧气和氢气被转换为水,能够使电池单元内的内压保持恒定,防止内压上升引起电池单元和二次电池的破坏。
<本发明的二次电池的反应机制>
认为本发明的二次电池的电池图(電池図)基于下述反应机制。另外,电池图记载中的“aq”表示水溶液。以下同。另外,在以下例子中,以使用h3po4水溶液、k3po4水溶液和na3po4水溶液作为电解液的情况为例进行说明。在本发明的二次电池中,可以使用由其它碱性阳离子(例如锂离子和铵离子等)与磷酸根离子构成的盐的水溶液作为电解液。
电池图:(-)负极金属或合金|(h3po4aq,k3po4aq或na3po4aq)|mno2,c或m(+)
(m为集电体金属)
(a)放电时的反应(使用金属锌作为负极活性物质、磷酸作为电解液的情况)
正极:3mno2+nh3po4+6h++6e-→mn3h(3n-6)(po4)n+6h2o
负极:3zn+mh3po4→zn3h(3m-6)(po4)m+6h++6e-
(n、m分别为2以上的正数)
(b)充电时的反应(使用金属锌作为负极活性物质、磷酸作为电解液的情况)
正极:mn3h(3n-6)(po4)n+6h2o→3mno2+nh3po4+6h++6e-
负极:zn3h(3m-6)(po4)m+6h++6e-→3zn+mh3po4
(n、m分别为2以上的正数)
以下对伴随本发明的二次电池的充放电反应的正·负极活性物质的化学变化与常规型电池的不同点进行说明。
<与锰干电池(一次电池)的不同点>
锰干电池是正极活性物质使用二氧化锰、负极活性物质使用金属锌、电解质使用氯化铵或氯化锌的一次电池。该电池的电池图和放电反应通常由下述反应式表示。
电池图:(-)zn|zncl2aq,nh4claq|mno2,c(+)
放电时的负极的反应如下所示。
(ph5.1至ph5.8的范围)
zn+2nh4cl→zncl2+2nh4++2e-(zn溶解)
(ph5.8至ph7.9的范围)
zn+2nh4cl+2h2o→zn(nh3)2·cl2+2h3o++2e-(zn沉淀)
(ph7.9至ph9.3的范围)
zn+4nh4cl+4h2o→zn(nh3)4·cl2+4h3o++4e-(zn溶解)
另一方面,对于作为正极的二氧化锰(以下记作mno2),在放电时从nh4+或h3o+游离的氢离子向二氧化锰中扩散,此时与mno2反应,产生下述反应。
mno2+nh4++e-→mno(oh)+nh3
mno2+h3o+e-→mno(oh)+h2o
无论在哪种情况下,放电反应时在正极产生的金属化合物都是mno(oh),放电中的总反应式如下所示。
2mno2+2nh4cl+zn→2mno(oh)+zn(nh3)2·cl2
或者,在电解液中含有大量氯化锌的锰电池中变为
8mno2+8h2o+zncl2+4zn→8mno(oh)+zncl2·zn(oh)2,
具有与本发明的二次电池不同的反应机制。
如上所述,由于锰干电池的电解液中含有氯化物离子,因此留在一次电池中,如果进行充电,则氯化物离子被氧化而成为气体而产生,引起电池内部膨胀。
<与碱性锰干电池(一次电池)的不同点>
碱性锰干电池是正极活性物质使用二氧化锰、负极活性物质使用金属锌、电解质使用氢氧化钠的一次电池。该电池的电池图和放电反应通常由下述反应式表示。
电池图:(-)zn|naohaq|mno2,c(+)
(放电时的负极的反应)
zn+2oh-→zno+h2o+2e-
(放电时的正极的反应)
2mno2+h2o+2e-→mn2o3+2oh-
在碱性锰干电池中,是正极中的二氧化锰对电解液中的水供给氧离子而生成两个氢氧化物离子的反应。因此,碱性锰干电池的反应机制与本发明的二次电池的反应机制不同。
如上所述,在锰干电池的情况下,通过放电反应,正极的mno2变化为
<本发明的二次电池的电动势>
关于各个二次电池能够产生的电压,可以通过热化学计算进行理论上的计算。
正极活性物质使用锰氧化物、负极活性物质使用金属锌时的电动势可以通过将放电反应中整个反应体系的吉布斯能变化转换为电化学电压表示(電压表記)而得到。即,理论电动势可以用下式表示。
e=-δg/(n·f)
(在此,e为理论电动势,-δg为放电反应中电池整体的吉布斯能变化,n为反应电子数,以及f为法拉第常数。)
作为本发明的二次电池能够产生比锰一次电池(电动势:约1.5v)高的电动势的理由,可以考虑如下。即,在锰一次电池的放电反应中,在正极侧生成的物质为氢氧化锰;与此相对,在本发明的二次电池的情况下为磷酸锰化合物。此外,负极生成的物质同样,在锰一次电池的情况下是与铵离子和氯化物离子形成的锌化合物;与此相对,在本发明的二次电池的情况下为磷酸化物。由于由这样的不同引起的吉布斯能变化量的不同,认为本发明的二次电池能够产生高电动势。此外,该现象也可以根据锰的pourbaix图(プールベダイアグラム)(e-ph图)来推测。
铅蓄电池的负极活性物质中使用的金属铅通常摩尔质量大(207.2g/mol),金属铅的比重在室温附近约为11.34g/cm3,与其它金属相比属于大的种类。作为正极活性物质的氧化铅(作为pbo2)的摩尔质量为239.2g/mol,比重为约9.7g/cm3。
与此相对,在本发明的二次电池中,在使用金属锌作为负极活性物质、使用二氧化锰作为正极活性物质的情况下,金属锌的摩尔质量为65.4g/mol,二氧化锰质量的摩尔质量为86.9g/mol。此外,锡的摩尔质量为118.7g/mol,比铅轻。此外,锌的比重为7.1g/cm3,β锡的比重为7.4g/cm3。因此,与铅蓄电池相比,可以说本发明的二次电池具有高性能且轻量的二次电池这样的优点。
本发明是包含上述本发明的二次电池的装置。在本说明书中,“装置”包括电子设备、电机(電気機械)、动力设备等。通过包含本发明的二次电池,电子设备、电机、动力设备等装置能够得到性能更高的装置。
实施例
以下,通过实施例对本发明进行具体说明,但本发明并不限定于这些实施例。
使用以表1和表2中所示的电解液和负极活性物质为材料的负极来尝试制作二次电池。另外,作为正极的正极活性物质,使用如下述那样制备的二氧化锰。
(正极活性物质电极的制备)
如下所述制作包含正极活性物质的电极。即,在1mol/l(2n)硫酸酸性水溶液中加热溶解硫酸锰,使其为1mol/l。将该加热溶解的硫酸锰-稀硫酸水溶液保持在75℃的恒定温度,将2根碳棒电极浸入上述溶液中,将流过电极的电流量保持在0.01a,维持10分钟。此时的电极间电压为2.0v~2.5v,确认从低电位侧的电极产生氢。10分钟的电解结束后,从硫酸锰-稀硫酸水溶液槽中取出高电位侧的电极,用蒸馏水反复充分洗涤。然后,为了进一步除去水分,进行120度、30分钟的干燥,得到锰氧化物包覆碳电极棒。包覆的锰氧化物的重量由电解析出前后的碳棒重量差计算。基于该计算,仅使用在高侧碳电极表面上析出的二氧化锰的重量均在1.0mg±0.2mg的范围的电极进行实验。图2示出了利用扫描电子显微镜(以下称为“sem”)观察这样得到的二氧化锰包覆碳电极表面的结果。进而,图3示出了使用能量分散谱仪(以下称为“eds”)对上述电极表面的锰元素和氧元素进行分析的结果。其结果,可以确认在碳电极上生成了二氧化锰的被膜(被膜)。
(电解液)
作为电解液,使用下述电解液a~电解液z、电解液α、电解液β和电解液γ。
本研究中使用的电解液使用将市售84wt%磷酸稀释而得到的磷酸溶液以及在上述磷酸溶液中以规定的重量比例混合磷酸盐(k3po4、li3po4、na3po4或(nh4)2hpo4)的水溶液(1mol/l)而成的溶液。此外,还使用有机含氧酸(对甲苯磺酸、苯磺酸、对苯酚磺酸、苯基膦酸或5-磺基水杨酸)。此外,为了比较,还使用氢氧化钾水溶液(1mol/l或15mol/l)和氢氧化钠水溶液(1mol/l或15mol/l)。具体而言,作为电解液,使用下述电解液a~电解液z、电解液α、电解液β和电解液γ。在制备的电解液的ph测定中,使用适当校准的横河电机株式会社制造的ph计(型号ph81型),任一种电解液的ph均在25℃的条件下测定。
电解液a~电解液i如下所述。
电解液a:42wt%磷酸(h3po4)水溶液,ph1.24
电解液b:16.8wt%磷酸(h3po4)水溶液,ph1.31
电解液c:8.4wt%磷酸(h3po4)水溶液,ph1.36
电解液d:42wt%磷酸(h3po4)水溶液+1mol/l磷酸三钾水溶液(以2:1的重量比例混合的混合水溶液),ph1.39
电解液e:16.8wt%磷酸(h3po4)水溶液+1mol/l磷酸三钾(k3po4)水溶液(以2:1的重量比例混合的混合水溶液),ph2.19
电解液f:8.4wt%磷酸(h3po4)水溶液+1mol/l磷酸三钾(k3po4)水溶液(以2:1的重量比例混合的混合水溶液),ph4.13
电解液g:1mol/l氢氧化钾(koh)水溶液,ph14.19
电解液h:15mol/l氢氧化钾(koh)水溶液(由于电解质浓度高而不能测定ph。)
电解液i:0.5mol/l有机含氧酸(对甲苯磺酸)水溶液,ph1.48
作为电解液,进一步使用下述电解液j~电解液z、电解液α、电解液β和电解液γ。
电解液j:氢氧化钠(naoh)水溶液(1mol/l),ph14.7
电解液k:氢氧化钠(naoh)水溶液(15mol/l),(由于电解质浓度高而不能测定ph。)
电解液l:磷酸(h3po4)水溶液(42wt%)+磷酸盐na3po4水溶液(1mol/l),(以2:1的重量比例混合的混合水溶液),ph1.73
电解液m:磷酸(h3po4)水溶液(16.8wt%)+磷酸盐na3po4水溶液(1mol/l),(以2:1的重量比例混合的混合水溶液),ph2.24
电解液n:磷酸(h3po4)水溶液(8.4wt%)+磷酸盐na3po4水溶液(1mol/l),(以2:1的重量比例混合的混合水溶液),ph4.76
电解液o:磷酸(h3po4)水溶液(42wt%)+磷酸盐[(nh4)2hpo4]水溶液(1mol/l),(以2:1的重量比例混合的混合水溶液),ph1.59
电解液p:磷酸(h3po4)水溶液(16.8wt%)+磷酸盐[(nh4)2hpo4]水溶液(1mol/l),(以2:1的重量比例混合的混合水溶液),ph1.95
电解液q:磷酸(h3po4)水溶液(8.4wt%)+磷酸盐[(nh4)2hpo4]水溶液(1mol/l),(以2:1的重量比例混合的混合水溶液),ph2.44
电解液r:有机含氧酸(苯磺酸)水溶液(1mol/l),ph1.45
电解液s:有机含氧酸(对苯酚磺酸)水溶液(0.5mol/l),ph1.49
电解液t:有机含氧酸(苯基膦酸)水溶液(0.2mol/l),ph1.56
电解液u:有机含氧酸(5-磺基水杨酸)水溶液(1mol/l),ph1.43
电解液v:磷酸(h3po4)水溶液(8.4wt%)+磷酸盐(li3po4)水溶液(1mol/l),(以2:1的重量比例混合的混合水溶液),ph3.32
电解液w:磷酸(h3po4)水溶液(8.4wt%)+有机含氧酸(苯基膦酸,0.2mol/l),(在规定浓度的磷酸水溶液中以达到规定浓度的方式添加了有机含氧酸的水溶液),ph1.51
电解液x:磷酸(h3po4)水溶液(8.4wt%)+磷酸盐[(nh4)2hpo4]水溶液(1mol/l)+有机含氧酸(苯基膦酸,0.2mol/l),(在以2:1的重量比例混合磷酸水溶液和磷酸盐水溶液的混合水溶液中以达到规定浓度的方式添加了有机含氧酸的水溶液),ph2.26
电解液y:磷酸(h3po4)水溶液(16.8wt%)+磷酸盐li3po4水溶液(1mol/l)+有机含氧酸(苯基膦酸,0.2mol/l),(在以2:1的重量比例混合磷酸水溶液和磷酸盐水溶液的混合水溶液中以达到规定浓度的方式添加了有机含氧酸的水溶液),ph1.93
电解液z:磷酸(h3po4)水溶液(8.4wt%)+磷酸盐li3po4水溶液(1mol/l)+有机含氧酸(苯基膦酸,0.2mol/l),(在以2:1的重量比例混合磷酸水溶液和磷酸盐水溶液的混合水溶液中以达到规定浓度的方式添加了有机含氧酸的水溶液),ph2.42
电解液α:磷酸(h3po4)水溶液(8.4wt%)+磷酸盐k3po4水溶液(1mol/l)+有机含氧酸(苯基膦酸,0.2mol/l),(在以2:1的重量比例混合磷酸水溶液和磷酸盐水溶液的混合水溶液中以达到规定浓度的方式添加了有机含氧酸的水溶液),ph2.77
电解液β:磷酸(h3po4)水溶液(16.8wt%)+磷酸盐[(nh4)2hpo4]水溶液(1mol/l),(以1:1的重量比例混合的混合水溶液),ph1.95
电解液γ:磷酸(h3po4)水溶液(0.84wt%)+磷酸盐k3po4水溶液(1mol/l),(以1:1的重量比例混合的混合水溶液),ph7.27
(负极活性物质)
在表1和表2中示出了实施例和比较例中使用的负极活性物质。表1和表2中的“zn”是金属锌(zn)。作为金属锌负极,使用将市售锌板(t=0.5mm)切成长条状的材料。长条的宽度为5mm。表1的“pb-sn”是由68重量%的铅(pb)和32重量%的锡(sn)构成的合金。该合金是市售共晶焊料,线径为
表1中,“实验na-nb”的na表示电解质种类,nb表示负极活性物质种类。na的1~9对应于电解液a~电解液i。负极活性物质种类的nb如下所述。
(负极活性物质:nb)
nb=1:上述金属锌(表1中的“zn”)
nb=2:上述68重量%的pb和32重量%的sn的合金(共晶焊料合金)(表1中的“pb-sn”)
nb=3:上述由96.5重量%的锡(sn)、3重量%的银(ag)和0.5重量%的au构成的合金(表1中的“sn-ag-au”)
nb=4:上述金属镍(表1中的“ni”)
nb=5:上述金属铜(表1中的“cu”)
(电解液的制备)
实验中使用的磷酸水溶液是用离子交换水将市售84%磷酸溶液稀释成各种浓度而制备的。1mo/l磷酸三钾水溶液也是在室温下将1mol磷酸三钾溶解于离子交换水中成为1l,得到1mol/l磷酸三钾。电解液e、电解液f和电解液g通过将规定浓度的磷酸水溶液和规定浓度的磷酸三钾水溶液以重量比2:1混合而得到。
电解液g和电解液h的氢氧化钾水溶液通过将1mol或15mol氢氧化钾溶解于离子交换水中,使其为1mol/l(电解液g)和15mol/l(电解液h)的水溶液而得到。
电解液i的对甲苯磺酸水溶液通过将0.5mol对甲苯磺酸·一水合物溶解在离子交换水中成为1l而得到。
电解液j和电解液k的naoh水溶液通过将市售氢氧化钠溶解在离子交换水中,使其作为naoh为1mol/l(电解液j)和15mol/l(电解液k)的水溶液而得到。
电解液l、电解液m、电解液n、电解液o、电解液p和电解液q通过将规定浓度的磷酸水溶液和规定浓度的磷酸盐水溶液以重量比2:1混合而得到。
电解液r的有机含氧酸(苯磺酸)水溶液通过将市售苯磺酸溶解在离子交换水中,使其为1mol/l而得到。
电解液s的有机含氧酸(对苯酚磺酸)水溶液通过将市售对苯酚磺酸溶解在离子交换水中,使其为0.5mol/l而得到。
电解液t的有机含氧酸(苯基膦酸)水溶液通过将市售苯基膦酸溶解在离子交换水中,使其为0.2mol/l而得到。
电解液u的有机含氧酸(5-磺基水杨酸)水溶液通过将市售5-磺基水杨酸溶解在离子交换水中,使其为1mol/l而得到。
电解液v通过将规定浓度的磷酸水溶液和1mol/l磷酸盐(li3po4)水溶液以重量比2:1混合而得到。
电解液w通过在规定浓度的磷酸水溶液中以达到0.2mol/l的方式添加有机含氧酸(苯基膦酸)而得到。
电解液x、电解液y、电解液z和电解液α通过在将规定浓度的磷酸水溶液和1mol/l规定的磷酸盐水溶液以2:1的重量比混合的混合水溶液中以达到0.2mol/l的方式添加有机含氧酸(苯基膦酸)而得到。
电解液β通过将规定浓度的磷酸水溶液和1mol/l磷酸盐[(nh4)2hpo4]水溶液以1:1的重量比混合而得到。
电解液γ通过将规定浓度的磷酸水溶液和1mol/l磷酸盐(k3po4)水溶液以1:1的重量比混合而得到。
上述任一种电解液均在25℃的室温下制备。另外,上述市售试剂可以从和光纯药工业株式会社获得。
(二次电池的尝试制作)
如图1所示,制作在容器8中将锰氧化物包覆的碳电极(正极2)和各种负极活性物质(负极4)用电解液a~电解液z、电解液α、电解液β和电解液γ中的任一种(电解液6)填充的试验电池,并进行充放电试验。以包覆在碳电极上的锰氧化物全部浸渍在电解液中的方式外加负极活性物质也以1.5cm浸渍在电解液中的方式进行配置。将此时的电极间距离设为1cm,电解液量均为40ml。
充放电试验无论在哪种情况下都在25℃的室温下实施,以放电电流10μa进行30分钟放电反应,设置5分钟无负过状态,进而,在充电电流10μa下进行40分钟充电反应后,设置5分钟无负过状态。将其作为1个循环,进行50次放电反应和充电反应。另外,本说明书中的“完全充电时的开路电压”是指如上所述经过以10μa的电流进行30分钟放电和5分钟无负过状态,进而以10μa进行40分钟充电,设置5分钟无负过状态,即将进入下一次放电反应之前的电压值。因此,所谓完全充电时的开路电压与下一次放电反应时的放电开始电压同义。此外,在本说明书中,“初始开路电压”是指1个循环的放电-充电后的开路电压。
表1和表2中示出了充放电试验的结果。实验1-1、实验1-2、实验1-3、实验2-1、实验2-2、实验2-3、实验3-1、实验3-2、实验3-3、实验4-1、实验4-2、实验4-3、实验5-1、实验5-2、实验5-3、实验6-1、实验6-2和实验9-1以及实验12~实验28在进行50次充放电试验中的充电结束后的开路电压均为1.6v以上(实施例)。另一方面,实验3-4、实验3-5、实验6-3、实验7-1和实验8-1以及实验10、实验11和实验29充电结束后的开路电压小于1.6v(比较例)。为了参考,图6中示出了实验2-1的充放电试验时的电压变化。此外,图7中示出了实验3-1和实验3-4的充放电试验时的电压变化。
由以上结果可知,与实验3-4和实验3-5中使用的金属镍、金属铜相比,由于在得到1.6v以上的开路电压的电池中使用的负极金属或合金均是氢超电压高的金属,因此可以说能够产生1.6v以上的开路电压。此外,在电解液呈酸性的范围内,这些实验中使用的金属由电解液ph的差异引起的氧化还原电位的变化均较少。与此相对,作为正极活性物质的二氧化锰的氧超电压随ph而变化,电解液ph越低,二氧化锰的氧超电压越大。因此,在将同一金属用于负极活性物质的情况下,通常,使用ph低的电解液的一方的电池的电动势变大。实验6-3(比较例)中开路电压小于1.6v就是由于该理由。因此,为了得到1.6v以上的开路电压,可以说电解液的ph较优选为5以下,进一步优选为4以下。
作为实验7-1和实验8-1(比较例),构成了将上述的二氧化锰包覆碳电极用于正极、将金属锌用于负极、将浓度不同的氢氧化钾水溶液用于电解液的电池,进行同样的充放电试验。
实验7-1和实验8-1放电开始时的电压分别为1.48v、1.51v,得到比较高的电压。然而,每次重复充放电循环时,充电结束后的开路电压降低。特别是关于实验7-1,为这样的结果:放电结束后的开路电压和接着的充电结束后的开路电压没有大的差异,放电引起的电池电压的下降一方总是大于充电引起的电池电压的上升。作为该结果的理由,可以说是由于伴随正极活性物质和负极活性物质双方或一方的活性物质的充放电反应的电极反应的可逆性不充分,在充电操作中投入到电池中的电力的大部分花费在水的电解上,充电引起的正极活性物质的再氧化、负极活性物质的再还原不充分。因此,在电解液为碱性的碱性锰干电池的情况下,即使与本发明的电池相比,充放电反应而来的可逆性也不充分。
进而,本发明人对如下进行了确认:随着本发明电池的放电反应,作为正极活性物质的二氧化锰通过与电解液中的磷酸根离子的反应而成为锰-磷酸化合物。构筑与实验2-1所示的电池同样的电池后,将放电电流设为10μa,进行放电直至电池电压达到1.5v后,停止放电反应,取出正极,用离子交换水进行充分洗涤、干燥,进行表面的sem观察(参照图4)。进而,进行eds分析(参照图5)。另外,此时放电反应所需的时间为48.07小时。图4的sem照片与保持平滑性的放电前的状态(参照图2)的情况不同,在表面可见较多的凹凸。进而,eds分析的结果确认了该凹凸的组成是由锰-磷-氧构成的化合物。
从上述试验中,作为与铅蓄电池同等或其以上的电压的一例,还记载并公开了实验5-1的长期充放电试验的结果。
图8示出了实验5-1的电池单元在50次循环的充放电试验结束后再继续实施至800次循环时的充放电曲线。即,图8示出了第100次、第200次、第400次、第600次、第800次循环的充放电曲线和各循环中的充放电行为的变化。
如图8所示,在实验5-1的电池单元中,随着充放电循环数的增加,充电电压、放电电压均有少许降低。由第100次循环的充电结束后的开路电压和第800次循环的充放电后的开路电压求出平均开路电压下降率。根据这些充放电开路电压的差和循环数,该充放电期间的每1次循环的平均开路电压下降率为约0.12mv/循环,表现出良好的充放电循环特性。
[表1]
[表2]
符号的说明
2正极
4负极
6电解液
8容器
10电压计
- 还没有人留言评论。精彩留言会获得点赞!