使用了多环芳香族化合物的发光材料的有机电致发光元件
本发明涉及使用了多环芳香族化合物及其多聚体(以下也将两者一并简称为多环芳香族化合物)的发光材料的有机电致发光元件、以及显示装置和照明装置。
背景技术:
以往,使用进行电致发光的发光元件得到的显示装置因能够实现省电化、薄型化而受到各种研究,进而,由有机材料形成的有机电致发光元件(以下也称为有机el元件)因容易轻量化、大型化而受到积极研究。尤其是,针对具有作为光的三原色之一的蓝色等的发光特性的有机材料的开发和具备空穴、电子等的电荷输送能力(具有成为半导体、超导体的可能性)的有机材料的开发,无论是高分子化合物还是低分子化合物,至今为止均进行了积极研究。
有机el元件具有如下结构:其包括包含阳极和阴极的一对电极、以及配置在该一对电极之间且包含有机化合物的一个层或多个层。包含有机化合物的层有发光层、输送或注入空穴、电子等电荷的电荷输送/注入层等,开发了适合于这些层的各种有机材料。
作为发光层用材料,开发了例如苯并芴系化合物等(国际公开第2004/061047号公报)。此外,作为空穴输送材料,开发了例如三苯基胺系化合物等(日本特开2001-172232号公报)。此外,作为电子输送材料,开发了例如蒽系化合物等(日本特开2005-170911号公报)。
此外,近年来,作为有机el元件、有机薄膜太阳能电池中使用的材料,还报告了对三苯基胺衍生物进行改良而得的材料(国际公开第2012/118164号公报)。该材料的特征在于,以已实用化的n,n’-二苯基-n,n’-双(3-甲基苯基)-1,1’-联苯-4,4’-二胺(tpd)作为参考,通过将构成三苯基胺的芳香环彼此连接而提高其平面性。该文献中,针对例如no连接系化合物(第63页的化合物1)的电荷输送特性进行了评价,但并未记载除no连接系化合物之外的材料的制造方法,此外,如果要连接的元素不同则化合物整体的电子状态会不同,因此,由除no连接系化合物之外的材料得到的特性也尚属未知。除此之外也可见到这种化合物的例子(国际公开第2011/107186号公报)。例如,具有三重态激子的能量(t1)大的共轭结构的化合物由于能够发出更短波长的磷光,因此作为蓝色的发光层用材料是有益的。
有机el元件的主体材料通常是将多个苯、咔唑等现有的芳香环用单键、磷原子、硅原子连接而得的分子。这是因为:通过将多个共轭体系较小的芳香环进行连接来确保主体材料所需的大的homo-lumo间隙(薄膜的带隙eg)。进而,使用磷光材料、热活化延迟荧光材料得到的有机el元件的主体材料还需要高的三重态激发能量(et),但通过对分子连接施主或受主性的芳香环、取代基而使三重态激发态(t1)的somo1和somo2定域化,减小两个轨道间的交换相互作用,由此能够提高三重态激发能量(et)。但是,共轭体系的小芳香环的氧化还原稳定性不充分,使用将现有的芳香环连接而得的分子作为主体材料的元件的寿命不充分。另一方面,具有扩张π共轭体系的多环芳香族化合物通常氧化还原稳定性优异,但homo-lumo间隙(薄膜的带隙eg)、三重态激发能量(et)低,因此,可以认为其不适合于主体材料。
此外,近年来还报告了以硼等作为中心原子并稠合多个芳香环而得的化合物(国际公开第2015/102118号公报)。该文献中实施了使用该稠合多个芳香环而得的化合物作为发光层的掺杂材料而得的有机el元件的评价,但该文献中公开了极大数量的化合物,研究它们之中尤其是发光特性等有机el特性优异的化合物是有益的。
现有技术文献
专利文献
专利文献1:国际公开第2004/061047号公报
专利文献2:日本特开2001-172232号公报
专利文献3:日本特开2005-170911号公报
专利文献4:国际公开第2012/118164号公报
专利文献5:国际公开第2011/107186号公报
专利文献6:国际公开第2015/102118号公报
技术实现要素:
发明要解决的问题
如上所述,作为有机el元件中使用的材料而开发了各种材料,为了进一步提高发光特性等有机el特性或者增加发光层用材料等有机el材料的可选项,期望开发以往未具体知晓的化合物。
用于解决问题的方案
本发明人等为了解决上述课题而进行了深入研究,结果发现:通过将用硼原子和氧原子连接多个芳香环而得的多环芳香族化合物用作发光层用材料,能够获得优异的有机el元件,由此完成了本发明。
需要说明的是,本说明书中,化学结构、取代基有时用碳原子数表示,但化学结构上用取代基进行了取代时、取代基上进一步用取代基进行了取代时等的碳原子数是指化学结构、取代基各自的碳原子数,并不是指化学结构与取代基的总碳原子数、取代基与取代基的总碳原子数。例如,“被碳原子数x的取代基a取代的碳原子数y的取代基b”是指在“碳原子数y的取代基b”上用“碳原子数x的取代基a”进行取代,碳原子数y不是取代基a和取代基b的总碳原子数。此外,例如,“被取代基a取代的碳原子数y的取代基b”是指在“碳原子数y的取代基b”上用“(碳原子数不限的)取代基a”进行取代,碳原子数y不是取代基a与取代基b的总碳原子数。
项1.
一种有机电致发光元件,其具有:包含阳极和阴极的一对电极、以及配置在该一对电极之间的发光层,
该有机电致发光元件中的发光层中,
作为第一成分,包含下述通式(1)所示的多环芳香族化合物作为主体,
作为第二成分,包含含硼的多环芳香族化合物作为掺杂物。
(上述式(1)中,
r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基,
前述芳基、前述杂芳基、前述二芳基氨基和前述二芳基硼基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代,
式(1)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
项2.
根据项1所述的有机电致发光元件,其中,上述通式(1)中,r1~r11各自独立地为氢、碳原子数6~30的芳基、碳原子数2~30的杂芳基、二芳基氨基(其中,芳基为碳原子数6~12的芳基)、二芳基硼基(其中,芳基为碳原子数6~12的芳基,两个芳基任选借助单键或连接基团进行键合)、碳原子数1~24的烷基、碳原子数3~12的环烷基、碳原子数1~24的烷氧基或碳原子数6~30的芳氧基,
前述芳基、前述杂芳基、前述二芳基氨基和前述二芳基硼基中的至少1个氢任选被碳原子数6~30的芳基、碳原子数2~30的杂芳基、碳原子数1~24的烷基或碳原子数3~12的环烷基取代。
项3.
根据项1所述的有机电致发光元件,其中,上述通式(1)中,r1~r11各自独立地为氢、碳原子数6~16的芳基、碳原子数2~15的杂芳基、二芳基氨基(其中,芳基为碳原子数6~10的芳基)、二芳基硼基(其中,芳基为碳原子数6~10的芳基,两个芳基任选借助单键或连接基团进行键合)、碳原子数1~6的烷基、碳原子数6~10的环烷基、碳原子数1~6的烷氧基或碳原子数6~16的芳氧基,
前述芳基、前述杂芳基、前述二芳基氨基和前述二芳基硼基中的至少1个氢任选被碳原子数6~16的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数6~10的环烷基取代。
项4.
根据项1~3中任一项所述的有机电致发光元件,其中,上述通式(1)中,r1~r11中的至少一者为下述式(1-a)~(1-s)中任意者所示的基团。
(上述式中,*表示键合位置,
式(1-a)~式(1-h)和式(1-p))~式(1-q)中的至少1个氢任选被碳原子数6~30的芳基、碳原子数2~30的杂芳基、碳原子数1~24的烷基或碳原子数3~12的环烷基取代,
式(1-i)、式(1-j)、式(1-k)和式(1-r)中的r各自独立地表示氢、碳原子数6~30的芳基、碳原子数2~30的杂芳基、碳原子数1~24的烷基或碳原子数3~12的环烷基。)
项5.
根据项4所述的有机电致发光元件,其中,上述通式(1)中,r1~r11中的至少一者为上述式(1-d)所示的基团。
项6.
根据项1~5中任一项所述的有机电致发光元件,其中,上述通式(1)中,r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基或烷氧基,
前述芳基、前述杂芳基、前述二芳基氨基和前述二芳基硼基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代。
项7.
根据项1~6中任一项所述的有机电致发光元件,其中,上述通式(1)中,r4~r11中的至少一者为杂芳基,该杂芳基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代。
项8.
根据项1~7中任一项所述的有机电致发光元件,其中,上述通式(1)中,r1~r3中的至少一者为芳基或二苯并呋喃基,前述芳基和前述二苯并呋喃基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代。
项9.
根据项1~6中任一项所述的有机电致发光元件,其中,上述通式(1)中,r1~r3中的至少一者为杂芳基(该杂芳基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代),并且,r4~r11中的至少一者为芳基(该芳基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代)。
项10.
根据项1所述的有机电致发光元件,其中,第一成分的主体为下述式中的任意者所示的多环芳香族化合物。
项11.
根据项1~10中任一项所述的有机电致发光元件,其中,作为第二成分的掺杂物为下述通式(2)所示的多环芳香族化合物或其多聚体。
(上述式(2)中,
r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基、氰基或卤素,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代,
并且,r1~r11之中的相邻基团任选彼此键合并与a环、b环或c环一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基取代,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代,
y1为b(硼),
x1和x2各自独立地为>o、>n-r、>s、>se或-c(-r)2-(其中,x1和x2不同时为>o),前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,并且,该>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环和c环中的至少一者键合(需要说明的是,前述“-c(-r’)2-”的r’为氢或碳原子数1~5的烷基或碳原子数5~10的环烷基);并且
式(2)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
项12.
根据项11所述的有机电致发光元件,其中,上述通式(2)中,r8为卤素、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~10的芳基或碳原子数2~10的杂芳基,
r7为氢、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~10的芳基或碳原子数2~10的杂芳基。
项13.
根据项11所述的有机电致发光元件,其中,作为第二成分的掺杂物是包含两个上述通式(2)所示的部分结构和连接该两个部分结构的连接基团l1的二聚体化合物,
前述连接基团l1为单键、碳原子数6~12的亚芳基、碳原子数2~15的亚杂芳基、碳原子数1~6的亚烷基、碳原子数1~6的亚烯基、碳原子数1~6的亚炔基、-o-、-s-、>n-r或它们的组合,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~14的环烷基,
前述二聚体化合物中的至少1个氢任选被氰基、卤素或氘取代。
项14.
根据项1~11中任一项所述的有机电致发光元件,其中,作为第二成分的掺杂物为下述通式(3)所示的多环芳香族化合物。
(上述式(3)中,
r3~r12、z1和z2各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基、氰基或卤素,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代;
并且,r5~r7和r10~r12之中的相邻基团任选彼此键合并与b环和d环中的至少一者一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基取代,而且,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代;
z1任选借助连接基团或单键而与a环键合;并且,z2任选借助连接基团或单键而与c环键合;
y为b(硼);
x1、x2、x3和x4各自独立地为>o、>n-r、>s、>se或-c(-r)2-(其中,x1和x2不同时为>o,并且,x3和x4也不同时为>o),前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,并且,该>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环、c环和d环中的至少一者键合(需要说明的是,前述“-c(-r’)2-”的r’为氢或碳原子数1~5的烷基或碳原子数5~10的环烷基);
r1和r2各自独立地为氢、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~12的芳基、碳原子数2~15的杂芳基或二芳基氨基(其中,芳基为碳原子数6~12的芳基)、二芳基硼基(其中,芳基为碳原子数6~12的芳基,两个芳基任选借助单键或连接基团进行键合);
式(3)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
项15.
根据项1~11中任一项所述的有机电致发光元件,其中,作为第二成分的掺杂物为下述通式(4)所示的多环芳香族化合物或其多聚体。
(上述式(4)中,
r1~r3和r5~r15各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基、氰基或卤素,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代;
并且,r1~r3、r5~r7、r8~r11和r12~r15之中的相邻基团任选彼此键合并与a环、b环、c环和d环中的至少一者一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基取代,而且,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代;
y1为b(硼);
x为>o、>n-r、>s、>se或-c(-r)2-,前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基;
l为单键、-c(-r)2-、>o、>s或>n-r,前述-c(-r)2-和>n-r中的r各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基,它们中的至少1个氢任选进一步被芳基、杂芳基、烷基或环烷基取代;
其中,x为>n-r时,l不是>o;
为多聚体时的式(4)中的r2为氢;并且
通式(4)所示的化合物和结构中的至少1个氢任选被氰基、卤素或氘取代。)
项16.
根据项1~10中任一项所述的有机电致发光元件,其中,作为第二成分的掺杂物为下述通式(5)所示的多环芳香族化合物或其多聚体。
(上述式(5)中,
r1~r9各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基、氰基或卤素,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代;
并且,r1~r9之中的相邻基团任选彼此键合并与a环、b环和c环中的至少一者一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基取代,而且,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代;
y1为b(硼),
x1、x2和x3各自独立地为>o、>n-r、>s、>se或-c(-r)2-(x1、x2和x3之中的至少两者为n-r),前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,并且,该>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环和c环中的至少一者键合(需要说明的是,前述“-c(-r’)2-”的r’为氢或碳原子数1~5的烷基或碳原子数5~10的环烷基),并且
式(5)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
项17.
根据项1所述的有机电致发光元件,其中,第二成分的掺杂物为下述式中的任意者所示的多环芳香族化合物。
项18.
根据项1~17中任一项所述的有机电致发光元件,其具有配置在前述阴极与前述发光层之间的电子输送层和电子注入层中的至少一者,该电子输送层和电子注入层中的至少一者含有选自由硼烷衍生物、吡啶衍生物、荧蒽衍生物、bo系衍生物、蒽衍生物、苯并芴衍生物、氧化膦衍生物、嘧啶衍生物、咔唑衍生物、三嗪衍生物、苯并咪唑衍生物、菲绕啉衍生物和羟基喹啉系金属络合物组成的组中的至少一者。
项19.
根据项18所述的有机电致发光元件,其中,前述电子输送层和电子注入层中的至少一者还含有选自由碱金属、碱土金属、稀土金属、碱金属的氧化物、碱金属的卤化物、碱土金属的氧化物、碱土金属的卤化物、稀土金属的氧化物、稀土金属的卤化物、碱金属的有机络合物、碱土金属的有机络合物和稀土金属的有机络合物组成的组中的至少一者。
项20.
一种多环芳香族化合物,其用下述通式(1)表示。
(上述式(1)中,
r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基,
前述芳基、前述杂芳基、前述二芳基氨基和前述二芳基硼基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代,
r1~r11中的至少一者为下述式(1-d)所示的基团,
式(1)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
(上述式中,*表示键合位置,式(1-d)中的至少1个氢任选进一步被芳基、杂芳基、烷基或环烷基取代。)
项21.
一种反应性化合物,其是下述通式(1)所示的多环芳香族化合物上用反应性取代基进行取代而得的。
(上述式(1)中,
r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基,
前述芳基、前述杂芳基、前述二芳基氨基和前述二芳基硼基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代,
式(1)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
项22.
一种高分子化合物或高分子交联体,其中,所述高分子化合物是以项21所述的反应性化合物作为单体并使其高分子化而得的,所述高分子交联体是使该高分子化合物进一步交联而得的。
项23.
一种侧基型高分子化合物或侧基型高分子交联体,其中,所述侧基型高分子化合物是主链型高分子上用项21所述的反应性化合物进行取代而得的,所述侧基型高分子交联是使该侧基型高分子化合物进一步交联而得的。
项24.
一种发光层形成用组合物,其中,作为第一成分,包含项21所述的反应性化合物、项22所述的高分子化合物或高分子交联体、或者项23所述的侧基型高分子化合物或侧基型高分子交联体作为主体,
作为第二成分,包含含硼的多环芳香族化合物作为掺杂物,
作为第三成分,包含有机溶剂。
项25.
一种发光层形成用组合物,其中,
作为第一成分,包含下述通式(1)所示的多环芳香族化合物作为主体,
作为第二成分,包含含硼的多环芳香族化合物作为掺杂物,
作为第三成分,包含有机溶剂。
(上述式(1)中,
r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基,
前述芳基、前述杂芳基、前述二芳基氨基和前述二芳基硼基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代,
式(1)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
项26.
根据项24或25所述的发光层形成用组合物,其中,第三成分的至少1种有机溶剂的沸点为130~350℃。
项27.
根据项24~26中任一项所述的发光层形成用组合物,其中,第三成分的有机溶剂包含对于第一成分的主体和第二成分的掺杂物中的至少1种而言的良溶剂(gs)和贫溶剂(ps),良溶剂(gs)的沸点(bpgs)低于贫溶剂(ps)的沸点(bpps)。
项28.
根据项24~27中任一项所述的发光层形成用组合物,其中,第一成分相对于发光层形成用组合物的总质量为0.0999质量%~8.0质量%,
第二成分相对于发光层形成用组合物的总质量为0.0001质量%~2.0质量%,
第三成分相对于发光层形成用组合物的总质量为90.0质量%~99.9质量%。
项29.
一种发光层形成用组合物,其包含:
选自由高分子化合物、高分子交联体、侧基型高分子化合物和侧基型高分子交联体中的至少1种;以及
有机溶剂,
所述高分子化合物具有:源自项21所述的反应性化合物的第一结构单元、以及源自在含硼的多环芳香族化合物上用反应性取代基进行取代而得的反应性化合物的第二结构单元,
所述高分子交联体是使该高分子化合物进一步交联而得的,
所述侧基型高分子化合物是在主链型高分子上用反应性化合物进行取代而得的,所述反应性化合物为项21所述的反应性化合物和在含硼的多环芳香族化合物上用反应性取代基进行取代而得的反应性化合物,
侧基型高分子交联体是使该侧基型高分子化合物进一步交联而得的。
项30.
一种有机电致发光元件,其具有:包含阳极和阴极的一对电极、以及配置在该一对电极之间且使用项24~29中任一项所述的发光层形成用组合物而形成的发光层。
项31.
根据项1~19和30中任一项所述的有机电致发光元件,其中,空穴注入层、空穴输送层、发光层、电子输送层和电子注入层之中的至少一层包含:以能够形成各层的低分子化合物作为单体并使其高分子化而得的高分子化合物;或者,使该高分子化合物进一步交联而得的高分子交联体;或者,使能够形成各层的低分子化合物与主链型高分子反应而得的侧基型高分子化合物;或者,使该侧基型高分子化合物进一步交联而得的侧基型高分子交联体。
项32.
一种显示装置或照明装置,其具备项1~19、30和31中任一项所述的有机电致发光元件。
发明的效果
根据本发明的优选方式,通过将特定的多环芳香族化合物用作发光层用材料,能够进一步提高发光特性等有机el特性。
附图说明
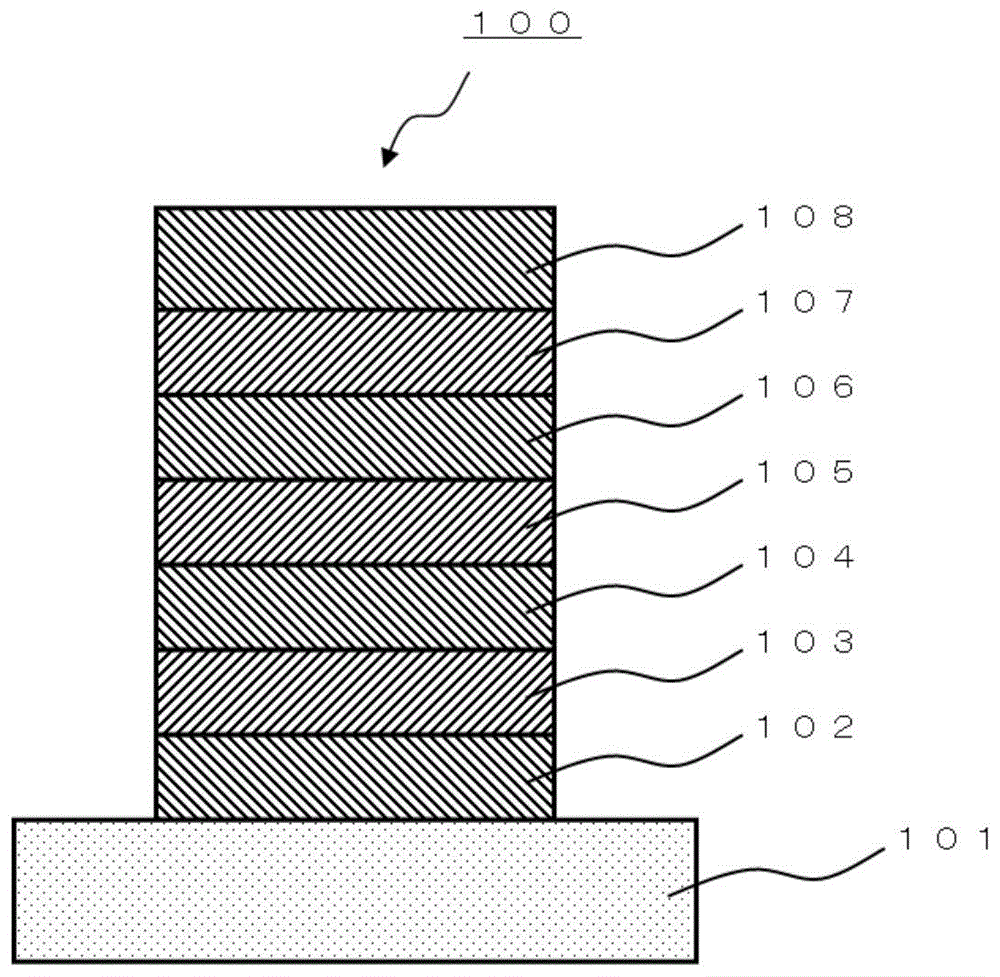
图1是示出本实施方式的有机el元件的示意剖视图。
具体实施方式
1.有机电致发光元件
本发明的有机el元件具有包含阳极和阴极的一对电极、以及配置在该一对电极之间的发光层。并且,其特征在于,在发光层中,作为第一成分而包含上述通式(1)所示的多环芳香族化合物,作为第二成分而包含含硼的多环芳香族化合物。需要说明的是,在发光层中,第一成分作为主体而发挥功能,第二成分作为掺杂物而发挥功能。
1-1.第一成分
式(1)所示的多环芳香族化合物具有大的homo-lumo间隙(薄膜的带隙eg)和高的三重态激发能量(et)。其原因在于,由于包含杂元素的六元环的芳香属性低,因而,与共轭体系的扩张相伴的homo-lumo间隙的减少受到抑制;因杂元素的电子微扰而导致三重态激发态(t1)的somo1和somo2定域化。式(1)所示的多环芳香族化合物具有高的三重态能量,因此,优选作为热活化延迟荧光材料的主体。
具体而言,从促进在发光层内产生tadf而不加以阻碍的观点出发,由第一成分的化合物的磷光光谱的峰顶求出的激发三重态能级e(1,t,pt)优选比由第二成分的化合物的磷光光谱的峰顶求出的激发三重态能级e(2,t,pt)高,具体而言,第一成分的化合物的激发三重态能级e(1,t,pt)与e(2,t,pt)相比优选为0.01ev以上,更优选为0.03ev以上,进一步优选为0.1ev以上。此外,主体化合物可以使用tadf活性的化合物。
第一成分是作为主体使用的化合物,一般而言,在发光层中使用的含量比作为第二成分的掺杂物多。因此,激发三重态能量通常在近似实际使用条件的状态下求出,例如,第一成分的激发三重态能量由单一成分的蒸镀膜求出,第二成分的激发三重态能量由以非活性成分或第一成分作为主成分且均匀分散有低浓度的第二成分的膜求出。
另一方面,本发明中使用的第一成分如式(1)所示那样地,具有由硼原子和氧原子和a~b环形成的较大且平面性高的结构,因此,激发单重态能量和激发三重态能量的值与由上述第一成分的单一成分的蒸镀膜求出的情况相比有时预估得较低。因而,本说明书中,为了排除由第一成分之间的聚集和相互作用导致的影响,第一成分和第二成分的激发单重态能量和激发三重态能量由以非活性成分作为主成分且均匀分散有低浓度的第一成分或第二成分的膜求出。此处,非活性成分可列举出例如在第一成分或第二成分的激发和发光的范围内光学透明的聚合物,具体而言,可列举出聚(甲基丙烯酸甲酯)、聚苯乙烯、聚烯烃和环烯烃聚合物。
进而,从降低相互作用、得到高的激发三重态能量的观点出发,第一成分优选聚集性低,具体而言,第一成分的分子结构优选为非对称结构,优选在分子内具有大的二面角,或者,优选在分子内具有位阻。此外,从电荷输送性和能量移动的观点出发,优选与电荷输送相关的轨道能够接近。此外,从元件驱动时的元件特性稳定性的观点出发,优选第一成分的玻璃化转变温度(tg)高,优选在分子间发生相互作用。
关于各成分之间的聚集性,第一成分和第二成分可以均使用聚集性低的化合物,也可以任一者使用聚集性低的化合物。关于聚集性,可根据低浓度均匀分散状态和单一成分蒸镀膜的光谱的红移程度、或者第一成分与第二成分的共蒸镀膜的光谱和低浓度均匀分散状态的第二成分的光谱的红移程度来预估。
上述式(1)中,r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基),前述芳基、前述杂芳基、前述二芳基氨基和前述二芳基硼基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
关于作为第一取代基的“芳基”,可列举出例如碳原子数6~30的芳基,优选为碳原子数6~24的芳基,更优选为碳原子数6~20的芳基,进一步优选为碳原子数6~16的芳基,特别优选为碳原子数6~12的芳基,最优选为碳原子数6~10的芳基。
作为具体的芳基,可列举出例如作为单环系芳基的苯基;作为二环系芳基的(2-,3-,4-)联苯基;作为稠合二环系芳基的(1-,2-)萘基;作为三环系芳基的三联苯基(间三联苯-2’-基、间三联苯-4’-基、间三联苯-5’-基、邻三联苯-3’-基、邻三联苯-4’-基、对三联苯-2’-基、间三联苯-2-基、间三联苯-3-基、间三联苯-4-基、邻三联苯-2-基、邻三联苯-3-基、邻三联苯-4-基、对三联苯-2-基、对三联苯-3-基、对三联苯-4-基);作为稠合三环系芳基的苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为四环系芳基的四联苯基(5’-苯基-间三联苯-2-基、5’-苯基-间三联苯-3-基、5’-苯基-间三联苯-4-基、间四联苯基);作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基、并五苯-(1-,2-,5-,6-)基等。
作为第一取代基的“芳基”的上述说明对于作为第一取代基的二芳基氨基中的“芳基”、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)中的“芳基”、芳氧基中的“芳基”、作为第二取代基的“芳基”也可以同样地引用。
关于作为第一取代基的“杂芳基”,可列举出例如碳原子数2~30的杂芳基,优选为碳原子数2~25的杂芳基,更优选为碳原子数2~20的杂芳基,进一步优选为碳原子数2~15的杂芳基,特别优选为碳原子数2~10的杂芳基。此外,作为杂芳基,可列举出例如除碳之外还含有1~5个选自氧、硫和氮中的杂原子作为成环原子的杂环等。
作为具体的杂芳基,可列举出例如呋喃基、噻吩基、吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、吡唑基、噁二唑基、呋咱基、噻二唑基、三唑基、四唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、苯并呋喃基、异苯并呋喃基、二苯并呋喃基、噻吩基、苯并[b]噻吩基、二苯并噻吩基、吲哚基、异吲哚基、1h-吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、1h-苯并三唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、酞嗪基、萘啶基、嘌呤基、蝶啶基、咔唑基、吖啶基、吩噁嗪基、吩噻嗪基、吩嗪基、二苯并[b,e][1,4]氮硅杂环己烷基(phenazasilinyl)、吩噁噻基、噻蒽基、中氮茚基、吲哚并咔唑基、苯并吲哚并咔唑基、苯并苯并吲哚并咔唑基、萘并苯并呋喃基等。
作为第一取代基的“杂芳基”的上述说明对于作为第二取代基的“杂芳基”也可以同样地引用。此外,作为第二取代基的“杂芳基”中,该杂芳基中的至少1个氢被苯基等芳基(具体例为上述基团)、甲基等烷基(具体例为后述基团)取代的基团也包括在作为第二取代基的杂芳基中。作为其一例,在第二取代基为咔唑基的情况下,9位上的至少1个氢被苯基等芳基、甲基等烷基取代的咔唑基也包括在作为第二取代基的杂芳基中。
关于作为第一取代基的“烷基”,可以是直链和支链中的任一者,可列举出例如碳原子数1~24的烷基(碳原子数3~24的支链烷基),优选为碳原子数1~18的烷基(碳原子数3~18的支链烷基),更优选为碳原子数1~12的烷基(碳原子数3~12的支链烷基),进一步优选为碳原子数1~6的烷基(碳原子数3~6的支链烷基),更进一步优选为碳原子数1~5的烷基(碳原子数3~5的支链烷基),特别优选为碳原子数1~4的烷基(碳原子数3~4的支链烷基),最优选为甲基。
作为具体的烷基,可列举出例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基(叔戊烷基)、正己基、1-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、正庚基、1-甲基己基、正辛基、叔辛基(1,1,3,3-四甲基丁基)、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、2,6-二甲基-4-庚基、3,5,5-三甲基己基、正癸基、正十一烷基、1-甲基癸基、正十二烷基、正十三烷基、1-己基庚基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、正二十烷基等。
此外,还可列举出例如1-乙基-1-甲基丙基、1,1-二乙基丙基、1,1-二甲基丁基、1-乙基-1-甲基丁基、1,1,4-三甲基戊基、1,1,2-三甲基丙基、1,1-二甲基辛基、1,1-二甲基戊基、1,1-二甲基庚基、1,1,5-三甲基己基、1-乙基-1-甲基己基、1-乙基-1,3-二甲基丁基、1,1,2,2-四甲基丙基、1-丁基-1-甲基戊基、1,1-二乙基丁基、1-乙基-1-甲基戊基、1,1,3-三甲基丁基、1-丙基-1-甲基戊基、1,1,2-三甲基丙基、1-乙基-1,2,2-三甲基丙基、1-丙基-1-甲基丁基、1,1-二甲基己基等。
作为第一取代基的“烷基”的上述说明对于作为第二取代基的“烷基”也可以同样地引用。作为第二取代基的烷基在第一取代基上的取代位置没有特别限定,以第一取代基在a环、b环和c环上的键合位置(1位)作为基准,优选为2位或3位,更优选为2位。
关于作为第一取代基的“环烷基”,可以是包含1个环的环烷基、包含多个环的环烷基、在环内包含非共轭双键的环烷基和在环外包含支链的环烷基中的任一者,可列举出例如碳原子数3~24的环烷基、碳原子数3~20的环烷基、碳原子数3~16的环烷基、碳原子数3~14的环烷基、碳原子数3~12的环烷基、碳原子数5~10的环烷基、碳原子数5~8的环烷基、碳原子数5~6的环烷基、碳原子数5的环烷基、碳原子数6~10的环烷基等。
作为具体的环烷基,可列举出例如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基和它们的碳原子数1~5的烷基(尤其是甲基)取代物;降冰片烯基、双环[1.0.1]丁基、双环[1.1.1]戊基、双环[2.0.1]戊基、双环[1.2.1]己基、双环[3.0.1]己基、双环[2.1.2]庚基、双环[2,2,1]庚基、双环[2.2.2]辛基、十氢萘基、金刚烷基、双金刚烷基、十氢萘基、十氢薁基等。
作为第一取代基的“环烷基”的上述说明对于作为第二取代基的“环烷基”也可以同样地引用。
作为“烷氧基”(第一取代基),可列举出例如碳原子数1~24的烷氧基(碳原子数3~24的支链烷氧基),优选为碳原子数1~18的烷氧基(碳原子数3~18的支链烷氧基),更优选为碳原子数1~12的烷氧基(碳原子数3~12的支链烷氧基),进一步优选为碳原子数1~6的烷氧基(碳原子数3~6的支链烷氧基),更进一步优选为碳原子数1~5的烷氧基(碳原子数3~5的支链烷氧基),特别优选为碳原子数1~4的烷氧基(碳原子数3~4的支链烷氧基)。
作为具体的烷氧基,可列举出甲氧基、乙氧基、丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基、叔戊基氧基、正戊基氧基、异戊基氧基、新戊基氧基、叔戊基氧基、正己基氧基、1-甲基戊基氧基、4-甲基-2-戊基氧基、3,3-二甲基丁氧基、2-乙基丁氧基、正庚基氧基、1-甲基己基氧基、正辛基氧基、叔辛基氧基、1-甲基庚基氧基、2-乙基己基氧基、2-丙基戊基氧基、正壬基氧基、2,2-二甲基庚基氧基、2,6-二甲基-4-庚基氧基、3,5,5-三甲基己基氧基、正癸基氧基、正十一烷氧基、1-甲基癸基氧基、正十二烷氧基、正十三烷氧基、1-己基庚基氧基、正十四烷氧基、正十五烷氧基、正十六烷氧基、正十七烷氧基、正十八烷氧基、正二十烷氧基等。
此外,作为第一取代基的“二芳基硼基”中的“芳基”,可以引用上述芳基的说明。此外,这两个芳基任选借助单键或连接基团(例如>c(-r)2、>o、>s或>n-r)进行键合。此处,>c(-r)2和>n-r的r为芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基),该第一取代基任选进一步被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代,作为这些基团的具体例,可以引用上述作为第一取代基的芳基、杂芳基、二芳基氨基、烷基、环烷基、烷氧基或芳氧基的说明。
可以通过第一取代基的结构的位阻性、供电子性和吸电子性来调整发光波长,优选为以下结构式所示的基团,更优选为甲基、叔丁基、叔戊基、叔辛基、苯基、邻甲苯基、对甲苯基、2,4-二甲苯基、2,5-二甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二苯基氨基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、咔唑基、3,6-二甲基咔唑基、3,6-二叔丁基咔唑基和苯氧基,进一步优选为甲基、叔丁基、叔戊基、叔辛基、苯基、邻甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二苯基氨基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、咔唑基、3,6-二甲基咔唑基和3,6-二叔丁基咔唑基。从合成容易度的观点出发,位阻大时对于选择性合成而言是优选的,具体而言,优选为叔丁基、叔戊基、叔辛基、邻甲苯基、对甲苯基、2,4-二甲苯基、2,5-二甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、3,6-二甲基咔唑基和3,6-二叔丁基咔唑基。
下述结构式中,“me”表示甲基、“tbu”表示叔丁基、“tam”表示叔戊基、“toct”表示叔辛基。
r1~r11中的至少一者为下述式(1-a)~(1-s)中任意者所示的基团,更优选为下述式(1-d)所示的基团。
上述式中,*表示键合位置。
式(1-a)~式(1-h)和式(1-p)~式(1-q)中的至少1个氢任选被上述作为“第二取代基”的碳原子数6~30的芳基、碳原子数2~30的杂芳基、碳原子数1~24的烷基或碳原子数3~12的环烷基取代。
此外,式(1-i)、式(1-j)、式(1-k)和式(1-r)中的r各自独立地表示氢、或者上述作为“第二取代基”的碳原子数6~30的芳基、碳原子数2~30的杂芳基、碳原子数1~24的烷基或碳原子数3~12的环烷基。
作为式(1-a)~式(1-s)所示基团的更具体方式,可列举出例如以下所示的基团。需要说明的是,式中的*表示键合位置,me表示甲基,tbu表示叔丁基。
上述式(1)中,r1~r11之中的相邻基团任选彼此键合并与a环、b环或c环一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)取代,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
因此,通式(1)所示的多环芳香族化合物因a环、b环和c环上的取代基的相互键合形态的不同,而如下述式(1-l1)和式(1-l2)所示那样,构成化合物的环结构发生变化。各式中的a’环、b’环和c’环相当于上述“所形成的环(芳环或杂芳环)”。需要说明的是,式(1-l1)和式(1-l2)中的各符号与式(1)中的定义相同。
需要说明的是,虽然在上述式中并未示出,但还存在a环、b环和c环全部变成a’环、b’环和c’环的化合物。此外,由上述式(1-l1)和式(1-l2)可知:例如,a环的r3与c环的r4、c环的r7与b环的r8、b环的r11与a环的r1等不符合“相邻基团彼此”,它们不进行键合。即,“相邻基团”是指在同一环上相邻的基团。
上述式(1-l1)、式(1-l2)所示的化合物例如是具有对作为a环(和b环和c环中的至少一者)的苯环稠合苯环、吲哚环、吡咯环、苯并呋喃环或苯并噻吩环等而形成的a’环(和b’环和c’环中的至少一者)的化合物,所形成的稠合环a’(稠合环b’或稠合环c’)分别为萘环、咔唑环、吲哚环、二苯并呋喃环或二苯并噻吩环等。
关于作为所形成的环的“芳环”,可列举出例如碳原子数9~30的芳环,优选为碳原子数9~24的芳环,更优选为碳原子数9~20的芳环,进一步优选为碳原子数9~16的芳环,特别优选为碳原子数9~12的芳环,最优选为碳原子数9~10环的芳基。需要说明的是,该“芳环”由于a环(b环或c环)已经由碳原子数6的苯环构成,因此,对其稠合五元环而得的稠环的总碳原子数9成为碳原子数的下限。
作为具体的“芳环”,可列举出例如作为稠合二环系的萘环;作为稠合三环系的苊烯环、芴环、非那烯环、菲环;作为稠合四环系的苯并菲环、芘环、并四苯环;作为稠合五环系的苝环、并五苯环等。
关于作为所形成的环的“杂芳环”,可列举出例如碳原子数6~30的杂芳环,优选为碳原子数6~25的杂芳环,更优选为碳原子数6~20的杂芳环,进一步优选为碳原子数6~15的杂芳环,特别优选为碳原子数6~10的杂芳环。作为“杂芳环”,可列举出例如除碳之外还含有1~5个选自氧、硫和氮中的杂原子作为成环原子的杂环等。需要说明的是,该“杂芳环”由于a环(b环或c环)已经由碳原子数6的苯环构成,因此,对其稠合五元环而得的稠环的总碳原子数6成为碳原子数的下限。
作为具体的“杂芳环”,可列举出例如吲哚环、异吲哚环、1h-吲唑环、苯并咪唑环、苯并噁唑环、苯并噻唑环、1h-苯并三唑环、喹啉环、异喹啉环、噌啉环、喹唑啉环、喹喔啉环、酞嗪环、萘啶环、嘌呤环、蝶啶环、咔唑环、吖啶环、吩噁噻环、吩噁嗪环、吩噻嗪环、吩嗪环、中氮茚环、苯并呋喃环、异苯并呋喃环、二苯并呋喃环、苯并噻吩环、二苯并噻吩环、噻蒽环等。
关于所形成的环上的第一取代基和第二取代基,在r1~r11一栏中说明的第一取代基和第二取代基的说明也可以同样地引用。
通式(1)中,r1~r11中的多个任选具有第一取代基。从合成难易度的观点出发,以彼此的位阻变小的方式选择取代位置。可以在相同环上的相邻位置具有取代基,此时优选位阻小的基团。
此外,作为通式(1)的r1~r11上的取代基的个数,没有特别限定,r1~r11的取代基的总碳原子数优选为36以下。
通式(1)中,r1~r11上具有多个第一取代基时,尤其是使用最后导入硼的合成工序时,从合成容易度的观点出发,优选以相对于a环-b键呈现线对称的方式具有取代基。另一方面,从降低结晶性和聚集性的观点出发,优选以呈现非对称结构的方式具有取代基。
作为第一成分的适合的第一方式的主体,可列举出通式(1)中的r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基或烷氧基(以上为第一取代基),且前述芳基、前述杂芳基和前述二芳基氨基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代的多环芳香族化合物。
换言之,第一方式的作为主体的多环芳香族化合物是如下化合物:作为第一取代基,不包括上述式(1-h)所示基团那样的芳氧基,且不具有芳氧基。
作为第一成分的适合的第二方式的主体,可列举出通式(1)中的r4~r11中的至少一者为杂芳基(以上为第一取代基),且该杂芳基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代的多环芳香族化合物。
关于第二方式的作为主体的多环芳香族化合物,可列举出例如后述化合物(bo2-0431)、化合物(bo2-0520s)等。
第二方式的作为主体的多环芳香族化合物优选r4~r11中的至少一者为上述式(1-a)、式(1-b)、式(1-c)、式(1-d)、式(1-l)、式(1-m)和式(1-n)中任意者所示的基团,更优选为上述式(1-a)和式(1-d)中任意者所示的基团。
作为第一成分的适合的第三方式的主体,可列举出上述通式(1)中的r1~r3中的至少一者为芳基或二苯并呋喃基(以上为第一取代基),且前述芳基和前述二苯并呋喃基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代的多环芳香族化合物。
关于第三方式的作为主体的多环芳香族化合物,可列举出例如后述化合物(bo2-0264/0511s)、化合物(bo2-0231)等。
第三方式的作为主体的多环芳香族化合物优选r1~r3中的至少一者为上述式(1-d)、式(1-f)、式(1-i)、式(1-j)和式(1-k)中任意者所示的基团,更优选为上述式(1-d)和式(1-i)中任意者所示的基团。
作为第一成分的适合的第四方式的主体,可列举出上述通式(1)中的r1~r3中的至少一者为杂芳基(以上为第一取代基)(该杂芳基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代),且r4~r11中的至少一者为芳基(以上为第一取代基)(该芳基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代)的多环芳香族化合物。
关于第四方式的作为主体的多环芳香族化合物,可列举出例如后述化合物(bo2-0220/0510s)、化合物(bo2-0220/0511s)等。
第四方式的作为主体的多环芳香族化合物优选r1~r3中的至少一者为上述式(1-a)、式(1-b)、式(1-c)、式(1-d)、式(1-l)、式(1-m)和式(1-n)中任意者所示的基团,更优选r4~r11中的至少一者为上述式(1-f)、式(1-i)、式(1-j)和式(1-k)中任意者所示的基团。
需要说明的是,式(1)所示的多环芳香族化合物中的至少1个氢任选被氰基、卤素或氘取代。卤素为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
作为第一成分的主体,上述通式(1)所示的多环芳香族化合物优选为例如下述式中任意者所示的化合物。需要说明的是,各式中,任意的氢任选被碳原子数1~5的烷基(例如甲基或叔丁基)或碳原子数5~10的环烷基(例如环戊基或环己基)取代。
以下,关于通式(1)所示的多环芳香族化合物,更具体地进行说明。
将通式(1)所示的化合物与其化合物编号相关联时,也记作通式(bo2-1)。需要说明的是,以下在表示化合物的通用结构的通式中,为了简化表达,有时省略r1~r11的符号。不是通式而是表示具体化合物的结构的式中,不能这样省略。
例如,通式(bo2-1)中,r1~r11为氢时,用通式(bo2-0001)表示。
此外,通式(bo2-1)中的r1~r11具有不是氢的取代基时,可列举出例如如下的结构。从立体上的混合情况的观点出发,r1、r2、r3、r4、r5、r6、r9、r10和r11也可以具备任意的取代基,从调节homo和lumo的观点出发,在在使homo变深时,优选向r1、r3、r4、r6、r9和r11中的至少一者导入供电子性的取代基,反之,在使homo变浅时,优选向r1、r3、r4、r6、r9和r11中的至少一者导入吸电子性的取代基。此外,在使lumo变深时,优选向r2、r5和r10中的至少一者导入供电子性的取代基,反之,在使lumo变浅时,优选向r2、r5和r10中的至少一者导入吸电子性的取代基。
此外,相对于由环a~c和硼原子和氧原子形成的芳香环,r1~r11的取代基具有更大的二面角时,能够降低聚集性和主体间或主体-掺杂物间的相互作用。尤其是,本发明中使用的第一成分的化合物、作为第二成分而适合的后述化合物大多是平面性高的化合物,因此,从防止发光光谱的红移或宽幅化、实现深蓝色的发光和高色纯度的观点出发,优选减小聚集性和相互作用。需要说明的是,在作为混合有第一成分和第二成分的混合膜的发光层中,难以测定本发明所使用的第一成分的化合物的二面角,因此,与结构和二面角相关的理论可以使用分子轨道计算。无需严密的计算,可以使用例如mopac等。
关于第一材料的作为主体的通式(1)所示的多环芳香族化合物,具体而言,可列举出如下结构式的化合物。需要说明的是,me表示甲基、tbu表示丁基。
通式(1)所示的多环芳香族化合物即使制成以在它们上用反应性取代基进行取代而成的反应性化合物作为单体并使其高分子化而得的高分子化合物(用于获得该高分子化合物的前述单体具有聚合性取代基)、或者使该高分子化合物进一步交联而得的高分子交联体(用于获得该高分子交联体的前述高分子化合物具有交联性取代基)、或者使主链型高分子与前述反应性化合物反应而得的侧基型高分子化合物(用于获得该侧基型高分子化合物的前述反应性化合物具有反应性取代基)、或者使该侧基型高分子化合物进一步交联而得的侧基型高分子交联体(用于获得该侧基型高分子交联体的前述侧基型高分子化合物具有交联性取代基),也可以用于有机设备用材料、例如有机电致发光元件用材料、有机场效应晶体管用材料或有机薄膜太阳能电池用材料。
作为上述反应性取代基(包含前述聚合性取代基、前述交联性取代基和用于获得侧基型高分子的反应性取代基,以下也简称为“反应性取代基”),只要是能够使上述多环芳香族化合物发生高分子量化的取代基、能够使如此操作而得到的高分子化合物进一步交联化的取代基、以及能够与主链型高分子发生侧基反应的取代基,就没有特别限定,优选为以下结构的取代基。各结构式中的*表示键合位置。
l各自独立地为单键、>o、>s、>c=o、-o-c(=o)-、碳原子数1~12的亚烷基、碳原子数1~12的氧亚烷基和碳原子数1~12的聚氧亚烷基。上述取代基之中,优选为式(xls-1)、式(xls-2)、式(xls-3)、式(xls-9)、式(xls-10)或式(xls-17)所示的基团,更优选为式(xls-1)、式(xls-3)或式(xls-17)所示的基团。
此外,作为除上述之外的反应性取代基,可以为氯、溴或碘;下述式(xls-19)所示的含硼基团。结构式中的*表示键合位置。
上述式(xls-19)中,r41和r42各自独立地为烷基,r41和r42任选相互键合而形成环。并且,r41和r42的总碳原子数优选为2~10。
关于这种高分子化合物、高分子交联体、侧基型高分子化合物和侧基型高分子交联体(以下也简称为“高分子化合物和高分子交联体”)的详细用途,如后所述。
1-2.通式(1)所示的多环芳香族化合物的制造方法
关于式(1)所示的化合物,首先,通过利用键合基团(-o-)使a~c环进行键合来制造中间体(第一反应),其后,通过利用键合基团(包含b的基团)使a~c环进行键合,由此能够制造最终产物(第二反应)。第一反应中,可以利用例如亲核取代反应、乌尔曼反应之类的常规的醚化反应。此外,第二反应中,可以利用tandembora-friedel-crafts反应(连续芳香族亲电取代反应、以下相同)。第一反应和第二反应的详情可以参考国际公开第2015/102118号公报中记载的说明。
第二反应如下述路线(1)所示那样,是导入键合a环、b环和c环的b(硼)的反应。首先,利用正丁基锂、仲丁基锂或叔丁基锂等对两个o之间的氢原子进行邻位金属化。接着,通过添加三氯化硼、三溴化硼等,进行锂-硼的金属交换后,添加n,n-二异丙基乙胺等布朗斯台德碱,从而使其发生tandembora-friedel-crafts反应,能够获得目标物。第二反应中,为了促进反应,可以添加三氯化铝等路易斯酸。
上述路线中,通过邻位金属化而向期望位置导入了锂,但如下述路线(2)那样地向想要导入锂的位置导入溴原子等,通过卤素-金属交换也能够向期望位置导入锂。
为了获得被卤素或氘取代的化合物,可以将这些基团预先导入至中间体中,也可以在第二反应后再导入这些基团。
通过适当选择上述合成方法,并适当选择所使用的原料,能够合成在期望位置具有取代基且用式(1)表示的化合物。
1-3.第二成分
本发明的有机el元件中,在发光层中,作为第二成分,包含含硼的多环芳香族化合物作为掺杂物。
作为本发明的有机el元件的发光层中包含的第二成分,可以是延迟荧光体,也可以是非延迟荧光体,优选为延迟荧光体,更优选为热活化型延迟荧光体。
“热活化型延迟荧光体”是指:能够吸收热能而发生自激发三重态向激发单重态的反向系间窜跃,自该激发单重态进行辐射失活而发射延迟荧光的化合物。其中,“热活化型延迟荧光”还包括在自激发三重态向激发单重态的激发过程中历经高阶三重态的荧光。
可列举出例如durham大学的monkman等人的论文(naturecommunications,7:13680,doi:10.1038/ncomms13680)、产业技术综合研究所的细贝等人的论文(hosokaietal.,sci.adv.2017;3:e1603282)、京都大学的佐藤等人的论文(scientificreports,7:4820,doi:10.1038/s41598-017-05007-7)和同为京都大学的佐藤等人的学会发表(日本化学会第98次春季年会、发表编号:2i4-15、将dabna用作发光分子的有机el中的高效发光的机理(dabnaを発光分子として用いた有機elにおける高効率発光の機構)、京都大学大学院工学研究科)等。本发明中,针对包含对象化合物的样品以300k测定荧光寿命时,因观察到延迟的荧光成分而判定该对象化合物为“热活化型延迟荧光体”。此处,延迟的荧光成分是指荧光寿命为0.1μsec以上。荧光寿命的测定可使用例如荧光寿命测定装置(hamamatsuphotonics公司制、c11367-01)来进行。
关于作为本发明第二成分的含有硼原子的化合物,已指出:根据分子轨道计算,参与从激发三重态向激发单重态的正向和反向的系间窜跃的激发三重态能量不是由磷光光谱观测到的激发三重态能量,而有可能是更高阶的激发三重态能量(日本化学会第98次春季年会、发表编号:2i4-15、将dabna用作发光分子的有机el中的高效发光的机理(dabnaを発光分子として用いた有機elにおける高効率発光の機構)、京都大学大学院工学研究科的佐藤彻教授的发表)。根据发表而启示出:在分子中具有硼原子的dabna2中的反向系间窜跃是使用高阶三重态轨道的fvht(fluorescenceviahighertriplet)机理,从高阶三重态轨道向基态的跃迁受到抑制,因此,发生自高阶三重态轨道向激发单重态轨道的跃迁。
将由第二成分的荧光光谱的短波长侧的峰顶求出的激发单重态能级记作e(2,s,pt),并将由第二成分的磷光光谱的短波长侧的峰顶求出的激发三重态能级记作e(2,t,pt)时,由它们求出的单重态三重态能量差(δe(2,st,pt))优选处于以下的关系。
δe(2,st,pt)=e(2,s,pt)-e(2,t,pt)≤0.20ev
换言之,在第二成分中,作为tadf活性的指标而使用δe(st)的大小。δe(st)越小则对显示出tadf活性而言越有利。
此处,δe(2,st,pt)优选为0.20ev以下,更优选为0.15ev以下,进一步优选为0.10ev以下。
反向系间窜跃速度
反向系间窜跃速度表示从激发三重态向激发单重态的反向系间窜跃的速度。第二成分的反向系间窜跃速度可通过瞬态荧光光谱测定并使用nat.commun.2015,6,8476.或organicelectronics2013,14,2721-2726记载的方法来计算,具体而言,辅助掺杂物的反向系间窜跃速度优选为105s-1以上,更优选为106s-1以上。
发光速度
发光速度表示未历经tadf过程但经由荧光发光从激发单重态向基态跃迁的速度。第二成分的发光速度与反向系间窜跃速度同样地可使用nat.commun.2015,6,8476.或organicelectronics2013,14,2721-2726中记载的方法来计算,具体而言,第二成分的反向系间窜跃速度优选为107s-1以上,更优选为108s-1以上。
关于作为掺杂物的多环芳香族化合物,只要是除式(1)所示的化合物之外的化合物即可,以下,针对适合的多环芳香族化合物进行详述。
1-3-1.通式(2)所示的多环芳香族化合物及其多聚体
关于作为第二成分的掺杂物的一个方式,优选为下述通式(2)所示的多环芳香族化合物或其多聚体。
上述式(3)中,r1~r11(以下也称为“r1等”)各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基、氰基或卤素(以上为第一取代基),它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
并且,r1~r11之中的相邻基团任选彼此键合并与a环、b环或c环一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)取代,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
y1为b(硼),x1和x2各自独立地为>o、>n-r、>s、>se或-c(-r)2-(其中,x1和x2不同时为>o)、前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,并且,该>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环和c环中的至少一者键合(需要说明的是,前述“-c(-r’)2-”的r’为氢、碳原子数1~5的烷基或碳原子数5~10的环烷基)。
通式(2)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。
作为r1等的第一取代基的“芳基”、“杂芳基”、“二芳基氨基”、“二芳基硼基(两个芳基任选借助单键或连接基团进行键合)”、“烷基”、“环烷基”、“烷氧基”和“芳氧基”、以及作为r1等的第二取代基的“芳基”、“杂芳基”、“烷基”和“环烷基”可以引用作为上述式(1)中的第一取代基的这些基团的说明。
此外,作为r1等的第一取代基的二杂芳基氨基中的“杂芳基”、芳基杂芳基氨基中的“杂芳基”可以引用作为上述式(1)中的第一取代基的杂芳基的说明,芳基杂芳基氨基中的“芳基”可以引用作为上述式(1)中的第一取代基的芳基的说明。
作为r1等的第一取代基的“卤素”为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
具体而言,可利用r1等(第一取代基)的结构的位阻性、供电子性和吸电子性来调整发光波长,r1~r11中的至少一者优选为以下式所示的基团,更优选为甲基、叔丁基、叔戊基、叔辛基、苯基、邻甲苯基、对甲苯基、2,4-二甲苯基、2,5-二甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二苯基氨基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、咔唑基、3,6-二甲基咔唑基、3,6-二叔丁基咔唑基和苯氧基,进一步优选为甲基、叔丁基、叔戊基、叔辛基、苯基、邻甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二苯基氨基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、咔唑基、3,6-二甲基咔唑基和3,6-二叔丁基咔唑基。此外,从合成容易度的观点出发,位阻大的基团对于选择性合成而言是优选的,具体而言,优选为叔丁基、叔戊基、叔辛基、邻甲苯基、对甲苯基、2,4-二甲苯基、2,5-二甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、3,6-二甲基咔唑基和3,6-二叔丁基咔唑基。
下述结构式中,“me”表示甲基、“tbu”表示叔丁基、“tam”表示叔戊基、“toct”表示叔辛基。
通式(2)中的r1~r11之中的相邻基团任选彼此键合并与a环、b环和c环中的至少一者一同形成芳环或杂芳环,通式(2)所示的多环芳香族化合物因a环、b环和c环上的取代基的相互键合形态的不同,而如下述通式(2-l1)和通式(2-l2)所示那样,构成化合物的环结构发生变化。各式中的符号的定义与通式(2)的定义相同。
式(2-l1)和式(2-l2)中的a’环、b’环和c’环表示取代基r1~r3、取代基r8~r11和取代基r4~r7之中的相邻基团彼此键合并分别与a环、b环和c环一同形成的芳环或杂芳环(也可以说是a环、b环或c环上稠合其它环结构而形成的稠环)。需要说明的是,虽然在式中并未示出,但还存在a环、b环和c环全部变成a’环、b’环和c’环的化合物。此外,由式(2-l1)和式(2-l2)可知:例如,a环的r3与c环的r4、b环的r11与a环的r1等不符合“邻接基团彼此”,它们不进行键合。即,“相邻基团”是指在同一环上相邻的基团。此外,b环的r8和c环的r7不与相邻基团键合,不构成所形成的上述芳环或杂芳环的一部分。
所形成的“芳环”(a’环、b’环或c’环)或“杂芳环”(a’环、b’环或c’环)是上述作为第一取代基的芳基或杂芳基的无价环。其中,构成a’环(b’环或c’环)的一部分的a环(或b环、c环)均为碳原子数6的苯环,因此,针对“芳环”,该苯环上稠合有五元环的稠环的总碳原子数9成为碳原子数的下限,针对“杂芳环”,该苯环上稠合有五元环的稠环的总碳原子数6成为碳原子数的下限。
式(2-l1)、式(2-l2)所示的化合物例如是具有对作为a环(或b环或c环)的苯环稠合例如苯环、吲哚环、吡咯环、苯并呋喃环或苯并噻吩环而形成的a’环(或b’环或c’环)的化合物,所形成的稠环a’(或稠环b’或稠环c’)分别为萘环、咔唑环、吲哚环、二苯并呋喃环或二苯并噻吩环。
作为所形成的芳环或杂芳环上取代的、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)、以及可在该第一取代基上进一步取代的芳基、杂芳基、烷基或环烷基(以上为第二取代基),可以引用作为上述r1等(第一取代基)和上述式(1)中的第一取代基的芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基的说明。
通式(2)中的x1和x2各自独立地为>o、>n-r、>s、>se或-c(-r)2-,其中,从x1和x2不同时为>o的观点出发,与通式(1)所示的多环芳香族化合物有所区别。
x1和x2优选均为>n-r、>o和>n-r、或>n-r和>o,更优选均为>o或均为>n-r,进一步优选均为>n-r。
需要说明的是,前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,作为它们的取代基,可以引用作为上述式(1)中的第一取代基的芳基、杂芳基、烷基或环烷基的说明。
此外,前述>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环和c环中的至少一者键合。需要说明的是,前述“-c(-r)2-”的r为氢、碳原子数1~5的烷基或碳原子数5~10的环烷基。
该规定可以用下述式(2-l3)所示的、具有n进入至稠环b’和稠环c’中的环结构的化合物来表现。即,例如是具有对于通式(2)中的作为b环(或c环)的苯环以n进入的方式稠合其它环而形成的b’环(或c’环)的化合物。所形成的稠环b’(或稠环c’)例如为吩噁嗪环、吩噻嗪环或吖啶环。
此外,上述规定也可以用下述式(2-l4)、式(2-l5)所示的、具有n进入至稠环a’中的环结构的化合物来表现。即,例如是具有对于通式(2)中的作为a环的苯环以n进入的方式稠合其它环而形成的a’环的化合物。所形成的稠环a’例如为吩噁嗪环、吩噻嗪环或吖啶环。需要说明的是,式(2-l3)~式(2-l5)中的各符号与式(2)中的定义相同。
作为具有多个通式(2)所示单元结构的多环芳香族化合物的多聚体,优选为二~六聚体,更优选为二~三聚体,进一步优选为二聚体。多聚体只要是1个化合物中具有多个上述单元结构的形态即可,例如,可以是多个上述单元结构用单键、碳原子数1~3的亚烷基(例如亚甲基)、亚苯基、亚萘基等连接基团键合而成的形态(连接型多聚体);以及,以上述单元结构所含的任意环(a环、b环或c环)被多个单元结构共享的方式键合而成的形态(环共享型多聚体),此外,也可以是以上述单元结构所含的任意环(a环、b环或c环)彼此稠合的方式键合而得的形态(环稠合型多聚体),优选为环共享型多聚体和环稠合型多聚体,更优选为环共享型多聚体。
需要说明的是,多聚体所具有的多个通式(1)所示的单元结构中,r2优选为氢。
作为这种多聚体,可列举出例如下述通式(2-4)、式(2-4-1)、式(2-4-2)、式(2-5-1)~式(2-5-4)或式(2-6)所示的多聚体。
下述式(2-4)所示的多聚体如果用通式(2)进行说明,则是共享作为a环的苯环,在1个化合物中具有多个(下述结构式中为两个)通式(2)所示单元结构的多聚体化合物(环共享型多聚体)。
此外,下述式(2-4-1)所示的多聚体如果用通式(2)进行说明,则是共享作为a环的苯环,在1个化合物中具有多个(下述结构式中为三个)通式(2)所示单元结构的多聚体化合物(环共享型多聚体)。
此外,下述式(2-4-2)所示的多聚体如果用通式(2)进行说明,则是共享作为a环的苯环,在1个化合物中具有多个(下述结构式中为六个)通式(2)所示单元结构的多聚体化合物(环共享型多聚体)。
此外,下述式(2-5-1)~式(2-5-4)所示的多聚体化合物如果用通式(2)进行说明,则是共享作为c环的苯环,在1个化合物中具有多个通式(2)所示单元结构的多聚体化合物(环共享型多聚体)。
此外,下述式(2-6)所示的多聚体如果用通式(2)进行说明,则是例如某个单元结构的作为b环(或a环、c环)的苯环与某个单元结构的作为b环(或a环、c环)的苯环发生稠合,在1个化合物中具有多个通式(2)所示单元结构的多聚体化合物(环稠合型多聚体)。
需要说明的是,下述各式中的r2优选为氢。
多聚体可以是用式(2-4)、式(2-4-1)或式(2-4-2)表现的多聚化形态与用式(2-5-1)~式(2-5-4)中任一者或式(2-6)表示的多聚化形态组合而成的多聚体,也可以是用式(2-5-1)~式(2-5-4)中任一者表现的多聚化形态与用式(2-6)表现的多聚化形态组合而成的多聚体,还可以是用式(2-4)、式(2-4-1)或式(2-4-2)表现的多聚化形态与用式(2-5-1)~式(2-5-4)中任一者表现的多聚化形态与用式(2-6)表现的多聚化形态组合而成的多聚体。
此外,通式(2)所示的多环芳香族化合物及其多聚体的化学结构中的至少一个氢任选被氰基、卤素或氘取代。例如,在通式(2)中,a环、b环、c环、这些环上的取代基、以及x1和x2为>n-r或-c(-r)2-时的r上的至少1个氢可以被氰基、卤素或氘取代。卤素为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
通式(2)所示的多环芳香族化合物及其多聚体可以按照国际公开第2015/102118号公报记载的制造方法来制造。此外,可以参考上述式(1)所示的多环芳香族化合物的制造方法,在第一反应中,不使用醚化反应,而是使用buchwald-hartwig反应等常规的氨基化反应来制造。
1-3-2.通式(2)所示的多环芳香族化合物及其多聚体的适合方式的例子
关于作为第二成分的掺杂物的一个方式,优选上述通式(2)中的r8为卤素、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~10的芳基或碳原子数2~10的杂芳基,且r7为氢、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~10的芳基或碳原子数2~10的杂芳基的多环芳香族化合物及其多聚体。
作为r8的卤素,为氟、氯、溴或碘,从通过重原子效应来增大自旋轨道相互作用的观点出发,优选为分子量大的卤素,优选为氯、溴和碘,更优选为氯和溴,进一步优选为碘。从通过导入电负度高的元素来使homo/lumo轨道变深的观点出发,优选为电负度大的元素,优选为氟、氯和溴,更优选为氟和氯,进一步优选为氟。
r8和r7的碳原子数1~6的烷基可以为直链和支链中的任一者,优选为碳原子数1~5的烷基(碳原子数3~5的支链烷基),更优选为碳原子数1~4的烷基(碳原子数3~4的支链烷基),具体为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、正己基、1-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基等,更优选为甲基或叔丁基,进一步优选为甲基。
r8和r7的碳原子数3~14的环烷基优选为碳原子数3~12的环烷基,更优选为碳原子数5~10的环烷基,具体而言,优选为环戊基、环己基、降冰片烯基或金刚烷基,更优选为环己基。
r8和r7的碳原子数6~10的芳基优选为苯基或萘基,更优选为苯基。
r8和r7的碳原子数2~10的杂芳基可列举出与通式(1)的第一取代基的“杂芳基”相同的基团,优选为六元环或五元环的一环结构的基团。
作为r8,更具体而言,优选为下述部分结构式(m)、式(e)、式(v)、式(t)、式(h)、式(p)、式(q)、式(r)、式(s)、式(y)、式(u)、式(w)、式(j)、式(k)、式(f)、式(c)、式(b)、式(i)或式(n)的基团,更优选为式(m)、式(t)、式(p)、式(f)或式(n)的基团,进一步优选为式(m)或式(t)的基团。
(上述式中,me表示甲基、et表示乙基、ipr表示异丙基、tbu表示丁基。)
针对r8与r7的组合,优选的是:r8为卤素、碳原子数1~5(优选为1~4)的烷基、碳原子数5~10的环烷基或苯基,且r7为氢、碳原子数1~5(优选为1~4)的烷基、碳原子数5~10的环烷基或苯基,优选r8和r7的分子量之和小。更优选的是:r8为甲基、叔丁基或苯基,且r7为氢、甲基、叔丁基或苯基。进一步优选的是:r8为甲基或叔丁基,且r7为氢或甲基。特别优选的是:r8为甲基,且r7为氢或甲基。最优选的是:r8为甲基且r7为氢。
从合成通式(2)的化合物的观点出发,与r8处于对称位置的r10优选为除氢之外的基团,更优选r8与r10为相同基团。此外,同样地r7为除氢之外的基团时,与r7处于对称位置的r5也优选为除氢之外的基团,更优选r7与r5为相同基团。
此外,该方式中,通式(2)中的x1和x2中至少一者为>n-r时,前述>n-r的r为芳基、杂芳基、烷基或环烷基,优选为上述部分结构式(m)、式(e)、式(v)、式(t)、式(h)、式(p)、式(q)、式(r)、式(s)、式(y)、式(u)、式(w)、式(j)或式(k)的基团,更优选为式(p)、式(q)、式(r)、式(s)、式(y)、式(u)或式(w)的基团,进一步优选为式(p)、式(q)或式(r)的基团,特别优选为式(p)的基团。
本方式的多环芳香族化合物及其多聚体可以按照国际公开第2015/102118号公报记载的制造方法来制造。此外,可以参考上述式(1)所示的多环芳香族化合物的制造方法,在第一反应中,不使用醚化反应,而是使用buchwald-hartwig反应等常规的氨基化反应来制造。
1-3-3.通式(2)所示的多环芳香族化合物的多聚体的适合方式的例子
关于作为第二成分的掺杂物的一个方式,优选为包含两个上述通式(2)所示的部分结构和连接该两个部分结构的连接基团l1的二聚体化合物。
前述连接基团l1为单键、碳原子数6~12的亚芳基、碳原子数2~15的亚杂芳基、碳原子数1~6的亚烷基、碳原子数1~6的亚烯基、碳原子数1~6的亚炔基、-o-、-s-、>n-r或它们的组合,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~14的环烷基,前述二聚体化合物中的至少1个氢任选被氰基、卤素或氘取代。
关于连接基团l1中的“亚芳基”、“亚杂芳基”和“亚烷基”,可以将上述式(1)中的第一取代基的“芳基”、“杂芳基”和“烷基”的说明替换成从这些基团中进一步去除任意的1个氢原子而表示的二价基团形式的说明并加以引用。
此外,“亚烯基”是亚烷基中具有1个或2个以上-c=c-基的基团,“亚炔基”是亚烷基中具有1个或2个以上-c≡c-基的基团,可以将上述“亚烷基”的说明中的1个或2个以上-ch2-基分别替换成-c=c-基、-c≡c-基并进行说明。
关于作为连接基团l1中的>n-r的r的“芳基”、“杂芳基”、“烷基”和“环烷基”以及与连接基团l1中的至少1个氢进行取代的“芳基”、“杂芳基”、“烷基”和“环烷基”,可以引用上述式(1)中的第一取代基的“芳基”、“杂芳基”、“烷基”和“环烷基”的说明。
连接基团l1可以是将选自由碳原子数6~12的亚芳基、碳原子数2~15的亚杂芳基、碳原子数1~6的亚烷基、碳原子数1~6的亚烯基、碳原子数1~6的亚炔基、-o-、-s-和>n-r组成的组中的至少1个基团组合而形成的基团。
连接基团l1与式(2)所示的部分结构的键合部位是任意的。
此外,二聚体化合物中的至少1个氢任选被氰基、卤素或氘取代。例如,在式(2)中,a环、b环、c环、这些环上的取代基、以及x1和x2为>n-r或-c(-r)2-时的r上的至少1个氢可以被取代,这些之中,可列举出芳基、杂芳基上的全部或一部分氢被取代的方式。
本方式的二聚体化合物可通过如下方法来制造:在制造与通式(2)所示部分结构相当的多环芳香族化合物后,通过公知的方法并利用连接基团l1将两个多环芳香族化合物进行键合;或者,预先将两个用于形成多环芳香族化合物的中间体用连接基团l1进行键合,并对用该连接基团l1进行了键合的两个中间体部分进行多环芳香族化。
1-3-4.通式(2)所示的多环芳香族化合物及其多聚体的适合的具体例
作为通式(2)所示的多环芳香族化合物,具体而言,可列举出日本特愿2017-199617、日本特愿2018-107092、国际申请号pct/jp2015/054426、国际申请号pct/jp2017/001089的说明书中记载的化合物,优选为以下示出的化合物。
1-3-5.通式(3)所示的多环芳香族化合物
关于作为第二成分的掺杂物的一个方式,优选为下述通式(3)所示的多环芳香族化合物。需要说明的是,通式(3)所示的多环芳香族化合物符合具有两个上述通式(2)所示单元结构的多环芳香族化合物的二聚体。
上述式(3)中,r3~r12、z1和z2(以下也称为“r3等”)各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基、氰基或卤素(以上为第一取代基),它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
并且,r5~r7和r10~r12之中的相邻基团任选彼此键合并与b环和d环中的至少一者一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)取代,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
z1任选借助连接基团或单键而与a环键合,此外,z2任选借助连接基团或单键而与c环键合。
y为b(硼),x1、x2、x3和x4各自独立地为>o、>n-r、>s、>se或-c(-r)2-(其中,x1和x2不同时为>o,并且,x3和x4不同时为>o)、前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,并且,该>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环、c环和d环中的至少一者键合(需要说明的是,前述“-c(-r’)2-”的r’为氢或碳原子数1~5的烷基或碳原子数5~10的环烷基)。
r1和r2各自独立地为氢、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~12的芳基、碳原子数2~15的杂芳基、二芳基氨基(其中,芳基为碳原子数6~12的芳基)或二芳基硼基(其中,芳基为碳原子数6~12的芳基,两个芳基任选借助单键或连接基团进行键合),式(3)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。
作为r3等的第一取代基的“芳基”、“杂芳基”、“二芳基氨基”、“二芳基硼基(两个芳基任选借助单键或连接基团进行键合)”、“烷基”、“环烷基”、“烷氧基”和“芳氧基”、以及作为r1等的第二取代基的“芳基”、“杂芳基”、“烷基”和“环烷基”可以引用作为上述式(1)中的第一取代基的这些基团的说明。
此外,作为r3等的第一取代基的二杂芳基氨基中的“杂芳基”、芳基杂芳基氨基中的“杂芳基”可以引用作为上述式(1)中的第一取代基的杂芳基的说明,芳基杂芳基氨基中的“芳基”可以引用作为上述式(1)中的第一取代基的芳基的说明。
作为r3等的第一取代基的“卤素”为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
需要说明的是,上述式(3)中的z1和z2各自独立地优选为芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基),它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
通式(3)中的b环的取代基r5~r7与d环的至少一个取代基r10~r12之中的相邻基团任选彼此键合并与b环和d环中的至少一者一同形成芳环或杂芳环。
因此,通式(3)所示的多环芳香族化合物因b环和d环上的取代基的相互键合形态的不同,而如下述通式(3-l1)所示那样,构成化合物的环结构发生变化。式(3-l1)中的b’环和d’环与通式(3)中的b环和d环分别对应。此外,式(3-l1)中的各符号的定义与通式(3)中的符号相同。
上述式(3-l1)中的b’环和d’环表示b环的取代基r5~r7与d环的取代基r10~r12之中的相邻基团彼此键合并分别与b环和d环一同形成的芳环或杂芳环(也可以说是b环或d环上稠合其它环结构而形成的稠环)。
此外,由上述式(3-l1)可知那样,式(3)中的b环的r7与d环的r12不符合“相邻基团彼此”,它们不进行键合。即,“相邻基团”是指在同一环上相邻的基团。
需要说明的是,z1可以借助连接基团或单键而与a环键合,此外,z2可以借助连接基团或单键而与c环键合,在发生键合的情况下,与上述b’环和d’环同样地,环结构会发生变化。
作为将z1与a环键合的连接基团以及将z2与c环进行键合的连接基团,可各自独立地列举出-o-、-s-或-c(-r’)2-,前述“-c(-r’)2-”的r’为氢或碳原子数1~6的烷基。
所形成的“芳环”(b’环或d’环)或“杂芳环”(b’环或d’环)是上述作为第一取代基的芳基或杂芳基的无价环。其中,构成b’环或c’环的一部分的b环或c环已经是碳原子数6的苯环,因此,针对“芳环”,该苯环上稠合有五元环的稠环的总碳原子数9成为碳原子数的下限,针对“杂芳环”,该苯环上稠合有五元环的稠环的总碳原子数6成为碳原子数的下限。
式(3-l1)所示的化合物是具有对作为b环或c环的苯环稠合例如苯环、吲哚环、吡咯环、苯并呋喃环或苯并噻吩环而形成的b’环或c’环的化合物,所形成的稠环b’或稠环c’分别为萘环、咔唑环、吲哚环、二苯并呋喃环或二苯并噻吩环。
作为所形成的芳环或杂芳环上取代的芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)、以及可在该第一取代基上进一步取代的芳基、杂芳基、烷基或环烷基(以上为第二取代基),可以引用作为上述r3等(第一取代基)和上述式(1)中的第一取代基的芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基的说明。
通式(3)中的x1、x2、x3和x4各自独立地为>o、>n-r、>s、>se或-c(-r)2-,其中,x1和x2不同时为>o,并且,x3和x4不同时为>o。
前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,作为它们的取代基,可以引用作为上述式(1)中的第一取代基的芳基、杂芳基、烷基或环烷基的说明。
此外,前述>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环、c环和d环中的至少一者键合。需要说明的是,前述“-c(-r’)2-”的r’为氢或碳原子数1~5的烷基或碳原子数5~10的环烷基。
该规定可以用下述式(3-l2)所示的、具有x1、x3进入至稠环b’和稠环d’中的环结构的化合物来表现。即,例如是具有对通式(3)中的作为b环(或d环)的苯环以x1(或x3)进入的方式稠合其它环而形成的b’环(或d’环)的化合物。
所形成的稠环b’(或稠环d’)例如为咔唑环、吩噁嗪环、吩噻嗪环或吖啶环等。需要说明的是,式(3-l2)中的各符号的定义与通式(3)中的定义相同。
需要说明的是,式(3-l2)示出了x1、x3进入至稠环b’和稠环d’中的环结构,但作为x2、x4的>n-r的r也可以同样地与a环、c环键合,在发生键合的情况下,与上述b’环和d’环同样地,环结构会发生变化。
通式(3)中的r1和r2各自独立地为氢、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~12的芳基、碳原子数2~15的杂芳基、二芳基氨基(其中,芳基为碳原子数6~12的芳基)或二芳基硼基(其中,芳基为碳原子数6~12的芳基,两个芳基任选借助单键或连接基团进行键合),优选为氢、碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基。
需要说明的是,这些取代基可以引用作为上述式(1)中的第一取代基的烷基、环烷基、芳基、杂芳基、二芳基氨基或二芳基硼基(两个芳基任选借助单键或连接基团进行键合)的说明。
此外,通式(3)所示的多环芳香族化合物中的至少一个氢任选被氰基、卤素或氘取代。例如,在式(3)中,a环、b环、c环、d环、这些环上的取代基、x1~x4为>n-r或-c(-r)2-时的r上的至少1个氢可以被氰基、卤素或氘取代。卤素为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氯。
作为通式(3)所示的多环芳香族化合物,具体而言,可列举出国际申请编号pct/jp2018/018731的说明书中记载的化合物,优选为以下所示的化合物。
通式(3)所示的多环芳香族化合物可以应用国际公开第2015/102118号公报记载的制造方法,且参考上述式(1)所示的多环芳香族化合物及其多聚体的制造方法来制造。
通式(3)所示的多环芳香族化合物基本上可通过使各个环结构彼此键合来制造中间体(第一反应),其后,通过将各个环结构用硼原子进行键合来制造最终产物(第二反应)。在第一反应中,可以利用例如亲核取代反应、乌尔曼反应之类的常规的醚化反应;buchwald-hartwig反应之类的常规的氨基化反应等。此外,在第二反应中,可以利用tandembora-friedel-crafts反应(连续芳香族亲电取代反应)。
1-3-6.通式(4)所示的多环芳香族化合物或其多聚体
关于作为第二成分的掺杂物的一个方式,优选为下述通式(4)所示的多环芳香族化合物或其多聚体。需要说明的是,通式(4)所示的多环芳香族化合物如上述式(2-l3)所示那样地,是具有n进入至稠环c’中的环结构的化合物之一。
上述式(4)中,r1~r3和r5~r15(以下也称为“r1等”)各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基、氰基或卤素(以上为第一取代基),它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
并且,r1~r3、r5~r7、r8~r11和r12~r15之中的相邻基团任选彼此键合并与a环、b环、c环和d环中的至少一者一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)取代,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
y1为b(硼),x为>o、>n-r、>s、>se或-c(-r)2-,前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,
l为单键、-c(-r)2-、>o、>s或>n-r,前述-c(-r)2-和>n-r中的r各自独立地为氢、芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基),它们任选进一步被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代,其中,x为>n-r时,l不为>o。
为多聚体时的式(4)中的r2为氢,且通式(4)所示的化合物和结构中的至少1个氢任选被氰基、卤素或氘取代。
作为上述式(4)中的r1等的第一取代基的“芳基”、“杂芳基”、“二芳基氨基”、“二芳基硼基(两个芳基任选借助单键或连接基团进行键合)”、“烷基”、“环烷基”、“烷氧基”和“芳氧基”、以及作为r1等的第二取代基的“芳基”、“杂芳基”、“烷基”和“环烷基”可以引用作为上述式(1)中的第一取代基的这些基团的说明。
此外,作为上述式(4)中的r1等的第一取代基的二杂芳基氨基中的“杂芳基”、芳基杂芳基氨基中的“杂芳基”可以引用作为上述式(1)中的第一取代基的杂芳基的说明,芳基杂芳基氨基中的“芳基”可以引用作为上述式(1)中的第一取代基的芳基的说明。
作为上述式(4)中的r1等的第一取代基的“卤素”为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
此外,作为上述式(4)中的r1等的第一取代基的更适合基团,可以应用上述式(1)中的r1等的第一取代基的适合基团的记载。
通式(4)中的r1~r3、r5~r7、r8~r11和r12~r15之中的相邻基团任选彼此键合并与a环、b环、c环和d环中的至少一者一同形成芳环或杂芳环,通式(4)所示的多环芳香族化合物因a环、b环、c环和d环上的取代基的相互键合形态的不同,而如下述通式(4-l1)、通式(4-l2)和通式(4-l3)所示那样,构成化合物的环结构发生变化。各式中的符号的定义与通式(4)的定义相同。
式(4-l1)~式(4-l3)中的a’环、b’环、c’环和d’环表示取代基r1~r3、取代基r5~r7、取代基r8~r11和取代基r12~r15之中的相邻基团彼此键合并分别与a环、b环、c环和d环中的至少一者一同形成的芳环或杂芳环(也可以说是a环、b环、c环或d环上稠合其它环结构而形成的稠环)。需要说明的是,虽然在式中并未示出,但还存在a环、b环、c环和d环全部变成a’环、b’环、c’环和d’环的化合物等其它组合。此外,由式(4-l1)~式(4-l3)可知:例如,a环的r1与b环的r11、b环的r8与c环的r7、c环的r5与d环的r15、d环的r12与a环的r3等不符合“相邻基团彼此”,它们不进行键合。即,“相邻基团”是指在同一环上相邻的基团。
所形成的“芳环”(a’环、b’环、c’环或d’环)或“杂芳环”(a’环、b’环、c’环或d’环)是上述作为第一取代基的芳基或杂芳基的无价环。其中,构成a’环(b’环、c’环或d’环)的一部分的a环(b环、c环或d环)均为碳原子数6的苯环,因此,针对“芳环”,该苯环上稠合有五元环的稠环的总碳原子数9成为碳原子数的下限,针对“杂芳环”,该苯环上稠合有五元环的稠环的总碳原子数6成为碳原子数的下限。
式(4-l1)~式(4-l3)所示的化合物例如是具有对作为a环(b环、c环或d环)的苯环稠合例如苯环、吲哚环、吡咯环、苯并呋喃环或苯并噻吩环而形成的a’环(b’环、c’环或d’环)的化合物,所形成的稠环a’(稠环b’、稠环c’或稠环d’)分别为萘环、咔唑环、吲哚环、二苯并呋喃环或二苯并噻吩环。
作为所形成的芳环或杂芳环上取代的、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)、以及可在该第一取代基上进一步取代的芳基、杂芳基、烷基或环烷基(以上为第二取代基),可以引用作为上述r1等(第一取代基)和上述式(1)中的第一取代基的芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基的说明。
通式(4)中的y1为b(硼),x为>o、>n-r、>s、>se或-c(-r)2-,优选为>o和>n-r。
需要说明的是,前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,作为它们的取代基,可以引用作为上述式(1)中的第一取代基的芳基、杂芳基、烷基或环烷基的说明。
通式(4)中的l为单键、-c(-r)2-、>o、>s和>n-r,优选为单键、>o或>n-r,更优选为单键。
关于作为前述-c(-r)2-和>n-r的r的芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)、以及在该第一取代基上进一步取代的芳基、杂芳基、烷基或环烷基(以上为第二取代基),可以引用作为上述式(1)中的第一取代基的芳基、杂芳基、二芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基的说明。
需要说明的是,式(4)所示的化合物不包括x为>n-r且l为>o的化合物。
作为具有多个通式(4)所示单元结构的多环芳香族化合物的多聚体,优选为二~六聚体,更优选为二~三聚体,进一步优选为二聚体。多聚体只要是1个化合物中具有多个上述单元结构的形态即可,例如,可以是多个上述单元结构用单键、碳原子数1~3的亚烷基(例如亚甲基)、亚苯基、亚萘基等连接基团键合而成的形态(连接型多聚体);以及,以上述单元结构所含的任意环(a环、b环、c环或d环)被多个单元结构共享的方式键合而成的形态(环共享型多聚体),此外,也可以是以上述单元结构所含的任意环(a环、b环、c环或d环)彼此稠合的方式键合而得的形态(环稠合型多聚体),优选为环共享型多聚体和环稠合型多聚体,更优选为环共享型多聚体。
需要说明的是,多聚体所具有的多个通式(4)所示的单元结构中,r2为氢。
作为这种多聚体,可列举出例如下述通式(4-4)、式(4-5-1)、式(4-5-2)、式(4-6-1)或式(4-6-2)所示的多聚体。
下述式(4-4)所示的多聚体如果用通式(4)进行说明,则是共享作为a环的苯环,在1个化合物中具有多个(下述结构式中为两个)通式(4)所示单元结构的多聚体化合物(环共享型多聚体)。
此外,下述式(4-5-1)、式(4-5-2)所示的多聚体如果用通式(4)进行说明,则是共享作为b环的苯环,在1个化合物中具有多个(下述结构式中为两个)通式(1)所示单元结构的多聚体化合物(环共享型多聚体)。
此外,下述式(4-6-1)、式(4-6-2)所示的多聚体如果用通式(4)进行说明,则是例如某个单元结构的作为a环(b环、c环或d环)的苯环与某个单元结构的作为a环(b环、c环或d环)的苯环发生稠合,在1个化合物中具有多个(下述结构式中为两个)通式(4)所示单元结构的多聚体化合物(环稠合型多聚体)。
需要说明的是,下述各式中的r2为氢。
多聚体可以是用式(4-4)表现的多聚化形态与用式(4-5-1)或式(4-5-2)表现的多聚化形态组合而成的多聚体,也可以是用式(4-4)、式(4-5-1)或式(4-5-2)表现的多聚化形态与用式(4-6-1)或式(4-6-2)表现的多聚化形态组合而成的多聚体。
此外,通式(4)所示的多环芳香族化合物及其多聚体的化学结构中的至少一个氢任选被氰基、卤素或氘取代。例如,在通式(4)中,a环、b环、c环、d环、这些环上的取代基、以及x为>n-r或-c(-r)2-时的r、l为-c(-r)2-或>n-r时的r上的至少1个氢可以被氰基、卤素或氘取代。卤素为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
上述通式(4)中,优选的是:r7和r8之中的一者为卤素、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~10的芳基或碳原子数2~10的杂芳基(以上也称为“z取代基”),且另一者为氢、碳原子数1~6的烷基、碳原子数3~14的环烷基、碳原子数6~10的芳基或碳原子数2~10的杂芳基。
此外,此时,b环的r8和c环的r7不与相邻基团键合,不构成所形成的上述芳环或杂芳环的一部分。此外,优选的是:前述“一者”为r8且前述“另一者”为r7。
r7和r8的卤素为氟、氯、溴或碘。从通过重原子效应来增大自旋轨道相互作用的观点出发,优选为分子量大的卤素,优选为氯、溴和碘,更优选为氯和溴,进一步优选为碘。从通过导入电负度高的元素来使homo/lumo轨道变深的观点出发,优选为电负度大的元素,优选为氟、氯和溴,更优选为氟和氯,进一步优选为氟。
r7和r8的碳原子数1~6的烷基可以为直链和支链中的任一者,优选为碳原子数1~5的烷基(碳原子数3~5的支链烷基),更优选为碳原子数1~4的烷基(碳原子数3~4的支链烷基),具体为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、正己基、1-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基等,更优选为甲基或叔丁基,进一步优选为甲基。
r7和r8的碳原子数3~14的环烷基优选为碳原子数3~12的环烷基,更优选为碳原子数5~10的环烷基,具体而言,优选为环戊基、环己基、降冰片烯基或金刚烷基,更优选为环己基。
r7和r8的碳原子数6~10的芳基优选为苯基或萘基,更优选为苯基。
r7和r8的碳原子数2~10的杂芳基可列举出与通式(1)的第一取代基的“杂芳基”相同的基团,优选为六元环或五元环的一环结构的基团。
需要说明的是,作为z取代基,优选为下述部分结构式(m)、式(e)、式(v)、式(t)、式(h)、式(p)、式(q)、式(r)、式(s)、式(y)、式(u)、式(w)、式(j)、式(k)、式(f)、式(c)、式(b)、式(i)或式(n)的基团,更优选为式(m)、式(t)、式(p)、式(f)或式(n)的基团,进一步优选为式(m)或式(t)的基团。
(上述式中,me表示甲基、et表示乙基、ipr表示异丙基、tbu表示丁基。)
从通过对分子赋予形变而表现出缩短延迟荧光寿命的tadf机理的观点出发,r7和r8优选均为z取代基。从获得高plqy的观点和分子稳定性出发,优选r7和r8中的仅任一者为z取代基。从合成容易度的观点出发,优选r8为z取代基。
从合成容易度的观点出发,r8为z取代基时,优选r10具有取代基,同样地,r7为z取代基时,优选r5和r13中的至少一者具有取代基,同样地,r5为z取代基时,优选r7和r14中的至少一者具有取代基。
此外,从合成容易度和稳定性的观点出发,优选取代基较小,优选为上述式(m)、式(e)、式(v)、式(t)、式(h)、式(p)、式(q)、式(r)、式(s)、式(j)、式(k)、式(f)、式(c)、式(b)、式(i)和式(n)的基团,这些之中,更优选为式(m)、式(e)、式(v)、式(t)、式(p)、式(f)和式(n)的基,进一步优选为式(m)和式(t)的基团,最优选为式(m)的基团。
针对r7与r8的组合,优选的是:r7和r8之中的一者为卤素、碳原子数1~5(优选为1~4)的烷基、碳原子数5~10的环烷基或苯基,且另一者为氢、碳原子数1~5(优选为1~4)的烷基、碳原子数5~10的环烷基或苯基,优选r7和r8的分子量之和小。此外,更优选的是:一者为甲基、叔丁基或苯基,且另一者为氢、甲基、叔丁基或苯基。此外,进一步优选的是:一者为甲基或叔丁基且另一者为氢或甲基。此外,特别优选的是:一者为甲基且另一者为氢或甲基。此外,最优选的是:一者为甲基且另一者为氢。此外,优选的是:前述“一者”为r8且前述“另一者”为r7。
从合成通式(4)的化合物的观点出发,与r8处于对称位置的r10优选为除氢之外的基团,更优选r8与r10为相同基团。此外,同样地r7为除氢之外的基团时,与r7处于对称位置的r5也优选为除氢之外的基团,更优选r7与r5为相同基团。
作为通式(4)所示的多环芳香族化合物及其多聚体,具体而言,可列举出日本特愿2018-110876的说明书中记载的化合物,优选为以下所示的化合物。
式(4)所示的多环芳香族化合物及其多聚体可以应用国际公开第2015/102118号公报记载的制造方法来制造。
即,如下述路线那样地,通过合成具有z1基团的中间体,并通过tandembora-friedel-crafts反应(连续芳香族亲电取代反应)使其环化,能够合成期望的多环芳香族化合物及其多聚体。下述路线中,z1表示卤素或氢,其它符号的定义与上述定义相同。
上述路线中的环化前的中间体也可以同样地利用国际公开第2015/102118号公报等所示的方法来合成。即,通过将基于buchwald-hartwig反应、铃木偶联反应或亲核取代反应、ullmann反应等的醚化反应等适当组合,能够合成具有期望取代基的中间体。
1-3-7.通式(5)所示的多环芳香族化合物或其多聚体
关于作为第二成分的掺杂物的一个方式,优选为下述通式(5)所示的多环芳香族化合物或其多聚体。
上述式(5)中,r1~r9(以下也称为“r1等”)各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基、芳氧基、氰基或卤素(以上为第一取代基),它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
并且,r1~r9之中的相邻基团任选彼此键合并与a环、b环和c环中的至少一者一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)取代,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(以上为第二取代基)取代。
y1为b(硼),x1、x2和x3各自独立地为>o、>n-r、>s、>se或-c(-r)2-(x1、x2和x3之中的至少两者为n-r),前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,并且,该>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环和c环中的至少一者键合(需要说明的是,前述“-c(-r’)2-”的r’为氢或碳原子数1~5的烷基或碳原子数5~10的环烷基)。
通式(5)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。
作为上述式(5)中的r1等的第一取代基的“芳基”、“杂芳基”、“二芳基氨基”、“二芳基硼基(两个芳基任选借助单键或连接基团进行键合)”、“烷基”、“环烷基”、“烷氧基”和“芳氧基”、以及作为r1等的第二取代基的“芳基”、“杂芳基”、“烷基”和“环烷基”可以引用作为上述式(1)中的第一取代基的这些基团的说明。
此外,作为上述式(5)中的r1等的第一取代基的二杂芳基氨基中的“杂芳基”、芳基杂芳基氨基中的“杂芳基”可以引用作为上述式(1)中的第一取代基的杂芳基的说明,芳基杂芳基氨基中的“芳基”可以引用作为上述式(1)中的第一取代基的芳基的说明。
作为上述式(5)中的r1等的第一取代基的“卤素”为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
通式(5)中的r1~r9之中的相邻基团任选彼此键合并与a环、b环和c环中的至少一者一同形成芳环或杂芳环,通式(5)所示的多环芳香族化合物因a环、b环和c环上的取代基的相互键合形态的不同,而如下述通式(5-l1)和通式(5-l2)所示那样,构成化合物的环结构会发生变化。各式中的符号的定义与通式(5)的定义相同。
式(5-l1)和式(5-l2)中的a’环、b’环和c’环表示取代基r1~r9之中的相邻基团彼此键合并分别与a环、b环和c环一同形成的芳环或杂芳环(也可以说是a环、b环或c环上稠合其它环结构而形成的稠环)。需要说明的是,虽然在式中并未示出,但还存在a环、b环和c环全部变成a’环、b’环和d’环的化合物等其它组合。此外,由上述式(5-l1)和式(5-l2)可知:例如,a环的r1与b环的r9、b环的r7与c环的r6、c环的r4与a环的r3等不符合“相邻基团彼此”,它们不进行键合。即,“相邻基团”是指在同一环上相邻的基团。
所形成的“芳环”(a’环、b’环或c’环)或“杂芳环”(a’环、b’环或c’环)是上述作为第一取代基的芳基或杂芳基的无价环。其中,构成a’环(b’环或c’环)的一部分的a环(b环或c环)均为碳原子数6的苯环,因此,针对“芳环”,该苯环上稠合有五元环的稠环的总碳原子数9成为碳原子数的下限,针对“杂芳环”,该苯环上稠合有五元环的稠环的总碳原子数6成为碳原子数的下限。
式(5-l1)和式(5-l2)所示的化合物例如是具有对作为a环(b环或c环)的苯环稠合例如苯环、吲哚环、吡咯环、苯并呋喃环或苯并噻吩环而形成的a’环(b环或c环)的化合物,所形成的稠环a’(稠环b’或稠环c’)分别是萘环、咔唑环、吲哚环、二苯并呋喃环或二苯并噻吩环。
作为所形成的芳环或杂芳环上取代的、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基(以上为第一取代基)、以及可在该第一取代基上进一步取代的芳基、杂芳基、烷基或环烷基(以上为第二取代基),可以引用作为上述r1等(第一取代基)和上述式(1)中的第一取代基的芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、二芳基硼基(两个芳基任选借助单键或连接基团进行键合)、烷基、环烷基、烷氧基或芳氧基的说明。
通式(5)中的y1为b(硼),x1、x2和x3各自独立地为>o、>n-r、>s、>se或-c(-r)2-,其中,x1、x2和x3之中的至少两个为n-r,优选x1、x2和x3中的三个为n-r。
前述-c(-r)2-的r为碳原子数1~6的烷基、碳原子数3~14的环烷基或碳原子数6~12的芳基,前述>n-r的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数1~6的烷基或碳原子数3~6的环烷基,作为它们的取代基,可以引用作为上述式(1)中的第一取代基的芳基、杂芳基、烷基或环烷基的说明。
此外,前述>n-r的r任选借助-o-、-s-、-c(-r’)2-、单键或稠合而与前述a环、b环和c环中的至少一者键合。需要说明的是,前述“-c(-r’)2-”的r’为氢、碳原子数1~5的烷基或碳原子数5~10的环烷基。
该规定可以用下述式(5-l3)所示的、具有式(5)的x2、x1的位置的n进入至稠环b’和稠环c’中的环结构的化合物来表现。即,例如是具有对通式(5)中的作为b环(或c环)的苯环以x1(或x2)的位置的n进入的方式稠合其它环而形成的b’环(或c’环)的化合物。所形成的稠环b’(或稠环c’)例如为吩噁嗪环、吩噻嗪环、吖啶环或磷杂吖嗪(phenophosphazine)环。
此外,上述规定也可以用下述式(5-l4)、式(5-l5)所示的、具有x1和x2中至少一者的位置的n进入至稠环a’中的环结构的化合物来表现。即,例如是具有对通式(5)中的作为a环的苯环以x1(和x2中至少一者)的位置的n进入的方式稠合其它环而形成的a’环的化合物。所形成的稠环a’例如为吩噁嗪环、吩噻嗪环、吖啶环或磷杂吖嗪环。
需要说明的是,式(5-l3)~式(5-l5)中的各符号与式(5)中的定义相同。
虽未具体说明,但上述规定还包括x3的n-r的r借助连接基团、单键而与b环和c环中的至少一者键合而成的形态。例如是具有对通式(5)中的作为b环(或c环)的苯环以x3进入的方式稠合其它环而形成的b’环(或c’环)的化合物。所形成的稠环b’(或稠环c’)例如为吩噁嗪环、吩噻嗪环、吖啶环或磷杂吖嗪环。
此外,上述规定还包括x1、x2或x3进入至任一稠环的形态进行复合而成的形态。
作为具有多个通式(5)所示单元结构的多环芳香族化合物的多聚体,优选为二~六聚体,优选为二~三聚体,进一步优选为二聚体。多聚体只要是1个化合物中具有多个上述单元结构的形态即可,例如,可以是多个上述单元结构用单键、碳原子数1~3的亚烷基(例如亚甲基)、亚苯基、亚萘基等连接基团键合而成的形态(连接型多聚体);以及,以上述单元结构所含的任意环(a环、b环或c环)被多个单元结构共享的方式键合而成的形态(环共享型多聚体),此外,也可以是以上述单元结构所含的任意环(a环、b环或c环)彼此稠合的方式键合而得的形态(环稠合型多聚体),优选为环共享型多聚体和环稠合型多聚体,更优选为环共享型多聚体。
需要说明的是,多聚体所具有的多个通式(5)所示的单元结构中,r2优选为氢。
作为这种多聚体,可列举出例如下述式(5-4)、式(5-5)或式(5-6)所示的多聚体。
下述式(5-4)所示的多聚体如果用通式(5)进行说明,则是共享作为a环的苯环,在1个化合物中具有两个通式(5)所示单元结构的二聚体化合物(环共享型多聚体)。
此外,下述式(5-5)所示的多聚体如果用通式(5)进行说明,则是共享作为a环的苯环和x2,在1个化合物中具有3个通式(5)所示单元结构的三聚体化合物(环共享型多聚体)。
此外,下述式(5-6)所示的多聚体如果用通式(5)进行说明,则是例如某个单元结构的作为a环(或b环、c环)的苯环与某个单元结构的作为a环(或b环、c环)的苯环发生稠合,在1个化合物中具有两个通式(5)所示单元结构的二聚体化合物(环稠合型多聚体)。
需要说明的是,下述式中的各符号与式(5)中的定义相同。
此外,通式(5)所示的多环芳香族化合物及其多聚体的化学结构中的至少一者的氢也可以为氰基、卤素或氘。例如,在通式(5)中,a环、b环、c环、这些环上的取代基、以及x1、x2和x3为>n-r或-c(-r)2-时的r上的至少1个氢可以被氰基、卤素、氘取代。卤素为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氯。
作为通式(5)所示的多环芳香族化合物及其多聚体,具体而言,可列举出日本特愿2017-171324的说明书记载的化合物,优选为以下所示的化合物。
式(5)所示的多环芳香族化合物及其多聚体可通过应用国际公开第2015/102118号公报记载的制造方法来制造。此外,可以参照上述式(1)所示的多环芳香族化合物及其多聚体的制造方法,在第一反应中不使用醚化反应,而是使用buchwald-hartwig反应等常规的氨基化反应来制造。
1-3-8.作为第二成分的多环芳香族化合物而适合的部分结构
作为第二成分的含硼的多环芳香族化合物,优选为包含下述式的任意部分结构的化合物。
需要说明的是,下述式的部分结构中的至少1个氢任选被芳基、杂芳基、烷基、环烷基、氰基、卤素或氘取代。
1-3-9.使第二成分的多环芳香族化合物高分子化而得的高分子化合物
通式(2)~(5)中任一者所示的多环芳香族化合物也可以以如下形式用于发光层用材料:以在它们上用反应性取代基进行取代而成的反应性化合物为单体并使其高分子化而得的高分子化合物或其高分子交联体、或者使主链型高分子与前述反应性化合物反应而得的侧基型高分子化合物或其侧基型高分子交联体。作为此时的反应性取代基,可以引用在式(1)所示的多环芳香族化合物中的说明。此外,针对这种高分子化合物和高分子交联体的用途详见后述。
需要说明的是,也可以制成具有第一结构单元和第二结构单元的共聚体、即高分子化合物(hd),所述第一结构单元源自在通式(1)所示的多环芳香族化合物上用反应性取代基进行取代而成的反应性化合物(h),所述第二结构单元源自在第二成分的含硼的多环芳香族化合物(通式(2)~(5)中任意者所示的多环芳香族化合物)上用反应性取代基进行取代而成的反应性化合物(d)。此外,还可以制成使该高分子化合物(hd)进一步交联而得的高分子交联体(hd)。
高分子化合物(hd)和高分子交联体(hd)呈现在同一主链中具有与主体对应的第一结构单元以及与掺杂物对应的第二结构单元的结构。
进而,可以制成在主链型高分子上用反应性化合物(h)和反应性化合物(d)进行取代而成的侧基型高分子化合物(hd),也可以制成使该侧基型高分子化合物(hd)进一步交联而得的侧基型高分子交联体(hd)。
侧基型高分子化合物(hd)和侧基型高分子交联体(hd)具有对于主链用与主体和掺杂物对应的侧链进行取代而得的侧基型结构。
2.有机电致发光元件的更详细说明
以下,针对本实施方式的有机el元件,基于附图来详细说明。图1是示出本实施方式的有机el元件的示意剖视图。
2-1.有机电致发光元件的结构
图1所示的有机el元件100具有:基板101、在基板101上设置的阳极102、在阳极102上设置的空穴注入层103、在空穴注入层103上设置的空穴输送层104、在空穴输送层104上设置的发光层105、在发光层105上设置的电子输送层106、在电子输送层106上设置的电子注入层107、以及在电子注入层107上设置的阴极108。
需要说明的是,有机el元件100也可以颠倒制作顺序而制成具有例如基板101、在基板101上设置的阴极108、在阴极108上设置的电子注入层107、在电子注入层107上设置的电子输送层106、在电子输送层106上设置的发光层105、在发光层105上设置的空穴输送层104、在空穴输送层104上设置的空穴注入层103、以及在空穴注入层103上设置的阳极102的构成。
上述各层并不是所有层均为必须,将最小结构单元设为包括阳极102和发光层105和阴极108的构成,空穴注入层103、空穴输送层104、电子输送层106、电子注入层107是任选设置的层。此外,上述各层可以分别由单一层构成,也可以由多层构成。
作为构成有机el元件的层的方式,除了上述“基板/阳极/空穴注入层/空穴输送层/发光层/电子输送层/电子注入层/阴极”的构成方式之外,可以为“基板/阳极/空穴输送层/发光层/电子输送层/电子注入层/阴极”、“基板/阳极/空穴注入层/发光层/电子输送层/电子注入层/阴极”、“基板/阳极/空穴注入层/空穴输送层/发光层/电子注入层/阴极”、“基板/阳极/空穴注入层/空穴输送层/发光层/电子输送层/阴极”、“基板/阳极/发光层/电子输送层/电子注入层/阴极”、“基板/阳极/空穴输送层/发光层/电子注入层/阴极”、“基板/阳极/空穴输送层/发光层/电子输送层/阴极”、“基板/阳极/空穴注入层/发光层/电子注入层/阴极”、“基板/阳极/空穴注入层/发光层/电子输送层/阴极”、“基板/阳极/发光层/电子输送层/阴极”、“基板/阳极/发光层/电子注入层/阴极”的构成方式。
2-2.有机电致发光元件中的基板
基板101为有机el元件100的支承体,通常可使用石英、玻璃、金属、塑料等。基板101根据目的而形成为板状、薄膜状或片状,可使用例如玻璃板、金属板、金属箔、塑料薄膜、塑料片等。其中,优选为玻璃板、以及聚酯、聚甲基丙烯酸酯、聚碳酸酯、聚砜等的透明合成树脂制板。如果是玻璃基板,则可使用钠钙玻璃、无碱玻璃等,此外,厚度只要是对于保持机械强度而言充分的厚度即可,只要是例如0.2mm以上即可。作为厚度的上限值,例如为2mm以下、优选为1mm以下。关于玻璃的材质,从玻璃中溶出的离子少时较好,因此优选为无碱玻璃,施加有sio2等隔离涂层的钠钙玻璃也已有市售,因此可以使用该玻璃。此外,为了提高阻气性,可以在基板101的至少单面设置有致密的氧化硅膜等阻气膜,尤其是将阻气性低的合成树脂制的板、薄膜或片用作基板101时,优选设置阻气膜。
2-3.有机电致发光元件中的阳极
阳极102发挥出向发光层105中注入空穴的作用。需要说明的是,在阳极102与发光层105之间设置有空穴注入层103和空穴输送层104中至少一者的情况下,借助它们向发光层105中注入空穴。
作为形成阳极102的材料,可列举出无机化合物和有机化合物。作为无机化合物,可列举出例如金属(铝、金、银、镍、钯、铬等)、金属氧化物(铟的氧化物、锡的氧化物、铟-锡氧化物(ito)、铟-锌氧化物(izo)等)、卤化金属(碘化铜等)、硫化铜、炭黑、ito玻璃、奈塞玻璃等。作为有机化合物,可列举出例如聚(3-甲基噻吩)等聚噻吩、聚吡咯、聚苯胺等导电性聚合物等。此外,可以从作为有机el元件的阳极使用的物质中适当选择来使用。
关于透明电极的电阻,只要能够供给对于发光元件的发光而言充分的电流即可,因此没有限定,从发光元件的耗电量的观点出发,优选为低电阻。例如,如果是300ω/□以下的ito基板则作为元件电极发挥功能,但现在也能够供给10ω/□左右的基板,因此,特别期望使用例如100~5ω/□、优选50~5ω/□的低电阻制品。ito的厚度可根据电阻值来任意选择,通常在50~300nm之间使用的情况较多。
2-4.有机电致发光元件中的空穴注入层、空穴输送层
空穴注入层103发挥将从阳极102移动过来的空穴高效地注入至发光层105内或空穴输送层104内的作用。空穴输送层104发挥将从阳极102注入的空穴或从阳极102借助空穴注入层103注入的空穴高效地输送至发光层105的作用。空穴注入层103和空穴输送层104分别通过将一种或两种以上的空穴注入/输送材料层叠、混合来形成,或者,由空穴注入/输送材料与高分子粘结剂的混合物来形成。此外,可以向空穴注入/输送材料中添加氯化铁(iii)那样的无机盐来形成层。
作为空穴注入/输送性物质,在施加有电场的电极间高效地注入/输送来自正极的空穴是必要的,理想的是空穴注入效率高,并高效地输送所注入的空穴。为此,优选电离电势小且空穴迁移率大、进而稳定性优异、在制造时和使用时不易产生成为阱的杂质的物质。
作为形成空穴注入层103和空穴输送层104的材料,可以从在光导电材料中作为空穴的电荷输送材料一直以来惯用的化合物、在p型半导体、有机el元件的空穴注入层和空穴输送层中使用的公知化合物中任意选择并使用。它们的具体例为咔唑衍生物(n-苯基咔唑、聚乙烯基咔唑等)、双(n-芳基咔唑)或双(n-烷基咔唑)等双咔唑衍生物;三芳基胺衍生物(在主链或侧链具有芳香族叔氨基的聚合物、1,1-双(4-二对甲苯基氨基苯基)环己烷、n,n’-二苯基-n,n’-二(3-甲基苯基)-4,4’-二氨基联苯、n,n’-二苯基-n,n’-二萘基-4,4’-二氨基联苯、n,n’-二苯基-n,n’-二(3-甲基苯基)-4,4’-二苯基-1,1’-二胺、n,n’-二萘基-n,n’-二苯基-4,4’-二苯基-1,1’-二胺、n4,n4’-二苯基-n4,n4’-双(9-苯基-9h-咔唑-3-基)-[1,1’-联苯]-4,4’-二胺、n4,n4,n4’,n4’-四[1,1’-联苯]-4-基)-[1,1’-联苯]-4,4’-二胺、4,4’,4”-三(3-甲基苯基(苯基)氨基)三苯基胺等三苯基胺衍生物;星型胺衍生物等)、茋衍生物、酞菁衍生物(无金属、铜酞菁等)、二氢吡唑衍生物、腙系化合物、苯并呋喃衍生物、噻吩衍生物、噁二唑衍生物、喹喔啉衍生物(例如1,4,5,8,9,12-六氮杂苯并菲-2,3,6,7,10,11-六甲腈等)、卟啉衍生物等杂环化合物;聚硅烷等。在聚合物体系中,优选在侧链具有前述单体的聚碳酸酯、苯乙烯衍生物、聚乙烯基咔唑和聚硅烷等,只要是能够形成对于发光元件的制作而言必要的薄膜,能够从阳极注入空穴,进而能够输送空穴的化合物,就没有特别限定。
此外,还已知有机半导体的导电性受到其掺杂的强烈影响。这种有机半导体基质物质由供电子性良好的化合物或受电子性良好的化合物构成。为了掺杂供电子物质,已知四氰基醌二甲烷(tcnq)或2,3,5,6-四氟四氰基-1,4-苯醌二甲烷(f4tcnq)等强受电子体(例如参见文献“m.pfeiffer,a.beyer,t.fritz,k.leo,appl.phys.lett.,73(22),3202-3204(1998)”和文献“j.blochwitz,m.pheiffer,t.fritz,k.leo,appl.phys.lett.,73(6),729-731(1998)”)。它们通过供电子型基础物质(空穴输送物质)中的电子迁移过程而生成所谓的空穴。根据空穴的数量和迁移率,基础物质的传导性非常明显地变化。作为具有空穴输送特性的基质物质,已知例如联苯胺衍生物(tpd等)或星型胺衍生物(tdata等)或特定的金属酞菁(尤其是锌酞菁znpc等)(日本特开2005-167175号公报)。
上述空穴注入层用材料和空穴输送层用材料也可以以如下形式用于空穴层用材料:以在它们上用反应性取代基进行取代而成的反应性化合物为单体并使其高分子化而得的高分子化合物或其高分子交联体、或者使主链型高分子与前述反应性化合物反应而得的侧基型高分子化合物或其侧基型高分子交联体。作为此时的反应性取代基,可以引用在式(1)所示的多环芳香族化合物中的说明。
针对这种高分子化合物和高分子交联体的用途,详见后述。
2-5.有机电致发光元件中的发光层
发光层105是通过在施加有电场的电极之间使从阳极102注入的空穴与从阴极108注入的电子再结合而发光的层。作为形成发光层105的材料,只要是通过空穴与电子的再结合而被激发并发光的化合物(发光性化合物)即可,优选为能够形成稳定的薄膜形状且在固体状态下显示高发光(荧光)效率的化合物。
发光层可以为单一层,也可以由多层构成,分别由发光层用材料(主体材料、掺杂材料)形成。主体材料和掺杂材料分别可以为1种,也可以是多种的组合。掺杂材料可以包含于主体材料的整体,也可以包含于局部。
需要说明的是,本发明的有机电致发光元件所具有的发光层中,作为第一成分,包含式(1)所示的多环芳香族化合物作为主体材料,作为第二成分,包含含硼的多环芳香族化合物作为掺杂材料。
主体材料的用量因主体材料的种类而异,只要根据其主体材料的特性来确定即可。主体材料的用量的基准优选为发光层用材料整体的50~99.999重量%,更优选为70~99.9重量%,进一步优选为80~99.9重量%,特别优选为90~99.9重量%。
掺杂材料的用量因掺杂材料的种类而异,只要根据其掺杂材料的特性来确定即可。掺杂物的用量基准优选为发光层用材料整体的0.001~50重量%,更优选为0.1~30重量%,进一步优选为0.1~20重量%,特别优选为0.1~10重量%。如果是上述范围,则从例如能够防止浓度淬灭现象这一点出发是优选的。
另一方面,从表现tadf的观点出发,优选掺杂物多。此外,由于还会因发光层之外的层而受到影响,因此,不仅根据发光层的主体和掺杂物,还根据元件构成来确定掺杂物的浓度。
作为能够与式(1)所示化合物组合使用的主体材料,可列举出一直以来作为发光体而已知的的蒽、芘等稠环衍生物;双苯乙烯基蒽衍生物、二苯乙烯基苯衍生物等双苯乙烯基衍生物;四苯基丁二烯衍生物、环戊二烯衍生物、芴衍生物、苯并芴衍生物等。
此外,作为能够与含硼的多环芳香族化合物组合使用的掺杂材料,没有特别限定,可以使用已知的化合物,可根据期望的发光颜色而从各种材料中选择。具体而言,可列举出例如菲、蒽、芘、并四苯、并五苯、苝、萘并芘、二苯并芘、红荧烯和
分发色光地进行例示时,作为蓝~蓝绿色掺杂材料,可列举出萘、蒽、菲、芘、苯并菲、苝、芴、茚、
此外,作为绿~黄色掺杂材料,可列举出香豆素衍生物、邻苯二甲酰亚胺衍生物、萘二甲酰亚胺衍生物、苝酮衍生物、吡咯并吡咯衍生物、环戊二烯衍生物、吖啶酮衍生物、喹吖啶酮衍生物和红荧烯等并四苯衍生物等,进而,作为适合例,还可列举出向作为上述蓝~蓝绿色掺杂材料而例示的化合物中导入芳基、杂芳基、芳基乙烯基、氨基、氰基等能够长波长化的取代基而得的化合物。
进而,作为橙~红色掺杂材料,可列举出双(二异丙基苯基)苝四羧酸酰亚胺等萘二甲酰亚胺衍生物;苝酮衍生物、以乙酰丙酮或苯甲酰丙酮和菲绕啉等作为配体的eu络合物等稀土络合物;4-(二氰基亚甲基)-2-甲基-6-(对二甲基氨基苯乙烯基)-4h-吡喃或其类似物、镁酞菁、铝氯酞菁等金属酞菁衍生物;罗丹明化合物、脱氮黄素衍生物、香豆素衍生物、喹吖啶酮衍生物、吩噁嗪衍生物、噁嗪衍生物、喹唑啉衍生物、吡咯并吡啶衍生物、方酸内鎓盐衍生物、紫蒽酮衍生物、吩嗪衍生物、吩噁嗪酮衍生物和噻二唑并芘衍生物等,进而,作为适合例,还可列举出向上述作为蓝~蓝绿色和绿~黄色掺杂材料而例示的化合物中导入芳基、杂芳基、芳基乙烯基、氨基、氰基等能够长波长化的取代基而得的化合物。
另外,作为掺杂物,可以从化学工业2004年6月号第13页和其中列举的参考文献等所记载的化合物等中适当选择并使用。
具有茋结构的胺用例如下述式表示。
该式中,ar1为从碳原子数6~30的芳基中进一步去除任意m-1个氢原子而示出的m价基团,ar2和ar3各自独立地为碳原子数6~30的芳基,ar1~ar3中至少一者具有茋结构,ar1~ar3任选被取代,且m为1~4的整数。
具有茋结构的胺更优选为下述式所示的二氨基茋。
该式中,ar2和ar3各自独立地为碳原子数6~30的芳基,ar2和ar3任选被取代。
碳原子数6~30的芳基的具体例可列举出苯、萘、苊烯、芴、非那烯、菲、蒽、荧蒽、苯并菲、芘、
具有茋结构的胺的具体例可列举出n,n,n’,n’-四(4-联苯基)-4,4’-二氨基茋、n,n,n’,n’-四(1-萘基)-4,4’-二氨基茋、n,n,n’,n’-四(2-萘基)-4,4’-二氨基茋、n,n’-二(2-萘基)-n,n’-二苯基-4,4’-二氨基茋、n,n’-二(9-菲基)-n,n’-二苯基-4,4’-二氨基茋、4,4’-双[4”-双(二苯基氨基)苯乙烯基]-联苯、1,4-双[4’-双(二苯基氨基)苯乙烯基]-苯、2,7-双[4’-双(二苯基氨基)苯乙烯基]-9,9-二甲基芴、4,4’-双(9-乙基-3-咔唑乙烯基)联苯、4,4’-双(9-苯基-3-咔唑乙烯基)联苯等。
此外,也可以使用日本特开2003-347056号公报和日本特开2001-307884号公报等中记载的具有茋结构的胺。
作为苝衍生物,可列举出例如3,10-双(2,6-二甲基苯基)苝、3,10-双(2,4,6-三甲基苯基)苝、3,10-二苯基苝、3,4-二苯基苝、2,5,8,11-四-叔丁基苝、3,4,9,10-四苯基苝、3-(1’-芘基)-8,11-二(叔丁基)苝、3-(9’-蒽基)-8,11-二(叔丁基)苝、3,3’-双(8,11-二(叔丁基)苝基)等。
此外,也可以使用日本特开平11-97178号公报、日本特开2000-133457号公报、日本特开2000-26324号公报、日本特开2001-267079号公报、日本特开2001-267078号公报、日本特开2001-267076号公报、日本特开2000-34234号公报、日本特开2001-267075号公报和日本特开2001-217077号公报等中记载的苝衍生物。
作为硼烷衍生物,可列举出例如1,8-二苯基-10-(双(三甲苯基硼基))蒽、9-苯基-10-(双(三甲苯基硼基))蒽、4-(9’-蒽基)双(三甲苯基硼基)萘、4-(10’-苯基-9’-蒽基)双(三甲苯基硼基)萘、9-(双(三甲苯基硼基))蒽、9-(4’-联苯基)-10-(双(三甲苯基硼基))蒽、9-(4’-(n-咔唑基)苯基)-10-(双(三甲苯基硼基))蒽等。
此外,也可以使用国际公开第2000/40586号单行本等中记载的硼烷衍生物。
芳香族胺衍生物用例如下述式表示。
该式中,ar4为从碳原子数6~30的芳基中进一步去除任意n-1个氢原子而示出的n价基团,ar5和ar6各自独立地为碳原子数6~30的芳基,ar4~ar6任选被取代,且n为1~4的整数。
尤其是,更优选ar4为从蒽、
碳原子数6~30的芳基的具体例可列举出苯、萘、苊烯、芴非那烯、菲、蒽、荧蒽、苯并菲、芘、
作为芳香族胺衍生物,作为
此外,作为芘系,可列举出例如n,n,n’,n’-四苯基芘-1,6-二胺、n,n,n’,n’-四(对甲苯基)芘-1,6-二胺、n,n,n’,n’-四(间甲苯基)芘-1,6-二胺、n,n,n’,n’-四(4-异丙基苯基)芘-1,6-二胺、n,n,n’,n’-四(3,4-二甲基苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-二(对甲苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-双(4-乙基苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-双(4-乙基苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-双(4-异丙基苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-双(4-叔丁基苯基)芘-1,6-二胺、n,n’-双(4-异丙基苯基)-n,n’-二(对甲苯基)芘-1,6-二胺、n,n,n’,n’-四(3,4-二甲基苯基)-3,8-二苯基芘-1,6-二胺、n,n,n,n-四苯基芘-1,8-二胺、n,n’-双(联苯基-4-基)-n,n’-二苯基芘-1,8-二胺、n1,n6-二苯基-n1,n6-双-(4-三甲基硅烷基苯基)-1h,8h-芘-1,6-二胺等。
此外,作为蒽系,可列举出例如n,n,n,n-四苯基蒽-9,10-二胺、n,n,n’,n’-四(对甲苯基)蒽-9,10-二胺、n,n,n’,n’-四(间甲苯基)蒽-9,10-二胺、n,n,n’,n’-四(4-异丙基苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-二(对甲苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-二(间甲苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-双(4-乙基苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-双(4-乙基苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-双(4-异丙基苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-双(4-叔丁基苯基)蒽-9,10-二胺、n,n’-双(4-异丙基苯基)-n,n’-二(对甲苯基)蒽-9,10-二胺、2,6-二叔丁基-n,n,n’,n’-四(对甲苯基)蒽-9,10-二胺、2,6-二叔丁基-n,n’-二苯基-n,n’-双(4-异丙基苯基)蒽-9,10-二胺、2,6-二叔丁基-n,n’-双(4-异丙基苯基)-n,n’-二(对甲苯基)蒽-9,10-二胺、2,6-二环己基-n,n’-双(4-异丙基苯基)-n,n’-二(对甲苯基)蒽-9,10-二胺、2,6-二环己基-n,n’-双(4-异丙基苯基)-n,n’-双(4-叔丁基苯基)蒽-9,10-二胺、9,10-双(4-二苯基氨基-苯基)蒽、9,10-双(4-二(1-萘基氨基)苯基)蒽、9,10-双(4-二(2-萘基氨基)苯基)蒽、10-二对甲苯基氨基-9-(4-二对甲苯基氨基-1-萘基)蒽、10-二苯基氨基-9-(4-二苯基氨基-1-萘基)蒽、10-二苯基氨基-9-(6-二苯基氨基-2-萘基)蒽等。
此外,还可列举出[4-(4-二苯基氨基-苯基)萘-1-基]-二苯基胺、[6-(4-二苯基氨基-苯基)萘-2-基]-二苯基胺、4,4’-双[4-二苯基氨基萘-1-基]联苯、4,4’-双[6-二苯基氨基萘-2-基]联苯、4,4”-双[4-二苯基氨基萘-1-基]-对三联苯、4,4”-双[6-二苯基氨基萘-2-基]-对三联苯等。
此外,也可以使用日本特开2006-156888号公报等中记载的芳香族胺衍生物。
作为香豆素衍生物,可列举出香豆素-6、香豆素-334等。
此外,也可以使用日本特开2004-43646号公报、日本特开2001-76876号公报和日本特开平6-298758号公报等中记载的香豆素衍生物。
作为吡喃衍生物,可列举出下述dcm、dcjtb等。
此外,也可以使用日本特开2005-126399号公报、日本特开2005-097283号公报、日本特开2002-234892号公报、日本特开2001-220577号公报、日本特开2001-081090号公报和日本特开2001-052869号公报等中记载的吡喃衍生物。
上述发光层用材料(主体材料和掺杂材料)也可以以如下形式用于发光层用材料:以在它们上用反应性取代基进行取代而成的反应性化合物为单体并使其高分子化而得的高分子化合物或其高分子交联体、或者使主链型高分子与前述反应性化合物反应而得的侧基型高分子化合物或其侧基型高分子交联体。作为此时的反应性取代基,可以引用在式(1)所示的多环芳香族化合物中的说明。
针对这种高分子化合物和高分子交联体的用途,详见后述。
2-6.有机电致发光元件中的电子注入层、电子输送层
电子注入层107发挥将从阴极108移动过来的电子高效地注入至发光层105内或电子输送层106内的作用。电子输送层106发挥将从阴极108注入的电子或从阴极108借助电子注入层107注入的电子高效地输送至发光层105的作用。电子输送层106和电子注入层107分别通过将一种或两种以上的电子输送/注入材料层叠、混合来形成,或者,由电子输送/注入材料与高分子粘结剂的混合物来形成。
电子注入/输送层是指负责从阴极注入电子、进而输送电子的层,理想的是电子注入效率高,且高效地输送所注入的电子。为此,优选电子亲和力大且电子迁移率大、进而稳定性优异、在制造时和使用时不易产生成为阱的杂质的物质。然而,考虑到空穴与电子的输送平衡时,在主要发挥能够高效地阻止来自阳极的空穴流向阴极侧而未再结合的作用的情况下,即便电子输送能力不那么高,也与电子输送能力高的材料同等地具有使发光效率提高的效果。因此,本实施方式中的电子注入/输送层也包括能够高效地阻止空穴移动的层的功能。
作为形成电子输送层106或电子注入层107的材料(电子输送材料),可以从在光导电材料中作为电子传导化合物一直以来惯用的化合物、在有机el元件的电子注入层和电子输送层中使用的公知化合物中任意地选择并使用。
作为在电子输送层或电子注入层中使用的材料,优选含有从如下物质中选择的至少一种:包含由选自碳、氢、氧、硫、硅和磷中的一种以上原子构成的芳香族环或杂芳香族环的化合物、吡咯衍生物及其稠环衍生物、以及具有受电子性氮的金属络合物。具体而言,可列举出萘、蒽等稠环系芳香族环衍生物;4,4’-双(二苯基乙烯基)联苯所代表的苯乙烯基系芳香族环衍生物;苝酮衍生物、香豆素衍生物、萘二甲酰亚胺衍生物、蒽醌、联苯醌等醌衍生物;氧化磷衍生物、咔唑衍生物和吲哚衍生物等。作为具有受电子性氮的金属络合物,可列举出例如羟基苯基噁唑络合物等羟基唑络合物;偶氮次甲基络合物、环庚三烯酚酮金属络合物、黄酮醇金属络合物和苯并喹啉金属络合物等。这些材料可以单独使用,也可以与不同的材料混合使用。
此外,作为其它电子传导化合物的具体例,可列举出吡啶衍生物、萘衍生物、蒽衍生物、菲绕啉衍生物、苝酮衍生物、香豆素衍生物、萘二甲酰亚胺衍生物、蒽醌衍生物、联苯醌衍生物、二苯基醌衍生物、苝衍生物、噁二唑衍生物(1,3-双[(4-叔丁基苯基)1,3,4-噁二唑基]亚苯基等)、噻吩衍生物、三唑衍生物(n-萘基-2,5-二苯基-1,3,4-三唑等)、噻二唑衍生物、8-羟基喹啉衍生物的金属络合物、羟基喹啉系金属络合物、喹喔啉衍生物、喹喔啉衍生物的聚合物、苯并唑类化合物、镓络合物、吡唑衍生物、全氟化亚苯基衍生物、三嗪衍生物、吡嗪衍生物、苯并喹啉衍生物(2,2’-双(苯并[h]喹啉-2-基)-9,9’-螺二芴等)、咪唑并吡啶衍生物、硼烷衍生物、苯并咪唑衍生物(三(n-苯基苯并咪唑-2-基)苯等)、苯并噁唑衍生物、苯并噻唑衍生物、喹啉衍生物、三联吡啶等寡吡啶衍生物、联吡啶衍生物、三联吡啶衍生物(1,3-双(4’-(2,2’:6’2”-三联吡啶基))苯等)、萘啶衍生物(双(1-萘基)-4-(1,8-萘啶-2-基)苯基氧化膦等)、醛连氮衍生物、咔唑衍生物、吲哚衍生物、氧化磷衍生物、双苯乙烯基衍生物等。
此外,也可以使用具有受电子性氮的金属络合物,可列举出例如羟基喹啉系金属络合物、羟基苯基噁唑络合物等羟基唑络合物;偶氮次甲基络合物、环庚三烯酚酮金属络合物、黄酮醇金属络合物和苯并喹啉金属络合物等。
上述材料可以单独使用,也可以与不同的材料混合使用。
上述材料之中,优选为硼烷衍生物、吡啶衍生物、荧蒽衍生物、bo系衍生物、蒽衍生物、苯并芴衍生物、氧化膦衍生物、嘧啶衍生物、咔唑衍生物、三嗪衍生物、苯并咪唑衍生物、菲绕啉衍生物和羟基喹啉系金属络合物。
<硼烷衍生物>
硼烷衍生物为例如下述通式(etm-1)所示的化合物,详情公开在日本特开2007-27587号公报中。
上述式(etm-1)中,r11和r12各自独立地为氢、烷基、任选被取代的芳基、被取代的甲硅烷基、任选被取代的含氮杂环、或氰基中的至少一者,r13~r16各自独立地为任选被取代的烷基或任选被取代的芳基,x为任选被取代的亚芳基,y为任选被取代的碳原子数16以下的芳基、被取代的硼基或任选被取代的咔唑基,并且,n各自独立地为0~3的整数。此外,作为“任选被取代的”或“被取代的”时的取代基,可列举出芳基、杂芳基、烷基或环烷基等。
上述通式(etm-1)所示的化合物之中,优选为下述通式(etm-1-1)所示的化合物、下述通式(etm-1-2)所示的化合物。
式(etm-1-1)中,r11和r12各自独立地为氢、烷基、任选被取代的芳基、被取代的甲硅烷基、任选被取代的含氮杂环、或者氰基中的至少一者,r13~r16各自独立地为任选被取代的烷基或任选被取代的芳基,r21和r22各自独立地为氢、烷基、任选被取代的芳基、被取代的甲硅烷基、任选被取代的含氮杂环、或者氰基中的至少一者,x1为任选被取代的碳原子数20以下的亚芳基,n各自独立地为0~3的整数,并且,m各自独立地为0~4的整数。此外,作为“任选被取代的”或“被取代的”时的取代基,可列举出芳基、杂芳基、烷基或环烷基等。
式(etm-1-2)中,r11和r12各自独立地为氢、烷基、任选被取代的芳基、被取代的甲硅烷基、任选被取代的含氮杂环、或者氰基中的至少一者,r13~r16各自独立地为任选被取代的烷基或任选被取代的芳基,x1为任选被取代的碳原子数20以下的亚芳基,并且,n各自独立地为0~3的整数。此外,作为“任选被取代的”或“被取代的”时的取代基,可列举出芳基、杂芳基、烷基或环烷基等。
作为x1的具体例,可列举出下述式(x-1)~式(x-9)中任一者所示的二价基团。
(各式中,ra各自独立地烷基或任选被取代的苯基。)
作为该硼烷衍生物的具体例,可列举出例如以下例子。
该硼烷衍生物可使用公知的原料和公知的合成方法来制造。
<吡啶衍生物>
吡啶衍生物为例如下述式(etm-2)所示的化合物,优选为式(etm-2-1)或式(etm-2-2)所示的化合物。
φ为n价的芳环(优选为n价的苯环、萘环、蒽环、芴环、苯并芴环、非那烯环、菲环或苯并菲环),n为1~4的整数。
上述式(etm-2-1)中,r11~r18各自独立地为氢、烷基(优选为碳原子数1~24的烷基)、环烷基(优选为碳原子数3~12的环烷基)或芳基(优选为碳原子数6~30的芳基)。
上述式(etm-2-2)中,r11和r12各自独立地为氢、烷基(优选为碳原子数1~24的烷基)、环烷基(优选为碳原子数3~12的环烷基)或芳基(优选为碳原子数6~30的芳基),r11与r12任选键合而形成环。
各式中,“吡啶系取代基”为下述式(py-1)~式(py-15)中任一者,吡啶系取代基各自独立地任选被碳原子数1~4的烷基取代。此外,吡啶系取代基任选借助亚苯基、亚萘基而键合于各式中的φ、蒽环或芴环。
吡啶系取代基为上述式(py-1)~式(py-15)中的任一者,这些之中,优选为下述式(py-21)~式(py-44)中的任一者。
各吡啶衍生物中的至少1个氢任选被氘取代,此外,上述式(etm-2-1)和式(etm-2-2)中的两个“吡啶系取代基”之中的一者任选被芳基置换。
作为r11~r18中的“烷基”,可以为直链和支链中的任一者,可列举出例如碳原子数1~24的直链烷基或碳原子数3~24的支链烷基。优选的“烷基”为碳原子数1~18的烷基(碳原子数3~18的支链烷基)。更优选的“烷基”为碳原子数1~12的烷基(碳原子数3~12的支链烷基)。进一步优选的“烷基”为碳原子数1~6的烷基(碳原子数3~6的支链烷基)。特别优选的“烷基”为碳原子数1~4的烷基(碳原子数3~4的支链烷基)。
作为具体的“烷基”,可列举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、正己基、1-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、正庚基、1-甲基己基、正辛基、叔辛基、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、2,6-二甲基-4-庚基、3,5,5-三甲基己基、正癸基、正十一烷基、1-甲基癸基、正十二烷基、正十三烷基、1-己基庚基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、正二十烷基等。
作为在吡啶系取代基上进行取代的碳原子数1~4的烷基,可以引用上述烷基的说明。
作为r11~r18中的“环烷基”,可列举出例如碳原子数3~12的环烷基。优选的“环烷基”为碳原子数3~10的环烷基。更优选的“环烷基”为碳原子数3~8的环烷基。进一步优选的“环烷基”为碳原子数3~6的环烷基。
作为具体的“环烷基”,可列举出环丙基、环丁基、环戊基、环己基、甲基环戊基、环庚基、甲基环己基、环辛基或二甲基环己基等。
作为r11~r18中的“芳基”,优选的芳基为碳原子数6~30的芳基,更优选的芳基为碳原子数6~18的芳基,进一步优选为碳原子数6~14的芳基,特别优选为碳原子数6~12的芳基。
作为具体的“碳原子数6~30的芳基”,可列举出作为单环系芳基的苯基;作为稠合二环系芳基的(1-,2-)萘基;作为稠合三环系芳基的苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基、并五苯-(1-,2-,5-,6-)基等。
优选的“碳原子数6~30的芳基”可列举出苯基、萘基、菲基、
上述式(etm-2-2)中的r11与r12任选键合而形成环,其结果,任选在芴骨架的五元环上螺键合有环丁烷、环戊烷、环戊烯、环戊二烯、环己烷、芴或茚等。
作为该吡啶衍生物的具体例,可列举出例如以下例子。
该吡啶衍生物可使用公知的原料和公知的合成方法来制造。
<荧蒽衍生物>
荧蒽衍生物为例如下述通式(etm-3)所示的化合物,详情公开在国际公开第2010/134352号公报中。
上述式(etm-3)中,x12~x21表示氢、卤素、直链、支化或环状的烷基、直链、支化或环状的烷氧基、取代或未取代的芳基、或者取代或未取代的杂芳基。此处,作为被取代时的取代基,可列举出芳基、杂芳基、烷基或环烷基等。
作为该荧蒽衍生物的具体例,可列举出例如以下例子。
<bo系衍生物>
bo系衍生物为例如下述式(etm-4)所示的多环芳香族化合物或具有多个下述式(etm-4)所示结构的多环芳香族化合物的多聚体。
r1~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代。
并且,r1~r11之中的相邻基团任选彼此键合并与a环、b环或c环一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代,它们中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代。
此外,式(etm-4)所示的化合物或结构中的至少1个氢任选被卤素或氘取代。
针对式(etm-4)中的取代基、成环形态、或者式(etm-4)的结构混杂多个而形成的多聚体的说明,可以引用上述通式(1)所示的多环芳香族化合物或其多聚体的说明。
作为该bo系衍生物的具体例,可列举出例如以下例子。
该bo系衍生物可使用公知的原料和公知的合成方法来制造。
<蒽衍生物>
蒽衍生物之一为例如下述式(etm-5-1)所示的化合物。
ar各自独立地为2价的苯或萘,r1~r4各自独立地为氢、碳原子数1~6的烷基、碳原子数3~6的环烷基或碳原子数6~20的芳基。
ar可各自独立地从2价的苯或萘中适当选择,两个ar可以相同也可以不同,从蒽衍生物的合成容易度的观点出发,优选为相同。ar与吡啶键合而形成“包含ar和吡啶的部位”,该部位以例如下述式(py-1)~式(py-12)中任意者所示的基团的形式而键合于蒽。
这些基团之中,优选为上述式(py-1)~式(py-9)中任意者所示的基团,更优选为上述式(py-1)~式(py-6)中任意者所示的基团。键合于蒽的两个“包含ar和吡啶的部位”的结构可以相同也可以不同,从蒽衍生物的合成容易度的观点出发,优选为相同结构。其中,从元件特性的观点出发,两个“包含ar和吡啶的部位”的结构相同或不同均是优选的。
关于r1~r4中的碳原子数1~6的烷基,可以是直链和支链中的任一者。即,是碳原子数1~6的直链烷基或碳原子数3~6的支链烷基。更优选为碳原子数1~4的烷基(碳原子数3~4的支链烷基)。作为具体例,可列举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、正己基、1-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基或2-乙基丁基等,优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,更优选为甲基、乙基或叔丁基。
作为r1~r4中的碳原子数3~6的环烷基的具体例,可列举出环丙基、环丁基、环戊基、环己基、甲基环戊基、环庚基、甲基环己基、环辛基或二甲基环己基等。
针对r1~r4中的碳原子数6~20的芳基,优选为碳原子数6~16的芳基,更优选为碳原子数6~12的芳基,特别优选为碳原子数6~10的芳基。
作为“碳原子数6~20的芳基”的具体例,可列举出作为单环系芳基的苯基、(邻,间,对)甲苯基、(2,3-,2,4-,2,5-,2,6-,3,4-,3,5-)二甲苯基、三甲苯基(2,4,6-三甲基苯基)、(邻,间,对)异丙苯基;作为二环系芳基的(2-,3-,4-)联苯基;作为稠合二环系芳基的(1-,2-)萘基;作为三环系芳基的三联苯基(间三联苯-2’-基、间三联苯-4’-基、间三联苯-5’-基、邻三联苯-3’-基、邻三联苯-4’-基、对三联苯-2’-基、间三联苯-2-基、间三联苯-3-基、间三联苯-4-基、邻三联苯-2-基、邻三联苯-3-基、邻三联苯-4-基、对三联苯-2-基、对三联苯-3-基、对三联苯-4-基);作为稠合三环系芳基的蒽-(1-,2-,9-)基、苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基等。
优选的“碳原子数6~20的芳基”为苯基、联苯基、三联苯基或萘基,更优选为苯基、联苯基、1-萘基、2-萘基或间三联苯-5’-基,进一步优选为苯基、联苯基、1-萘基或2-萘基,最优选为苯基。
蒽衍生物之一为例如下述式(etm-5-2)所示的化合物。
ar1各自独立地为单键、2价的苯、萘、蒽、芴或非那烯。
ar2各自独立地为碳原子数6~20的芳基,可以引用与上述式(etm-5-1)中的“碳原子数6~20的芳基”相同的说明。优选为碳原子数6~16的芳基,更优选为碳原子数6~12的芳基,特别优选为碳原子数6~10的芳基。作为具体例,可列举出苯基、联苯基、萘基、三联苯基、蒽基、苊基、芴基、非那烯基、菲基、苯并菲基、芘基、并四苯基、苝基等。
r1~r4各自独立地为氢、碳原子数1~6的烷基、碳原子数3~6的环烷基或碳原子数6~20的芳基,可以引用上述式(etm-5-1)中的说明。
作为这些蒽衍生物的具体例,可列举出例如以下例子。
这些蒽衍生物可使用公知的原料和公知的合成方法来制造。
<苯并芴衍生物>
苯并芴衍生物为例如下述式(etm-6)所示的化合物。
ar1各自独立地为碳原子数6~20的芳基,可以引用与上述式(etm-5-1)中的“碳原子数6~20的芳基”相同的说明。优选为碳原子数6~16的芳基,更优选为碳原子数6~12的芳基,特别优选为碳原子数6~10的芳基。作为具体例,可列举出苯基、联苯基、萘基、三联苯基、蒽基、苊基、芴基、非那烯基、菲基、苯并菲基、芘基、并四苯基、苝基等。
ar2各自独立地为氢、烷基(优选为碳原子数1~24的烷基)、环烷基(优选为碳原子数3~12的环烷基)或芳基(优选为碳原子数6~30的芳基),两个ar2任选键合而形成环。
作为ar2中的“烷基”,可以是直链和支链中的任一者,可列举出例如碳原子数1~24的直链烷基或碳原子数3~24的支链烷基。优选的“烷基”为碳原子数1~18的烷基(碳原子数3~18的支链烷基)。更优选的“烷基”为碳原子数1~12的烷基(碳原子数3~12的支链烷基)。进一步优选的“烷基”为碳原子数1~6的烷基(碳原子数3~6的支链烷基)。特别优选的“烷基”为碳原子数1~4的烷基(碳原子数3~4的支链烷基)。作为具体的“烷基”,可列举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、正己基、1-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、正庚基、1-甲基己基等。
作为ar2中的“环烷基”,可列举出例如碳原子数3~12的环烷基。优选的“环烷基”为碳原子数3~10的环烷基。更优选的“环烷基”为碳原子数3~8的环烷基。进一步优选的“环烷基”为碳原子数3~6的环烷基。作为具体的“环烷基”,可列举出环丙基、环丁基、环戊基、环己基、甲基环戊基、环庚基、甲基环己基、环辛基或二甲基环己基等。
作为ar2中的“芳基”,优选的芳基为碳原子数6~30的芳基,更优选的芳基为碳原子数6~18的芳基,进一步优选为碳原子数6~14的芳基,特别优选为碳原子数6~12的芳基。
作为具体的“碳原子数6~30的芳基”,可列举出苯基、萘基、苊基、芴基、非那烯基、菲基、苯并菲基、芘基、并四苯基、苝基、并五苯基等。
两个ar2任选键合而形成环,其结果,在芴骨架的五元环上任选螺键合有环丁烷、环戊烷、环戊烯、环戊二烯、环己烷、芴或茚等。
作为该苯并芴衍生物的具体例,可列举出例如以下例子。
该苯并芴衍生物可使用公知的原料和公知的合成方法来制造。
<氧化膦衍生物>
氧化膦衍生物为例如下述式(etm-7-1)所示的化合物。详情还记载于国际公开第2013/079217号公报中。
r5为取代或未取代的、碳原子数1~20的烷基、碳原子数6~20的芳基或碳原子数5~20的杂芳基,
r6为cn、取代或未取代的、碳原子数1~20的烷基、碳原子数1~20的杂烷基、碳原子数6~20的芳基、碳原子数5~20的杂芳基、碳原子数1~20的烷氧基或碳原子数6~20的芳氧基,
r7和r8各自独立地为取代或未取代的、碳原子数6~20的芳基或碳原子数5~20的杂芳基,
r9为氧或硫,
j为0或1,k为0或1,r为0~4的整数,q为1~3的整数。
此处,作为被取代时的取代基,可列举出芳基、杂芳基、烷基或环烷基等。
氧化膦衍生物可以为例如下述式(etm-7-2)所示的化合物。
r1~r3可以相同也可以不同,选自氢、烷基、环烷基、芳烷基、烯基、环烯基、炔基、烷氧基、烷基硫基、芳基醚基、芳基硫醚基、芳基、杂环基、卤素、氰基、醛基、羰基、羧基、氨基、硝基、甲硅烷基、以及在相邻取代基之间形成的稠环。
ar1可以相同也可以不同,为亚芳基或亚杂芳基。ar2可以相同也可以不同,为芳基或杂芳基。其中,ar1和ar2中的至少一者具有取代基或者在相邻取代基之间形成有稠环。n为0~3的整数,n为0时不存在不饱和结构部分,n为3时不存在r1。
这些取代基之中,烷基表示例如甲基、乙基、丙基、丁基等饱和脂肪族烃基,它们可以未取代也可以被取代。被取代时的取代基没有特别限定,可列举出例如烷基、芳基、杂环基等,这一点在以下的记载中也是通用的。此外,烷基的碳原子数没有特别限定,从获取容易性、成本的观点出发,通常为1~20的范围。
此外,环烷基表示例如环丙基、环己基、降冰片基、金刚烷基等饱和脂环式烃基,它们可以未取代也可以被取代。烷基部分的碳原子数没有特别限定,通常为3~20的范围。
此外,芳烷基表示例如苄基、苯基乙基等借由脂肪族烃的芳香族烃基,脂肪族烃和芳香族烃均可以未取代也可以被取代。脂肪族部分的碳原子数没有特别限定,通常为1~20的范围。
此外,烯基表示例如乙烯基、烯丙基、丁二烯基等包含双键的不饱和脂肪族烃基,它们可以未取代也可以被取代。烯基的碳原子数没有特别限定,通常为2~20的范围。
此外,环烯基表示例如环戊烯基、环戊二烯基、环己烯基等包含双键的不饱和脂环式烃基,它们可以未取代也可以被取代。
此外,炔基表示例如乙炔基等包含三键的不饱和脂肪族烃基,它们可以未取代也可以被取代。炔基的碳原子数没有特别限定,通常为2~20的范围。
此外,烷氧基表示例如甲氧基等借由醚键的脂肪族烃基,脂肪族烃基可以未取代也可以被取代。烷氧基的碳原子数没有特别限定,通常为1~20的范围。
此外,烷基硫基是烷氧基的醚键的氧原子被硫原子取代而成的基团。
此外,芳基醚基表示例如苯氧基等借由醚键的芳香族烃基,芳香族烃基可以未取代也可以被取代。芳基醚基的碳原子数没有特别限定,通常为6~40的范围。
此外,芳基硫醚基是芳基醚基的醚键的氧原子被硫原子取代而成的基团。
此外,芳基表示例如苯基、萘基、联苯基、菲基、三联苯基、芘基等芳香族烃基。芳基可以未取代也可以被取代。芳基的碳原子数没有特别限定,通常为6~40的范围。
此外,杂环基表示例如呋喃基、噻吩基、噁唑基、吡啶基、喹啉基、咔唑基等具有除碳之外的原子的环状结构基团,它们可以未取代也可以被取代。杂环基的碳原子数没有特别限定,通常为2~30的范围。
卤素表示氟、氯、溴、碘。
也可以包含在醛基、羰基、氨基上用脂肪族烃、脂环式烃、芳香族烃、杂环等进行取代而成的基团。
此外,脂肪族烃、脂环式烃、芳香族烃、杂环可以未取代也可以被取代。
甲硅烷基表示例如三甲基甲硅烷基等硅化合物基团,它们可以未取代也可以被取代。甲硅烷基的碳原子数没有特别限定,通常为3~20的范围。此外,硅原子数通常为1~6。
在相邻取代基之间形成的稠环是指例如在ar1与r2、ar1与r3、ar2与r2、ar2与r3、r2与r3、ar1与ar2等之间形成的共轭或非共轭的稠环。此处,n为1时,任选两个r1彼此形成共轭或非共轭的稠环。这些稠环可以在环内结构中包含氮、氧、硫原子,也可以进一步与其它环稠合。
作为该氧化膦衍生物的具体例,可列举出例如以下例子。
该氧化膦衍生物可使用公知的原料和公知的合成方法来制造。
<嘧啶衍生物>
嘧啶衍生物为例如下述式(etm-8)所示的化合物,优选为下述式(etm-8-1)所示的化合物。详情还记载于国际公开第2011/021689号公报中。
ar各自独立地为任选被取代的芳基或任选被取代的杂芳基。n为1~4的整数,优选为1~3的整数,更优选为2或3。
作为“任选被取代的芳基”的“芳基”,可列举出例如碳原子数6~30的芳基,优选为碳原子数6~24的芳基、更优选为碳原子数6~20的芳基、进一步优选为碳原子数6~12的芳基。
作为具体的“芳基”,可列举出作为单环系芳基的苯基;作为二环系芳基的(2-,3-,4-)联苯基;作为稠合二环系芳基的(1-,2-)萘基;作为三环系芳基的三联苯基(间三联苯-2’-基、间三联苯-4’-基、间三联苯-5’-基、邻三联苯-3’-基、邻三联苯-4’-基、对三联苯-2’-基、间三联苯-2-基、间三联苯-3-基、间三联苯-4-基、邻三联苯-2-基、邻三联苯-3-基、邻三联苯-4-基、对三联苯-2-基、对三联苯-3-基、对三联苯-4-基);作为稠合三环系芳基的苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为四环系芳基的四联苯基(5’-苯基-间三联苯-2-基、5’-苯基-间三联苯-3-基、5’-苯基-间三联苯-4-基、间四联苯基);作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基、并五苯-(1-,2-,5-,6-)基等。
作为“任选被取代的杂芳基”的“杂芳基”,可列举出例如碳原子数2~30的杂芳基,优选为碳原子数2~25的杂芳基,更优选为碳原子数2~20的杂芳基,进一步优选为碳原子数2~15的杂芳基,特别优选为碳原子数2~10的杂芳基。此外,作为杂芳基,可列举出例如除碳之外还含有1~5个选自氧、硫和氮中的杂原子作为成环原子的杂环等。
作为具体的杂芳基,可列举出例如吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、噁二唑基、噻二唑基、三唑基、四唑基、吡唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、吲哚基、异吲哚基、1h-吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、1h-苯并三唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、酞嗪基、萘啶基、嘌呤基、蝶啶基、咔唑基、吖啶基、吩噁噻基、吩噁嗪基、吩噻嗪基、吩嗪基、二苯并[b,e][1,4]氮硅杂环己烷基、中氮茚基、呋喃基、苯并呋喃基、异苯并呋喃基、二苯并呋喃基、萘并苯并呋喃基、噻吩基、苯并噻吩基、二苯并噻吩基、萘并苯并噻吩基、苯并磷杂环戊二烯基、二苯并磷杂环戊二烯基、苯并磷杂环戊二烯氧化物环的一价基团、二苯并磷杂环戊二烯氧化物环的一价基团、呋咱基、噻蒽基、吲哚并咔唑基、苯并吲哚并咔唑基和苯并苯并吲哚并咔唑基等。
此外,上述芳基和杂芳基中的至少1个氢任选被取代,分别任选被例如上述芳基、杂芳基取代。
作为该嘧啶衍生物的具体例,可列举出例如以下例子。
该嘧啶衍生物可使用公知的原料和公知的合成方法来制造。
<咔唑衍生物>
咔唑衍生物为例如下述式(etm-9)所示的化合物或者其借助单键等键合多个而成的多聚体。详情记载在美国公开公报2014/0197386号公报中。
ar各自独立地为任选被取代的芳基或任选被取代的杂芳基。n独立地为0~4的整数,优选为0~3的整数,更优选为0或1。
作为“任选被取代的芳基”的“芳基”,可列举出例如碳原子数6~30的芳基,优选为碳原子数6~24的芳基、更优选为碳原子数6~20的芳基、进一步优选为碳原子数6~12的芳基。
作为具体的“芳基”,可列举出作为单环系芳基的苯基;作为二环系芳基的(2-,3-,4-)联苯基;作为稠合二环系芳基的(1-,2-)萘基;作为三环系芳基的三联苯基(间三联苯-2’-基、间三联苯-4’-基、间三联苯-5’-基、邻三联苯-3’-基、邻三联苯-4’-基、对三联苯-2’-基、间三联苯-2-基、间三联苯-3-基、间三联苯-4-基、邻三联苯-2-基、邻三联苯-3-基、邻三联苯-4-基、对三联苯-2-基、对三联苯-3-基、对三联苯-4-基);作为稠合三环系芳基的苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为四环系芳基的四联苯基(5’-苯基-间三联苯-2-基、5’-苯基-间三联苯-3-基、5’-苯基-间三联苯-4-基、间四联苯基);作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基、并五苯-(1-,2-,5-,6-)基等。
作为“任选被取代的杂芳基”的“杂芳基”,可列举出例如碳原子数2~30的杂芳基,优选为碳原子数2~25的杂芳基,更优选为碳原子数2~20的杂芳基,进一步优选为碳原子数2~15的杂芳基,特别优选为碳原子数2~10的杂芳基。此外,作为杂芳基,可列举出例如除碳之外还含有1~5个选自氧、硫和氮中的杂原子作为成环原子的杂环等。
作为具体的杂芳基,可列举出例如吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、噁二唑基、噻二唑基、三唑基、四唑基、吡唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、吲哚基、异吲哚基、1h-吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、1h-苯并三唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、酞嗪基、萘啶基、嘌呤基、蝶啶基、咔唑基、吖啶基、吩噁噻基、吩噁嗪基、吩噻嗪基、吩嗪基、二苯并[b,e][1,4]氮硅杂环己烷基、中氮茚基、呋喃基、苯并呋喃基、异苯并呋喃基、二苯并呋喃基、萘并苯并呋喃基、噻吩基、苯并噻吩基、二苯并噻吩基、萘并苯并噻吩基、苯并磷杂环戊二烯基、二苯并磷杂环戊二烯基、苯并磷杂环戊二烯氧化物环的一价基团、二苯并磷杂环戊二烯氧化物环的一价基团、呋咱基、噻蒽基、吲哚并咔唑基、苯并吲哚并咔唑基和苯并苯并吲哚并咔唑基等。
此外,上述芳基和杂芳基中的至少1个氢任选被取代,分别任选被例如上述芳基、杂芳基取代。
咔唑衍生物可以为多个上述式(etm-9)所示的化合物借助单键等键合而成的多聚体。此时,除了借助单键之外,也可以借助芳环(优选为多价的苯环、萘环、蒽环、芴环、苯并芴环、非那烯环、菲环或苯并菲环)来键合。
作为该咔唑衍生物的具体例,可列举出例如以下例子。
该咔唑衍生物可使用公知的原料和公知的合成方法来制造。
<三嗪衍生物>
三嗪衍生物为例如下述式(etm-10)所示的化合物,优选为下述式(etm-10-1)所示的化合物。详情记载在美国公开公报2011/0156013号公报中。
ar各自独立地为任选被取代的芳基或任选被取代的杂芳基。n为1~3的整数,优选为2或3。
作为“任选被取代的芳基”的“芳基”,可列举出例如碳原子数6~30的芳基,优选为碳原子数6~24的芳基、更优选为碳原子数6~20的芳基、进一步优选为碳原子数6~12的芳基。
作为具体的“芳基”,可列举出作为单环系芳基的苯基;作为二环系芳基的(2-,3-,4-)联苯基;作为稠合二环系芳基的(1-,2-)萘基;作为三环系芳基的三联苯基(间三联苯-2’-基、间三联苯-4’-基、间三联苯-5’-基、邻三联苯-3’-基、邻三联苯-4’-基、对三联苯-2’-基、间三联苯-2-基、间三联苯-3-基、间三联苯-4-基、邻三联苯-2-基、邻三联苯-3-基、邻三联苯-4-基、对三联苯-2-基、对三联苯-3-基、对三联苯-4-基);作为稠合三环系芳基的苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为四环系芳基的四联苯基(5’-苯基-间三联苯-2-基、5’-苯基-间三联苯-3-基、5’-苯基-间三联苯-4-基、间四联苯基);作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基、并五苯-(1-,2-,5-,6-)基等。
作为“任选被取代的杂芳基”的“杂芳基”,可列举出例如碳原子数2~30的杂芳基,优选为碳原子数2~25的杂芳基,更优选为碳原子数2~20的杂芳基,进一步优选为碳原子数2~15的杂芳基,特别优选为碳原子数2~10的杂芳基。此外,作为杂芳基,可列举出例如除碳之外还含有1~5个选自氧、硫和氮中的杂原子作为成环原子的杂环等。
作为具体的杂芳基,可列举出例如吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、噁二唑基、噻二唑基、三唑基、四唑基、吡唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、吲哚基、异吲哚基、1h-吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、1h-苯并三唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、酞嗪基、萘啶基、嘌呤基、蝶啶基、咔唑基、吖啶基、吩噁噻基、吩噁嗪基、吩噻嗪基、吩嗪基、二苯并[b,e][1,4]氮硅杂环己烷基、中氮茚基、呋喃基、苯并呋喃基、异苯并呋喃基、二苯并呋喃基、萘并苯并呋喃基、噻吩基、苯并噻吩基、二苯并噻吩基、萘并苯并噻吩基、苯并磷杂环戊二烯基、二苯并磷杂环戊二烯基、苯并磷杂环戊二烯氧化物环的一价基团、二苯并磷杂环戊二烯氧化物环的一价基团、呋咱基、噻蒽基、吲哚并咔唑基、苯并吲哚并咔唑基和苯并苯并吲哚并咔唑基等。
此外,上述芳基和杂芳基中的至少1个氢任选被取代,分别任选被例如上述芳基、杂芳基取代。
作为该三嗪衍生物的具体例,可列举出例如以下例子。
该三嗪衍生物可使用公知的原料和公知的合成方法来制造。
<苯并咪唑衍生物>
苯并咪唑衍生物为例如下述式(etm-11)所示的化合物。
φ-(苯并咪唑系取代基)n(etm-11)
φ为n价的芳环(优选为n价的苯环、萘环、蒽环、芴环、苯并芴环、非那烯环、菲环或苯并菲环),n为1~4的整数,“苯并咪唑系取代基”是上述式(etm-2)、式(etm-2-1)和式(etm-2-2)中的“吡啶系取代基”中的吡啶基置换成苯并咪唑基而得的基团,苯并咪唑衍生物中的至少1个氢任选被氘取代。
上述苯并咪唑基中的r11为氢、碳原子数1~24的烷基、碳原子数3~12的环烷基或碳原子数6~30的芳基,可以引用上述式(etm-2-1)和式(etm-2-2)中的r11的说明。
φ优选进一步为蒽环或芴环,此时的结构可以引用上述式(etm-2-1)或式(etm-2-2)的结构,各式中的r11~r18可以引用上述式(etm-2-1)或式(etm-2-2)中的说明。此外,上述式(etm-2-1)或式(etm-2-2)中,用键合有两个吡啶系取代基的形态进行了说明,但将它们置换成苯并咪唑系取代基时,可以将两个吡啶系取代基用苯并咪唑系取代基进行置换(即n=2),也可以将任一个吡啶系取代基用苯并咪唑系取代基进行置换,并将另一个吡啶系取代基用r11~r18进行置换(即n=1)。进而,例如,还可以将上述式(etm-2-1)中的r11~r18中的至少一者用苯并咪唑系取代基进行置换,并将“吡啶系取代基”用r11~r18进行置换。
作为该苯并咪唑衍生物的具体例,可列举出例如1-苯基-2-(4-(10-苯基蒽-9-基)苯基)-1h-苯并[d]咪唑、2-(4-(10-(萘-2-基)蒽-9-基)苯基)-1-苯基-1h-苯并[d]咪唑、2-(3-(10-(萘-2-基)蒽-9-基)苯基)-1-苯基-1h-苯并[d]咪唑、5-(10-(萘-2-基)蒽-9-基)-1,2-二苯基-1h-苯并[d]咪唑、1-(4-(10-(萘-2-基)蒽-9-基)苯基)-2-苯基-1h-苯并[d]咪唑、2-(4-(9,10-二(萘-2-基)蒽-2-基)苯基)-1-苯基-1h-苯并[d]咪唑、1-(4-(9,10-二(萘-2-基)蒽-2-基)苯基)-2-苯基-1h-苯并[d]咪唑、5-(9,10-二(萘-2-基)蒽-2-基)-1,2-二苯基-1h-苯并[d]咪唑等。
该苯并咪唑衍生物可使用公知的原料和公知的合成方法来制造。
<菲绕啉衍生物>
菲绕啉衍生物为例如下述式(etm-12)或式(etm-12-1)所示的化合物。详情记载在国际公开2006/021982号公报中。
φ为n价的芳环(优选为n价的苯环、萘环、蒽环、芴环、苯并芴环、非那烯环、菲环或苯并菲环),n为1~4的整数。
各式的r11~r18各自独立地为氢、烷基(优选为碳原子数1~24的烷基)、环烷基(优选为碳原子数3~12的环烷基)或芳基(优选为碳原子数6~30的芳基)。此外,上述式(etm-12-1)中,r11~r18中任意者与作为芳环的φ键合。
各菲绕啉衍生物中的至少1个氢任选被氘取代。
作为r11~r18中的烷基、环烷基和芳基,可以引用上述式(etm-2)中的r11~r18的说明。此外,φ除了上述结构之外,还可列举出例如以下的结构式。需要说明的是,下述结构式中的r各自独立地为氢、甲基、乙基、异丙基、环己基、苯基、1-萘基、2-萘基、联苯基或三联苯基。
作为该菲绕啉衍生物的具体例,可列举出例如4,7-二苯基-1,10-菲绕啉、2,9-二甲基-4,7-二苯基-1,10-菲绕啉、9,10-二(1,10-菲绕啉-2-基)蒽、2,6-二(1,10-菲绕啉-5-基)吡啶、1,3,5-三(1,10-菲绕啉-5-基)苯、9,9’-二氟-联(1,10-菲绕啉-5-基)、浴铜灵、1,3-双(2-苯基-1,10-菲绕啉-9-基)苯等。
该菲绕啉衍生物可使用公知的原料和公知的合成方法来制造。
<羟基喹啉系金属络合物>
羟基喹啉系金属络合物为例如下述通式(etm-13)所示的化合物。
式中,r1~r6各自独立地为氢、氟、烷基、芳烷基、烯基、氰基、烷氧基或芳基,m为li、al、ga、be或zn,n为1~3的整数。
作为羟基喹啉系金属络合物的具体例,可列举出8-羟基喹啉锂、三(8-羟基喹啉)铝、三(4-甲基-8-羟基喹啉)铝、三(5-甲基-8-羟基喹啉)铝、三(3,4-二甲基-8-羟基喹啉)铝、三(4,5-二甲基-8-羟基喹啉)铝、三(4,6-二甲基-8-羟基喹啉)铝、双(2-甲基-8-羟基喹啉)(苯酚)铝、双(2-甲基-8-羟基喹啉)(2-甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(3-甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(4-甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(2-苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(3-苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(4-苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,3-二甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,6-二甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(3,4-二甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(3,5-二甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(3,5-二叔丁基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,6-二苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,4,6-三苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,4,6-三甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,4,5,6-四甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(1-萘酚)铝、双(2-甲基-8-羟基喹啉)(2-萘酚)铝、双(2,4-二甲基-8-羟基喹啉)(2-苯基苯酚)铝、双(2,4-二甲基-8-羟基喹啉)(3-苯基苯酚)铝、双(2,4-二甲基-8-羟基喹啉)(4-苯基苯酚)铝、双(2,4-二甲基-8-羟基喹啉)(3,5-二甲基苯酚)铝、双(2,4-二甲基-8-羟基喹啉)(3,5-二叔丁基苯酚)铝、双(2-甲基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-8-羟基喹啉)铝、双(2,4-二甲基-8-羟基喹啉)铝-μ-氧代-双(2,4-二甲基-8-羟基喹啉)铝、双(2-甲基-4-乙基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-4-乙基-8-羟基喹啉)铝、双(2-甲基-4-甲氧基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-4-甲氧基-8-羟基喹啉)铝、双(2-甲基-5-氰基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-5-氰基-8-羟基喹啉)铝、双(2-甲基-5-三氟甲基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-5-三氟甲基-8-羟基喹啉)铝、双(10-羟基苯并[h]喹啉)铍等。
该羟基喹啉系金属络合物可使用公知的原料和公知的合成方法来制造。
<噻唑衍生物和苯并噻唑衍生物>
噻唑衍生物为例如下述式(etm-14-1)所示的化合物。
φ-(噻唑系取代基)n(etm-14-1)
苯并噻唑衍生物为例如下述式(etm-14-2)所示的化合物。
φ-(苯并噻唑系取代基)n(etm-14-2)
各式的φ为n价的芳环(优选为n价的苯环、萘环、蒽环、芴环、苯并芴环、非那烯环、菲环或苯并菲环),n为1~4的整数,“噻唑系取代基”、“苯并噻唑系取代基”是上述式(etm-2)、式(etm-2-1)和式(etm-2-2)中的“吡啶系取代基”中的吡啶基置换成噻唑基、苯并噻唑基而得的基团,噻唑衍生物和苯并噻唑衍生物中的至少1个氢任选被氘取代。
φ优选进一步为蒽环或芴环,此时的结构可以引用上述式(etm-2-1)或式(etm-2-2)的结构,各式中的r11~r18可以引用上述式(etm-2-1)或式(etm-2-2)中的说明。此外,上述式(etm-2-1)或式(etm-2-2)中,用键合有两个吡啶系取代基的形态进行了说明,但将它们置换成噻唑系取代基(或苯并噻唑系取代基)时,可以将两个吡啶系取代基用噻唑系取代基(或苯并噻唑系取代基)进行置换(即n=2),也可以将任一个吡啶系取代基用噻唑系取代基(或苯并噻唑系取代基)进行置换,并将另一个吡啶系取代基用r11~r18进行置换(即n=1)。进而,例如,还可以将上述式(etm-2-1)中的r11~r18中的至少一者用噻唑系取代基(或苯并噻唑系取代基)进行置换,并将“吡啶系取代基”用r11~r18进行置换。
这些噻唑衍生物或苯并噻唑衍生物可使用公知的原料和公知的合成方法来制造。
电子输送层或电子注入层中,可以进一步包含能够将形成电子输送层或电子注入层的材料还原的物质。该还原性物质只要是具有一定还原性的物质,就可以使用各种物质,可适合地使用例如选自由碱金属、碱土金属、稀土金属、碱金属的氧化物、碱金属的卤化物、碱土金属的氧化物、碱土金属的卤化物、稀土金属的氧化物、稀土金属的卤化物、碱金属的有机络合物、碱土金属的有机络合物和稀土金属的有机络合物组成的组中的至少一种。
作为优选的还原性物质,可列举出na(功函数为2.36ev)、k(功函数为2.28ev)、rb(功函数为2.16ev)或cs(功函数为1.95ev)等碱金属;ca(功函数为2.9ev)、sr(功函数为2.0~2.5ev)或ba(功函数为2.52ev)等碱土金属,特别优选功函数为2.9ev以下的物质。这些之中,更优选的还原性物质为k、rb或cs的碱金属,进一步优选为rb或cs,最优选为cs。这些碱金属尤其是还原能力高,通过向形成电子输送层或电子注入层的材料中添加较少量而实现有机el元件中的发光亮度的提高、长寿命化。此外,作为功函数为2.9ev以下的还原性物质,还优选这些中的两种以上碱金属的组合,特别优选包含cs的组合、例如cs与na、cs与k、cs与rb、或者cs与na与k的组合。通过包含cs,能够高效地发挥还原能力,通过向形成电子输送层或电子注入层的材料中添加,从而实现有机el元件中的发光亮度的提高、长寿命化。
上述电子输注入层用材料和电子输送层用材料也可以以如下形式用于电子层用材料:以在它们上用反应性取代基进行取代而成的反应性化合物为单体并使其高分子化而得的高分子化合物或其高分子交联体、或者使主链型高分子与前述反应性化合物反应而得的侧基型高分子化合物或其侧基型高分子交联体。作为此时的反应性取代基,可以引用在式(1)所示的多环芳香族化合物中的说明。
针对这种高分子化合物和高分子交联体的用途,详见后述。
2-7.有机电致发光元件中的阴极
阴极108发挥借助电子注入层107和电子输送层106而向发光层105中注入电子的作用。
作为形成阴极108的材料,只要是能够将电子高效地注入至有机层中的物质,就没有特别限定,可以使用与形成阳极102的材料相同的材料。其中,优选为锡、铟、钙、铝、银、铜、镍、铬、金、铂、铁、锌、锂、钠、钾、铯和镁等金属或者它们的合金(镁-银合金、镁-铟合金、氟化锂/铝等铝-锂合金等)等。为了提高电子注入效率而使元件特性提高,锂、钠、钾、铯、钙、镁或包含这些低功函数金属的合金是有效的。然而,这些低功函数金属通常在大气中不稳定的情况较多。为了改善这一点,已知例如向有机层中掺杂微量的锂、铯、镁并使用稳定性高的电极的方法。作为其它的掺杂物,也可以使用氟化锂、氟化铯、氧化锂和氧化铯那样的无机盐。但不限定于它们。
进而,为了保护电极,作为优选例可列举出将铂、金、银、铜、铁、锡、铝和铟等金属或使用了这些金属的合金、以及二氧化硅、二氧化钛和氮化硅等无机物、聚乙烯醇、氯乙烯、烃系高分子化合物等进行层叠。这些电极为电阻加热、电子射线束、溅射、离子镀和涂布等,只要能够实现导通,就没有特别限定。
2-8.在各层中可以使用的粘结剂
在以上的空穴注入层、空穴输送层、发光层、电子输送层和电子注入层中使用的材料可以单独形成各层,也可以是其分散至作为高分子粘结剂的聚氯乙烯、聚碳酸酯、聚苯乙烯、聚(n-乙烯基咔唑)、聚甲基丙烯酸甲酯、聚甲基丙烯酸丁酯、聚酯、聚砜、聚苯醚、聚丁二烯、烃树脂、酮树脂、苯氧基树脂、聚酰胺、乙基纤维素、乙酸乙烯酯树脂、abs树脂、聚氨酯树脂等溶剂可溶性树脂、酚醛树脂、二甲苯树脂、石油树脂、尿素树脂、三聚氰胺树脂、不饱和聚酯树脂、醇酸树脂、环氧树脂、有机硅树脂等固化性树脂等中来使用。
2-9.有机电致发光元件
构成有机el元件的各层可通过利用蒸镀法、电阻加热蒸镀、电子束蒸镀、溅射、分子层叠法、印刷法、旋涂法或流延法、涂布法等方法将应构成各层的材料制成薄膜来形成。如此操作而形成的各层的膜厚没有特别限定,可根据材料的性质来适当设定,通常为2nm~5000nm的范围。膜厚通常可通过石英振荡式膜厚测定装置等进行测定。使用蒸镀法进行薄膜化时,其蒸镀条件因材料的种类、膜的目标晶体结构和缔合结构等而异。蒸镀条件通常优选在舟加热温度+50~+400℃、真空度10-6~10-3pa、蒸镀速度0.01~50nm/秒、基板温度-150~+300℃、膜厚2nm~5μm的范围内适当设定。
对如此操作而得到的有机el元件施加直流电压时,只要将阳极设为+、将阴极设为-的极性来施加即可,若施加2~40v左右的电压,则能够从透明或半透明的电极侧(阳极或阴极、以及两侧)观测发光。此外,该有机el元件在施加脉冲电流、交流电流的情况下也发光。需要说明的是,施加的交流的波形可以是任意的。
接着,作为制作有机el元件的方法的一例,针对包括阳极/空穴注入层/空穴输送层/由主体材料和掺杂材料形成的发光层/电子输送层/电子注入层/阴极的有机el元件进行说明。
2-9-1.蒸镀法
在适当的基板上,通过蒸镀法等形成阳极材料的薄膜而制作阳极后,在该阳极上形成空穴注入层和空穴输送层的薄膜。在其上共蒸镀主体材料和掺杂材料而形成薄膜,制成发光层,在该发光层上形成电子输送层、电子注入层,进而通过蒸镀法等形成包含阴极用物质的薄膜而制成阴极,由此得到目标的有机el元件。需要说明的是,在上述有机el元件的制作中,也可以颠倒制作顺序,按照阴极、电子注入层、电子输送层、发光层、空穴输送层、空穴注入层、阳极的顺度来制作。
2-9-2.湿式成膜法
湿式成膜法通过准备可形成有机el元件的各有机层的低分子化合物作为液状的有机层形成用组合物,并使用其来实施。不存在溶解该低分子化合物的适当有机溶剂时,也可以由高分子化合物等来准备有机层形成用组合物,所述高分子化合物是制成在该低分子化合物上用反应性取代基进行取代而成的反应性化合物并与具有溶解性功能的其它单体、主链型高分子一同高分子化而得的。
一般来说,湿式成膜法通过历经在基板上涂布有机层形成用组合物的涂布工序和从所涂布的有机层形成用组合物中去除溶剂的干燥工序来形成涂膜。上述高分子化合物具有交联性取代基时(也将其称为交联性高分子化合物),通过该干燥工序而进一步交联,形成高分子交联体。根据涂布工序的差异,将使用旋涂机的方法称为旋涂法,将使用狭缝涂布机的方法称为狭缝涂布法,将使用版的方法称为凹版、胶版、反向胶版、柔性印刷法,将使用喷墨打印机的方法称为喷墨法,将以雾状进行喷洒的方法称为喷雾法。干燥工序有风干、加热、减压干燥等方法。干燥工序可以仅进行1次,也可以使用不同的方法、条件进行多次。此外,例如,如在减压下烧成那样,也可以并用不同的方法。
湿式成膜法是指使用溶液的成膜法,例如,一部分印刷法(喷墨法)、旋涂法或流延法、涂布法等。湿式成膜法与真空蒸镀法不同,其不需要使用昂贵的真空蒸镀装置,能够在大气压下成膜。并且,湿式成膜法能够大面积化、连续生产,有助于降低制造成本。
另一方面,与真空蒸镀法相比时,湿式成膜法有时难以层叠化。使用湿式成膜法来制作层叠膜时,需要防止下层因上层的组合物而溶解,使用溶解性受控的组合物、下层的交联和正交溶剂(orthogonalsolvent、互不相溶的溶剂)等。然而,即使使用这些技术,有时也难以在全部膜的涂布中使用湿式成膜法。
因而,通常采用如下方法:仅几个层使用湿式成膜法,剩余通过真空蒸镀法来制作有机el元件。
例如,以下示出部分应用湿式成膜法来制作有机el元件的步骤。
(步骤1)阳极的基于真空蒸镀法的成膜
(步骤2)包含空穴注入层用材料的空穴注入层形成用组合物的基于湿式成膜法的成膜
(步骤3)包含空穴输送层用材料的空穴输送层形成用组合物的基于湿式成膜法的成膜
(步骤4)包含主体材料和掺杂材料的发光层形成用组合物的基于湿式成膜法的成膜
(步骤5)电子输送层的基于真空蒸镀法的成膜
(步骤6)电子注入层的基于真空蒸镀法的成膜
(步骤7)阴极的基于真空蒸镀法的成膜
通过历经该步骤,从而得到由阳极/空穴注入层/空穴输送层/包含主体材料和掺杂材料的发光层/电子输送层/电子注入层/阴极构成的有机el元件。
当然,通过存在防止下层的发光层溶解的手段或者使用与上述步骤相反地自阴极侧进行成膜的手段等,从而能够制成包含电子输送层用材料、电子注入层用材料的层形成用组合物,并通过湿式成膜法对它们进行成膜。
2-9-3.其它的成膜法
在有机层形成用组合物的成膜化中,可以使用激光加热描画法(liti)。liti是指通过用激光对附着于基材的化合物进行加热蒸镀的方法,向基材涂布的材料可以使用有机层形成用组合物。
2-9-4.任选工序
在成膜的各工序的前后,也可以适宜加入适当的处理工序、清洗工序和干燥工序。作为处理工序,可列举出例如曝光处理、等离子体表面处理、超声波处理、臭氧处理、使用了适当溶剂的清洗处理和加热处理等。进而,也可列举出制作堤(bank)的一系列工序。
堤的制作可以使用光刻技术。作为光刻可利用的堤材料,无机系材料和有机系材料均可使用。作为无机系材料,可例举出例如sinx、siox及其混合物等。另一方面,作为有机系材料,可列举出例如正型抗蚀材料和负型抗蚀材料等。此外,也可以使用喷墨法、凹版胶版印刷、反向胶版印刷、丝网印刷等可图案化的印刷法。此时,也可以使用永久抗蚀材料。
作为堤中使用的材料,可列举出多糖类及其衍生物、具有羟基的烯属单体的均聚物和共聚物、生物高分子化合物、聚丙烯酰基化合物、聚酯、聚苯乙烯、聚酰亚胺、聚酰胺酰亚胺、聚醚酰亚胺、聚硫醚、聚砜、聚亚苯基、聚苯醚、聚氨酯、环氧(甲基)丙烯酸酯、三聚氰胺(甲基)丙烯酸酯、聚烯烃、环状聚烯烃、丙烯腈-丁二烯-苯乙烯共聚物(abs)、有机硅树脂、聚氯乙烯、氯化聚乙烯、氯化聚丙烯、聚乙酸酯、聚降冰片烯、合成橡胶、聚偏二氟乙烯、聚四氟乙烯、聚六氟丙烯等氟化聚合物、氟烯烃-氢碳烯烃的共聚物、氟碳聚合物,但不仅仅限定于此。
例如,作为在堤的光刻技术中使用有机系材料的形成方法,
通过在形成有电极的元件基板上涂布相对于有机层形成用组合物显示拒液性的材料,并进行干燥,从而形成有机层。通过使用曝光用掩膜对该有机层进行曝光工序和显影工序,能够在形成有电极的元件基板上形成堤。其后,根据需要,为了使有机层形成用组合物均匀地铺展,也可以进行用于将堤表面的杂质去除的基于溶剂的清洗/干燥工序、紫外线处理等工序。
此外,也可以对具有堤的基板使用喷墨法来制作有机el元件,具体而言,通过在形成有电极的元件基板上设置堤,并从喷墨头向堤之间滴加有机层形成用组合物的液滴,使其干燥,由此能够形成膜。并且,如果反复该操作,将膜依次层叠,并使用真空蒸镀法来成膜电子输送层、电子注入层和电极,则能够制作发光部位被堤材料划分的有机el元件。
需要说明的是,为了保护如此制作的有机el元件不受水分、氧的影响,优选利用密封层进行覆盖。例如,若水分、氧等从外部侵入,则发光功能受阻,发生发光效率的降低、不发光的暗点(暗斑)。此外,存在发光寿命变短的可能性。
作为密封层,可以使用例如水分、氧等的透过性低的氮氧化硅(sion)等无机绝缘材料。此外,通过将透明玻璃、不透明陶瓷等密封基板借助粘接剂而粘贴于形成有有机el元件的元件基板,也可以对有机el元件进行密封。
2-9-5.湿式成膜法所使用的有机层形成用组合物
有机层形成用组合物通过在有机溶剂中溶解能够形成有机el元件的各有机层的低分子化合物或者使该低分子化合物高分子化而得的高分子化合物来获得。例如,发光层形成用组合物中优选含有:作为第一成分且作为主体材料的上述通式(1)所示的多环芳香族化合物(或其高分子化合物);作为第二成分且作为掺杂材料的上述含硼的多环芳香族化合物(或其高分子化合物);以及作为第三成分的至少1种有机溶剂。第三成分作为溶解组合物中的第一成分和第二成分的溶剂而发挥功能,在涂布时通过第三成分自身的受到控制的蒸发速度而提供平滑且均匀的表面形状。
需要说明的是,上述高分子化合物还包括:作为具有第一结构单元和第二结构单元的共聚体的高分子化合物(hd),所述第一结构单元源自在上述通式(1)所示的多环芳香族化合物上用反应性取代基进行取代而成的反应性化合物(h),所述第二结构单元源自在第二成分的含硼的多环芳香族化合物(通式(2)~(5)中任一者所示的多环芳香族化合物)上用反应性取代基进行取代而成的反应性化合物(d);使该高分子化合物(hd)进一步交联而得的高分子交联体(hd);在主链型高分子上用反应性化合物(h)和反应性化合物(d)进行取代而成的侧基型高分子化合物(hd);以及使该侧基型高分子化合物(hd)进一步交联而得的侧基型高分子交联体(hd)。
换言之,可以制成包含选自高分子化合物(hd)、高分子交联体(hd)、侧基型高分子化合物(hd)和侧基型高分子交联体(hd)中的至少一者以及有机溶剂的有机层形成用组合物。
需要说明的是,高分子化合物(hd)、高分子交联体(hd)、侧基型高分子化合物(hd)和侧基型高分子交联体(hd)具有在同一分子内存在作为第一成分的主体和作为第二成分的掺杂物的结构。
<有机溶剂>
有机层形成用组合物包含至少一种有机溶剂。通过在成膜时控制有机溶剂的蒸发速度,能够控制和改善成膜性和涂膜缺陷的有无、表面粗糙度、平滑性。此外,在使用喷墨法进行成膜时,能够控制喷墨头的针孔中的弯液面稳定性,控制/改善喷出性。并且,通过控制膜的干燥速度和衍生物分子的取向,能够改善具有由该有机层形成用组合物得到的有机层的有机el元件的电特性、发光特性、效率和寿命。
(1)有机溶剂的物性
至少1种有机溶剂的沸点为130~350℃,优选为140~300℃、进一步优选为150~250℃。如果沸点为130℃以上,则从喷墨喷出性的观点出发是优选的。此外,如果沸点为350℃以下,则从涂膜的缺陷、表面粗糙度、残留溶剂和平滑性的观点出发是优选的。从良好的喷墨喷出性、成膜性、平滑性和残留溶剂低的观点出发,有机溶剂更优选为包含2种以上有机溶剂的构成。另一方面,根据情况,考虑到搬运性等,可以是通过从有机层形成用组合物中去除溶剂而制成固态的组合物。
进而,有机溶剂优选包含对于第一成分的主体和第二成分的掺杂物中的至少1种而言的良溶剂(gs)和贫溶剂(ps),且良溶剂(gs)的沸点(bpgs)低于贫溶剂(ps)的沸点(bpps)。
通过添加高沸点的贫溶剂,在成膜时,低沸点的良溶剂会先挥发,组合物中的含有物的浓度与贫溶剂的浓度增加,促进迅速成膜。由此,能够获得缺陷少、表面粗糙度小、平滑性高的涂膜。
溶解度之差(sgs-sps)优选为1%以上、更优选为3%以上、进一步优选为5%以上。沸点之差(bpps-bpgs)优选为10℃以上、更优选为30℃以上、进一步优选为50℃以上。
有机溶剂在成膜后,通过真空、减压、加热等干燥工序而从涂膜中被去除。进行加热时,从改善涂布成膜性的观点出发,优选在至少1种溶质的玻璃化转变温度(tg)+30℃以下进行。此外,从削减残留溶剂的观点出发,优选在至少1种溶质的玻璃化转变温度(tg)-30℃以上进行加热。即便加热温度低于有机溶剂的沸点,有机溶剂也会因膜薄而被充分去除。此外,可以在不同温度下进行多次干燥,也可以并用多个干燥方法。
(2)有机溶剂的具体例
作为有机层形成用组合物中使用的有机溶剂,可列举出烷基苯系溶剂、苯基醚系溶剂、烷基醚系溶剂、环状酮系溶剂、脂肪族酮系溶剂、单环性酮系溶剂、具有二酯骨架的溶剂和含氟系溶剂等,作为具体例,可列举出戊醇、己醇、庚醇、辛醇、壬醇、癸醇、十一烷醇、十二烷醇、十四烷醇、己烷-2-醇、庚烷-2-醇、辛烷-2-醇、癸烷-2-醇、十二烷-2-醇、环己醇、α-萜品醇、β-萜品醇、γ-萜品醇、δ-萜品醇、萜品醇(混合物)、乙二醇单甲基醚乙酸酯、丙二醇单甲基醚乙酸酯、二乙二醇二甲基醚、二丙二醇二甲基醚、二乙二醇乙基甲基醚、二乙二醇异丙基甲基醚、二丙二醇单甲基醚、二乙二醇二乙基醚、二乙二醇单甲基醚、二乙二醇丁基甲基醚、三丙二醇二甲基醚、三乙二醇二甲基醚、二乙二醇单丁基醚、乙二醇单苯基醚、三乙二醇单甲基醚、二乙二醇二丁基醚、三乙二醇丁基甲基醚、聚乙二醇二甲基醚、四乙二醇二甲基醚、对二甲苯、间二甲苯、邻二甲苯、2,6-二甲基吡啶、2-氟间二甲苯、3-氟邻二甲苯、三氟化-2-氯苯、异丙苯、甲苯、2-氯-6-氟甲苯、2-氟茴香醚、茴香醚、2,3-二甲基吡嗪、溴苯、4-氟茴香醚、3-氟茴香醚、3-三氟甲基茴香醚、均三甲基苯、1,2,4-三甲基苯、叔丁基苯、2-甲基茴香醚、苯乙醚、苯并二氧杂环戊烯、4-甲基茴香醚、仲丁基苯、3-甲基茴香醚、4-氟-3-甲基茴香醚、伞花烃、1,2,3-三甲基苯、1,2-二氯苯、2-氟苯甲腈、4-氟藜芦醚、2,6-二甲基茴香醚、正丁基苯、3-氟苯甲腈、萘烷(十氢萘)、新戊基苯、2,5-二甲基茴香醚、2,4-二甲基茴香醚、苯甲腈、3,5-二甲基茴香醚、二苯基醚、1-氟-3,5-二甲氧基苯、苯甲酸甲酯、异戊基苯、3,4-二甲基茴香醚、邻甲苯基腈、正戊基苯、藜芦醚、1,2,3,4-四氢萘、苯甲酸乙酯、正己基苯、苯甲酸丙酯、环己基苯、1-甲基萘、苯甲酸丁酯、2-甲基联苯、3-苯氧基甲苯、2,2’-联甲苯、十二烷基苯、二戊基苯、四甲基苯、三甲氧基苯、三甲氧基甲苯、2,3-二氢苯并呋喃、1-甲基-4-(丙氧基甲基)苯、1-甲基-4-(丁基氧基甲基)苯、1-甲基-4-(戊基氧基甲基)苯、1-甲基-4-(己基氧基甲基)苯、1-甲基-4-(庚基氧基甲基)苯苄基丁基醚、苄基戊基醚、苄基己基醚、苄基庚基醚、苄基辛基醚、硝基苯、二甲基硝基苯、氨基联苯、二苯基胺等,不仅仅限定于此。此外,溶剂可以使用一种,也可以混合。
这些之中,作为有机溶剂,优选为选自烷基苯系溶剂和苯基醚系溶剂中的1种以上,更优选为3-苯氧基甲苯与环己基苯的混合溶剂。
<任选成分>
有机层形成用组合物可以在不损害其性质的范围内包含任选成分。作为任选成分,可列举出粘结剂和表面活性剂等。
(1)粘结剂
有机层形成用组合物可以含有粘结剂。粘结剂在成膜时形成膜,且将所得膜与基板进行接合。此外,在该有机层形成用组合物中发挥出使其它成分溶解和分散和粘结的作用。
作为有机层形成用组合物中使用的粘结剂,可列举出例如丙烯酸类树脂、聚对苯二甲酸乙二醇酯、乙烯-乙酸乙烯酯共聚物、乙烯-乙烯醇共聚物、丙烯腈-乙烯-苯乙烯共聚物(aes)树脂、离聚物、氯化聚醚、邻苯二甲酸二烯丙酯树脂、不饱和聚酯树脂、聚乙烯、聚丙烯、聚氯乙烯、聚偏二氯乙烯、聚苯乙烯、聚乙酸乙烯酯、特氟隆、丙烯腈-丁二烯-苯乙烯共聚物(abs)树脂、丙烯腈-苯乙烯共聚物(as)树脂、酚醛树脂、环氧树脂、三聚氰胺树脂、脲树脂、醇酸树脂、聚氨酯、以及上述树脂与聚合物的共聚物,不仅仅限定于此。
有机层形成用组合物所使用的粘结剂可以仅为1种,也可以混合使用多种。
(2)表面活性剂
例如,为了控制有机层形成用组合物的膜面均匀性、膜表面的亲溶剂性和拒液性,有机层形成用组合物可以含有表面活性剂。表面活性剂根据亲水性基团的结构而被分类为离子性和非离子性,进而,根据疏水性基团的结构而被分类为烷基系和硅系和氟系。此外,根据分子的结构而被分类为分子量较小且具有简单结构的单分子系以及分子量大且具有侧链、分枝的高分子系。此外,根据组成而被分类为单一系、混合有两种以上表面活性剂和基材的混合系。作为可用于该有机层形成用组合物的表面活性剂,可以使用所有种类的表面活性剂。
作为表面活性剂,可列举出例如polyflowno.45、polyflowkl-245、polyflowno.75、polyflowno.90、polyflowno.95(商品名、共荣社化学工业公司制);disperbyk161、disperbyk162、disperbyk163、disperbyk164、disperbyk166、disperbyk170、disperbyk180、disperbyk181、disperbyk182、byk300、byk306、byk310、byk320、byk330、byk342、byk344、byk346(商品名、byk-chemiejapan公司制);kp-341、kp-358、kp-368、kf-96-50cs、kf-50-100cs(商品名、信越化学工业公司制);surflonsc-101、surflonkh-40(商品名、seimichemical公司制);ftergent222f、ftergent251、ftx-218(商品名、neos公司制);eftopef-351、eftopef-352、eftopef-601、eftopef-801、eftopef-802(商品名、三菱材料公司制);megafacf-470、megafacf-471、megafacf-475、megafacr-08、megafacf-477、megafacf-479、megafacf-553、megafacf-554(商品名、dic公司制);氟烷基苯磺酸盐、氟烷基羧酸盐、氟烷基聚氧乙烯醚、氟烷基碘化铵、氟烷基甜菜碱、氟烷基磺酸盐、二甘油四(氟烷基聚氧乙烯醚)、氟烷基三甲基铵盐、氟烷基氨基磺酸盐、聚氧乙烯壬基苯基醚、聚氧乙烯辛基苯基醚、聚氧乙烯烷基醚、聚氧乙烯月桂酸酯、聚氧乙烯油酸酯、聚氧乙烯硬脂酸酯、聚氧乙烯月桂胺、脱水山梨糖醇月桂酸酯、脱水山梨糖醇棕榈酸酯、脱水山梨糖醇硬脂酸酯、脱水山梨糖醇油酸酯、脱水山梨糖醇脂肪酸酯、聚氧乙烯脱水山梨糖醇月桂酸酯、聚氧乙烯脱水山梨糖醇棕榈酸酯、聚氧乙烯脱水山梨糖醇硬脂酸酯、聚氧乙烯脱水山梨糖醇油酸酯、聚氧乙烯萘基醚、烷基苯磺酸盐和烷基二苯基醚二磺酸盐。
此外,表面活性剂可以使用1种,也可以组合使用2种以上。
<有机层形成用组合物的组成和物性>
有机层形成用组合物中的各成分的含量可考虑有机层形成用组合物中的各成分的良好溶解性、保存稳定性和成膜性、以及由该有机层形成用组合物得到的涂膜的优质膜质、以及使用喷墨法时的良好喷出性、具有使用该组合物制作的有机层的有机el元件的良好电特性、发光特性、效率、寿命的观点来决定。例如,在发光层形成用组合物的情况下,优选的是:第一成分的主体材料相对于发光层形成用组合物的总质量为0.0999~8.0质量%,作为第二成分的掺杂材料相对于发光层形成用组合物的总质量为0.0001~2.0质量%,作为第三成分的有机溶剂相对于发光层形成用组合物的总质量为90.0~99.9质量%。
更优选的是:作为第一成分的主体材料相对于发光层形成用组合物的总质量为0.095~4.0质量%,第二成分相对于发光层形成用组合物的总质量为0.005~1.0质量%,作为第三成分的有机溶剂相对于发光层形成用组合物的总质量为95.0~99.9质量%。
进一步优选的是:作为第一成分的主体材料相对于发光层形成用组合物的总质量为0.25~2.5质量%,作为第二成分的掺杂材料相对于发光层形成用组合物的总质量为0.05~0.5质量%,作为第三成分的有机溶剂相对于发光层形成用组合物的总质量为97.0~99.7质量%。
有机层形成用组合物可通过利用公知的方法,对上述成分适当选择并进行搅拌、混合、加热、冷却、溶解、分散等来制造。此外,也可以在制备后适当选择并进行过滤、脱气(也称为除气)、离子交换处理和非活性气体置换/封入处理等。
作为有机层形成用组合物的粘度,粘度高时能够获得良好的成膜性和使用喷墨法时的良好喷出性。另一方面,粘度低时容易制作薄膜。由此,关于该有机层形成用组合物的粘度,25℃下的粘度优选为0.3~3mpa·s、更优选为1~3mpa·s。本发明中,粘度是使用圆锥平板型旋转粘度计(锥板类型)而测得的值。
作为有机层形成用组合物的表面张力,低时能够获得成膜性良好且无缺陷的涂膜。另一方面,高时能够获得良好的喷墨喷出性。由此,关于该有机层形成用组合物的粘度,25℃中的表面张力优选为20~40mn/m、更优选为20~30mn/m。本发明中,表面张力是使用悬滴法而测得的值。
2-9-6.交联性高分子化合物:通式(xlp-1)所示的化合物
接着,针对上述高分子化合物具有交联性取代基的情况进行说明。这种交联性高分子化合物例如为下述通式(xlp-1)所示的化合物。
式(xlp-1)中,
mux、ecx和k与上述式(sph-1)中的mu、ec和k的定义相同,其中,式(xlp-1)所示的化合物具有至少1个交联性取代基(xls),优选具有交联性取代基的1价或2价的芳香族化合物的含量在分子中为0.1~80质量%。
具有交联性取代基的1价或2价的芳香族化合物的含量优选为0.5~50质量%,更优选为1~20质量%。
作为交联性取代基(xls),只要是能够将上述高分子化合物进一步交联化的基团,就没有特别限定,优选为以下结构的取代基。各结构式中的*表示键合位置。
l各自独立地为单键、-o-、-s-、>c=o、-o-c(=o)-、碳原子数1~12的亚烷基、碳原子数1~12的氧亚烷基和碳原子数1~12的聚氧亚烷基。上述取代基之中,优选为式(xls-1)、式(xls-2)、式(xls-3)、式(xls-9)、式(xls-10)或式(xls-17)所示的基团,更优选为式(xls-1)、式(xls-3)或式(xls-17)所示的基团。
此外,作为除上述之外的交联性取代基,可以为氯、溴或碘;下述式(xls-19)所示的含硼基团。结构式中的*表示键合位置。
上述式(xls-19)中,r41和r42各自独立地为烷基,r41与r42任选相互键合而形成环。并且,r41和r42的总碳原子数优选为2~10。
作为具有交联性取代基的2价芳香族化合物,可列举出例如具有下述部分结构的化合物。各结构式中的*表示键合位置。
2-9-7.高分子化合物和交联性高分子化合物的制造方法
针对高分子化合物和交联性高分子化合物的制造方法,以上述式(sph-1)所示的化合物和(xlp-1)所示的化合物为例进行说明。这些化合物可适当组合公知的制造方法来合成。
作为反应中使用的溶剂,可列举出芳香族溶剂、饱和/不饱和烃溶剂、醇溶剂、醚系溶剂等,可列举出例如二甲氧基乙烷、2-(2-甲氧基乙氧基)乙烷、2-(2-乙氧基乙氧基)乙烷等。
此外,反应可以通过二相体系来进行。通过二相体系使其反应时,可根据需要而添加季铵盐等相转移催化剂。
制造式(sph-1)的化合物和(xlp-1)的化合物时,可以通过一个阶段来制造,也可以历经多个阶段来制造。此外,可以通过将原料全部投入至反应容器后再开始反应的一并聚合法来进行,也可以通过将原料滴加至反应容器来添加的滴加聚合法来进行,还可以通过产物随着反应的进行而沉淀的沉淀聚合法来进行,可以将它们适当组合来合成。例如,在通过一个阶段来合成式(sph-1)所示的化合物时,通过在将单体单元(mu)和封端单元(ec)添加至反应容器的状态下进行反应而得到目标物。此外,在通过多个阶段来合成通式(sph-1)所示的化合物时,通过将单体单元(mu)聚合至目标分子量后,添加封端单元(ec)使其反应而得到目标物。如果通过多个阶段添加不同种类的单体单元(mu)并进行反应,则能够制作针对单体单元的结构具有浓度梯度的聚合物。此外,可以在制备前体聚合物后,通过后反应来获得目标聚合物。
此外,如果选择单体单元(mu)的聚合性基团,则能够控制聚合物的一次结构。例如,如合成路线的1~3所示那样,能够合成具有无规的一次结构的聚合物(合成路线1)、具有规则的一次结构的聚合物(合成路线2和3)等,可根据目标物适当组合并使用。进而,如果使用具有3个以上聚合性基团的单体单元,则能够合成超支化聚合物、树状高分子(dendrimer)。
a、b=mu或mux
聚合性基团=x、y(x与y分别键合)
1)使用两种单体(x-a-y)和(x-b-y)而合成的聚合物
2)使用两种单体(x-a-x)和(y-b-y)而合成的聚合物
3)使用两种单体(x-a-y)和(y-b-y)而合成的聚合物
作为本发明中可使用的单体单元,可按照日本特开2010-189630号公报、国际公报第2012/086671号、国际公开第2013/191088号、国际公开第2002/045184号、国际公开第2011/049241号、国际公开第2013/146806号、国际公开第2005/049546号、国际公开第2015/145871号、日本特开2010-215886号、日本特开2008-106241号公报、日本特开2010-215886号公报、国际公开第2016/031639号、日本特开2011-174062号公报、国际公开第2016/031639号、国际公开第2016/031639号、国际公开第2002/045184号中记载的方法来合成。
此外,针对具体的聚合物合成步骤,可按照日本特开2012-036388号公报、国际公开第2015/008851号、日本特开2012-36381号公报、日本特开2012-144722号公报、国际公开第2015/194448号、国际公开第2013/146806号、国际公开第2015/145871号、国际公开第2016/031639号、国际公开第2016/125560号、国际公开第2016/031639号、国际公开第2016/031639号、国际公开第2016/125560号、国际公开第2015/145871号、国际公开第2011/049241号、日本特开2012-144722号公报中记载的方法来合成。
2-10.有机电致发光元件的应用例
此外,本发明也可以应用于具备有机el元件的显示装置或具备有机el元件的照明装置等。具备有机el元件的显示装置或照明装置可通过将本实施方式的有机el元件与公知的驱动装置连接等公知的方法来制造,可以适当使用直流驱动、脉冲驱动、交流驱动等公知的驱动方法来驱动。
作为显示装置,可列举出例如彩色平板显示器等面板显示器、柔性彩色有机电致发光(el)显示器等柔性显示器等(例如参见日本特开平10-335066号公报、日本特开2003-321546号公报、日本特开2004-281086号公报等)。此外,作为显示器的显示方式,可列举出例如矩阵方式和区段方式中的至少一者等。需要说明的是,矩阵显示和区段显示可以在相同面板中共存。
在矩阵中,用于显示的像素二维地配置成格子状、马赛克状等,通过像素的集合来显示文字、图像。像素的形状、尺寸根据用途来确定。例如,在个人电脑、监测器、电视机的图像和文字显示中,通常使用单边为300μm以下的四边形的像素,此外,在显示面板那样的大型显示器的情况下,使用单边为mm数量级的像素。在单色显示的情况下,只要排列相同颜色的像素即可,在彩色显示的情况下,将红、绿、蓝的像素排列并进行显示。该情况下,典型而言,有三角类型和条纹类型。并且,作为该矩阵的驱动方法,可以是线依次驱动方法、有源矩阵中的任一者。线依次驱动具有结构简单的优点,但考虑到工作特性时,有源矩阵有时更优异,因此,其也需要根据用途来区分使用。
在区段方式(类型)中,以显示预先确定的信息的方式形成图案,并使已确定的区域发光。可列举出例如数字时钟、温度计中的时刻、温度显示;音响设备、电磁炉等的工作状态显示和汽车的面板显示等。
作为照明装置,可列举出例如室内照明等照明装置、液晶显示装置的背光等(例如参见日本特开2003-257621号公报、日本特开2003-277741号公报、日本特开2004-119211号公报等)。背光主要出于使不会自发光的显示装置的观看性提高的目的而使用,其用于液晶显示装置、钟表、音响装置、汽车面板、显示板和标识等。尤其是,作为液晶显示装置、尤其是薄型化成为课题的个人电脑用途的背光,若考虑到以往方式因由荧光灯、导光板构成而难以薄型化,则使用了本实施方式的发光元件的背光具有薄型且轻量的特征。
另外,当今,正在积极地研究将基于色转换方式的多彩化技术应用于液晶显示器、有机el显示器、照明等。色转换表示将来自发光体的发光转换(波长转换)成更长波长的光,例如将蓝色发光转换成绿色、红色发光。通过将具有该波长转换功能的组合物进行薄膜化,并与例如蓝色光源组合,能够从蓝色光源中取出蓝色、绿色、红色的三原色,即取出白色光。通过将组合有这种蓝色光源和具有波长转换功能的薄膜的白色光源作为光源单元,并将液晶驱动部分与彩色滤波器加以组合,能够制作全彩显示器。另外,如果没有液晶驱动部分,则可以直接用作白色光源,可用作例如led照明等的白色光源。此外,通过将蓝色有机el元件作为光源,并与转换成绿色和红色的薄膜组合使用,能够制作不使用金属掩膜的全彩有机el显示器。进而,通过将蓝色微型led作为光源,并与转换成绿色和红色的薄膜组合使用,能够制作低成本的全彩微型led显示器。
上述通式(1)所示的多环芳香族化合物作为通过激发光而提供色纯度高的蓝色发光或绿色发光的荧光材料是有用的,也可以用作具有这种波长转换功能的材料。具体而言,式(1)的多环芳香族化合物可用作例如将波长为300nm~449nm的光转换成在450nm~500nm具有极大值的半值宽度狭窄(25nm以下、进而为20nm以下)的蓝色发光的波长转换材料。此外,可用作例如将波长为300nm~499nm的光转换成在500nm~570nm具有极大值的半值宽度狭窄(25nm以下、进而20nm以下)的绿色发光的波长转换材料。
具有波长转换功能的组合物中,除了包含式(1)的多环芳香族化合物之外,也可以包含粘结剂树脂、其它添加剂和溶剂。作为粘结剂树脂,可以使用例如国际公开第2016/190283号的段落[0173]~[0176]中记载的树脂。作为其它添加剂,可以使用国际公开第2016/190283号的段落[0177]~[0181]中记载的化合物。此外,作为溶剂,只要使用可适当溶解这些材料的溶剂即可。
波长转换薄膜包含通过使具有波长转换功能的组合物发生固化而形成的波长转换层。作为由组合物制作波长转换层的方法,可以参照公知的薄膜形成方法。波长转换薄膜可以仅包含由包含式(1)的多环芳香族化合物的组合物形成的波长转换层,也可以包含其它波长转换层(例如将蓝色光转换成绿色光、红色光的波长转换层;将蓝色光、绿色光转换成红色光的波长转换层)。进而,波长转换薄膜还可以包含基材层、用于防止色转换层因氧、水分、热而劣化的阻隔层。
实施例
以下,通过实施例更具体地说明本发明,但本发明不限定于它们。换言之,本发明的有机el元件的构成不限定于作为以下的实施例而示出的构成,各层的膜厚、构成材料可根据本发明的基础物性进行适当变更。
吸收特性和发光特性的评价
前述样品的吸收光谱的测定使用紫外可见近红外分光光度计(株式会社岛津制作所、uv-2600)来进行。此外,前述样品的荧光光谱的测定使用分光荧光光度计(日立hi-tech公司制、f-7000)来进行。
对于荧光光谱的测定,在室温下利用适当的激发波长进行激发,测定光致发光。对于磷光光谱的测定,使用附带的冷却单元,在将前述样品浸渍于液态氮的状态(温度为77k)下进行测定。样品利用适当的激发波长进行激发,并测定光致发光。
此外,使用绝对pl量子收率测定装置(hamamatsuphotonics公司制、c9920-02g)来测定荧光量子收率(plqy)。
<有机el元件的评价>
评价项目和评价方法
作为评价项目,有驱动电压(v)、发光波长(nm)、cie色度(x,y)、外量子效率(%)、发光光谱的最大波长(nm)、半值宽度(nm)和衰减(roll-off)等。这些评价项目可以使用适当的发光亮度时的值。
发光元件的量子效率有内量子效率和外量子效率,内量子效率表示以电子(或空穴)的形式向发光元件的发光层中注入的外部能量纯粹被转化成光子的比例。另一方面,外量子效率基于该光子被释放至发光元件外部的量来计算,在发光层中产生的光子的一部分被发光元件的内部吸收或者持续被反射,不向发光元件的外部释放,因此,外量子效率与内量子效率相比变低。
光谱辐射亮度(发光光谱)和外量子效率的测定方法如下所示。通过使用advantest公司制的电压/电流发生器r6144来施加电压而使元件发光。使用topcon公司制的光谱辐射亮度计sr-3ar,从与发光面垂直的方向测定可见光区域的光谱辐射亮度。假设发光面为完全扩散面,通过测得的各波长成分的光谱辐射亮度的值除以波长能量并乘以π而得的数值是各波长中的光子数。接着,在所观测的全部波长区域中累计光子数,作为从元件释放的总光子数。将施加电流值除以基本电荷而得的数值作为向元件中注入的载流子数,从元件中释放的总光子数除以向元件中注入的载流子数而得的数值为外量子效率。此外,发光光谱的半值宽度作为以最大发光波长作为中心、其强度达到50%的上下的波长间的宽度来求出。
衰减是指对元件施加电压时,效率随着电压的施加而降低的现象,小是优选的。在tadf元件中,掺杂物或辅助掺杂物的tau(delay)大时,衰减变大,tau(delay)小时,衰减变小。作为衰减程度的比较和评价方法,可通过对任意两点的亮度或电流密度时的效率进行对比来评价。优选效率高且衰减也小。
衰减表示任意两个亮度之间的效率降低程度,例如,100cd/m2与1000cd/m2之间的衰减(ro)通过下式(xxxx)来求出。式中,eqe(100cd/m2)和eqe(1000cd/m2)分别表示100cd/m2和1000cd/m2时的外量子效率。
ro=1-(eqe(100cd/m2)/eqe(1000cd/m2))
(1)蒸镀型有机el元件
制作文献(adv.mater.2016,28,2777-2781)中示出的、具备可期待与热活化型延迟荧光用材料相符的高效率的元件构成的有机el元件。
以下的实施例和比较例中,制作构成a的有机el元件时,所使用的发光层之外的各层的形成材料如下所示。
示出表1中制作的有机el元件的各层的形成材料。
作为空穴注入层材料的“hi”为n,n’-二苯基-n,n’-二萘基-4,4’-二氨基联苯,作为空穴输送层材料的“ht”为4,4’,4”-三(n-咔唑基)三苯基胺,作为电子阻挡层材料的“eb”为1,3-双(n-咔唑基)苯,作为电子输送层材料的“et”为二苯基[4-(三苯基甲硅烷基)苯基]氧化膦。
以下示出化学结构。
<实施例1~9、比较例1~3>
制作将表1所示的形成材料和膜厚的各层层叠而成的有机el元件。
[表1]
此外,作为发光层的主体和掺杂物使用的化合物的结构如下所示。
<实施例1>
将通过溅射而成膜为200nm厚的ito研磨至50nm而得的26mm×28mm×0.7mm的玻璃基板(optoscience公司制)作为透明支承基板。将该透明支承基板固定于市售的蒸镀装置(长州产业公司制)的基板支架,安装分别装有hi、ht、eb、化合物(bo2-0220)、化合物(dabna2)、和et的钽制蒸镀用舟、分别装有lif和铝的氮化铝制蒸镀用舟。
在透明支承基板的ito膜上依次形成下述各层。将真空槽减压至5×10-4pa为止,首先,将hi加热并以膜厚达到40nm的方式进行蒸镀,接着,将ht加热并以膜厚达到15nm的方式进行蒸镀,分别形成空穴注入层和空穴输送层。接着,将eb加热并以膜厚达到15nm的方式进行蒸镀,形成电子阻挡层。接着,将化合物(bo2-0220)与化合物(dabna2)同时加热,并以膜厚达到20nm的方式进行蒸镀,形成发光层。以化合物(bo2-0220)与化合物(dabna2)的重量比达到99:1的方式调节蒸镀速度。接着,将et加热并以膜厚达到40nm的方式进行蒸镀,形成电子输送层。各层的蒸镀速度为0.01~1nm/秒。其后,将lif加热并以膜厚达到1nm的方式且以0.01~0.1nm/秒的蒸镀速度进行蒸镀,接着,将铝加热并以膜厚达到100nm的方式进行蒸镀,形成阴极,从而得到有机el元件。此时,以铝的蒸镀速度达到1~10nm/秒的方式进行调节。
将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为467nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为23.7%,能够获得高的量子效率。
<实施例2>
除了将主体变更为化合物(bo2-0511s)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为465nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为15.4%,能够获得高的量子效率。
<实施例3>
除了将主体变更为化合物(bo2-0264/0511s)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为465nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为14.2%,能够获得高的量子效率。
<比较例1>
除了将主体变更为化合物(emh1)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为465nm,观察到深蓝色发光。另一方面,100cd/m2发光时的外量子效率为10.8%,与实施例1~3相比效率低。
<实施例4>
除了将掺杂物变更为化合物(bd1)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为462nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为28.6%,能够获得高的量子效率。
<实施例5>
除了将主体变更为化合物(bo2-0220/0511s),且将掺杂物变更为化合物(bd1)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为461nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为22.4%,能够获得高的量子效率。
<比较例2>
除了将掺杂物变更为化合物(bd1)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为461nm,观察到深蓝色发光。另一方面,100cd/m2发光时的外量子效率为12.6%,与实施例4和5相比效率低。
<实施例6>
除了将主体变更为化合物(bo2-0220),且将掺杂物变更为化合物(bd2)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为34.0%,能够获得高的量子效率。
<实施例7>
除了将主体变更为化合物(bo2-0511s),且将掺杂物变更为化合物(bd2)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为28.0%,能够获得高的量子效率。
<实施例8>
除了将主体变更为化合物(bo2-0520s),且将掺杂物变更为化合物(bd2)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为29.2%,能够获得高的量子效率。
<实施例9>
除了将主体变更为化合物(bo2-0264/0511s),且将掺杂物变更为化合物(bd2)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为470nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为30.3%,能够获得高的量子效率。
<比较例3>
除了将主体变更为化合物(emh1),且将掺杂物变更为化合物(bd2)之外,利用与实施例1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为471nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为19.1%,与实施例6~9相比效率低。
<实施例10~14、比较例4~8>
制作将表2所示的形成材料和膜厚的各层层叠而成的有机el元件。
[表2]
此外,作为发光层的主体和掺杂物使用的化合物的结构如下所示。
<实施例10>
将通过溅射而成膜为200nm厚的ito研磨至50nm而得的26mm×28mm×0.7mm的玻璃基板(optoscience公司制)作为透明支承基板。将该透明支承基板固定于市售的蒸镀装置(长州产业公司制)的基板支架,安装分别装有hi、ht、eb、化合物(bo2-0511s)、化合物(bd3)和et的钽制蒸镀用舟、分别装有lif和铝的氮化铝制蒸镀用舟。
在透明支承基板的ito膜上依次形成下述各层。将真空槽减压至5×10-4pa,首先,将hi加热并以膜厚达到40nm的方式进行蒸镀,接着,将ht加热并以膜厚达到15nm的方式进行蒸镀,分别形成空穴注入层和空穴输送层。接着,将eb加热并以膜厚达到15nm的方式进行蒸镀,形成电子阻挡层。接着,将化合物(bo2-0511s)与bd3同时加热,并以膜厚20nm的方式进行蒸镀,形成发光层。以化合物(bo2-0511s)与化合物(bd3)的重量比达到99:1的方式调节蒸镀速度。接着,将et加热并以膜厚达到30nm的方式进行蒸镀,形成电子输送层。各层的蒸镀速度为0.01~1nm/秒。其后,将lif加热并以膜厚达到1nm的方式且以0.01~0.1nm/秒的蒸镀速度进行蒸镀,接着,将铝加热并以膜厚达到100nm的方式进行蒸镀,形成阴极,从而得到有机el元件。此时,以铝的蒸镀速度达到1~10nm/秒的方式进行调节。
将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为451nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为14.8%,能够获得高的量子效率。
<比较例4>
除了将主体变更为化合物(emh1)之外,利用与实施例10同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为452nm,观察到深蓝色发光。另一方面,100cd/m2发光时的外量子效率为8.1%,与实施例10相比效率低。
<实施例11>
除了将掺杂物变更为化合物(bd4)之外,利用与实施例10同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为461nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为19.5%,能够获得高的量子效率。
<比较例5>
除了将主体变更为化合物(emh1)之外,利用与实施例11同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为461nm,观察到深蓝色发光。另一方面,100cd/m2发光时的外量子效率为11.1%,与实施例11相比效率低。
<实施例12>
除了将掺杂物变更为化合物(bd5)之外,利用与实施例10同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为468nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为17.5%,能够获得高的量子效率。
<比较例6>
除了将主体变更为化合物(emh1)之外,利用与实施例12同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为468nm,观察到深蓝色发光。另一方面,100cd/m2发光时的外量子效率为11.4%,与实施例12相比效率低。
<实施例13>
除了将掺杂物变更为化合物(bd5)之外,利用与实施例10同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为489nm,观察到蓝色发光。此外,100cd/m2发光时的外量子效率为18.1%,能够获得高的量子效率。
<比较例7>
除了将主体变更为化合物(emh1)之外,利用与实施例13同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为490nm,观察到蓝色发光。另一方面,100cd/m2发光时的外量子效率为12.2%,与实施例13相比效率低。
<实施例14>
除了将掺杂物变更为化合物(bd7)之外,利用与实施例10同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光光谱的峰波长为468nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为11.6%,能够获得高的量子效率。
<比较例8>
除了将主体变更为化合物(emh1)之外,利用与实施例12同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定发光光谱的峰波长为468nm,观察到深蓝色发光,但发生劣化,因此在100cd/m2时不发光。
<实施例15~16、比较例9>
制作将表3所示的形成材料和膜厚的各层层叠而成的有机el元件。
[表3]
此外,作为发光层的主体和掺杂物使用的化合物的结构如下所示。
<实施例15>
将通过溅射而成膜为200nm厚的ito研磨至50nm而得的26mm×28mm×0.7mm的玻璃基板(optoscience公司制)作为透明支承基板。将该透明支承基板固定于市售的蒸镀装置(长州产业公司制)的基板支架,安装分别装有hi、ht、eb、化合物(bo2-0231)、化合物(bd2)、和et的钽制蒸镀用舟、分别装有lif和铝的氮化铝制蒸镀用舟。
在透明支承基板的ito膜上依次形成下述各层。将真空槽减压至5×10-4pa,首先,将hi加热并以膜厚达到40nm的方式进行蒸镀,接着,将ht加热并以膜厚达到15nm的方式进行蒸镀,分别形成空穴注入层和空穴输送层。接着,将eb加热并以膜厚达到15nm的方式进行蒸镀,形成电子阻挡层。接着,将化合物(bo2-0231)与化合物(bd2)同时加热,并以膜厚20nm的方式进行蒸镀,形成发光层。以化合物(bo2-0231)与化合物(bd2)的重量比达到99:1的方式调节蒸镀速度。接着,将et加热并以膜厚达到30nm的方式进行蒸镀,形成电子输送层。各层的蒸镀速度为0.01~1nm/秒。其后,将lif加热并以膜厚达到1nm的方式且以0.01~0.1nm/秒的蒸镀速度进行蒸镀,接着,将铝加热并以膜厚达到100nm的方式进行蒸镀,形成阴极,从而得到有机el元件。此时,以铝的蒸镀速度达到1~10nm/秒的方式进行调节。
将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为476nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为27.7%和24.5%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减也小至-11.6%。
<实施例16>
除了将主体变更为化合物(bo2-0431)之外,利用与实施例15同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为474nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为29.4%和25.3%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减也小至-14%。
<比较例9>
除了将主体变更为emh1之外,利用与实施例16同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为471nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为18.2%和12.7%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减大至-30%。
<实施例17~25、比较例10>
制作将表4所示的形成材料和膜厚的各层层叠而成的有机el元件。
[表4]
此外,作为发光层的主体和掺杂物、以及电子输送层的形成材料使用的化合物的结构如下所示。需要说明的是,作为除发光层和电子输送层之外的各层的形成材料使用的化合物的结构如上所述。
<实施例17>
将通过溅射而成膜为200nm厚的ito研磨至50nm而得的26mm×28mm×0.7mm的玻璃基板(optoscience公司制)作为透明支承基板。将该透明支承基板固定于市售的蒸镀装置(长州产业公司制)的基板支架,安装分别装有hi、ht、eb、化合物(bo2-0431)、化合物(bd2)、2czbn和bpy-tp2的钽制蒸镀用舟、分别装有lif和铝的氮化铝制蒸镀用舟。
在透明支承基板的ito膜上依次形成下述各层。将真空槽减压至5×10-4pa为止,首先,将hi加热并以膜厚达到40nm的方式进行蒸镀,接着,将ht加热并以膜厚达到15nm的方式进行蒸镀,分别形成空穴注入层和空穴输送层。接着,将eb加热并以膜厚达到15nm的方式进行蒸镀,形成电子阻挡层。接着,将化合物(bo2-0231)与化合物(bd2)同时加热,并以膜厚20nm的方式进行蒸镀,形成发光层。以化合物(bo2-0231)与化合物(bd2)的重量比达到99:1的方式调节蒸镀速度。接着,将2czbn加热并以膜厚达到10nm的方式进行蒸镀,形成电子输送层1。接着,将bpy-tp2加热并以膜厚达到20nm的方式进行蒸镀,形成电子输送层1。各层的蒸镀速度为0.01~1nm/秒。其后,将lif加热并以膜厚达到1nm的方式且以0.01~0.1nm/秒的蒸镀速度进行蒸镀,接着,将铝加热并以膜厚达到100nm的方式进行蒸镀,形成阴极,从而得到有机el元件。此时,以铝的蒸镀速度达到1~10nm/秒的方式进行调节。
将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为28.0%和25.1%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-10.4%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为83小时。
<实施例18>
除了将主体变更为化合物(bo2-0520)之外,利用与实施例17同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为28.6%和25.7%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-9.2%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为90小时。
<实施例19>
除了将主体变更为化合物(bo2-0220)之外,利用与实施例17同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为29.3%和26.6%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-10.1%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到cd/m2为止的时间(lt80)为30小时。
<实施例20>
除了将主体变更为化合物(bo2-0220-4)之外,利用与实施例17同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为24.3%和20.9%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-14.0%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为100小时。
<实施例21>
除了将主体变更为化合物(bo2-0431-1)之外,利用与实施例17同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为26.1%和23.5%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-10.0%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为90小时。
<实施例22>
除了将主体变更为化合物(bo2-0431-2)之外,利用与实施例17同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为26.3%和23.5%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-10.6%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为98小时。
<实施例23>
除了将主体变更为化合物(bo2-0220/0511s-1)之外,利用与实施例17同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为473nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为24.7%和21.1%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-14.6%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为67小时。
<实施例24>
除了将掺杂物变更为化合物(bd8)之外,利用与实施例18同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为470nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为24.6%和22.5%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-8.5%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为80小时。
<实施例25>
除了将掺杂物变更为化合物(bd9)之外,利用与实施例18同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为462nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为23.9%和21.0%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减小至-12.1%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为61小时。
<比较例10>
除了将主体变更为emh1之外,利用与实施例17同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定1000cd/m2发光时的特性时,发光光谱的峰波长为471nm,观察到深蓝色发光。此外,100cd/m2和1000cd/m2发光时的外量子效率为17.5%和10.9%,能够获得高的量子效率。并且,100cd/m2和1000cd/m2之间的衰减大至-38%。此外,以亮度为100cd/m2的电流值使其连续驱动时,至亮度达到80cd/m2为止的时间(lt80)为22小时。
接着,为了更详细地说明本发明,示出本发明的发光层形成用组合物的例的评价和使用了本发明的发光层形成用组合物的有机el元件的实施例,但本发明不限定于它们。
(2)发光层形成用组合物
<实施例s-1~实施例s-10和比较例s-1>
将表6中记载的第一成分的主体0.99质量%、第二成分的掺杂物0.01质量%和第三成分的溶剂99质量%混合,分别制备固体成分浓度为1质量%的发光层形成用组合物。
需要说明的是,这些制备的组合物之中,测定实施例s-9的发光层形成用组合物的粘度和表面张力时,粘度为3.5mpa·s,表面张力为36.3mn/m。
制备发光层形成用组合物时使用的表6中记载的主体和掺杂物的化合物的结构如下所示,溶剂如表5记载那样。
[表5]
针对所制备的发光层形成用组合物,进行以下的评价。它们的结果如表6所示。
<溶解性的评价>
通过确认所制备的发光层形成用组合物有无浑浊和沉淀来进行溶解性的评价。无浑浊和沉淀的组合物记作“a”,发生浑浊或沉淀的组合物记作“f”,评价溶解性。
<成膜性的评价>
针对溶解性的评价为“a”的发光层形成用组合物,观察按照下述操作进行旋涂成膜后或喷墨印刷后得到的膜,膜中存在针孔或析出或不均的膜记作“c”,将不存在针孔、化合物的析出和不均的膜记作“b”,将不存在针孔、化合物的析出和不均且平滑性高(ra<5nm)的膜记作“a”,评价成膜性。
(基于旋涂的成膜方法)
通过对厚度0.5mm、尺寸28×26mm的干净玻璃基板照射照射能量为1000mj/cm2(低压汞灯(254纳米))来进行uv-o3处理。接着,在玻璃上滴加0.3~0.6ml的发光层形成用组合物,进行旋涂(倾斜(以5秒钟提升至规定转速)→以500~5000rpm进行涂布(以规定转速维持10秒钟)→倾斜(以5秒钟降低转速,使转速为0rpm))。进而,在120℃的加热板上使其干燥10分钟来成膜。
(基于喷墨的成膜方法)
使用喷墨机,向100ppi的像素内喷出发光层形成用组合物,以100℃使其干燥来成膜。
<喷墨喷出稳定性的评价>
针对溶解性的评价为“a”的发光层形成用组合物,使用喷墨机,开始向100ppi的像素内喷出发光层形成用组合物,对刚刚开始喷出后和连续运转24小时后各自的喷墨的喷出稳定性进行评价。需要说明的是,在评价时,无法喷出的情况记作“c”,能够从不足九成的喷出孔中喷出的情况记作“b”,能够从九成以上的喷出孔中喷出的情况记作“a”。
[表6]
(3)涂布型有机el元件
接着,针对涂布形成有机层而得到的有机el元件进行说明。
<高分子空穴输送化合物:xlp-101的合成>
按照日本特开2018-61028号公报中记载的方法,如下那样地合成xlp-101。得到在m4的旁边键合有m5或m6的共聚物,根据投料比推测各单元为40:10:50(摩尔比)。需要说明的是,下述式中,bpin为频哪醇合硼基。
<实施例sd-1~实施例sd-3的有机el元件的制作>
将有机el元件中的各层的材料构成示于表7。
[表7]
关于表7中的作为空穴注入层的形成材料的“pedot:pss”,使用市售的pedot:pss溶液(clevios(tm)pvpai4083、下述式所示的pedot:pss的水分散液、heraeusholdings公司制)。
关于表7中的作为空穴输送层的形成材料的“otpd”,使下述式所示的otpd(lt-n159、luminescencetechnologycorp制)和ik-2(光阳离子聚合引发剂、sun-apro公司制)溶解于甲苯,制成otpd浓度为0.7质量%、ik-2浓度为0.007质量%的otpd溶液。
关于表7中的作为空穴输送层的形成材料的“xlp-101”,制成使作为上述高分子空穴输送化合物的xlp-101以0.6质量%的浓度溶解于二甲苯而得的xlp-101溶液。
作为表7中的“pcz”,使下述式所示的pcz(聚乙烯基咔唑)溶解于二氯苯,制成0.7质量%的pcz溶液。
表7中的“bo2-0431-2”、“bd2”、“2czbn”、“bpy-tp2”的化合物的结构如下所示。
<实施例sd-1>
在将ito蒸镀至50nm厚的玻璃基板上旋涂pedot:pss溶液,并在200℃的加热板上烧成1小时,由此成膜为膜厚40nm的pedot:pss膜(空穴注入层)。接着,旋涂otpd溶液,并在80℃的加热板上干燥10分钟后,用曝光机以100mj/cm2的曝光强度进行曝光,在100℃的加热板上烧成1小时,由此成膜为不溶于溶液的膜厚30nm的otpd膜(空穴输送层)。接着,旋涂实施例s-9中制备的发光层形成用组合物,在120℃的加热板上烧成1小时,由此成膜为膜厚20nm的发光层。
将所制作的多层膜固定于市售的蒸镀装置(昭和真空公司制)的基板支架,安装装有2czbn和bpy-tp2的钼制蒸镀用舟、装有lif的钼制蒸镀用舟、装有铝的钨制蒸镀用舟。将真空槽减压至5×10-4pa后,将2czbn加热并以膜厚达到10nm的方式进行蒸镀,形成电子输送层1。接着,将bpy-tp2加热并以膜厚达到20nm的方式进行蒸镀,形成电子输送层2。形成电子输送层时的蒸镀速度设为1nm/秒。其后,将lif加热并以膜厚达到1nm的方式且以0.01~0.1nm/秒的蒸镀速度进行蒸镀。接着,将铝加热并以膜厚达到100nm的方式进行蒸镀,形成阴极。如此操作而得到有机el元件。
将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光面均匀,发光光谱的峰波长为472nm、半值宽度为21nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为10.1%。
<实施例sd-2>
针对空穴输送层,通过旋涂xlp-101溶液并在200℃的加热板上烧成1小时而成膜为膜厚30nm的膜,除此之外,利用与实施例sd-1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光面均匀,发光光谱的峰波长为472nm、半值宽度为20nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为12.1%。
<实施例sd-3>
针对空穴输送层,通过旋涂pcz溶液并在120℃的加热板上烧成1小时而成膜为膜厚30nm的膜,除此之外,利用与实施例sd-1同样的步骤和构成来获得有机el元件。将ito电极作为阳极且将铝电极作为阴极,施加直流电压,测定100cd/m2发光时的特性时,发光面均匀,发光光谱的峰波长为472nm且半值宽度为20nm,观察到深蓝色发光。此外,100cd/m2发光时的外量子效率为11.5%。
实施例sd-1~sd-3中制作的涂布型有机el元件的外量子效率为10%以上,并且,观察到深蓝色且半值宽度狭窄的发光,颜色优异。
(4)高分子化合物
本发明的有机el元件可以制成具有包含高分子化合物、高分子交联体的发光层的构成。作为这种发光层中包含的高分子化合物,可列举出例如实施例ps-1中记载的高分子化合物。
<实施例ps-1>
通过国际专利公开号wo2019/004248中记载的方法,能够合成包含以下作为第一成分的主体以及作为第二成分的掺杂物和发光掺杂物的结构的高分子化合物。下述高分子化合物对第一成分和第二成分进行高分子化,具有源于各自的结构单元。
以上,针对本发明所述的化合物的一部分以及主体材料与掺杂材料的组合的一部分,进行作为有机el元件的发光层用材料的评价,示出了其有用性,但未进行评价的其它化合物、组合也是具有相同的基本骨架、基本性能,且作为整体也具有类似结构、类似特性的化合物,本领域技术人员能够理解由其它化合物、组合也可同样地获得优异的发光层用材料。
产业上的可利用性
根据本发明的优选方式,通过制成以往未具体知晓的、组合含有作为第一成分的主体的式(1)所示的多环芳香族化合物和作为第二成分的掺杂物的含硼的多环芳香族化合物的发光层,能够进一步提高发光特性等有机el特性。
附图标记说明
100有机电致发光元件
101基板
102阳极
103空穴注入层
104空穴输送层
105发光层
106电子输送层
107电子注入层
108阴极
- 还没有人留言评论。精彩留言会获得点赞!