借助导电水凝胶检测和影响生物活性物质的吸收和或释放的方法和材料与流程
借助导电水凝胶检测和影响生物活性物质的吸收和或释放的方法和材料
1.本发明涉及一种方法,用于影响和检测生物活性物质在水凝胶材料中的吸收和/或生物活性物质从所述水凝胶材料中的释放。本发明另外涉及一种适合用于执行所述方法的导电水凝胶。
2.基于水凝胶的物质释放体系和物质吸收体系对于在生物技术且尤其在医学中的应用而言是很有前途的,因为与许多其他生物材料相比水凝胶在其含水量和机械特性方面与人体生理组织相似并且可以实现各种物质的封装及其针对性的释放。根据定义,水凝胶是大幅度水合的、共价或物理交联的聚合物,这些聚合物允许物质经由各种非共价的相互作用可逆地键合至水凝胶网络的有亲和性的聚合物构造单元上并且由此针对性地从生物流体或活体组织中去除这些物质,也就是说将其封存在水凝胶中,或者从水凝胶中释放到生物流体或活体组织。此类物质可以为来自细胞因子、趋化因子、荷尔蒙、神经递质、生长因子类别的基于蛋白质的信号分子,或者非基于蛋白质的低分子有效成分,即所谓的小分子(英语small molecules),这些小分子承担上述基于蛋白质的信号分子的一种或多种生物功能,或者还有非基于蛋白质的化学/医学有效成分如抗微生物有效成分、防腐剂、色素,这些物质通过电荷相互作用和/或疏水相互作用或其他特定的化学相互作用如氢桥键而可逆地结合至水凝胶中的赋予亲和性的聚合物构造单元上。由现有技术已知如下的水凝胶体系,其中水凝胶的用于封存和/或释放某些物质的物化特性必须在形成时就已经固定下来。这通过水凝胶网络的特定电荷特征例如由wo 2018/162009 a2已知,或者通过针对性地设定物理特性如网眼宽度来实现。另外已知的是,通过酶触发物、光或变化的ph值使共价偶联的物质受控释放,其中此类水凝胶网络的缺点是不能进行可逆的物质键合。因此无法进行物质的受控封存以及由此从生物流体或组织周边削减物质。
3.在经由非共价相互作用可逆地实现了对物质的亲和性的已知体系中,亲和性以及由此对物质的封存或释放的控制由其固有的(也就是说在形成水凝胶网络时定下的)网络架构来决定。后续的调制只能通过先前所述的外部触发物光、ph值变化或酶切断来实现。
4.除了固有带电的水凝胶之外,在生物医学研究中还描述了导电水凝胶。这些导电水凝胶主要用作电极材料的涂层,例如用于神经电极,以便优化其生物相容性和电荷注入。由于其与组织和器官的机械相似性,与使用金属电极相比,使用软性的经水合的聚合物材料产生较小的排异反应。另外,在经典的金属电极的情况下,对于刺激组织和器官而言关键的电荷注入只能在电极表面处发生。人们试图通过纳米结构化增大表面并由此增大电极与组织液(生物流体)之间的接触面积,其结果是增大的电荷注入。因为在导电水凝胶的情况下生物流体可以渗入到材料的整个体积中,所以在没有进一步结构化的情况下接触面积已经明显大于具有类似尺寸的金属电极的情况。这同样产生了明显提高的电荷注入。作为用于能够将电荷传导到生理溶液中的措施,在文献中使用了术语电荷存储容量(英文charge storage capacity)。
5.为了制备此类导电水凝胶,使用了导电物质如碳纳米管和/或导电聚合物,其中大多数情况下将导电物质分布在水凝胶前体溶液中并且随后通过在与导电物质无关的另一
种组分中聚合和交联形成水凝胶。在此,作为综合性的特性要提及的是,导电组分大多是疏水的并且因此不形成水凝胶。
6.由于其多种多样的应用可能性及其简单且成本有利的加工,导电有机聚合物越来越多地用在工业应用中。这些聚合物按照半导体原理来工作。最重要的组成部分是穿过整个聚合物骨架延伸的共轭π电子体系。这些聚合物的固有的电导率是较低的。为了产生游离的载流子以便提高分子的电导率,需要从聚合物体系中去除电子(p掺杂)或者向聚合物体系中引入电子(n掺杂)的带电分子。这个过程被称为初级掺杂。大多数情况下使用的方法是p掺杂。掺杂和由此产生的疏水聚合物与强带电的亲水分子的相互作用额外地降低了聚合物-掺杂物-复合体的疏水性并且由此允许将这些聚合物用在水溶液或水凝胶中。
7.除了初级掺杂之外,导电聚合物链相对彼此的排列方式也具有决定性意义。为了在较长的路程上传输载流子,必须在导电聚合物链之间转移载流子。为此,在空间上彼此接近的同时,聚合物链在体积中需要均匀分布。导电聚合物和相应掺杂用的分子的水溶液大多形成悬浮液。由于导电聚合物链彼此缺少相互作用,造成了较低的电导率。通过导电聚合物链相对彼此的结构上的重新组织(次级掺杂)可以实现聚合物链相对彼此所需的空间上的接近度并且由此进一步提高电导率。这例如可以通过提高离子浓度以及与之相关的电荷屏蔽效应(通过debye长度来表征)来实现。
8.关于导电的聚-3,4-亚乙基二氧噻吩(pedot)的例子由zhenan bao及其他作者进行了说明(doi:10.1038/s41467-018-05222-4和us20190390068a1)。如从这篇文献中已知的,由亲水的聚磺苯乙烯(pss)和pedot(初级掺杂)的混合物通过物理缠绕pss并且在使用离子液体(次级掺杂)的情况下首先形成弱交联的水凝胶,随后通过形成用丙烯酸酯单体的自由基交联反应形成的伪互穿(pseudo-interpenetrierendes)网络在机械上稳定水凝胶。在聚合之后产生了导电水凝胶网络(10.1038/s41467-018-05222-4和us20190390068a1),其中次级聚合物网络仅仅用于稳定和改善材料的机械特性。水凝胶的电特性仅仅得自于初级的非共价的pedot:pss水凝胶。
9.从us 9 299 476 b2中已知获得导电水凝胶的另一种方法。从us 9 299 476 b2中已知的方法的结果是基于生物聚合物的水凝胶网络,该水凝胶网络带有阴离子官能团、形成并沉积在电极的表面上。将如此获得的初级网络在包含3,4-亚乙基二氧噻吩(edot)单体的溶液中溶胀或转移到其中,并且通过影响电压来触发edot单体到聚-3,4-亚乙基二氧噻吩(pedot)的电聚合。通过pedot与初级网络的阴离子官能团的离子相互作用产生了伪互穿的聚合物网络。这些阴离子基团同时以p掺杂的方式作用于pedot(初级掺杂)并且组合地产生导电水凝胶材料。基于共价键合在水凝胶中的阴离子基团的预定的分布以及pedot围绕初级水凝胶网络的后续聚合,由于pedot聚合物链的均匀分布,在没有次级掺杂的情况下就已经可以获得具有高电导率的水凝胶。
10.此前已知的水凝胶材料可以通过固有确定的物化特征实现对物质的封存和/或释放,或者在导电水凝胶材料的情况下显示出对于与某些生物活性物质的相互作用而言有限的可调制性和特异性。
11.本发明的目的是提出一种方法,利用所述方法可以影响并确定生物活性物质在水凝胶材料中或在水凝胶材料的环境中的浓度。本发明的目的还有提供一种导电水凝胶,所述导电水凝胶在其电学特性和物化特性方面是可调制化的并且可以实现尤其载有带正电
基团的物质的可逆封存和/或释放。同时,利用这种材料应可以通过所造成的电学特性的特征性变化来检测物质的键合。
12.这个目的通过具有权利要求1所述特征的方法以及具有权利要求7所述特征的导电水凝胶材料来实现。改进方案分别在从属权利要求中给出。所述导电水凝胶材料的用途在权利要求19至22中给出。
13.本发明包括一种方法,用于检测和影响生物活性物质在水凝胶材料中的吸收和/或生物活性物质从所述水凝胶材料中的释放,其中根据定义所述水凝胶材料为由带阴离子电性的构造单元和不带电的构造单元形成的聚合物网络,能够借助限定所述带阴离子电性的构造单元的参数来配置所述聚合物网络对于生物活性物质的亲和性,并且所述水凝胶材料具有导电组分,所述导电组分的电阻和电荷储存容量取决于与水凝胶构造单元的相互作用以及生物活性物质在所述水凝胶材料上的键合,其中所述导电组分适合于通过影响电势来改变所述水凝胶材料的阴离子电荷及其对于生物活性物质的亲和性。在所述方法中使以上定义的水凝胶材料与生物流体进行接触,其中检测所述水凝胶材料的电阻的变化和/或电荷储存容量的变化并且借助所检测的电阻的变化和/或电荷储存容量的变化来得知生物活性物质向所述水凝胶材料中的吸收或者生物活性物质从所述水凝胶材料向所述生物流体中的释放,和/或其中通过作用于所述水凝胶材料的电势来影响所述生物流体中生物活性物质的浓度和/或所述水凝胶材料中生物活性物质的浓度。
14.由带阴离子电性的构造单元和不带电的构造单元形成的聚合物网络是带阴离子电性的聚合物网络。可以借助限定带阴离子电性的构造单元来配置带阴离子电性的聚合物网络。
15.为了简单起见,下文将根据定义导电的水凝胶材料称为水凝胶材料。
16.在本发明的意义上,将生理溶液、细胞培养物和活体组织理解为生物流体。因此,水凝胶材料与生物流体的接触的处理指示可以理解为通过浸入生理溶液进行接触或者理解为水凝胶材料与活体组织在体内和体外的表面接触。
17.在本发明的意义上,将基于蛋白质或非基于蛋白质的生物活性物质、有效成分以及具有细胞因子、趋化因子、荷尔蒙、神经递质、生长因子的信号特性并且产生其他生物作用的小分子理解为生物活性物质。生物活性物质尤其可以为药学有效成分。对于先前提及的生物活性物质而言,作为综合特征适用的是小于等于70kda的分子量。
18.本发明的方法包括检测生物活性物质在水凝胶材料中的吸收和/或生物活性物质从所述水凝胶材料中的释放,以及影响生物活性物质在水凝胶材料中的吸收和/或生物活性物质从所述水凝胶材料中的释放。由此可以进行对生物活性物质的检测和影响或者——根据替代方案——对生物活性物质的检测或影响。
19.为了检测生物活性物质在水凝胶材料中的吸收和/或生物活性物质从水凝胶材料中的释放而检测水凝胶材料的电阻的变化和/或水凝胶材料的电荷容量变化,是以以下认识为基础,即水凝胶材料的电阻的变化和/或水凝胶材料的电荷容量变化受生物活性物质在水凝胶材料上的键合影响。于是,水凝胶材料的电阻因为封存和键合到水凝胶材料上或其中而升高,其中水凝胶材料的电导率由于用生物活性物质负载阴离子基团而降低。反过来说,当生物活性物质从水凝胶材料中或其上脱离时,水凝胶材料的电阻减小,其中水凝胶材料的电导率升高。
20.电荷存储容量的计算借助循环伏安法测量来进行。为此,在3电极结构中测量工作电极(水凝胶材料)与对电极(碳电极)之间的电流,而在5个循环流程中将所施加的电势从-0.6改变至0.8v(工作电极与ag/agcl参比电极之间的电势)。扫描速率为50mv/s。随后将曲线下方的面积的负的部分积分(multitrace 4.3,palmsens 4)并从中用下式计算电荷存储容量:
[0021][0022]
软件将以[a]*[v]为单位的数值i*u作为积分输出。在此有[a]=[c/s]。通过对扫描速率[v/s]做除法得到通过材料转移的电荷[c]。随后将其除以体积,因为与周围介质的界面涉及水凝胶的整个体积并且由此不能计算表面积/接触面积。
[0023]
为了检测生物活性物质在水凝胶材料中的吸收和/或生物活性物质从水凝胶材料中的释放,替代地可以确定水凝胶材料的电导率的变化,其中借助电导率的变化来得知生物活性物质在水凝胶材料中的吸收和/或生物活性物质从水凝胶材料中的释放。生物活性物质在导电水凝胶材料中的键合通过生物活性物质与水凝胶材料的聚合物链的非共价相互作用来进行。在此尤其离子相互作用扮演重要角色。通过键合的生物活性物质的阴离子和阳离子基团与水凝胶材料的带有阴离子基团的聚合物网络以及与阳离子型的导电聚合物的相互作用,导电聚合物的掺杂发生变化。键合的物质中的阴离子基团在此可以有助于掺杂并且提高电导率。相反,阳离子基团补偿了阴离子型聚合物组分的负电荷并且由此对掺杂具有不利影响。另外,生物活性物质的疏水区域可能影响pedot聚合物链彼此的相互作用。由此,取决于所键合的生物活性物质的分子类型以及生物活性物质的浓度,水凝胶材料的电学特性发生特定变化。
[0024]
生物活性物质的吸收和/或释放可以理解为生物活性物质在水凝胶材料中的浓度变化。另外可以提出,将离散的电导率值、离散的电阻值或离散的电荷存储容量值与生物活性物质的离散的浓度相关联。
[0025]
可以作为直流电阻或作为阻抗来得知水凝胶材料的电阻。对于阻抗检测可以预设0.01hz至1mhz的频率范围。可以提出,为了检测生物活性物质在所述水凝胶上或其中的键合,至少在0.1hz至1mhz范围内的频率下测量所述水凝胶材料的阻抗变化。在此还可以考虑到电荷存储容量的变化。
[0026]
为了影响生物流体中生物活性物质的浓度和/或水凝胶材料中生物活性物质的浓度,对水凝胶材料施加电势。通过影响水凝胶材料上的电势,水凝胶材料的阴离子电荷及其对生物活性物质的亲和性被改变,使得由于电势变化,生物活性物质在水凝胶材料中或其上的键合受到影响。
[0027]
从水凝胶材料中释放生物活性物质的前提条件是,在与生物流体接触之前已将生物活性物质键合到水凝胶材料上或其中。因此可以提出,为了释放生物活性物质,在与生物流体接触之前用预定浓度的预定的生物活性物质以电学或化学方式加载水凝胶材料。
[0028]
根据本发明方法的一个实施变体提出,能够借助至少三个限定所述带阴离子电性的构造单元的参数将所述聚合物网络在其组成方面进行配置,所述参数选自参数p0、p1、p2、p3的组,其中参数p0为对应于由在生理条件下溶胀的水凝胶材料的每体积单位的经电离阴离子基团数量得出的值,假定所有阴离子基团的30%发生电离,参数p1为对应于由在
生理条件下溶胀的水凝胶材料的每体积单位的具有小于2.5的固有pks值的强阴离子基团数量得出的值,参数p2为对应于由每个重复单元的具有小于2.5的固有pks值的强阴离子基团数量除以所述重复单元的分子量得出的值,并且参数p3对应于用于描述所述阴离子型构造单元的两亲性的值,其中所述水凝胶材料的电阻和/或电荷储存容量由所述水凝胶材料的参数配置的参数值预定。参数值的具体定义及其测定可以在说明书中再下文中得知。
[0029]
生物活性物质的相互作用还可以基于物质特异的值pp,所述值由生物活性物质的净电荷与生物活性物质的水可接近的表面积之比来计算。对于基于蛋白质的物质,在蛋白质数据库(pdb,http://www.rcsb.org/)中可以获得任意的蛋白质结构。所选的蛋白质结构的净电荷用delphi万维网服务器(http://compbio.clemson.edu/sapp/delphi_webserver/)用在ph 7下的标准设定来计算。溶剂水可接近的蛋白质表面积在使用的水溶剂半径下用pymol软件(www.pymol.org)计算。然后,由净电荷除以溶剂水可接近的蛋白质表面积乘以系数1000000来计算pp,以获得单位10-6
x[1/a
2 bzw.a-2
]。对于非基于蛋白质的物质,计算可以由化学结构推导出的、与阴离子基团或阳离子基团的过量相对应的净电荷以及溶剂水可接近的分子表面积,该分子表面积与参数p3的形成流程类似地通过使用chemdraw19.0和chemaxon marvinsketch 19.21软件推导出。将所获得的值乘以1000000的系数,以获得单位10-6
x[1/a
2 bzw.a-2
]。
[0030]
水凝胶材料的负载,即将水凝胶材料中或其上的生物活性物质的预定浓度固定化,可以以不同方式进行。根据第一方法,还可以将其称为第一负载方法,将预定浓度的被设置用于键合的一种或多种生物活性物质与带阴离子电性的水凝胶构造单元混合并且同时整合到聚合物网络中。然后,在后续通过结合导电组分来形成导电的水凝胶材料时,生物活性物质已经按照预定的浓度被包含在聚合物网络中。在这种方式中有利的是,在形成聚合物网络之后,这种或这些生物活性物质的总量已被定量地包含在水凝胶材料中。换言之,这种或这些生物活性材料的负载与参数p0、p1、p2、p3无关并且与物质特异的值pp无关地进行。在形成水凝胶物质时占主导的反应条件可能对生物活性物质的结构具有不利影响,因此不是所有的生物活性物质都适合于根据第一负载方法的固定化。
[0031]
根据第二方法,还可以被称为第二负载方法,以预定的参数配置和预定的参数值形成导电水凝胶材料并且随后将导电水凝胶材料与作为负载溶液的具有预定物质浓度的水溶液或生物流体接触预定的时间段。在此,取决于参数p0、p1、p2、p3将处于溶液中的生物活性物质从水溶液或生物流体中吸收并键合到水凝胶材料中。随后将经负载的水凝胶材料从负载溶液中移除。然后,可以通过影响电势将在水凝胶材料上或其中固定化的生物活性物质释放到周围环境、优选生物流体或活体组织。在此,通过影响电势进一步存在以下可能性,即将生物活性物质从水凝胶材料的周围环境封存到水凝胶材料中。
[0032]
根据用于负载的第三方法,还被称为第三负载方法,将具有带有预定参数值的预定参数配置的预定导电水凝胶材料与具有预定物质浓度的作为负载溶液的水溶液或生物流体接触预定的时间段并且同时暴露于对电势的影响。在此,取决于预定的参数值将生物活性物质从负载溶液中吸收(封存)到水凝胶材料中。可能需要的是,必须维持作用于水凝胶材料上的电势,以便使生物活性物质的键合保持恒定。否则,当电势或电流改变时,生物活性物质可能从水凝胶材料中释放。在此重要的是,生物活性物质的封存或释放除了受电势的影响之外还基于由参数p0、p1、p2、p3、pp预定的、水凝胶材料对某些生物活性物质的亲
和性。
[0033]
已经显示出,影响水凝胶材料的电导率的、导电组分在水凝胶材料中的结构形成和分布可能受参数配置的参数值影响。因此可以提出,预定如下的水凝胶材料,所述水凝胶材料基于具有预定参数值的预定参数配置而具有预定的电导率。
[0034]
在此方法中可以进一步提出,为了吸收生物活性物质,对所述水凝胶材料加载1mv至1000mv范围内、优选400mv至600mv范围内的电势(针对ag/agcl参比电极)。为了释放生物活性物质,可以对所述水凝胶材料加载-1mv至-1000mv范围内、优选-400mv至-600mv范围内的电势(针对ag/agcl参比电极)。
[0035]
为了吸收生物活性物质,可以对所述水凝胶材料加载大于0ma的恒定电流,其中改变所述电流流动方向以释放生物活性物质。
[0036]
本发明进一步包括一种适合用于执行上述方法的导电水凝胶。本发明的水凝胶材料具有由带阴离子电性的构造单元和不带电的构造单元形成的聚合物网络或者由此类聚合物网络组成,能够借助限定所述带阴离子电性的构造单元的至少三个参数将所述聚合物网络在其组成方面进行配置,所述参数选自参数p0、p1、p2、p3的组,其中参数p0为对应于由在生理条件下溶胀的水凝胶材料的每体积单位的经电离阴离子基团数量得出的值,假定所有阴离子基团的30%发生电离,参数p1为对应于由在生理条件下溶胀的水凝胶材料的每体积单位的具有小于2.5的固有pks值的强阴离子基团数量得出的值,参数p2为对应于由每个重复单元的具有小于2.5的固有pks值的强阴离子基团数量除以所述重复单元的分子量得出的值,并且参数p3对应于用于描述所述阴离子型构造单元的两亲性的值。水凝胶材料还具有结合到聚合物网络中的导电组分,其中所述水凝胶材料的电导率、电阻和/或电荷储存容量能够由所述水凝胶材料的参数配置的参数值预定。
[0037]
借助以下确定和形成流程来详细限定参数p0至p3:
[0038]
参数p0:可以以μmol/ml给出的p0的值对应于相对于在生理条件(0.154mmol/l nacl,ph被缓冲到7.4)下溶胀的水凝胶体积的阴离子基团的总数的30%。例如可以由在生理溶液中溶胀情况下水凝胶构造单元的聚合物浓度来进行计算。
[0039]
参数p1:可以以μmol/ml给出的p1的值对应于相对于在生理条件(0.154mmol/l nacl,ph被缓冲到7.4)下溶胀的水凝胶体积的具有小于2.5的pks值的强阴离子基团的数量。
[0040]
参数p2:可以以mmol/(g/mol)给出的p2的值对应于每个带阴离子电性的构造单元的具有小于2.5的pks值的强阴离子基团的数量除以阴离子型构造单元的相应的分子量。
[0041]
参数p3:描述阴离子型构造单元的两亲性的参数p3通过将阴离子型构造单元的辛醇/水分配系数(logp值)除以阴离子型构造单元的溶剂水可接近的表面积来计算。这可以借助于软件chemdraw19.0和chemaxon marvinsketch 19.21如下进行:在使用软件chemdraw19.0的情况下,将具有22个碳原子的聚合物骨架长度的每一个阴离子型构造单元或者在基于糖的结构的情况下具有总共2个二糖单元的每一个阴离子型构造单元作为完整的化学结构进行绘制。随后,通过使用软件应用chemaxon marvinsketch 19.21,通过读取由chemdraw19.0绘制的结构式来计算辛烷/水分配系数(logp值),并且用的溶剂半径来计算溶剂水可接近的表面积。将所获得的值乘以1000的系数,以获得单位10-3
x[1/a
2 bzw.a-2
]。
[0042]
本发明的水凝胶材料是用于执行本发明方法的重要的组成部分。本发明的水凝胶所涉及的特征因此可以用于详细解说本发明的方法、尤其用于限定水凝胶材料,反之亦然。本发明的水凝胶材料基于带有阴离子基团的聚合物网络,所述聚合物网络在其特性方面由参数p0、p1、p2、p3限定。借助这些参数p0至p3来控制由导电组分形成(伪)互穿网络并由此控制形成的导电水凝胶材料的电学特性。有利地,可以通过施加电势或通过影响电势以连续变换的方式在导电水凝胶材料的电荷特性方面对其进行调制,其中与参数p0、p1、p2、p3相关地调制电荷特性控制了导电水凝胶材料与生物活性物质的亲和性并且由此能够连续变化地、可逆地且实时地直接取决于所施加的电势来调节从与导电水凝胶接触的生物流体中消减物质(封存)或者从水凝胶材料向生物流体中释放生物有效物质。
[0043]
通过使用各种带有阴离子基团的带电构造单元以及其在水凝胶材料中的浓度的变化和强阴离子基团沿着不带电构造单元的聚合物链的数量和密度的变化,根据参数p0-p3可以合成具有相同交联度和固体含量的不同配置的水凝胶材料。为了产生导电的水凝胶材料,作为导电组分,优选将聚合物pedot作为伪互穿网络围绕初级水凝胶网络化学聚合。取决于所配置的参数或参数值及其构型,所获得的水凝胶材料在其电学特性以及对生物活性物质的封存和释放方面有所不同。
[0044]
与参数p1相比,与固有pka无关地描述在溶胀的水凝胶中的所有实际电离的阴离子基团的参数p0在此对所获得的水凝胶材料的电学特性施加略微较低的影响。在参数p0中包含的弱阴离子基团不是对pedot的有效掺杂,由此与描述具有pka《2.5的强酸性基团的参数p1相比影响了电导率或电阻。相反,带强负电的阴离子基团的整体数量(p1)直接影响电导率或电阻。在完全未掺杂的水凝胶材料中(p1=0)或没有导电组分的情况下实现了最小的电导率。水凝胶材料中的带强电的阴离子基团的数量越大,电导率越高并且电阻越小。原因在于由于对pedot的p掺杂产生游离的载流子。掺杂用的单元的数量越大,就可以形成越多的游离的载流子。对于强阴离子基团的局部电荷密度(p2)而言,同样可以预期对电学特性的直接影响。在p0和p1保持不变的情况下减小局部电荷密度导致水凝胶材料的电导率降低。原因在于带负电的聚合物与带正电的pedot聚合物链的局部静电相互作用。过低的局部负电荷导致带正电的pedot聚合物链与阴离子型聚合物或带阴离子电性的构造单元的较弱的相互作用。由此使得掺杂变难,这导致较低的电导率。由此,即使在中等的p1值和过小的p2值的情况下,可能也无法观察到相对于未掺杂的水凝胶材料升高的电导率。通过参数p3,同样可以配置两亲性的阴离子型聚合物与疏水的导电聚合物(pedot)之间的相互作用。通过带阴离子电性的构造单元的提高的疏水度,在明显很小的p1值下已经可以产生提高的电导率。原因是疏水的pedot单元对带阴离子电性的构造单元上的疏水基团的高亲和性,这有利地影响掺杂。另外,疏水基团在pedot合成期间已经使得单体单元(edot)向聚合物网络中的更好的渗入更容易并且由此使得pedot链的更好的插入更容易。
[0045]
对于取决于电压或取决于电流的物质封存和释放而言,在整个水凝胶材料中在所施加的不同的电压/电流下主要是整体(p0或p1)和局部电荷密度(p2)起作用。在没有施加电压的情况下,pedot的正电荷补偿了带阴离子电性的构造单元的负电荷的一部分。由此,与由没有导电组分的聚合物网络组成的水凝胶材料相比,还可以在更大程度上键合带负电的分子。取决于生物活性物质对阴离子型聚合物(也就是说对带阴离子电性的构造单元)的亲和性,带正电的生物活性物质的键合同样是可能的。通过配置参数p0、p1、p2、p3可以在恒
定的pedot聚合条件下设定pedot的正电荷与带电的构造单元的阴离子基团之比。由此可以实现对带正电或负电的生物活性物质的封存(吸收)。通过施加电压,另外可以将pedot的电荷设定为中性至每个单体单元66%正电荷。由此可以另外连续变化地设定键合。所键合的生物活性物质的释放同样可以取决于聚合物网络的所配置的参数p0、p1、p2、p3结合pedot(即导电组分)的电荷来设定。另外,还可以通过施加电压或电流来设定pedot的电荷而进行连续变化的配置。由此可以连续变化地设定各种带电生物活性物质的减少或增多的释放。
[0046]
带阴离子电性的构造单元可以选自包含以下项的组:聚(丙烯酸-共-4-丙烯酰胺基甲基苯磺酸),聚(丙烯酸-共-丙烯酰胺基乙烷磺酸),聚(丙烯酸-共-丙烯酰胺基乙烷硫酸氢盐),聚(4-苯乙烯磺酸-共-马来酸),硫酸化的糖胺聚糖、尤其肝素,选择性去硫酸化的肝素衍生物,硫酸乙酰肝素,硫酸软骨素,硫酸角质素和硫酸皮肤素。不带电的构造单元可以为包含氨基或硫醇基的聚合物或带有至少两个氨基或硫醇基的交联剂分子,其中所述带阴离子电性的构造单元和不带电的构造单元被交联到所述聚合物网络,能够通过以下方式进行:用edc/磺基nhs活化聚(丙烯酸-共-4-丙烯酰胺基甲基苯磺酸)和/或聚(丙烯酸-共-丙烯酰胺基乙烷磺酸)和/或聚(丙烯酸-共-丙烯酰胺基乙烷硫酸氢盐)和/或聚(4-苯乙烯磺酸-共-马来酸)和/或硫酸化的糖胺聚糖、尤其肝素和/或选择性去硫酸化的肝素衍生物和/或硫酸乙酰肝素和/或硫酸软骨素和/或硫酸角质素和/或硫酸皮肤素的羧基,并且与所述包含氨基的聚合物或所述带有至少两个氨基的交联剂分子分别在形成酰胺的情况下进行直接交联或借助于双官能交联剂分子将经活化的羧基官能化,所述双官能交联剂分子分别包含氨基和能进行迈克尔类加成的基团,并且随后与所述包含硫醇基的聚合物或所述带有至少两个硫醇基的交联剂分子分别通过迈克尔类加成进行交联。
[0047]
在0.01hz的频率下测量的本发明的水凝胶材料的电阻抗能够在150ω至10ω的范围内变化。优选地,参数配置的参数值优选被选择为实现优选30ω的电阻抗。当预定具有如下的参数p1、p2、p3的参数配置时实现了30ω的优选阻抗值:p1=110μmol/ml,p2=4.5mmol/(g/mol)并且p3=-5.9a-2
。当预定具有如下的参数p1、p2、p3的参数配置时实现了63ω的另外的有利的阻抗值:p1=12μmol/ml,p2=4.5mmol/(g/mol)并且p3=6.8a-2
。
[0048]
本发明的水凝胶材料的电荷储存容量能够在900mc/ml至4000mc/ml的范围内变化。优选地,参数配置的参数值被选择为实现3040mc/ml的电荷储存容量。当预定具有如下的参数p1、p2、p3的参数配置时实现了2480mc/ml的优选电荷存储容量:p1=110μmol/ml,p2=4.5mmol/(g/mol)并且p3=-5.9a-2
。当预定具有如下的参数p1、p2、p3的参数配置时实现了同样3040mc/ml的另外的有利的电荷存储容量:p1=12μmol/ml,p2=4.5mmol/(g/mol)并且p3=6.8a-2
。
[0049]
所述导电组分可以为π共轭的导电聚合物或由聚吡咯、聚苯胺、聚噻吩和/或聚(3,4-亚乙基二氧噻吩)(pedot)。
[0050]
根据本发明的导电水凝胶的一个改进方案可以提出,作为不带电的构造单元的包含氨基和硫醇基的聚合物选自以下类别:聚乙二醇(peg),聚(2-噁唑啉)(pox),聚乙烯基吡咯烷酮(pvp),聚乙烯醇(pva)和/或聚芳基酰胺(pam),并且所述包含氨基或硫醇基的交联剂分子为非聚合物型的双官能的交联剂分子。
[0051]
另外可以提出,使用具有共轭的能用酶切断的肽作为不带电的构造单元的聚合物用于形成聚合物网络,所述肽具有赖氨酸或半胱氨酸作为肽序列中的反应性氨基酸。能够
用酶切断的肽能够通过人类或细菌蛋白酶、尤其基mmp、组织蛋白酶、弹性蛋白酶、金黄色葡萄球菌金属蛋白酶(aureolysin)和/或凝血酶切断。
[0052]
根据本发明的导电水凝胶的另一个有利的改进方案可以提出,具有氨基或羧基的生物活性的和/或抗粘分子和/或对细胞有益的肽经由在所述带阴离子电性的构造单元聚(丙烯酸-共-4-丙烯酰胺基甲基苯磺酸)和/或聚(丙烯酸-共-丙烯酰胺基乙烷磺酸)和/或聚(丙烯酸-共-丙烯酰胺基乙烷硫酸氢盐)和/或聚(4-苯乙烯磺酸-共-马来酸)和/或硫酸化的糖胺聚糖如肝素和/或选择性去硫酸化的肝素衍生物和/或硫酸乙酰肝素和/或硫酸软骨素和/或硫酸角质素和/或硫酸皮肤素或其衍生物处的序列中的赖氨酸或半胱氨酸利用能够进行迈克尔类加成的基团在形成共价键的情况下结合至所述水凝胶网络。所述生物活性分子可以为抗微生物物质例如抗菌剂或防腐剂、或者药用有效成分。
[0053]
优选地,所述导电水凝胶材料预定由具有参数p0、p2、p3或参数p1、p2、p3的参数配置。这些参数值可以在预定的参数值范围内变化。参数p0的值可以预设在0至80μmol/ml范围内,参数p1的值可以预设在0至150μmol/ml范围内,参数p2的值可以预设0至10mmol/(g/mol)范围内,并且参数p3的值可以预设在-7x 10-3
至7x 10-3
a-2
范围内。
[0054]
本发明的水凝胶材料可以优选地具有0.2kpa至22kpa的存储模量。
[0055]
可以提出本发明的导电水凝胶材料的用途为用于体内的要素管理,以便在免疫疾病、癌症疾病、糖尿病、神经退化性疾病、克罗恩病、溃疡性结肠炎、多发性硬化、哮喘、类风湿性关节炎或皮肤伤口治疗以及骨再生的情况下控制血管生成。所述导电水凝胶材料的另一种用途或应用在于对细胞或组织的电刺激。
[0056]
另外,本发明的水凝胶材料可以用于从微生物来源或真核生物来源的细胞裂解产物中针对性地纯化蛋白质。
[0057]
此外,可以提出本发明的水凝胶材料的用途为用于诱导性多功能干细胞(ips)以及其他不属于ips的干细胞和前驱体细胞、从患者处获得的原发细胞、永生细胞系、以及心脏组织、肌肉组织、肾脏组织、肝脏组织和神经组织在体外的细胞培养和器官培养。
[0058]
本发明的核心是提供本发明的水凝胶,作为重要特征,所述水凝胶在生理条件(离子强度和ph值)下携带阴离子型(也就是说带负电的)基团。在此通过以下参数p0、p1、p2和p3来描述本发明的水凝胶材料的物化特性,尤其对于与物质的固有亲和性而言起决定作用的(阴离子型)电荷特征以及对于非离子型相互作用而言起决定作用的该阴离子基团的化学环境的特征。附加于已经描述的特性,通过影响电势还可以改变或影响本发明的水凝胶材料的物理特性如溶胀、刚度和网眼宽度。在此,共价键合的信号的存在可以在较宽的范围上并且大体上与参数p0-p3无关地被分级。
[0059]
为了制备本发明的水凝胶材料,使具有带有预定参数值的预定参数配置的预定的原声的聚合物网络在包含导电组分的溶液中溶胀,并且随后引发聚合或交联以形成导电的聚合物网络。原生的聚合物网络及其阴离子基团在此通过静电相互作用以掺杂方式作用于导电组分。根据本发明,所制备的水凝胶材料由一种或多种导电聚合物体系组成,这些聚合物体系通过物理相互作用与预定的原生的聚合物网络相互作用。出人意料地已经显示出,导电组分的结构和分布可以受参数p0-p3影响并且与之相关地受水凝胶材料的电阻、电导率和电荷存储容量等电学特性还有机械和物化特性影响。另外,通过影响电势(也就是说通过对导电组分施加电压)可以连续变化地、可逆地且实时地调制聚合物网络的电荷特性以
及由此调制对生物活性物质的亲和性。
[0060]
由通过借助于本发明的水凝胶材料对细胞的电刺激与释放或封存生物活性物质相组合产生的出人意料的影响得出了其他有利的特性。另外,通过对电流的调制还可以取决于参数p0至p3实时改变材料的机械特性。
[0061]
下面将借助于实施例详细阐释本发明的水凝胶材料的制备:
[0062]
为了将水凝胶材料在电学上功能化,将导电聚合物聚-3,4-亚乙基二氧噻吩(pedot)作为导电组分围绕预定的原生的聚合物网络进行聚合。为此,首先将整个经溶胀的聚合物网络在室温下在由溶解于1m hcl中0.4m过氧二硫酸铵(aps)组成的溶液中培养3小时。随后在室温下在矿物油中0.4m的3,4-亚乙基二氧噻吩(edot)中进行6小时的培养。在第二个培养步骤期间,进行pedot通过原生的聚合物网络的氧化性聚合。获得了sph-pedot,随后将其在矿物油、己烷和pbs中清洗。与pedot电极位置相比,由于所使用的方法而不需要电极。另外,可以使得任意体积实体导电。
[0063]
在氧化性聚合之后,pedot直接就具有固有的正电荷(参见10.1021/acs.jpcb.9b01745,10.1021/acsapm.8b00061)。通过pedot与水凝胶的带阴离子电性的构造单元之间的非共价相互作用以及各个pedot链之间的非共价相互作用(大多数情况下很可能是疏水相互作用),在带阴离子电性的聚合物网络与pedot之间形成了伪互穿的网络。同时,带阴离子电性的聚合物网络的负电荷用作对pedot的掺杂。取决于由参数p0或p1和p2限定的整体和局部的电荷密度,pedot的掺杂度有所变化。这对导电水凝胶材料的电学特性有直接影响。由于pedot为疏水聚合物,pedot链彼此的分布和交联严重依赖于周围环境的疏水度(由参数p3限定),这同样对水凝胶材料的电学特性有影响。
[0064]
除了释放带电的分子之后,还可以通过根据p1和p2以及疏水度p3的预定值来改变掺杂度而获得具有不同电学特性的导电水凝胶。通过高掺杂可以获得具有高电导率的水凝胶材料。这些材料可以用作生物相容的电极。由于与生物组织非常类似的水凝胶材料的机械特性,与经典的金属电极相比可以降低生物体针对sph-pedot电极的排异反应。另外,在经典的金属电极中用于电刺激的电荷传输仅仅在金属与组织(生理溶液)的接触面处发生。由于导电组分在水凝胶材料内部的分布和生理液体能够向水凝胶材料中扩散的可能性,在水凝胶材料的体积内部可以发生电荷转移。由此,有利地,对于相同的电荷注入需要较小的电压,其结果是较少的发热和因此保护组织。
[0065]
本发明的水凝胶材料可以与本发明的方法相组合地实现有效成分向生物流体或活体组织中的缓释。
[0066]
本发明设计的其他细节、特征和优点将从参照相关附图和表格对实施例的后续说明得出。在附图中:
[0067]
图1:用于阐释本发明水凝胶材料的示意图,
[0068]
图2:用于进一步阐释本发明的另一个示意图,
[0069]
图3:用于总览聚合物网络的带电和不带电的水凝胶构造单元的表1,
[0070]
图4:可得知作为水凝胶材料的前体的聚合物网络的组成和合成的表2,
[0071]
图5:以横截面展示导电的多孔和非多孔的水凝胶材料的视觉外观的图像,
[0072]
图6:可得知不同导电水凝胶材料的电学特性的表3,
[0073]
图7:可得知通过导电水凝胶材料键合生物活性物质的表4,
[0074]
图8:可得知在不同电势下通过导电水凝胶材料释放生物活性物质的表5,以及
[0075]
图9:可得知导电水凝胶材料相对于pc12细胞和与之不同的神经类细胞的生物相容性的表6。
[0076]
带阴离子电性的水凝胶构造单元在下文中简称为gb,其中载有不同阴离子的构造单元附加地用数字表征。水凝胶材料的不带电的构造单元简称为ugb,其中不同的不带电的构造单元用数字表征。出于简洁和节省空间的原因,在表中将水凝胶材料称为水凝胶。在表中将水凝胶材料类型称为水凝胶类型。
[0077]
图1示出用于阐释本发明的导电水凝胶材料1的示意图。图1的图像a示例性地示出由带阴离子电性的构造单元3和交联剂分子4合成聚合物网络2作为用于形成本发明水凝胶材料1的模板。关于聚合物网络2,预定了具有参数p1、p2和p3的参数配置。图像b示出了作为由聚合物网络2和导电组分5形成的伪互穿聚合物网络(ipn)的导电水凝胶材料1的构造。聚合物网络2带有阴离子基团并且由参数p1、p2和p3确定。导电水凝胶材料1通过聚合物网络2与导电组分5的聚合或交联产生。在图1的图像c中示例性地展示了导电组分5的掺杂。在此实施例中,导电组分5为pedot:通过与带阴离子电性的聚合物网络2中的硫酸根/磺酸基团的相互作用进行掺杂。对于与pedot 5的相互作用以及由此产生的导电水凝胶材料1的电学特性而言,聚合物网络2的整体电荷密度p1、局部电荷密度p2和聚合物网络2中携带阴离子基团的聚合物的疏水度p3起决定性作用。在图像d中示例性地展示了施加电势对导电水凝胶材料有哪些影响。通过影响电势可以连续变化地调节pedot的正电荷。在此从中性(0)经由带中等(+1)正电直至带强(+3)正电来进行调节。
[0078]
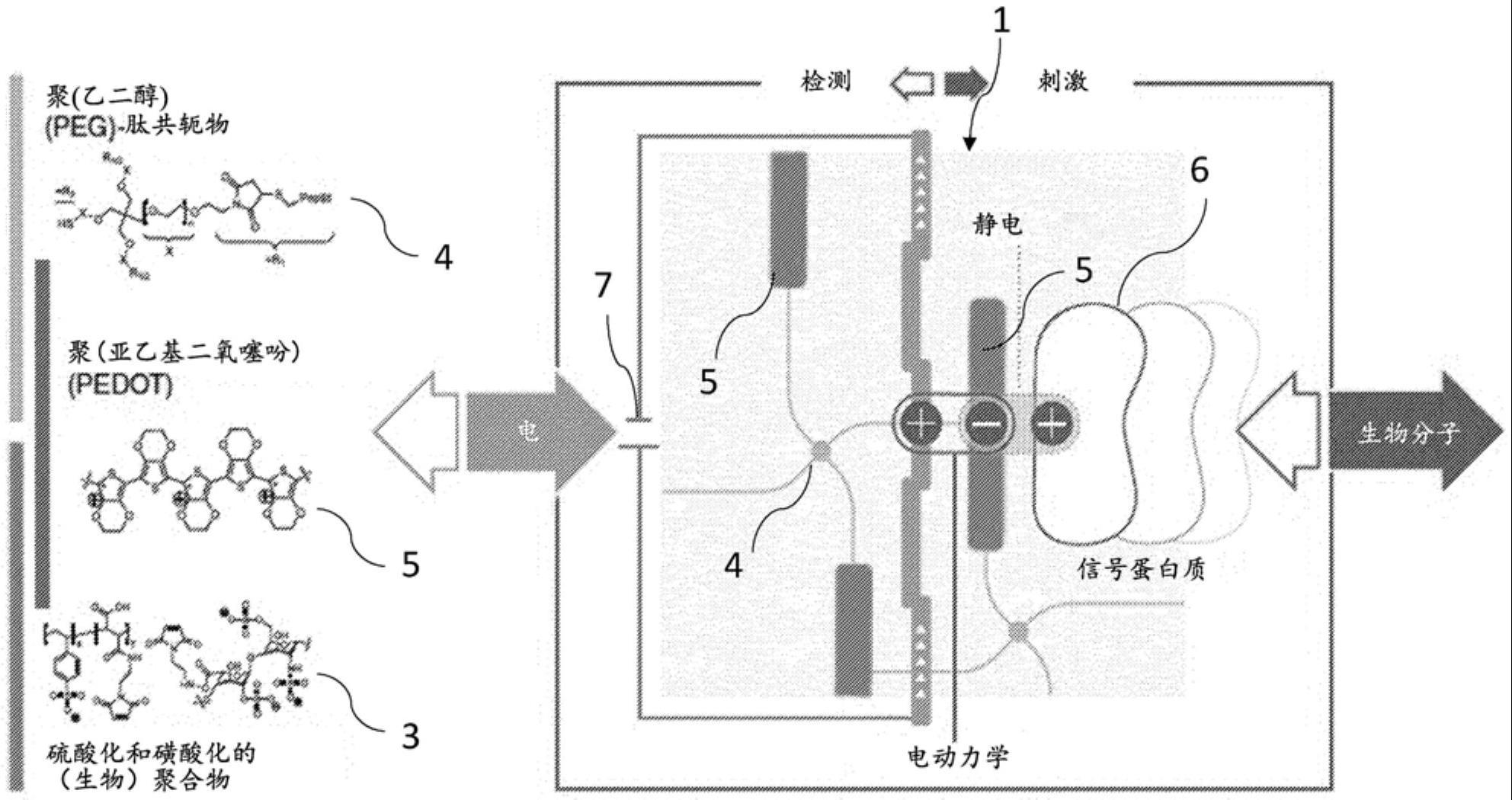
图2示出用于进一步阐释本发明的另一个示意图。所展示的是一种导电水凝胶材料1,该导电水凝胶材料由作为带电的构造单元3的硫酸化和磺酸化的聚合物和作为交联剂4的peg(形成聚合物网络2)以及作为导电组分5被结合在聚合物网络中的pedot形成。右侧用附图标记6展示了键合到带负电的pedot上的带正电的信号蛋白质。信号蛋白质6在水凝胶材料1中的键合特性可以通过影响电势而受到影响。为了在电学上影响水凝胶材料1,使水凝胶材料1与电压源7电接触。本发明的水凝胶材料1可以实现对水凝胶聚合物与信号蛋白质6之间的特定静电相互作用的电动力学调制。
实施例:
[0079]
合成聚合物网络
[0080]
为了合成水凝胶材料1使用了三种带阴离子电性的聚合物网络体系2,(1)由两种水凝胶构造单元形成的体系,即一种带有马来酰亚胺基团的带阴离子电性的构造单元(gb1-5)和带有硫醇基团的不带电的构造单元(ugb2)(后文称为马来酰亚胺-硫醇二组分体系)或者(2)由三种水凝胶构造单元形成的体系(一种带有马来酰亚胺基团的带阴离子电性的构造单元(gb1-5)和带有买来酰亚胺基团的不带电的构造单元(ugb1)以及带有硫醇基团的不带电的构造单元(ugb2)(后文称为马来酰亚胺-硫醇三组分体系)或者(3)由两种水凝胶构造单元形成的体系,通过对带阴离子电性的水凝胶构造单元(gb1)的羧基的基于edc/nhs的活化并且通过与不带电的第二构造单元(ugb3)上的氨基的反应交联而形成(后文称为edc-nhs体系)。
[0081]
带阴离子电性的水凝胶构造单元(gb1至gb5)和不带电的水凝胶构造单元(ugb1至
ugb3)的特性可以从图3中的表1中得知。
[0082]
马来酰亚胺-硫醇二组分体系用于合成作为本发明水凝胶材料前体的带阴离子电性的聚合物网络
[0083]
将gb1(肝素-马来酰亚胺,15kda)和ugb2(星形的硫醇官能化的聚乙二醇,starpeg,10kda)以各自0.0015mol/l的浓度溶解在0.1x磷酸盐缓冲的食盐溶液((pbs),ph=6)中。1x pbs由137nm nacl、2.7mm kcl和12mm总磷酸盐(由hpo
42-和h2po4组成)组成。混合比和浓度可以从图4的表2中得知。直至混合水凝胶构造单元为止的所有后续步骤都在冰上进行。(设定ph值以实现30分钟的凝胶化时间)对于这两种构造单元摩尔比为1的情况而言,通过借助于滴管和/或在混合器中混合来将相同体积的这两种溶液混合。随后将混合物离心以去除气泡,并且将试样用滴管滴加到金电极(直径11mm,100μl)上或者盖玻片(直径8mm,67μl)上并且用11mm或8mm大小的疏水盖玻片(出售)覆盖。水凝胶的交联通过硫醇基团与马来酰亚胺基团的反应(迈克尔加成反应)进行。聚合在室温下在潮湿的腔室中进行至少30分钟,以避免凝胶干燥。为了进行冷冻凝胶化,将样品在-15℃下聚合过夜。然后将完全聚合的水凝胶在1x pbs(0.154mmol/l nacl,ph 7.4)中溶胀过夜。凝胶的固体含量为约3%(m/v)。
[0084]
马来酰亚胺-硫醇三组分体系用于合成作为本发明水凝胶材料前体的聚合物网络
[0085]
为了准确设定水凝胶材料中整体负电荷,使用了三组分体系。将星形peg-硫醇、星形peg-马来酰亚胺和马来酰亚胺官能化的带阴离子电性的水凝胶构造单元聚合物以预定浓度溶解在0.01x pbs中并且取决于所希望的整体电荷而以不同比率混合。混合比可以从图4(表2)中得知。通过加入0.01m hcl或0.01m naoh将凝胶化时间设定为小于5分钟。随后将溶液混合并且与二组分体系类似地在室温下(30分钟)或15℃下(过夜)产生样品。将完全聚合的水凝胶在1x pbs(ph 7)中溶胀过夜。凝胶的固体含量为约3%(m/v)。
[0086]
不带电的和带阴离子电性的构造单元的特性在图3(表1)中示出。
[0087]
edc/nhs体系用于合成作为本发明水凝胶材料前体的聚合物网络
[0088]
对于edc/nhs体系,对于ugb3星形peg-胺与未马来酰亚胺化的gb1的摩尔比为2的情况,将0.167mg/μl的ugb3、0.145mg/μl的gb1、0.1mg/μl的edc(n-(3-二甲基氨基丙基)-n'-乙基碳二亚胺)和0.1mg/μl的nhs(n-羟基磺基琥珀酰亚胺)溶解在用冰冷却的milliq水中。为了获得1ml最终的凝胶体积,首先将85.20μl的edc溶液和48.25μl的nhs溶液用滴管滴加至533.22μl的肝素溶液、在实验室混合器中混合(涡流搅拌)并且在冰上培养15分钟。随后加入333.33μl的星形peg溶液并且通过涡流搅拌重新混合。随后与二组分体系完全相同地直接产生所希望的成形体。在室温下或-15℃下在潮湿的腔室中过夜进行聚合,以避免水凝胶干燥。在最终的星形peg浓度为0.00784mol/l并且最终的肝素浓度为0.00392mol/l的情况下,凝胶的总固体含量约为10%。将完全聚合的水凝胶在1x pbs(ph 7)中溶胀过夜。
[0089]
合成作为伪互穿网络的导电水凝胶材料
[0090]
导电的伪互穿聚合物网络的合成对于具有上述形成流程的所有水凝胶材料而言都是可能的。为了合成具有pedot作为导电组分的导电的伪互穿的聚-3,4-亚乙基二氧噻吩(pedot)网络,在第一步骤中将完全溶胀的带阴离子电性的聚合物网络在室温下在1m hcl中0.4m的过氧二硫酸铵(aps)溶液中培养3小时。随后将水凝胶在旋转振荡器中在矿物油中0.4m的3,4-亚乙基二氧噻吩(edot)溶液中培养6小时。此时,edot氧化性聚合成导电的
pedot网络,随着pedot的聚合进展该网络的黑色变多(图5)。随后将如此制备的水凝胶材料在矿物油中清洗过夜,以便去掉未反应的单体。为了去除矿物油,随后在己烷中清洗水凝胶材料。可以重复清洗过程。随后将水凝胶材料在pbs(ph 7.4)中清洗至少24小时。
[0091]
所有水凝胶材料类型总结在图4的表2中。所给出的浓度为在成品凝胶混合物中的浓度。水凝胶材料类型gb1-ugb2 16、gb1-ugb2 18、gb2-ugb2-ugb1 19、gb2-ugb2-ugb1 20、gb3-ugb2-ugb1 21和gb4-ugb2-ugb1 22为没有用pedot官能化的水凝胶。水凝胶材料类型ugb1-ugb2 15是纯的peg-peg水凝胶,不带有阴离子电荷,但是已被pedot官能化。
[0092]
电学表征
[0093]
所有水凝胶的电学表征都借助于阻抗谱或循环伏安法在3电极设置中在100ml1x pbs(ph 7)中进行。对于这两种测试方法,在用作工作电极的金网电极上制备了100μl的凝胶样品(未溶胀的体积)。使用具有与工作电极相比表面积明显更大的多孔碳电极(biologic a-010530)作为对电极。ag/agcl电极(metrohm,零件编号6.0726.100)用作参比电极。电位仪(metrohm autolab pgstat204或palmsens 4)用作测量仪器。
[0094]
阻抗谱
[0095]
为了获得阻抗谱,施加10mv
rms
的有效电势并且在0.01hz至105hz的频率范围内以每十倍频(dekade)10个测量点来测量阻抗以及相位角。在0.01hz的频率下比较不同水凝胶材料类型的阻抗。电导率与阻抗成反比。阻抗升高则电导率降低。
[0096]
循环伏安法
[0097]
电荷存储容量的计算借助循环伏安法测量来进行。为此,在使用上述3电极结构的情况下测量工作电极(水凝胶)与对电极(碳电极)之间的电流,而在5个循环流程中将所施加的电势从-0.6改变至0.8v(工作电极与ag/agcl参比电极之间的电势)。扫描速率为50mv/s。随后将曲线下方的面积的负的部分积分(multitrace 4.3,palmsens 4)并从中用下式计算水凝胶的电荷存储容量:
[0098][0099]
软件将以[a]*[v]为单位的数值i*u作为积分输出。在此有[a]=[c/s]。通过对扫描速率[v/s]做除法得到通过材料转移的电荷[c]。随后将其除以体积,因为与周围介质的界面存在于水凝胶的整个体积中并且由此不能计算表面积。数值以每毫升水凝胶的电荷给出。
[0100]
水凝胶材料的电学特性
[0101]
在氧化性聚合之后,pedot直接就具有固有的正电荷(10.1021/acs.jpcb.9b01745,10.1021/acsapm.8b00061)。通过pedot与带阴离子电性的聚合物网络(水凝胶)之间的非共价相互作用以及各个pedot聚合物链之间的非共价相互作用,在带阴离子电性的聚合物网络与pedot之间形成了伪互穿的网络。同时,带阴离子电性的聚合物网络的负电荷用作对pedot的p掺杂。取决于整体和局部的电荷密度(参数p0/p1和p2),pedot的掺杂度有所变化。这对导电水凝胶材料的电学特性(阻抗和电荷存储容量)有直接影响。在p2和p3相同的情况下,在110至2μmol/ml的p1范围内对于水凝胶材料类型gb1-ugb2 01和gb1-ugb2-ugb1 02-04获得了3040至1505mc/ml的电荷存储容量和30至93ω的阻抗,并且在128至2μmol/ml的p1范围内对于水凝胶材料类型gb2-ugb2 05和gb2-ugb2-ugb1 06-08(图6
的表3)获得了3040至1894mc/ml的电荷存储容量和36至74ω的阻抗。由于pedot为疏水聚合物,pedot链彼此的分布和交联严重依赖于周围环境的疏水度且由此依赖于带阴离子电性的聚合物网络的两亲性(参数p3),这同样对水凝胶材料的电学特性有影响。在这些实施例中显示出,在6.8*10-3 1/a2(gb2-ugb2-ugb1 08)的较高的参数p3值的情况下,参见表2与-5.9*10-3 1/a2(gb1-ugb2-ugb1 04)的较低的参数p3值相比,在p2(4.5mmol/(g/mol))和p1(2μmol/ml)的值保持不变时,较高的疏水度产生了较高的电荷存储容量(1894对1505mc/ml)和较小的阻抗(74ω对93ω)(图6的表3)。如果将载有强阴离子的基团沿着聚合物链的距离增大(减小的p2值,代表较小的局部电荷密度),则在类似的p3和几乎相同的p1下获得了明显减小的电荷存储容量以及升高的阻抗。这种差异特别表现在9mmol/ml的较低的p1、0.9mmol/(g/mol)的p2和0.7*10-3 1/a2的p3(gb4-ugb2-ugb1 12)与11或4mmol/ml的p1、4.5mmol/(g/mol)的p2和-5.9*10-3 1/a2的p3(gb1-ugb2-ugb1 02/03)的对比中。尽管p3的值较小并且p1的值几乎相同或较小,具有较高p2(gb1-ugb2-ugb102/03)的水凝胶与gb4-ugb2-ugb1 12(910mc/ml和150ω)相比具有明显更高的电荷存储容量(2350和1811mc/ml)和较小的阻抗(42和81ω)。虽然具有中等的p1和p3值,gb4-ugb2-ugb1 12表现得如同在pedot官能化之后没有带阴离子电性基团的水凝胶,参见ugb1-ugb2 15(纯peg水凝胶材料,921mc/ml和167ω)。由此可以通过改变掺杂度(p1、p2)以及疏水度(p3)获得具有不同电学特性的导电水凝胶。通过较大的整体阴离子基团数量(也就是说较高的p0或p1值)以及载有强阴离子的基团之间较小的距离(p2),可以获得具有高电导率的水凝胶。p0表现为对电学特性具有与p1类似的影响,这可能归因于强阴离子基团的比例。弱阴离子基团、在此例如具有在3.5至4.5范围内的固有pka的羧基可能在pedot掺杂中扮演次要角色。通过参数p3,同样可以配置亲水性/两亲性的阴离子型聚合物与疏水的导电聚合物(pedot)之间的相互作用。由于带阴离子电性的水凝胶构造单元的提高的疏水度(较高的参数p3值),在明显较低的p1下已经可以产生增高的电导率(也就是说较低的阻抗)。原因在于疏水的pedot单元对带阴离子电性的水凝胶构造单元上的疏水基团的高亲和性,这可能有利地影响掺杂。另外,疏水基团在pedot合成期间已经使得单体单元(edot)在带阴离子电性的聚合物网络中的渗透和分布更容易。具有非常高电导率(低阻抗)和高电荷存储容量的导电水凝胶材料可以用作生物相容的电极材料用于刺激细胞或组织。由于这些与生物组织非常相似的水凝胶的高水合度和柔软度,与经典的金属电极相比,可以明显减少生物体针对此类以本发明的导电水凝胶材料为基础的电极的排异反应。另外,在经典的金属电极中用于电刺激的电荷传输仅仅在金属与组织(生理溶液)的接触面处发生。由于导电聚合物在本体材料内部的分布和生物流体能够扩散到水凝胶中的可能性,在整个体积内部可以发生电荷转移。由此可以将较小的电压用于相同的电荷注入,这与经典的金属电极相比减少了发热和由此产生的潜在的组织损伤。
[0102]
有效成分的封存和释放
[0103]
以与电学特性的表征完全相同的方式进行用于有效成分的封存和释放的样品准备。将100μl的不同的带阴离子电性的聚合物网络施加到金网电极上并且借助于edot单体后续的渗透和聚合成pedot来使其导电。
[0104]
有效成分的封存
[0105]
在pbs中对导电水凝胶材料进行基础的清洗之后,分别以在带有0.1% bsa的
2.5ml pbs中100ng/ml物质的浓度(以便模拟具有载体蛋白质的生理状况)对不同物质进行封存。这对应于各蛋白质和水凝胶材料250ng。在5ml的低键合eppendorf管(eppendorf)中进行封存,以便将蛋白质对反应容器的非特异键合最小化。在24小时中进行吸收。封存在500mv、0mv(被动)和-500mv下进行。主动封存与电学表征类似地在3电极设置中进行。在金电极上的导电水凝胶用作工作电极。工作电极与参比电极(ag/agcl丝)一起处于5ml的低键合eppendorf管中。具有与工作电极相比明显更大的表面积的对电极(多孔碳电极,biologic a-010530)处于具有100ml pbs的分开的容器中。通过由pvc软管形成的盐桥将电路闭合,该软管填充有在pbs中溶胀的25%的聚丙烯酰胺水凝胶(根据制造商指导给出)。在eppendorf容器中另外用1000da的渗析膜将软管封闭,以避免物质渗入。为了施加经限定的电势,电位仪(metrohm autolab pgstat204或palmsens 4)用作测量仪器。作为样品,在封存之前和之后取出100μl的溶液。在根据制造商指导使用多路分析套装(multiplex assays kits)(luminex technology,thermofisher)测定不同蛋白质的浓度之后,以百分比计算所吸收的蛋白质的量。
[0106]
对于封存物质而言,在所施加的电压不同的情况下,水凝胶材料(带阴离子电性的聚合物网络-pedot伪ipn)中整体电荷密度p0或p1以及局部电荷密度(p2)起到主要作用。在此,与所键合的分子的电荷无关地,可以在没有施加电势的情况下测量最高封存量(图7的表4)。与具有相似p1和p2的不导电的水凝胶(没有pedot)相比显示出,导电水凝胶材料具有对带正电物质的较小吸收量(gb2-ugb2-ugb1 09;72.3% sdf-1α;72.7% fgf-2;70.8% il-8相对于gb2-ugb2-ugb1 19;98.2% sdf-1α;85.0% fgf-2;96.7% il-8)(参见表4)。在带负电的分子的情况下显示出相反的效果。可以测量到在gb2-ugb2-ugb1 09的情况下49.9% gm-csf和37.1% egf的吸收,相比之下在gb2-ugb2-ugb1 19的情况下为43.3% gm-csf和33.5% egf。这种效果在更低的p1下更加显著。于是在gb2-ugb2-ugb1 10的情况下可以键合77.8% gm-csf和69.2% egf,相比之下在gb2-ugb2-ugb1 20的情况下为0.0% gm-csf和21.0% egf。其原因很可能是pedot的正电荷。在不施加电势的情况下pedot具有单体单元的约33%的正电荷,这可以产生与带负电的物质的相互作用并且很可能可以将其键合(10.1021/acsapm.8b00061,10.1021/acsami.5b04768)。另外显示出,与不导电的对照组相比,在较低p1下即使带正电的物质也可以通过导电水凝胶更好地键合。于是在gb2-ugb2-ugb1 10的情况下可以键合76.9% sdf-1α;86.1% fgf-2;39.9% il-8,相比之下在gb2-ugb2-ugb1 20的情况下为60.5% sdf-1α;41.6% fgf-2;17.1% il-8。这可能使得,主要由于与水凝胶材料的带阴离子电性的基团的相互的电荷补偿,导电聚合物pedot即使对于大体上带正电的物质的键合也扮演重要角色。在蛋白质中带负电的域通过pedot的离子键合以及蛋白质与pedot之间的疏水相互作用在此都扮演重要角色。
[0107]
如果施加500mv的正电势,则物质的封存总体上减少(图7的表4)。主要可以在带正电的物质的情况下观察到这种情况。在带负电的物质的情况下,例如gm-csf和egf,相反可以观察到较小的升高或者几乎相同的封存。于是,在gb2-ugb2-ugb109的情况下在施加电势之前可以键合49.9% gm-csf和37.1% egf而在施加电势之后可以键合59.2% gm-csf和67.0% egf,或者在gb2-ugb2-ugb1 09的情况下在施加电势之前可以键合77.8% gm-csf和69.2% egf而在施加电势之后可以键合78.4%gm-csf和64.8% egf。其原因可能是,通过施加正电势增加了pedot的电荷。(10.1021/acsapm.8b00061,10.1021/
acsami.5b04768)。由于提高的离子相互作用,这产生了对带负电的蛋白质如gm-csf和egf的键合的有利影响。相反,由于在水凝胶中阴离子组分的负电荷是恒定的并且pedot的较强的正电荷可能导致部分电荷补偿,所以总体而言对带正电的蛋白质的吸收降低。
[0108]
如果施加负电势,pedot的正电荷可能减少或甚至完全被中和(10.1021/acsapm.8b00061,10.1021/acsami.5b04768)。在-500mv的电势下,大体上显示出与物质的电荷无关且与水凝胶材料的p1和p2无关的物质封存减少(图8的表4)。于是,在gb2-ugb2-ugb1 09中sdf-1α的封存从72.3%降低到47.2%、ngf-β从94.1%降低到75.0%并且il-8从70.8%降低到35.4%。对于gb2-ugb2-ugb1 10和gb3-ugb2-ugb1 11/12可以观察到相同的趋势。这确认了以下推测,即,对于带正电物质的键合而言,pedot的正电荷扮演重要角色。这例如可以由于物质(蛋白质)的带负电的域键合到pedot的正电荷(即先前描述的现象)而产生。在封存带负电的物质时,在-500mv下显示出非常大幅度的封存减少。于是,在gb2-ugb2-ugb1 09中gm-csf的封存从49.9%降低到17.9%并且egf从37.1%降低到0.0%,或者在gb2-ugb2-ugb1 10中gm-csf的封存从77.8%降低到44.9%并且egf从69.2%降低到42.8%。这种在负电势下带负电物质的封存严重降低的原因可能在于pedot的正电荷的减少。由此用于带负电的物质的键合位置明显更少。
[0109]
有效成分的释放
[0110]
在封存(根据上述第三负载方法对水凝胶进行负载)之后对生物活性分子进行电控释放。由于平均最高的封存,为此使用了在0mv的电势下(被动)用物质负载了24小时的样品。主动封存的物质的受控释放同样可以根据下文说明的实验方案来进行。
[0111]
在对水凝胶进行负载之后,首先进行较短的清洗步骤,以便去除弱键合的蛋白质。为此首先在3000rpm下将水凝胶离心1分钟,以便去除附着的液体。随后在1ml pbs中用bsa清洗水凝胶并且重新在3000rpm下离心1分钟。释放同样在“有效成分封存”章节中说明的3电极设置中在所施加的500mv、0mv和-500mv的电势下进行。对于初始溶液(对照组)、封存之后、清洗之后和释放之后,在0分钟、10分钟、30分钟、1小时、6小时、8小时和24小时之后进行取样。由于在8小时之后已经可以观察到释放蛋白质的饱和,在8小时之后显示出处于平台部分的释放结果(图8的表5)。在根据制造商指导使用多路分析套装(multiplex assays kits)(luminex technology,thermofisher)进行不同物质浓度的测定。
[0112]
所键合的物质的释放可以取决于带阴离子电性的聚合物网络的所配置的参数结合pedot的电荷来设定(图8的表5)。在高p1下(60μmol/ml,gb2-ugb2-ugb1 09)仅仅发生非常少的带正电物质的释放(0.0% sdf-1α;0.0% fgf-2;0.5% il-8)。相反,对于带正电物质可以观察到稍小的释放(2.3% gm-csf;9.1% egf)。由于pedot的正电荷很可能被阴离子基团过度补偿,所以释放带负电的物质很可能比释放带正电的蛋白质明显更快地进行。在低p1下(2μmol/ml,gb2-ugb2-ugb1 10)发生带正电物质的增大的释放(0.8% sdf-1α;0.3% fgf-2;11.7% il-8)。相反,带负电的物质与较高p1相比释放较少(0.4% gm-csf;2.0% egf)。如果在相似p1值的情况下降低p2(gb3-ugb2-ugb1 11/12),则可以在带正电物质的释放几乎不变的情况下(1.6/0.2% sdf-1α;0.0/0.0% fgf-2;1.4/1.2% il-8)实现带负电物质的增大的释放(4.3/3.7% gm-csf;94.1/73.5% egf)(图8的表5)。其原因同样是虽然电荷密度较低但pedot中的正电荷被阴离子基团补偿。
[0113]
如果施加500mv的电势,则可以观察到所键合的物质保持不变,而与其电荷无关。
这种效应对于gb2-ugb2-ugb1 09表现得特别明显。在此,几乎所有14种蛋白质的释放都降低到0%(图8的表5)。即使在gb3-ugb2-ugb1 12中的中等的p1(9μmol/ml)和非常小的p2(0.94mmol/(g/mol))的情况下,所有物质的释放也可以减少到几乎为0%(图8的表5)。其原因可能在于水凝胶的溶胀速率。在正电势的情况下,pedot的增加的正电荷更多地补偿了带阴离子电性的基团。如果假定与pedot的正电荷相比在水凝胶材料中存在更多的阴离子基团,则水凝胶的总电荷就向中性偏移,由此造成水凝胶的水损失并由此造成收缩。这导致聚合物链的减小的网眼宽度,这进而造成减少的蛋白质释放,而与其电荷无关。
[0114]
如果施加-500mv的电势,在这些物质中的大部分中显示出增大的释放(图8的表5)。这主要涉及带负电的生物活性分子。于是,在施加电势之后,对于水凝胶材料类型gb2-ugb2-ugb1 09的tnf-α、gm-csf和egf释放从1.4/2.3/9.2%增加到5.3/10.4/67.2%并且对于gb2-ugb2-ugb1 10从1.7/0.4/2.0%增加到53.2/5.9/72.6%。对于水凝胶材料类型gb3-ugb2-ugb1 11/12也可以观察到这种趋势。在此有意义的是,在没有施加电势的情况下已经具有较多释放的物质通过施加负电势得以最大程度释放。其原因最有可能是pedot的正电荷的减少/中和。由此存在多个游离的阴离子基团,它们通过离子相互作用促使排斥带负电的蛋白质。然而在带正电的物质的情况下还可以观察到增多的释放。于是,对于gb2-ugb2-ugb1 10而言fgf-2、il4和il8的释放从0.3%增大到2.6%、从0.6%增大到1.7%以及从11.7%增大到26.3%。其原因同样可能是,由于缺少用pedot的电荷补偿,游离的带阴离子电性的基团的数量增加。由此促成的水凝胶的负净电荷增加产生了溶胀。由此有利于与电荷无关的释放,从而还可以以更大的量释放带正电的物质。
[0115]
水凝胶的生物相容性
[0116]
为了研究生物相容性,使用了pc12细胞系和水凝胶材料类型gb1-ugb2 17。该细胞系为嗜铬细胞瘤细胞,可以通过加入ngf-β使其在几天之内分化成神经类细胞。pc-12细胞系是广泛用于神经元分化的模型。为了用pc12细胞进行培育,首先将经清洗且在pbs中溶胀的导电水凝胶在70%的乙醇中冲洗10分钟,以杀死可能存在的微生物,并且随后在无菌pbs中清洗。在用i型胶原蛋白(50μg/ml,1ml/100μl凝胶,gibco
tm
)在20mm无菌乙酸在室温下处理2小时之后,将凝胶在pbs中清洗30分钟。对于载有ngf-β的凝胶,附加地用ngf-β(100ng/ml,sigma-aldrich)在带有1% bsa的pbs中培养过夜。随后每cm2凝胶表面播撒50,000个细胞。细胞的播撒及其培养在rpmi1640(gibco
tm
)中以在介质中加入10%马血清(gibco
tm
)、5%的胎牛血清(gibco
tm
)和1%的青霉素和链霉素(gibco
tm
)来进行。依据培育条件不同,使用纯介质、向介质中加入100ng/ml ngf-β或者使用仅具有1%马血清(gibco
tm
)和0.5%的胎牛血清的减养料介质(减少)。在每2天更换介质培养5或7天之后在室温下在pbs中4%的pfa中固定细胞20分钟。为了成像,根据制造商指导用鬼笔环肽(abcam)和dapi(pierce)染色。用荧光显微镜拍摄图像。用fiji/imagej在使用watershed和analyze particles(细胞数量)和skeletonize插件的情况下进行细胞数量和细胞范围的分析。
[0117]
对于所有的培育条件都观察到凝胶上的细胞粘附和细胞增殖。在7天与5天的比较中,在没有加入ngf-β的情况下,在水凝胶上细胞范围减小的情况下细胞数量大幅度增加(图9的表6)。这对应于较多的细胞增殖。向介质中加入ngf-β造成在5天之后pc12细胞已经分化(图9的表6)。这可以在由于轴突状结构生长造成的细胞范围增加中得到确认。向水凝胶中而非向介质加入ngf-β导致在细胞数量仅少量增多的情况下细胞范围仅略微增大(图9
的表6)。在没有刺激的情况下,所释放的ngf-β的量过小,而无法实现细胞的完全分化。其原因是ngf-β对水凝胶的高亲和性。如果减少介质中的养料含量,则可能实现增多的分化。然后,这些细胞在所有培育条件下都具有在水凝胶上增殖并分化的能力,这确认了水凝的高生物相容性。
[0118]
附图标记清单
[0119]1ꢀꢀꢀꢀꢀꢀꢀꢀ
导电水凝胶材料/水凝胶材料
[0120]2ꢀꢀꢀꢀꢀꢀꢀꢀ
聚合物网络
[0121]3ꢀꢀꢀꢀꢀꢀꢀꢀ
带阴离子电性的构造单元
[0122]4ꢀꢀꢀꢀꢀꢀꢀꢀ
交联剂分子
[0123]5ꢀꢀꢀꢀꢀꢀꢀꢀ
导电组分/pedot
[0124]6ꢀꢀꢀꢀꢀꢀꢀꢀ
生物活性物质/多种生物活性物质/信号蛋白质
[0125]7ꢀꢀꢀꢀꢀꢀꢀꢀ
电压源
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1