具有除草剂抗性的转基因植物的制作方法
本发明涉及一种对砜吡草唑(pyroxasulfone)和笨磺噁唑草(fenoxasulfone)等异噁唑啉衍生物有抗性的转基因植物。
背景技术:
已知具有异噁唑啉骨架的化合物(异噁唑啉衍生物)有除草剂活性。予以说明,异噁唑啉骨架也称为isoxazoline骨架。作为异噁唑啉衍生物,如非专利文献1所述,开发出砜吡草唑等作为具有优异的除草效果以及作物与杂草间选择性的化合物。砜吡草唑是将超长链脂肪酸延伸酶(vlcfae:very-long-chainfattyacidelongase)作为作用点的除草剂,其中,vlcfae可以催化植物角质的蜡层和细胞膜的鞘脂质的主成分超长链脂肪酸的生物合成。
关于砜吡草唑,已知有不仅对禾本科杂草和阔叶杂草,而且对现有的抗性杂草也能表现出高除草效果的田间作用除草剂(非专利文献1)。即,砜吡草唑对小麦等作物具有安全性。另一方面,已知甘蓝型油菜、大麦、稻等对砜吡草唑的敏感性高(非专利文献1、2)。因此,对于甘蓝型油菜、大麦、稻等,砜吡草唑未被作为除草剂而进行农药登记。
另外,关于砜吡草唑,谷胱甘肽-s-转移酶(gst)的药剂代谢有可能与小麦中的抗性(小麦选择性)有关(非专利文献3)。很多报告显示,农药的谷胱甘肽结合一般会引起代谢解毒(非专利文献4~7)。尤其是关于谷胱甘肽结合引起的代谢解毒,已知vlcfae抑制型除草剂氯乙酰胺类化合物与砜吡草唑相同,也与作物与杂草间选择性有关(非专利文献8~10)。
其中,已知gst在一种植物中存在多个分子种类。另外,非专利文献11公开了来自玉米的gst(gsti、zmm16901)对氯乙酰胺类的甲草胺表现出很高的结合活性,而对结构非常相似的异丙甲草胺却没有结合活性。此外,非专利文献12公开了与zmgsti的同源性最高(氨基酸序列的同源性约为56%)的zmgst8(zmq9fqd1)对甲草胺未表现出结合活性。如上所述,由于gst的底物特异性高,因此鉴定代谢特定药剂的gst分子种类是非常困难的,即使以与该药剂相似的化合物作为底物的gst是公知的。
予以说明,虽然已知植物gst可以直接减少氧化胁迫(非专利文献13),赋予对盐、干燥、温度、除草剂等各种胁迫的抗性(非专利文献14),但没有报告称能同时赋予除草剂抗性和高温抗性的基因。此外,有报告称同时导入gst和gpx(谷胱甘肽过氧化物酶)可以赋予植物高温抗性(非专利文献15),但没有报告称单独导入gst可以赋予高温抗性。
现有技术文献
非专利文献
非专利文献1:y.tanetani等pestic.biochem.physiol.95,47-55(2009)
非专利文献2:y.tanetani等j.pestic.sci.36,221-228(2011)
非专利文献3:y.tanetani等j.pestic.sci.38,152-156(2013)
非专利文献4:e.boyland等adv.enzymol.relat.areas.mol.biol.32,173-219(1969).
非专利文献5:b.mannervikadv.enzymol.relat.areas.mol.biol.57,357-417(1985).
非专利文献6:p.j.hatton等pestic.sci.46,267-275(1996).
非专利文献7:d.p.dixon等genomebiol.3,1-10(2002)
非专利文献8:g.l.lamoureux等j.agric.foodchem.19,346-350(1971).
非专利文献9:j.r.c.leavitt等j.agric.food.chem.27,533-536(1979).
非专利文献10:t.mozer等biochemistry22,1068-1072(1983).
非专利文献11:m.karavangeli等biomolecularengineering22,121-128(2005).
非专利文献12:i.cummins等plantmol.biol.52,591-603(2003).
非专利文献13:i.cummins等plantj.18,285-292(1999).
非专利文献14:redwars&dpdixsonmethodsenzymol.401,169-186(2005).
非专利文献15:vproxas等plantcellphysiol.41,1229-1234(2000).
专利文献
专利文献1:美国专利us6730828
技术实现要素:
发明所要解决的问题
因此,本发明的目的在于鉴定一种谷胱甘肽-s-转移酶,其对砜吡草唑等异噁唑啉衍生物表现出代谢解毒活性,提供一种利用该谷胱甘肽-s-转移酶对异噁唑啉衍生物有抗性的转基因植物,同时提供一种对表达该谷胱甘肽-s-转移酶的植物使用异噁唑啉衍生物作为除草剂的方法。
解决问题的技术方案
为了达到上述目的,本发明人进行了潜心研究,结果成功地鉴定出对砜吡草唑等异噁唑啉衍生物表现出代谢解毒活性,且存在于小麦中的谷胱甘肽-s-转移酶,并且发现该谷胱甘肽-s-转移酶对异噁唑啉衍生物的底物特异性极高,此外,意想不到的是,导入了该谷胱甘肽-s-转移酶(gst)的转基因植物获得了优异的胁迫抗性,从而完成了本发明。
本发明包含以下内容:
(1)本发明提供一种转基因植物的栽培方法,其特征在于,在异噁唑啉衍生物存在下,栽培转基因植物,所述转基因植物导入有编码以下(a)或(b)蛋白质的核酸:
(a)含有seqidno:2的氨基酸序列的蛋白质;
(b)具有相对于seqidno:2的氨基酸序列有80%以上的同一性的氨基酸序列,且具有谷胱甘肽-s-转移酶活性的蛋白质。
(2)根据(1)所述的栽培方法,其特征在于,所述异噁唑啉衍生物是砜吡草唑和/或笨磺噁唑草。
(3)根据(1)所述的栽培方法,其特征在于,所述转基因植物来自于对所述异噁唑啉衍生物有敏感性的植物。
(4)根据(3)所述的栽培方法,其特征在于,对所述异噁唑啉衍生物有敏感性的植物是禾本科植物。
(5)根据(4)所述的栽培方法,其特征在于,所述禾本科植物是稻。
(6)根据(3)所述的栽培方法,其特征在于,对所述异噁唑啉衍生物有敏感性的植物是十字花科、豆科、伞形科、苋科、唇形科、藜科、蔷薇科、菊科、茄科或锦葵科植物。
(7)根据(6)所述的栽培方法,其特征在于,所述十字花科植物是甘蓝型油菜(brassicanapus)或拟南芥。
(8)一种对异噁唑啉衍生物的抗性赋予方法,其特征在于,对于对异噁唑啉衍生物有敏感性的植物,导入编码以下(a)或(b)蛋白质的核酸:
(a)含有seqidno:2的氨基酸序列的蛋白质;
(b)具有相对于seqidno:2的氨基酸序列有80%以上的同一性的氨基酸序列,且具有谷胱甘肽-s-转移酶活性的蛋白质。
(9)根据(8)所述的抗性赋予方法,其特征在于,所述异噁唑啉衍生物是砜吡草唑和/或笨磺噁唑草。
(10)根据(8)所述的抗性赋予方法,其特征在于,对所述异噁唑啉衍生物有敏感性的植物是禾本科植物。
(11)根据(10)所述的抗性赋予方法,其特征在于,所述禾本科植物是稻。
(12)根据(8)所述的抗性赋予方法,其特征在于,对所述异噁唑啉衍生物有敏感性的植物是十字花科、豆科、伞形科、苋科、唇形科、藜科、蔷薇科、菊科、茄科或锦葵科植物。
(13)根据(12)所述的抗性赋予方法,其特征在于,所述十字花科植物是甘蓝型油菜(brassicanapus)或拟南芥。
(14)一种对环境胁迫的抗性赋予的方法,其特征在于,对于植物,导入编码以下(a)或(b)蛋白质的核酸:
(a)含有seqidno:2的氨基酸序列的蛋白质;
(b)具有相对于seqidno:2的氨基酸序列有80%以上的同一性的氨基酸序列,且具有谷胱甘肽-s-转移酶活性的蛋白质。
(15)根据(14)所述的抗性赋予方法,其特征在于,所述环境胁迫是高温胁迫。
(16)根据(14)所述的抗性赋予方法,其特征在于,所述植物是对异噁唑啉衍生物有敏感性的植物。
(17)根据(16)所述的抗性赋予方法,其特征在于,所述异噁唑啉衍生物是砜吡草唑和/或笨磺噁唑草。
(18)根据(14)所述的抗性赋予方法,其特征在于,所述植物是禾本科植物。
(19)根据(18)所述的抗性赋予方法,其特征在于,所述禾本科植物是稻。
(20)根据(14)所述的抗性赋予方法,其特征在于,所述植物是十字花科、豆科、伞形科、苋科、唇形科、藜科、蔷薇科、菊科、茄科或锦葵科植物。
(21)根据(20)所述的抗性赋予方法,其特征在于,所述十字花科植物是甘蓝型油菜(brassicanapus)或拟南芥。
(22)一种转基因植物,其特征在于,所述转基因植物导入有编码以下(a)或(b)蛋白质的核酸:
(a)含有seqidno:2的氨基酸序列的蛋白质;
(b)具有相对于seqidno:2的氨基酸序列有80%以上的同一性的氨基酸序列,且具有谷胱甘肽-s-转移酶活性的蛋白质。
(23)根据(22)所述的转基因植物,其特征在于,所述转基因植物对异噁唑啉衍生物有抗性和/或对环境胁迫有抗性。
(24)根据(22)所述的转基因植物,其特征在于,所述转基因植物是对于对异噁唑啉衍生物有敏感性的植物导入上述核酸而成的。
(25)根据(23)或(24)所述的转基因植物,其特征在于,所述异噁唑啉衍生物是砜吡草唑和/或笨磺噁唑草。
(26)根据(23)所述的转基因植物,其特征在于,所述环境胁迫是高温胁迫。
(27)根据(24)所述的转基因植物,其特征在于,对所述异噁唑啉衍生物有敏感性的植物是禾本科植物。
(28)根据(27)所述的转基因植物,其特征在于,所述禾本科植物是稻。
(29)根据(24)所述的转基因植物,其特征在于,对所述异噁唑啉衍生物有敏感性的植物是十字花科、豆科、伞形科、苋科、唇形科、藜科、蔷薇科、菊科、茄科或锦葵科植物。
(30)根据(29)所述的转基因植物,其特征在于,所述十字花科植物是甘蓝型油菜(brassicanapus)或拟南芥。
本说明书包含了作为本申请的优先权基础的日本专利申请号2016-132689号的公开内容。
发明效果
根据本发明,可以提供获得了对砜吡草唑和笨磺噁唑草等异噁唑啉衍生物的抗性和/或获得高温胁迫等环境胁迫抗性的转基因植物。换言之,根据本发明,可以对于对所述异噁唑啉衍生物有敏感性的植物赋予所述异噁唑啉衍生物抗性,另外,可以对植物赋予环境胁迫抗性。
由此,本发明的转基因植物即使在所述异噁唑啉衍生物存在下也可生长,因此可以利用异噁唑啉衍生物来稳定地栽培和生产。
附图说明
图1是表示taq8gtc0蛋白的大肠杆菌表达构建体的结构示意图。
图2是确认taq8gtc0蛋白的电泳照片。
图3是用于谷胱甘肽结合活性试验的vlcfae抑制型除草剂的化学式。
图4表示砜吡草唑和谷胱甘肽的结合反应,以及将砜吡草唑用作vlcfae抑制型除草剂时的hplc图的特征图。
图5是表示taq8gtc0基因的稻转化用载体的结构示意图。
图6是表示筛选并培养导入有taq8gtc0基因的稻培养细胞的状态照片。
图7-1是表示#3-13系统和野生型稻在vlcfae抑制型除草剂存在下栽培时的状态的特征图。
图7-2是表示#3-13系统和野生型稻在vlcfae抑制型除草剂存在下栽培时的状态的特征图。
图7-3是表示#3-13系统和野生型稻在vlcfae抑制型除草剂存在下栽培时的状态的特征图。
图7-4是表示#3-13系统和野生型稻在vlcfae抑制型除草剂存在下栽培时的状态的特征图。
图7-5是表示#3-13系统和野生型稻在vlcfae抑制型除草剂存在下栽培时的状态的特征图。
图7-6是表示#3-13系统和野生型稻在vlcfae抑制型除草剂存在下栽培时的状态的特征图。
图8是表示taq8gtc0基因的拟南芥转化用载体的结构示意图。
图9是表示将从导入有taq8gtc0基因的拟南芥植物体采集的种子进行栽培的状态照片。
图10是确认导入拟南芥中的taq8gtc0基因的电泳照片。
图11是表示对野生型拟南芥(columbia-0)进行砜吡草唑敏感性试验的结果的特征图。
图12是表示对导入有taq8gtc0基因的拟南芥进行砜吡草唑敏感性试验的结果的特征图。
图13是表示对导入有taq8gtc0基因的拟南芥进行对vlcfae抑制型除草剂的药剂敏感性试验的结果的特征图。
图14是表示对导入有taq8gtc0基因的拟南芥进行对vlcfae抑制型除草剂的药剂敏感性试验的结果的特征图。
图15是表示对导入有taq8gtc0基因的稻进行高温胁迫抗性试验的结果的特征图。
图16是包含taq8gtc0和与该taq8gtc0具有高同源性的gst的分支树状图。
图17是表示用于表达各种gst的稻转化用载体的结构示意图。
图18表示测定在含砜吡草唑培养基中进行液体培养的两种导入有植物gst基因的稻培养细胞和对照稻培养细胞,以及未进行药剂处理的对照稻培养细胞中的脂肪酸含量的结果的特征图。
图19表示测定在含砜吡草唑培养基中进行液体培养的三种导入有植物gst基因的稻培养细胞和对照稻培养细胞,以及未进行药剂处理的对照稻培养细胞中的脂肪酸含量的结果的特征图。
图20表示测定在含砜吡草唑培养基中进行液体培养的两种导入有植物gst基因的稻培养细胞,以及对照稻培养细胞中的脂肪酸含量的结果的特征图。
图21是表示表达玉米gst基因的稻转化用载体的结构示意图。
图22是表示导入有玉米gst基因的稻培养细胞的照片。
图23是表示对导入有玉米gst基因的稻培养细胞进行对砜吡草唑的抗性的试验结果的照片。
图24是表示taq8gtc1-r基因克隆的结构示意图。
图25是表示本实验中确定的taq8gtc1-r基因的碱基序列(上段,seqidno:31)和登记在数据库中的taq8gtc1基因的碱基序列(下段,seqidno:33)的对比结果的特征图。
图26是表示本实验中确定的taq8gtc1-r基因所编码的氨基酸序列(上段,seqidno:32)和登记在数据库中的taq8gtc1基因所编码的氨基酸序列(下段,seqidno:34)的对比结果的特征图。
图27是表示taq8gtc1-r蛋白的大肠杆菌表达构建体的结构示意图。
图28是确认taq8gtc1-r蛋白的电泳照片。
图29表示砜吡草唑和谷胱甘肽的结合反应,以及将砜吡草唑用作vlcfae抑制型除草剂时的hplc图的特征图。
图30是通过各种植物gst氨基酸序列的多序列比对进行对比的结果的特征图。第1行:atgstf2(seqidno:37);第2行:pttgstf1(seqidno:38);第3行:zmgstf1(seqidno:39);第4行:tagstf1(seqidno:40);第5行:tagstf2-r(seqidno:32);第6行:tagstf3(seqidno:2);第7行:tagstf4(seqidno:41);第8行:tagstf5(seqidno:42);第9行:tagstf6(seqidno:43)。
图31是表示taq8gtc1-r基因的稻转化用载体的结构示意图。
图32是表示筛选并培养导入有taq8gtc1-r基因的稻培养细胞的状态照片。
图33是表示导入有taq8gtc1-r基因的稻对砜吡草唑抗性的试验结果的照片。
图34是表示taq8gtc0基因的甘蓝型油菜转化用载体的结构示意图。
图35是表示筛选并培养导入有taq8gtc0基因的甘蓝型油菜培养细胞的状态照片。
图36是表示通过pcr来确认是否为导入有taq8gtc0基因的重组甘蓝型油菜的结果的电泳图照片。
图37是表示野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜的砜吡草唑的发芽前土壤处理试验的结果的照片。
图38是表示野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜的砜吡草唑的发芽前土壤处理试验的结果的照片。
图39是表示野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜的砜吡草唑的发芽前土壤处理试验的结果的照片。
图40是表示野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜在琼脂培养基中的生长抑制试验的结果的照片。
图41是表示野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜在琼脂培养基中的生长抑制试验的结果的照片。
图42是表示野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜在琼脂培养基中的生长抑制试验的结果的照片。
图43是表示野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜在琼脂培养基中的生长抑制试验的结果的特征图。
图44是表示野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜在琼脂培养基中的高温抗性试验的结果的特征图。
具体实施方式
下面详细地说明本发明。
〔本发明的谷胱甘肽-s-转移酶〕
本发明的谷胱甘肽-s-转移酶(以下,有时简称为gst)可以规定为以下(a)或(b)蛋白质。
(a)含有seqidno:2的氨基酸序列的蛋白质;
(b)具有相对于seqidno:2的氨基酸序列有80%以上的同一性的氨基酸序列,且具有谷胱甘肽-s-转移酶活性的蛋白质。
其中,由seqidno:2的氨基酸序列组成的蛋白质,也称为来自小麦(triticumaestivum)的gst中的gstf3,确定为登录号:q8gtc0。另外,seqidno:2的氨基酸序列,与cds序列(seqidno:1)一起确定为登录号:aj440792_1。但是,本发明中可以使用的gst不限于由seqidno:2的氨基酸序列组成的蛋白质,如上述(b)所述,也可以是具有相对于seqidno:2的氨基酸序列有80%以上、优选85%以上、更优选90%以上、进一步优选95%以上、最优选97%以上的同一性的氨基酸序列,且具有谷胱甘肽-s-转移酶活性的蛋白质。
予以说明,氨基酸序列之间的同一性的值可以通过安装有blast算法的blastn和blastx程序来计算(默认设置)。予以说明,计算在对一对氨基酸序列进行配对比较分析时完全一致的氨基酸残基,作为比较的整个氨基酸残基中的比例而计算同一性的值。
另外,本发明中可以使用的gst不限于由seqidno:2的氨基酸序列组成的蛋白质,也可以是具有相对于seqidno:2的氨基酸序列置换、缺失、插入或添加1个或更多个氨基酸而形成的氨基酸序列,且具有谷胱甘肽-s-转移酶活性的蛋白质。其中,“更多个”例如是指2~30个,优选为2~20个,更优选为2~15个,进一步优选为2~10个,再进一步优选为2~5个。
另外,本发明中可以使用的gst也可以是由以下dna编码,且具有谷胱甘肽-s-转移酶活性的蛋白质,所述dna是由在严格条件下对由seqidno:1的碱基序列组成的dna的互补链的全部或部分进行杂交而成的。“严格条件”是指形成所谓的特异性杂交体,不形成非特异性杂交体的条件,例如可以参考《分子克隆实验指南》第三版(molecularcloning:alaboratorymanual(thirdedition))来适当确定。具体而言,可以根据southern杂交法时的温度和溶液所含的盐浓度,以及southern杂交法的洗涤步骤时的温度和溶液所含的盐浓度,来设置严格度。更详细而言,作为严格条件,例如钠浓度为25~500mm,优选为25~300mm;温度为42~68℃,优选为42~65℃。更具体而言,为5×ssc(83mmnacl、83mm柠檬酸钠),温度42℃。
本发明中可以使用的gst尤其具有下文所述的对异噁唑啉衍生物的谷胱甘肽结合活性。即,本发明中可以使用的gst具有结合异噁唑啉衍生物和谷胱甘肽的活性。
更详细而言,本发明中可以使用的gst如果在植物内表达,则能促进谷胱甘肽对异噁唑啉衍生物的结合,降低异噁唑啉衍生物引起的超长链脂肪酸延伸酶抑制。因此,本发明中可以使用的gst如果在植物内表达,则能够对该植物赋予异噁唑啉衍生物抗性。
即,上述谷胱甘肽-s-转移酶活性也可以改称为对异噁唑啉衍生物的谷胱甘肽结合活性,或对异噁唑啉衍生物结合的谷胱甘肽的活性。
另外,如上所述,即使是含有与seqidno:2的氨基酸序列不同的氨基酸序列的蛋白质,本发明中可以使用的gst也可以称为除了上述谷胱甘肽-s-转移酶活性以外,还具有降低异噁唑啉衍生物引起的超长链脂肪酸延伸酶抑制作用的gst,还可以称为对植物赋予异噁唑啉衍生物抗性的gst。
〔转基因植物〕
本发明的转基因植物是向规定植物(植物体、植物细胞)中导入并可表达编码上述gst的基因而形成的。本发明的转基因植物通过表达编码上述gst的基因,而获得下文所述的对异噁唑啉衍生物的抗性,以及对环境胁迫的抗性。
其中,获得对异噁唑啉衍生物的抗性是指:与导入上述gst之前的植物对异噁唑啉衍生物的敏感性相比,导入上述gst之后的植物对异噁唑啉衍生物的敏感性在统计学上显著下降。换言之,获得对异噁唑啉衍生物的抗性是指:异噁唑啉衍生物对导入上述gst之后的植物的抑制效果,与异噁唑啉衍生物对导入该gst之前的植物的抑制效果相比,在统计学上显著降低。予以说明,作为异噁唑啉衍生物引起的抑制效果,可以使用所谓的50%抑制浓度等指标进行评价。
另外,获得环境胁迫抗性是指:与导入上述gst之前的植物对环境胁迫的敏感性相比,导入上述gst之后的植物对该环境胁迫的敏感性在统计学上显著下降。换言之,获得环境胁迫抗性是指:在负荷了规定的环境胁迫的条件下栽培导入上述gst之后的植物和导入该gst之前的植物时,导入gst之后的植物的生长速度在统计学上显著加快。予以说明,植物的生长速度例如可以使用株高的长度、根重等指标进行评价。
其中,作为环境胁迫,没有特别限制,可举出:高温胁迫、高盐浓度胁迫、干燥胁迫和低温胁迫。各种环境胁迫中,本发明的转基因植物尤其对高温胁迫具有优异的抗性。
另外,导入上述gst的对象植物没有特别限制,可以是任何植物。无论任何植物,只要导入上述gst,都能够获得高温胁迫抗性等环境胁迫抗性。作为导入上述gst的对象植物,尤其优选为下文所述的对异噁唑啉衍生物有敏感性的植物。通过向对异噁唑啉衍生物有敏感性的植物中导入上述gst,该植物能够获得对异噁唑啉衍生物的抗性。
其中,对异噁唑啉衍生物有敏感性的植物是指:在将异噁唑啉衍生物用作除草剂时的最佳浓度范围内生长受到抑制的植物。例如,当作为异噁唑啉衍生物的砜吡草唑的相关50%抑制浓度为200nm以下、优选100nm以下、更优选50nm以下时,可以作为对砜吡草唑有敏感性的植物。
更具体而言,作为对异噁唑啉衍生物有敏感性的植物,没有特别限制,可举出:稻、大麦、高粱、燕麦、硬质小麦、玉米等禾本科植物;油菜(brassicarapa)、甘蓝型油菜(brassicanapus)、卷心菜、油菜、羽衣甘蓝、白芥、萝卜、拟南芥等十字花科植物;苜蓿、芸豆、大豆、小豆、绿豆、三叶草等豆科植物;莳萝、茴香、欧芹等伞形科植物;菠菜、甜菜等苋科植物;罗勒等唇形科植物;红甜菜等藜科植物;欧洲李等蔷薇科植物;生菜等菊科植物;番茄等茄科植物;棉花等锦葵科植物。
对这些具体列举的植物导入上述gst,可以对该植物赋予对异噁唑啉衍生物的抗性,并且能够提高环境胁迫抗性。
尤其是上述gst在vlcfae抑制型的除草剂中对异噁唑啉衍生物的结合活性高,与i.cummins等人在plantmol.biol.52,591-603(2003)中报告的对异丙甲草胺的结合活性相比,在统计学上显著高。因此,可以将异噁唑啉衍生物用作vlcfae抑制型的除草剂中的除草剂,栽培导入有上述gst的转基因植物。
另外,导入有上述gst的转基因植物的环境胁迫抗性优异,因此即使在目前因环境胁迫导致生长不良的环境下也能栽培。导入有上述gst的转基因植物对环境胁迫中的高温胁迫尤其表现出优异的抗性。因此,导入有上述gst的转基因植物可以在目前气温高而不适宜生长的土地和时期进行栽培。
予以说明,本发明的转基因植物的制作方法没有特别限制,基本上可以通过以下方法来制作表达上述gst的转基因植物:将编码上述gst的核酸导入表达载体中,将得到的表达载体导入植物中。
表达载体构建为含有可在植物内表达的启动子,以及编码上述gst的核酸。作为表达载体的母体即载体,可以使用目前公知的各种载体。例如,可以使用质粒、噬菌体或粘粒等,可根据导入的植物细胞和导入方法适当选择。具体而言,例如可举出pbr322、pbr325、puc19、puc119、pbluescript、pbluescriptsk、pbi类的载体等。尤其是在向植物体中导入载体的方法是使用土壤杆菌的方法时,优选使用pbi类的二元载体。作为pbi类的二元载体,具体而言,例如可举出pbig、pbin19、pbi101、pbi121等。
启动子只要是能在植物体内使编码上述gst的核酸表达的启动子,就没有特别限制,可以适当使用公知的启动子。作为启动子,尤其优选使用在植物体内使下游基因恒常表达的恒常表达启动子。作为该启动子,例如可举出:花椰菜花叶病毒35s启动子(camv35s)、各种肌动蛋白基因启动子、各种泛素基因启动子、胭脂碱合成酶基因的启动子、烟草pr1a基因启动子、番茄的核酮糖1,5-二磷酸羧化酶/加氧酶小亚基基因启动子、napin基因启动子等。其中,可以更优选使用花椰菜花叶病毒35s启动子、肌动蛋白基因启动子或泛素基因启动子。使用上述各启动子,可以在导入植物细胞内时,强烈表达任意的基因。
另外,作为启动子,也可以使用具有在植物中部位特异性表达功能的启动子。作为这种启动子,可以使用目前公知的任何启动子。使用这种启动子,能够使上述gst部位特异性表达。
予以说明,表达载体除了含有启动子和编码上述gst的核酸外,还可以含有其他dna片段。该其他dna片段没有特别限制,可举出:终止子、筛选标记、增强子、用于提高翻译效率的碱基序列等。此外,上述表达载体还可以具有t-dna区域。尤其在使用土壤杆菌将上述重组表达载体导入植物体中时,t-dna区域可以提高基因导入的效率。
转录终止子只要具有转录终止位点的功能,就没有特别限制,可以是公知的。例如,具体而言,可以优选使用胭脂碱合成酶基因的转录终止区域(nos终止子)、花椰菜花叶病毒35s的转录终止区域(camv35s终止子)等。其中,可以更优选使用nos终止子。上述表达载体中,通过将转录终止子配置在适当的位置,可以防止在导入植物细胞中后合成不必要的长转录物的现象发生。
作为转化体筛选标记,例如可以使用药剂抗性基因。作为该药剂抗性基因的具体一例,例如可举出:针对潮霉素、博来霉素、卡那霉素、庆大霉素、氯霉素等的药剂抗性基因。由此,通过选择在含有上述抗生素的培养基中生长的植物体,能够容易地筛选转化的植物体。另外,作为转化体筛选标记,也可以使用对规定药剂赋予抗性的突变型乙酰乳酸合成酶基因。
表达载体的构建方法也没有特别限制,可以按照规定顺序,将上述启动子和编码上述gst的核酸,以及上述其他dna片段(如果需要)导入适当选择的母体载体中。例如,连接编码上述gst的核酸和启动子(根据需要,再连接转录终止子等),构建表达盒,将其导入载体中即可。表达盒的构建中,例如,可以事先将各dna片段的切割位点作为彼此互补的突出末端,用连接酶使其反应,由此规定该dna片段的顺序。予以说明,当表达盒中含有终止子时,从上游起,可以设为启动子、编码上述gst的核酸、终止子的顺序。另外,用于构建表达载体的试剂类,即限制酶和连接酶等的种类也没有特别限制,适宜选用市售品即可。
另外,上述表达载体的增殖方法(生产方法)也没有特别限制,可以使用目前公知的方法。一般将大肠杆菌作为宿主,使其在该大肠杆菌内增殖即可。此时,根据载体的种类,可以选择优选的大肠杆菌的种类。
上述表达载体可以利用一般的转化方法导入对象植物内。将表达载体导入植物细胞内的方法(转化方法)没有特别限制,可以根据植物细胞使用适当的目前公知的方法。具体而言,例如,可以利用使用土壤杆菌的方法和直接导入植物细胞内的方法。作为将表达载体直接导入植物细胞内的方法,例如可以使用微注射法、电穿孔法(electroporation)、聚乙二醇法、粒子枪法、原生质体融合法、磷酸钙法等。
另外,如果采用将dna直接导入植物细胞内的方法,只要是含有表达对象基因所需的转录单元(例如启动子和转录终止子)和编码上述gst的核酸的dna即可,表达功能不是必需的。而且,即使是没有转录单元,只含有上述gst的编码区域的dna,只要能整合到宿主的转录单元内,表达对象gst即可。
作为导入有含有上述表达载体,或不含表达载体而含有编码对象gst的核酸的表达盒的植物细胞,例如可举出:花、叶、根等植物器官中的各组织细胞、愈伤组织、悬浮培养细胞等。其中,表达载体可以根据要生产的植物体的种类而适当构建适合的载体,但也可以预先构建通用的表达载体,将其导入植物细胞中。
可以将转化所得的肿瘤组织和芽、毛状根等直接用于细胞培养、组织培养或器官培养,还可以使用目前公知的植物组织培养法,通过施用适当浓度的植物激素(生长素、细胞分裂素、赤霉素、脱落酸、乙烯、芸苔素内酯等)等而使植物体再生。
作为再生方法,可以采用将愈伤组织状的转化细胞移至激素种类、浓度改变的培养基进行培养,形成不定胚,得到完整植物体的方法。作为使用的培养基,可举出ls培养基、ms培养基等。
另外,本发明的转基因植物的含义也包括以下植物:将含有编码上述gst的核酸的表达载体导入宿主细胞中,得到转基因植物细胞,从该转基因植物细胞再生出转基因植物体,从得到的转基因植物体得到植物种子,从该植物种子得到后代植物。从转基因植物体得到植物种子,例如,从生根培养基采集转基因植物体,将其移植到放入有含水土壤的盆中,在一定温度下培育,形成花,最终形成种子。另外,从种子生产植物体,例如,在转基因植物体上形成的种子成熟后,将其分离,接种到含水土壤中,在一定温度、照度下培育,由此生产植物体。这样生产的植物会表达上述gst,因此表现出对异噁唑啉衍生物的抗性和对环境胁迫的抗性。
〔异噁唑啉衍生物〕
本发明中,异噁唑啉衍生物包括具有异噁唑啉骨架的化合物及其盐。关于异噁唑啉衍生物的除草活性,例如在日本特开平8-225548号公报、日本特开平9-328477号公报和日本特开平9-328483号公报等中有报告。即,这些已经报告的异噁唑啉衍生物可以用作除草剂。
另外,专利第4465133号公报公开了异噁唑啉衍生物中尤其具有除草效果以及作物与杂草间选择性的一组化合物。专利第4465133号公报所公开的异噁唑啉衍生物包括砜吡草唑(化合物名称:3-[5-(二氟甲氧基)-1-甲基-3-(三氟甲基)吡唑-4-基甲基磺酰基]-4,5-二氢-5,5-二甲基-1,2-噁唑)。
具体而言,专利第4465133号公报公开了以下(1)~(17)表示的异噁唑啉衍生物。
(1)一种具有通式[i]的异噁唑啉衍生物或其药学上可接受的盐:
[化1]
式中,
相同或不同的r1和r2表示氢原子、c1~c10烷基、c3~c8环烷基或c3~c8环烷c1~c3烷基,或者r1和r2一起与它们所结合的碳原子共同表示c3~c7的螺环;
相同或不同的r3和r4表示氢原子、c1~c10烷基或c3~c8环烷基,或者r3和r4一起与它们所结合的碳原子共同表示c3~c7的螺环;另外,r1、r2、r3和r4也可以与它们所结合的碳原子一起形成五元至八元环;
相同或不同的r5和r6表示氢原子或c1~c10烷基;
y表示具有选自氮原子、氧原子和硫原子的任意杂原子的五元至六元芳香族杂环基或芳香族杂缩合环基,这些杂环基可以用选自取代基组α的0~6个相同或不同的基团取代;另外,也可以形成两个相邻烷基、两个烷氧基、烷基和烷氧基、烷基和烷硫基、烷基和烷基磺酰基、烷基和单烷基氨基,或烷基和二烷基氨基结合而成且可以被1~4个卤素原子取代的五元至八元环;另外,当这些杂环基的杂原子为氮原子时,可以成为氧化的n-氧化物;
n表示0~2的整数;
以下取代基组中的“可以被取代的苯基、可以被取代的苯氧基、可以被取代的苯硫基、可以被取代的芳香族杂环基、可以被取代的芳香族杂环氧基、可以被取代的芳香族杂环硫基、可以被取代的苯基亚磺酰基、可以被取代的苯磺酰基、可以被取代的芳香族杂环磺酰基、可以被取代的苯磺酰氧基、可以被取代的苄基羰基、可以被取代的苯甲酰基、可以被取代的苄氧基羰基、可以被取代的苯氧基羰基、可以被取代的苄基羰氧基、可以被取代的苯甲酰氧基”中的“可以被取代”,表示该取代基可以用卤素原子、c1~c10烷基、c1~c4卤代烷基、c1~c10烷氧基烷基、c1~c10烷氧基、c1~c10烷硫基、c1~c10烷基磺酰基、酰基、c1~c10烷氧基羰基、氰基、氨基甲酰基(该基团的氮原子可以相同或不同地用c1~c10烷基取代)、硝基或氨基(该基团的氮原子可以相同或不同地用c1~c10烷基、c1~c6酰基、c1~c4卤代烷基羰基、c1~c10烷基磺酰基或c1~c4卤代烷基磺酰基)取代。
“取代基组α”
羟基、巯基、卤素原子、c1~c10烷基、用选自取代基β的任意基团单取代的c1~c10烷基、c1~c4卤代烷基、c3~c8环烷基、c1~c10烷氧基、用选自取代基组γ的任意基团单取代的c1~c10烷氧基、c1~c4卤代烷氧基、c3~c8环烷氧基、c3~c8环烷基c1~c3烷氧基、c1~c10烷硫基、用选自取代基组γ的任意基团单取代的c1~c10烷硫基、c1~c4卤代烷硫基、c2~c6烯基、c2~c6烯氧基、c2~c6炔基、c2~c6炔氧基、c1~c10烷基亚磺酰基、用选自取代基组γ的任意基团单取代的c1~c10烷基亚磺酰基、c1~c10烷基磺酰基、用选自取代基组γ的任意基团单取代的c1~c10烷基磺酰基、c1~c4卤代烷基亚磺酰基、用选自取代基组γ的任意基团单取代的c1~c10烷基磺酰氧基、c1~c4卤代烷基磺酰基、c1~c10烷基磺酰氧基、c1~c4卤代烷基磺酰氧基、可以被取代的苯基、可以被取代的苯氧基、可以被取代的苯硫基、可以被取代的芳香族杂环基、可以被取代的芳香族杂环氧基、可以被取代的芳香族杂环硫基、可以被取代的苯基亚磺酰基、可以被取代的苯磺酰基、可以被取代的芳香族杂环磺酰基、可以被取代的苯磺酰氧基、酰基、c1~c4卤代烷基羰基、可以被取代的苄基羰基、可以被取代的苯甲酰基、羧基、c1~c10烷氧基羰基、可以被取代的苄氧基羰基、可以被取代的苯氧基羰基、氰基、氨基甲酰基(该基团的氮原子可以相同或不同地用c1~c10烷基或可以被取代的苯基取代)、c1~c6酰氧基、c1~c4卤代烷基羰氧基、可以被取代的苄基羰氧基、可以被取代的苯甲酰氧基、硝基、氨基(该基团的氮原子可以相同或不同地用c1~c10烷基、可以被取代的苯基、c1~c6酰基、c1~c4卤代烷基羰基、可以被取代的苄基羰基、可以被取代的苯甲酰基、c1~c10烷基磺酰基、c1~c4卤代烷基磺酰基、可以被取代的苄基磺酰基或可以被取代的苯磺酰基取代)。
“取代基组β”
羟基、c3~c8环烷基(该基团可以用卤素原子或烷基取代)、c1~c10烷氧基、c1~c10烷硫基、c1~c10烷基磺酰基、c1~c10烷氧基羰基、c2~c6卤代烯基、氨基(该基团的氮原子可以相同或不同地用c1~c10烷基、c1~c6酰基、c1~c4卤代烷基羰基、c1~c10烷基磺酰基、c1~c4卤代烷基磺酰基取代)、氨基甲酰基(该基团的氮原子可以相同或不同地用c1~c10烷基取代)、c1~c6酰基、c1~c4卤代烷基羰基、c1~c10烷氧基亚氨基、氰基、可以被取代的苯基、可以被取代的苯氧基。
“取代基组γ”
c1~c10烷氧基羰基、可以被取代的苯基、可以被取代的芳香族杂环基、氰基、氨基甲酰基(该基团的氮原子可以相同或不同地用c1~c10烷基取代)。
(2)根据上述(1)所述的异噁唑啉衍生物,其中,可以用0~6个相同或不同的基团取代的杂环上的取代基组α为羟基、卤素原子、c1~c10烷基、用选自取代基β的任意基团单取代的c1~c10烷基、c1~c4卤代烷基、c3~c8环烷基、c1~c10烷氧基、用选自取代基组γ的任意基团单取代的c1~c10烷氧基、c1~c4卤代烷氧基、c3~c8环烷氧基、c3~c8环烷基c1~c3烷氧基、c1~c10烷硫基、用选自取代基组γ的任意基团单取代的c1~c10烷硫基、c1~c4卤代烷硫基、c2~c6烯基、c2~c6烯氧基、c2~c6炔基、c2~c6炔氧基、c1~c10烷基磺酰基、c1~c4卤代烷基磺酰基、可以被取代的苯基、可以被取代的苯氧基、可以被取代的苯硫基、可以被取代的芳香族杂环基、可以被取代的芳香族杂环氧基、可以被取代的芳香族杂环硫基、可以被取代的苯磺酰基、可以被取代的芳香族杂环磺酰基、c1~c6酰基、c1~c4卤代烷基羰基、可以被取代的苄基羰基、可以被取代的苯甲酰基、羧基、c1~c10烷氧基羰基、氰基、氨基甲酰基(该基团的氮原子可以相同或不同地用c1~c10烷基或可以被取代的苯基取代)、硝基、氨基(该基团的氮原子可以相同或不同地用c1~c10烷基、可以被取代的苯基、c1~c6酰基、c1~c4卤代烷基羰基、可以被取代的苄基羰基、可以被取代的苯甲酰基、c1~c10烷基磺酰基、c1~c4卤代烷基磺酰基、可以被取代的苄基磺酰基或可以被取代的苯磺酰基取代),或者,也可以形成两个相邻烷基、两个烷氧基、烷基和烷氧基、烷基和烷硫基、烷基和烷基磺酰基、烷基和单烷基氨基,或烷基和二烷基氨基结合而成且可以被1~4个卤素原子取代的五元至八元环。
(3)根据上述(2)所述的异噁唑啉衍生物,其中,可以用0~6个相同或不同的基团取代的杂环上的取代基组α为卤素原子、c1~c10烷基、c1~c4卤代烷基、c1~c10烷氧基c1~c3烷基、c3~c8环烷基(该基团可以用卤素原子或烷基取代)、c1~c10烷氧基、c1~c4卤代烷氧基、c3~c8环烷基c1~c3烷氧基、可以被取代的苯氧基、c1~c10烷硫基、c1~c10烷基磺酰基、酰基、c1~c4卤代烷基羰基、c1~c10烷氧基羰基、氰基或氨基甲酰基(该基团的氮原子可以相同或不同地用c1~c10烷基取代)。
(4)根据上述(1)、(2)或(3)所述的异噁唑啉衍生物,其中,相同或不同的r1和r2为甲基或乙基,r3、r4、r5和r6为氢原子。
(5)根据上述(1)、(2)、(3)或(4)所述的异噁唑啉衍生物,其中,y是具有选自氮原子、氧原子和硫原子的任意杂原子的五元或六元环的芳香族杂环基。
(6)根据上述(5)所述的异噁唑啉衍生物,其中,y是噻吩基、吡唑基、异噁唑基、异噻唑基、吡啶基或嘧啶基。
(7)根据上述(6)所述的异噁唑啉衍生物,其中,y是噻吩-3-基、吡唑-4-基、吡唑-5-基、异噁唑-4-基、异噻唑-4-基、吡啶-3-基或嘧啶-5-基。
(8)根据上述(7)所述的异噁唑啉衍生物,其中,y是噻吩-3-基,取代基组α必须取代在噻吩环的2位和4位。
(9)根据上述(7)所述的异噁唑啉衍生物,其中,y是吡唑-4-基,取代基组α必然取代吡唑环的3位和5位,并且用以下基团取代1位:氢原子、c1~c10烷基、用选自取代基组β的任意基团单取代的c1~c10烷基、c1~c4卤代烷基、c3~c8环烷基、c2~c6烯基、c2~c6炔基、c1~c10烷基亚磺酰基、c1~c10烷基磺酰基、用选自取代基组γ的任意基团单取代的c1~c10烷基磺酰基、c1~c4卤代烷基磺酰基、可以被取代的苯基、可以被取代的芳香族杂环基、可以被取代的苯磺酰基、可以被取代的芳香族杂环磺酰基、酰基、c1~c4卤代烷基羰基、可以被取代的苄基羰基、可以被取代的苯甲酰基、c1~c10烷氧基羰基、可以被取代的苄氧基羰基、可以被取代的苯氧基羰基、氨基甲酰基(该基团的氮原子可以相同或不同地用c1~c10烷基或可以被取代的苯基取代)、氨基(该基团的氮原子可以相同或不同地用c1~c10烷基、可以被取代的苯基、酰基、c1~c4卤代烷基羰基、可以被取代的苄基羰基、可以被取代的苯甲酰基、c1~c10烷基磺酰基、c1~c4卤代烷基磺酰基、可以被取代的苄基磺酰基或可以被取代的苯磺酰基取代)。
(10)根据上述(7)所述的异噁唑啉衍生物,其中,y是吡唑-5-基,取代基组α必须取代在吡唑环的4位,并且用以下基团取代1位:氢原子、c1~c10烷基、用选自取代基组β的任意基团单取代的c1~c10烷基、c1~c4卤代烷基、c3~c8环烷基、c2~c6烯基、c2~c6炔基、c1~c10烷基亚磺酰基、c1~c10烷基磺酰基、用选自取代基组γ的任意基团单取代的c1~c10烷基磺酰基、c1~c4卤代烷基磺酰基、可以被取代的苯基、可以被取代的芳香族杂环基、可以被取代的苯磺酰基、可以被取代的芳香族杂环磺酰基、酰基、c1~c4卤代烷基羰基、可以被取代的苄基羰基、可以被取代的苯甲酰基、c1~c10烷氧基羰基、可以被取代的苄氧基羰基、可以被取代的苯氧基羰基、氨基甲酰基(该基团的氮原子可以相同或不同地用c1~c10烷基或可以被取代的苯基取代)、氨基(该基团的氮原子可以相同或不同地用c1~c10烷基、可以被取代的苯基、酰基、c1~c4卤代烷基羰基、可以被取代的苄基羰基、可以被取代的苯甲酰基、c1~c10烷基磺酰基、c1~c4卤代烷基磺酰基、可以被取代的苄基磺酰基或可以被取代的苯磺酰基取代)。
(11)根据上述(7)所述的异噁唑啉衍生物,其中,y是异噁唑-4-基,取代基组α必须取代在异噁唑环的3位和5位。
(12)根据上述(7)所述的异噁唑啉衍生物,其中,y是异噻唑-4-基,取代基组α必须取代在异噻唑环的3位和5位。
(13)根据上述(7)所述的异噁唑啉衍生物,其中,y是吡啶-3-基,取代基组α必须取代在吡啶环的2位和4位。
(14)根据上述(7)所述的异噁唑啉衍生物,其中,y是嘧啶-5-基,取代基组α必须取代在嘧啶环的4位和6位。
(15)根据上述(1)~(14)中任一项所述的异噁唑啉衍生物,其中,n是整数2。
(16)根据上述(1)~(14)中任一项所述的异噁唑啉衍生物,其中,n是整数1。
(17)根据上述(1)~(14)中任一项所述的异噁唑啉衍生物,其中,n是整数0。
另外,专利第4299483号公报还公开了异噁唑啉衍生物中尤其具有除草效果以及作物与杂草间选择性的一组化合物。专利第4299483号公报所公开的异噁唑啉衍生物包括笨磺噁唑草(化合物名称:3-[(2,5-二氯-4-乙氧基苄基)磺酰基]-4,5-二氢-5,5-二甲基-1,2-噁唑)。
具体而言,专利第4299483号公报公开了以下(18)~(20)表示的异噁唑啉衍生物及其盐。
(18)一种由通式[i]表示的异噁唑啉衍生物及其盐。
[化2]
{式中,q表示基-s(o)n-(cr5r6)m-,n表示0~2的整数,m表示1~3的整数,彼此独立的r5和r6表示氢原子、氰基、烷氧基羰基或c1~c6烷基;
r1和r2表示氢原子、[可以用c3~c8环烷基、c1~c6烷氧基、c1~c6烷基羰基、c1~c6烷硫基、c1~c6烷基亚磺酰基、c1~c6烷基磺酰基、c1~c6烷基氨基、二(c1~c6烷基)氨基、氰基、c1~c6烷氧基羰基、c1~c6烷基氨基羰基、二(c1~c6烷基)氨基羰基、(c1~c6烷硫基)羰基、羧基、(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苄氧基、(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苯氧基或(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苯基取代的]c1~c8烷基、c3~c8环烷基、c1~c6烷氧基羰基、c1~c6烷基氨基羰基、二(c1~c6烷基)氨基羰基、(c1~c6烷硫基)羰基、羧基或(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苯基;或者,r1和r2可以与它们所结合的碳原子一起形成c3~c7的螺环;
其中,r1和r2不同时为氢原子;
r3和r4表示氢原子、(可以用相同或不同的1~3个卤素原子、c3~c8环烷基或c1~c6烷氧基取代的)c1~c8烷基或c3~c8环烷基;r3和r4可以与它们所结合的碳原子一起形成c3~c7的螺环;或者r1、r2、r3和r4可以与它们所结合的碳原子一起形成五元至八元环;
y表示氢原子、c1~c6烷氧基羰基、c2~c6烯基、[可以用相同或不同的1~3个卤素原子、c1~c6烷氧基、c2~c6烯氧基、c2~c6炔氧基、(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苄氧基、c1~c6烷氧基羰基、羧基、羟基或甲酰基取代的]c1~c10烷基或(用1~5个相同或不同的r7取代的)苯基;
r7表示氢原子、[可以用相同或不同的1~3个卤素原子、c1~c6烷氧基、羟基、c1~c6烷硫基、c1~c6烷基亚磺酰基、c1~c6烷基磺酰基、c1~c6烷基氨基、二(c1~c6)烷基氨基、氰基或(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苯氧基取代的]c1~c6烷基、(可以用相同或不同的1~3个卤素原子、c1~c6烷氧基、c2~c6烯基、c2~c6炔基、c1~c6烷氧基羰基、c1~c6烷基羰基或c3~c8环烷基取代的)c1~c6烷氧基、c2~c6烯基、c3~c8环烷氧基、(可以用相同或不同的1~3个卤素原子或c1~c6烷氧基取代的)c1~c6烷硫基、(可以用相同或不同的1~3个卤素原子或c1~c6烷氧基取代的)c1~c6烷基亚磺酰基、(可以用相同或不同的1~3个卤素原子或c1~c6烷氧基取代的)c1~c6烷基磺酰基、(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苄氧基、(c1~c6烷基、c1~c6烷基磺酰基、c1~c6烷基羰基(c1~c6烷基)基或c1~c6烷基磺酰基(c1~c6烷基)基取代的)氨基、二(c1~c6烷基)氨基、卤素原子、氰基、硝基、c1~c6烷氧基羰基、c3~c8环烷氧基羰基、羧基、c2~c6链烯氧基羰基、c2~c6炔氧基羰基、(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苄氧基羰基、(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苯氧基羰基或c1~c6烷基羰氧基。}
(19)一种由上述(18)中的通式[i]表示的异噁唑啉衍生物及其盐。
{式中,q表示基-s(o)n-(cr5r6)m-,n表示0~2的整数,m表示1,r5和r6表示氢原子;
r1和r2表示氢原子、(可以用c3~c8环烷基或c1~c6烷氧基取代的)c1~c8烷基或c3~c8环烷基;或者,r1和r2可以与它们所结合的碳原子一起形成c3~c7的螺环;
其中,r1和r2不同时为氢原子;
r3和r4表示氢原子或(可以用相同或不同的1~3个卤素原子、c3~c8环烷基或c1~c6烷氧基取代的)c1~c8烷基;r3和r4可以与它们所结合的碳原子一起形成c3~c7的螺环;或者r1、r2、r3和r4可以与它们所结合的碳原子一起形成五元至八元环;
y表示(用1~5个相同或不同的r7取代的)苯基;
r7表示氢原子、[可以用相同或不同的1~3个卤素原子、c1~c6烷氧基、羟基、c1~c6烷硫基、c1~c6烷基亚磺酰基、c1~c6烷基磺酰基、c1~c6烷基氨基、二(c1~c6)烷基氨基、氰基或(1~5个的卤素原子、c1~c6烷基或c1~c6烷氧基可以被取代的)苯氧基取代的]c1~c6烷基、(可以用相同或不同的1~3个卤素原子、c1~c6烷氧基、c2~c6烯基、c2~c6炔基、c1~c6烷氧基羰基、c1~c6烷基羰基或c3~c8环烷基取代的)c1~c6烷氧基、c3~c8环烷氧基或卤素原子。}
(20)一种由上述(18)中的通式[i]表示的异噁唑啉衍生物及其盐。
{式中,q表示基-s(o)n-(cr5r6)m-,n表示0~2的整数,m表示1,r5和r6表示氢原子;
r1和r2表示c1~c8烷基;
r3和r4表示氢原子;
y表示(用1~5个相同或不同的r7取代的)苯基;
r7表示氢原子、(可以用相同或不同的1~3个卤素原子或c1~c6烷氧基取代的)c1~c6烷基、(可以用相同或不同的1~3个卤素原子或c1~c6烷氧基取代的)c1~c6烷氧基或卤素原子。}
上述gst对这些已经报告的异噁唑啉衍生物有结合活性。因此,导入上述gst而形成的转基因植物对这些已经报告的异噁唑啉衍生物有抗性。
其中,上述gst对专利第4465133号公报公开的异噁唑啉衍生物(具体为上述(1)~(17)的异噁唑啉衍生物)和专利第4299483号公报公开的异噁唑啉衍生物(具体为上述(18)~(20)的异噁唑啉衍生物)有优异的结合活性。因此,导入上述gst而形成的转基因植物对专利第4465133号公报公开的异噁唑啉衍生物和专利第4299483号公报公开的异噁唑啉衍生物有更加优异的抗性。
另外,上述gst对砜吡草唑和笨磺噁唑草有更加优异的结合活性。因此,导入上述gst而形成的转基因植物对砜吡草唑和笨磺噁唑草有更加优异的抗性。
当将上述异噁唑啉衍生物用作除草剂时,可以防除除了导入有上述gst的转基因植物以外的各种杂草生长。作为这种杂草,没有特别限制,例如以稗草、马唐、狗尾草、早熟禾、石茅、看麦娘、野生燕麦等禾本科杂草为代表,可举出:大犬蓼、野苋菜、白藜、繁缕、苘麻、刺金午时花、田菁、豚草、牵牛花的阔叶杂草、莎草、油莎草、无刺鳞水蜈蚣、具芒碎米莎草、碎米莎草等多年生和一年生莎草科杂草。另外,当将异噁唑啉衍生物作为除草剂用于水田时,能够以低药量在发芽前至生长期的宽广范围内防除稗草、异型莎草、鸭舌草、陌上菜等一年生杂草和水莎草、欧菱、萤蔺等多年生杂草。
实施例
下面通过实施例进一步详细地说明本发明,但本发明的技术范围并不限于以下实施例。
〔实施例1〕
本实施例中,对于小麦的gst中确定为登录号:q8gtc0的gst(本实施例中称为taq8gtc0),分析对vlcfae抑制型除草剂的谷胱甘肽结合活性。
<taq8gtc0蛋白的大肠杆菌表达构建体的构建>
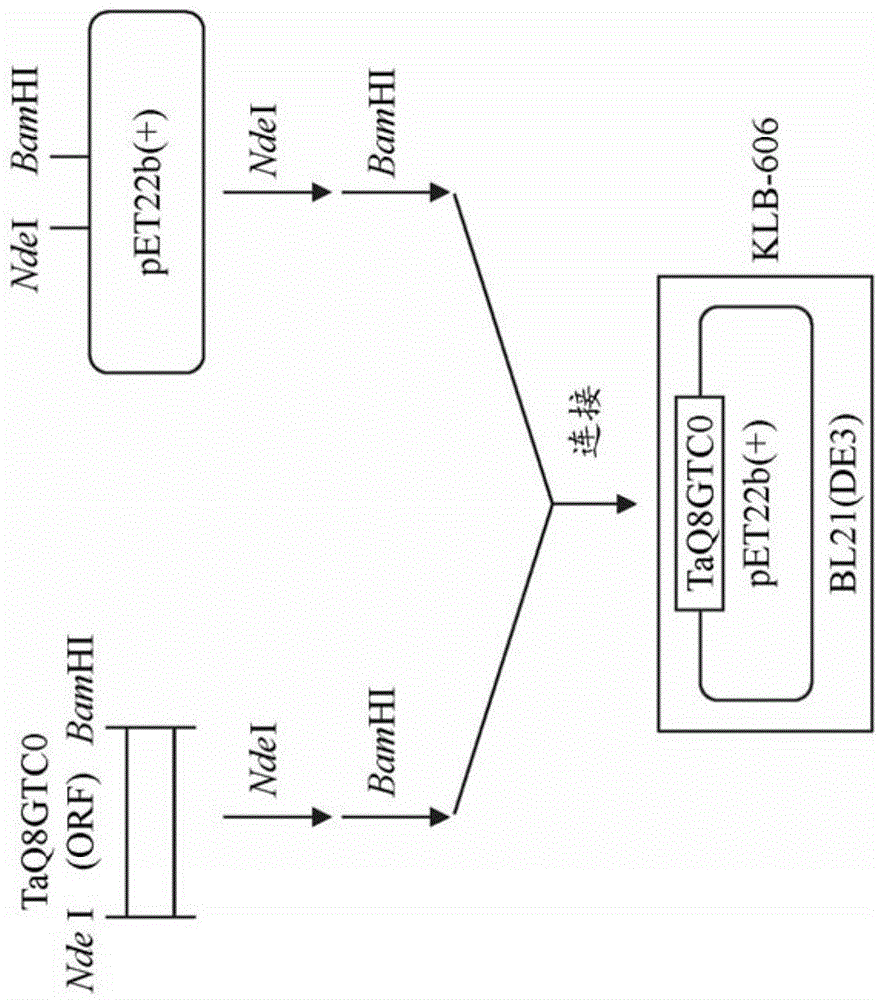
图1表示构建taq8gtc0蛋白的大肠杆菌表达构建体的结构。首先,将从小麦(农林61号)茎叶部制备的rna作为模板进行反转录反应,由此合成cdna。将得到的cdna作为模板,利用taq8gtc0-h(seqidno:3)和taq8gtc0-d(seqidno:4)的引物组进行pcr,得到在5’末端添加有ndei识别位点、在3’末端添加有bamhi识别位点的taq8gtc0基因的基因片段。
然后,将得到的taq8gtc0基因片段进行ndei和bamhi处理,将处理后的taq8gtc0基因片段作为插入片段,将同样经过ndei和bamhi处理的pet22b(+)作为载体。使用这些插入片段和载体进行连接反应。使用连接反应后的反应液,将反应液所含有的载体导入大肠杆菌jm109株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒。通过序列分析,确认存在于ndei和bamhi切割位点之间的taq8gtc0基因的碱基序列没有pcr导致的错误。将得到的质粒导入大肠杆菌bl21(de3)株中,构建表达taq8gtc0蛋白的大肠杆菌表达构建体(klb-606)。
<taq8gtc0蛋白的制备>
使用制作的大肠杆菌bl21(de3)株(klb-606),进行taq8gtc0蛋白的表达。将单菌落接种到含50ppm氨苄青霉素的lb液体培养基中后,将在试管中振荡培养过夜的溶液用作预培养液。将2.5ml预培养液添加到250ml的含50ppm氨苄青霉素的lb液体培养基(1l锥形烧瓶)中,在37℃下以200rpm培养至od600=0.5~0.6。接着,在冰上冷却5分钟,然后添加iptg,使最终浓度为1mm,在27℃下以200rpm进行21小时的taq8gtc0蛋白表达诱导后,收集细菌(在4℃下以6000×g离心10分钟),在-80℃下保存菌体。向冻存的菌体(0.5l培养量)添加30ml的pbs缓冲液(0.14mnacl、2.7mmkcl、10mmna2hpo4、1.8mmkh2po4,ph7.3),进行超声波处理(taitecvp-30s、微型芯片、输出3、15秒常数×7~8次)后,在4℃下以15,000×g离心20分钟,得到上清液。以1ml/min的流速将该粗酶溶液加载于用pbs缓冲液平衡的gstrap4b柱(床体积1ml),用20ml以上的pbs缓冲液洗涤谷胱甘肽亲和柱后,将2ml洗脱缓冲液(50mmtris-hcl、10mm还原型谷胱甘肽、ph8.0)注入到柱,将taq8gtc0蛋白洗脱(图2)。通过使用nanosep(10k)的超滤,将该蛋白质溶液置换成pbs缓冲液,在-80℃下保存。予以说明,蛋白质的浓度测定利用bradford方法,按照takarabradford蛋白浓度测定试剂盒(takara)的手册进行。予以说明,图2中,m是分子量标记。此外,图2的结果中,在粗酶和流穿物(flow-through)组分的泳道将8.0μg总蛋白质上样。予以说明,粗酶是将菌体进行超声波处理后离心而成的上清液,流穿物(flow-through)是粗酶液加载到亲和柱过程中采集的溶液。
<对vlcfae抑制型除草剂的谷胱甘肽结合活性的分析>
本实施例使用的所有vlcfae抑制型除草剂作为丙酮溶液添加到反应体系中。对vlcfae抑制型除草剂的结合反应在含有50μl的100mm磷酸钾缓冲液(ph6.8)、10μl的1mmvlcfae抑制型除草剂、20μl的10mm还原型谷胱甘肽(ph7.0)、6μl的taq8gtc0蛋白(总378ng、pbs缓冲溶液)、114μl的pbs缓冲液的总200μl的系统中进行,在30℃下反应15分钟后,将50μl使用0.2μm过滤器过滤的溶液注入到hplc中。下面示出hplc分析条件。
设备:agilent1100系列
色谱柱:capcellpakc18aq4.6mmi.d.×250mm(资生堂)
流动相:乙腈/水=5/95(保持5分钟)→(4分钟)→40/60(保持4分钟)→(4分钟)→90/10(保持8分钟)→(1分钟)→5/95(保持4分钟)(各溶剂含有0.5%乙酸)
温度:35℃
流速:1.0ml/min
检测:254nm
<结果与考察>
将用于taq8gtc0蛋白的谷胱甘肽结合活性试验的vlcfae抑制型除草剂示于图3。在分析对各vlcfae抑制型除草剂的谷胱甘肽结合活性时,根据反应液中vlcfae抑制型除草剂的减少量,求出谷胱甘肽结合物(gs结合物)的生成量。将taq8gtc0蛋白对各vlcfae抑制型除草剂的谷胱甘肽结合活性示于表1。
[表1]
a)酶活性在砜吡草唑中用7个的平均±标准偏差表示,在其他药剂中则用4个的平均±标准偏差表示。
b)检测极限以下
予以说明,作为一例,砜吡草唑和谷胱甘肽的结合反应,以及将砜吡草唑用作vlcfae抑制型除草剂时的hplc图示于图4。予以说明,图4所示的hplc图的上段表示含有taq8gtc0蛋白的谷胱甘肽结合活性试验的结果,中段表示不含taq8gtc0蛋白的谷胱甘肽结合活性试验的结果,下段表示不含taq8gtc0蛋白和谷胱甘肽的谷胱甘肽结合活性试验的结果。
如表1所示,可知taq8gtc0蛋白对vlcfae抑制型除草剂中具有异噁唑啉骨架的砜吡草唑和笨磺噁唑草的结合活性特异性地高。而对于具有除异噁唑啉骨架以外的结构的vlcfae抑制型除草剂,taq8gtc0蛋白的谷胱甘肽结合活性明显地低。另外,如图4所示,使用砜吡草唑的系统中,在酶添加区域确认到砜吡草唑的gs结合物(m-15)的波峰。这表示,在添加到反应体系的砜吡草唑的总量10nmol内,相当于4.81nmol的量成为gs结合物。
予以说明,本实施例中,对唑草胺的结合活性是通过定量因本剂的谷胱甘肽结合而游离的化合物来求出的。另外,由于8种药剂(异丙甲草胺、甲草胺、氟噻草胺、苯噻草胺、四唑酰草胺、茚草酮、莎稗磷、哌草磷)的谷胱甘肽结合物的波峰不清楚,因此在分析这些药剂的谷胱甘肽结合活性时,要先改变反应条件(增加添加到反应体系中的酶量,或延长反应时间),生成谷胱甘肽结合物(gs结合物),用lc/ms鉴定波峰。
〔实施例2〕
本实施例中,制作导入有taq8gtc0基因的转基因稻,对该转基因稻对vlcfae抑制型除草剂的敏感性进行试验。
<转基因稻的制作>
本实施例中,如图5所示,制作taq8gtc0基因的稻转化用载体(r-5-taq8gtc0)。
具体而言,首先,将从小麦(农林61号)茎叶部制备的rna作为模板进行反转录反应,由此合成cdna。将得到的cdna作为模板,利用taq8gtc0-m(seqidno:5)、taq8gtc0-n(seqidno:6)的引物组进行pcr,得到在5’末端添加有sali识别位点、在3’末端添加有noti识别位点的taq8gtc0基因的基因片段。
然后,将得到的taq8gtc0基因片段进行sali和noti处理,将处理后的taq8gtc0基因片段作为插入片段,将同样经过sali和noti处理的pentr-1a(thermofisherscientificinc.)作为载体。使用这些插入片段和载体进行连接反应。通过转化,将这样制作的入门克隆(entryclone)(pentr1a-taq8gtc0)导入大肠杆菌jm109株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒。通过序列分析,确认存在于sali和noti切割位点之间的taq8gtc0基因的碱基序列没有pcr导致的错误。
接着,进行制作的入门克隆(entryclone)(pentr1a-taq8gtc0)(klb-649)和目的载体palselectr-5(inplantainnovationsinc.)的lr反应,通过转化,将制作的表达载体(在palselectr-5的attb序列间插入taq8gtc0基因而形成的稻转化用载体)导入大肠杆菌hst02株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒,通过序列分析,确认到在attb序列间插入的taq8gtc0基因的碱基序列正确(klb-650)。
<通过转化将taq8gtc0基因导入稻中>
利用电穿孔法将制作的稻转化用载体klb-650(palselectr-5-taq8gtc0)导入土壤杆菌(eha105)中(klb-654)。接着,通过土壤杆菌法(s.tokiplantmol.biol.rep.1516-21(1997))将taq8gtc0基因导入稻培养细胞中,然后用双草醚(bs)进行筛选。
通过转化,将taq8gtc0基因导入稻中,然后在1个月内用0.25μm双草醚(bs)筛选导入有taq8gtc0基因的稻培养细胞,则以与klb-279(导入gfp基因而不是taq8gtc0基因的阳性对照)相同的方式确认在选择培养基中生长的重组稻培养细胞(图6)。然后,将这些转基因稻培养细胞移植到未添加药剂的再分化培养基中后,依次在隔离温室中栽培得到的植物体。从开始在隔离温室栽培起,平均两个月在所有植物体上确认到抽穗,从这些植物体中采集后代种子(t1)。<导入有taq8gtc0基因的稻的砜吡草唑抗性>
将结冷胶作为培养基,通过发芽生长抑制试验来考察18个系统对砜吡草唑的抗性。
将hoaglandmix和3g结冷胶悬浮于1l蒸馏水中,然后用微波炉加热,使其充分溶解。在未冷却前,将15ml溶液注入到管瓶中(向培养皿中注入30ml)。在调制药剂时,在向管瓶或培养皿注入时添加并充分混合。将未脱壳稻米在稀释了50倍的次氯酸钠溶液(安替福民)(wako)中浸泡20分钟左右,然后用水充分洗涤。将经过灭菌处理的种子浸泡在蒸馏水中,在27℃下静置,直至催芽(约2天)。将催芽种子芽朝上,轻轻埋入含有0.25μm的bs的结冷胶培养基(培养皿)。将它们和放入了蒸馏水的烧杯一起放入到透明容器内,用保鲜膜覆盖,在27℃、荧光灯照明下(明期14小时,暗期10小时)培育2天。然后,将以根部的延长为指标判断为具有bs抗性的稻种子移植到含有砜吡草唑(最终浓度10-8、10-7、10-6、10-5m)的结冷胶培养基(管瓶)中。接着,将它们和放入了蒸馏水的烧杯一起放入到透明容器内,用保鲜膜覆盖,在27℃、荧光灯照明下(明期14小时,暗期10小时)培育4~5天,之后测定株高。药剂的抑制以株高为指标,计算对未添加药剂区的生长抑制率,生长抑制50%浓度(i50值)利用probit法求出。
将上述导入有taq8gtc0基因的稻对砜吡草唑抗性的试验结果示于表2。
[表2]
表2中,1)是i50(重组稻)/i50(野生型稻)的值。如表2所示,用于试验的18个系统内,16个系统与野生型相比,对砜吡草唑表现出10倍以上的抗性,在最强的系统(#3-13)中确认到约350倍的抗性。
<抑制野生型稻生长的vlcfae抑制型除草剂的最小浓度的确定>
导入有taq8gtc0基因的稻是否具有药剂抗性,是以其与野生型稻的敏感性差为指标判断的,因此利用以下方法进行野生型稻(日本晴)对用于谷胱甘肽结合活性试验的vlcfae抑制型除草剂的敏感性试验。
将结冷胶作为培养基,进行发芽生长抑制试验。将hoaglandmix和3g结冷胶悬浮于1l蒸馏水中,然后用微波炉加热,使其充分溶解。在未冷却前,将15ml溶液注入到管瓶中。在调制药剂(丙酮溶液)时,在向管瓶注入时添加并充分混合(最终丙酮浓度为0.1%)。将未脱壳稻米在稀释了50倍的次氯酸钠溶液(安替福民)(wako)中浸泡20分钟左右,然后用水充分洗涤。将经过灭菌处理的种子浸泡在蒸馏水中,在27℃下静置,直至催芽(约2天)。将催芽种子芽朝上,移植到含药剂的结冷胶培养基(管瓶)。接着,将它们和放入了蒸馏水的烧杯一起放入到透明容器内,用保鲜膜覆盖,在27℃、荧光灯照明下(明期14小时,暗期10小时)培育1周,之后将植物体采样,测定株高。药剂的抑制以株高为指标,计算对未添加药剂区的生长抑制率,生长抑制50%浓度(i50值)利用probit法求出。
进行野生型稻(日本晴)对用于谷胱甘肽结合活性试验的vlcfae抑制型除草剂的敏感性试验。将由试验结果知晓的各药剂对野生型稻的生长的i50值和抑制生长的最小浓度示于表3。
[表3]
<导入有taq8gtc0基因的稻对vlcfae抑制型除草剂的抗性试验>
利用与上述砜吡草唑抗性试验相同的方法,进行导入有taq8gtc0基因的稻对vlcfae抑制型除草剂的抗性试验。本示例中,如表4所示,在完全抑制野生型稻植物体(日本晴)生长的最小浓度(×1)、最小浓度的4倍浓度(×4)、最小浓度的16倍浓度(×16)共三种浓度下,进行对vlcfae抑制型除草剂的抗性试验。
[表4]
表4中,a)表示抑制野生型稻(日本晴)生长的最小浓度,b)表示a)的4倍浓度,c)表示a)的16倍浓度。
本示例中,将日本晴作为比较对照,使用对砜吡草唑表现出强抗性的#3-13系统的导入有taq8gtc0基因的稻。将结果示于图7-1~图7-6。予以说明,图7-1~图7-6中,自左起,依次表示药剂浓度0μm、表4的最小浓度(×1)、表4的最小浓度的4倍浓度(×4)、表4的最小浓度的16倍浓度(×16)。
砜吡草唑和笨磺噁唑草处理区中(图7-1),即使在试验的最高浓度(最小浓度的16倍浓度)下也未看到对导入有taq8gtc0基因的稻的生长的影响,表现出强抗性;而在6种药剂(氟噻草胺、莎稗磷、哌草磷、唑草胺、茚草酮、四唑酰草胺)的处理区中(图7-2~图7-4),即使在最小浓度下生长也受到抑制,导入有taq8gtc0基因的稻未对这些药剂表现出抗性。另外,关于3种药剂(异丙甲草胺、甲草胺、苯噻草胺),在最小浓度下未看到对生长的影响,但在最小浓度的4倍浓度(×4)下生长受到了抑制,因此导入有taq8gtc0基因的稻对这3种药剂的抗性未达到实用水平,非常弱(图7-5和图7-6)。
予以说明,虽然数据没有公开,但对砜吡草唑表现出与#3-13系统同样强的抗性的#4-7系统,其对各种药剂的敏感性的强度与#3-13相同。
由此可见,导入有taq8gtc0基因的稻对vlcfae抑制型除草剂中的异噁唑啉类除草剂表现出特异性的抗性。另外,本重组稻的药剂抗性与taq8gtc0蛋白的谷胱甘肽结合活性大致相关。
〔实施例3〕
本实施例中,制作导入有taq8gtc0基因的转基因拟南芥,对该转基因拟南芥对vlcfae抑制型除草剂的敏感性进行试验。
<转基因拟南芥的制作>
首先,如图8所示,制作具有taq8gtc0基因的拟南芥转化用载体(a-3-taq8gtc0)。具体而言,进行在pentr-1a(thermofisherscientificinc.)的attl1和attl2之间插入taq8gtc0基因(orf)的入门克隆(entryclone)(pentr1a-taq8gtc0,klb-649)与目的载体palselecta-3(inplantainnovationsinc.)的lr反应,由此制作拟南芥转化用载体。该拟南芥转化用载体在palselecta-3的attb序列间插入有taq8gtc0基因。接着,通过转化,将制作的拟南芥转化用载体导入大肠杆菌hst02株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒,通过序列分析,确认到在attb序列间插入的taq8gtc0基因的碱基序列正确(klb-707)。
<通过转化将taq8gtc0基因导入拟南芥中>
利用电穿孔法将如上制作的拟南芥转化用载体(palselecta-3-taq8gtc0)导入土壤杆菌(eha105)中(klb-718)。接着,通过floraldip法(s.j.clough等plantj.16735-743(1998))将taq8gtc0基因导入拟南芥中,然后用双草醚(bs)进行筛选。
<确认基因向转基因拟南芥的导入>
使用ampdirectplus样品溶解液(岛津)[20mmtris-hcl(ph8.0)、5mmedta、400mmnacl、0.3%sds、200μg/ml蛋白酶k],简单地从如上得到的转基因拟南芥植物体制备基因组dna。将其作为模板,使用kapa3gdna聚合酶(kapabiosystems),在以下条件下利用pcr确认基因导入。
pcr用总50μl的反应体系(0.4μl模板、0.3μl50μm正义引物(序列(taq8gtc0)-2:seqidno:7)、0.3μl50μm反义引物(noster-13:seqidno:8)、25μlkapa植物pcr缓冲液、0.4μlkapa3gdna聚合酶、23.6μl灭菌水)进行。关于pcr,初始变性:在95℃下进行20秒;变性:在95℃下进行20秒;退火:在58℃下进行15秒;延长:在72℃下进行30秒(40个循环);最终延长:在72℃下进行4分钟。
另外,使用导入有拟南芥转化用载体(palselecta-3-taq8gtc0)的土壤杆菌(klb-718),通过转化向拟南芥导入taq8gtc0基因。然后,将从进行了转化的拟南芥植物体采集的种子(全部约50,000粒)接种到含有0.1μm的bs的选择培养基,以有无筛选标记(w574l/s653i突变型拟南芥als)为指标,筛选转化体。结果,全部30个个体有生长(图9)。予以说明,图9所示的照片表示自接种起14天后的样子,表示在选择培养基生长的全部30个个体的转化体内的3个个体。然后,从中选取10个个体,将从它们的叶子中简易提取的基因组dna作为模板进行pcr,结果确认到目的小麦gst基因的导入。予以说明,图10中,泳道1~10表示从在选择培养基中生长的全部30个个体中选取10个个体,将从各个体简易提取的基因组dna作为模板进行pcr的结果。pcr用上述序列(taq8gtc0)-2和noster-13的引物组扩增区域a(563bp)。另外,在图10的电泳照片中,左端的泳道为100bpdnaladder。
<导入有taq8gtc0基因的拟南芥的砜吡草唑抗性试验>
为了考察导入有taq8gtc0基因的拟南芥的砜吡草唑抗性,如下制作了培养基。首先,将murashige-skoog(ms)培养基(1袋)、盐酸硫胺素(3mg)、烟酸(5mg)、盐酸吡哆辛(0.5mg)、蔗糖(10g)添加到1l烧杯中,将ph值调节至5.7,定容至1l,然后添加8g(0.8%)的琼脂。将其高压灭菌后,冷却至室温,添加砜吡草唑(丙酮溶液)。将30ml溶液分注到角形2号培养皿,准备含有规定浓度的砜吡草唑的ms培养基。
使用这些培养基,利用以下方法进行转基因拟南芥的砜吡草唑敏感性试验。将所需量的拟南芥干燥种子在70%乙醇中搅拌2分钟,在次氯酸(0.02%triton-x-100)中搅拌15分钟,用灭菌水洗涤10次。接着,将种子悬浮于高压灭菌后的0.1%琼脂溶液1ml中,充分混合该溶液使其均匀,在培养基表面播种每一粒种子,共30粒。用医用胶带密封,在4℃下放置2天后,移至22℃下使其发芽。
将野生型拟南芥(columbia-0)的相关试验结果示于图11,将导入有taq8gtc0基因的拟南芥的相关试验结果示于图12。予以说明,图11、12所示的照片是在22℃下培育14天以后的拍摄的照片。
如图11所示,野生型拟南芥在100nm的砜吡草唑浓度下生长略微受到抑制,在1μm以上的浓度下则基本完全受到抑制。与此相对,如图12所示,可知导入有taq8gtc0基因的拟南芥在1μm的砜吡草唑浓度下,与未添加药剂区(对照组)同样地生长,不仅如此,即使在10μm的浓度下,虽然确认到与1μm相比生长略微受到抑制,但生长得较为充分,表现出对砜吡草唑的强抗性。本示例用于试验的全部7系统的导入有taq8gtc0基因的拟南芥,与野生型(columbia-0)相比,至少表现出10倍的砜吡草唑抗性。予以说明,图12表示表现出特别强的抗性的转基因拟南芥(klb-7181-1-5)的结果。由这些结果可知,小麦gst(taq8gtc0)在拟南芥中也能发挥功能,赋予对砜吡草唑的抗性。
<拟南芥植物体对vlcfae抑制型除草剂的敏感性试验>
本示例中,利用与上述导入有taq8gtc0基因的拟南芥的砜吡草唑抗性试验相同的方法,进行野生型拟南芥对vlcfae抑制型除草剂的敏感性试验。
首先,将确定强烈抑制野生型拟南芥生长的vlcfae抑制型除草剂浓度的结果示于表5。
[表5]
接着,采用这些试验浓度,考察导入有taq8gtc0基因的拟南芥对vlcfae抑制型除草剂的药剂敏感性。将结果示于图13、14。予以说明,图13、14所示的照片是在22℃下培育14天以后的拍摄的照片。由图13、14可知,导入有taq8gtc0基因的拟南芥(将抗性最强的klb-7181-1-5用于试验)对异噁唑啉类的砜吡草唑和笨磺噁唑草表现出强抗性(图13)。另一方面,关于其他9种药剂,导入有taq8gtc0基因的拟南芥的生长与野生型同样地受到了强烈抑制(图13、14)。
由以上结果可知,导入有taq8gtc0基因的拟南芥对异噁唑啉类除草剂表现出特异性的抗性。另外,导入有taq8gtc0基因的拟南芥的药剂抗性与taq8gtc0蛋白对药剂的谷胱甘肽结合活性大致相关。
〔实施例4〕
本实施例中,对导入有taq8gtc0基因的转基因稻对高温胁迫的抗性进行试验。
首先,通过与导入有taq8gtc0基因的稻的砜吡草唑抗性试验相同的方法,将根据根部在结冷胶培养基(培养皿)的延长来判断其具有bs抗性的导入有taq8gtc0基因的稻种子移植到塑料杯中(日本晴则是将在未添加bs的结冷胶培养基中生长的个体移植到塑料杯中)。在隔离温室中培育1周后,进行高温处理(50℃,2.5小时),再在隔离温室中培育1周,测定稻的株高和根重。予以说明,本实施例使用实施例2中制作的导入有taq8gtc0基因的稻中的#4-7和#3-13。
总共3次试验中得到了相同的结果,因此将其中1次的试验结果示于图15。由试验结果可知,关于株高和根重,与日本晴相比,导入有taq8gtc0基因的稻因高温处理而受到的影响小,制作的导入有taq8gtc0基因的稻具有高温胁迫抗性。
〔比较例1〕
本比较例中,关于在实施例1~4中和与对异噁唑啉衍生物的抗性和对高温胁迫的抗性相关的taq8gtc0具有高同源性的其他植物gst,分析砜吡草唑代谢活性。
具体而言,图16示出了taq8gtc0、与该taq8gtc0具有高同源性且来自小麦和玉米的gst的11种分子、对相同作用的异丙甲草胺具有代谢活性的来自稻的gst的3种分子(i.cummins等plantmol.biol.52,591-603(2003)、b.mcgonigle等plantphysiol.124,1105-1120(2000)、h.y.cho等pestic.biochem.physiol.83,29-36(2005)、h.y.cho等pestic.biochem.physiol.86,110-115(2006)和h.y.cho等j.biochem.mol.biol.40,511-516(2007))共14种植物gst。本示例中,制作分别导入有这些植物gst基因的稻培养细胞,验证其对砜吡草唑有无抗性。予以说明,图16中,括号内的数字表示相对于小麦gst(taq8gtc0)的氨基酸序列的同源性。
具体而言,对于7种基因,以在含有砜吡草唑的培养基中液体培养的稻培养细胞的脂肪酸含量为指标,分析有无代谢活性;对于2种基因,则以稻培养细胞在含有药剂的培养皿上的增殖为指标,分析有无代谢活性。
<以稻培养细胞中的脂肪酸含量为指标的砜吡草唑代谢活性的分析>
首先,如图17所示,制作稻转化用载体。本示例中,通过从稻(日本晴)、小麦(农林61号)和玉米(pioneer32k61)茎叶部制备的rna的反转录反应,分别制备cdna。将得到的cdna作为模板,利用pcr将在5’末端添加有xbai、在3’末端添加有aflii限制酶位点的各gst基因全长扩增。然后,将它们的3’末端进行aflii处理,利用t4dna聚合酶平滑化,将5’末端进行xbai处理。接着,将在palselectr-4(inplantainnovationsinc.)的mcs区域导入有csp(稻愈伤组织特异性启动子:genelocusos10g0207500)::gus::nost的构建体的klb-224进行saci处理,之后利用t4dna聚合酶平滑化并进行xbai处理,作为载体片段。
将上述gst基因片段和载体片段连接,通过转化将制作的载体导入大肠杆菌(hst-02株)中。将一部分转化反应液涂抹在含50ppm奇霉素的lb固体培养基中,在37℃下培养过夜,通过将生长的多个菌落作为模板的pcr,选择导入有目的载体的菌落。将该菌落接种到含50ppm奇霉素的ym液体培养基中,在37℃下培养过夜,从菌体中制备质粒。接着,进行测序反应,分析插入载体中的目的基因的所有序列和5’、3’这两个末端部分的碱基序列。下面示出制作插入有各gst基因的稻转化用载体时所使用的引物的碱基序列。
对来自稻的osgstf5使用以下引物组。
osgstf5-1:5’-aaaaaatctagaaaagtgcagggcaaattc-3’(有义:seqidno:9)
osgstf5-2:5’-aaaaaacttaagctatggtatgttcccact-3’(反义:seqidno:10)
对来自稻的osgstu5使用以下引物组。
osgstu5-1:5’-aaaaaatctagaatcttcttctccgacgag-3’(有义:seqidno:11)
osgstu5-2:5’-aaaaaacttaagctacttggcgccaaactt-3’(反义:seqidno:12)
对来自小麦的taq8gtb9使用以下引物组。
taq8gtb9(gstf4)-1:5’-aaaaaatctagaatggagcctatgaaggtg-3’(有义:seqidno:13)
taq8gtb9(gstf4)-2:5’-aaaaaacttaagtcatggtattctcccgct-3’(反义:seqidno:14)
对来自玉米的zmb6t8r4使用以下引物组。
zmb6t8r4(corn)-3:5’-aaaaaatctagatcgtttcgaggccgat-3’(有义:seqidno:15)
zmb6t8r4(corn)-2:5’-aaaaaacttaagtcacttggccccgaactt-3’(反义:seqidno:16)
对来自玉米的zmq9zp61使用以下引物组。
zmq9zp61(gst6)-3:5’-aaaaaatctagataccagccacgtcgctt-3’(有义:seqidno:17)
zmq9zp61(gst6)-2:5’-aaaaaacttaagtcacttggccccgaactt-3’(反义:seqidno:18)
对来自玉米的zmm16901使用以下引物组。
m16901(gsti)-3:5’-aaaaaatctagagttgggtctgggacac-3’(有义:seqidno:19)
m16901(gsti)-2:5’-aaaaaacttaagtcaagcagatggcttcat-3’(反义:seqidno:20)
对来自玉米的zmy12862使用以下引物组。
zmy12862(gst5)-1:5’-aaaaaatctagaatggccgaggagaagaag-3’(有义:seqidno:21)
zmy12862(gst5)-2:5’-aaaaaacttaagctactcgatgcccagcct-3’(反义:seqidno:22)
即,关于图16所示的全部14种基因中的7种基因,分别制作稻转化用载体(palselectr-4-gst)。予以说明,关于几种基因,其插入载体内的序列与数据库上的序列不同。将它们的差异示于表6。
[表6]
予以说明,表6中,“-”是指氨基酸序列上没有差异。另外,关于osgstf5、osgstu5、zmq9zp61,其与数据库上的序列完全一致。
<通过转化将gst基因导入稻中>
利用电穿孔法将如上制作的具有各种gst基因的稻转化用载体(palselectr-4-gst)导入土壤杆菌(eha105)中。接着,通过土壤杆菌法(s.tokiplantmol.biol.rep.1516-21(1997))将gst基因导入稻培养细胞中,然后用双草醚(bs)进行筛选。
<稻转化培养细胞的液体培养>
将如上制作的稻转化培养细胞在砜吡草唑存在下进行液体培养。将砜吡草唑作为丙酮溶液添加到液体培养基中。最终丙酮浓度设为0.1%。进行液体培养时,用klb-279(在palselectr-4的mcs部分导入act1p(稻肌动蛋白1启动子)::sgfp::nost而形成的质粒),将转化的稻培养细胞作为对照组。利用以下方法进行液体培养。
将1袋murashige-skoog培养基用混合盐类(ms无机盐)、1ml的10mg/ml盐酸硫胺素、1ml的5mg/ml烟酸、1ml的10mg/ml盐酸吡哆醇、1ml的2mg/ml甘氨酸、1ml的0.2mg/ml的2,4-d、30g蔗糖(sucrose)、1ml的50mg/ml的肌醇放入到1l的烧杯中,将ph值调节至5.7,用蒸馏水准确地定容至1000ml,然后进行高压灭菌。向放入有50ml该液体培养基的200ml锥形烧瓶中添加0.05ml砜吡草唑后,以与上述相同的组成添加约0.5g在含有3g结冷胶和0.25μmbs的固体培养基中增殖的对照组稻培养细胞和如上制作的稻转化培养细胞,培养14~17天。在培养后去除液体培养基,回收稻培养细胞。
在转化后的1个月内,用0.25μm的双草醚(bs)筛选导入有gst基因的稻培养细胞。接着,用锥形烧杯大量培养用选择培养基增殖的新鲜稻培养细胞约1个月,然后用于在含砜吡草唑的培养基中进行液体培养。关于液体培养时的药剂浓度,设为砜吡草唑会对稻培养细胞中的脂肪酸含量产生影响的10-7m或10-6m(y.tanetani等pestic.biochem.physiol.95,47-55(2009))。予以说明,考虑到当突变型als在稻培养细胞中发挥功能时可能会影响脂肪酸含量,作为比较对照(对照组),使用通过klb-279(在palselectr-4的mcs部分导入act1p::sgfp::nost而形成的质粒)转化的稻培养细胞。
<以稻培养细胞中的脂肪酸含量为指标的砜吡草唑代谢活性的分析>
脂肪酸的提取是将十一烯酸(c11:1)作为内标物进行的。作为分析标准品,使用含有c14:0、c16:0、c16:1、c18:0、c18:1、c18:2、c18:3、c20:0、c22:0、c22:1、c24:0的supelco公司的famemix和其他脂肪酸甲酯(c11:1、c15:0、c20:1、c26:0),制作各个校准曲线进行定量。各脂肪酸甲酯的鉴定根据气相色谱(gc)的维持时间和质谱进行判断。予以说明,定量和定性利用甲酯进行,在定量时基于分子量换算成脂肪酸量。
对1g培养细胞,添加10ml水、25ml甲醇、12.5ml氯仿,使用microtecco.,ltd.公司的physcotron将培养细胞破碎。此时,添加0.1mg溶解于氯仿中的内部标准[10-十一烯酸(c11:1)]。将破碎的溶液抽滤后,放入分液漏斗中,添加40ml氯仿和50ml饱和硫酸铵水溶液后,放置30分钟左右,以充分提取脂肪酸和脂质,再用氯仿重复进行2次(共3次)脂质提取操作。将回收的氯仿层放入分液漏斗中,用水洗涤后,将氯仿层回收到茄形瓶中,用蒸发器浓缩。在减压干燥的容器中加入6ml的25%氢氧化钾、9ml乙醇,在65℃下加热1小时后,恢复至室温,添加10%盐酸,使其呈酸性(ph值为2左右)。将该溶液放入分液漏斗中,加入50ml己烷充分搅拌,重复2次回收有机层的操作,然后用固体无水硫酸镁脱水回收。用蒸发器将该己烷层浓缩后,将其溶解于2ml的混合溶剂(甲苯/甲醇=4/1,v/v)中,向反应体系中滴加几滴浓硫酸,在80℃下反应1小时。反应结束后,恢复至室温,用饱和碳酸氢钠水溶液中和,用ph试纸确认到中和后,回收有机层。将200μl该有机层注入到附带过滤器的微量离心管中,将2μl离心后的溶液用于gc。下面示出gc分析条件。
设备:安捷伦6890系列gc系统
色谱柱:supelco,omegawax250(30m长,0.25mmi.d.,膜厚0.25μm)
注入温度:250℃
初始温度:100℃
初始时间:5分钟
速率:4℃/min
最终温度:220℃
最终时间:25分钟
检测器:fid
检测器温度:250℃
作为分析结果,将在含砜吡草唑培养基中进行液体培养的7种导入有植物gst基因的稻培养细胞和对照稻培养细胞,以及未进行药剂处理的对照稻培养细胞中的脂肪酸含量示于图18~20。予以说明,图18~20所示的数据全部为一系列数据。此外,图18~20表示进行各gst基因的2个系统(系统1、系统2)的稻培养细胞的脂肪酸分析的结果。
在含有砜吡草唑的液体培养基中培养的稻培养细胞,由于砜吡草唑的vlcfae抑制作用,超长链脂肪酸(vlcfa)含量大幅减少,而c15:0(十五烷酸)含量显著蓄积(y.tanetani等pestic.biochem.physiol.95,47-55(2009))。基于该见解,判断各gst有无砜吡草唑代谢活性。结果,分别导入有7种植物gst(taq8gtb9、zmm16901、zmb6t8r4、zmq9zp61、zmy12862、osgstf5、osgstu5)基因的稻培养细胞中的c15:0和vlcfa含量全部与药剂处理区的对照稻培养细胞相同,由此判断出这些gst不具有砜吡草唑代谢活性。予以说明,关于两种导入有osgst基因(f5、u5)的稻培养细胞,是10-6m处理区内的结果,虽然没有未经药剂处理的对照稻培养细胞的数据,但根据vlcfa和c15:0含量,判断出两种gst均无代谢活性。
<以稻培养细胞在培养基中的增殖为指标的砜吡草唑代谢活性的分析>
接着,如图21所示,制作具有玉米gst基因的稻转化用载体。予以说明,本示例中,虽然分别就两种玉米gst基因(zmq9fqd1和zmb8a3k0)制作了稻转化用载体,但由于制作步骤相同,因此下面将说明就zmq9fqd1基因制作稻转化用载体的步骤。
通过从玉米(pioneer32k61)茎叶部制备的rna的反转录反应,合成cdna。将合成的cdna作为模板,用zmq9fqd1-x、zmq9fqd1-y的引物组进行pcr,得到zmq9fqd1基因片段。然后,将zmq9fqd1基因片段进行sali和noti处理,将处理后的zmq9fqd1基因片段作为插入片段,将同样经过sali和noti处理的pentr-1a作为载体。使用这些插入片段和载体进行连接反应。将这样制作的入门克隆(entryclone)(pentr1a-zmq9fqd1)导入大肠杆菌jm109株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒。通过序列分析,确认到插入的zmq9fqd1基因的碱基序列正确。
接着,进行制作的入门克隆(entryclone)(pentr1a-zmq9fqd1)和目的载体palselectr-5(inplantainnovationsinc.)的lr反应,制作表达载体(palselectr-5-zmq9fqd1)。通过转化,将该表达载体(palselectr-5-zmq9fqd1)导入大肠杆菌hst02株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒。通过序列分析,确认插入的zmq9fqd1基因的碱基序列。予以说明,由于两种基因的插入palselectr-5内的序列都与数据库上的序列不同,因此将它们的差异示于表7。
[表7]
予以说明,表7中,“-”是指氨基酸序列上没有差异。
另外,下面示出pcr所使用的引物组。
zmb8a3k0-x:5’-aaaaaagtcgacatggcggcggcggcggag-3’(有义:seqidno:23)
zmb8a3k0-y:5’-aaaaaagcggccgctcacttggccccgaacttg-3’(反义:seqidno:24)
zmq9fqd1-x:5’-aaaaaagtcgacatggcgccgccgatgaag-3’(有义:seqidno:25)
zmq9fqd1-y:5’-aaaaaagcggccgcctatggtatgttcccgctg-3’(反义:seqidno:26)
<通过转化将gst基因导入稻中>
利用电穿孔法将如上制作的与两种来自玉米的gst基因相关的稻转化用载体(palselectr-5-zmgst)导入土壤杆菌(eha105)中。接着,通过土壤杆菌法(s.tokiplantmol.biol.rep.1516-21(1997))将taq8gtc0基因导入稻培养细胞中,然后用双草醚(bs)进行筛选。
在通过转化将两种玉米gst基因分别导入稻中后的1个月内,用0.25μm的双草醚(bs)筛选导入有gst基因的稻培养细胞。结果,确认到与klb-279(未导入taq8gtc0基因,而是导入有gfp基因的阳性对照)同样地在选择培养基中活跃增殖的个体,因此判断已经做出了2个系统的导入有玉米gst基因的稻培养细胞(图22)。
<以稻培养细胞在培养基中的增殖为指标的砜吡草唑代谢活性的分析>
将如上得到的2个系统的导入有玉米gst基因的稻培养细胞和klb-279转基因稻培养细胞(比较对照)在n6d培养基播种2周后,以各稻培养细胞的增殖为指标,考察其对砜吡草唑的抗性。将砜吡草唑作为丙酮溶液用于试验,向培养基添加时的最终丙酮浓度设为1%,药剂的最终浓度设为10-4m。
将结果示于图23。图23所示的照片是稻转化培养细胞在含有100μm(10-4m)的砜吡草唑的培养基中增殖的样子。由图23可以看出,播种2周后,2个系统的gst基因稻培养细胞只是与比较对照一样地膨大而已。这样,导入有zmb8a3k0基因的稻培养细胞、导入有zmq9fqd1基因的稻培养细胞与比较对照同样地没有增殖,对砜吡草唑没有表现出抗性。因此,由本示例的结果可以判断,两种来自玉米的gst没有砜吡草唑代谢活性。
综上所述,由本比较例的结果可知,与稻gst和taq8gtc0(已知其与和砜吡草唑相同的作用机理的药剂代谢相关)的同源性高的小麦和玉米gst没有砜吡草唑代谢活性。因此,实施例1~4所示的taq8gtc0对砜吡草唑的代谢活性显然是无法从公知信息容易推断出来的特异性的性质。
〔比较例2〕
本比较例就与taq8gtc0的氨基酸序列的同源性最高的小麦gst(taq8gtc1)(品种:hunter;accessionno.:aj440791;同源性为78%)进行了谷胱甘肽结合活性的分析。
<taq8gtc1基因的克隆(图24)>
本比较例使用梦香、花满天、梦世纪、农林61号、apache和gatalina这6个品种的小麦。对于这6个品种的小麦,分别将通过从茎叶部制备的rna的反转录反应合成的cdna作为模板,利用pcr得到在5’末端添加有xbai识别位点、在3’末端添加有ecori识别位点的taq8gtc1基因的orf。将该基因片段进行xbai和ecori处理,将由此得到的taq8gtc1基因作为插入片段,将经过相同限制酶处理的pbi121作为载体。使用这些插入片段和载体进行连接,通过转化,将使用该反应液制作的载体导入大肠杆菌jm109株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒。接着,进行测序反应,分析插入载体中的目的基因的碱基序列。
下面示出pcr所使用的引物组。
taq8gtc1-3:5’-aaaaaatctagagatcttcaagaagcggaa-3’(有义:seqidno:27)
taq8gtc1-4:5’-aaaaaagaattctcacttctctgccttctttccga-3’(反义:seqidno:28)
下面示出序列分析所使用的引物组。
序列(taq8gtc1)-2:5’-gacctcaccatcttcgagtc-3’(有义:seqidno:29)
序列(taq8gtc1)-3:5’-ctcgtacacgtcgaacag-3’(反义:seqidno:30)
从上述6个品种得到的taq8gtc1基因,虽然全是相同的碱基序列,但与数据库中登记的序列不同。具体而言,本实验确定的碱基序列和数据库中登记的碱基序列中,组成orf的675bp中有25个碱基不同。其中13处随着氨基酸突变而不同。以下将本实验确定的碱基序列的基因记作taq8gtc1-r基因。
将本实验确定的碱基序列与数据库中登记的碱基序列的对比结果示于图25,将用氨基酸序列对比的结果示于图26。图25中,将在taq8gtc1-r(上段)和数据库上的taq8gtc1的碱基序列(下段)之间不同的25个碱基用方框圈出。图26中,将通过序列分析明确在taq8gtc1-r(上段)和数据库上的taq8gtc1的氨基酸序列(下段)之间不同的13个氨基酸用方框圈出。另外,将本实验确定的碱基序列与数据库中登记的碱基序列的差异总结在表8中。予以说明,表8中,“-”是指碱基序列有差异但氨基酸残基相同。
[表8]
予以说明,将本实验确定的碱基序列(即taq8gtc1-r基因的碱基序列)和用该碱基序列编码的氨基酸序列分别示于seqidno:31和seqidno:32。另外,将数据库中登记的taq8gtc1基因的碱基序列和用该碱基序列编码的氨基酸序列分别示于seqidno:33和seqidno:34。
<taq8gtc1-r蛋白的大肠杆菌表达构建体的构建(图27)>
将通过从小麦(农林61号)茎叶部制备的rna的反转录反应合成的cdna作为模板,利用taq8gtc1-z和taq8gtc1-4的引物组(参考下文)进行pcr,得到在5’末端添加有ndei识别位点、在3’末端添加有ecori识别位点的taq8gtc1-r基因的orf。将本片段进行ndei和ecori处理,将由此得到的taq8gtc1-r基因作为插入片段,将经过相同限制酶处理的pet22b(+)作为载体。使用这些插入片段和载体进行连接,通过转化,将使用该反应液制作的载体导入大肠杆菌jm109株中。
然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒。通过序列分析,确认插入ndei和ecori切割位点之间的taq8gtc1-r基因的碱基序列没有pcr导致的错误,将该质粒导入大肠杆菌bl21(de3)株中,构建taq8gtc1-r蛋白的大肠杆菌表达系统(klb-862)。下面示出pcr所使用的引物组。
taq8gtc1-z:5’-aaaaaacatatggcggcgccggcggtgaaggtg-3’(有义:seqidno:35)
taq8gtc1-4:5’-aaaaaagaattctcacttctctgccttctttccga-3’(反义:seqidno:36)
<taq8gtc1-r蛋白的制备>
使用制作的大肠杆菌bl21(de3)株(klb-862),进行taq8gtc1-r蛋白的表达。将单菌落接种到含有50ppm氨苄青霉素的液体lb培养基中后,将在试管中振荡培养过夜的溶液用作预培养液。将2.5ml预培养液添加到250ml的含有50ppm氨苄青霉素的液体lb培养基(1l锥形烧瓶)中,在37℃下以200rpm培养至od600=0.5~0.6。接着,在冰上冷却5分钟,然后添加iptg,使最终浓度为1mm,在27℃下以200rpm进行21小时的taq8gtc1-r蛋白表达诱导,收集细菌(在4℃下以6000×g离心10分钟),在-80℃下保存菌体。向冻存的菌体(0.5l培养量)添加30ml的pbs缓冲液(0.14mnacl、2.7mmkcl、10mmna2hpo4、1.8mmkh2po4、ph7.3),进行超声波处理(taitecvp-30s、微型芯片、输出3、15秒常数×7~8次)后,在4℃下以15,000×g离心20分钟,得到上清液。以1ml/min的流速将该粗酶溶液加载于用pbs缓冲液平衡的gstrapff柱和gstrap4b柱(均为床体积1ml),用20ml以上的pbs缓冲液洗涤两个谷胱甘肽亲和柱后,将2ml洗脱缓冲液(50mmtris-hcl、10mm还原型谷胱甘肽、ph8.0)注入到柱,将taq8gtc1-r蛋白洗脱(图28)。通过使用nanosep(10k)的超滤,将该蛋白质溶液置换成pbs缓冲液,在-80℃下保存。予以说明,蛋白质的浓度测定利用bradford方法,按照takarabradford蛋白浓度测定试剂盒(takara)的手册进行。
<taq8gtc1-r蛋白的谷胱甘肽结合活性的分析>
本实验分析了纯化的taq8gtc1-r蛋白对cdnb(2,4-二硝基氯苯)和砜吡草唑的谷胱甘肽结合反应。
对cdnb的活性测定,用含有634μl的100mm磷酸钾缓冲液(ph7.6)、300μl的3.3mm还原型谷胱甘肽、33μl纯化酶(含有20%甘油的pbs溶液)、33μl的30mmcdnb(乙醇溶液)的总1ml的反应体系进行。制备除了cdnb以外的反应体系后,最后添加30mm的cdnb开始酶反应,在30℃下测定340nm的吸光度。利用分子吸光系数9.6mm-1cm-1计算出活性。将添加有酶的替代品即含有20%甘油的pbs的反应体系作为阴性对照区(非酶反应区),将该反应体系中的生成量作为非酶生成量。
对砜吡草唑的活性测定,用含有50μl的100mm磷酸钾缓冲液(ph6.8)、10μl的1mm砜吡草唑(丙酮溶液)、20μl的10mm还原型谷胱甘肽(ph7.0)、120μl的taq8gtc1-r蛋白(含有20%甘油的pbs溶液)的总200μl的系统进行,在30℃下反应1小时后,将50μl用0.2μm过滤器过滤的溶液注入到hplc。将未添加酶区(添加taq8gtc1-r蛋白的替代品即含有20%甘油的pbs)和未添加酶和谷胱甘肽区(添加taq8gtc1-r蛋白的替代品即含有20%甘油的pbs、谷胱甘肽的替代品即灭菌水)作为对照区。以下hplc条件下的保留时间按照砜吡草唑、m-15(砜吡草唑的谷胱甘肽结合物)的谷胱甘肽结合物的顺序,为19.0分钟、11.0分钟。
设备:agilent1100系列
色谱柱:capcellpakc18aq4.6mmi.d.×250mm(资生堂)
流动相:乙腈/水=5/95(保持5分钟)→(4分钟)→40/60(保持4分钟)→(4分钟)→90/10(保持8分钟)→(1分钟)→5/95(保持4分钟)(各溶剂含有0.5%乙酸)
温度:35℃
流速:1.0ml/min
检测:254nm
<结果与考察>
首先,为了考察本实验纯化的taq8gtc1-r蛋白是否具有gst活性,考察了标准底物对cdnb(1-氯-2,4-二硝基苯)的谷胱甘肽结合活性。结果表明,对cdnb的活性为2.17μmol/min/mg蛋白(n=2),纯化酶具有gst活性。
接着,考察taq8gtc1-r蛋白对砜吡草唑的结合活性。结合活性试验用酶添加区(酶促、非酶促生成谷胱甘肽结合物)、未添加酶区(非酶促生成谷胱甘肽结合物)、未添加酶和谷胱甘肽区(作为亲化合物而残留)这三个反应体系进行。关于添加到酶添加区的蛋白量,当在同等条件下考察约400ng的taq8gtc0(参考实施例1)的结合活性时,在添加的除草剂的总10nmol内,约50%成为谷胱甘肽结合物,据此设为500ng。
taq8gtc1-r蛋白的结合活性试验的结果是,当将砜吡草唑作为底物时,在酶添加区和在未添加酶区生成的谷胱甘肽结合物相同(添加到反应体系中的砜吡草唑的约3%转化为m-15)(图29)。这样,酶添加区和未添加酶区的谷胱甘肽结合物的生成量没有明显差异,因此表示本示例纯化的taq8gtc1-r蛋白对砜吡草唑没有结合活性。如实施例1等所示,与taq8gtc1-r具有约80%的氨基酸同源性的taq8gtc0对vlcfae抑制剂中的砜吡草唑表现出特别高的结合活性,而taq8gtc1-r蛋白则未表现出活性。
这样,由于在相似度较高的gst中也没有对砜吡草唑的结合活性,因此认为实施例1~3所示的taq8gtc0的砜吡草唑结合活性的特异性高。
另一方面,关于实施例1~3所示的来自小麦的gst中与具有砜吡草唑代谢活性的taq8gtc0(tagstf3)同被归类为phi类型的植物gst的底物识别的相关氨基酸残基,已通过底物和gst复合物的x射线晶体结构分析明确(preinemer等j.mol.biol.255,289-309(1996)、t.neuefeind等j.mol.biol.274,446-453(1997)、h.pegeot等flontiersinplantscience5,1-15(2014)和t.neuefeind等j.mol.biol.274,446-453(1997))。各种植物gst氨基酸序列的多序列比对中,将推定底物识别位点示于图30,将通过上述论文明确的形成底物识别位点的氨基酸总结在表9中。予以说明,图30中,两处推定底物识别位点用方框圈出,组成推定底物识别位点的氨基酸则用粗体字(带下划线)表示。
予以说明,如图30所示,将来自拟南芥的atgstf2的氨基酸序列示于seqidno:37,将来自白杨的pttgstf1的氨基酸序列示于seqidno:38,将来自玉米的zmgstf1的氨基酸序列示于seqidno:39,将来自小麦的tagstf1的氨基酸序列示于seqidno:40,将来自小麦的tagstf4的氨基酸序列示于seqidno:41,将来自小麦的tagstf5的氨基酸序列示于seqidno:42,将来自小麦的tagstf6的氨基酸序列示于seqidno:43。予以说明,图30中来自小麦的tagstf2-r的氨基酸序列示于seqidno:32,来自小麦的tagstf3的氨基酸序列示于seqidno:2。
[表9]
表9中,1)是structure6,1445-1452(1998);2)是j.mol.biol.255,289-309(1996);3)是j.mol.biol.274,446-453(1997);4)是flontiersinplantscience5,1-15(2014)。由图30和表9可知,与底物识别相关的氨基酸(对应于tagstf3(taq8gtc0)的氨基酸序列)主要分布在gst的5~15位附近的区域1和115~125位附近的区域2。因此,将这两个区域推断为gst的底物识别位点,考察各区域(区域1为10个氨基酸,区域2为12个氨基酸)与tagstf3(taq8gtc0)的氨基酸序列的同源性。
结果,区域1中,tagstf3(taq8gtc0)与tagstf1、tagstf2-r、tagstf4、tagstf5、tagstf6之间的同源性分别为40%、80%、80%、40%和50%。另外,区域2中,tagstf3(taq8gtc0)与tagstf1、tagstf2-r、tagstf4、tagstf5、tagstf6之间的同源性分别为45%、64%、55%、45%和18%。予以说明,关于tagstf1、tagstf2-r、tagstf3(taq8gtc0)、tagstf4、tagstf5和tagstf6,在i.cummins等plantmol.biol.52,591-603(2003)中作为归类为phi类型的来自小麦的gst而公开。
由此可知,区域1、区域2中,相对于taq8gtc0(tagstf3)的氨基酸同源性最高的均为tagstf2-r(taq8gtc1-r)。tagstf2-r(taq8gtc1-r)未表现出砜吡草唑代谢活性,由此认为实施例1~3所示的tagstf3(taq8gtc0)对砜吡草唑的代谢是非常特异性的。
〔比较例3〕
本比较例制作了导入有比较例2中克隆的taq8gtc1-r基因的重组稻,并分析了该重组稻相关的药剂抗性。
<taq8gtc1-r基因的稻转化用载体(r-5-taq8gtc1-r)的制作(图31)>
将通过从小麦(农林61号)茎叶部制备的rna的反转录反应合成的cdna作为模板,用taq8gtc1-x、taq8gtc1-y的引物组进行pcr,得到taq8gtc1-r基因(orf)。使用将该片段的5’末端进行sali处理、3’末端进行noti处理的taq8gtc1-r基因片段作为插入片段,将经过相同限制酶处理的pentr-1a作为载体。使用这些插入片段和载体进行连接,通过转化,将制作的入门克隆(entryclone)(pentr1a-taq8gtc1-r)导入大肠杆菌jm109株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒,通过序列分析,确认到在sali和noti切割位点之间插入的taq8gtc1-r基因的碱基序列正确。
接着,进行制作的入门克隆(entryclone)(pentr1a-taq8gtc1-r)和目的载体r-5(palselectpstara)的lr反应,通过转化,将制作的表达载体(在r-5的attb序列间插入taq8gtc1-r基因而形成的稻转化用载体)导入大肠杆菌hst02株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒,通过序列分析,确认到在attb序列间插入的taq8gtc1-r基因的碱基序列正确。下面示出pcr所使用的引物组。
taq8gtc1-x:5’-aaaaaagtcgacatggcggcgccggcggtgaagg-3’(有义:seqidno:44)
taq8gtc1-y:5’-aaaaaagcggccgctcacttctctgccttctt-3’(反义:seqidno:45)
<通过转化将taq8gtc1-r基因导入稻中>
利用电穿孔法将制作的将taq8gtc1-r基因插入palselectr-5而形成的稻转化用载体(palselectr-5-taq8gtc1-r)导入土壤杆菌(eha105)中(klb-872)。接着,通过土壤杆菌法将taq8gtc1-r基因导入稻培养细胞中,然后用双草醚(bs)进行筛选。
通过转化,将taq8gtc1-r基因导入稻中,然后在1个月内用0.25μm双草醚(bs)筛选导入有taq8gtc1-r基因的稻培养细胞,则确认到用选择培养基增殖的重组稻培养细胞(图32)。然后,将这些转基因稻培养细胞移植到未添加药剂的再分化培养基中后,依次在隔离温室中栽培得到的植物体。从开始在隔离温室栽培起,平均两个月在所有植物体上确认到抽穗,从这些植物体中采集后代种子(t1)。
<导入有taq8gtc1-r基因的稻对砜吡草唑的敏感性试验>
将结冷胶作为培养基,通过发芽生长抑制试验来考察18个系统(klb-872#3-11和klb-872#2-4)对砜吡草唑的抗性。首先,将hoaglandmix和3g结冷胶悬浮于1l蒸馏水中,然后用微波炉加热,使其充分溶解。在未冷却前,将15ml溶液注入到管瓶中(向培养皿中注入30ml)。在调制药剂时,在向管瓶或培养皿注入时添加并充分混合。将未脱壳稻米在稀释了50倍的次氯酸钠溶液(安替福民)(wako)中浸泡20分钟左右,然后用水充分洗涤。将经过灭菌处理的种子浸泡在蒸馏水中,在27℃下静置,直至催芽(约2天)。将催芽种子芽朝上轻轻埋入含有0.25μm的bs的结冷胶培养基(培养皿)。将它们和放入了蒸馏水的烧杯一起放入到透明容器内,用保鲜膜覆盖,在27℃、荧光灯照明下(明期14小时,暗期10小时)培育2天。然后,将以根部的延长为指标判断为具有bs抗性的稻种子移植到含有砜吡草唑(最终浓度10-8、10-7、10-6、10-5)的结冷胶培养基(管瓶)中。接着,将它们和放入了蒸馏水的烧杯一起放入到透明容器内,用保鲜膜覆盖,在27℃、荧光灯照明下(明期14小时,暗期10小时)培育4~5天,之后测定株高。药剂的抑制以株高为指标,计算对未添加药剂区的生长抑制率,生长抑制50%浓度(i50值)利用probit法求出。
<结果与考察>
将上述导入有taq8gtc1-r基因的稻(klb-872#3-11和klb-872#2-4)对砜吡草唑抗性的试验结果示于图33。用于试验的2个系统的砜吡草唑敏感性均与野生型相同。由该结果可以推断,导入有taq8gtc1-r基因的稻未对砜吡草唑表现出抗性。
〔实施例5〕
本实施例中,制作在实施例1~3中表现出对砜吡草唑具有结合活性的导入有taq8gtc0基因的转基因甘蓝型油菜(brassicanapus),对该转基因甘蓝型油菜对砜吡草唑的敏感性进行试验。
<taq8gtc0基因的甘蓝型油菜转化用载体的制作(图34)>
将通过从小麦(农林61号)茎叶部制备的rna的反转录反应合成的cdna作为模板,用taq8gtc0-if-平端(xbai)、taq8gtc0-if-平端(saci)的引物组进行pcr,得到taq8gtc0基因的orf。将该基因片段进行xbai和saci处理后,使用通过t4dna聚合酶平滑化的pbi121进行in-fusion反应,通过转化,将制作的甘蓝型油菜转化用质粒(taq8gtc0inpbi121)导入大肠杆菌jm109株中。然后,通过菌落pcr,从目的质粒的导入得到确认的菌落制备质粒,通过序列分析,确认到在xbai和saci切割位点之间插入的taq8gtc0基因的碱基序列正确。下面示出pcr所使用的引物。
taq8gtc0-if-平端(xbai):
5’-cacgggggactctagatggcgccggcggtgaaggt-3’(有义:seqidno:46)
taq8gtc0-if-平端(saci):
5’-gatcggggaaattcgctactctgctttctttccaa-3’(反义:seqidno:47)
<通过转化将taq8gtc0基因导入甘蓝型油菜中>
利用电穿孔法将制作的将taq8gtc0基因插入pbi121而形成的甘蓝型油菜转化用载体(pbi121-taq8gtc0)导入土壤杆菌(gv3101)中(klb-858)。接着,通过土壤杆菌法将taq8gtc0基因导入甘蓝型油菜中,然后用卡那霉素进行筛选。
<确认基因向转基因甘蓝型油菜的导入>
使用dneasyplantminikit制备重组甘蓝型油菜的基因组dna。然后,将该基因组dna作为模板,利用pcr确认目的构建体的导入。pcr用总25μl的反应体系(2μl模板、0.25μl的50μm有义引物、0.25μl的50μm反义引物、2.5μl的2mmdntp混合物、5μl的phire反应缓冲液、0.5μl的phire热启动dna聚合酶、14.5μl灭菌水)进行。关于pcr,初始变性:在98℃下进行20秒;变性:在98℃下进行20秒;退火:在58℃下进行15秒;延长:在72℃下进行30秒(40个循环);最终延长:在72℃下进行4分钟。另外,在确认t-dna区域的导入时所使用的引物的碱基序列如下所示。
nosp-2:5’-cgcctaaggtcactatcagctagc-3’(反义:seqidno:48)
连接肽(pbi121)-2:5’-gaactccagcatgagatc-3’(反义:seqidno:49)
cam35s-1:5’-agaggacctaacagaactcgcc-3’(有义:seqidno:50)
taq8gtc0-2:5’-aaaaaacttaagctactctgctttctttcc-3’(反义:seqidno:51)
接着,利用电穿孔法将导入有taq8gtc0基因的甘蓝型油菜转化用载体导入到将卡那霉素作为筛选试剂的pbi121中,使用由此形成的土壤杆菌gv3101株(klb-858),通过转化将taq8gtc0基因导入甘蓝型油菜中。结果,得到了被认为是目的转化体的1个体(图35,图中,用方框圈出得到的1个体)。接着,将从该重组甘蓝型油菜提取的基因组重组作为模板进行pcr,结果t-dna区域所含有的两个构建体(pnos::nptii::tnos、p35s::taq8gtc0::tnos)被导入,由此可知得到的个体是作为目的的重组甘蓝型油菜(图36)。在人工气候室中继续栽培该重组甘蓝型油菜,采集t1种子。
<导入有taq8gtc0基因的甘蓝型油菜的砜吡草唑敏感性试验>
〔甘蓝型油菜敏感性试验1(接种后出芽前土壤处理)〕
甘蓝型油菜敏感性试验1中,将野生型甘蓝型油菜(品种:westar)和导入有小麦gst基因的甘蓝型油菜用于试验,试验规模为方形白色塑料罐(长8cm、宽8cm、高6cm),用于试验的土壤为fujino土(沙土)、每罐接种4粒野生型甘蓝型油菜种子,接种8粒重组甘蓝型油菜种子(接种深度1cm)。将含有50%砜吡草唑的水分散粒剂作为试剂用于试验,以1、4、16、63、250ga.i./ha的五种剂量重复3次。在处理后立即利用降雨装置进行约1mm的人工降雨,然后从罐的下方供水。之后在罐表面干燥的时候,适当从罐的下方供水。
〔结果与考察〕
进行砜吡草唑的发芽前土壤处理试验(温度22℃、荧光灯),从株高和作用症状及子叶生长的角度考虑,分析小麦gst重组甘蓝型油菜有无砜吡草唑抗性。具体而言,在接种甘蓝型油菜种子和喷洒药剂两周后,测定在各处理区生长的植物体的株高,计算对甘蓝型油菜生长的抑制率(n=4~12)。将试验结果示于图37~图39。图37~图39中,“tagst”是指taq8gtc0基因重组甘蓝型油菜。图38所示的表格的数值是指平均±标准偏差(n=4~12)。
根据明确的对野生型和重组甘蓝型油菜的株高的抑制率,在4~63ga.i./ha,尤其是16ga.i./ha的处理剂量下,砜吡草唑对重组甘蓝型油菜的生长抑制率低于野生型甘蓝型油菜(按重组体、野生型的顺序为48.2%、61.9%)。另外,当以作用症状为指标时,野生型甘蓝型油菜在16ga.i./ha以上的处理剂量下其子叶浓绿化,而重组甘蓝型油菜则未确认到该症状。关于子叶的生长,野生型甘蓝型油菜在16ga.i./ha以上的处理剂量下几乎完全受到抑制,而重组甘蓝型油菜即使在250ga.i./ha的处理剂量下也在适宜地生长(图39)。
综合以上结果可知,在砜吡草唑的接种后出芽前土壤处理试验(22℃、荧光灯)中,从甘蓝型油菜株高和作用症状以及子叶生长的角度考虑,制作的导入有tag8qgtc0基因的甘蓝型油菜与野生型甘蓝型油菜相比,对砜吡草唑有抗性。
〔甘蓝型油菜敏感性试验2(琼脂培养基)〕
由上述接种后发芽前土壤处理试验的结果可知,导入有tag8qgtc0基因的甘蓝型油菜对砜吡草唑表现出抗性。因此,为了考察该导入有tag8qgtc0基因的甘蓝型油菜具有几倍左右的抗性,在能够直接分析药剂影响的琼脂培养基中进行了甘蓝型油菜生长抑制试验。将野生型甘蓝型油菜(品种:westar)和导入有taq8gtc0基因的甘蓝型油菜用于试验,在琼脂培养基中进行生长抑制试验,考察对砜吡草唑的抗性。
该试验中,培养基的组分(1l)为:1×murashige-skoog(ms)培养基(1袋)、盐酸硫胺素(3μg/ml)、烟酸(5μg/ml)、盐酸吡哆辛(0.5μg/ml)、1%(w/v)蔗糖。向1l烧杯中加入上述组分,将ph值调节至5.7,定容至1l,并添加8g(0.8%)的琼脂。然后,将其高压灭菌并冷却至室温,添加规定浓度的砜吡草唑(丙酮溶液)。将该溶液每50ml地分注到苗木箱中(此时也制作分注有30ml未添加药剂的溶液的培养皿)。
在进行甘蓝型油菜的敏感性试验时,将所需量的甘蓝型油菜干燥种子在70%乙醇中搅拌2分钟,在次氯酸(0.02%triton-x-100)中搅拌15分钟,用灭菌水洗涤10次。在22℃下将这些种子在制作的未添加药剂的培养皿的培养基表面播种30粒左右,2~3天后,将发芽的幼苗埋入各个培养基(苗木箱),每个培养基(苗木箱)埋入5粒。然后,在22℃下培育2周,之后获取数据。
〔结果与考察〕
用含有多种浓度(0.1μm、1μm、10μm、100μm)的砜吡草唑的琼脂培养基进行了甘蓝型油菜的敏感性试验。将试验结果示于图40~图43。图40是使用野生型甘蓝型油菜的结果,表格所示数值是平均±标准偏差(n=4~5)。图41~43是使用导入有tag8qgtc0基因的甘蓝型油菜(图中记作tagst)的结果。图41、42的表格所示的数值是平均±标准偏差(n=4~5)。图43所示的数值是平均值(n=4~5)。
由明确的对甘蓝型油菜的株高抑制率和真叶的生长抑制率可知,对0.1μm添加区的野生型甘蓝型油菜的抑制率(按株高抑制率、真叶的生长抑制率的顺序为8.9±2.8%、8.4±1.4%)和对10μm添加区的小麦gst重组甘蓝型油菜的抑制率(按株高抑制率、真叶的生长抑制率的顺序为7.8±5.9%、1.2±2.7%)是相同的。因此,导入有tag8qgtc0基因的甘蓝型油菜与野生型相比,具有约100倍的砜吡草唑抗性。
综上所述,由导入有tag8qgtc0基因的甘蓝型油菜对砜吡草唑的敏感性试验(接种后出芽前土壤处理、琼脂培养基)的结果可以推断,导入有tag8qgtc0基因的甘蓝型油菜与野生型甘蓝型油菜相比,对砜吡草唑有抗性,其抗性约为100倍左右。这样,明确在实施例1~3中具有砜吡草唑代谢活性的taq8gtc0在甘蓝型油菜中也能发挥功能,对砜吡草唑赋予抗性。
〔实施例6〕
本实施例中,对导入有taq8gtc0基因的转基因拟南芥(参考实施例3)对高温胁迫的抗性进行试验。
<导入有taq8gtc0基因的拟南芥的高温胁迫抗性试验>
为了考察实施例3制作的导入有taq8gtc0基因的转基因拟南芥的高温抗性,如下制作培养基。首先,将murashige-skoog(ms)培养基(1袋)、盐酸硫胺素(3mg)、烟酸(5mg)、盐酸吡哆辛(0.5mg)、蔗糖(10g)添加到1l烧杯中,将ph值调节至5.7,定容至1l,然后添加8g(0.8%)的琼脂。将其高压灭菌后,冷却至室温,将30ml分注到培养皿上。
使用这些培养基,利用以下方法进行实施例3制作的转基因拟南芥的高温胁迫抗性试验。将所需量的拟南芥干燥种子在70%乙醇中搅拌2分钟,在次氯酸(0.02%triton-x-100)中搅拌15分钟,用灭菌水洗涤10次。接着,将种子悬浮于高压灭菌后的0.1%琼脂溶液1ml中,将该悬浮液在培养基表面播种,由此在每个培养皿上接种30粒左右。用外科带密封,在4℃下放置2天。移至22℃下培育11天后,进行高温处理(50℃、40分钟),再培育6天。
〔结果与考察〕
将野生型拟南芥(columbia-0)作为比较对照进行高温胁迫处理后,以植物体的表达型为指标,考察导入有taq8gtc0基因的拟南芥有无高温抗性。试验使用野生型和3系统的重组拟南芥(1-1-3、1-1-5、1-2-12)。结果,因高温处理而发生白化(完全枯死)的植物体的比例,野生型为74%(26/35),而导入有taq8gtc0基因的重组体按1-1-3、1-1-5、1-2-12的顺序为0%(0/11)、24%(8/34)、26%(10/38)(括号内是白化的个体数/用于试验的个体数)。由这些结果可知,导入有taq8gtc0基因的拟南芥与野生型相比,因高温处理而受到的影响小,制作的导入有taq8gtc0基因的拟南芥具有高温胁迫抗性。因此,实施例4所示的导入有taq8gtc0基因的稻具有高温抗性,表示taq8gtc0基因在单子叶至双子叶的广泛植物中可以发挥功能,不仅是除草剂抗性,也能赋予高温胁迫抗性。
〔实施例7〕
本实施例对实施例5制作的导入有taq8gtc0基因的转基因甘蓝型油菜(brassicanapus)有无高温抗性进行了试验。
<导入有taq8gtc0基因的甘蓝型油菜的高温胁迫抗性试验>
为了考察实施例5制作的导入有taq8gtc0基因的转基因甘蓝型油菜的高温抗性,如下制作培养基。首先,将murashige-skoog(ms)培养基(1袋)、盐酸硫胺素(3mg)、烟酸(5mg)、盐酸吡哆辛(0.5mg)、蔗糖(10g)添加到1l烧杯中,将ph值调节至5.7,定容至1l,然后添加8g(0.8%)的琼脂。将其高压灭菌后,冷却至室温,将70ml分注到苗木箱中。
使用这些培养基,利用以下方法进行实施例5制作的转基因甘蓝型油菜的高温胁迫抗性试验。将所需量的甘蓝型油菜干燥种子在70%乙醇中搅拌2分钟,在次氯酸(0.02%triton-x-100)中搅拌15分钟,用灭菌水洗涤10次。接着,将5粒左右的种子在上述制作的培养基表面播种。用封口膜密封,在22℃下培育4天后,进行高温处理(50℃下进行1小时,或50℃下进行2.5小时),再在隔离室温中培育4天。
〔结果与考察〕
将野生型甘蓝型油菜(westar)作为比较对照进行高温胁迫处理后,考察导入有taq8gtc0基因的甘蓝型油菜有无高温抗性。结果,试验1(50℃下处理1小时)中,导入有taq8gtc0基因的甘蓝型油菜的株高与野生型相比,明显变高(图44)。予以说明,图44所示的表格的数值表示平均±标准偏差(n=3~7)。另外,试验2(50℃下处理2.5小时)中,白化(完全枯死)的个体的比例按野生型甘蓝型油菜、导入有taq8gtc0基因的甘蓝型油菜的顺序为75%(3/4)、20%(1/5),导入有taq8gtc0基因的甘蓝型油菜的白化比例与野生型甘蓝型油菜相比,明显小(括号内是白化的个体数/用于试验的个体数)。由这些结果可知,如果在两个试验中分别将株高、白化个体的比例作为指标,则导入有taq8gtc0基因的甘蓝型油菜与野生型甘蓝型油菜相比,因高温处理而受到的影响小,实施例5制作的导入有taq8gtc0基因的甘蓝型油菜具有高温胁迫抗性。因此,来自小麦的taq8gtc0基因在甘蓝型油菜中也能发挥功能,不仅是除草剂抗性,也能赋予高温胁迫抗性。
序列表
<110>组合化学工业株式会社.
<120>具有除草剂抗性的转基因植物
<130>ph-6982-pct
<150>jp2016-132689
<151>2016-07-04
<160>51
<170>patentinversion3.5
<210>1
<211>669
<212>dna
<213>小麦(triticumaestivum)
<220>
<221>cds
<222>(1)..(669)
<400>1
atggcgccggcggtgaaggtgtacgggtgggccgtgtcgccgttcgtg48
metalaproalavallysvaltyrglytrpalavalserpropheval
151015
gcgcgcccactgctgtgcctggaggaggccggcgtcgagtacgagctc96
alaargproleuleucysleugluglualaglyvalglutyrgluleu
202530
gtgtccatgagccgcgcggccggcgaccaccgccagccggacttcctc144
valsermetserargalaalaglyasphisargglnproasppheleu
354045
gcccggaaccccttcggccaggtccccgtcctcgaggacggcgacctc192
alaargasnpropheglyglnvalprovalleugluaspglyaspleu
505560
accctcttcgagtcgcgcgcgatcgcgaggcacgtgctccggaagcac240
thrleuphegluserargalailealaarghisvalleuarglyshis
65707580
aagccggagctgctgggctgcggctcgccggaggcggaggcgatggtg288
lysprogluleuleuglycysglyserproglualaglualametval
859095
gacgtgtggctggaggtggaggcccaccagtacaaccccgcggccagc336
aspvaltrpleugluvalglualahisglntyrasnproalaalaser
100105110
gccatcgtggtgcagtgcatcatcttgccgctactgggcggcgcgcgg384
alailevalvalglncysileileleuproleuleuglyglyalaarg
115120125
gaccaggcggtggtggacgagaacgtagccaagctcaagaaggtgctg432
aspglnalavalvalaspgluasnvalalalysleulyslysvalleu
130135140
gaggtgtacgaggcacggctgtcggcgtccaggtacctcgccggggac480
gluvaltyrglualaargleuseralaserargtyrleualaglyasp
145150155160
gacatcagcctcgccgacctcagccacttccccttcacgcgctacttc528
aspileserleualaaspleuserhispheprophethrargtyrphe
165170175
atggagacggagtacgcgccgctggtggcggagctcccccacgtgaac576
metgluthrglutyralaproleuvalalagluleuprohisvalasn
180185190
gcgtggtgggaggggctcaaggccaggccggccgcgaggaaggtgacg624
alatrptrpgluglyleulysalaargproalaalaarglysvalthr
195200205
gagctcatgccgccggaccttgggcttggaaagaaagcagagtag669
gluleumetproproaspleuglyleuglylyslysalaglu
210215220
<210>2
<211>222
<212>prt
<213>小麦(triticumaestivum)
<400>2
metalaproalavallysvaltyrglytrpalavalserpropheval
151015
alaargproleuleucysleugluglualaglyvalglutyrgluleu
202530
valsermetserargalaalaglyasphisargglnproasppheleu
354045
alaargasnpropheglyglnvalprovalleugluaspglyaspleu
505560
thrleuphegluserargalailealaarghisvalleuarglyshis
65707580
lysprogluleuleuglycysglyserproglualaglualametval
859095
aspvaltrpleugluvalglualahisglntyrasnproalaalaser
100105110
alailevalvalglncysileileleuproleuleuglyglyalaarg
115120125
aspglnalavalvalaspgluasnvalalalysleulyslysvalleu
130135140
gluvaltyrglualaargleuseralaserargtyrleualaglyasp
145150155160
aspileserleualaaspleuserhispheprophethrargtyrphe
165170175
metgluthrglutyralaproleuvalalagluleuprohisvalasn
180185190
alatrptrpgluglyleulysalaargproalaalaarglysvalthr
195200205
gluleumetproproaspleuglyleuglylyslysalaglu
210215220
<210>3
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>3
aaaaaacatatggcgccggcggtgaaggtg30
<210>4
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>4
aaaaaaggatccctactctgctttctttcc30
<210>5
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>5
aaaaaagtcgacatggcgccggcggtgaag30
<210>6
<211>32
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>6
aaaaaagcggccgcctactctgctttctttcc32
<210>7
<211>22
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>7
cacgtgctccggaagcacaagc22
<210>8
<211>20
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>8
ccggcaacaggattcaatct20
<210>9
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>9
aaaaaatctagaaaagtgcagggcaaattc30
<210>10
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>10
aaaaaacttaagctatggtatgttcccact30
<210>11
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>11
aaaaaatctagaatcttcttctccgacgag30
<210>12
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>12
aaaaaacttaagctacttggcgccaaactt30
<210>13
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>13
aaaaaatctagaatggagcctatgaaggtg30
<210>14
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>14
aaaaaacttaagtcatggtattctcccgct30
<210>15
<211>28
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>15
aaaaaatctagatcgtttcgaggccgat28
<210>16
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>16
aaaaaacttaagtcacttggccccgaactt30
<210>17
<211>29
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>17
aaaaaatctagataccagccacgtcgctt29
<210>18
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>18
aaaaaacttaagtcacttggccccgaactt30
<210>19
<211>28
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>19
aaaaaatctagagttgggtctgggacac28
<210>20
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>20
aaaaaacttaagtcaagcagatggcttcat30
<210>21
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>21
aaaaaatctagaatggccgaggagaagaag30
<210>22
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>22
aaaaaacttaagctactcgatgcccagcct30
<210>23
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>23
aaaaaagtcgacatggcggcggcggcggag30
<210>24
<211>33
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>24
aaaaaagcggccgctcacttggccccgaacttg33
<210>25
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>25
aaaaaagtcgacatggcgccgccgatgaag30
<210>26
<211>33
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>26
aaaaaagcggccgcctatggtatgttcccgctg33
<210>27
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>27
aaaaaatctagagatcttcaagaagcggaa30
<210>28
<211>35
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>28
aaaaaagaattctcacttctctgccttctttccga35
<210>29
<211>20
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>29
gacctcaccatcttcgagtc20
<210>30
<211>18
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>30
ctcgtacacgtcgaacag18
<210>31
<211>675
<212>dna
<213>小麦(triticumaestivum)
<220>
<221>cds
<222>(1)..(675)
<400>31
atggcggcgccggcggtgaaggtgcacgggtgggcgatgtcgccgttc48
metalaalaproalavallysvalhisglytrpalametserprophe
151015
gtggcgcgcgcgttgctgtgcctggaggaggccggcgtggagtacgag96
valalaargalaleuleucysleugluglualaglyvalglutyrglu
202530
ctcgtccccatgagccgcgaggccggcgaccaccgccagccggacttc144
leuvalprometserargglualaglyasphisargglnproaspphe
354045
ctcgccaggaaccccttcggccaggtccccgttctcgaggacggcgac192
leualaargasnpropheglyglnvalprovalleugluaspglyasp
505560
ctcaccatcttcgaatcgcgcgccgtcgcgaggcacgtgctgcgcaag240
leuthrilephegluserargalavalalaarghisvalleuarglys
65707580
cacaagccggagctgctgggctccggctcgccggagtcggcggcgaag288
hislysprogluleuleuglyserglyserprogluseralaalalys
859095
gtggacgtgtggctggaggtggaggcgcaccagcaccagaccccggcg336
valaspvaltrpleugluvalglualahisglnhisglnthrproala
100105110
ggcaccatcgtgatgcagtgcatcctcaccccgttcctcggctgcgag384
glythrilevalmetglncysileleuthrpropheleuglycysglu
115120125
cgcgaccagaccgccatcgacgagaacgcggcaaagctgacgaagctg432
argaspglnthralaileaspgluasnalaalalysleuthrlysleu
130135140
ttcgacgtgtacgaggcgcggctgtcggcgtcgaggtacctcgccggg480
pheaspvaltyrglualaargleuseralaserargtyrleualagly
145150155160
gactccctcagcctcgccgacctcagccacttcccgctcatgcgctac528
aspserleuserleualaaspleuserhispheproleumetargtyr
165170175
ttcatggacaccgagtacgcgtcgctggtggtggagcgcccgcacgtg576
phemetaspthrglutyralaserleuvalvalgluargprohisval
180185190
aaggtgtggtgggaggagctcaaggccaggccggcggcgaagagggtg624
lysvaltrptrpglugluleulysalaargproalaalalysargval
195200205
acggagttcatgccgccaaacttcgggttcggaaagaaggcagagaag672
thrgluphemetproproasnpheglypheglylyslysalaglulys
210215220
tga675
<210>32
<211>224
<212>prt
<213>小麦(triticumaestivum)
<400>32
metalaalaproalavallysvalhisglytrpalametserprophe
151015
valalaargalaleuleucysleugluglualaglyvalglutyrglu
202530
leuvalprometserargglualaglyasphisargglnproaspphe
354045
leualaargasnpropheglyglnvalprovalleugluaspglyasp
505560
leuthrilephegluserargalavalalaarghisvalleuarglys
65707580
hislysprogluleuleuglyserglyserprogluseralaalalys
859095
valaspvaltrpleugluvalglualahisglnhisglnthrproala
100105110
glythrilevalmetglncysileleuthrpropheleuglycysglu
115120125
argaspglnthralaileaspgluasnalaalalysleuthrlysleu
130135140
pheaspvaltyrglualaargleuseralaserargtyrleualagly
145150155160
aspserleuserleualaaspleuserhispheproleumetargtyr
165170175
phemetaspthrglutyralaserleuvalvalgluargprohisval
180185190
lysvaltrptrpglugluleulysalaargproalaalalysargval
195200205
thrgluphemetproproasnpheglypheglylyslysalaglulys
210215220
<210>33
<211>675
<212>dna
<213>小麦(triticumaestivum)
<220>
<221>cds
<222>(1)..(675)
<400>33
atggcggcgccggcggtgaaggtgtacgggtgggcgatgtcgccgttc48
metalaalaproalavallysvaltyrglytrpalametserprophe
151015
gtggcgcgcgcgctgctgtgcctggaggaggccggcgtggagtacgag96
valalaargalaleuleucysleugluglualaglyvalglutyrglu
202530
ctcgtccccatgagccgcgaggccggcgaccaccgccagcccgacttc144
leuvalprometserargglualaglyasphisargglnproaspphe
354045
ctcgcccggaaccccttcggccaggtccccgttctcgaggacggcgac192
leualaargasnpropheglyglnvalprovalleugluaspglyasp
505560
ctcaccatcttcgagtcgcgcgccgtcgcgaggcacgtgctgcgcaag240
leuthrilephegluserargalavalalaarghisvalleuarglys
65707580
cacaaaccggagctgctgggctccggctcgccggagtcggcggcgatg288
hislysprogluleuleuglyserglyserprogluseralaalamet
859095
gtggacgtgtggctggaggtggaggcccaccagcaccagaccccggcg336
valaspvaltrpleugluvalglualahisglnhisglnthrproala
100105110
ggcaccatcgtcatgcagtgcatcctcaccccgttcctcggctgccag384
glythrilevalmetglncysileleuthrpropheleuglycysgln
115120125
cgcgaccaggccgccatcgacgagaacgcggcaaagctgacgaatctg432
argaspglnalaalaileaspgluasnalaalalysleuthrasnleu
130135140
ttcgacgtgtacgaggcgcgcctgtcggcgtcgaggtaccttgccggg480
pheaspvaltyrglualaargleuseralaserargtyrleualagly
145150155160
gaggcggtcagcctcgcggacctcagccacttcccgttcatgcgatac528
glualavalserleualaaspleuserhispheprophemetargtyr
165170175
ttcatggacaccgagtacgcgtcgctggtggaggagcgcccgcacgtg576
phemetaspthrglutyralaserleuvalglugluargprohisval
180185190
aaggcgtggtgggaggagttcaaggccagcccggcggcgaagagggtg624
lysalatrptrpglugluphelysalaserproalaalalysargval
195200205
acggagttcatgccgccaaacttcgggttcggaaagaaggcagagaag672
thrgluphemetproproasnpheglypheglylyslysalaglulys
210215220
tga675
<210>34
<211>224
<212>prt
<213>小麦(triticumaestivum)
<400>34
metalaalaproalavallysvaltyrglytrpalametserprophe
151015
valalaargalaleuleucysleugluglualaglyvalglutyrglu
202530
leuvalprometserargglualaglyasphisargglnproaspphe
354045
leualaargasnpropheglyglnvalprovalleugluaspglyasp
505560
leuthrilephegluserargalavalalaarghisvalleuarglys
65707580
hislysprogluleuleuglyserglyserprogluseralaalamet
859095
valaspvaltrpleugluvalglualahisglnhisglnthrproala
100105110
glythrilevalmetglncysileleuthrpropheleuglycysgln
115120125
argaspglnalaalaileaspgluasnalaalalysleuthrasnleu
130135140
pheaspvaltyrglualaargleuseralaserargtyrleualagly
145150155160
glualavalserleualaaspleuserhispheprophemetargtyr
165170175
phemetaspthrglutyralaserleuvalglugluargprohisval
180185190
lysalatrptrpglugluphelysalaserproalaalalysargval
195200205
thrgluphemetproproasnpheglypheglylyslysalaglulys
210215220
<210>35
<211>33
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>35
aaaaaacatatggcggcgccggcggtgaaggtg33
<210>36
<211>35
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>36
aaaaaagaattctcacttctctgccttctttccga35
<210>37
<211>212
<212>prt
<213>拟南芥(arabidopsisthaliana)
<400>37
metalaglyilelysvalpheglyhisproalaserilealathrarg
151015
argvalleuilealaleuhisglulysasnleuaspphegluleuval
202530
hisvalgluleulysaspglygluhislyslysglupropheleuser
354045
argasnpropheglyglnvalproalaphegluaspglyaspleulys
505560
leuphegluserargalailethrglntyrilealahisargtyrglu
65707580
asnglnglythrasnleuleuglnthraspserlysasnilesergln
859095
tyralailemetalaileglymetglnvalgluasphisglnpheasp
100105110
provalalaserlysleualaphegluglnilephelysseriletyr
115120125
glyleuthrthraspglualavalvalalaglugluglualalysleu
130135140
alalysvalleuaspvaltyrglualaargleulysgluphelystyr
145150155160
leualaglygluthrphethrleuthraspleuhishisileproala
165170175
ileglntyrleuleuglythrprothrlyslysleuphethrgluarg
180185190
proargvalasnglutrpvalalagluilethrlysargproalaser
195200205
glulysvalgln
210
<210>38
<211>215
<212>prt
<213>白杨(populustrichocarpa)
<400>38
metalathrprovalthriletyrglyproproleuserthralaval
151015
serargvalleualathrleuileglulysaspvalprophehisleu
202530
valproileaspleuserlysglygluglnlyslysproglutyrleu
354045
lysileglnpropheglyglnvalproalaphelysaspgluserile
505560
thrleuphegluserargalailecysargtyrilecysasplystyr
65707580
alaasplysglyasnargserleutyrglythraspileleuserlys
859095
alaasnileaspglntrpvalgluthraspglyglnthrpheglypro
100105110
proserglyaspleuvalhisaspleuleupheserservalproval
115120125
aspglualaleuilelyslysasnvalasplysleualalysvalleu
130135140
aspiletyrgluglnlysleuglyglnthrargpheleualaglyasp
145150155160
glupheserphealaaspleuserhisleuproasnglyasptyrleu
165170175
valasnserthrasplysglytyrleuphethrserarglysasnval
180185190
asnargtrptrpthrgluileserasnargglusertrplyslysval
195200205
leuglumetarglysasnala
210215
<210>39
<211>214
<212>prt
<213>玉米(zeamays)
<400>39
metalaprometlysleutyrglyalavalmetsertrpasnleuthr
151015
argcysalathralaleugluglualaglyserasptyrgluileval
202530
proileasnphealathralagluhislysserprogluhisleuval
354045
argasnpropheglyglnvalproalaleuglnaspglyaspleutyr
505560
leuphegluserargalailecyslystyralaalaarglysasnlys
65707580
progluleuleuarggluglyasnleugluglualaalametvalasp
859095
valtrpilegluvalglualaasnglntyrthralaalaleuasnpro
100105110
ileleupheglnvalleuileserprometleuglyglythrthrasp
115120125
glnlysvalvalaspgluasnleuglulysleulyslysvalleuglu
130135140
valtyrglualaargleuthrlyscyslystyrleualaglyaspphe
145150155160
leuserleualaaspleuasnhisvalservalthrleucysleuphe
165170175
alathrprotyralaservalleuaspalatyrprohisvallysala
180185190
trptrpserglyleumetgluargproservalglnlysvalalaala
195200205
leumetlysproserala
210
<210>40
<211>212
<212>prt
<213>小麦(triticumaestivum)
<400>40
metalaprovallysleutyrglyalathrleusertrpasnvalthr
151015
argcysvalalaalaleugluglualaglyvalglntyrgluileval
202530
proileasnpheglythrglygluhislysserproasphisleuala
354045
argasnpropheglyglnvalproalaleuglnaspglyaspleutyr
505560
valphegluserargalailecyslystyralacysarglysasnlys
65707580
progluleuleulysgluglyaspilelysgluseralametvalasp
859095
valtrpleugluvalglualahisglntyrthralaalaleuserpro
100105110
ileleupheglucysleuilehisprometleuglyglyalathrasp
115120125
glnlysvalileaspaspasnleuvallysilelysasnvalleuala
130135140
valtyrglualahisleuserlysserlystyrleualaglyaspphe
145150155160
leuserleualaaspleuasnhisvalservalthrleucysleuala
165170175
alathrprotyralaserleupheaspalatyrprohisvallysala
180185190
trptrpthraspleuleualaargproservalglnlysvalalaala
195200205
leumetlyspro
210
<210>41
<211>222
<212>prt
<213>小麦(triticumaestivum)
<400>41
metgluprometlysvaltyrglytrpalavalserprotrpmetala
151015
argvalleuvalserleugluglualaglyalaasptyrgluleuval
202530
prometserargasnglyglyasphisargargprogluhisleuala
354045
argasnpropheglygluileprovalleuglutyrglyglyleuthr
505560
leutyrglnserargalailealaarghisileleuarglyshislys
65707580
proglyleuleuglyalaglyserleuglugluseralametvalasp
859095
valtrpvalaspvalaspalahishisleugluprovalleulyspro
100105110
ilevaltrpasncysileileasnprophevalglyargaspvalasp
115120125
glnglyleuvalaspgluservalglulysleulyslysleuleuglu
130135140
valtyrglualaargleuserserasnlystyrleualaglyaspphe
145150155160
valserphealaaspleuthrhispheserphemetargtyrphemet
165170175
alathrgluhisalavalvalleuaspalatyrprohisvallysala
180185190
trptrplysalaleuleualaargproservallyslysvalileala
195200205
glymetproproasppheglypheglyserglyargilepro
210215220
<210>42
<211>213
<212>prt
<213>小麦(triticumaestivum)
<400>42
metalaproilelysleutyrglymetmetleuseralaasnvalthr
151015
argvalthrthrleuleuasngluleuglyleuglupheasppheval
202530
aspvalaspleuargthrglyalahislyshisproasppheleulys
354045
leuasnpropheglyglnileproalaleuglnaspglyaspgluval
505560
valphegluserargalaileasnargtyrilealathrlystyrgly
65707580
alaserleuleuprothrproseralalysleuglualatrpleuglu
859095
valgluserhishisphetyrproproalaargthrleuvaltyrglu
100105110
leuvalilelysprometleuglyalaprothraspalaalagluval
115120125
asplysasnalaalaaspleualalysleuleuaspvaltyrgluala
130135140
hisleualaalaglyasnlystyrleualaglyaspalapheproleu
145150155160
alaaspalaasnhismetsertyrleuphemetleuthrlysserpro
165170175
lysalaaspleuvalalaserargprohisvallysalatrptrpglu
180185190
gluileseralaargproalatrpalalysthrvalalaserilepro
195200205
leuproproalaval
210
<210>43
<211>218
<212>prt
<213>小麦(triticumaestivum)
<400>43
metalaprovallysvalpheglyproalametserthrasnvalala
151015
argvalleuvalcysleuglugluvalglyalaglutyrgluvalval
202530
aspileaspphelysalametgluhislysserprogluhisleuval
354045
argasnpropheglyglnileproalapheglnaspglyaspleuleu
505560
leuphegluserargalailealaargtyrvalleuarglystyrlys
65707580
lysasngluvalaspleuleuarggluglyaspleulysglualaala
859095
metvalaspvaltrpthrgluvalaspalahisthrtyrasnproala
100105110
ileserproilevaltyrglucysserserthralahisalaargleu
115120125
prothrasnglnthrvalvalaspgluserleuglulysleulysasn
130135140
valleugluvaltyrglualaargleuserlyshisasptyrleuala
145150155160
glyaspphevalserphealaaspleuasnhispheprotyrthrphe
165170175
tyrphemetalathrprohisalaalaleupheaspsertyrprohis
180185190
vallysalatrptrpgluargilemetalaargproalavallyslys
195200205
leualaalaglnmetvalprolyslyspro
210215
<210>44
<211>34
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>44
aaaaaagtcgacatggcggcgccggcggtgaagg34
<210>45
<211>32
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>45
aaaaaagcggccgctcacttctctgccttctt32
<210>46
<211>35
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>46
cacgggggactctagatggcgccggcggtgaaggt35
<210>47
<211>35
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>47
gatcggggaaattcgctactctgctttctttccaa35
<210>48
<211>24
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>48
cgcctaaggtcactatcagctagc24
<210>49
<211>18
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>49
gaactccagcatgagatc18
<210>50
<211>22
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>50
agaggacctaacagaactcgcc22
<210>51
<211>30
<212>dna
<213>人工的(artificial)
<220>
<223>合成dna
<400>51
aaaaaacttaagctactctgctttctttcc30
- 还没有人留言评论。精彩留言会获得点赞!