生物强化细胞营养素在制备促中枢神经细胞再生的功能食品中的应用的制作方法
本发明涉及一种生物强化细胞营养素的用途,特别是涉及生物强化细胞营养素在制备促中枢神经细胞再生的功能食品中的应用
背景技术:
我们人类的身体由上万亿个细胞组成,这些细胞是人体结构的基本功能单位,细胞的健康是在核酸的调控下,依靠蛋白质、多种氨基酸、多肽、多糖、多种微量元素、矿物质等带有生物活性的物质以维持细胞的正常代谢。细胞有特定的职责,协同工作,保持着我们的身体健康。身体内的每个组织由细胞构成,而相关细胞组织集群便构成了人体的器官。虽然这些器官由功能不同的细胞构成,但是,它们需要同样的基本营养成分,这便是支撑细胞代谢的基础物质。细胞是有寿命的,理论上说,如果为细胞提供合适的、足够的基本营养成分,淘汰凋亡的细胞,精确复制已经存在的健康的细胞,提高人体对于疾病的自愈能力,我们人类可延缓衰老,保持健康。
人体对于疾病的自愈能力,即是人类依靠自身的内在生命力,依靠免疫系统、神经系统和内分泌系统为主的修复机制,修复受损的细胞、摆脱疾病与亚健康状态的一种保持身体健康的能力。当人体的自愈力下降时,是因为某些人体器官组织系统缺少足够的营养因子,细胞不能正常地代谢,不能完全正确地复制健康细胞和液化凋亡的细胞。由于细胞的不正确的复制,使得细胞的正常功能打了折扣,身体的自我修复能力减低,这直接影响了人体对于疾病的抵抗能力,一旦遭遇外界不良因素,人体就会生病。
神经系统是机体内对生理功能活动的调节起主导作用的系统,体内各器官、系统的功能和各种生理过程都是在中枢神经系统的直接或间接的调节、控制下进行的。然而,随着年龄的增长,细胞衰老、脑血管意外、外伤、肿瘤等各种因素均会对中枢神经系统造成各种各样的损伤,出现中枢神经细胞的病变、凋亡等现象,并最终引起认知能力下降、甚至行为障碍等各种神经退行性疾病。鉴于中枢神经系统在身体功能活动中的主导地位,中枢神经细胞的病变是致残致亡的最常见和最重要因素,往往给病人和家属的生活造成巨大影响,所带来的经济负担十分沉重。不幸的是,中枢神经细胞损伤后,传统的治疗措施效果非常有限,发病或损伤后康复的希望很渺茫,因此对新的预防和治疗方法有着极大的需求。近年的研究证明,与身体其它部位一样,中枢神经系统也存在神经干细胞。因此,促进中枢神经干细胞向神经细胞方向分化、进而促进中枢神经细胞的再生,可以增强中枢神经功能、防止神经退行性疾病、以及促进受损神经康复。为此,开发可以促进中枢神经干细胞向神经元方向分化、增强中枢神经细胞再生的食品具有非常大的价值。与传统治疗药物相比,功能性食品能够提高患者的顺应性,降低使用不适感,使治疗过程无负担、治疗效果无副作用。
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种生物强化细胞营养素在制备促中枢神经细胞再生的功能食品中的应用。
本发明的技术方案概述如下:
生物强化细胞营养素在制备促中枢神经细胞再生的功能食品中的应用。
上述生物强化细胞营养素是用下述方法制成:
(一)母液的制备:
(1)选取谷类为原料,清洗分离杂质后,置于纸浆蒸煮机中加入原料总重量30%~50%的水,启动纸浆蒸煮机,旋转浸泡30~60分钟;
(2)停止旋转,将水放净,打开冷气机,通入冷气,旋转保持-4℃以下60~90分钟,停止旋转;
(3)关闭冷气机,打开空压机,通入室温空气,旋转,升温至室温;
(4)关闭空压机,停止旋转,通入蒸汽,旋转,保持100℃,30~60分钟,关闭蒸汽;
(5)停止旋转,打开空压机,通入室温空气,旋转,降至30℃~50℃;
(6)停止旋转,加入原料总重量1%~3%的营养配料粉,旋转30~60分钟;所述营养配料为重量比为1:2:3:1的灵芝、枸杞、蓝莓果和肉桂;
(7)停止旋转,加入原料总重量0.2%~0.4%的复合酶,旋转1~2小时;
(8)加入原料总重量0.2%~1%食用菌种,旋转使均匀;停止旋转,分装至发酵桶,在28~35℃发酵8~15天,即得母液备用;
(二)胶料的制备:
(1)另取谷类为第二原料,用18~30℃水浸泡8~16小时;沥水,置于容器内;
(2)向容器内加入第二原料重量1~2倍的水,煮1~3小时;
(3)过滤,去除水,获得胶料备用;
(三)成品的制备:
(1)将母液与胶料按重量比为1:1~2的比例,混合,分离除渣,得混合液;
(2)加入混合液重量1%~2%的低聚异麦芽糖,混合液重量0.2%~0.7%的黄原胶,混合液重量0~1%的阿胶,均质;灌装灭菌,得生物强化细胞营养素;
所述复合酶是质量比为3:3:1:1的糖化酶、淀粉酶、纤维素酶和果胶酶;
所述食用菌种为面包酵母,甜酒曲酵母、植物乳杆菌、嗜酸乳杆菌和保加利亚乳杆菌至少两种。
优选地,原料为黑糯米、黄糯米、白糯米、紫米、黍米、粟米、香米、高粱米、大米和薏米中的至少五种。
第二原料优选黑糯米、黄糯米和白糯米至少一种。
本发明的优点:
实验证明,低浓度(5μl/ml以下)生物强化细胞营养素对神经干细胞没有毒性,但具有显著促进胚胎以及成年中枢神经干细胞向神经细胞方向分化的作用,口服生物强化细胞营养素可以增强成年大脑神经前体细胞向成熟神经元的分化,从而可以用于预防和治疗神经退行性疾病、提高中枢神经功能以及促进损伤神经的康复。
附图说明
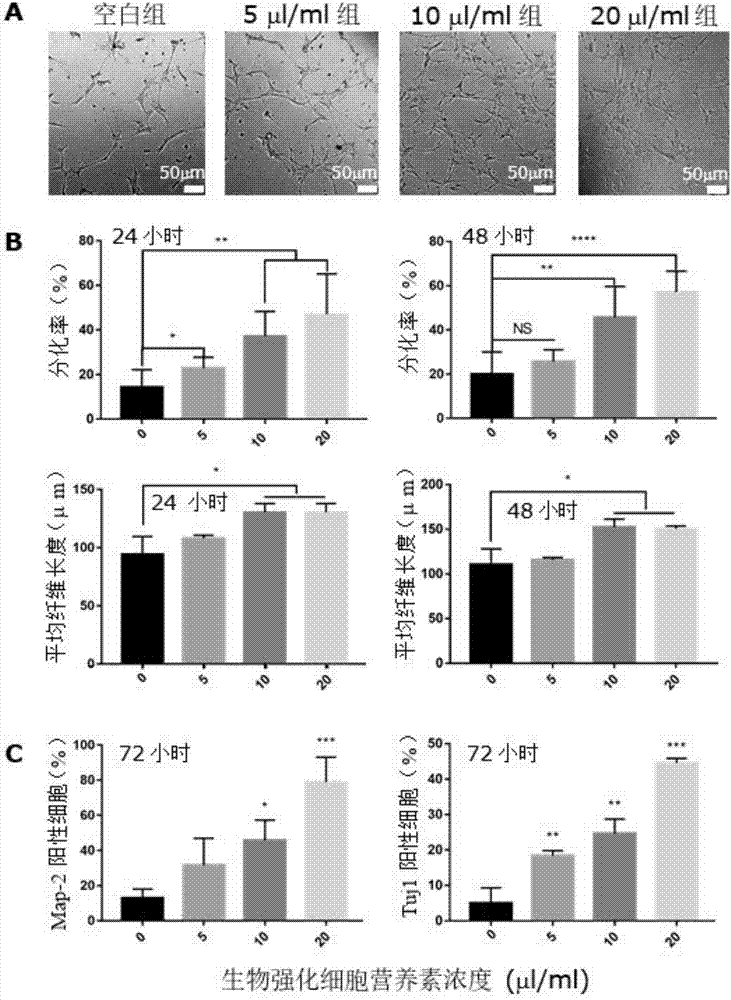
图1为生物强化细胞营养素对小鼠神经母细胞瘤的影响:生物强化细胞营养素处理小鼠神经母细胞瘤(neuro-2a)后,分化的细胞中神经细胞比例和神经突的长度都显著增加;
图2为生物强化细胞营养素对大鼠胚胎神经干细胞的影响:生物强化细胞营养素处理大鼠胚胎神经干细胞(embryonicneuralstemcell,nsc)后,分化的细胞中神经细胞比例和神经突的长度都显著增加;
图3为生物强化细胞营养素对成年大鼠神经前体细胞的影响:生物强化细胞营养素处理成年大鼠神经前体细胞(neuralprogenitorcell,npc)后,分化的细胞中神经细胞比例和神经突的长度都显著增加;
图4为口服生物强化细胞营养素对成年小鼠海马区神经前体细胞的影响:口服生物强化细胞营养素使成年小鼠海马区新增生的神经元增加。
图5为口服生物强化细胞营养素实验的实验流程说明图。
具体实施方式
本发明的实施例是为了使本领域的技术人员能够更好的理解本发明,但并不对本发明作任何限制。
本发明所采用的各个食用酵母菌均购自安琪酵母股份有限公司(但并不对本发明作任何限制,其它公司生产的功能相同的食用酵母菌也可以用于本发明);各个乳杆菌购自丹麦汉森公司(但并不对本发明作任何限制,其它公司生产的功能相同的乳杆菌也可以用于本发明)。
下面结合具体实施例对本发明作进一步的说明。
实施例1
生物强化细胞营养素用下述方法制成:
(一)母液的制备:
(1)选取重量比例为1:1:1:2:2的黑糯米、黄糯米、紫米、黍米和大米五种谷物为原料,清洗分离杂质后,置于纸浆蒸煮机中加入原料总重量30%的水,启动纸浆蒸煮机,旋转浸泡30分钟;浸泡的目的是使原料充分吸收水份;
(2)停止旋转,将水放净,打开冷气机,通入冷气,旋转保持-4℃以下60分钟,停止旋转;放冷的目的是使吸水后的原料膨胀;
(3)关闭冷气机,打开空压机,通入室温空气,旋转,升温至室温;提前预热的目的是为了下一步通蒸汽之前的温度升高而节省能源;
(4)关闭空压机,停止旋转,通入蒸汽,旋转,保持100℃,60分钟,关闭蒸汽;其目的是熟化并消毒;
(5)停止旋转,打开空压机,通入室温空气,旋转,降至30℃;其目的为后续加入营养配料、复合酶及菌种提供合适的温度;
(6)停止旋转,加入原料总重量2%的营养配料粉,旋转30分钟;所述营养配料为重量比为1:2:3:1的灵芝、枸杞、蓝莓果和肉桂;
(7)停止旋转,加入原料总重量0.2%的复合酶,旋转1小时;复合酶是质量比为3:3:1:1的糖化酶、淀粉酶、纤维素酶和果胶酶;
(8)加入原料总重量0.2%食用菌种,旋转使均匀;停止旋转,分装至发酵桶,在28℃发酵15天,即得母液备用;食用菌种为重量比为3:1的面包酵母菌和保加利亚乳杆菌;
(二)胶料的制备:
(1)另取重量比为1:1的黄糯米和白糯米为第二原料,用18℃水浸泡16小时;沥水,将沥水后的米置于容器内;
(2)向容器内加入第二原料重量1倍的水,煮1小时;
(3)过滤,去除水,获得胶料备用;
(三)成品的制备:
(1)将母液与胶料按重量比为1:1的比例,混合,分离除渣,得混合液;
(2)加入混合液重量1%的低聚异麦芽糖,混合液重量0.2%的黄原胶,均质;灌装灭菌,得生物强化细胞营养素。
本实施例中的旋转转速均为15转/分钟。
实施例2
生物强化细胞营养素用下述方法制成:
(一)母液的制备:
(1)选取重量比为1:1:2:1:1:2:1的黑糯米、紫米、黍米、白糯米、粟米、高粱米和大米七种谷物为原料,清洗分离杂质后,置于纸浆蒸煮机中加入原料总重量40%的水,启动纸浆蒸煮机,旋转浸泡40分钟;
(2)停止旋转,将水放净,打开冷气机,通入冷气,旋转保持-4℃以下80分钟,停止旋转;
(3)关闭冷气机,打开空压机,通入室温空气,旋转,升温至室温;
(4)关闭空压机,停止旋转,通入蒸汽,旋转,保持100℃,50分钟,关闭蒸汽;
(5)停止旋转,打开空压机,通入室温空气,旋转,降至40℃;
(6)停止旋转,加入原料总重量1%的营养配料粉,旋转60分钟;所述营养配料为重量比为1:2:3:1的灵芝、枸杞、蓝莓果和肉桂;
(7)停止旋转,加入原料总重量0.3%的复合酶,旋转1.5小时,复合酶是质量比为3:3:1:1的糖化酶、淀粉酶、纤维素酶和果胶酶;
(8)加入原料总重量0.5%食用菌种,旋转使均匀;停止旋转,分装至发酵桶,在32℃发酵12天,即得母液备用;食用菌种为重量比为2:1:1的面包酵母、甜酒曲酵母和植物乳杆菌;
(二)胶料的制备:
(1)另取重量比为1:1的黄糯米和白糯米为第二原料,用30℃水浸泡8小时;沥水,置于容器内;
(2)向容器内加入第二原料重量1.5倍的水,煮2小时;
(3)过滤,去除水,获得胶料备用;
(三)成品的制备:
(1)将母液与胶料按重量比为1:1.5的比例,混合,分离除渣,得混合液;
(2)加入混合液重量2%的低聚异麦芽糖,混合液重量0.4%的黄原胶,混合液重量0.1%的阿胶,均质;灌装灭菌,得生物强化细胞营养素。
本实施例中的旋转转速均为20转/分钟。
实施例3
生物强化细胞营养素用下述方法制成:
(一)母液的制备:
(1)选取重量比为1:1:1:2:1:0.5:1:1:0.5的黑糯米、白糯米、紫米、黍米、粟米、香米、高粱米、大米和薏米九种谷物为原料,清洗分离杂质后,置于纸浆蒸煮机中加入原料总重量50%的水,启动纸浆蒸煮机,旋转浸泡60分钟;
(2)停止旋转,将水放净,打开冷气机,通入冷气,旋转保持-4℃以下90分钟,停止旋转;
(3)关闭冷气机,打开空压机,通入室温空气,旋转,升温至室温;
(4)关闭空压机,停止旋转,通入蒸汽,旋转,保持100℃,30分钟,关闭蒸汽;
(5)停止旋转,打开空压机,通入室温空气,旋转,降至50℃;
(6)停止旋转,加入原料总重量3%的营养配料粉,旋转30分钟;营养配料为重量比为1:2:3:1的灵芝、枸杞、蓝莓果和肉桂;
(7)停止旋转,加入原料总重量0.4%的复合酶,旋转2小时,复合酶是质量比为3:3:1:1的糖化酶、淀粉酶、纤维素酶和果胶酶;
(8)加入原料总重量1%食用菌种,旋转使均匀;停止旋转,分装至发酵桶,在35℃发酵8天,即得母液备用;食用菌种为重量比为2:1:1的面包酵母、甜酒曲酵母和嗜酸乳杆菌;
(二)胶料的制备:
(1)另取黑糯米为第二原料,用25℃水浸泡10小时;沥水,置于容器内;
(2)向容器内加入第二原料重量2倍的水,煮3小时;
(3)过滤,去除水,获得胶料备用;
(三)成品的制备:
(1)将母液与胶料按重量比为1:2的比例,混合,分离除渣,得混合液;
(2)加入混合液重量2%的低聚异麦芽糖,混合液重量0.7%的黄原胶,混合液重量1%的阿胶,均质;灌装灭菌,得生物强化细胞营养素。
各实施例中的转速为15-20转/分钟,其目的是使物料混匀,但对转速并不限制,达到混匀目的的其它转速也可以使用。
在实施例1-3的基础上再加以微波、气流干燥、喷雾等烘干技术,可将本发明制成粉体状食品,减轻了液体灌装的重量,方便外出携带,食用时即冲即食;
在实施例1-3的基础上再在上述成品工序中将黄原胶的加入比例提高,加入天然果胶,也可制成类似果冻状食品,或添加到巧克力、麦乳精、饼干、面包等食品中食用;也可精制成口服液服用。又可制成固体羹状食品,此外,本发明还可制成饼干、糖果、点心等食品,方便各类群体食用。
实施例4
生物强化细胞营养素(实施例1制备)促进小鼠神经母细胞瘤细胞向神经元方向分化:
实验步骤:
(1)细胞铺板:当小鼠神经母细胞瘤细胞(neuro-2a)(购自美国atcc生物资源中心)生长处于对数期时,用2ml胰酶将细胞消化下来,用等体积含有10%fbs(胎牛血清)的mem完全培养基终止消化,然后将胰酶与细胞悬液的混合液吸入到15毫升的离心管中,在离心机中于以1035rpm离心5min,弃上清,加入2ml新鲜的mem培养基重新悬浮细胞,进行细胞计数,将细胞浓度进行适当稀释,按照1x105/孔的密度接种于24孔板中(200μl/孔)。
(2)药物处理:新接种的细胞在37℃,5%co2培养箱中培养12h后,吸去培养基,加入含有0,5,10,20μl实施例1制备的生物强化细胞营养素的新培养基,在37℃,5%co2培养箱中继续培养至设定的时间。每个浓度设置三个复孔。
(3)细胞免疫荧光染色:map-2免疫荧光染色实验用于对neuro-2a细胞分化情况进行鉴定。在neuro-2a细胞经生物强化细胞营养素处理24h和48h后,吸走培养板中旧培养基,pbs(磷酸盐缓冲液)清洗两次,用4%pfa(多聚甲醛)固定30min,然后用0.3%tritonx-100透膜处理20min,透膜处理结束以后用含有3%bsa的pbst(含0.3%tritonx-100)作封闭处理20min,孵育一抗(rabbitanti-mousemap-2,1:500),于4℃孵育12h。孵育结束以后,用pbs清洗3次,加入二抗(1:1000,goatanti-rabbit)常温孵育2h,pbs清洗两次,用dapi染液复染细胞核,在荧光显微镜下观察、拍照。
(4)细胞形态观察和统计分析:在neuro-2a细胞经生物强化细胞营养素处理24h和48h后,在荧光显微镜下观察细胞形态,拍照后用imagej软件对经不同浓度生物强化细胞营养素处理不同时间以后的neuro-2a细胞的分化情况进行量化分析,量化项目包括分化细胞比率和神经突长度,量化数据用graphpadprism5软件进行统计分析。
实验结果表明,实施例1制备的生物强化细胞营养素可以显著促进neuro-2a细胞分化成为有很多突起的细胞(图1a,20μl/ml),免疫荧光染色证明分化的细胞中绝大多数为map-2阳性的神经元(图1b)。统计分析表明生物强化细胞营养素处理小鼠神经母细胞瘤后,分化的细胞中神经细胞比例(图1c)和神经突的长度(图1d)都显著增加,且生物强化细胞营养素的作用呈现明显的剂量和时间依赖性(图1c-d)。本实验结果证明,实施例1制备的生物强化细胞营养素能够促进小鼠神经母细胞瘤neuro-2a细胞向神经元方向分化。
实验证明,实施例2、实施例3制备的生物强化细胞营养素促进neuro-2a细胞向神经元方向分化的活性与实施例3的活性相似。
实验例5
生物强化细胞营养素(实施例1制备)促进大鼠胚胎神经干细胞向神经元方向分化:
实验步骤:
(1)大鼠胚胎神经干细胞球体外培养:取孕18天的wistar大鼠胚胎(怀孕大鼠购自长春亿斯实验动物技术有限责任公司)3只,用手术剪剪下整个大脑,置于预冷的d-hanks平衡液(invitrogen)中,在无菌工作台上,剥离出胚胎前脑放于新鲜的dmem/f12的基础培养基中,用眼科剪将胚胎前脑组织剪碎成小块,再用枪头反复吹打,直到变成细胞悬液。收集细胞悬液以后在细胞筛网(nest)上过滤3次,从而获得单细胞悬液。收集单细胞悬液到15-ml离心管中,低温离心机1032rpm离心5min,弃上清,用3ml新鲜的dmem/f12完全培养基(dmem/f12,egf20mg/l,fgf-210mg/l,glutamine2mmol/l,b272%,1%p-s)重新悬浮细胞,均匀接种于细胞培养皿或孔板中。置于细胞培养箱中37℃,5%co2培养3-8天,这时可以看到质地均匀,圆滑饱满的神经球形成。
(2)神经干细胞贴壁培养和分化:当神经球生长到第6天时,神经干细胞生长处于旺盛的增殖阶段,这时形成的神经干细胞球透明且均匀。将悬浮神经球收集到无菌的15-mlep管中,1035rpm离心5min,弃上清,加入1ml胰蛋白酶,置于37℃恒温培养箱中消化5min,然后加入2ml10%dmem/f12培养基终止消化,用细胞移液器反复吹打形成细胞悬液,1035rpm离心去上清,再用6ml无血清的dmem/12培养基重新悬浮细胞,经40μm尼龙网(nest)过滤,从而获得单细胞悬液。进行细胞计数,然后按照5x104/ml的细胞数接种在用pdl预处理过的24孔板中。
(3)药物处理:设置实验组和对照组,细胞贴壁后实验组各用5μl/ml,10μl/ml,20μl/ml三个浓度梯度生物强化细胞营养素处理细胞,对照组为正常培养的细胞,所有实验都设三个复孔。
(4)细胞免疫荧光染色:map-2和tuj-1免疫荧光染色实验用于对神经干细胞(nsc)分化情况进行鉴定。在nsc细胞经生物强化细胞营养素处理72h后,吸走培养板中旧培养基,pbs清洗两次,用4%pfa固定30min,然后用0.3%tritonx-100透膜处理20min,透膜处理结束以后用含有3%bsa的pbst(含0.3%tritonx-100)作封闭处理20min,孵育一抗(rabbitanti-mousemap-2,1:500或rabbitanti-mousetuj-1,1:400),于4℃孵育12h。孵育结束以后,用pbs清洗3次,加入二抗(1:1000,goatanti-rabbit)常温孵育2h,pbs清洗两次,用dapi染液复染细胞核,在荧光显微镜下观察、拍照。
(5)细胞形态观察和统计分析:nsc细胞经生物强化细胞营养素处理不同时间后,在荧光显微镜下观察细胞形态,拍照后用imagej软件对经不同浓度生物强化细胞营养素处理不同时间以后的细胞的分化情况进行量化分析,量化项目包括分化细胞比率和神经突长度,量化数据用graphpadprism5软件进行统计分析。
实验结果显示,nsc细胞贴壁24h后开始长出神经突(图2a,control),在生物强化细胞营养素处理以后,发现有更多细胞长出了神经突,神经突明显伸长并且有大量分支形成,神经突进一步交叉连接,形成丰富的神经网络连接结构(图2a,5μl/ml,10μl/ml,20μl/ml),生物强化细胞营养素的作用呈现明显的剂量和时间依赖性(图2b:分化细胞比例和神经突起长度;2c:map-2和tuj-1阳性细胞比例)。本实验证明,实施例1制备的生物强化细胞营养素可以促进大鼠胚胎神经干细胞向成熟神经元方向的分化。
实验证明,实施例2、实施例3制备的生物强化细胞营养素在促进大鼠胚胎神经干细胞nsc向神经元方向分化的活性与实施例1的活性相近。
实验例6
生物强化细胞营养素(简称zge)(实施例1制备)促进成年大鼠神经前体细胞向神经元方向分化:
实验步骤:
(1)成年大鼠海马神经前体细胞的获取:实验用wistar大鼠购自长春亿斯实验动物技术有限责任公司。先将大鼠麻醉,75%酒精消毒后置于超净无菌工作台上,用手术剪剪下整个大脑,置于预冷的d-hanks平衡液(invitrogen)中,在无菌工作台上,剥离整个大脑并置于d-hanks平衡液中,仔细剥离出其海马部位,放入新鲜dmem/f12的基础培养基中,并用眼科剪将海马组织剪碎成小块,再用枪头反复吹打,直到变成细胞悬液。收集细胞悬液以后在细胞筛网(nest)上过滤3次,从而获得单细胞悬液。收集单细胞悬液到15-ml离心管中,于4℃,1032rpm离心5min,弃上清,用3ml新鲜的dmem/f12完全培养基(dmem/f12,egf20mg/l,fgf-210mg/l,glutamine2mmol/l,b272%,1%p-s)重新悬浮细胞,均匀接种于细胞培养皿或孔板中。置于细胞培养箱中37℃,5%co2培养6-8天,这时可以看到质地均匀,圆滑饱满的神经球形成。
(2)神经干细胞贴壁培养和分化:当神经细胞球生长6-8天时,细胞生长处于旺盛的增殖阶段,这时形成的神经球透明且均匀,由该阶段神经球消化形成的单个细胞分裂迅速,生长状态优良。收集这个阶段的悬浮神经球到无菌的15-mlep管中,1035rpm离心5min,弃上清,加入1ml胰蛋白酶,置于37℃恒温培养箱中消化5min,然后加入2ml10%dmem/f12培养基终止消化,用细胞移液器反复吹打形成细胞悬液,1035rpm离心去上清,再用6ml无血清的dmem/12培养基重新悬浮细胞,经40μm尼龙网(nest)过滤,从而获得单细胞悬液。进行细胞计数,然后按照5x104/ml的细胞数目接种在用pdl预处理过的24孔板中。
(3)药物处理:设置实验组以及对照组,实验组各用5μl/ml,10μl/ml,20μl/ml三个浓度梯度生物强化细胞营养素处理细胞,对照组为正常培养的单细胞npc。
(4)细胞免疫荧光染色:map-2和tuj-1免疫荧光染色实验用于对npc细胞分化情况进行鉴定。在npc细胞经生物强化细胞营养素处理72h以后,吸走培养板中旧培养基,pbs清洗两次,用4%pfa固定30min,然后用0.3%tritonx-100透膜处理20min,透膜处理结束以后用含有3%bsa的pbst(含0.3%tritonx-100)作封闭处理20min,孵育一抗(rabbitanti-mousemap-2,1:500或rabbitanti-mousetuj-1,1:400),于4℃孵育12h。孵育结束以后,用pbs清洗3次,加入二抗(1:1000,goatanti-rabbit)常温孵育2h,pbs清洗两次,用dapi染液复染细胞核,在荧光显微镜下观察、拍照。
(5)细胞形态观察和统计分析:npc细胞经生物强化细胞营养素处理不同时间后,在荧光显微镜下观察细胞形态,拍照后用imagej软件对经不同浓度生物强化细胞营养素处理不同时间以后的细胞的分化情况进行量化分析,量化项目包括分化细胞比率和神经突长度,量化数据用graphpadprism5软件进行统计分析。
实验结果显示,npc细胞贴壁24h后开始长出神经突,在生物强化细胞营养素(zge)处理以后,与对照组相比有更多细胞长出了神经突。免疫荧光染色证明分化的细胞和纤维突起中绝大多数为map-2以及tuj-1阳性(图3a)。统计分析表明zge处理成年大鼠npc后,分化的细胞中神经细胞比例(图3b)和神经突的长度(图3c)都显著增加,且zge的作用呈现明显的剂量和时间依赖性(图3a-c)。本实验证明,实施例1制备的生物强化细胞营养素(zge)可以促进成年大鼠神经前体细胞npc向成熟神经元方向的分化。
实验证明,实施例2、实施例3制备的生物强化细胞营养素在促进成年大鼠神经前体细胞npc向神经元方向分化的活性与实施例3的活性相近。
实验例7
口服生物强化细胞营养素(实施例1制备)促进成年小鼠海马区神经前体细胞向神经元方向分化:
实验步骤:
(1)小鼠灌胃:6-8周龄c57b6l小鼠购自北京维通利华实验动物技术有限公司。实验组每天对其用生物强化细胞营养素(zge)进行灌胃,灌胃体积为300μl,对照组每天用pbs进行同样的处理,连续进行30天,在实验开始后的最初7天对小鼠进行brdu腹腔注射(50mg/kg,每天一次)7天后停用brdu,继续口服生物强化细胞营养素或生理盐水至第29天,如图5所示:
(2)组织块包埋固定:第29天晚上,对小鼠进行麻醉,用pfa进行心脏灌流,然后用手术剪分离小鼠整个大脑,并置于40%蔗糖溶液中作沉降过夜,第二天用oct包埋组织,包埋盒外倒入异戊烷,然后加入干冰,使oct迅速凝固。组织储存于-80℃的低温冰箱中保存。
(3)切片:切片前,先将组织置于-20℃冰箱中复温30min,然后放入冷冻切片机中进行冠状切片,切片厚度为30μm.切至海马区时开始收集第一片切片,连续切5片并贴于5张不同载玻片上,然后在载玻片上的另一位置粘贴接下来的五片组织,每张载玻片上组织片数目为4片,直至海马区域被完全收集。切片保存于-80℃冰箱中。
(4)免疫组织化学染色:从-80取出切片,室温复温,4%pfa固定20min,3%bsa(用pbst稀释)封闭处理15min,然后孵育一抗(mouseanti-brdu1:200,rabbitanti-neun1:500),4℃过夜,然后孵育二抗(donkeyanti-mouse1:1000和goatanti-rabbit1:1000),dapi封片,显微镜下观察拍照。
(5)brdu+/neun+细胞数目分析:从第一片载玻片开始,每相邻的5片载玻片片中随机取出一张(总共取出数目为n/5),进行免疫荧光染色实验,统计这张载玻片上所有组织切片brdu+/neun+细胞数目,记为m1,依次类推,接下来的五片载玻片中随机取出一片进行染色,记下其数目为m2……,则该小鼠海马区brdu+/neun+细胞数目约为m1*5+m2*5+……+m(n/5)*5。分别随机选取实验组和对照组中的5只小鼠的海马组织进行切片分析,用graphpadprism统计分析实验组和对照组中小鼠海马dg区brdu+/neun+细胞数目,实验结果如图4a所示,图中绿色为brdu,红色为neun。统计所得细胞数目用graphpaprism软件进行分析。结果见图4b。
本实验证明口服实施例1制备的生物强化细胞营养素(zge)可以促进成年小鼠海马区npc向神经元方向分化,使成年小鼠海马区新增生的神经元增加。
实验证明,实施例2、实施例3制备的生物强化细胞营养素促进小鼠海马区npc向神经元方向分化的活性与实施例1的活性相近。
- 还没有人留言评论。精彩留言会获得点赞!