一种由SubtilosinA与蒲公英根多糖制备复合免疫增强剂的方法及其应用
一种由subtilosin a与蒲公英根多糖制备复合免疫增强剂的方法及其应用
技术领域
1.本发明涉及复合免疫增强剂的制备方法,具体涉及一种由subtilosin a与蒲公英根多糖制备复合免疫增强剂的方法及其应用。
背景技术:
2.subtilosin a是枯草芽孢杆菌所产生的一种抗菌物质,它能较好地抑制革兰氏阳性菌和部分革兰氏阴性菌的生长,其中包括一些nisin不敏感的菌株,而且能够对阴道结合病原菌具有抑制作用而对人体正常的乳酸菌群无任何毒副作用,且与单月桂酸甘油酯、lauric arginate等具有协同作用,复合使用能够更好的抑制病原菌的生长。
3.枯草芽孢杆菌及其代谢产物均具有显著的抗细菌能力,并且与天然产物联合运用能够达到免疫增强的作用。而蒲公英多糖作为蒲公英中的重要组成部分,可以作为生物体中的重要的营养成分,还参与多种生物活性,具有抗病毒,抑菌,增强免疫力,抗辐射等多种生理功能。多糖可以作为天然的,几乎无副作用的一种提取物,在诸多疾病的预防和治疗上有独特的疗效。
4.目前,现有的复合免疫增强剂都是使用活菌制剂制成,但存在者在肠道环境中的协同作用不好,兼容性差,成本高的问题,以及在进入肠道时容易受到胃酸和胆汁的作用,在达到起效部位肠道之前活菌数会大幅度下降,从而影响益生菌产品的疗效。
技术实现要素:
5.发明目的:针对现有技术存在的问题,本发明提供一种从枯草芽孢杆菌jcl16中提取subtilosin a与蒲公英根多糖制成复合免疫增强剂的方法,本发明制备的复合免疫增强剂采用的是jcl16产生的抗菌物质subtilosin a,具有协同作用好,相容性好,成本低的优点,并且本发明采用的两种物质都具有耐酸,耐碱等的特点,解决了现有菌剂在胃酸的作用下无法发挥其应有的抗菌作用的问题。
6.本发明提供制备的复合免疫增强剂及其应用。
7.技术方案:为了实现上述目的,本发明所述一种由subtilosin a与蒲公英根多糖制备复合免疫增强剂的方法,其特征在于,包括以下步骤:
8.(1)对枯草芽孢杆菌进行发酵培养,发酵液离心去除菌体,取其上清液,调节ph值为强酸性使其产生沉淀;
9.(2)对沉淀进行浸提,收集浸提液,调节ph至中性,搅拌;
10.(3)对浸提液进行离心,去除沉淀物,收集上清液,即得subtilosin a的粗提液;
11.(4)通过固相萃取柱对步骤(3)的subtilosin a的粗提液进行分离纯化,得到分离纯化之后的subtilosin a提取液;
12.(5)称取蒲公英根干粉,加入水搅拌混合均匀,之后用超声波浸提,结束后冷却至室温;离心后用真空抽滤,收集滤液,得到蒲公英根多糖粗提液;
13.(6)将蒲公英根多糖粗提液用离子交换柱层析,收集流出液,再将流出液用凝胶柱进行纯化,得到纯化后的蒲公英根多糖提取液;
14.(7)将步骤(4)收集的subtilosin a提取液和步骤(6)蒲公英多糖溶液将易挥发的溶剂蒸发干,之后将这两种溶液按体积比为1:1-10混合,将其制成复合颗粒,得到最终的复合免疫颗粒剂。
15.其中,步骤(1)中枯草芽孢杆菌为枯草芽孢杆菌jcl16。
16.其中,步骤(1)中枯草芽孢杆菌进行发酵培养为从固体培养基中挑取单一的枯草芽孢杆菌jcl16菌落,接种到30ml的种子培养基中培养16-18h,转速为180r/min,温度为37℃,之后将种子液按体积比为5%-10%接种到到发酵培养基中培养24-48h,温度为35℃-43℃,转速160r/min-240r/min得到发酵培养基。
17.其中,步骤(1)中所述的种子液培养时间为16-18h,种子培养基为牛肉膏5g/l,蛋白胨10g/l,nacl 5g/l,ph值为7.2。发酵培养基为lb培养基:胰蛋白胨10g/l,nacl 10g/l,酵母粉5g/l。
18.其中,步骤(1)中用hcl调节ph值为2-3,在4℃环境下静至过夜,使其产生沉淀。
19.作为优选,步骤(1)中所述的离心条件为8000r/min,3min、hcl浓度为5-7mol/l。
20.其中,步骤(2)中用甲醇对沉淀进行浸提,收集甲醇浸提液,再用naoh溶液将甲醇浸提液的ph值调节至7.0进行搅拌。
21.作为优选,步骤(2)中将静至过夜之后的发酵上清液进行离心,离心去除上清液,保留沉淀,离心条件为10000r/min、5min,naoh溶液浓度为1-3mol/l,搅拌为磁力搅拌器搅拌,时间为7-9h。
22.作为优选,步骤(3)的离心为离心条件为10000g、20min。
23.其中,步骤(4)中通过c18固相萃取柱对步骤(3)的subtilosin a的粗提液进行分离纯化,分别用3倍柱体积30%,50%,70%,100%的甲醇水溶液梯度洗脱,收集100%甲醇水洗脱的流出液,即可得到分离纯化之后的subtilosin a提取液。
24.其中,步骤(5)中蒲公英根干粉和水比为1:10-50g/ml,所述的超声波浸提中的超声时间为0.5-2.5h,温度为50-90℃,超声功率为60-140w。
25.作为优选,步骤(7)中所述的离心条件为8000r/min、20min。
26.其中,步骤(6)中将蒲公英根多糖粗提液用deae-52离子交换柱层析,打开恒流泵以0.6-1ml/min的流速进行上样,之后用0.1-0.5mol/lnacl溶液进行洗脱,洗脱速度为0.6-1ml/min,收集流出液,再将流出液用葡萄糖凝胶柱sephadexg-100进行纯化每次上样量为1.5ml,洗脱液为0.1-0.5mol/lnacl溶液,以0.6-1ml/min流速洗脱,最终得到纯化后的蒲公英根多糖提取液。
27.进一步地,步骤(1)中所述种子培养时间为17h,所述的hcl浓度为6mol/l。步骤(2)中所述的naoh溶液浓度为2mol/l,磁力搅拌器搅拌时间为8h。步骤(5)中所述的超声波浸提法中的时间为1.5h,温度为60℃,超声功率为100w,料液比为1:30g/ml。步骤(6)中所述的nacl溶液浓度为0.1mol/l。步骤(7)中所述的溶液体积比为1:5。
28.本发明所述的由subtilosin a与蒲公英根多糖制备复合免疫增强剂的方法所制备的免疫增强剂。
29.本发明所述的免疫增强剂在制备动物饲料中的应用。
30.本发明先对枯草芽孢杆菌jcl16培养条件进行优化;提取jcl16产生的subtilosin a;提取蒲公英中的多糖;通过喷雾干燥法将两种物质进行复合。与现有的复合免疫剂相比,本发明的复合免疫剂使用的是抗菌产物,具有协同作用好,相容性好,成本低的优点,并且本发明采用的两种物质都具有耐酸,耐碱等的优点。
31.本发明利用枯草芽孢杆菌jcl16产生的抗菌物质subtilosin a以及蒲公英多糖进行复合,形成免疫增强剂,具有很好的协同作用和免疫增强的能力,并且能够忍受胃酸的酸性。
32.有益效果:与现有技术相比,本发明具有如下优点:
33.本发明所制备的复合免疫增强剂具有很好的耐酸特性,其中使用的蒲公英来源广泛,成本低,subtilosin a以及蒲公英多糖进行复合两种物质在酸性条件下具有很好的协同作用,兼容性好,对免疫力有增强作用,进入肠道之后不会使疗效降低。并且生产成本低,能够大规模生产。
附图说明
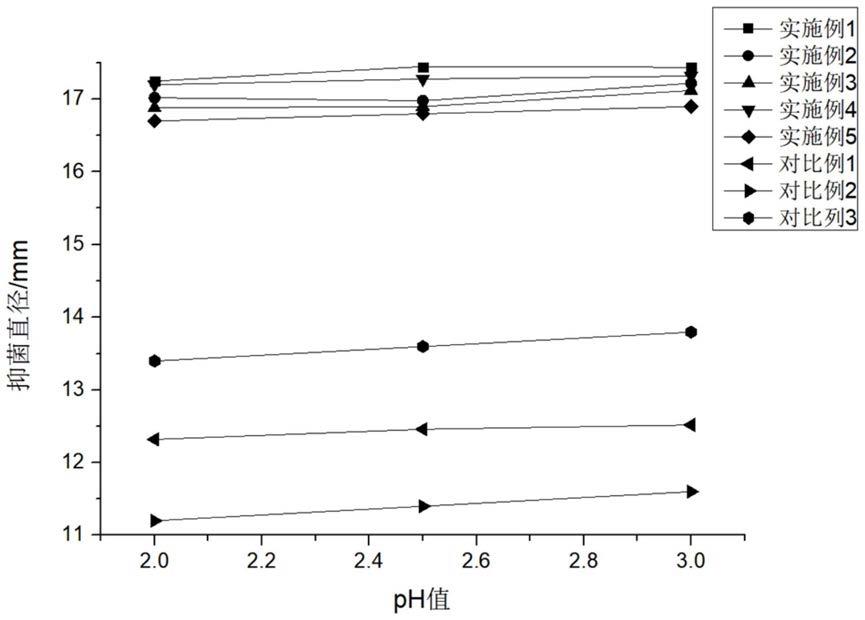
34.图1为复合免疫颗粒剂抑菌情况随ph值变化示意图。
35.图2为复合免疫颗粒剂在模拟肠液中的抑菌情况图。
36.具体实施方法
37.以下结合附图和实施例对本发明作进一步说明。
38.下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂家建议的条件。
39.本发明中菌株jcl16,经鉴定为枯草芽孢杆菌(bacillus subtilis),已保藏于中国典型微生物保藏中心,保藏时间为2018年06月01日,保藏编号为cctcc no:m2018336,在申请人在先专利cn 111411053 a中已经公开保藏,属于已公开的菌株。
40.实施例1
41.(1)将保藏的菌株jcl16活化,涂布在固体lb培养基中,从固体培养基中挑取单菌落,放入配置好的30ml种子培养液中培养17h,温度为37℃,转速为180r/min,之后将种子液按体积比5%接种到发酵培养液中培养24h,温度为37℃,转速为200r/min。
42.(2)收集发酵培养好的菌液进行离心,转速为8000r/min、3min,之后去除菌体,收集离心上清液,用浓度为6mol的hcl溶液将收集好的上清液ph值调到2.0,放入4℃的环境下静置过夜,使其产生沉淀。
43.(3)将过夜之后的离心上清液进行离心,离心条件为10000r/min,5min,离心去除上清液,收集沉淀,再以甲醇:上清液=1:10的体积比列对沉淀进行浸提,之后用2mol/l的naoh的溶液将甲醇抽提液ph值调到7.0,用磁力搅拌器搅拌8小时。
44.(4)用离心机离心步骤(3)中处理之后的甲醇浸提液,离心条件为10000g,20min,去除沉淀,收集离心上清液,即可得到subtilosin a粗提液。
45.(5)将收集好的subtilosin a粗提液用c18固相萃取柱进行分离纯化,分别用3倍柱体积的30%,50%,70%,100%的甲醇水溶液梯度洗脱,收集100%甲醇溶液洗脱下来的流出液,即可得到分离纯化后的subtilosin a提取液。
46.(6)称取蒲公英根干粉100g,按料液比1:30g/ml加入蒸馏水搅拌混合均匀,调节超
声功率为100w,超声温度为60℃,再超声1.5h,取出溶液冷却至室温。
47.(7)将步骤(6)中的溶液用离心机离心,离心条件为8000r/min,20min,收集离心之后的溶液用真空抽滤机抽滤,收集滤液即可得到蒲公英根多糖粗提液。
48.(8)将蒲公英根多糖粗提液用deae-52离子交换柱层析,准确量取5ml的样品,打开恒流泵以1ml/min的流速进行上样,结束上样后,用0.1mol/l的nacl溶液对多糖溶液洗脱,洗脱速度为1ml/min,收集流出液。再用sephadex g-100葡萄糖凝胶柱进一步纯化,条件为:使用2.6*60cm的洗脱柱,将收集的流出液进行上样,每次上样量为1.5ml,洗脱液为0.1mol/l的nacl溶液,以1ml/min的流速洗脱,收集流出液,即为纯化后蒲公英根多糖。
49.(9)由于这两种溶液中的物质不会被蒸发,收集的subtilosin a提取液和蒲公英多糖溶液用旋转蒸发仪将其中的易挥发溶剂蒸干,其中调节温度为50℃,转速调节合适即可,之后将这两种溶液按体积比为1:5制成混合溶液,再用喷雾干燥法将其制成复合颗粒,得到最终的复合免疫颗粒剂。
50.用6mol/l盐酸将无菌水调节ph至2.0,2.5,3.0再将颗粒剂按质量比为1:5溶于无菌水中放置在37℃下处理12h。之后在用2mol/lnaoh溶液将溶液调回ph为7.0,进行抑菌(金黄色葡萄球菌)实验,测量抑菌直径如图1。
51.采用牛津杯法进行抑菌活性的测定,具体步骤包括:将以培养到对数期的金黄色葡萄球菌为指示菌,平板牛津杯垂直放置在平板上,分别取0.2ml的复合免疫颗粒剂溶液打入到牛津杯中,进行实验对比,37℃条件下培养24h,观察牛津杯周围抑菌圈,抑菌圈直径/mm=总直径/mm-牛津杯直径/mm,测量抑菌直径如图1。
52.模拟肠液:称取磷酸二氢钾6.8g,溶于无菌水中,调节ph值为6.8,称量10g的胰蛋白酶用适量无菌水溶解,之后将两溶液混合稀释至1000ml,将颗粒剂按质量比为1:5溶于无菌水中放置在37℃下处理12h。之后在用2mol/lnaoh溶液将溶液调回ph为7.0,进行抑菌(金黄色葡萄球菌)实验(方法同上)。空白对照组为不加颗粒剂,显示无抑菌性。
53.实施列2
54.(1)将保藏的菌株jcl16活化,涂布在固体lb培养基中,从固体培养基中挑取单菌落,放入配置好的30ml种子培养液中培养17h,温度为37℃,转速为180r/min,之后将种子液按体积比6%接种到发酵培养液中培养36h,温度为35℃,转速为240r/min。
55.(2)收集发酵培养好的菌液进行离心,转速为8000r/min、3min,之后去除菌体,收集离心上清液,用浓度为6mol的hcl溶液将收集好的上清液ph值调到2.0,放入4℃的环境下静置过夜,使其产生沉淀。
56.(3)将过夜之后的离心上清液进行离心,离心条件为10000r/min,5min,离心去除上清液,收集沉淀,再以甲醇:上清液=1:10的体积比列对沉淀进行浸提,之后用2mol/l的naoh的溶液将甲醇抽提液ph值调到7.0,用磁力搅拌器搅拌7小时。
57.(4)用离心机离心步骤(3)中处理之后的甲醇浸提液,离心条件为10000g,20min,去除沉淀,收集离心上清液,即可得到subtilosin a粗提液。
58.(5)将收集好的subtilosin a粗提液用c18固相萃取柱进行分离纯化,分别用3倍柱体积的30%,50%,70%,100%的甲醇水溶液梯度洗脱,收集100%甲醇溶液洗脱下来的流出液,即可得到分离纯化后的subtilosin a提取液。
59.(6)称取蒲公英根干粉100g,按料液比1:10g/ml加入蒸馏水搅拌混合均匀,调节超
声功率为60w,超声温度为50℃,再超声0.5h,取出溶液冷却至室温。
60.(7)将步骤(6)中的溶液用离心机离心,离心条件为8000r/min,20min,收集离心之后的溶液用真空抽滤机抽滤,收集滤液即可得到蒲公英根多糖粗提液。
61.(8)将蒲公英根多糖粗提液用deae-52离子交换柱层析,准确量取5ml的样品,打开恒流泵以1ml/min的流速进行上样,结束上样后,用0.1mol/l的nacl溶液对多糖溶液洗脱,洗脱速度为1ml/min,收集流出液。再用sephadex g-100葡萄糖凝胶柱进一步纯化,条件为:使用2.6*60cm的洗脱柱,将收集的流出液进行上样,每次上样量为1.5ml,洗脱液为0.1mol/l的nacl溶液,以1ml/min的流速洗脱,收集流出液,即为纯化后蒲公英根多糖。
62.(9)收集的subtilosin a提取液和蒲公英多糖溶液用旋转蒸发仪将其中的易挥发溶剂蒸干,其中调节温度为50℃,转速调节合适即可,之后将这两种溶液按体积比为1:5制成混合溶液,再用喷雾干燥法将其制成复合颗粒,得到最终的复合免疫颗粒剂。抑菌实验同实施例1。
63.实施列3
64.(1)将保藏的菌株jcl16活化,涂布在固体lb培养基中,从固体培养基中挑取单菌落,放入配置好的30ml的种子培养液中培养17h,温度为37℃,转速为180r/min,之后将种子液按体积比7%接种到发酵培养液中培养48h,温度为39℃,转速为220r/min。
65.(2)收集发酵培养好的菌液进行离心,转速为8000r/min、3min,之后去除菌体,收集离心上清液,用浓度为6mol的hcl溶液将收集好的上清液ph值调到2.0,放入4℃的环境下静置过夜,使其产生沉淀。
66.(3)将过夜之后的离心上清液进行离心,离心条件为10000r/min,5min,离心去除上清液,收集沉淀,再以甲醇:上清液=1:10的体积比列对沉淀进行浸提,之后用2mol/l的naoh的溶液将甲醇抽提液ph值调到7.0,用磁力搅拌器搅拌9小时。
67.(4)用离心机离心步骤(3)中处理之后的甲醇浸提液,离心条件为10000g,20min,去除沉淀,收集离心上清液,即可得到subtilosin a粗提液。
68.(5)将收集好的subtilosin a粗提液用c18固相萃取柱进行分离纯化,分别用3倍柱体积的30%,50%,70%,100%的甲醇水溶液梯度洗脱,收集100%甲醇溶液洗脱下来的流出液,即可得到分离纯化后的subtilosin a提取液。
69.(6)称取蒲公英根干粉100g,按料液比1:20g/ml加入蒸馏水搅拌混合均匀,调节超声功率为80w,超声温度为70℃,再超声1h,取出溶液冷却至室温。
70.(7)将步骤(6)中的溶液用离心机离心,离心条件为8000r/min,20min,收集离心之后的溶液用真空抽滤机抽滤,收集滤液即可得到蒲公英根多糖粗提液。
71.(8)将蒲公英根多糖粗提液用deae-52离子交换柱层析,准确量取5ml的样品,打开恒流泵以1ml/min的流速进行上样,结束上样后,用0.1mol/l的nacl溶液对多糖溶液洗脱,洗脱速度为1ml/min,收集流出液。再用sephadex g-100葡萄糖凝胶柱进一步纯化,条件为:使用2.6*60cm的洗脱柱,将收集的流出液进行上样,每次上样量为1.5ml,洗脱液为0.1mol/l的nacl溶液,以1ml/min的流速洗脱,收集流出液,即为纯化后蒲公英根多糖。
72.(9)收集的subtilosin a提取液和蒲公英多糖溶液用旋转蒸发仪将其中的易挥发溶剂蒸干,其中调节温度为50℃,转速调节合适即可,之后将这两种溶液按体积比为1:5制成混合溶液,再用喷雾干燥法将其制成复合颗粒,得到最终的复合免疫颗粒剂。抑菌实验同
实施例1。
73.实施列4
74.(1)将保藏的菌株jcl16活化,涂布在固体lb培养基中,从固体培养基中挑取单菌落,放入配置好的30ml的种子培养液中培养17h,温度为37℃,转速为180r/min,之后将种子液按体积比8%接种到发酵培养液中培养48h,温度为41℃,转速为180r/min。
75.(2)收集发酵培养好的菌液进行离心,转速为8000r/min、3min,之后去除菌体,收集离心上清液,用浓度为6mol的hcl溶液将收集好的上清液ph值调到3.0,放入4℃的环境下静置过夜,使其产生沉淀。
76.(3)将过夜之后的离心上清液进行离心,离心条件为10000r/min,5min,离心去除上清液,收集沉淀,再以甲醇:上清液=1:10的体积比列对沉淀进行浸提,之后用2mol/l的naoh的溶液将甲醇抽提液ph值调到7.0,用磁力搅拌器搅拌8小时。
77.(4)用离心机离心步骤(3)中处理之后的甲醇浸提液,离心条件为10000g,20min,去除沉淀,收集离心上清液,即可得到subtilosin a粗提液。
78.(5)将收集好的subtilosin a粗提液用c18固相萃取柱进行分离纯化,分别用3倍柱体积的30%,50%,70%,100%的甲醇水溶液梯度洗脱,收集100%甲醇溶液洗脱下来的流出液,即可得到分离纯化后的subtilosin a提取液。
79.(6)称取蒲公英根干粉100g,按料液比1:40g/ml加入蒸馏水搅拌混合均匀,调节超声功率为120w,超声温度为80℃,再超声2h,取出溶液冷却至室温。
80.(7)将步骤(6)中的溶液用离心机离心,离心条件为8000r/min,20min,收集离心之后的溶液用真空抽滤机抽滤,收集滤液即可得到蒲公英根多糖粗提液。
81.(8)将蒲公英根多糖粗提液用deae-52离子交换柱层析,准确量取5ml的样品,打开恒流泵以1ml/min的流速进行上样,结束上样后,用0.1mol/l的nacl溶液对多糖溶液洗脱,洗脱速度为1ml/min,收集流出液。再用sephadex g-100葡萄糖凝胶柱进一步纯化,条件为:使用2.6*60cm的洗脱柱,将收集的流出液进行上样,每次上样量为1.5ml,洗脱液为0.1mol/l的nacl溶液,以1ml/min的流速洗脱,收集流出液,即为纯化后蒲公英根多糖。
82.(9)收集的subtilosin a提取液和蒲公英多糖溶液用旋转蒸发仪将其中的易挥发溶剂蒸干,其中调节温度为50℃,转速调节合适即可,之后将这两种溶液按体积比为1:5制成混合溶液,再用喷雾干燥法将其制成复合颗粒,得到最终的复合免疫颗粒剂。抑菌实验同实施例1。
83.实施列5
84.(1)将保藏的菌株jcl16活化,涂布在固体lb培养基中,从固体培养基中挑取单菌落,放入配置好的30ml的种子培养液中培养17h,温度为37℃,转速为180r/min,之后将种子液按体积比9%接种到发酵培养液中培养48h,温度为43℃,转速为160r/min。
85.(2)收集发酵培养好的菌液进行离心,转速为8000r/min、3min,之后去除菌体,收集离心上清液,用浓度为6mol的hcl溶液将收集好的上清液ph值调到3.0,放入4℃的环境下静置过夜,使其产生沉淀。
86.(3)将过夜之后的离心上清液进行离心,离心条件为10000r/min,5min,离心去除上清液,收集沉淀,再以甲醇:上清液=1:10的体积比列对沉淀进行浸提,之后用2mol/l的naoh的溶液将甲醇抽提液ph值调到7.0,用磁力搅拌器搅拌7小时。
87.(4)用离心机离心步骤(3)中处理之后的甲醇浸提液,离心条件为10000g,20min,去除沉淀,收集离心上清液,即可得到subtilosin a粗提液。
88.(5)将收集好的subtilosin a粗提液用c18固相萃取柱进行分离纯化,分别用3倍柱体积的30%,50%,70%,100%的甲醇水溶液梯度洗脱,收集100%甲醇溶液洗脱下来的流出液,即可得到分离纯化后的subtilosin a提取液。
89.(6)称取蒲公英根干粉100g,按料液比1:50g/ml加入蒸馏水搅拌混合均匀,调节超声功率为140w,超声温度为90℃,再超声2.5h,取出溶液冷却至室温。
90.(7)将步骤(6)中的溶液用离心机离心,离心条件为8000r/min,20min,收集离心之后的溶液用真空抽滤机抽滤,收集滤液即可得到蒲公英根多糖粗提液。
91.(8)将蒲公英根多糖粗提液用deae-52离子交换柱层析,准确量取5ml的样品,打开恒流泵以1ml/min的流速进行上样,结束上样后,用0.1mol/l的nacl溶液对多糖溶液洗脱,洗脱速度为1ml/min,收集流出液。再用sephadex g-100葡萄糖凝胶柱进一步纯化,条件为:使用2.6*60cm的洗脱柱,将收集的流出液进行上样,每次上样量为1.5ml,洗脱液为0.1mol/l的nacl溶液,以1ml/min的流速洗脱,收集流出液,即为纯化后蒲公英根多糖。
92.(9)收集的subtilosin a提取液和蒲公英多糖溶液用旋转蒸发仪将其中的易挥发溶剂蒸干,其中调节温度为50℃,转速调节合适即可,之后将这两种溶液按体积比为1:5制成混合溶液,再用喷雾干燥法将其制成复合颗粒,得到最终的复合免疫颗粒剂。抑菌实验同实施例1。
93.对比例1
94.(1)将保藏的菌株jcl16活化,涂布在固体lb培养基中,从固体培养基中挑取单菌落,放入配置好的30ml种子培养液中培养17h,温度为37℃,转速为180r/min,之后将种子液按体积比5%接种到发酵培养液中培养24h,温度为37℃,转速为200r/min。
95.(2)收集发酵培养好的菌液进行离心,转速为8000r/min、3min,之后去除上清液,收集菌体,之后用0.9%生理盐水清洗菌体再离心,条件为6000r/min、3min,重复三次,收集菌泥。最终体积为原发酵液体积的1/10,制成菌悬液。
96.(3)将菌悬液与脱脂牛奶按比列1:2的比列混合均匀后分装到冻干瓶中,装样高度为0.5-0.6cm,在-80℃的冰箱中预冻24小时。待快速冷冻干燥机开机预冷1小时后迅速将预冻好的样品放置物料盘内,在冷冻干燥机盖好之后,开始抽真空,进入真空冷冻干燥24小时。得到冻干菌粉,之后将冻干后的样品放置干燥处储存备用。
97.(4)将实施列1中的subtilosin a替换成冻干菌粉,其余不变。
98.对比例2为与本发明实施列1相同,不同之处在于将抗菌物质subtilosin a去除,全部替换成等量的蒲公英多糖。
99.对比例3为与本发明实施列1相同,不同之处在于将蒲公英多糖去除,全部替换成等量的抗菌物质subtilosin a。
100.对比例1-3的抑菌实验和模拟肠液中的抑菌情况同实施例1。
101.由图1可知,实施列1略高于实施列2-5,在酸性条件下,抑菌效果远高于对比例1,2和3。结果表明单独使用subtilosin a或者蒲公英多糖效果没有两者组合之后的效果好,在酸性条件下,使用菌粉的效果也不是很好。说明subtilosin a与蒲公英多糖具有很好的协同作用,能够起到免疫增强的,并且可以耐胃酸,在达到动物起效部位肠道之前有效成分不
易损失,保证疗效。由图2可知,在模拟ph值6.8的肠液中,颗粒剂的抑菌情况没有发生改变,并且实施例明显高于对比例,进一步说明本发明制备的复合免疫增强剂进入肠道之后不会使疗效降低。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1