无菌体液采集装置和方法与流程
无菌体液采集装置和方法相关申请的交叉引用本申请要求2012年12月4日提交的名称为“无菌体液采集装置和方法”的美国临时专利申请序列号61/733,199的优先权和利益,其全部公开内容通过引用合并于此。
背景技术:
本文描述的实施例总体涉及不经肠道获得体液样本,更具体地,涉及在减少微生物污染或体液源外部的其他污染物(诸如皮肤驻留的微生物)的情况下不经肠道获得体液样本的装置和方法。医疗保健行业从业者例行利用非经肠道获得的体液对患者进行各种类型的微生物测试。在一些情形中,测试患者样本(例如,体液)是否存在一种或多种潜在有害的微生物,诸如细菌、真菌或酵母属(例如,假丝酵母属)。微生物测试可包括在包含有助于微生物生长、实时诊断和/或基于PCR的方法的培养介质的一个或多个无菌器皿中培养患者样本。一般来说,当患者样本中存在这类微生物时,培养介质中的微生物随时间迅速增多。在可变的时间(例如,几小时至几天)之后,可通过自动的持续监控检测有机体的生长。这种自动监控可检测有机体生长所产生的二氧化碳。于是可测试培养介质中是否存在微生物。培养介质中微生物的存在表示从其获得样品的患者的体液中存在相同的微生物。因此,当确定培养介质中存在微生物时,患者的处方可以是一种或多种抗生素或者专门用于治疗或以其他方式去除患者体内的有害微生物的其他治疗方式。但是,患者样本可能在获得期间被污染和/或易于以其他方式导致错误的阳性结果。患者样本污染可能发生的一种方式是传送体表的微生物(例如,皮肤驻留的微生物),该微生物在针头插入患者期间被带走,随后被传送到具有患者样本的培养介质。体表和/或其他有害外部微生物可直接被带走,或经由组织碎片、毛囊、汗腺和其他附器结构被带走。另一种可能的污染源来自提取患者样本的人。例如,医生、采血师、护士等可将污染物从他们的身体(例如,手指、手臂等)传送到患者样本和/或传送到包含患者样本的仪器。进一步详述,在患者样本获得过程中(例如,患者至针头、针头/管至样本器皿等)使用的仪器和/或装置通常包括都可引入潜在的污染部位的多个流体分界面。这类仪器和/或装置的使用通常包括用以连接和/或流体耦接各个分界面的人工干预。由于这些分界面未被预组装和消毒为单个流体耦接系统,因此外部污染物可经由使用者(例如,医生、采血师等)和/或其他源(例如,环境空气、患者房间中的桌子和案台表面上的污染物、传送自亚麻织物或衣服的微生物等)被引入患者样本中。在一些情形中,这类污染物可在培养介质中存活并最终导致阳性微生物测试结果,由此错误地表明活体中存在这类微生物。在一些情形中,错误的阳性结果和/或错误的阴性结果可归因于患者样本的特定体积。例如,过度填充容积敏感的血液培养瓶可导致错误的阳性结果,如这类培养瓶的制造商提供的使用说明和/或警告标签以及相关的自动连续监控微生物检测系统提示的。在另一方面,作为另一例子,培养介质内不足的患者样本体积可导致错误的阴性结果。例如,在MayoClinic2011年12月在JournalofClinicalMicrobiology发表的名称为“OptimizedPathogenDetectionwith30-Comparedto20-MilliliterBloodCultureDraws”的研究中,20毫升(mL)的患者样本体积的结果是检测到患者样本中存在约80%的细菌,40毫升(mL)的患者样本体积的结果是检测到约88%的细菌,60毫升(mL)的患者样本体积的结果是检测到约99%的细菌。在试图诊断或治疗可疑的疾病或情况时由污染、患者样本体积不足等导致的这种不准确的结果是一个顾虑。例如,微生物测试的错误阴性结果可导致误诊和/或延迟治疗患者的疾病,在一些情形中,这可能导致患者死亡。相反,微生物测试的错误阳性结果可导致患者不必要地经受一种或多种抗生素疗法,这会对患者产生严重的副作用,包括例如死亡,以及由于延长了患者住院时间和/或与错误治疗相关的其他并发症而给医疗保健系统带来不必要的负担和花费。错误,因这些错误的阳性结果而进行的诊断成像仪器的使用在成本方面以及患者安全方面(因为不必要地暴露于与各种成像过程(例如,CT扫描)相关的大剂量辐射对患者的长期健康具有许多已知的负面影响)也是一个顾虑。因此,需要一种通过例如最小化患者样本和/或流体分界面暴露于周围的非无菌环境和/或其他外部污染源减少体液测试样本中的微生物污染的无菌“多合一”体液采集装置和方法。此外,这类体液采集装置需要包括准确计量、测量和/或其其他方式评估和确定从患者传送到样本储存器或培养介质的体液体积的装置,其可以是可视的、策略的或以其他方式与获得患者样本的医疗保健行业从业者基本实时地通信(例如,在患者床边)。
技术实现要素:
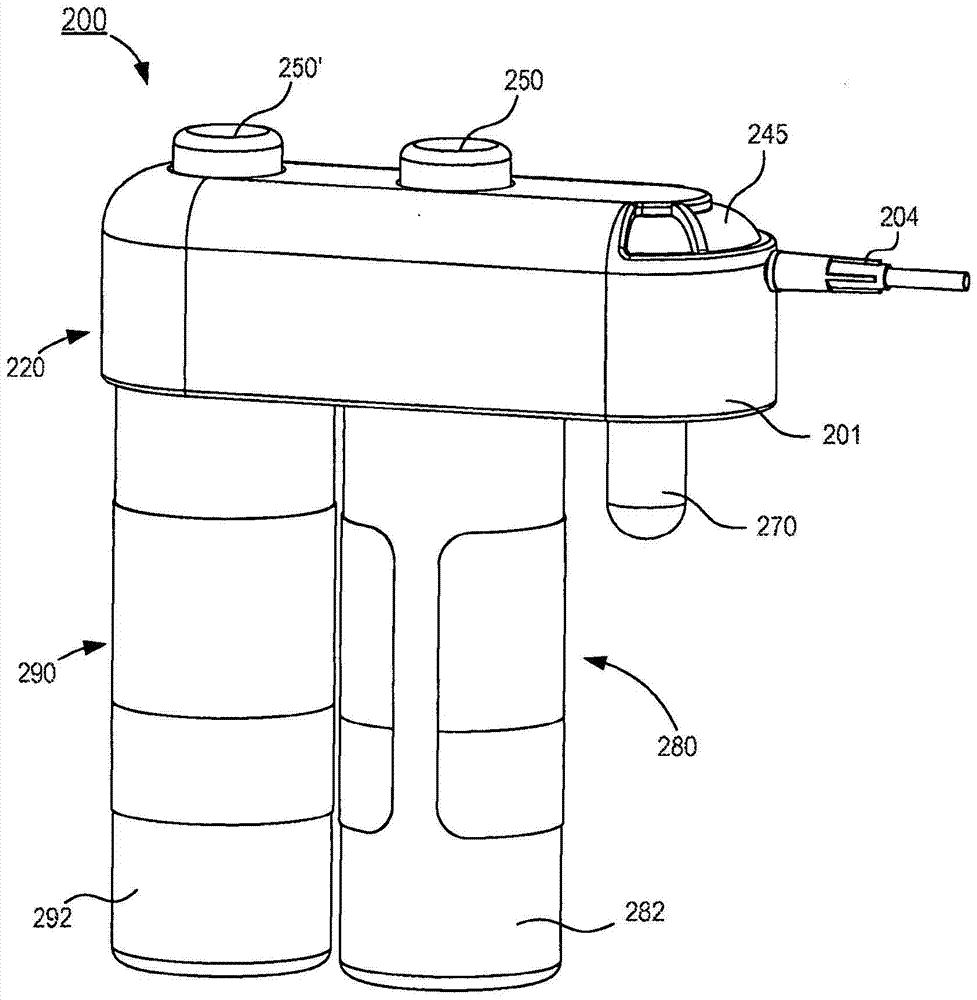
本文描述了用于在减少体液源外部的微生物(诸如皮肤驻留的微生物)和/或其他有害外部污染物的情况下不经肠道获得体液样本的装置。在一些实施例中,用于从患者获取体液样本的设备包括前样本储存器、转移机构和流计量机构。前样本储存器被配置为接收从患者抽取的第一体积的体液。转移机构包括入口端口、第一出口端口和第二出口端口,并且限定第一流体流路径和第二流体流路径。所述入口端口可耦接到用于从患者接收体液的内腔限定装置。所述第一出口端口和第二出口端口被配置为将所述前样本储存器和样本储存器分别流体耦接到所述转移机构。第一流体流路径被配置为使所述第一出口端口与所述入口端口流体连通,并且第二流体流路径被配置为使所述第二出口端口与所述入口端口流体连通。流计量机构与所述第一流体流路径和所述第二流体流路径流体连通。所述流计量机构被配置为计量通过所述第一流体流路径流入所述前样本储存器的第一体积的体液流并计量通过所述第二流体流路径流入所述样本储存器的第二体积的体液流。所述流计量机构被配置为显示与第一体积和第二体积相关的体积指示。附图说明图1是根据实施例的体液采集装置的示意图。图2是根据实施例的体液采集装置的立体图。图3是图2的体液采集装置的分解立体图。图4是沿图3的线X1-X1截取的图2的体液采集装置中包括的外壳的剖视侧视图。图5是沿图3的线X2-X2截取的图2的体液采集装置中包括的可移动构件的剖视图。图6和7分别是沿图3的线X3-X3和X4-X4截取的图2的体液采集装置中包括的流控制器的剖视图。图8是处于第一配置的图2的体液采集装置的顶视图。图9是沿图8的线X5-X5截取的处于第一配置的图2的体液采集装置的剖视图。图10是处于第二配置的图2的体液采集装置的顶视图。图11是沿图10的线X6-X6截取的处于第二配置的图2的体液采集装置的剖视图。图12和13分别是沿图10的线X6-X6截取的处于第三配置和第四配置的图2的体液采集装置的剖视图。图14是根据实施例的体液采集装置的立体图。图15是沿图14的线X7-X7截取的图14的体液采集装置的剖视侧视图。图16是根据实施例的体液采集装置的立体图。图17是图16的体液采集装置中包括的转移机构的分解立体图。图18是沿图16的线X8-X8截取的图16的体液采集装置中包括的分配构件的剖视侧视图。图19是处于第一配置的图16的体液采集装置的顶视图。图20是沿图19的线X9-X9截取的处于第一配置的图16的体液采集装置的一部分的剖视图。图21是处于第二配置的图16的体液采集装置的顶视图。图22是沿图21的线X10-X10截取的处于第二配置的图16的体液采集装置的剖视图。图23是根据实施例的体液采集装置的立体图。图24是沿线X11-X11截取的处于第一配置的图23的体液采集装置的一部分的剖视图。图25是沿线X11-X11截取的处于第二配置的图23的体液采集装置的剖视图。图26是根据实施例的体液采集装置的立体图。图27的图26的体液采集装置中包括的转移机构的分解立体图。图28是沿图27的线X13-X13截取的图26的体液采集装置中包括的分配构件的剖视图。图29是沿图27的线X14-X14截取的图26的体液采集装置中包括的耦接构件的剖视图。图30是沿图27的线X15-X15截取的图26的体液采集装置中包括的转盘的剖视图。图31是沿图27的线X16-X16截取的图26的体液采集装置中包括的阀的剖视图。图32是沿线X12-X12截取的处于第一配置的图26的体液采集装置的剖视图。图33是沿线X12-X12截取的处于第二配置的图26的体液采集装置的剖视图。图34是根据实施例的体液采集装置的立体图。图35的图34的体液采集装置中包括的转移机构的分解立体图。图36是沿线X17-X17截取的图35的转移机构中包括的分配构件的剖视图。图37是处于第一配置的图34的体液采集装置的一部分的顶视图。图38是沿线X18-X18截取的处于第一配置的图37的体液采集装置的一部分的剖视图。图39是处于第一配置的图33的体液采集装置的一部分的顶视图。图40是沿图39的线X19-X19截取的处于第一配置的图33的体液采集装置的剖视图。图41是根据实施例的处于第一配置的体液采集装置的立体图。图42是图41的体液采集装置的一部分的分解立体图。图43是沿线X20-X20截取的处于第一配置的图41的体液采集装置的剖视侧视图。图44是沿线X20-X20截取的处于第二配置的图41的体液采集装置的剖视侧视图。图45是沿线X20-X20截取的处于第三配置的图41的体液采集装置的剖视侧视图。图46是根据实施例的处于第一配置的体液采集装置的立体图。图47的图45的体液采集装置的一部分的分解立体图。图48是沿图47的线X21-X21截取的图46的体液采集装置中包括的分配构件的剖视侧视图。图49是沿图47的线X22-X22截取的图46的体液采集装置中包括的可移动构件的剖视图。图50是处于第一配置的图46的体液采集装置的顶视图。图51是沿图50的线X23-X23截取的处于第一配置的图46的体液采集装置的一部分的剖视图。图52是处于第二配置的图46的体液采集装置的顶视图。图53是沿图52的线X24-X24截取的处于第二配置的图46的体液采集装置的剖视图。图54是根据实施例的体液采集装置的立体图。图55是图54的体液采集装置的顶视图。图56是流程图,图示了利用根据实施例的采集装置获取减少污染的体液样本的方法。具体实施方式本文描述了用于在减少体液源外部的微生物(诸如皮肤驻留的微生物)和/或其他有害外部污染物的情况下不经肠道获得体液样本的装置。在一些实施例中,用于从患者获取体液样本的设备包括前样本储存器、转移机构和流计量机构。前样本储存器被配置为接收从患者抽取的第一体积的体液。转移机构包括入口端口、第一出口端口和第二出口端口,并且限定第一流体流路径和第二流体流路径。所述入口端口可耦接到用于从患者接收体液的内腔限定装置。所述第一出口端口和第二出口端口被配置为将所述前样本储存器和样本储存器分别流体耦接到所述转移机构。第一流体流路径被配置为使所述第一出口端口与所述入口端口流体连通,并且第二流体流路径被配置为使所述第二出口端口与所述入口端口流体连通。流计量机构与所述第一流体流路径和所述第二流体流路径流体连通。所述流计量机构被配置为计量通过所述第一流体流路径流入所述前样本储存器的第一体积的体液流并计量通过所述第二流体流路径流入所述样本储存器的第二体积的体液流。所述流计量机构被配置为显示与第一体积和第二体积相关的体积指示。在一些实施例中,用于从患者获取体液样本的设备包括前样本储存器、转移机构、流控制器和可移动构件。前样本储存器被配置为接收从患者抽取的第一体积的体液。转移机构包括入口端口、第一出口端口和第二出口端口。所述入口端口可耦接到用于从患者接收体液的内腔限定装置。所述第一出口端口将所述前样本储存器流体耦接到所述转移机构,并且所述第二出口端口将样本储存器流体耦接到所述转移机构。流控制器至少部分地位于所述转移机构内,并且可在第一配置和第二配置之间移动,在所述第一配置,所述流控制器限定在所述入口端口和所述第一出口端口之间的流体流路径的至少一部分,在所述第二配置,所述流控制器限定在所述入口端口和所述第二出口端口之间的流体流路径的至少一部分。可移动构件可移动地耦接到所述转移机构,并且可在所述样本储存器与所述入口端口和所述第二出口端口之间的流体流路径流体隔离的第一配置和所述样本储存器与所述入口端口和所述第二出口端口之间的流体流路径流体连通的第二配置之间移动通过所述第二出口端口。所述样本储存器被配置为当所述流控制器处于其第二配置并且所述可移动构件处于其第二配置时接收从患者抽取的第二体积的体液。在一些实施例中,用于从患者获取体液样本的设备包括前样本储存器、转移机构和流控制器。前样本储存器被配置为接收从患者抽取的第一体积的体液。转移机构包括外壳和分配构件。所述外壳限定第一孔口和第二孔口,所述第一孔口与所述前样本储存器流体连通。所述分配构件至少部分地位于所述外壳内并限定与所述第二孔口流体连通的流体流通道。所述分配构件包括与所述流通道流体连通的耦接部分并且被配置为物理地和流体地耦接到样本储存器。流控制器包括可耦接到用于从患者接收体液的内腔限定装置的入口端口。所述流控制器可旋转地耦接到所述转移机构并且可在所述入口端口与所述第一孔口流体连通的第一配置和所述入口端口与所述第二孔口流体连通的第二配置之间移动。在一些实施例中,一种利用流计量传送装置的方法,所述流计量传送装置具有转移机构,所述转移机构具有被配置为选择性地与前样本储存器和样本储存器流体连通的入口端口,并且所述流计量传送装置包括被配置为计量从患者流至所述前样本储存器和所述样本储存器的体液流的流计量机构,所述方法包括在患者和所述流计量传送装置的端口之间建立流体连通。然后,在所述端口和所述前样本储存器之间建立流体连通。计量从患者传送到所述前样本储存器的体液流。所述方法包括经由所述流计量传送装置的所述流计量机构验证位于所述前样本储存器中的前样本体积的体液是预定前样本体积的体液。在前样本体积位于前样本储存器中时,使所述前样本储存器与所述端口流体隔离,以将所述前样本体积的体液隔绝在所述前样本储存器中。当前样本储存器被流体隔离时,所述方法包括在所述端口和所述样本储存器之间建立流体连通。计量从患者传送到所述样本储存器的体液流。所述方法包括经由所述流计量传送装置的所述流计量机构验证位于所述样本储存器中的样本体积的体液是预定样本体积的体液。在一些实施例中,所述设备包括转移机构和流控制器。转移机构可限定入口端口、第一出口端口、第二出口端口和第三出口端口。第一出口端口流体耦接到前样本储存器,第二出口端口流体耦接到第一样本储存器,并且第三出口端口流体耦接到第二样本储存器,等等。所有流体储存器可彼此流体隔离。流控制器包括可容许沿特定方向的流体移动的各种流体通道并可被配置为可操作地耦接到转移机构。在使用时,当转移机构处于第一配置时,流控制器可容许体液流进入前样本储存器。转移机构可移动到第二配置,在该配置中,流控制器可容许体液流进入第一样本储存器。此外,之后可将转移机构移动到第三配置,由此流控制器可容许体液流进入第二样本储存器。在一些实施例中,体液采集装置可被配置为在允许第二体积的体液流入第一样本储存器和/或第三体积的体液流入第二样本储存器之前选择性地将第一预定体积的体液转移到前样本储存器中。以此方式,第二和/或第三体积的体液可用于诊断或其他测试,同时隔离可能包含来自(从其获得样本的)患者的体表或体外的其他源的微生物的第一体积的体液。在一些实施例中,根据将执行的分析和/或测试方案,体液采集装置可包括额外的样本储存器(例如,3、4、5、6个或更多个)。在一些实施例中,体液采集装置可包括流计量装置,以确保从患者采集合适体积的体液和/或将合适体积的体液传送到特定的前样本和/或样本储存器中。体液采集装置可被配置为在采集了经计量体积的体液之后自动地转移和/或控制流体流。例如,在采集了第一计量前样本体积之后,转移机构可被配置为将体液流转移到第一样本储存器,然后在采集了第一计量样本体积之后,转移机构可被配置为将体液流转移到第二样本储存器,等等。在一些实施例中,体液采集装置可包括计量体积显示器,诸如,例如,液晶显示器(LCD),以为使用者提供关于多少体液已经被采集到每个特定的单个样本储存器中的视觉指示。在一些实施例中,可提供多个显示器,以容许定制的前样本和/或样本体积采集。如在本说明书和所附权利要求中使用的,单数形式的冠词可包括复数个指示对象,除非上下文清晰地指示相反。因此,例如,用语“一个构件”意在表示单个构件或多个构件的组合,“一种材料”意在表示一种或多种材料或其组合。如在此使用的,“体液”可包括从患者身体获取的任何流体,包括但不限于,血液、脑脊液、尿液、胆汁、淋巴液、唾液、滑液、血清、胸膜液、羊水等,或其任意组合。如在此使用的,用语“第一预定量”、“第一量”和“第一体积”描述被配置为由第一储存器或前样本储存器接收或容纳的体液的量。虽然用语“第一量”和“第一体积”未明确描述预定量,但应该理解,第一量是第一预定量,除非存在明确的不同描述。如在此使用的,用语“第二量”和“第二体积”描述被配置为由第二储存器或样本储存器接收或容纳的体液的量。第二量可以是任何合适的体液量,不必是预定的。相反,当明确地如此描述时,第二储存器或样本储存器接收或容纳的第二量可以是第二预定量。如在此使用的,用语“组”可涉及多个特征或具有多个部分的单个特征。例如,当涉及一组壁时,一组壁可被认为是具有不同部分的一个壁,或者一组壁可为认为是多个壁。另一种类似的表述是,整体构造的项可包括一组壁。所述一组壁可包括例如彼此不连续的多个部分。一组壁还可由单独生产、之后接合在一起(例如,经由焊接、粘合剂或任何合适的方法)的多个项制成。如在此使用的,词语“近端”和“远端”分别涉及靠近和远离使装置与患者接触的使用者的方向。因此,例如,首先接触患者身体的装置端部将是远端,而装置的相反端(例如,使用者操纵的装置端部)将是装置的近端。如在此使用的,在与数值一起使用时,用语“约”、“近似”和“大体上”意在传达的是如此限定的值名义上是表述值。换言之,在与数值一起使用时,用语约、近似和大体上通常包括表述值±给定公差。例如,在一些情形中,合适的公差可以是表述值的±10%;因此,约0.5将包括0.45和0.55,约10将包括9至11,约1000将包括900至1100。在其他情形中,合适的公差可以表述值的最后一位有效数字的±可接受百分比。例如,合适的公差可以是最后一位有效数字的±10%;因此,约10.1将包括10.09和10.11,约25将包括24.5和25.5。这些变化可由制造公差或其他实际考虑(诸如,例如,与测量工具或可接受的人为误差等相关的公差)决定。当描述体液的预定体积和体液的采集体积之间的关系时,应该理解所述值包括合适的公差,诸如上文描述的那些。例如,当表述体液的采集体积大体上等于体液的预定体积时,采集体积和预定体积在合适的公差内名义上相等。在一些情形中,公差可由采集体积的体液的目的用途决定。例如,在一些情形中,当血液的采集体积在制造商(或最佳循证实践)的建议量的1.0%至5.0%内时血液培养物的化验的准确率可约为99%。例如,体液化验的制造商建议量可为每个样本采集瓶10毫升(mL),总计使用四至六个采集瓶(即,总体积40ml至60ml),对于约99%的可信度±5%。因此,10.5mL的采集体积将提供超过约99%可信度的结果,而11mL的采集体积将提供小于约99%可信度的结果。在其他情形中,合适的公差可以为0.1%、0.5%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0%、7.0%、8.0%、9.0%、10.0%或其之间的百分比的任何分数。在其他情形中,公差可大于10.0%。因此,本文描述的任何实施例可包括被配置为计量流和/或以其他方式测量合适公差内的体液体积的任何合适的流计量机构和/或装置,和/或与这样的机构和/或装置一起使用。此外。流计量机构和/或装置可被布置为用以最小化或消除可由不准确的测量和/或人为误差等的组合导致的公差叠加。图1是根据实施例的体液采集装置100的一部分的示意图。一般来说,体液采集装置100(在此被称作“流体采集装置”或“采集装置”)被配置为允许从患者抽取体液,从而使得第一部分或体积的抽取流体被转移远离将用作生物样本(诸如,为医疗诊断和/或治疗而进行测试)的第二和/或第三部分或体积的抽取流体。换言之,采集装置100被配置为将第一预定体积的体液传送到前样本采集储存器,并将第二和第三体积(或者,在一些实施例中,第四、第五等等)的体液传送到与前样本采集储存器流体隔离的一个或多个样本采集储存器,如本文更详细地描述的。采集装置100包括转移机构120、流控制器140、前样本储存器170、第一样本储存器180和不同于第一样本储存器180的第二样本储存器190。转移机构120包括入口端口121和至少两个出口端口,诸如第一出口端口125和第二出口端口126,如图1所示。在一些实施例中,转移机构120可包括与前样本储存器和样本储存器的总数相等的一组出口端口。例如,当采集装置100具有一个前样本储存器和四个样本储存器时,转移机构120可包括五个出口端口。在一些实施例中,转移机构120能够可操作地耦接到致动器(图1未示出),其可辅助转移机构120在多个配置之间的移动。入口端口121被配置为流体耦接到用于限定将体液从患者抽取和/或输送到采集装置100的路径X的医疗装置上。例如,入口端口121可流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。以此方式,转移装置120可经由针头或任何其他内腔限定装置从患者接收体液。转移机构120的第一出口端口125可流体耦接到前样本储存器170。在一些实施例中,前样本储存器170与第一出口端口125和/或转移机构120的一部分一体形成。在其他实施例中,前样本储存器170可经由粘合剂、阻力配合、机械紧固件、任意数量的配合凹口、螺纹耦接和/或任何其他合适的耦接或其组合而机械地和/或流体地耦接到转移机构120。另一种类似的表述是,前样本储存器170可物理地(例如,机械地)耦接到转移机构120,从而使得前样本储存器170所限定的内部容积与转移机构120的第一出口端口125流体连通。在其他实施例中,前样本储存器170可经由中间结构(图1未示出),诸如柔性无菌管,可操作地耦接到转移机构120的第一出口端口125。更具体地,该中间结构可限定被配置为使前样本储存器170与第一出口端口125流体连通的内腔。前样本储存器170被配置为接收和容纳第一预定体积的体液。在一些实施例中,前样本储存器170被配置为容纳第一体积的体液,从而使得第一体积与随后从患者抽取的第二和/或第三体积的体液(其可与第一体积的体液相同或不同)流体隔离开。前样本储存器170可以是用于容纳体液的任何合适的储存器,诸如,2012年6月12日公布的名称为“SystemsandMethodsforParenterallyProcuringBodily-FluidSampleswithReducedContamination”的美国专利No.8,197,420(在下文中称作“‘420专利”)中详细描述的前样本储存器,该专利的全部公开内容通过引用合并于此。在一些实施例中,转移机构120的第二出口端口126被配置为流体耦接到内腔限定装置上,该内腔限定装置可耦接到第一样本储存器180和第二样本储存器190。可选地,在其他实施例中,转移机构120的第二出口端口126可耦接到第一样本储存器180,并且转移机构120可具有耦接到第二样本储存器190上的第三出口端口(未示出)。在一些实施例中,第一样本储存器180可与第二出口端口126和/或转移机构120的一部分一体形成。在其他实施例中,第一样本储存器180可机械耦接到第二出口端口126或经由中间结构(诸如,上文参照前样本储存器170描述的)可操作地耦接到第二出口端口126。第一样本储存器180被配置为接收和容纳第二体积的体液。例如,第二体积的体液可以是在抽取第一前样本体积之后从患者抽取的量。在一些实施例中,第一样本储存器180被配置为以第二体积与第一体积的前样本体液流体隔离的方式容纳第二体积的体液。第一样本储存器180和第二样本储存器190可以是用于容纳体液的任何合适的无菌储存器,包括例如上文通过引用合并的‘420专利中描述的样本储存器。在一些实施例中,第二体积可以是任何合适的体液体积并且不需要是预定的。在一些实施例中,将体液传送到第一样本储存器180和/或第二样本储存器190可被计量等,从而使得第二体积是第二预定体积。第二样本储存器190可以是任何合适的样本储存器。在一些实施例中,第二样本储存器190可大体上类似于上述第一样本储存器180。第二样本储存器190可如上所述地流体耦接到第二出口端口126。第二出口端口126与第二样本储存器190的流体耦接可大体上类似于第二出口端口126与第一样本储存器180的流体耦接。因此,在此不进一步详细描述这些部分,并且应该认为大体上类似,除非存在明确的不同描述。此外,转移机构120的其他出口端口和样本储存器(图1未示出)可大体上类似于第二出口端口126和第一样本储存器180。在一些实施例中,前样本储存器170、第一样本储存器180和第二样本储存器190可以类似方式耦接到转移机构120(或与其形成在一起)。在其他实施例中,前样本储存器170、第一样本储存器180和第二样本储存器190不必以类似方式耦接到转移机构120。例如,在一些实施例中,前样本储存器170可与转移机构120(例如,第一出口端口124)一体形成,并且第一样本储存器180和/或第二样本储存器190可经由诸如柔性无菌管或其任意组合的中间结构可操作地耦接到转移机构120(例如,第二出口端口126)。在一些实施例中,采集装置100可还包括致动器(图1未示出)和限定第一流体流路径142、第二流体流路径144和可选的其他流体流路径(图1未示出)的流控制器140。在一些实施例中,致动器可包括在转移机构120中或以其他方式可操作地耦接到转移机构120。以此方式,致动器可被配置为控制流控制器140内的流体移动(例如,在不同配置之间)。例如,致动器可在对应于流控制器140的第一配置的第一位置、与第一位置不同的对应于流控制器140的第二配置的第二位置等等之间移动。在一些实施例中,致动器可被配置为单向移动。例如,致动器可从其第一位置移动到其第二位置,但不能从其第二位置移动到其第一位置。类似地,致动器可从其第二位置移动到第三位置,但不能从其第三位置移动返回其第二位置。以此方式,防止流控制器140在移动到其第一配置之前移动到其第二或第三配置,因此需要将第一量体液引导到前样本储存器170中,而非被设计为容纳将用作生物样本(诸如,为医疗诊断和/或治疗而进行测试)的第二和/或第三部体积的抽取流体的样本储存器180和/或190中。流控制器140被配置为使得,当处于第一配置时,第一流体流路径142将入口端口121流体耦接到第一出口端口125,并且当处于第二配置时,第二流体流路径144将入口端口121流体耦接到第二出口端口126。在一些实施例中,如上所述的致动器可被配置为在第一配置和第二配置以及可选的第三或第四配置之间以平移方式移动流控制器140。例如,在一些实施例中,当流控制器140相对于采集装置100处于远端位置时,流控制器140可处于第一配置。在这类实施例中,致动器可被致动,以相对于采集装置100沿近端方向将流控制器140移动到近端位置,由此使流控制器130处于第二配置。在其他实施例中,致动器也可被致动,以在第一配置和第二配置或可选的第三或第四配置之间以旋转运动方式移动流控制器140。因此,当流控制器140处于第一配置时,第二出口端口126(以及耦接到相同储存器的可选的其他出口端口)与入口端口121流体隔离。类似地,当流控制器140处于第二配置时,第一出口端口125与入口端口121流体隔离。并且可选地,如果流控制器140处于第三配置(图1未示出),则第一出口端口125和第二出口端口126与入口端口121流体隔离。以此方式,当流控制器140处于第一配置时,流控制器140可经由第一出口端口125将第一量的体液引导或转移到前样本储存器170,并且当流控制器140处于第二配置时,流控制器140可经由第二出口端口126将第二量的体液引导或转移到第一样本储存器180。在一些实施例中,致动器的至少一部分可以可操作地耦接到前样本储存器170。以此方式,致动器(或至少致动器的所述部分)可被配置为在“前样本”流体储存器170内引入真空或以其他方式促进真空的产生,由此,当转移机构120处于其第一配置时,使体液开始通过采集装置100流入前样本流体储存器170中。致动器可包括用于促使液体流入采集装置100的任何合适的机构,诸如,例如,旋转盘、活塞、滑块、转盘、按钮、手柄、杠杆和/或任何其他合适的机构或其组合。在此参照特定实施例更详细地描述合适的致动器的例子。在一些实施例中,转移机构120可被配置为需要在转移机构120允许第二量的体液流通过转移机构120被输送到第一样本流体储存器180和/或第二样本流体储存器190之前将第一量体液输送到前样本流体储存器170。以此方式,转移机构120的特征可被描绘为需要医疗保健行业从业者服从在采集第二和/或第三量(例如,样本)体液之前采集第一预定量(例如,前样本)。另一种类似的表述是,转移机构120可被配置为防止医疗保健行业从业者在未首先将第一量或前样本体液转移到前样本储存器170的情况下将第二量或样本体液采集到第一样本储存器180中。以此方式,防止医疗保健行业从业者将第一量体液包括(无论是有意的还是无意的)在用于分析的体液样本中,该第一量体液更可能含有体表微生物和/或其他有害外部污染物。在其他实施例中,流体采集装置100不需要包括强制服从特征或部件。在一些实施例中,转移机构120可具有与第一、第二和第三配置不同的第四配置(图1未示出)。当处于第四配置时,转移机构120可同时将入口端口121与第一出口端口125、第二出口端口126和可选的第三出口端口流体隔离。因此,当转移机构120处于其第四配置时,防止体液从入口端口121流到前样本储存器170、第一样本储存器180和第二样本储存器190。在使用时,例如,可致动(例如,手动地或自动地)转移机构120,以使转移机构120处于第一配置,从而使得体液从入口端口121流到前样本储存器170,然后移动到第二配置,从而使得体液可从入口端口121流到第一样本储存器180,并可选地移动到第三配置,从而使得体液可从入口端口121流到第二样本储存器190,然后移动到第四配置,以使体液停止流入和/或流过转移机构120。以此方式,装置被有效地“锁定”并独立地处于第四配置,从而防止装置100中任何残留的体液被污染和/或以其他方式使医疗保健行业从业者和/或患者暴露于潜在的危险流体。此可选的安全特征可防止暴露于可能感染诸如HIV、丙型肝炎等病原体的体液样本。在一些实施例中,采集装置100的一个或多个部分可位于外壳(图1未示出)内。例如,在一些实施例中,转移机构120、第一前样本储存器170及样本储存器180和190中的一个或多个的至少一部分可位于外壳内。在这种实施例中,转移机构120的至少一部分可通过外壳,以容许使用者致动流控制器140,从而控制体液从患者(例如,血管)流到采集装置100。在此参照特定实施例更详细地描述合适的外壳的例子。在一些实施例中,采集装置100可以可选地包括可计量通过采集装置的体液流的一个或多个流计量装置。例如,流计量装置可与第一流体流路径142和/或第二流体流路径144流体连通,以计量通过它们的体液流。在其他实施例中,流计量装置可与第一端口125和/或第二端口126流体连通和/或位于其中。流计量装置可包括指示器等(例如,转盘、显示器、颜色、触觉输出装置、电信号输出装置,诸如无线电信号、蓝牙无线电信号等),其可被配置为向使用者提供与传送到前样本储存器170、第一样本储存器180和/或第二样本储存器190相关的指示。在一些实施例中,流计量装置可以可操作地耦接到例如致动器等,诸如上文描述的那些。在这类实施例中,流计量装置可致动致动器,以基于已流过流计量装置的期望量体液使流控制器140在其第一配置和其第二配置之间移动。因此,流计量装置可用于确保期望量的体液被传送到前样本储存器170、第一样本储存器180和/或第二样本储存器190,这继而可防止在例如患者样本等的微生物测试中产生不足的、不准确的和/或错误的结果。现在参照图2-13,采集装置200包括转移机构220、流控制器240、前样本储存器270、第一样本储存器280和与第一样本储存器280不同的第二样本储存器290。如在此进一步描述的,采集装置200可在第一、第二和第三配置之间移动,以传递大体上不存在体外微生物(诸如,例如,皮肤驻留的微生物和/或其他有害外部污染物)的体液流。采集装置200可具有任何合适的形状、尺寸或配置。例如,尽管图2-13示出了样本储存器280和/或290相对于外壳201垂直地定向,但采集装置200的样本储存器280和/或290可定向在外壳201的平面中或相对于外壳201成圆锥形地放置,等等。转移机构220包括外壳201和可移动构件250和250’。如图2-4所示,外壳201耦接到前样本储存器270、第一样本储存器280和第二样本储存器290。外壳201包括入口端口221、第一出口端口230、第二出口端口231、第三出口端口232,并限定内部流通道235,流通道235可限定从患者采集体液的流体流路径。入口端口221可选择性地与内部流通道235流体连通。更具体地,入口通道221可限定可与内部流通道235流体连通的入口内腔202。以此方式,入口端口221从外壳201的一部分延伸出,从而使得内部流通道235可经由入口内腔202与大体在外壳201外的空间流体连通。入口端口221可流体耦接到限定将体液从患者抽取和/或输送到采集装置200的流体流路径的医疗装置(未示出)。例如,入口端口221可直接地或经由适配器204间接地流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。另一种类似的表述是,当内腔限定装置耦接到入口端口221时,入口端口221限定的入口内腔202与内腔限定装置限定的内腔流体连通。进一步详述,当内腔限定装置位于患者身体的一部分内(例如,在患者的血管或脊柱腔内)时,外壳201的内部流通道235可与患者身体的该部分流体连通。外壳201限定的内部流通道235是中心内腔,其沿外壳201的长度延伸并且可在静脉穿刺(用于获取体液的其他方法)之后与患者的体液流体连通,如在此描述的。内部流通道235形成用于在入口端口221和第一出口端口230、第二出口端口231及第三出口端口232之间传送体液的流体流路径。更具体地,当内部流通道235与患者(经由耦接到入口端口221的医疗装置)流体连通时,第一出口端口230、第二出口端口231和第三出口端口232可选择性地与内部流通道235流体连通,以容许体液流入前样本储存器270、第一样本储存器280或第二样本储存器290中的至少一个。在一些实施例中,在预定体积的体液被采集在前样本储存器270中之前,阻止体液流到第二出口端口231和第三出口端口232。在一些实施例中,第二出口端口231和第三出口端口232可同时与内部流通道235流体连通。在一些实施例中,第二出口端口231和第三出口端口232可依次与内部流通道235流体连通。可移动构件250、250’被配置为被使用者从相对于外壳201的第一位置致动到第二位置,以将流体流引导到第一样本储存器280和第二样本储存器290中。可移动构件250、250’大体相同,并因此参照单个可移动构件250进行描述。如图5所示,可移动构件250包括限定内部腔252的凸台251、入口端口253、第一出口端口254和限定流体耦接到内部腔252的内腔256的刺穿构件255。入口端口253和出口端口254延伸通过限定可移动构件250的内部腔252的凸台251的壁。可移动构件250被配置为被安装在外壳201的支撑件257(见图4)上,从而使得凸台251位于孔眼258(见图4)内并且可移动构件250的至少一部分被容纳在环形腔260中。可选地,偏置构件259(例如,弹簧)可位于环形腔260中,以使可移动构件250在被使用者致动之后返回其第一位置。在一些实施例中,可移动构件250、环形腔260、孔眼258或凸台251可包括被配置为在被使用者致动之后将可移动构件250承托在第二位置(例如,下压位置)的机械锁定特征。如在此描述的,在第一配置,以使得可移动构件250与内部流通道235分隔开的方式放置可移动构件250。在这种配置中,不会在患者身体的一部分(例如,血管、脊柱腔等)和样本储存器280和/或290之间建立流体流路径。换言之,当可移动构件250处于其第一配置时,第一样本储存器280和第二样本储存器290与外壳201所限定的内部流通道235流体隔离开。使用者可致动可移动构件250,以将可移动构件250从第一配置移动到第二配置并与内部流通道235对齐。使用者施加的力可足以使偏置构件259变形(例如,压缩),由此容许刺穿构件255插入样本储存器280和/或290中。在第二配置,入口端口253和出口端口254与内部流通道235大体对齐,使得内部腔252与内部流通道235流体连通。因此,当可移动构件250处于第二配置时,在内部流通道235、内部腔252、刺穿构件255的内腔256和样本储存器280之间建立流体流路径。换言之,在这种配置中,体液可从患者(例如,血管、脊柱腔等)通过转移机构220流入第一样本储存器280和/或第二样本储存器290中,如在此更详细地描述的。前样本储存器270可以是用于容纳体液的任何合适的储存器,诸如,例如,一次性可丢弃式采集管和/或基于真空的采集管等。前样本储存器270被配置为以任何合适的方式流体耦接到采集装置200的第一出口端口230(直接地或经由中间结构,诸如无菌柔性管)。例如,在一些实施例中,前样本储存器270的一部分可在第一出口端口230的一部分内形成摩擦配合。在其他实施例中,前样本储存器270可经由螺纹耦接、粘合剂、卡扣配合、机械紧固件和/或任何其他合适的耦接方法耦接到第一出口端口230。在一些实施例中,前样本储存器270可与万科201一体形成。前样本储存器270可被配置为保持(前样本储存器270)内部处于负压状态(真空状态),这可容许经由真空吸力通过出口端口230将体液从入口端口221抽入前样本储存器270。前样本储存器270被配置为包含第一量体液,其中,第一量体液可以是预定或未定量,使得第一量体液与随后从患者抽取的第二和/或第三量体液流体隔离。样本储存器280和/或290可以是用于容纳体液的任何合适的储存器,诸如,例如,一次性可丢弃式采集管、基于真空的采集管和/或通过引用合并的‘420专利中描述的样本储存器等。在一些实施例中,样本储存器280和/或290可以大体类似于或等同于已知的样本容器,诸如,例如,等。样本储存器280和/或290分别包括样本容器282和292,并分别包括真空密封件284和294。真空密封件284或294分别保持样本容器282或292内的负压状态(真空状态),这可容许经由真空吸力将体液分别从内部流通道235抽入本容器282或292。样本储存器280和/或290可被配置为以任何合适的方式分别流体耦接到采集装置200的第二出口端口231和第三出口端口232(直接地或经由中间结构,诸如无菌柔性管)。可相对于出口端口231和/或232移动样本储存器280和/或290,以使样本储存器280和/或290与出口端口231和/或232流体连通。样本储存器280和290可被配置为包含第二或第三量的体液。第二或第三量的体液可以是预定或未定量,使得第二或第三量的体液与从患者抽取的第一量体液流体隔离。在一些配置中,样本储存器280和/或290可通过以与前样本储存器270类似的方式与外壳201一体形成而耦接到采集装置200,因此在此不详细描述。在一些情形中,样本储存器280和/或290可以是透明的,从而使得使用者可具有视觉反馈,以确认流入样本储存器280和/或290的体液流。在一些实施例中,样本储存器280和290及转移机构220(和/或采集装置200的除样本储存器280和290之外的部分)单独形成(例如,非一体形成)并在例如制造期间耦接在一起。在一些情形中,可在大体上无菌或密封环境(例如,填充乙撑氧等的环境)中,将样本储存器280和290耦接到转移机构220。因此,样本储存器280和290与转移机构220之间的接触面在使用之前大体是无菌的。此外,可以以预组装方式运输和/或存储采集装置200,从而保持样本储存器280和290与转移机构220之间的接触面大体无菌。如图6和7所示,流控制器240包括第一构件241和第二构件245。第一构件241被配置为位于外壳201的凹口266(例如,见图4)中,并且可由生物兼容的任意数量的材料制成,诸如,例如,钛、石墨、热解碳、聚酯、聚碳酸酯、聚亚安酯和/或弹性体材料等。在一些实施例中,第二构件245用作将第一构件241从第一配置移动到第二配置的致动器。更具体地,当第一构件241位于凹口266中时,第二构件245可在第一位置和第二位置之间移动,以在第一和第二配置之间移动流控制器240。在一些实施例中,外壳201可选择性地限制第二构件245从其第一位置到其第二位置的移动。在一些实施例中,外壳201可被配置为一旦第二构件245已经移动到第二位置就阻止其移动。换言之,外壳201可包括阻止第二构件245从第二位置移动返回第一位置的锁定构件。第二构件245和/或外壳201还可包括机械棘爪和/或提供视觉或触觉反馈以确保精确地定位第二构件245的其他指示器。第一构件241可包括用于在静脉穿刺(和/或其他获得患者体液的方法)之后引导流体流的多个通道。例如,如图6和7所示,第一构件241包括第一流通道242和第二流通道244。当第二构件245处于第一位置时(例如,见图8和9),流控制器240处于第一配置,并且第一流通道242在入口端口221和第一出口端口230之间建立流体连通,同时使入口端口221和内部流通道235流体隔离。当第二构件245处于第二位置时(例如,见图10-13),流控制器240处于第二配置,并且第二流通道244在入口端口221和内部流通道235之间建立流体连通,同时使入口端口221和第一出口端口230流体隔离。可包括与额外的第一构件241的流通道和/或流控制器240配置相对应的额外第二构件245位置,以在患者和采集装置200之间进一步引导/隔离流体。例如,第二构件245可具有与流控制器240的第三配置相对应的第三位置,其大体上完全阻止患者和采集装置200之间的流体流。换言之,在一些实施例中,在从患者获取了全部体液样本之后,可将转盘移动到第三位置,以相对于外部环境大体上密封采集装置200中的样本。在操作时,采集装置200可用于从患者采集减少污染(来自皮肤驻留的微生物和/或其他有害外部污染物)的体液(例如,血液)。例如,采集装置200的入口端口221经由适配器204流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。在静脉穿刺(或其他体液获得方法)之后,旋转第二构件245,直到它达到如图8和9所示的第一位置。替代性地,第二构件245可被预设在第一位置,并且采集装置200可以其他方式被密封,以保持前样本储存器270中的真空和采集装置200的无菌性。例如,入口端口221和/或适配器204可包括当采集装置200耦接到针头或其他内腔限定装置时打开的阀。如上所述,当第二构件245处于第一位置时,流控制器240处于第一配置,并且第一构件241的第一流通道242在入口端口221和第一出口端口230之间建立流体连通,同时使入口端口221和内部流通道235流体隔离。此外,在第一配置中,第一和第二样本储存器280和290与入口端口221流体隔离,并且在患者身体的一部分(例如,血管)和前样本储存器270之间限定流体流路径,如图9的箭头AA所示。如上所述,采集装置200中使用的流体储存器,诸如,前样本储存器270及样本储存器280和290,可被配置为限定负压(例如,小于采集装置200正在从其抽取体液的身体部分的流体压力的压力),从而使得一旦在患者身体的一部分(例如,血管)和前样本储存器270之间建立流体连通,前样本储存器270内的负压就会使前样本储存器270和患者身体的所述部分之间的压力差将体液抽入样样本储存器270。在此第一配置,流控制器240还使前样本储存器270与内部流通道235流体隔离。因此,第一量(预定的或未定的)体液可在静脉穿刺(例如)之后立即被容纳到前样本储存器270中并与随后的样本隔离。以此方式,采集装置200可用于防止第一量体液(其最可能含有体表微生物和/或其他有害的外部污染物)污染随后量的体液样本,这些体液样本被采集并用于可受污染物影响的诊断或其他测试。在前样本储存器270中采集了所述体积的体液前样本之后,可旋转第二构件245直到它达到其第二位置,如图10和11所示。当第二构件245处于第二位置时,流控制器240处于第二配置,并且第一构件241的第二流通道244在入口端口221和内部流通道235之间建立流体连通,同时使第一出口端口230(即,前样本储存器270)与入口端口221流体隔离。换言之,在第二配置,流控制器240经由第二流通道244在患者身体的一部分(例如,血管)和内部流通道235之间建立流体流路径,如图11的箭头BB所示。当流控制器240处于第二配置时,使用者可将可移动构件250和/或250’从第一位置致动(即,按压)到第二位置,以在患者身体的一部分(例如,血管)与第一样本储存器280和/或第二样本储存器290之间建立流体连通。更具体地,将可移动构件250从其第一位置移动到其第二配置,从而使刺穿构件255以刺穿构件255可穿透位于样本容器282内的第一样本储存器280的真空密封件284的方式穿过出口端口231,如图12的箭头CC所示。当处于第二位置时,可移动构件250的入口端口253和出口端口254与内部流通道235大体对齐并流体连通,这容许体液从内部流通道235流入可移动构件250的内部腔252并离开刺穿构件255的内腔256进入第一样本储存器280。样本储存器280和内部流通道235之间的压力差(例如,真空或负压)将体液抽入样本储存器280。换言之,在第二配置,可移动构件250在内部流通道235和第一样本储存器280之间建立流体流路径,如图12的箭头DD所示。一旦期望量的体液(例如,第二量)被采集在第一样本储存器280中,使用者就可释放可移动构件250,容许偏置构件259将按钮250移动回其第一位置。当可移动构件250返回其第一位置时,刺穿构件255被移离第一样本储存器280,并且密封件284(例如,独立密封隔膜)使第一样本储存器280与内部流通道235流体隔离。以类似方式,当流控制器240处于第二配置时,使用者可将可移动构件250’从其第一位置致动(即,按压)到其第二位置,如图13的箭头EE所示。以此方式,以与上述可移动构件250和第一样本储存器280类似的方式,在患者身体的一部分(例如,血管)和第二样本储存器290之间(经由出口端口232)建立流体连通。换言之,在第二配置,可移动构件250’在内部流通道235和第二样本储存器290之间建立流体流路径,如图13的箭头FF所示。一旦期望量的体液(例如,第三量)被采集在第二样本储存器290中,使用者就可释放可移动构件250’,容许偏置构件259’将按钮250’移动回其第一位置。尽管被示出和描述为按顺序的过程,但不必要求填充顺序和/或排序(即,不必必须在样本储存器290之前填充样本储存器280,等等)。换言之,一旦流控制器240被移动到第二配置,就可按任何顺序、在同一时刻(例如,同时)和/或以重叠的时间间隔填充第一样本储存器280和第二样本储存器290(和任何额外的样本储存器)。例如,使用者可开始填充第一样本储存器280,然后在部分地填充第一样本储存器280之后,使用者可按压可移动构件250’,以填充第二样本储存器290,而第一样本储存器280填充完成。此外,通过反复致动(插入)可移动构件250和/或250’可调整样本储存器280和/或290中采集的体液的体积。如上所述,第二构件245可具有与流控制器240的第三配置相对应的第三位置,其可大体上完全阻止患者和采集装置200之间的流体流,以相对于外部环境大体上密封采集装置200中的样本。尽管图2-13未示出,但采集装置200可包括可被配置为计量被传送到前样本储存器270、第一样本储存器280和/或第二样本储存器290的体液体积的流计量装置等。例如,在一些实施例中,流控制器240的第一构件241可包括与第一流通道242和第二流通道244流体连通的流计量装置。在其他实施例中,流计量装置可位于可移动构件250和/或250’的内部腔252内。因此,可计量和/或控制被传送到和位于第一样本储存器280和第二样本储存器290中的体液样本的体积,从而使得位于每个样本储存器280和290中的体液的体积是预定体积,诸如,例如,10mL、20mL、30mL等。尽管采集装置200被示出和描述为包括第一样本储存器280和第二样本储存器290,但在其他实施例中,采集装置可包括任意数量的前样本和/或样本储存器。例如,图14和15图示了根据实施例的采集装置300。如图所示,采集装置300的某些方面可与以上参照图2-13描述的采集装置200的相应方面大体类似。因此,在此不进一步详细描述类似的方面。如图14和15所示,采集装置300包括转移机构320、流控制器340、前样本储存器370、第一样本储存器380、第二样本储存器380’、第三样本储存器390和第四样本储存器390’。前样本储存器370可大体类似于上文详细描述的前样本储存器270。在一些实施例中,样本储存器380、380’、390和390’可大体类似于上文详细描述的样本储存器280和290。在一些实施例中,样本储存器380、380’、390和390’可具有大体相同的形状和尺寸并包括例如大体相同的培养介质。在其他实施例中,样本储存器380、380’、390和390’可具有大体相同的形状和尺寸并包括需氧培养介质或厌氧培养介质中的一种。例如,在一些实施例中,第一样本储存器380和第三样本储存器390可包括需氧培养介质,而第二样本储存器380’和第四样本储存器390’可包括厌氧培养介质。在其他实施例中,样本储存器380、380’、390和390’可各自包括处于任何布置或组合的需氧或厌氧培养介质。转移机构320包括外壳301和一组可移动构件350、350’、350”、350”’。可移动构件350、350’、350”、350”’例如大体类似于上文参照图5描述的可移动构件250。因此,可移动构件350、350’、350”、350”’可相对于外壳301在第一位置和第二位置之间移动,以分别与样本储存器380、380’、390和390’流体连通。外壳301包括和/或限定入口端口321、被配置为与前样本储存器370流体连通的第一出口端口330、被配置为与第一样本储存器380流体连通的第二出口端口331、被配置为与第二样本储存器380’流体连通的第三出口端口332、被配置为与第三样本储存器390流体连通的第四出口端口333和被配置为与第四样本储存器390’流体连通的第五出口端口334。此外,外壳301限定内部流通道335,流通道335可以与上文参照外壳201的内部流通道235描述的类似方式选择性地与入口端口321和出口端口331、332、333和334流体连通。例如,流控制器340大体类似于上文参照图6-13描述的流控制器240。因此,流控制器340可在第一配置和第二配置之间旋转,以选择性地限定患者和前样本储存器370或样本储存器380、380’、390和390’之间的流体流路径的一部分。以此方式,使用者可用与上文参照图8-13中的采集装置200描述的类似方式操纵采集装置300。因此,第一体积的体液可被传送到并位于前样本储存器370中,并且随后体积的体液可被传送到并位于样本储存器380、380’、390和390’中。图16-22图示根据实施例的采集装置400。采集装置400包括转移机构420、流控制器440和样本储存器480、480’、490和490’。如在此进一步描述的,采集装置400可在第一、第二、第三、第四和第五配置之间移动,以传递大体上不存在体外微生物(诸如,例如,皮肤驻留的微生物和/或其他有害外部污染物)的体液流。采集装置400可具有任何合适的形状、尺寸或配置。例如,尽管图16-22示出了样本储存器480、480’、490和490’相对于外壳401垂直地定向,但采集装置400的样本储存器480、480’、490和490’可相对于外壳401定向在任何合适的平面中或相对于外壳401成圆锥形地放置,等等。样本储存器480、480’、490和490’在形式和功能上大体类似于或等同于采集装置200的样本储存器280和/或290,因此这里不详细描述。如上所述,样本储存器480、480’、490和490’保持负压状态(真空状态),这可容许经由吸力将体液从患者抽入样本储存器480、480’、490和490’。在一些实施例中,样本储存器480和480’可以是需氧培养瓶,样本储存器490和490’可以是厌氧培养瓶,并且采集装置400可用于通过单次静脉穿刺采集多个需氧和多个厌氧血液培养样本。如在此进一步详细描述的,样本储存器480、480’、490和490’可各自与转移机构420的至少一部分流体连通,以接收一定体积的体液样本。体液样本的体积可以是预定或未定的量。此外,一旦期望量的体液位于样本储存器480、480’、490和490’中,每个样本储存器480、480’、490和490’就可与转移机构420的至少一部分流体隔离,如在此进一步详细描述的。转移机构420包括外壳401和分配构件429。转移机构420的外壳401物理地和流体地耦接到分配构件429,并提供和/或限定用于从患者采集体液的一组流体流路径。外壳401限定凹口466和一组出口孔口403。凹口466被配置为容纳包括在流控制器440中的密封构件441,如在此进一步详细描述的。该组出口孔口403包括第一出口孔口403a、第二出口孔口403b、第三出口孔口403c、第四出口孔口403d和第五出口孔口403e,它们各自被配置为限定与分配构件429的不同部分流体连通的不同流体流路径。更具体地,分配构件429限定和/或形成与第一出口孔口403a流体连通的前样本储存器470的至少一部分以及与第二出口孔口403b流体连通的第一流通道435a、与第三出口孔口403c流体连通的第二流通道435b、与第四出口孔口403d流体连通的第三流通道435c和第五出口孔口403e流体连通的第四流通道435。如图17和18所示,分配构件429限定腔或空间,所述腔或空间限定前样本储存器470的至少一部分。前样本储存器470被配置为容纳体液,诸如,例如,血液、血浆和/或尿液等。外壳401的第一出口孔口403a可与前样本储存器470的开口部分大体对齐,以容许前样本储存器470接收来自患者的体液流。例如,前样本储存器470可接收和容纳第一量或体积的体液,其中,体液的第一量可以是预定的或未定的量。此外,转移机构420的布置可使得前样本储存器470保持与流通道435a、435b、435c和435d和/或随后从患者抽取的多部分体液流体隔离,如在此进一步详细描述的。尽管上文将前样本储存器270和370描述为保持负压,但前样本储存器470不保持负压状态(真空状态),因而其他机制,诸如,例如,重力可用于将体液抽入前样本储存器470中。流通道435a-435d从分配构件429的中心沿径向延伸并被布置为使得每个流通道435a、435b、435c和435d与前样本储存器470和其他流通道流体隔离。以此方式,流通道435a、435b、435c和435d可引导和/或以其他方式限定第一端部(分别与出口孔口403b、403c、403d和403e大体对齐)和第二端部之间的流体流路径。如图17和18所示,分配构件429限定位于第一流通道435a的第二端部处的第一出口端口431、位于第二流通道435b的第二端部处的第二出口端口432、位于第三流通道435c的第二端部处的第三出口端口433和位于第四流通道435d的第二端部处的第四出口端口434。此外,分配构件429包括第一刺穿构件455a、第二刺穿构件455b、第三刺穿构件455c、第四刺穿构件455d,它们分别物理地和流体地耦接到第一出口端口431、第二出口端口432、第三出口端口433、第四出口端口434。因此,刺穿构件455a-355d可用于穿透样本储存器480、480’、490和490’的真空密封件,这可使体液开始流动,如在此进一步详细描述的。尽管图17和18未示出,但样本储存器480、480’、490和490’可以任何合适的方式物理地耦接到分配构件429的一部分上(直接地或经由中间结构,诸如无菌柔性管),这可容许样本储存器480、480’、490和490’分别与出口端口431、432、433和434流体连通。流控制器440包括转盘445和密封构件441。密封构件441位于外壳401的凹口466(例如,见图20)中。更具体地,流控制器440可耦接到外壳401,从而使得密封构件441位于限定凹口466的外壳401的表面和转盘445的表面之间并与两个表面接触。此外,密封构件441可具有这样的尺寸和形状,即,当流控制器440耦接到外壳401时,使得密封构件441与转盘445的表面和限定凹口466(例如,见图20)的外壳401的表面形成大体流体密封的密封结构,如在此进一步详细描述的。密封构件441可由任意数量的生物兼容材料制成,诸如,例如,硅酮、聚乳酸、聚乙交酯、聚乳酸-羟基乙酸共聚物(PLGA)、聚酸酐、聚原酸酯、聚醚、聚已酸内酯、聚酰胺酯、聚丁酸、聚戊酸、聚氨酯、尼龙、聚酯、聚碳酸酯、聚丙烯酸酯、醋酸乙烯酯和其他酰基取代纤维素乙酸酯的聚合物、聚苯乙烯、聚氯乙烯、聚氟乙烯、聚乙烯咪唑、聚烯烃氯磺酸、聚环氧乙烷和/或其共混物和共聚物。如图17所示,密封构件441限定可在静脉穿刺(或其他获得体液的方法)之后引导体液流的一组孔口444。例如,由密封构件441限定的该组孔口444包括第一孔口444a、第二孔口444b、第三孔口444c、第四孔口444d和第五孔口444e。密封构件441的布置使得,当密封构件441处于凹口466中时,第一孔口444a、第二孔口444b、第三孔口444c、第四孔口444d和第五孔口444e分别与外壳401的第一出口孔口403a、第二出口孔口403b、第三出口孔口403c、第四出口孔口403d和第五出口孔口403e大体对齐。流控制器440的转盘445可旋转地耦接到外壳401上并且可相对于外壳401在第一位置、第二位置、第三位置、第四位置和第五位置之间移动。转盘445包括限定内腔402的入口端口421。入口端口421可流体耦接到限定用于将体液从患者抽取和/或输送到采集装置400的流体流路径的医疗装置(未示出)。例如,入口端口421可直接地或经由适配器404间接地流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。另一种类似的表述是,当内腔限定装置耦接到入口端口421时,入口端口421限定的入口内腔402与内腔限定装置限定的内腔流体连通。以此方式,入口端口421可被配置为选择性地使前样本储存器470、第一样本储存器480、第二样本储存器480’、第三样本储存器490和第四样本储存器490’与患者流体连通,如在此进一步详细描述的。如上所述,转盘445可在第一、第二、第三、第四和第五位置之间移动。当转盘445处于第一位置时,流控制器440处于第一配置,并且入口端口421可与密封构件441的第一孔口444a和外壳401的第一出口孔口403a大体对齐。以此方式,密封构件441的第一孔口444a在入口端口421和第一出口孔口403a之间建立流体连通,同时使入口端口421与出口端口403b、403c、403d和403e流体隔离,这继而使入口端口421与流通道435a-335d流体隔离。当第一出口端口403a与前样本储存器470的开口部分对齐时,第一孔口444a和第一出口孔口403a在入口端口421和前样本储存器470之间建立流体连通。当转盘445被旋转(或被致动)到第二位置时,流控制器440处于第二配置,并且第二出口孔口444b在入口端口421和第二出口孔口403b之间建立流体连通,同时使入口端口421与出口端口403a、403c、403d和403e流体隔离。当第二出口孔口403b与第一流通道435a的第一端部对齐时,第二孔口444b和第二出口孔口403b在入口端口421和第一流通道435a之间建立流体连通。当转盘445被旋转到第三、第四和第五位置时,采集装置400以类似方式工作。因此,当入口内腔402与患者(例如,经由耦接到入口端口421的医疗装置)流体连通时,第一出口端口430、第二出口端口431、第三出口端口432、第四出口端口433和第五出口端口434可选择性地与入口内腔402流体连通,以容许全部体液流入样本储存器480、480’、490和490’中的一个或多个或前样本储存器470中的至少一者。在一些实施例中,可包括与额外的密封出口孔口和/或流控制器440的配置相对应的额外的转盘445的位置,以在患者和采集装置400之间进一步引导/隔离流体流。例如,转盘445可具有对应于流控制器440的第六配置的第六位置,其大体完全阻止患者和采集装置400之间的流体流。换言之,在一些实施例中,在从患者获取全部体液样本之后,转盘445可移动到第六位置,以相对于外部环境大体密封采集装置400中的样本。在一些实施例中,防止体液流到与样本储存器相连的出口端口(例如,出口端口431-434),直到在前样本储存器470中采集了预定体积的体液。在一些实施例中,与样本储存器相连的出口端口(例如,出口端口431-434)仅能依次与入口内腔402流体连通(例如,出口端口431必须在出口端口432之前与入口内腔402流体连通,等等)。在一些实施例中,与随后的样本储存器相连的出口端口(例如,出口端口432-434)仅能在已经采集确定体积的体液之后与入口内腔402流体连通。在一些实施例中,与样本储存器相连的出口端口(例如,出口端口431-434)可按任何随机方式、对顺序没有任何偏好地与入口内腔402流体连通(例如,出口端口434可在出口端口431之前与入口内腔402流体连通,出口端口432可在出口端口433之前与入口内腔402流体连通,等等)。在一些实施例中,外壳401可选择性地限制转盘445从其第一位置到其第二、第三、第四和第五位置的移动。在一些实施例中,外壳401可被配置为一旦转盘445已经移动到第五位置就阻止其移动。换言之,外壳401可包括阻止转盘445从第五位置移动返回第一位置的锁定机构。转盘445和/或外壳401还可包括机械棘爪和/或提供视觉或触觉反馈以确保相对于外壳401的出口孔口403a-403e精确地定位转盘445的其他指示器。在操作时,采集装置400可用于从患者采集减少污染的体液(例如,血液、血浆和/或尿液等)。例如,采集装置400的入口端口421流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。在静脉穿刺(或其他体液获得方法)之后,致动(或旋转)转盘445,直到它达到如图19和20所示的第一位置。替代性地,转盘445可被预设在第一位置,并且采集装置400可以其他方式被密封,以保持采集装置400的无菌性。例如,入口端口421可包括当采集装置400耦接到针头或其他内腔限定装置时打开的阀。如上所述,当转盘445处于第一位置时,流控制器440处于第一配置,并且密封构件441的第一孔口444a在入口端口421和第一出口端口430(包括在外壳401中)之间建立流体连通,同时使入口端口421和四个流通道435a-335d流体隔离。此外,在第一配置中,样本储存器480、480’、490和490’与入口端口421流体隔离,并且在患者身体的一部分(例如,血管)和前样本储存器470之间限定流体流路径,如图20的箭头GG所示。在此第一配置,体液(例如,通过重力、真空等)从患者身体的一部分通过入口端口421的入口内腔402、密封构件441的第一孔口444a、第一出口端口430流入前样本储存器470。在第一配置,流控制器440还使前样本储存器470与流通道435a-335d流体隔离。因此,第一量(预定的或未定的)体液可在静脉穿刺(例如)之后立即被容纳到前样本储存器470中并与随后的样本隔离。以此方式,采集装置400可用于防止第一量体液(其最可能含有体表微生物和/或其他有害的外部污染物)污染随后量的体液样本,这些体液样本被采集并用于可受污染物影响的诊断或其他测试。在前样本储存器470中采集了体液前样本之后,可致动(或旋转)转盘445直到它达到其第二位置,如图21和22所示。当转盘445处于第二位置时,流控制器440处于第二配置,并且密封构件441的第二孔口444b在入口端口421和流通道435a之间建立流体连通,同时使前样本储存器470与入口端口421流体隔离。换言之,在第二配置,流控制器440在患者身体的一部分(例如,血管)和流通道435a之间建立流体流路径,如图22的箭头HH所示。当流控制器440处于第二配置时,使用者可将样本储存器480从第一配置致动到第二配置(例如,推动刺穿构件455a),以在患者身体的一部分(例如,血管)与第一样本储存器480之间建立流体连通。如上所述,将样本储存器480移动到第二配置会致使刺穿构件455a穿透样本储存器480的真空密封件,位于样本储存器480内的。在此第二配置,患者身体的所述部分(例如,血管)暴露于来自样本储存器480的由其中的负压状态(真空)产生的真空吸力下。样本储存器480和患者身体的所述部分之间的压力差(例如,真空或负压)将体液抽入样本储存器480。体液从患者身体的所述部分通过入口端口421的入口内腔402、密封构件441的第二孔口444b、外壳401的第二出口孔口403b流入第一流通道435a。真空吸力经由第二出口端口431和刺穿构件455a通过第一流通道435a将体液流抽入样本储存器480。换言之,在第二配置,流控制器440在入口端口421和样本储存器480之间建立流体流路径。一旦期望量的体液(例如,第二量)被采集在样本储存器480中,使用者就可将流控制器440致动(旋转)到第三位置和/或将样本储存器480移回其第一配置,以使样本储存器480与流通道435a隔离。当样本储存器480返回其第一配置时,刺穿构件455a被移离样本储存器480,并且样本储存器480的密封件(例如,独立密封隔膜)使第一样本储存器480与流通道435a流体隔离。当流控制器440分别位于第三、第四和第五配置时,以类似方式填充其他样本储存器。应该注意,不必要求填充顺序和/或排序(即,不必必须在样本储存器490之前填充样本储存器480,等等)。换言之,可按任何顺序填充第一样本储存器480和第二样本储存器490(和任何额外的样本储存器)。例如,使用者可开始填充第一样本储存器480,然后在部分地填充第一样本储存器480之后,使用者可填充第二样本储存器490。此外,通过反复填充样本储存器480和/或490可调整样本储存器480和/或490中采集的体液的体积。但是,在其他实施例中,可机械地操纵填充顺序,从而使得在确定特定量的体液已经位于第一储存器之前不能进入第二样本储存器,等等。如上所述,转盘445可具有与流控制器440的第六配置相对应的第六位置,其可大体上完全阻止患者和采集装置400之间的流体流,以相对于外部环境大体上密封采集装置400中的样本。尽管采集装置400被示出和描述为包括和/或耦接到一组四个样本储存器(例如,第一样本储存器480、第二样本储存器480’、第三样本储存器490和第四样本储存器490’),但在其他实施例中,采集装置可包括和/或耦接到任意合适数量的样本储存器。例如,图23-25图示了根据实施例的采集装置500。如图所示,采集装置500的某些方面可与以上参照图16-22描述的采集装置500的相应方面大体类似。因此,在此不进一步详细描述类似的方面。采集装置500包括转移机构520、流控制器540和第一样本储存器580和第二样本储存器590。样本储存器580和590可与上文详细描述的样本储存器大体类似。在一些实施例中,样本储存器580和590可具有大体相同的形状和尺寸并可包括大体相同的培养介质。在其他实施例中,样本储存器580和590可具有大体相同的形状和尺寸并可包括需氧培养介质或厌氧培养介质中的一种。在其他实施例中,第一样本储存器580的第一尺寸可大体大于第二样本储存器590的尺寸。如图24和25所示,转移机构520包括外壳501和分配构件529。转移机构520的外壳501物理地和流体地耦接到分配构件529,并提供和/或限定用于从患者采集体液的一组流体流路径。如以上参照外壳401描述的,外壳501可限定凹口以及第一出口孔口503a、第二出口孔口503b和第三出口孔口503c。凹口被配置为容纳包括在流控制器540中的密封构件541,如上文详细描述的。第一出口孔口503a、第二出口孔口503b和第三出口孔口503c在形式和功能上可分别大体类似于外壳401限定的第一出口孔口403a、第二出口孔口403b和第三出口孔口403c。类似地,分配构件529限定与包括在转移机构429中的前样本储存器470、第一流通道435a和第二流通道435b大体类似的前样本储存器570、第一流通道535a和第二流通道535b。因此,前样本储存器570与第一出口孔口503a流体连通,第一流通道535a与第二出口孔口503b流体连通,并且第二流体流通道535b与第三出口孔口503c流体连通,如上文参照转移机构420描述的。如图25所示,分配构件529限定与第一流通道535a和第一刺穿构件555a流体连通的第一出口端口531和与第二流通道535b和第二刺穿构件555b流体连通的第二出口端口532。如上所述,刺穿构件555a和555b可用于穿透样本储存器580和590的真空密封件,这可使体液开始流动,如在此进一步详细描述的。流控制器540包括转盘545和密封构件541。密封构件541位于外壳501的凹口中,如上所述。以此方式,当流控制器540耦接到外壳501时,密封构件541与转盘545的表面和限定凹口的外壳501的表面形成大体流体密封的密封结构。如图24和25所示,密封构件541限定分别与第一出口孔口503a、第二出口孔口503b和第三出口孔口503c大体对齐的第一孔口544a、第二孔口544b和第三孔口544c,如参照密封构件441详细描述的。流控制器540的转盘545在形式和功能上可大体类似于转盘445,同时具有适于耦接到外壳501的尺寸。因此,转盘545可以可旋转地耦接到外壳501上并且可相对于外壳501在第一位置、第二位置和第三位置之间移动。转盘545包括限定内腔502的入口端口521,并且入口端口521可流体耦接到限定用于将体液从患者抽取和/或输送到采集装置500的流体流路径的医疗装置(未示出)。以此方式,入口端口521可被配置为选择性地设置前样本储存器570、第一样本储存器580和第二样本储存器590。更具体地,当转盘545处于第一位置时,流控制器540处于第一配置,并且入口端口521可与密封构件541的第一孔口544a和外壳501的第一出口孔口503a大体对齐。以此方式,密封构件541的第一孔口544a在入口端口521和第一出口孔口503a之间建立流体连通,并因而使入口端口521与前样本储存器570流体连通,如上文参照采集装置400详细描述的。类似地,当转盘545被旋转(或被致动)到第二位置时,流控制器540处于第二配置,并且第二出口孔口544b在入口端口521和第二出口孔口503b之间建立流体连通,并因而在入口端口521和第一流通道535a之间建立流体连通;并且当转盘545被旋转到第三位置时,流控制器540处于第三配置,并且第三出口孔口544c在入口端口521和第三出口孔口503c之间建立流体连通,并因而在入口端口521和第二流通道535a之间建立流体连通。以此方式,采集装置500可用于将第一体积的体液传送到前样本储存器570,随后用于分别将第二体积和第三体积的体液传送到第一样本储存器580和第二样本储存器590,如上文参照采集装置400详细描述的。图26-33图示了根据实施例的采集装置600。采集装置600包括转移机构620、流控制器640和样本储存器680、680’、690和690’。如在此进一步描述的,采集装置600可在第一、第二、第三、第四和第五配置之间移动,以传递大体上不存在体外微生物(诸如,例如,皮肤驻留的微生物和/或其他有害外部污染物)的体液流。采集装置600可具有任何合适的形状、尺寸或配置。例如,采集装置600的多个方面和/或部分在在形式和/或功能上大体类似于上述采集装置100、200、300、400和/或500中任何装置的相应方面和/或部分。因此,在此不进一步详细描述这类类似的方面和/或部分。例如,在一些实施例中,采集装置600的样本储存器680、680’、690和690’在形式和/或功能上可分别大体类似于和/或等同于图16-22的采集装置400中包括的样本储存器480、480’、490和490’。转移机构620包括分配构件629和一组耦接构件637a、637b、637c和637d(例如,见图27)。分配构件629与耦接构件637a、637b、637c和637d流体连通,并被配置为提供和/或限定用于从患者采集体液的一组流体流路径。如图27和28所示,分配构件629限定和/或形成与前样本储存器670流体连通的第一出口端口630、与第一耦接构件637a流体连通的第二出口端口631、与第二耦接构件637b流体连通的第三出口端口632、与第三耦接构件637c流体连通的第四出口端口633、与第四耦接构件637d流体连通的第五出口端口634。如图28所示,分配构件629限定腔或空间,所述腔或空间限定前样本储存器670的至少一部分。前样本储存器670被配置为容纳体液,诸如,例如,血液、血浆和/或尿液等。例如,前样本储存器670可接收和容纳来自患者的第一量或体积的体液,其中,体液的第一量可以是预定的或未定的量。此外,转移机构620和流控制器640的布置可使得前样本储存器670保持与耦接构件637a、637b、637c和637d和/或随后从患者抽取的多部分体液流体隔离,如在此进一步详细描述的。以此方式,出口端口631、632、633和634可在流控制器640与各个耦接构件637a、637b、637c和637d之间引导和/或限定流体流路径,如在此进一步详细描述的。在一些实施例中,第一出口端口630和前样本储存器670的布置在形式和功能上可大体类似于前样本储存器470和/或570。因此,这里不进一步详细描述前样本储存器670。如图29所示,第一耦接构件637a限定与刺穿构件655a流体耦接的流通道638a。如上所述,耦接构件637a可物理地和流体地耦接到分配构件629。例如,流通道638a可接纳分配构件的第二出口端口631的一部分,以将耦接构件637a物理地和流体地耦接到其上。在一些实施例中,第二出口端口631的表面可与限定流通道638a的耦接构件637a的内表面形成大体流体密封的密封结构(例如,可形成大体气密的密封结构的摩擦配合)。耦接部分637a的刺穿构件655a在形式和功能上可大体类似于图16-22的采集装置400中包括的刺穿构件455a。因此,这里不进一步详细描述刺穿构件655a。类似地布置第二耦接构件637b、第三耦接构件637c和第四耦接构件637d。因此,第二耦接构件637b、第三耦接构件637c和第四耦接构件637d各自分别包括刺穿构件655b、655c和655d,并各自分别限定流通道638b、638c和638d。如在此进一步详细描述的,第一耦接构件637a、第二耦接构件637b、第三耦接构件637c和第四耦接构件637d可用于选择性地使转移机构620分别与第一样本储存器680、第二样本储存器680’、第三样本储存器690和第四样本储存器690’流体连通。如图30和31所示,流控制器640包括转盘645和密封构件641。流控制器640的转盘645可旋转地位于分配构件629内(例如,见图32和33)并且可在第一位置、第二位置、第三位置和第四位置之间移动。转盘645包括各自与内部容积646(例如,见图30)流体连通的入口端口621、第一出口端口647和第二出口端口648。内部容积646被配置为接纳密封构件641的一部分,如在此进一步详细描述的。入口端口621可流体耦接到限定用于将体液从患者抽取和/或输送到采集装置600的流体流路径的医疗装置(未示出)。例如,入口端口621可直接地或经由适配器604(例如,见图26和27)间接地流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。第一出口端口647与前样本储存器670流体连通。例如,第一出口端口647可以可旋转地位于分配构件629的第一出口端口630中。当转盘645分别位于其第一位置、第二位置、第三位置和第四位置时,第二出口端口648可选择性地与第二出口端口631、第三出口端口632、第四出口端口633和第五出口端口634流体连通。以此方式,转盘645的内部容积646可选择性地与前样本储存器670、第一样本储存器680、第二样本储存器680’、第三样本储存器690和第四样本储存器690’与流体连通,如在此进一步详细描述的。流控制器640的密封构件641的至少一部分可旋转地位于转盘645的内部容积646中并可在第一位置和第二位置之间移动。此外,密封构件641可具有这样的尺寸和形状,即,使得密封构件641的外表面与限定内部容积646的至少一部分的转盘645的内表面形成大体流体密封的密封结构。如图31所示,密封构件641限定第一流通道642和第二流通道644。当密封构件641处于其在内部容积646内的第一位置时,第一流通道642在入口端口621和第一出口端口647之间建立流体连通,同时使入口端口621与第二出口端口648流体隔离。类似地,当密封构件641处于其在内部容积646内的第二位置时,第二流通道644在入口端口621和第二出口端口648之间建立流体连通,同时使入口端口621与第一出口端口647流体隔离。当转盘645旋转到分配构件629内的第二、第三和第四位置时,采集装置600以类似方式工作。因此,当入口端口621与患者(例如,经由耦接到入口端口621和/或适配器604的医疗装置)流体连通时,分配构件629的第一出口端口630、第二出口端口631、第三出口端口632、第四出口端口633和第五出口端口634可选择性地与入口端口621流体连通,以容许体液分别流入前样本储存器670、第一样本储存器680、第二样本储存器680’、第三样本储存器690和第四样本储存器690’。在操作时,采集装置600可用于从患者采集减少污染的体液(例如,血液、血浆和/或尿液等)。例如,采集装置600的入口端口621流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。在静脉穿刺(或其他体液获得方法)之后,可致动(或旋转)密封构件641,直到它处于如图32所示的第一位置。替代性地,密封构件641可被预设在第一位置,并且采集装置600可以其他方式被密封,以保持采集装置600的无菌性。当密封构件641处于其第一位置时,流控制器640在入口端口621和分配构件629的第一出口端口630之间建立流体连通,同时使入口端口621与耦接构件637a、637b、637c和637d流体隔离。因此,如图32的箭头II所示,可按上文参照采集装置400描述的类似方式将体液从患者通过入口端口621、第一流通道642、转盘645的第一出口端口647和分配构件629的第一出口端口630流入前样本储存器670。在前样本储存器670中采集了体液前样本之后,可相对于转盘645将密封构件641从其第一位置致动(或旋转)到其第二位置。类似地,可相对于分配构件629致动(或旋转)转盘645,直到它达到第二位置,如图33所示。当密封构件641和转盘645处于第二位置时,流控制器640处于第二配置,并且密封构件641的第二流通道644在入口端口621和第一耦接构件637a的流通道638a之间建立流体连通,同时使前样本储存器670与入口端口621流体隔离。当流控制器640处于第二配置时,使用者可将样本储存器680从第一配置致动到第二配置(例如,推动刺穿构件655a),以在患者身体的一部分(例如,血管)与第一样本储存器680之间建立流体连通。如上所述,将样本储存器680移动到第二配置会致使刺穿构件655a穿透样本储存器680的真空密封件,位于样本储存器680内的。在此第二配置,患者身体的所述部分(例如,血管)暴露于来自样本储存器680的由其中的负压状态(真空)产生的真空吸力下。体液从患者身体的所述部分通过入口端口621、第二流通道644、第二出口端口631、流通道638a和第一耦接构件637a的刺穿构件655a进入第一样本储存器680,如图33的箭头JJ所示。一旦期望量的体液(例如,第二量)被采集在样本储存器680中,使用者就可将流控制器640致动(旋转)到第三位置和/或将样本储存器680移回其第一配置,以使第一样本储存器680与第二流通道644隔离。当样本储存器680返回其第一配置时,刺穿构件655a被移离样本储存器680,并且样本储存器680的密封件(例如,独立密封隔膜)使第一样本储存器680与流通道635a流体隔离。当流控制器640分别位于第三、第四和第五配置时,以类似方式填充其他样本储存器。图34-40描绘根据实施例的采集装置700。采集装置700包括转移机构720、流控制器740以及样本储存器780和790(尽管描绘了用于四个样本储存器的托架,但为了清楚起见图中仅包括两个样本储存器,并且额外的样本储存器(例如,第五、第六等)可被包括作为采集装置700的一部分)。如在此进一步描述的,采集装置700可在第一、第二、第三、第四和第五配置之间移动,以传递大体上不存在体外微生物(诸如,例如,皮肤驻留的微生物和/或其他有害外部污染物)的体液流。采集装置700可具有任何合适的形状、尺寸或配置。例如,采集装置700的一些方面和/或部分在形式和功能上可大体类似于采集装置100、200、300、400、500和/或600中任何装置的相应方面和/或部分。因此这里不进一步详细描述这些类似的方面和/或部分。例如,采集装置700的样本储存器780和790在形式和功能上可大体类似于图16-22的采集装置400中包括的样本储存器480和490。转移机构720包括外壳701、分配构件729和基板771。如上文参照采集装置400描述的,外壳701限定第一出口孔口703a、第二出口孔口703b、第三出口孔口703c、第四出口孔口703d和第五出口孔口703e,它们各自被配置为与分配构件729的不同部分流体连通。更具体地,分配构件729限定和/或形成与第一出口孔口703a流体连通的前样本储存器770的至少一部分以及与第二出口孔口703b流体连通的第一流体腔735a、与第三出口孔口703c流体连通的第二流体腔735b、与第四出口孔口703d流体连通的第三流体腔735c和第五出口孔口703e流体连通的第四流体腔735d。此外,外壳701限定被配置为可移动地接纳流控制器740的至少一部分的凹口766,如在此进一步详细描述的。如图36所示,分配构件729限定腔或空间,所述腔或空间形成前样本储存器770的至少一部分。前样本储存器770被配置为容纳体液,诸如,例如,血液、血浆和/或尿液等。外壳701的第一出口孔口703a可与前样本储存器770的开口部分大体对齐,以容许前样本储存器770接收来自患者的体液流,如上文详细描述的。进一步详述,分配构件729包括一组壁736,它们可例如将分配构件729的内部容积划分成彼此流体隔离的多个部分和/或空间。例如,如图36所示,该组壁736可将分配构件729的内部容积划分成前样本储存器770、第一流体腔735a、第二流体腔735b、第三流体腔735c和第四流体腔735d。在一些实施例中,壁736可均等地限定和/或形成前样本储存器770和流体腔735a-735d。在其他实施例中,前样本储存器770限定的空间可不同于流体腔735a-735d限定的空间。分配构件729还包括第一刺穿构件755a、第二刺穿构件755b、第三刺穿构件755c、第四刺穿构件755d,它们分别与第一流体腔735a、第二流体腔735b、第三流体腔735c和第四流体腔735d。因此,刺穿构件755a-355d可用于穿透样本储存器780和790(以及图34-40中未示出的相应样本储存器)的真空密封件,这可使体液开始流动,如在此进一步详细描述的。采集装置700的流控制器740包括转盘745和密封构件741。密封构件741位于外壳701的凹口766(例如,见图38和40)中。更具体地,流控制器740可耦接到外壳701,从而使得密封构件741位于限定凹口766的外壳701的表面和转盘745的表面之间并与两个表面接触。密封构件741可被配置为与转盘745的表面和限定凹口766的外壳701的表面形成大体流体密封的密封结构,如上文详细描述的。如图35所示,密封构件741限定第一孔口744a、第二孔口744b、第三孔口744c、第四孔口744d和第五孔口744e。密封构件741的布置使得,当密封构件741处于凹口766中时,第一孔口744a、第二孔口744b、第三孔口744c、第四孔口744d和第五孔口744e分别与外壳701的第一出口孔口703a、第二出口孔口703b、第三出口孔口703c、第四出口孔口703d和第五出口孔口703e大体对齐。流控制器740的转盘745可旋转地耦接到外壳701上并且可相对于外壳701在第一位置、第二位置、第三位置、第四位置和第五位置之间移动。转盘745包括入口端口721,入口端口721可(直接地或经由适配器704间接地)流体耦接到限定用于将体液从患者抽取和/或输送到采集装置700的流体流路径的医疗装置。以此方式,入口端口721可被配置为选择性地使前样本储存器770、第一样本储存器780、第二样本储存器780’、第三样本储存器790和第四样本储存器790’与患者流体连通,如在此进一步详细描述的。当转盘745处于第一位置时,流控制器740处于第一配置,并且入口端口721可与密封构件741的第一孔口744a和外壳701的第一出口孔口703a大体对齐。以此方式,密封构件741的第一孔口744a在入口端口721和第一出口孔口703a之间建立流体连通,同时使入口端口721与出口端口703b、703c、703d和703e流体隔离,这继而使入口端口721与流体腔735a-335d流体隔离。当转盘745被旋转(或被致动)到第二位置时,流控制器740处于第二配置,并且第二出口孔口744b在入口端口721和第二出口孔口703b之间建立流体连通,同时使入口端口721与前样本储存器770和流体腔735b-735d流体隔离。当转盘745被旋转到第三、第四和第五位置时,采集装置700以类似方式工作。因此,当入口内腔721与患者(例如,经由耦接到入口端口721的医疗装置)流体连通时,第一出口孔口703a、第二出口孔口703b、第三出口孔口703c、第四出口孔口703d和第五出口孔口703e可选择性地与入口端口721流体连通,以容许全部体液流入前样本储存器770、第一样本储存器780或第二样本储存器790(或与其耦接的任何其他流体储存器)中的至少一个。在一些实施例中,外壳701可选择性地限制转盘745从其第一位置到其第二、第三、第四和第五位置的移动。在一些实施例中,外壳701可被配置为一旦转盘已经移动到第五位置就阻止其移动。换言之,外壳701可包括阻止转盘745从第五位置移动返回第一位置的锁定机构。此特征可降低流体腔735b-735d和/或样本储存器780和790中采集的体液被前样本储存器770中容纳的体液(其具有包含表面束缚微生物和/或其他有害外部污染物的高风险)污染的风险。此锁定机构还可保护医疗保健行业从业者,防止其暴露于患者样本中的血源性病原体,其可包括HIV、丙型肝炎等。转盘745和/或外壳701还可包括机械棘爪和/或提供视觉或触觉反馈以确保相对于出口端口703b和外壳701的出口孔口703a-703d精确地定位转盘745的其他指示器。与图16-22描绘的采集装置400的实施例类似,采集装置700包括前样本储存器770,其是包含在分配构件729内的腔。前样本储存器770可包含体液,诸如,例如,血液、血浆和/或尿液等。前样本储存器770被配置为流体耦接到采集装置700的第一出口端口703a(位于外壳701中)。在采集装置700的操作期间,当流控制器740处于第一位置时,体液从患者身体的一部分(例如,血管)经由入口端口721被抽入前样本储存器770、用于前样本储存器的位于密封构件741中的孔口744a和第一出口端口703a。前样本储存器770被配置为包含从患者抽取的第一量的体液,其中体液的第一量可以是预定或未定量,从而使得第一量体液与随后从患者抽取的第二和/或第三和/或第四和/或第五量体液流体隔离。在操作时,采集装置700可用于从患者采集减少污染的体液(例如,血液、血浆、尿液等)。例如,采集装置700的入口端口721流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。在静脉穿刺之后,旋转转盘745,直到它达到如图37和38所示的第一位置。替代性地,转盘745可被预设在第一位置,并且采集装置700可以其他方式被密封,以保持采集装置700的无菌性,如上所述。当转盘745处于第一位置时,流控制器740处于第一配置,并且密封构件741的第一出口孔口744a在入口端口721和第一出口端口703a(包括在外壳701中)之间建立流体连通,同时使入口端口721和四个样品流通道735a-735d流体隔离。在此第一配置,体液从患者身体的一部分通过入口端口721、密封构件741的第一出口孔口744a、外壳701的第一出口端口703a流入分配构件770限定的前样本储存器770,如图38的箭头KK所示。因此,第一量(预定的或未定的)体液可在静脉穿刺之后立即被接纳到前样本储存器770中并与随后的样本隔离,如上文详细描述的。在前样本储存器770中采集了体液前样本之后,可致动(或旋转)转盘745直到它达到第二位置,如图39和40所示。当转盘745处于第二位置时,流控制器740处于第二配置,并且密封构件741的第二出口孔口744a在入口端口721和第一流体腔735a之间建立流体连通,同时使前样本储存器770与入口端口721流体隔离。一旦第一流体腔735a被填充以体液,流控制器740就可移动到第三位置,以相对于外部环境隔离和密封第一流体通道735a。此外,可将样本储存器780从第一配置致动到第二配置,以将体液从第一流体腔735a传送到样本储存器780。例如,可通过使用者或自动地将样本储存器780从第一配置致动(推动刺穿构件755a)到第二配置,以在患者身体的一部分(例如,血管)和样本储存器780之间建立流体连通。如上所述,将样本储存器780移动至第二配置会致使刺穿构件755a穿透样本储存器780的真空密封件并位于样本储存器780中。在第二配置,患者身体的所述部分(例如,血管)暴露于来自样本储存器780的由某些实施例中样本储存器780内存在的负压状态(真空)产生的真空吸力。因此,体液从患者身体的所述部分通过入口端口721、密封构件741的第二出口孔口744b、外壳701的第二出口孔口703b、第二流体腔735b流入第一样本储存器780,如图40的箭头LL所示。一旦期望量的体液(例如,第二量)被采集在样本储存器780中,使用者就可将流控制器740致动(旋转)到第三位置和/或将样本储存器780移回其第一配置,以使样本储存器780与入口端口721隔离。当样本储存器780返回第一配置时,刺穿构件755a被移离样本储存器780,并且样本储存器780的密封件(例如,独立密封隔膜)使第一样本储存器780与第二流体腔735b及外部环境流体隔离。当流控制器740分别位于第三、第四和第五配置时,以相同方式填充其他样本储存器。在一些实施例中,采集装置700可被构造为不存在分隔分配构件729中的不同流体腔735a-735d的一组壁736(见图16的详细剖视图)。在这类实施例中,分配构件729被划分在前样本储存器770和组合式流体腔735(即,流体腔未被壁736分隔成四个单独的部段)之间。在这类实施例中,使用者可通过同时将转盘745致动(旋转)到各个第二、第三、第四或第五位置来填充全部四个样本储存器。本文描述的任何实施例都可与例如计量装置一起使用,计量装置可用于计量(例如,量化)流入前样本储存器和/或样本储存器的体液流。在一些情形中,实验室标准实践不能确保一致地遵从精确的体液(例如,血液样品)移入体积,因为实际上填充体积是临床医生和、或采血师视觉地确定的并因此存在人为误差。血液采集瓶上的体积指示器在被抓握时难以读数并且在抽取过程期间常常未竖直地抓握采集瓶的事实也可导致从患者接收的体液样本的体积不准确。不足的样本体积(例如,低于制造商的建议值)可降低培养测试的敏感度,导致错误的阴性结果。此外,超过制造商建议值的填充体积可导致错误的阳性结果,如在用于特定类型的测试供给和设备(例如,被设计为与制造商生产的自动微生物检测系统一起使用的血液培养瓶,制造商诸如为新泽西州富兰克林湖的BectonDickinson)的概述材料和使用说明中指示的。因此,流计量和体积显示特征可容许实验室技术人员和/或医疗保健行业从业者(例如,采血师)根据需要如何处理样本在将样本储存器放入培养器或放入其他实验室测试仪器之前确认各个单个样本储存器中采集的体液的体积。实验室技术人员和/或采血师还可记录(例如,在病历卡、数据库、电子表格等中)精确的体积信息,以便临床医生在收到结果时评估,由此帮助降低错误地解释错误的阴性和/或错误的阳性结果的可能性。例如,图41-45图示可包括一个或多个计量装置的采集装置800。采集装置800包括转移机构820、流控制器840、显示器875和样本储存器880。如在此进一步描述的,采集装置800可在第一、第二和第三配置之间移动,以传递大体上不存在体外微生物(诸如,例如,皮肤驻留的微生物和/或其他有害外部污染物)的体液流。采集装置800可具有任何合适的形状、尺寸或配置。例如,采集装置600的一些方面和/或部分在形式和功能上可大体类似于上述采集装置100、200、300、400、500、600和/或700中任何装置的相应方面和/或部分。因此,这里不进一步详细描述这些类似的方面和/或部分。例如,在一些实施例中,采集装置800的样本储存器880在形式和功能上可大体类似于和/或等同于图16-22的采集装置400中包括的样本储存器480。如图41-43所示,转移机构820包括致动器部分822(例如,第一部分)、医疗部分823(例如,第二部分)和耦接部分824(例如,第三部分)。转移机构820的致动器部分822的大体圆柱形的,包括限定内部容积806的一组环形壁。更具体地,致动器部分822包括大体闭合的第一端部和与第一端部相反、大体开口以容许进入内部容积806的第二端部。以此方式,致动器部分822可以可移动地接纳流控制器840的至少一部分,如在此进一步详细描述的。致动器部分822还包括入口端口821和出口端口831。入口端口821可流体耦接到限定用于将体液从患者抽取和/或输送到采集装置800的流体流路径的医疗装置(直接地或经由适配器804间接地),如上文详细描述的。致动器部分822的出口端口831可选择性地使致动器部分822的内部容积806与医疗部分823限定的内部容积807流体连通。如图43所示,医疗部分823位于致动器部分822和耦接部分824之间。尽管图41-45中未示出,但医疗部分823可包括计量装置,其可被配置为计量被传送到例如样本储存器880的体液的体积。例如,在一些实施例中,流计量装置可流体耦接到出口端口831,以计量流过的体液流。如图41和42所示,医疗部分823包括显示器875,其可为使用者提供与例如已流过出口端口831的体积相关的视觉指示和/或信息。在其他实施例中,流计量装置可被放置在转移机构820中或沿转移机构820的任何其他位置。耦接部分824可物理地和流体地耦接到医疗部分823。例如,在一些实施例中,耦接部分824可部分地位于医疗部分823的内部容积807中并经由摩擦配合、压装配合、卡扣配合、螺纹耦接和/或粘合剂至少暂时地耦接到其上。耦接部分824被配置为接纳样本储存器880的一部分,并包括刺穿构件855,其可用于穿透样本储存器880的真空密封件,这容许体液开始流动,如上文详细描述的。采集装置800的流控制器840至少部分地位于致动器部分822限定的内部容积806中,并且可在第一配置、第二配置和第三配置之间移动。如图42和43所示,流控制器840包括具有第一密封构件861、第二密封构件862和第三密封构件863的可移动构件850及偏置构件859(例如,弹簧等)。密封构件861、862和863与限定内部容积806的致动器部分822的内表面接触。因此,密封构件861、862和863可各自与所述内表面形成大体流体密封的密封结构,例如,这可将致动器部分822的内部容积806划分成流体隔离的多个部分,如在此进一步详细描述的。可移动构件850可在内部容积806内在第一位置、第二位置和第三位置之间移动。可移动构件850的布置可使得当可移动构件850在其第一、第二和第三位置之间移动时,密封构件861、862和863可在内部容积806内选择性地移动。更具体地,当可移动构件850在其第一、第二和第三位置之间移动时,第一密封构件861可与可移动构件850同时移动。第二密封构件862和第三密封构件863可牢固地耦接到彼此(例如,彼此相距固定距离地放置)并且关于可移动构件850的一部分可滑动地放置,这可容许可移动构件850从其第一位置(例如,见图43)移动至其第二位置(例如,见图44),同时第二密封构件862和第三密封构件863相对于致动器部分822保持处于大体固定的位置。例如,当可移动构件850在其第一位置和第二位置之间移动时,第二密封构件862和第三密封构件863可保持处于大体固定的位置,从而使得入口端口821位于第二密封构件862的第一侧上,而出口端口831位于第二密封构件862的与第一侧相反的第二侧上。因此,当可移动构件850处于其第一位置(图43)和其第二位置(图44)时,入口端口821与被限定在第一密封构件861和第二密封构件862之间的内部容积806部分流体连通,并且出口端口与被限定在第二密封构件862和第三密封构件863之间的内部容积806部分流体连通,如在此进一步详细描述的。流控制器840的布置可使得,当可移动构件850从其第一位置移动到其第二位置时,第一密封构件861相对于第二密封构件862和第三密封构件863移动。第一密封构件861相对于第二密封构件862的移动可使得限定在其之间的空间增大,这可形成和/或以其他方式限定前样本储存器870。此外,当密封构件861和862与致动器部分822的内表面形成大体流体密封的密封结构时,被限定在第一密封构件861和第二密封构件862之间的前样本储存器870与内部容积806的其他部分流体隔离。因此,当可移动构件850从其第一位置移动到其第二位置时,入口端口821可与前样本储存器870流体连通。当可移动构件850从其第二位置(例如,见图44)移动到其第三位置(例如,见图45)时,可移动构件850的一部分可接触第三密封构件863,以在内部容积806内同时移动第一密封构件861、第二密封构件862和第三密封构件863。因此,可相对于入口端口821移动第二密封构件862,从而使得入口端口821和出口端口831都与被限定在第二密封构件862和第三密封构件863之间的内部容积806的一部分流体连通,如在此进一步详细描述的。在操作时,采集装置800可用于从患者采集减少污染的体液(例如,血液、血浆、尿液等)。例如,采集装置800的入口端口821可流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。当入口端口821耦接到内腔限定装置时,可将流控制器840从其第一配置移动到其第二配置。以此方式,使用者可施加将可移动构件850从其第一位置移动到其第二位置的力,如图44的箭头MM所示。如上所述,第一密封构件861与可移动构件850同时移动,从而增大被限定在第一密封构件861和第二密封构件862之间的空间,由此形成和/或限定前样本储存器870。当第一密封构件861和第二密封构件862与限定内部容积806的致动器部分822的内表面形成大体流体密封的密封结构时,第一密封构件861和第二密封构件862之间空间的增大会在前样本储存器870中产生负压。因此,一旦在患者身体的一部分(例如,血管)和前样本储存器870之间建立了流体连通(例如,经由图44中的入口端口821),在前样本储存器870和患者身体的所述部分之间限定的负压差就会通过入口端口821将体液抽入前样本储存器870,如图44的箭头NN所示。在此第一配置中,流控制器840还使前样本储存器870与出口端口831流体隔离。因此,第一量(预定的或未定的)体液可在静脉穿刺(例如)之后立即被容纳到前样本储存器870中并与随后的样本隔离。以此方式,采集装置800可用于防止第一量体液(其最可能含有体表微生物和/或其他有害的外部污染物)污染随后量的体液样本,这些体液样本被采集并用于可受污染物影响的诊断或其他测试。在一些实施例中,计量装置可计量位于前样本储存器870中的体液的体积,并在显示器875上显示与体积相关的值。在前样本储存器870中采集了所述体积的体液前样本之后,将可移动构件850从其第二位置移动到其第三位置,以使流控制器处于其第三配置,如图45的箭头OO所示。如上所述,当将可移动构件850从其第二位置移动到其第三位置时,可移动构件850的所述部分与第三密封构件863接触。因此,可移动构件850可在内部容积806内大体同时地移动第一密封构件861、第二密封构件862和第三密封构件863。因此,可相对于入口端口821移动第二密封构件862,从而使得入口端口821和出口端口831都与被限定在第二密封构件862和第三密封构件863之间的内部容积806的一部分流体连通,如在此进一步详细描述的。此外,当所述体积的体液被流体隔离在前样本储存器870中时,第二密封构件862和第三密封构件863沿第一密封构件861方向的移动受到限制(即,体液的基本不可压缩的流体)。以此方式,前样本体积的体液被隔绝在前样本储存器870中,并且被限定在第二密封构件862和第三密封构件863之间的空间限定在入口端口821和出口端口831之间的流体流路径。此外,流控制器840的布置使得,当处于其第三配置时,第一密封构件861与偏置构件859接触,并且使用者施加在可移动构件850上的力的至少一部分能够使偏置构件859变形、收缩、弯曲和/或以其他方式改变形状。因此,偏置构件859可在第一密封构件861上施加抵抗流控制器840从其第二配置移动到其第三配置的反作用力,如在此进一步详细描述的。相对于采集装置800放置样本储存器880,从而使得刺穿构件855穿透样本储存器880的真空密封件,以位于样本储存器内,如上文详细描述的。样本储存器880和患者身体的所述部分之间的压力差(例如,真空或负压)将体液抽入样本储存器880。换言之,在第二配置,流控制器840和转移机构820建立流体流路径,从而使得体液可通过入口端口821、被限定在第二密封构件862和第三密封构件863之间的内部容积806部分和致动器部分822的出口端口831,通过医疗部分823和耦接部分824的刺穿构件855从患者被抽入样本储存器880中,如图45的箭头PP所示。如上所述,计量装置(未示出)可计量被传送通过例如出口端口831的体液的体积,并且可在显示器875上显示与体积相关的值。一旦期望量的体液(例如,第二量)被采集在样本储存器880中,使用者就可去除和/或减小施加在可移动构件850上的力,由此容许偏置构件859将第一密封构件861和可移动构件850从它们的第三位置移向它们的第二位置。此外,由于前样本储存器870中的体液基本不可压缩,因此第一密封构件861的移动会通过所述体积的体液传送力,以将第二密封构件862和第三密封构件863从它们的第三位置移向它们的第二位置。在一些实施例中,偏置构件859可在第一密封构件861上施加力,所述力能够相对于致动器部分822将第二密封构件862移动至可例如大体上阻塞入口端口821的第四位置。因此,入口端口821可与致动器部分822的内部容积806流体隔离。此外,可从样本储存器880移开刺穿构件855,并且和密封件(例如,独立密封隔膜)可使体液样本与样本储存器880外的空间流体隔离。通过将刺穿构件855放入样本储存器并将流控制器840移动至第三位置以容许液体从患者流至样本储存器,可类似地填充随后的样本储存器。图46-53图示根据实施例的采集装置900。采集装置900包括转移机构920、流控制器940和样本储存器980、980’、990和990’。如在此进一步描述的,采集装置900可在第一、第二、第三、第四和第五配置之间移动,以传递大体上不存在体外微生物(诸如,例如,皮肤驻留的微生物和/或其他有害外部污染物)的体液流。采集装置900可具有任何合适的形状、尺寸或配置。例如,采集装置900的一些方面和/或部分在形式和功能上可大体类似于上述采集装置100、200、300、400、500、600、700和/或800中任何装置的相应方面和/或部分。因此,这里不进一步详细描述这些类似的方面和/或部分。例如,在一些实施例中,采集装置900的样本储存器980、980’、990和990’在形式和功能上可分别大体类似于和/或等同于图26-33的采集装置600中包括的样本储存器680、680’、690和690’。。转移机构920包括外壳901、分配构件929和可移动构件950a、950b、950c和950d。外壳901物理地和流体地耦接到分配构件929,并提供和/或限定用于从患者采集体液的一组流体流路径。外壳901包括一组显示器975’(例如,液晶显示器(LCD)等),它们可被包括在流计量装置中和/或以其他方式耦接(例如,电气地和/或机械地)到流计量装置,如在此进一步详细描述的。外壳901限定凹口966、出口孔口903a、903b、903c、903d、903e和可移动构件开口950a、950b、950c、950d(在此也被称作“开口”)。凹口966被配置为容纳包括在流控制器940中的密封构件941,如在此进一步详细描述的。第一出口孔口903a、第二出口孔口903b、第三出口孔口903c、第四出口孔口903d和第五出口孔口903e各自被配置为限定与分配构件929的不同部分流体连通的不同流体流路径。更具体地,分配构件929限定和/或形成与第一出口孔口903a流体连通的前样本储存器970的至少一部分,以及与第二出口孔口903b流体连通的第一流通道935a、与第三出口孔口903c流体连通的第二流通道935b、与第四出口孔口903d流体连通的第三流通道935c和第五出口孔口903e流体连通的第四流通道935d。如图47和48所示,分配构件929限定腔或空间,所述腔或空间限定前样本储存器970的至少一部分。前样本储存器970被配置为容纳体液,诸如,例如,血液、血浆和/或尿液等。外壳901的第一出口孔口903a可与前样本储存器970的开口部分大体对齐,以容许前样本储存器970接收来自患者的体液流,如上文参照图16-22的前样本储存器470详细描述的。流通道935a-935d从分配构件929的中心沿径向延伸并被布置为使得每个流通道935a、935b、935c和935d与前样本储存器970及其他流通道流体隔离。以此方式,流通道935a、935b、935c和935d可引导和/或以其他方式限定第一端部(限定分别与出口孔口903b、903c、903d和903e大体对齐的开口)和第二端部(限定被配置为分别接纳可移动构件950a、950b、950c、950d的开口或端口)之间的流体流路径。尽管图47和48示出了分配构件929包括大体闭合的流通道935a-935d,但在其他实施例中,流通道935a-935d可以是大体开放的,如上文参照图17和18的分配构件429示出和描述的。因此,采集装置900的分配构件929可以与采集装置400的分配构件429大体类似的方式起作用。可移动构件950a、950b、950c和950d可以可移动地位于外壳901的各个开口905a、905b、905c和905d中,以及由分配构件929的第二端部限定的相应开口中。尽管图46-53中未示出,但在一些实施例中,可移动构件950a、950b、950c和950d可以可操作地耦接到偏置构件等,如上文参照采集装置200的可移动构件250和250’详细描述的。以此方式,使用者可相对于外壳901和分配构件929从第一位置和第二位置致动(例如,移动)可移动构件950a、950b、950c和950d,以将流体流分别引导入第一样本储存器980、第二样本储存器980’、第三样本储存器990和第四样本储存器990’。可移动构件950a、950b、950c和950d大体相同,并因此参照图49中的单个可移动构件950进行描述。此外,可移动构件950的一些部分可大体类似于上述可移动构件250和350。因此,这里不进一步详细描述可移动构件950的一些部分。可移动构件950限定与入口端口953和刺穿构件955流体连通的内部腔952。刺穿构件大体类似于上文详细描述的那些。入口端口953延伸通过限定内部腔952的一组壁,以使可移动构件950的内部容积952与相应的流通道935a、935b、935c或935d流体连通。如图49所示,可移动构件950包括可旋转地位于内部容积952中并与入口端口953大体直接地流体连通的流控制机构967。流计量机构967可以是例如可包括一组辐条或翅片的轮等。以此方式,体液可进入可移动构件950的入口端口953并流过流计量装置967,这继而可致使流计量装置967相对于可移动构件950旋转。因此,流计量装置967的旋转特征可用于确定被传送到可移动构件950的内部容积952中的体液的体积和/或体积流率等。尽管图46-53中未示出,但可移动构件950的流控制机构967可操作地耦接到外壳901的显示器975’上。因此,当体液被传送到例如样本储存器980、980’、990和/或990’时,与体液流相关的体积信息可显示在显示器975’上。以此方式,使用者可操纵采集装置900从患者采集体液样本并且可使至少一个显示器975’可视化,以确定被传送到例如样本储存器980的体液样本的准确体积。采集装置900的流控制器940包括转盘945和密封构件941。密封构件941位于外壳901的凹口966中。更具体地,流控制器940可耦接到外壳901,从而使得密封构件941位于限定凹口966的外壳901的表面和转盘945的表面之间并与两个表面接触。密封构件941可被配置为与转盘945的表面和限定凹口966的外壳901的表面形成大体流体密封的密封结构,如上文详细描述的。如图47所示,密封构件941限定第一孔口944a、第二孔口944b、第三孔口944c、第四孔口944d和第五孔口944e。密封构件941的布置使得,当密封构件941处于凹口966中时,第一孔口944a、第二孔口944b、第三孔口944c、第四孔口944d和第五孔口944e分别与外壳901的第一出口孔口903a、第二出口孔口903b、第三出口孔口903c、第四出口孔口903d和第五出口孔口903e大体对齐。流控制器940的转盘945可旋转地耦接到外壳901上并且可相对于外壳901在第一位置、第二位置、第三位置、第四位置和第五位置之间移动。转盘945包括入口端口921,其可流体耦接到限定用于将体液从患者抽取和/或输送到采集装置900的流体流路径的医疗装置(直接地或经由适配器904间接地)。以此方式,入口端口921可被配置为选择性地使前样本储存器970、第一样本储存器980、第二样本储存器980’、第三样本储存器990和第四样本储存器990’与患者流体连通,如在此进一步详细描述的。转盘945可被配置为以与上文参照采集装置400的转盘445描述的大体类似的方式旋转通过第一位置、第二位置、第三位置、第四位置和第五位置,并且因此,这里不进一步详细描述。如图所示,转盘945可还包括显示器975,其可被配置为显示与体液流相关的体积信息。例如,尽管图46-53中未示出,但转盘可包括流计量装置等,诸如可移动构件950包括的流计量装置967。以此方式,流计量装置可计量流过例如入口端口921的体液流并且可以可操作地耦接到显示器975,从而在转盘945的显示器975上显示通过入口端口921的体液流。在操作时,采集装置900可用于从患者采集减少污染的体液(例如,血液、血浆和/或尿液等)。例如,采集装置900的入口端口921可流体耦接到针头或其他内腔限定装置(例如,柔性无菌管)。在静脉穿刺(或其他体液获得方法)之后,致动(或旋转)转盘945,直到它达到如图50和51所示的第一位置。替代性地,转盘945可被预设在第一位置,并且采集装置900可以其他方式被密封,以保持采集装置900的无菌性。如上所述,当转盘945处于第一位置时,流控制器940处于第一配置,并且密封构件941的第一孔口944a在入口端口921和第一出口端口930(包括在外壳901中)之间建立流体连通,同时使入口端口921和四个流通道935a-335d流体隔离。此外,在第一配置中,样本储存器980、980’、990和990’与入口端口921流体隔离,并且在患者身体的一部分(例如,血管)和前样本储存器970之间限定流体流路径,如图51的箭头QQ所示。在此第一配置,体液(例如,通过重力、真空等)从患者身体的一部分通过入口端口921、密封构件941的第一孔口944a、外壳901的第一出口端口903a流入前样本储存器970。在第一配置,流控制器940还使前样本储存器970与流通道935a-935d流体隔离。因此,第一量(预定的或未定的)体液可在静脉穿刺(例如)之后立即被容纳到前样本储存器970中并与随后的样本隔离。以此方式,采集装置900可用于防止第一量体液(其最可能含有体表微生物和/或其他有害的外部污染物)污染随后量的体液样本,这些体液样本被采集并用于可受污染物影响的诊断或其他测试。此外,显示器975可显示例如从流控制机构(未示出)接收的与传送到前样本储存器970的体液体积相关的信息。因此,准确体积的体液可被传送到前样本储存器并被流体隔离在其中。在前样本储存器970中采集了体液前样本之后,可致动(或旋转)转盘945直到它达到第二位置,如图52和53所示。当转盘945处于第二位置时,流控制器940处于第二配置,并且密封构件941的第二孔口944b在入口端口921和流通道935a之间建立流体连通,同时使前样本储存器970与入口端口921流体隔离。当流控制器940处于第二配置时,使用者可将可移动构件950a从第一位置致动(例如,按压)到第二位置,以在患者(例如,血管)与第一样本储存器880之间建立流体连通。此外,可将可移动构件950从其第一位置移动到其第二配置,以使刺穿构件955穿过第一样本储存器980的真空密封件,以位于其中,如图53的箭头RR所示。当处于第二位置时,可移动构件950的入口端口953与第一流通道935a大体对齐并流体连通,这容许体液从第一流通道935a流入可移动构件950的内部腔952,并从刺穿构件955流入第一样本储存器980。样本储存器980和第一流通道935a之间的压力差(例如,真空或负压)将体液抽入样本储存器980。换言之,在第二配置,流控制器940和可移动构件950a在转盘945入口端口921和样本储存器980之间建立流体流路径,如图53的箭头SS所示。此外,流过可移动构件950a的体液流使流计量机构967相对于可移动构件950旋转。因此,流计量机构967的旋转可用于确定被传送到样本储存器980的体液样本的体积。此外,显示器975’可显示例如从流控制机构967接收的与传送到样本储存器980的体液体积相关的信息。因此,准确体积的体液可被传送到样本储存器980。例如,在一些情形中,采集装置900可用于分别在第一样本储存器980、第二样本储存器980’和第三样本储存器990中采集三个20mL体积的样本(即,采集的样本总体积为60mL)。一旦期望量的体液(例如,第二量)被采集在第一样本储存器980中,使用者就可释放可移动构件950,容许偏置构件(未示出)移回其第一位置。当可移动构件950返回其第一位置时,刺穿构件955被移离第一样本储存器980,并且密封件(例如,独立密封隔膜)使第一样本储存器980与内部流通道935流体隔离。采集装置900可用于通过分别将转盘945旋转到其第三位置、第四位置和第五位置,将第二样本体积传送到第二样本储存器980’、将第三样本体积传送到第三样本储存器990以及将第四样本体积传送到第四样本储存器990’。在一些情形中,体液采集装置900可容许临床医生和/或采血师打开包含体液采集装置900的包装并仅移除外壳901(其包含分配构件929)并将外壳901拿到患者床边。临床医生和/或采血师可利用任何标准化技术对患者身体的所述部分(例如,血管)执行静脉穿刺(或采用任何其他获得患者体液的方法)。在静脉穿刺之后,临床医生和/或采血师可采集全部样本所需的总血液体积。例如,临床医生和/或采血师可采集2.5mL前样本转移体积并为四个样本储存器中的每个采集10mL样本体积,总计采集42.5mL体液(例如,血液)。在采集了期望量的体液之后,可从患者身体的所述部分(例如,血管)移走皮下注射针头,并且临床医生和/或采血师可将外壳901(其包含体液)放置在4组式(或2组式)预消毒的样本储存器上方,所述样本储存器具有被预先放置在匹配外壳901的几何形状的定制托盘中的隔膜顶部。通过利用这种预消毒的一组样本储存器,临床医生不必执行用消毒试剂“擦拭”样本储存器顶部的过程步骤,由此减小的污染的可能性(例如,如果不适当地和不足地消毒储存器的顶部的话)。然后,临床医生和/或采血师可在准确地控制体积的情况下启动将体液自动移入样本储存器。在某些实施例中,在完成样本储存器的移入之后,可将显示每个单独样本储存器的体积信息的整个装置900送到实验室以便分析。在其他实施例中,样本储存器980和/或990可被单独移开并被送到实验室以便分析。尽管参照图46-53示出和描述了采集装置900包括可显示与被传送通过采集装置的一部分的体液的体积相关的体积数据的一组显示器975和975’,但在其他实施例中,采集装置可包括具有任何合适的输出指示器的任何合适的流计量机构。例如,图54和55图示了根据实施例的转移机构1020和流控制器1040。转移机构1020和流控制器1040在形式和功能上可分别与转移机构920和流控制器940大体类似。因此,在此不进一步详细描述类似部分。但是,转移机构1020和流控制器1040可在一组显示器1075的布置上不同。例如,转移机构1020包括被配置为可移动地接纳一组可移动构件1050a、1050b、1050c和1050d的外壳1001,可移动构件可各自包括上文参照可移动构件950描述的流计量机构。因此,可移动构件1050a、1050b、1050c和1050d可用于确定从其中传送通过的体液的准确体积。如图55所示,外壳1001的显示器1075可包括一组三个灯,第一灯对应小体积(例如,5mL)、第二灯对应中间体积(例如,20mL),并且第三灯对应可接受的和/或大体积(例如,40mL)。以此方式,当体液流通过流控制器1040和转移机构1020被传送到例如第一可移动构件1050a时,包括在其中的流计量机构可向显示器发送信号灯,显示器能够根据传送通过可移动构件1050的体液的体积点亮第一灯、第二灯和/或第三灯。在其他实施例中,可移动构件1050a、1050b、1050c和1050d可相对于外壳1001从第一位置移动到第二、第三或第四位置。在这类实施例中,位置可与例如待被传送到样本储存器的体液的目的体积相关。例如,在一些实施例中,使用者可将可移动构件1050a从其第一位置致动(例如,移动)到其第二位置。在这类实施例中,第二位置可与例如待被传送到样本储存器的小体积体液(例如,10mL)相关。在一些实施例中,外壳1001和/或可移动构件1050a可包括棘爪、锁、搭扣、突起和/或凹口等,它们可暂时保持可移动构件1050a处于第二位置,直到所述小体积的样本已被传送到样本储存器。此外,一旦位于第二位置,显示器1075就可被配置为点亮与小体积相关的第一灯,以向使用者指示待传送到样本储存器的体液的预设体积。一旦期望体积的体液被传送到样本储存器并被流体隔离在其中,转移机构1020就可被配置为使可移动构件1050a自动返回其第一位置。以此方式,转移机构1020和流控制器1040可物理地和流体地耦接到任意数量的样本储存器并用于将准确体积的体液传送到每个样本储存器。图56是图示利用流计量传送装置从患者获得预定样本体积的体液的方法1190的流程图。流计量传送装置可以是本文描述的任何传送装置(在此也被称作“采集装置”)。例如,在一些实施例中,传送装置可以是上文参照图46-53描述的采集装置900。因此,传送装置可包括具有被配置为与患者选择性地流体连通的入口端口的转移机构、前样本储存器和样本储存器以及被配置为计量从患者流到前样本储存器和样本储存器的体液流的流计量机构。方法1190包括在步骤1191在患者和流计量传送装置之间建立流体连通。例如,端口可流体耦接到针头或其他内腔限定装置(例如,柔性无菌管),其继而可插入患者(例如,静脉穿刺事件或其他获得体液的方法)。当端口与患者流体连通时,在步骤1192,在端口和前样本储存器之间建立流体连通。在一些实施例中,流计量传送装置可包括流控制器等(例如,诸如,采集装置900中包括的流控制器940),流控制器等可被致动和/或被操纵(例如,旋转)到在端口和前样本储存器之间建立流体连通的位置(例如,第一位置)。在一些实施例中,致动流控制器可使得流控制器和转移机构共同限定端口和前样本储存器之间的流体流路径的至少一部分。在一些实施例中,前样本储存器可包括负压等,其可例如使体液流开始从患者流入前样本储存器。在其他实施例中,可以任何其他合适的方式(例如,重力等)使体液流开始流动。在步骤1193,计量从患者传送到前样本储存器的体液流。例如,在一些实施例中,端口可包括可计量穿过端口的体液流的流控制机构(例如,以与上文参照采集装置900的流控制机构967描述的方式类似的方式)。因此,前样本体积的体液被传送到前样本储存器。方法1190包括在步骤1194包括经由流计量传送装置的流计量机构验证位于前样本储存器中的前样本体积的体液是预定前样本体积的体液。例如,流计量机构可以包括类似的显示器和/或可以可操作地耦接类似的显示器(例如,采集装置900的显示器975和/或975’)。流计量机构可被配置为在显示器上显示体积信息,如上所述。在步骤1195,一旦前样本体积的体液位于前样本储存器中,就使前样本储存器与端口流体隔离,以将前样本体积的体液隔绝在前样本储存器中。例如,在一些情形中,可将流控制器和/或转移机构从第一位置和/或配置致动(或旋转)到第二位置和/或第二配置。当流控制器和/或转移机构处于第二配置时,前样本储存器与前样本储存器外的空间流体隔离。在一些实施例中,在步骤1196,当流控制器和/或转移机构被致动到其第二位置和/或配置时,在端口和样本储存器之间建立流体连通。例如,在一些实施例中,流计量传送装置可包括可移动构件(例如,可移动构件950)等,其可包括被配置为刺穿样本储存器的一部分(例如,隔膜等)的刺穿构件。因此,当流控制器和/或转移机构处于其第二位置和/或配置时,刺穿样本储存器的所述部分会使样本储存器与端口流体连通。如上所述,样本储存器可包括可例如使体液流开始从患者流入样本储存器的负压等。在步骤1197,计量从患者传送到前样本储存器的体液流。例如,如上所述,端口可包括可计量穿过端口的体液流的流控制机构(例如,以与上文参照采集装置900的流控制机构967描述的方式类似的方式)。在一些实施例中,流控制机构可包括在例如可移动构件等中,诸如图49的可移动构件950。因此,样本体积的体液被传送到样本储存器。方法1190包括在步骤1198包括经由流计量传送装置的流计量机构验证位于样本储存器中的样本体积的体液是预定样本体积的体液。例如,显示器等可被配置为显示体积信息,如上所述。以此方式,采集了可包含例如外部驻留微生物的预定前样本体积的体液。例如,在一些实施例中,预定前样本体积可以是约0.1mL、约0.3mL、约0.5mL、约1.0mL、约2.0mL、约3.0mL、约4.0mL、约5.0mL、约10.0mL、约20mL、约50mL和/或其之间的任何体积或分数体积。在其他实施例中,前样本体积可大于50mL或小于0.1mL。在其他实施例中,预定前样本体积可在约2mL和约5mL之间。在一个实施例中,预定前样本体积可为约3mL。此外,通过采集预定前样本体积,位于一个或多个样本储存器中的预定样本体积可大体不存在外部驻留微生物。在一些实施例中,预定样本体积可在10mL和60mL之间。在其他实施例中,预定样本体积可在30mL和60mL之间。在其他实施例中,预定样本体积可为60mL。尽管上文描述了将样本体积的体液传送到单个样本储存器,但在其他实施例中,流计量传送装置可用于将预定样本体积传送到多于一个样本储存器。例如,在一些实施例中,可将预定前样本体积的体液采集和流体隔离在前样本储存器中,如上所述。当前样本体积被流体隔离时,流计量传送装置可用于将预定样本体积传送到第一样本储存器,将预定样本体积传送到第二样本储存器以及将预定样本体积传送到第三样本储存器。在这类情形中,预定样本体积可以是例如20mL,从而使得位于第一、第二和第三样本储存器中的总样本体积为60mL。本文描述的体液采集装置的各个实施例可容许利用单次静脉穿刺采集两(或更多)组体液(例如,血液)样本。当前的医疗水平规定利用从不同的单独体液获取位置获得的样本(例如,经由两次单独的静脉穿刺,经由导管和静脉穿刺和/或其任意组合)进行某些测试(例如,血液培养)。本文描述的实施例可帮助从单个体液获取位置(例如,静脉穿刺)获得用于特定诊断测试(例如,血液培养测试)的多个样本,这可将获得这些样本所需的静脉穿刺年度次数降至原来的1/2。这以类似的方式有益于患者和医疗保健行业从业者。减少静脉穿刺(和/或其他体液获得过程)的次数可显著降低针头刺伤医疗保健行业从业者的风险,并减少由这些过程导致的患者的相关并发症(例如,血肿、血栓、静脉炎、感染等)。此外,减少体液获得过程(例如,静脉穿刺)的数量减少了与这些过程相关的补给、人力和废物。医疗保健系统实现的成本降低是重大的并且给出了更高效地使用资源以及改进患者结果的机会,这是因为提高了样本的完整性,由此产生更准确的患者诊断,鼓励治疗计划的形成和执行。体液采集装置还显著降低了在采集后分析中产生错误阳性结果的可能性。本文描述的体液采集装置还可简化体液采集过程并减少手动步骤和“接触点”的数量,由此降低外部污染的可能性。本文描述的装置还可最小化实验室技术人员和/或采血师被针头刺伤和感染的风险。在一些实施例中,本文描述的体液采集装置(例如,100、200、300、400、500、600、700、800和900)可包括抗菌饱和材料和/或部分地由该材料形成(例如,外壳401)。当前水平依靠医疗保健行业从业者将各个抗菌材料(例如,异丙醇棉签)放置在各个样本储存器(例如,480、480’、490和490’)顶部。为了确保服从此准则,装置400(例如)可包括位于装置400内的抗菌材料,从而使得当外壳401位于4组式(或2组式)瓶的顶部时,如图16所示,外壳401与样本储存器480、480’、490和490’的顶部最先接触的点是抗菌材料。以此方式,可确保在将体液移入样本储存器之前合适地消毒样本储存器480、480’、490和490’的顶部。尽管已经具体地示出和描述了各种实施例,但可对形式和细节进行各种改变。例如,尽管参照图19-22示出和描述了沿单个方向选择转盘445(致动器),但在其他实施例中,可沿第一方向和与第一方向相反的第二方向旋转转盘445(致动器)。在这类实施例中,沿第二方向的旋转可被配置为使采集装置移动通过任意数量的配置。在其他实施例中,可限制致动器沿第二方向的旋转。在一些实施例中,转盘可包括机械止动件或锁,以流体隔离从患者接收的第一体积的体液(即,受污染的样本)。换言之,一旦第一储存器(前样本储存器)被填充以预定体积的体液并且使用者已经旋转转盘(致动器)以开始抽入额外的样本,转盘(致动器)就不能向后移动以与第一样本体积(包含在前样本储存器中)建立流体连通。尽管上文已经描述了实施例,但是应该理解,它们仅是以举例方式给出的,并且不受限制。虽然各个实施例已经被描述为具有特定的特征和/或部件的组合,但其他实施例可具有来自本文描述的任何实施例的任何特征和/或部件的任意组合或子组合。例如,尽管参照图34-40示出和描述了采集装置700具有第一、第二、第三、第四或第五配置,但在其他实施例中,本文描述的采集装置可具有更多或更少的配置。此外,尽管参照图2-13示出和描述了采集装置200具有作为前样本储存器270的基于真空的采集管,但在其他实施例中,采集装置200可具有被容纳在外壳201中的腔,类似于图16-22给出的实施例的采集装置400,其包括作为被容纳在分配构件429内的腔的前样本储存器470,反之亦然。还可以改变各个部件的特定配置。例如,各个部件的尺寸和特定形状可与所示实施例不同,但仍提供如本文所述的功能。更具体地,可具体选择各个部件的尺寸和形状,以使体液流以期望速率流入流体储存器。此外,尽管图49具体示出了流计量机构967,但本文描述的任何采集装置可与任何合适的流计量机构一起使用。例如,在一些实施例中,采集装置可包括流计量机构和/或被配置为测量体液的体积特征的任何其他机构、装置或方法,诸如,例如,压力传感器、电压传感器、光学传感器、速度传感器、流计量器、应变仪、阀、涡轮机、浮子、位移分析、密度分析、重量分析、光学分析、超声波分析、热能分析、多普勒分析、电磁场(emf)分析、反射分析、障碍分析、面积分析、文丘里管分析、科里奥利分析、视觉分析和/或任何其他合适的传感器、分析法和/或计算法(例如,应用和/或利用例如波义耳定律、理想气体定律和/或力计算法(力=质量*加速度))。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1