一种包含PIKA佐剂的狂犬病组合物的制作方法
本发明涉及免疫学领域,更具体地,涉及用于预防或/和治疗处理由狂犬病病毒感染引起的狂犬病的狂犬病组合物,其方法和用途,以及更具地涉及用于使用加速计划预防或/和治疗处理由狂犬病病毒感染引起的狂犬病的狂犬病疫苗组合物。
背景技术:
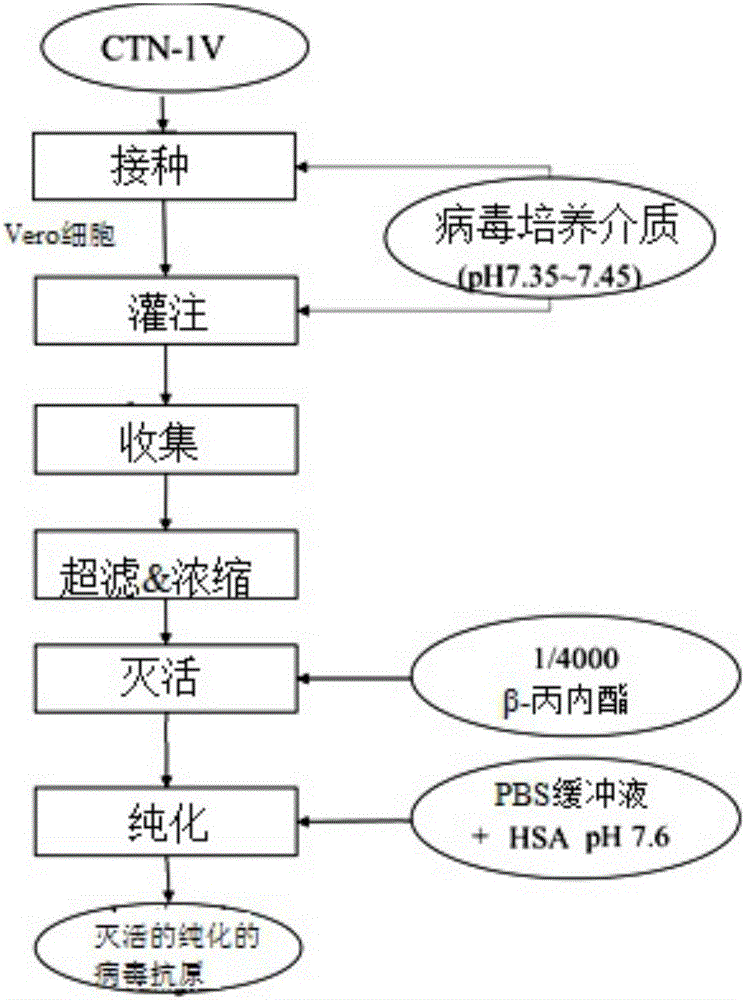
:狂犬病病毒是一种包膜病毒,其含有编码五种结构蛋白的单链RNA基因。狂犬病是一种人畜共患病,其通过携带负载病毒的唾液的污染物或者通过完整的粘膜从动物传播至人类。临床症状出现后的病死率接近100%,并且它还是已知的最具致死性的感染性疾病之一。在发达地区,由于强制性的宠物疫苗接种,通过犬类物种的狂犬病感染是罕见的,例如在美国几乎没有由狂犬咬伤引起的人类狂犬病案例。在发展中国家,由患狂犬病的狗传播的人类狂犬病是更为流行的,仅在印度每年引起25,000-30,000的死亡数。未接种疫苗的流浪狗或小狗是潜在的携带者,它们与受害者(如村庄的儿童)同居。在这些地区对流浪狗的疫苗接种规划通常是失败的。根据WHO报告,全球每年有超过60,000人死于狂犬病。亚洲和非洲是最为流行的地区。最近在印度尼西亚巴厘爆发狂犬病威胁了超过130人生命。到目前为止,一旦感染对狂犬病没有有效的治疗。例如抗病毒药物、类固醇、免疫调节因子和免疫球蛋白输注的治疗通常是无效的。幸运的是狂犬病感染可以通过疫苗接种来预防,一旦接触可能的患狂犬病动物,立即进行局部伤口处理以及适合的接触后预防(PEP)。在更严重的案例中,可能需要狂犬病免疫球蛋白(RIG)的共同施用。具有动物咬伤的高职业风险的人推荐采取针对狂犬病病毒的预防。针对WHO参考血清,通过快速荧光灶抑制试验(RFFIT)测定的等于或高于0.5国际单位(IU)滴度的狂犬病抗体被认为是在哺乳动物物种中有保护性的。试验的详细描述在:LaboratoryTechniquesinRabies,FXMeslin编辑,MMKaplanHKoprowski,第四版,ISBN92415441。商业可获得的狂犬病疫苗是基于固定的狂犬病毒株,例如毕特曼摩尔(pitmanMoore,PM)株、攻毒标准病毒(ChallengeVirusStandard,CVS)的Kissling株、或者Flury少代鸡胚传代(LEP)或者多代鸡胚传代(HEP)、Street-Alabama-Dufferin(SAD)病毒的固定的EvelynRokitnikiAbelseth(ERA)株和不同的SAD变体。这些病毒株适应被WHO批准的四种主要的培养系统,培养系统包括人二倍体细胞、鸡胚或鸭胚、仓鼠肾细胞和非洲绿猴肾(vero)细胞系。佐剂通常是化合物,当与抗原施用时(混合或者抗原施用之前给予),增强或者改进对该特定抗原的免疫应答。常规地,在狂犬病疫苗中添加铝作为佐剂以增强灭活的疫苗的效价。然而,已经发现铝延迟抗体产生并且在接触后试验中对提供更好的保护是无效的。因此,仍在继续寻找用于狂犬病疫苗的适合的佐剂。此外,灭活的疫苗在纯化、冷冻干燥和存储期间是不稳定的。因此,在疫苗溶液中添加化学和/或生物稳定试剂。迄今已知的化学稳定试剂的实例是人白蛋白、水解明胶、糖醇、氨基酸和其他无毒物质。Prince等人,美国专利号4,164,565公开了白蛋白在疫苗中作为稳定剂的用途。因此,一种典型的狂犬病疫苗组合物包含在适合的细胞系中培养的灭活的狂犬病病毒的抗原,含有或不含有佐剂,并且使用白蛋白和其它稳定试剂或赋形剂稳定化。用于预防目的,疫苗通常被给予3次以产生约3至4年的免疫。一旦接触狂犬病病毒,疫苗通常在第0、3、7和14天被给予四次,或者使用包括在第0、3、7、14和28天5次注射的Essen程序。常规施用接触后狂犬病疫苗以防止在接触疑似动物携带者后的致命性疾病。尽管每年在接触疑似狂犬病动物后数百万的人接受PEP(或者甚至与免疫球蛋白共同施用),仍然存在与接受PEP后狂犬病相关的死亡报告。在中国广西的1120人狂犬病案例的研究分析显示27.2%的死亡由疫苗接种失败引起;其中78.2%的死亡案例在第五次注射前发生。这些失败可能与狂犬病疫苗延迟产生狂犬病病毒中和抗体(RVNA)、缺乏T细胞介导的免疫应答、由于个体差异导致的免疫应答的缺乏、或者与WHO接触后治疗指南不符(例如没有注射免疫球蛋白)有关。研究显示,基于感染或对疫苗接种的应答,动物和人能产生狂犬病病毒中和抗体。早期动物研究显示疫苗诱导的IgM和IgG在保护经免疫的动物免受病毒攻击中发挥重要的作用。因此,更高滴度的中和抗体的早期产生在保护可能接触病毒的患者中至关重要。在另一方面,有研究试验和推荐新的疫苗接种方案,可以提高疫苗接种效力,减少临床的复杂性(即更少的注射或更短的临床期间)和成本。欧洲专利号1593392提供了一种具有减少剂量的免疫前和免疫后狂犬病疫苗的方法。在本公开中,我们公开了一种更有效的狂犬病疫苗,其能够诱导更早期的和更高滴度的狂犬病病毒中和抗体。本文中所描述的特定制剂包含混合于缓冲液溶液中的灭活的纯化的狂犬病抗原、PIKA佐剂和人血清白蛋白(含有或不含有其它赋形剂),其用于人使用时是安全和稳定的,具有长保质期。我们进一步公开了使用新的疫苗接种方案施用组合物的方法,其需要更少的临床随访和更短的免疫期间。文献以下参考文献可能是感兴趣的:·Wunner,W.H.,Larson,J.K.,Dietzschold,B.,&Smith,C.L.(1988).Themolecularbiologyofrabiesviruses.ReviewofInfectiousDiseases,10(Supplement4),S771-S784·SudarshanMK,MadhusudanaSN,MahendraBJ,RaoNS,AshwathNarayanaDH,等人(2007).AssessingtheburdenofhumanrabiesinIndia:resultsofanationalmulti-certerepidemiologicalsurvey.IntJInfectDis11:29-35.·JacksonAC,WarrellMJ,PupprechtCE,ErtlHC,DietzscholdB,等人(2003).Managementofrabiesinhumans.ClinInfectDis36:60-63.·世界卫生组织(WorldHealthOrganization)(2014).RabiesFactSheetN°99.检索自:http://www.who.int/mediacentre/factsheets/fs099/en/·Putra,A.A.G.,Hampson,K.,Girardi,J.,Hiby,E.,Knobel,D.,Mardiana,W.,&Scott-Orr,H(2013).Responsetoarabiesepidemic,Bali,Indonesia,2008–2011.Emerginginfectiousdiseases,19(4),648.·世界卫生组织(WorldHealthOrganization)(2010).Currentstrategiesforhumanrabiespreandpost-exposureprophylaxis.检索自http://www.who.int/rabies/human/WHO_strategy_prepost_exposure/en/·美国专利号4,164,565·Wang,S.etal(2010).AnewPIKAadjuvantrabiesvaccine.JournalofAppliedpreventivemedicine16(1),1-4.·DeshmukhDG,DamleAS,BajajJK,BhakreJB,PatilNS.Fatalrabiesdespitepost-exposureprophylaxis.IndianJMedMicrobiol.2011Apr-Jun;29(2):178-80·Shantavasinkul,P.,Tantawichien,T.,Wacharapluesadee,S.,Jeamanukoolkit,A.,Udomchaisakul,P.,Chattranukulchai,P.,&Hemachudha,T.(2010).Failureofrabiespostexposureprophylaxisinpatientspresentingwithunusualmanifestations.ClinicalInfectiousDiseases,50(1),77-79·WildeH,SirikawinS,SabcharoenA,KingnateD,TantawichienT,HarischandraPA,ChaiyabutrN,deSilvaDG,FernandoL,LiyanageJB,SitprijaV.Failureofpostexposuretreatmentofrabiesinchildren.ClinInfectDis.1996Feb;22(2):228-32·欧洲专利号1593392·Bertoletti,A,(2012)PIKAdoseresponsetodetermineeffectiveconcentrationformonocyte-derivedDCactivation.SingaporeInstituteforClinicalSciences,BiomedicalSciencesInstitutes.·世界卫生组织(WorldHealthOrganization)(2007).RabiesvaccinesWHOpositionpaper(1sted.).检索自http://www.who.int/immunization/sage/SAGEmeetingRabies_PP_Draft_oct12.pdf技术实现要素:考虑到现有技术中的以上缺陷,本公开提供了一种狂犬病疫苗组合物,其包含或由以下组成:a)灭活的纯化的狂犬病病毒(称为IPRV),b)PIKA佐剂,c)人血清白蛋白(称为HSA)。在一些实施方案中,所述狂犬病疫苗组合物包含每单位剂量0.2IU至4.0IU的IPRV,每单位剂量250μg至5000μg的PIKA佐剂、以及以浓度计0.1%至0.9%的HSA(冷冻干燥前或重建(reconstitution)后)。适合于本疫苗组合物的单位剂量制备成一定体积,所述体积选自:0.1ml、0.15ml、0.2ml、0.5ml、1.0ml、1.5ml、2.0ml,以及以下体积的任意两个之间的范围0.1ml、0.15ml、0.2ml、0.5ml、1.0ml、1.5ml、和2.0ml。应理解的是,当应用于人受试者时,太大或太小的施用体积导致在临床实践中的不便。因此,用于成人的单位剂量典型地可以制备成用于注射的0.5ml或者1.0ml(液体形式或者冷冻干燥的粉末形式的重建后),以及0.15ml或者0.2ml用于鼻内形式应用。在一些实施方案中,IPRV的量选自:每单位剂量0.2IU、0.5IU、1.0IU、1.5IU、2.0IU、2.5IU、3.0IU、3.5IU、4.0IU,以及以下IU值的任意两个之间的范围:0.2IU、0.5IU、1.0IU、1.5IU、2.0IU、2.5IU、3.0IU、3.5IU、和4.0IU。在一些实施方案中,IPRV的量是每单位剂量0.2IU至4.0IU。在一些具体的实施方案中,IPRV的量是选自:每单位剂量1.0IU、1.5IU、2.0IU、2.5IU,以及以下每单位剂量的任意两个之间的范围:每单位剂量1.0IU、1.5IU、2.0IU和2.5IU。在一个具体的实施方案中,用于成人的IPRV的量可以是每单位剂量1.0IU至2.0IU,例如每单位剂量1.0IU或2.0IU。在其他实施方案中,当应用于儿童时,每单位剂量中IPRV的量可减少;例如IPRV的量可以是每单位剂量0.5IU至1.0IU,例如,每单位剂量0.5IU或1.0IU。在一些具体的实施方案中,所述IPRV的浓度在0.05IU/ml和40.0IU/ml之间,例如0.05、0.1、0.15、0.2、0.5、1.0、2.0、3.0、4.0、5.0、10、15、20、25、30、35、40IU/ml,以及以下浓度的任意两个之间的范围:0.05、0.1、0.15、0.2、0.5、1.0、2.0、3.0、4.0、5.0、10、15、20、25、30、35、和40IU/ml。在一些实施方案中,适合于本疫苗组合物的PIKA佐剂的量选自:每单位剂量250μg、500μg、1000μg、1500μg、2000μg、3000μg、4000μg、5000μg,以及以下量的任意两个之间的范围:每单位剂量250μg、500μg、1000μg、1500μg、2000μg、3000μg、4000μg、5000μg。在一些具体的实施方案中,用于人受试者施用,PIKA佐剂的量为每单位剂量250μg至4000μg。在一些具体的实施方案中,PIKA佐剂的量选自:每单位剂量500μg、1000μg、1500μg、2000μg、2500μg,以及以下量的任意两个之间的值:每单位剂量500μg、1000μg、1500μg、2000μg、2500μg。在其他实施方案中,当应用于儿童时,每单位剂量中PIKA佐剂的量可以减少,例如,PIKA佐剂的量选自:每单位剂量250μg、500μg、750μg、1,000μg、1250μg,以及以下量的任意两个之间的值:每单位剂量250μg、500μg、750μg、1,000μg和1250μg。任意适合的PIKA佐剂可以在本公开的疫苗组合物中使用。PIKA是一种化学合成的dsRNA的类似物,通过临床前研究已经显示PIKA是TLR3激动剂。PIKA佐剂由PolyI:C、抗生素(例如,卡那霉素)和阳离子(例如,氯化钙)组成。它可溶于pH6.0至8.0的水性溶液中。除非另有说明,适合于本公开的狂犬病疫苗组合物的PIKA佐剂是在WO2006/131023中所公开的PIKA佐剂,其整体以引用并入本文。在相关的实施方案中,PIKA佐剂是分子量不均匀的(heterogeneous),其分子量从约66,000至1,200,000道尔顿、或者从约66,000至660,000道尔顿、或者从约138,000至660,000道尔顿、或者从约150,000至660,000道尔顿、或者从约138,000至1,200,000道尔顿、或者从约150,000至1,200,000道尔顿、或者从约300,000至1,200,000道尔顿、或者从约300,000至660,000道尔顿、或者从约337,000至660,000道尔顿、或者从约337,000至1,200,000道尔顿、或者从约500,000至1,200,000道尔顿、或者从约500,000至2,000,000道尔顿。在相关的实施方案中,在狂犬病疫苗组合物中的PIKA佐剂分子具有平均分子量等于或大于100,000道尔顿、或者等于或大于120,000道尔顿、或者等于或大于138,000道尔顿、或者等于或大于150,000道尔顿、或者等于或大于250,000道尔顿、或者等于或大于300,000道尔顿、或者等于或大于337,000道尔顿、或者等于或大于500,000道尔顿、或者等于或大于750,000道尔顿、或者等于或大于1,000,000道尔顿、或者等于或大于1,200,000道尔顿、或者等于或大于1,500,000道尔顿、或者等于或大于2,000,000道尔顿。在一些实施方案中,IPRV与PIKA佐剂的比例选自:1IU/100μg、1IU/125μg、1IU/200μg、1IU/250μg、1IU/300μg、1IU/350μg、1IU/400μg、1IU/450μg、1IU/500μg、1IU/550μg、1IU/600μg、1IU/700μg、1IU/800μg、1IU/1000μg、1IU/1500μg、1IU/2000μg以及任意以上两个比例之间的比例。在一个具体的实施方案中,IPRV与PIKA佐剂的比例是1IU/500μg。在一个具体的实施方案中,IPRV的量是每单位剂量2.0IU,以及PIKA佐剂的量是每单位剂量1000μg。在另一个具体的实施方案中,IPRV的量是每单位剂量4.0IU,以及PIKA佐剂的量是每单位剂量2000μg。在另一个具体的实施方案中,IPRV的量是每单位剂量3.0IU,以及PIKA佐剂的量是每单位剂量1000μg。仍然在另一个具体的实施方案中,IPRV的量是每单位剂量1.0IU,以及PIKA佐剂的量是每单位剂量1000μg。仍然在另一个具体的实施方案中,IPRV的量是每单位剂量1.0IU,以及PIKA佐剂的量是每单位剂量2000μg。在一些实施方案中,本公开的疫苗组合物进一步包含药学上可接受的缓冲液。在一些实施方案中,药学上可接受的缓冲液选自:PBS、醋酸盐、三-羟甲基氨基甲烷(tris-hydroxymethylaminomethane)、碳酸氢盐、碳酸盐。在一些实施方案中,缓冲液的pH选自:7.00、7.05、7.1、7.15、7.2、7.25、7.30、7.35、7.40、7.45、7.50、7.55、7.60、7.65、7.70、7.75、7.80、7.85、7.90、7.95、8.00以及以下pH值的任意两个之间的范围:7.00、7.05、7.1、7.15、7.2、7.25、7.30、7.35、7.40、7.45、7.50、7.55、7.60、7.65、7.70、7.75、7.80、7.85、7.90、7.95和8.00。在一些具体的实施方案中,缓冲液是PBS,PBS缓冲液的pH选自:7.3、7.4、7.5,以及上述任意两个值之间的范围。在一些实施方案中,适合于本疫苗组合物的HSA的量选自:以浓度计0.15%、0.20%、0.25%、0.30%、0.35%、0.40%、0.45%、0.50%、0.60%(冷冻干燥前或者重建后),或者任意以上两值之间的值。在狂犬病疫苗中添加人白蛋白作为稳定剂用于加工、冷冻干燥过程和存储。本领域技术人员将理解已知白蛋白对一些动物是过敏原,但是单独的人白蛋白是一种经批准用于人使用的药物,并且它能够安全地在人应用中使用。在一些实施方案中,根据本公开的狂犬病疫苗组合物进一步包括麦芽糖。在一些实施方案中,麦芽糖的量以浓度计在1.0%和6.0%之间(冷冻干燥前或者重建后)。在一些实施方案中,麦芽糖的量选自:以浓度计1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、6.0%,以及任意以上两个值之间的范围。在一些具体的实施方案中,麦芽糖的量是以浓度计5.0%。在一些实施方案中,根据本公开的狂犬病疫苗组合物不包含明胶。除非另有说明,任意可获得的狂犬病抗原可以被用于制备根据本公开的狂犬病疫苗组合物。WHO批准了数个用于疫苗生产的狂犬病病毒株,包括但不限于:毕特曼-摩尔株(Pitman-Moore,PM)、巴斯德(Pasteur)病毒株(PV)、攻毒标准病毒株(CVS)、来自Flury鸡胚胎适应(chickembryo-adapted)株的少代鸡胚传代(LEP)或者多代鸡胚传代(HEP)株、Street-Alabama-Dufferin(SAD)病毒的EvelynRokitnikiAbelseth(ERA)株和不同的SAD变体。这些经批准的病毒株适应于脑组织培养、鸡胚或鸭胚、原代细胞系(例如仓鼠肾细胞系)、人二倍体细胞、或者连续(continuous)细胞系(例如Vero细胞系)中。以上病毒株在灭活和纯化后能够用于制造疫苗。在一些实施方案中,IPRV选自:CTN株、aG株、毕特曼-摩尔(PM)株以及巴斯德病毒(PV)株。在一些具体的实施方案中,IPRV选自:CTN-1株、毕特曼-摩尔L503株和PV-2061株。在一些具体的实施方案中,IPRV在Vero细胞或者原代仓鼠肾(PHK)细胞中制备。IPRV通过繁殖混合至Vero细胞或PHK细胞中的病毒株而产生。在收集培养介质的上清液后,作为抗原收集、浓缩、灭活、纯化并存储病毒。除非另有说明,根据本公开的狂犬病疫苗组合物能够以液体形式制备,包括但不限于溶液或者悬液。在一些其他的具体实施方案中,狂犬病疫苗组合物作为固体形式制备,例如经冷冻干燥或者冻干的形式。在一些具体的实施方案中,根据本公开的狂犬病疫苗组合物包含或由以下组成:2.0IU/mlIPRV、1.0mg/mlPIKA佐剂和0.3%HSA。在一些其他的具体实施方案中,根据本公开的狂犬病疫苗组合物包含或由以下组成:2.0IU/mlIPRV、2.0mg/mlPIKA佐剂、0.3%HSA。在一些其他的具体实施方案中,根据本公开的狂犬病疫苗组合物包含或由以下组成:1.0IU/mlIPRV、2.0mg/mlPIKA佐剂和0.3%HSA;或者1.5IU/mlIPRV、2.0mg/mlPIKA佐剂和0.3%HSA;或者2.0IU/mlIPRV、2.0mg/mlPIKA佐剂和0.5%HSA;或者4.0IU/mlIPRV、1.0mg/mlPIKA佐剂和0.5%HSA。本公开还提供了一种药物试剂盒,其包含或由以下组成:a)本公开的狂犬病疫苗组合物、b)容器,例如小瓶或者安瓿、c)使用说明书、以及任选的d)用于注射的水。在一些具体的实施方案中,为了运输和存储的方便,药物试剂盒制备成冻干形式。因此,药物试剂盒包含或由以下组成:a)冻干的狂犬病疫苗组合物、b)装有冻干狂犬病疫苗组合物的小瓶、以及c)使用说明书。必要时,用于注射的水能够并入药物试剂盒用以在使用前重建液体狂犬病疫苗组合物。在一些具体的实施方案中,使用说明书建议以下施用方案:用于接触后保护的2-2-1方案和/或用于预防的2-1方案,其中所述2-2-1方案指的是在第0天施用2单位剂量,在第3天施用2单位剂量以及在第7天施用1单位剂量;其中2-1方案指的是在第0天施用2单位剂量,以及在第7天施用1单位剂量。在另一个具体的实施方案中,使用说明书建议以下施用方案:用于接触后保护的2-2-2方案,其中所述2-2-2方案指的是在第0、3、和7天分别施用2单位剂量。在另一个具体的实施方案中,使用说明书建议以下施用方案:用于接触后保护的1-1-1方案,其中所述1-1-1方案指的是在第0、3、和7天分别施用1单位剂量。本公开还提供了一种用于诱导对狂犬病病毒免疫应答的方法,其通过对宿主施用根据本公开的含有PIKA佐剂的狂犬病疫苗组合物进行。所述宿主可以是人类或者非人动物。所述施用可以是通过注射或通过吸入进行。本文还公开了一种狂犬病疫苗组合物,其用于医学治疗的方法中。具体地,本公开提供了一种用于治疗或预防狂犬病的方法中的狂犬病疫苗组合物。狂犬病疫苗组合物可以用于诱导对狂犬病病毒免疫应答的方法中。狂犬病疫苗组合物在本文公开的医学治疗和预防的方法中、以及诱导免疫应答的方法中是有用的。本公开还提供了狂犬病疫苗组合物在制备用于治疗或预防狂犬病的药物中的用途。在一个方面,本公开提供了根据本公开的狂犬病疫苗组合物在制备用于治疗或预防由狂犬病病毒感染引起的狂犬病的药物中的用途。在另一个方面,本公开还提供了一种狂犬病疫苗组合物,其用于治疗或预防由狂犬病病毒感染引起的狂犬病。所述药物在本文所公开的医学治疗和预防的方法中、以及诱导免疫应答的方法中是有用的。在现有技术中,有两种通常使用的肌肉内疫苗计划:一个是Essen计划,其包括在接触后的第0、3、7、14、和28天给予5次注射;另一个是Zagreb计划,其包括4次注射,其中第0天在不同位置施用两次注射,以及在第7天和第21天给予额外的两次注射。然而现有的施用方案通常是有限的,原因是宽泛的免疫计划需要五次临床随访,以及在免疫的早期阶段低滴度的抗体产生。相反地,本公开提供了一种用于以加速计划治疗狂犬病病毒感染的方法。在一些具体的实施方案中,该方法包括对宿主施用本公开的狂犬病疫苗组合物的步骤,其中所述宿主已经接触狂犬病病毒。在一些具体的实施方案中,所述宿主是人。在一些其他的具体实施方案中,所述宿主是非人动物,例如啮齿动物、狗和猴子。本公开提供了一种加速施用方案,其中在狂犬病病毒的接触后7天内,对宿主施用疫苗组合物5次,第0天是宿主接触狂犬病毒的当天。在一些具体的实施方案中,基于以下方案将疫苗组合物施用于宿主:分别为,1)在接触后的第0天第一次施用,2)在接触后的第0天第二次施用,3)在接触后的第2或第3天第三次施用,4)在接触后的第2或第3天第四次施用,5)在接触后的第6或第7天第五次施用。作为替代,在一些其他的具体实施方案中,基于以下方案将疫苗组合物施用于宿主:分别为,在接触后的第0天第一次和第二次施用;在接触后的第2或第3天第三次和第四次施用;以及在接触后的第7天第五次和/或第六次施用。本文公开的狂犬病疫苗组合物可以根据加速施用方案施用。在另一方面,本公开还提供了一种用于预防由狂犬病病毒感染引起的狂犬病的方法,以及本发明提供了用于该方法中的狂犬病疫苗组合物。在一些具体的实施方案中,所述方法包括对宿主施用本公开的狂犬病疫苗组合物的步骤,其中所述宿主未接触狂犬病毒。在一些具体的实施方案中,所述宿主是人。在一些其他的具体实施方案中,宿主是非人动物,例如啮齿动物、狗和猴子。在一些具体的实施方案中,本公开的狂犬病疫苗组合物在7天内被施用于宿主3次。在一些具体的实施方案中,本公开的狂犬病疫苗组合物是基于以下方案施用于宿主:分别为,1)在第0天第一次施用;2)在第0天第二次施用;以及3)在第7天第三次施用。预防或预防包括受试者的治疗,特别是无疾病或者无疾病症状的人。特别优选的,预防狂犬病的方法或者预防法是接触前预防(PEP)方法,其中疫苗是在受试者接触了活的狂犬病病毒或者有接触活的狂犬病病毒风险之前施用。受试者可被确定有倾向或发展疾病的风险。在这种情况或狂犬病中,受试者可被确定有倾向或发展狂犬病的风险。例如,由于他们已访问或者打算访问一国家或地区,已知该国家或地区存在狂犬病毒,或者由于他们的工作接触病毒或动物。在本公开的内容中,施用通过肠胃外注射、肌肉内注射、腹腔内注射、静脉注射、皮下注射、局部递送、透皮递送以及真皮内递送实施。在一些具体的实施方案中,用于动物的施用可以通过腹腔内注射实施。在一些其他的具体实施方案中,用于人的施用通过肌肉内注射或静脉注射实施。在另一个具体的实施方案中,施用通过吸入、直肠递送、鼻递送、口服递送(包括吸入)实施。附图说明图1:PIKA狂犬病疫苗毒性数据,以及剂量转换计算。图2:IPRV抗原的产生过程。图3:通过不同的免疫组合物抗体诱导。图4:PIKA狂犬病疫苗在经免疫的猴子中诱导血清IgG滴度。图5:PIKA狂犬病疫苗在经免疫的猴子中诱导中和抗体(Y-轴单位IU)。具体实施方式通过参考本文所包括的以下特定实施方案和实施例的详细描述,可以更容易理解本公开。为了对本公开所披露的现有技术更全面的描述,在本公开的全文中,引用出版物之处,这些出版物的公开据此作为引用以其整体并入本公开中。在本公开被进一步描述前,应理解本公开不限于所描述的具体实施方案,就其本身而言可以变化。还应理解,本文所使用的术语的目的仅是描述具体实施方案,并不是旨在限制,因为本公开的范围将仅通过所附权利要求限制。除非另有定义,本文中所使用的技术和科学术语与本领域技术人员通常所理解的具有相同含义。尽管任意相似或者等价于本文所描述的那些方法和材料也可以在本公开的实践或试验中使用,现描述优选的方法和材料。应注意本文和所附权利要求中所使用的单数形式“一个(a)”、“一种(an)”和“该(the)”包括复数指代,除非文中另有明确规定。术语的定义如本文所使用的术语“佐剂”指的是使宿主对一种抗原性化合物的免疫应答提高或多样化(diversifies)的任何物质或者物质的混合物。“PIKA”指的是一种组合物,其包含polyI:C、抗生素(例如,卡那霉素)、以及阳离子(例如,钙离子)。“PIKA”表现为具有以下佐剂的特征:相对于例如PICKCa具有减少的不良副作用(例如,减少的毒性),以及相对于例如Av-PICKCa更高的效价(例如,刺激免疫应答增强)。“PIKA狂犬病疫苗”指的是一种含有IPRV抗原和PIKA佐剂的狂犬病疫苗组合物。可替换地使用术语“PIKA狂犬病疫苗”、“PIKA狂犬病疫苗组合物”、“含有PIKA的疫苗组合物”、“含有PIKA佐剂的狂犬病疫苗组合物”、“PIKA佐剂狂犬病疫苗”以及“PIKA佐剂疫苗组合物”。术语“动物”包括人和所有驯养的和野生的动物,包括但不限于:牛、马、奶牛、猪、绵羊、山羊、狗、猫、啮齿动物、猴子等。“抗原”指的是一种当施用时诱导免疫应答(例如抗体形成,包括特异地结合抗原的抗体)的物质。抗原的两个典型的特征是:它们的免疫原性,即在体内它们诱导免疫应答的能力,以及它们的抗原性,即它们有选择地被起源于抗原的抗体识别的能力。术语“细胞介导的免疫”和“细胞介导的免疫应答”指的是由淋巴细胞提供的免疫防御,例如当它们靠近它们的受害(victim)细胞时,由T细胞淋巴细胞提供的防御。细胞介导的免疫应答通常包括淋巴细胞增殖。当测量“淋巴细胞增殖”时,测量淋巴细胞对特异性抗原应答的增殖能力。淋巴细胞增殖指的是B细胞、T辅助细胞或者细胞毒性T淋巴细胞(CTL)细胞增殖。“增强的免疫应答”或相似表述指的是相对于先前的免疫应答状态(例如本发明的免疫原性组合物施用之前),免疫应答提高、改进或增强以有益于宿主。术语“体液免疫”和“体液免疫应答”指的是对抗原性刺激应答产生抗体分子的免疫形式。术语“免疫应答”指的是通过脊椎动物受试者的免疫系统对抗原性化合物的任何反应。示例的免疫应答包括但不限于细胞的和局部和全身的体液免疫,例如CTL应答(包括CD8+CTL的抗原特异诱导)、辅助T细胞应答(包括T细胞增殖应答和细胞因子释放)、以及B细胞应答(包括抗体应答)本文所使用的术语“诱发(eliciting)免疫应答”通常包括免疫应答的诱导和/或加强。术语“诱导免疫应答”指的是免疫应答被刺激、发起或诱导。术语“加强免疫应答”指的是已存在的免疫应答被增加、增进、补充、放大、增强、提高、或者延长。本文所使用的术语“治疗(treatment)”、“治疗(treating)”、“治疗(treat)”等通常指的是获得期望的药理和/或生理作用。该作用可以是完全地或者部分地预防一种疾病或其症状的预防,和/或可以是部分或完全稳定或治愈疾病和/或由疾病引起的负作用的治疗。如本文所使用的“治疗”涵盖了受试者(具体是人)中疾病的任何治疗,并且包括(i)在受试者中预防疾病发生,受试者可以是对该疾病有倾向的但还未诊断为患有疾病;(ii)抑制疾病,即,阻止它的发展;或者(iii)缓解疾病,即,引起疾病的复原。本文中所使用的术语“预防”或“预防”等通常指的是给予治疗以预防或减缓疾病的发展。术语“混合”包括组合组合物成份的任何方法;该方法包括但不限于:混合、调剂、溶解、乳化、凝固、悬浮、或者物理地组合组合物的成份。如本文所使用的术语“单位剂量”指的是适合作为单位的剂量用于人或动物受试者的物理离散单位(physicallydiscreteunits),每单位含有经计算足以产生期望的作用的本组合物的预定量。在任何情况中,术语“单位剂量”不应理解为在容器(例如小瓶)中包含的疫苗组合物的体积。狂犬病疫苗组合物本公开提供了一种狂犬病疫苗组合物,其包含或由以下组成:a)灭活的纯化的狂犬病病毒(称为IPRV),b)PIKA佐剂,c)人血清白蛋白(称为HSA)。在一些实施方案中,狂犬病疫苗组合物包含每单位剂量0.2IU至4.0IU的IPRV,每单位剂量250μg至5000μg的PIKA佐剂,以及以浓度计0.1%至0.9%的HSA(在制剂中,浓度定义为在制剂中重量体积比(w/v),即,0.1%HSA指的是在1ml总体积中1mg的HSA含量)。在冷冻干燥过程中,通过从固相至气相的升华除去水。以重量测量的HSA的相同量保留在冷冻干燥的粉末中,并且在重建后恢复w/v的浓度。适合于本疫苗组合物的单位剂量是制备成一定体积,该体积选自:0.1ml、0.15ml、0.2ml、0.5ml、1.0ml、1.5ml、2.0ml,以及以下体积的任意两个之间的范围0.1ml、0.15ml、0.2ml、0.5ml、1.0ml、1.5ml、和2.0ml。应理解的是,当应用于人受试者时,太大或太小的施用体积导致在临床实践中的不便。因此,用于成人的单位剂量典型地可以制备成0.5ml或者1.0ml用于注射(液体形式或者经冷冻干燥的粉末形式的重建),以及0.15ml或者0.2ml用于鼻内形式应用。在特定实施方案中,IPRV的量选自:每单位剂量0.2IU、0.5IU、1.0IU、1.5IU、2.0IU、2.5IU、3.0IU、3.5IU、4.0IU,以及以下IU值的任意两个之间的范围:0.2IU、0.5IU、1.0IU、1.5IU、2.0IU、2.5IU、3.0IU、3.5IU、和4.0IU。在一些实施方案中,IPRV的量是每单位剂量0.2IU至4.0IU。在一些具体的实施方案中,IPRV的量是选自:每单位剂量1.0IU、1.5IU、2.0IU、2.5IU,以及以下每单位剂量的任意两个之间的范围:每单位剂量1.0IU、1.5IU、2.0IU和2.5IU。在一个具体实施方案中,用于成人的IPRV的量可以是每单位剂量1.0至2.0IU,例如每单位剂量1.0IU或2.0IU。在其他实施方案中,当应用于儿童时,每单位剂量IPRV的量可以减少;例如IPRV的量可以是每单位剂量0.5IU至1.0IU,例如,每单位剂量0.5IU或1.0IU。在一些具体的实施方案中,所述IPRV的浓度是在0.05IU/ml和40.0IU/ml之间,例如0.05、0.1、0.15、0.2、0.5、1.0、2.0、3.0、4.0、5.0、10、15、20、25、30、35、40IU/ml,以及以下浓度的任意两个之间的范围:0.05、0.1、0.15、0.2、0.5、1.0、2.0、3.0、4.0、5.0、10、15,20、25、30、35、和40IU/ml。在特定实施方案中,适合于本疫苗组合物的PIKA佐剂的量选自:每单位剂量250μg、500μg、1000μg、1500μg、2000μg、3000μg、4000μg、5000μg,以及以下量的任意两个之间的范围:每单位剂量250μg、500μg、1000μg、1500μg、2000μg、3000μg、4000μg、5000μg。在一些具体的实施方案中,用于成人受试者施用,PIKA佐剂的量为每单位剂量250μg和4000μg之间。在一些具体的实施方案中,PIKA佐剂的量选自:每单位剂量500μg、1000μg、1500μg、2000μg、2500μg,以及以下量的任意两个之间的范围:每单位剂量500μg、1000μg、1500μg、2000μg、2500μg。在其他实施方案中,当应用于儿童时,每单位剂量PIKA佐剂的量可以减少,例如,PIKA佐剂的量选自:每单位剂量250μg、500μg、750μg、1,000μg、1250μg,以及以下量的任意两个之间的范围:每单位剂量250μg、500μg、750μg、1,000μg和1250μg。在哺乳动物中使用的很多可获得的佐剂中,仅有少数已经被广泛地用于人的狂犬病疫苗中(包括氢氧化铝和磷酸铝)。其他佐剂已经被否定不能用于人的使用中,因为它们引起严重的局部或全身反应。例如,含有矿物油的弗氏(Freund's)完全佐剂是不可代谢的,并且在实验室动物中引起癌症。最近,已研制出不具有铝盐的狂犬病疫苗。它可以产生与铝佐剂疫苗相当的狂犬病中和抗体滴度。如WO2006/131023(通过引用以其整体并入本文)中所公开的PIKA佐剂,其包含polyI:C、抗生素(例如,卡那霉素)、以及阳离子(例如,钙离子),在动物研究中已经被认可增强狂犬病抗原的免疫原性。在相关实施方案中,PIKA佐剂是分子量不均匀的,其分子量从约66,000至1,200,000道尔顿、或者从约66,000至660,000道尔顿、或者从约138,000至660,000道尔顿、或者从约138,000至1,200,000道尔顿、或者从约150,000至1,200,000道尔顿、或者从约150,000至660,000道尔顿、或者从约300,000至1,200,000道尔顿、或者从约300,000至660,000道尔顿、或者从约337,000至660,000道尔顿、或者从约337,000至1,200,000道尔顿、或者从约500,000至1,200,000道尔顿、或者从约500,000至2,000,000道尔顿。在相关的实施方案中,在疫苗组合物中PIKA佐剂分子具有平均分子量等于或大于100,000道尔顿、或者等于或大于120,000道尔顿、或者等于或大于138,000道尔顿、或者等于或大于150,000道尔顿、或者等于或大于250,000道尔顿、或者等于或大于300,000道尔顿、或者等于或大于337,000道尔顿、或者等于或大于500,000道尔顿、或者等于或大于750,000道尔顿、或者等于或大于1,000,000道尔顿、或者等于或大于1,200,000道尔顿、或者等于或大于1,500,000道尔顿、或者等于或大于2,000,000道尔顿。任何合适的PIKA佐剂可以在本公开的疫苗组合物中使用。在一些实施方案中,PIKA佐剂的分子量是在从66,000道尔顿至1,200,000道尔顿之间的范围。在一个优选的实施方案中,PIKA佐剂的分子量是66,000至660,000道尔顿。在一些实施方案中,IPRV与PIKA佐剂的比例选自:1IU/100μg、1IU/125μg、1IU/200μg、1IU/250μg、1IU/300μg、1IU/350μg、1IU/400μg、1IU/450μg、1IU/500μg、1IU/550μg、1IU/600μg、1IU/700μg、1IU/800μg、1IU/1000μg、1IU/1500μg、1IU/2000μg以及以下比例任意两个之间的比例:1IU/100μg、1IU/125μg、1IU/200μg、1IU/250μg、1IU/300μg、1IU/350μg、1IU/400μg、1IU/450μg、1IU/500μg、1IU/550μg、1IU/600μg、1IU/700μg、1IU/800μg、1IU/1000μg、1IU/1500μg、和1IU/2000μg。在一个具体的实施方案中,IPRV与PIKA佐剂的比例是1IU/500μg。在一个具体的实施方案中,IPRV的量是每单位剂量2.0IU,以及PIKA佐剂的量是每单位剂量1000μg。在另一个具体的实施方案中,IPRV的量是每单位剂量4.0IU,以及PIKA佐剂的量是每单位剂量2000μg。在另一个具体的实施方案中,IPRV的量是每单位剂量3.0IU,以及PIKA佐剂的量是每单位剂量1000μg。仍然在另一个具体的实施方案中,IPRV的量是每单位剂量1.0IU,以及PIKA佐剂的量是每单位剂量1000μg。仍然在另一个具体的实施方案中,IPRV的量是每单位剂量1.0IU,以及PIKA佐剂的量是每单位剂量2000μg。现有技术已知,基于NIH效价试验或NIH试验的变化,根据WHO标准含有或不含有佐剂的灭活的纯化的狂犬病疫苗的效价高于2.5IU,适合用于狂犬病病毒感染的预防或接触后治疗。在实际生产中,在生产时疫苗效价通常高于4.5IU,并且效价随存储时间而降低。在疫苗的保质期内,效价不应减少至低于2.5IU。在本公开中使用的低抗原剂量能通过PIKA佐剂的添加而加强,用以在小鼠和猴子中通过疫苗接种产生高效保护免疫(见实施例1-3和6)。动物研究还显示含有PIKA佐剂的狂犬病组合物能够诱导更早期的和更高滴度的特异性抗体产生(见实施例1)。因此,产生的狂犬病疫苗组合物以更低的抗原含量的量实现了更高的效价。实际上,具有更低抗原剂量的狂犬病疫苗组合物减少了生产成本和可能的副作用,同时疫苗在诱导对狂犬病病毒感染的免疫应答中是起作用的。此外,我们发现了当无明胶存在、并添加了以上描述量的HSA和麦芽糖时,生产的PIKA佐剂狂犬病疫苗显示强热稳定性。已知HSA和麦芽糖作为稳定剂用于狂犬病疫苗;然而,从不知道其特定量的组合,根据本公开的疫苗组合物呈现热稳定性。狂犬病疫苗组合物的制备方法除非另有说明,任何可获得的狂犬病抗原可以被用于制备根据本公开的狂犬病疫苗组合物。用于疫苗生产的最常使用的狂犬病病毒株包括但不限于:CTN-1株、aG株、毕特曼摩尔(PM)株、攻毒标准病毒(CVS)的Kissling株、或者Flury少代鸡胚传代(LEP)或者多代鸡胚传代(HEP)、Street-Alabama-Dufferin(SAD)病毒的固定的EvelynRokitnikiAbelseth(ERA)株、和不同的SAD变体。在一些具体的实施方案中,灭活的纯化的狂犬病疫苗抗原从在仓鼠肾细胞系(PHK)中培养的aG狂犬病病毒株获得。制备病毒并灌注至PHK细胞。在病毒培养介质中培养细胞,而后收集病毒以产生病毒收集溶液。在本公开的另一个具体的实施方案中,灭活的纯化的狂犬病疫苗抗原从在Vero细胞系中培养的CTN-1狂犬病病毒株获得。接种CTN-1狂犬病病毒株并灌注至Vero细胞系,并且收集以产生病毒溶液。随后所收集的病毒溶液通过浓缩和灭活过程以产生灭活的抗原。灭活的纯化的病毒溶液在添加HSA后通过柱层析法获得(见图1的生产过程的说明)。在一些具体的实施方案中,适合用于本疫苗组合物的HSA的量选自:以浓度计0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%、0.5%,以及任意以上两值之间的值。在一些实施方案中,PIKA佐剂由单链多核苷酸聚合物PolyI和PolyC制造,随后通过添加单硫酸卡那霉素(mono-kanamycinsulfate)(卡那霉素)以及氯化钙(CaCl2)以产生最终的佐剂。在一些实施方案中,PIKA佐剂的pH值选自:6.0、6.05、6.1、6.15、6.2、6.25、6.3、6.35、6.4、6.45、6.5、6.55、6.6、6.65、6.7、6.75、6.8、6.85、6.9、6.95、7.07.05、7.1、7.15、7.2、7.25、7.3、7.35、7.4、7.45、7.5、7.55、7.6、7.65、7.7、7.75、7.8、7.85、7.9、7.95、8.0以及以上pH值的任意两个之间的值:6.0、6.05、6.1、6.15、6.2、6.25、6.3、6.35、6.4、6.45、6.5、6.55、6.6、6.65、6.7、6.75、6.8、6.85、6.9、6.95、7.07.05、7.1、7.15、7.2、7.25、7.3、7.35、7.4、7.45、7.5、7.55、7.6、7.65、7.7、7.75、7.8、7.85、7.9、7.95、和8.0。在一些具体的实施方案中,PIKA佐剂的pH值是pH6.0至pH8.0。在一些实施方案中,狂犬病疫苗组合物通过在磷酸盐缓冲液中将IPRV和PIKA佐剂组合而产生。IPRV和PIKA佐剂在选自以下的pH中混合:6.0、6.05、6.1、6.15、6.2、6.25、6.3、6.35、6.4、6.45、6.5、6.55、6.6、6.65、6.7、6.75、6.8、6.85、6.9、6.95、7.07.05、7.1、7.15、7.2、7.25、7.3、7.35、7.4、7.45、7.5、7.55、7.6、7.65、7.7、7.75、7.8、7.85、7.9、7.95、8.0以及以下pH值的任意两个之间的值:6.0、6.05、6.1、6.15、6.2、6.25、6.3、6.35、6.4、6.45、6.5、6.55、6.6、6.65、6.7、6.75、6.8、6.85、6.9、6.95、7.07.05、7.1、7.15、7.2、7.25、7.3、7.35、7.4、7.45、7.5、7.55、7.6、7.65、7.7、7.75、7.8、7.85、7.9、7.95、和8.0。在一些实施方案中,根据本公开的狂犬病疫苗组合物不包括明胶。在一些实施方案中,最终的产品包括:2.0IU/mlIPRV、1.0mg/mlPIKA佐剂、5.0%麦芽糖、和0.3%HSA。在一些其他的具体实施方案中,根据本发明的狂犬病疫苗组合物包含或由以下组成:2.0IU/mlIPRV、2.0mg/mlPIKA佐剂、0.3%HSA。在一些其他的具体实施方案中,根据本发明的狂犬病疫苗组合物包含或由以下组成:1.0IU/mlIPRV、2.0mg/mlPIKA佐剂和0.3%HSA;或者1.5IU/mlIPRV、2.0mg/mlPIKA佐剂和0.3%HSA;或者2.0IU/mlIPRV、2.0mg/mlPIKA佐剂和0.5%HSA;或者4.0IU/mlIPRV、1.0mg/mlPIKA佐剂和0.5%HSA。最终的产品以1ml/小瓶的填充体积填充至无菌小瓶中以形成一个单位剂量,接着加盖。本领域技术人员已知1ml/小瓶的填充体积包括操作误差。因此,1ml/小瓶的填充体积可在0.90至1.20ml/小瓶的范围,例如从1.10至1.12ml/小瓶。应当注意的是填充体积不限于1ml/小瓶,并且可以是任何选自以下的合适的值:0.1ml、0.2ml、0.3ml、0.4ml、0.5ml、0.6ml、0.7ml、0.8ml、0.9ml、1.0ml、1.2ml、1.5ml、2.0ml/小瓶,以及任意以上两值之间的任意体积。在一个优选的实施方案中,当应用于成人受试者时,太大或太小的施用体积导致在临床实践中的不便,因此,用于人的施用体积是1ml。因此,在本公开中的组合物以1ml/小瓶的形式制备。当应用于儿童或其他类型的受试者时,填充体积和单位剂量可相应地调整。在一些实施方案中,液体形式的狂犬病疫苗还可以制备成它相应的固体形式。在该情况中,液体形式组合物进一步经冻干。任选的,该狂犬病疫苗的固体形式与用于注射的水包装在一起。在使用前重建疫苗,用于注射的最终的体积选自:0.1ml、0.15ml、0.2ml、0.25ml、0.3ml、0.4ml、0.5ml、0.6ml、0.7ml、0.8ml、0.9ml、1.0ml、1.2ml、1.5ml、2.0ml,以及任意两值之间的任意体积。在一些实施方案中,制备适合浓度的液体形式的狂犬病疫苗用于鼻内应用。在该情况中,施用的狂犬病疫苗组合物的体积范围从0.05ml至0.1ml、0.1ml至0.15ml、0.15ml至0.2ml、0.2ml至0.25ml、0.25ml至0.3ml、0.3ml至0.35ml、0.35ml至0.4ml、0.4ml至0.45ml、0.45ml至0.5ml以及以下体积的任意两个之间的任意范围:0.05ml至0.1ml、0.1ml至0.15ml、0.15ml至0.2ml、0.2ml至0.25ml、0.25ml至0.3ml、0.3ml至0.35ml、0.35ml至0.4ml、0.4ml至0.45ml、0.45ml至0.5ml。所述IPRV的浓度是从0.05IU/ml至40.0IU/ml,例如0.05、0.1、0.15、0.2、0.5、1.0、2.0、3.0、4.0、5.0、10、15、20、25、30、35、40IU/ml,以及任意以上两个值之间的值。狂犬病疫苗组合物的安全性原则上,评估药物安全性的方式是一种风险鉴定和风险减轻的方法。对于第一次在人中应用,安全性可以在所选择的用于试验的动物物种上评估。从动物毒性数据至对人的最大推荐安全剂量的转换可以包括以下步骤:1)确定无可见有害作用水平(NOAEL),2)在最相关试验物种中转换NOAEL至人体等效剂量(HED),以及3)应用合适的安全系数(例如10)。根据FDA工业指南-评估在初期临床试验中用于成人健康志愿者治疗的最大安全起始剂量,人等价剂量可以从临床前动物研究计算,临床前动物研究选自下表中描述的模型动物:表1:动物剂量至人体等价剂量的转换适合用于评估研究产品安全性的任何以上动物可以被选择作为用于研究的模型动物。典型的,应该选择至少一种类型的实验啮齿动物和至少一种类型的实验灵长类动物用于人应用前的评估。试验动物应被测试单独应用的急性毒性和重复应用的长期毒性。本公开的含有PIKA佐剂的狂犬病疫苗组合物在啮齿动物和灵长类动物中试验显示良好的安全性情况(详细的安全性试验见实施例5和7)狂犬病疫苗组合物的稳定性使用前,疫苗通常被运输或存储。疫苗的正常保质期范围从1至3年。因此,疫苗的热稳定性是必须的以确保在施用时的疫苗效价。由于狂犬病疾病的高度流行,疫苗通常被分布至没有冷藏分销系统的热带国家。在这些地区提供的疫苗制剂必须在高温度时具有热稳定性。本公开的狂犬病疫苗组合物在2至8℃和37℃持续长时间测试,以证实热稳定性(详细参考实施例13)试剂盒在一些实施方案中,受试试剂盒包含在无菌液体(例如,水性)制剂中的狂犬病疫苗组合物,该制剂是无菌的,并且在无菌的容器、无菌的小瓶、无菌的安瓿、或者无菌的注射器中提供。在一些实施方案中,受试试剂盒包含冻干并在无菌容器中的狂犬病疫苗组合物;以及含有用于冻干组合物的重建的无菌液体的容器。在一些实施方案中,试剂盒进一步包含用于冻干组合物的重建的说明。在一些实施方案中的受试试剂盒将进一步包括使用说明书,其包括例如剂量的量和剂量的频率。在一些实施方案中的说明书直接印刷在试剂盒上。在其他实施方案中,说明书是作为包装说明书(packageinsert)提供的印刷制品。说明书还可以以其他介质提供,例如光盘、数字通用光盘等。本公开还提供了一种药物试剂盒,包含或由以下组成:a)本公开的狂犬病疫苗组合物,b)容器,例如小瓶或者安瓿,c)使用说明书,以及任选的d)用于注射的水。在一些具体的实施方案中,为了运输和存储的方便,药物试剂盒制备成冻干形式。因此药物试剂盒包含或由以下组成:a)冻干的狂犬病疫苗组合物,b)装有冻干狂犬病疫苗组合物的小瓶,以及c)使用说明书。必要时,用于注射的水可以包含在药物试剂盒中用于在使用前重建液体狂犬病疫苗组合物。在一些具体的实施方案中,使用说明书建议以下施用方案:2-2-1方案、2-2-2方案、1-1-1方案、和/或2-1方案,其中所述2-2-1方案指的是在第0天施用2单位剂量、在第3天施用2单位剂量以及在第7天施用1单位剂量;其中所述2-2-2方案指的是在第0、3和7天施用2单位剂量;其中1-1-1方案指的是在第0、3和7天施用1单位剂量;其中2-1方案指的是第0天施用2单位剂量,以及在第7天施用1单位剂量。施用方法本公开还提供了一种用于诱导对狂犬病病毒免疫应答的方法,所述方法通过对宿主施用根据本公开所述的含有PIKA佐剂的狂犬病疫苗组合物。宿主可以是人类或非人动物。施用可以通过注射或者通过吸入完成。本文还公开了一种狂犬病疫苗组合物,其用于医学治疗的方法中。具体地,本公开提供了一种狂犬病疫苗组合物,期用于狂犬病的治疗或预防的方法中。狂犬病疫苗组合物可以用于诱导对狂犬病病毒免疫应答的方法中。狂犬病疫苗组合物在本文公开的医学治疗和预防的方法中、以及诱导免疫应答的方法中是有用的。本公开还提供了狂犬病疫苗组合物在制备用于治疗或预防狂犬病的药物中的用途。在一个方面,本公开提供了根据本公开的狂犬病疫苗组合物在制备用于治疗或预防由狂犬病病毒感染引起的狂犬病的药物中的用途。在另一个方面,本公开还提供了一种狂犬病疫苗组合物,其用于治疗或预防由狂犬病病毒感染引起的狂犬病。所述药物在本文所公开的医学治疗和预防的方法中、以及诱导免疫应答的方法中是有用的。在现有技术中,有两种通常使用的肌肉内疫苗计划:一个是Essen计划,其涉及在接触后的第0、3、7、14、和28天给予5次注射;另一个是Zagreb计划,其涉及4次注射,其中第0天在不同位置施用两次注射,以及在第7天和第21天给予额外的两次注射。然而现有的施用方案通常是有限的,由于需要五次临床随访的宽泛的免疫计划,以及在免疫的早期阶段低滴度的抗体产生。考虑到这一点,本公开提供了一种用于以加速计划治疗狂犬病病毒的感染。在一些具体的实施方案中,该方法包括对宿主施用本公开的狂犬病疫苗组合物的步骤,其中所述宿主已经接触狂犬病病毒。在一些具体的实施方案中,所述宿主是人。在一些其他的具体实施方案中,所述宿主是非人动物,例如啮齿动物、狗和猴子。在一些具体的实施方案中,本公开提供了一种加速施用方案,其中在狂犬病病毒的接触后7天内,对宿主施用本公开的狂犬病疫苗组合物5次。在一些具体的实施方案中,基于以下方案将本公开的狂犬病疫苗组合物施用于宿主:分别为,1)在接触后的第0天第一次施用,2)在接触后的第0天第二次施用,3)在接触后的第2天或第3天第三次施用,4)在接触后的第2天或第3天第四次施用,5)在接触后的第6天或第7天第五次施用,任选的,6)在接触后的第6天或第7天第六次施用。作为替代,在一些其他的具体实施方案中,基于以下方案将本公开的狂犬病疫苗组合物施用于宿主:分别为,在接触后的第0天第1次和第2次施用;在接触后的第2天或第3天第三次和第四次施用;以及在接触后的第7天第五次和/或第六次施用。在另一方面,本公开还提供了一种用于预防狂犬病病毒感染的方法,以及用于该方法中的狂犬病疫苗组合物。在一些具体的实施方案中,所述方法包括对宿主施用本公开的狂犬病疫苗组合物的步骤,其中所述宿主未接触狂犬病病毒。在一些具体的实施方案中,所述宿主是人。在一些其他的具体实施方案中,宿主是非人动物,例如啮齿动物、狗和猴子。在一些具体的实施方案中,本公开的狂犬病疫苗组合物在7天内被施用于宿主3次。在一些具体的实施方案中,本公开的狂犬病疫苗组合物是基于以下方案施用于宿主:分别为,1)在第0天第一次施用;2)在第0天第二次施用;以及3)在第7天第三次施用。预防或预防包括受试者的治疗,特别是无疾病或者无疾病症状的人。特别优选的,预防狂犬病的方法或者预防法是接触前预防(PEP)方法,其中疫苗是在受试者接触了活的狂犬病病毒或者有接触活的狂犬病病毒风险之前施用。受试者可被确定有发展疾病的倾向或发展疾病的风险。在这种情况或狂犬病中,受试者可被确定有狂犬病的倾向或发展狂犬病的风险。例如,由于他们已访问或者打算访问一国家或地区,已知该国家或地区存在狂犬病,或者由于他们的工作接触病毒或动物。在本公开的内容中,施用通过肠胃外注射、肌肉内注射、腹腔内注射、静脉注射、皮下注射、局部递送、透皮递送以及真皮内递送实施。在一些具体的实施方案中,用于动物的施用可以通过腹腔内注射实施。在一些其他的具体实施方案中,用于人的施用通过肌肉内注射或静脉注射实施。在另一个具体的实施方案中,施用通过吸入、直肠递送、鼻递送、口服递送(包括吸入)实施。实施例实施例1:在小鼠中的体液免疫应答和病毒攻击程序:程序1:体液免疫应答在第0、3、7、14和30天,OF1小鼠被施用含有或不含有PIKA(75μg)的IPRV(在BHK21细胞中产生的PV株,0.2IU)。免疫后60天的期间采血液样本5次,通过快速荧光灶抑制试验(RFFIT)测试病毒中和抗体,并且还使用ELISA检测IgG、IgM。程序2:病毒攻击试验使用野生狂犬病病毒(5×106icLD50)皮下感染OF1小鼠,在感染后6小时、3天和7天,施用单独PIKA佐剂(50μg),施用不含佐剂、含50μgAl2O3、或含50μgPIKA的高剂量或低剂量的IPRV(0.1或0.2IU,PV株)。观察小鼠的生存率。结果总结:(1)在接受含有PIKA的狂犬病疫苗组合物的动物中观察到更高的体液免疫应答(即使用RFFIT试验的抗体滴度)。同时,早在免疫后4天时,PIKA佐剂疫苗组合物能诱导更高滴度的IgG和IgM产生。铝佐剂疫苗组合物在早期阶段减少抗体滴度。由含有或不含有佐剂的狂犬病疫苗组合物产生的IgG抗体的滴度在图3中表示。(2)在致死剂量病毒攻击试验中,95%未疫苗接种或者使用铝佐剂疫苗的小鼠死亡,即使当使用次优水平的IPRV(0.1IU)时,PIKA狂犬病疫苗组合物提供了90%的保护。使用含有PIKA佐剂的最优水平的IPRV(0.2IU)免疫的所有小鼠存活,然而当使用最优的IPRV水平和铝佐剂免疫时,仅30%的小鼠存活。作为结论,包括PIKA佐剂的狂犬病疫苗组合物免疫后,与传统铝佐剂疫苗相比,能诱导6-7倍高的中和抗体滴度。高IgG水平保持在60天的观察时间,其提供了免疫接种后长期的体液保护。中和抗体的早期提高还能够对接受接触后疫苗接种的患者提供更有效的保护。依照所有PIKA佐剂狂犬病疫苗免疫的小鼠在致死病毒攻击中存活,可以得出更直接的结论。实施例2:在小鼠中细胞介导的免疫应答2.1.在体外T细胞生长因子IL-2诱导和脾细胞增殖程序:使用PBS对照、含有或不含有PIKA佐剂(10μg)的IPRV(0.1IU)皮下免疫C3H小鼠。一周后,处死小鼠并分离脾细胞以使用Gillis方法评估IL-2的产生。简略地,培养脾细胞并使用对照、IPRV、PIKA佐剂或者ConA刺激脾细胞。24小时后收集上清液,并在IL-2滴定前过滤。添加上清液至CTLL细胞培养,CTLL细胞的生长依赖IL-2的存在。通过测量CTLL细胞增殖滴定IL-2的产生。此外,添加3H-胸腺嘧啶脱氧核苷(3H-thymidine),通过测量刺激后3H-胸腺嘧啶脱氧核苷的掺入以测定脾细胞的增殖。结果总结:含有0.1IUIPRV和10μg的PIKA佐剂狂犬病疫苗组合物能够增强IL-2的产生和脾细胞的增殖。当用于体外刺激时,单独的PIKA佐剂诱导弱IL-2产生以及高脾细胞增殖,其表明除了需要IL-2的T辅助细胞以外PIKA佐剂参与多种细胞机制以活化脾细胞。2.2.巨噬细胞活化程序:使用生理盐水对照、含有或不含有PIKA佐剂(10μg)的0.1IUIPRV免疫3组昆明(Kunming)小鼠(平均重20g)。在第0、3、7和14天小鼠接受使用以上组合物的腹腔内施用。每次免疫后4小时,收集并分离腹膜巨噬细胞用于显微镜视察。计数巨噬细胞吞噬活性并在下表中提供:表2:巨噬细胞吞噬指数注:百分比表明具有吞噬细胞活性的巨噬细胞的数量比无吞噬细胞活性的巨噬细胞数量;括号中的数字表示被每个巨噬细胞吞噬的红细胞的数。表2显示PIKA佐剂可以增强巨噬细胞活性,然而单独的IPRV抑制巨噬细胞活性。2.3.提高干扰素-γ(IFN-γ)产生针对标准,在PHK细胞中产生的狂犬病抗原(0.1或0.2IU)含有或不含有PIKA佐剂(10或者50μg)。在第0天或者分别在第0天和第7天,使用一剂量或两剂量的上述三种组合物腹腔内免疫BALB/c小鼠。在免疫后7天(即接受一剂量的小鼠的第7天,以及接受两剂量的小鼠的第14天)处死小鼠。分离脾细胞使用ELISPOT试验IFN-γ产生。结果:早在首次剂量后7天时,在小鼠中含有在PHK细胞中产生的IPRV和PIKA佐剂的狂犬病疫苗组合物诱导IFN-γ产生。无PIKA佐剂组中没有显著的IFN-γ产生。在接受两剂量的含有在PHK细胞中产生的IPRV和PIKA佐剂(50μg)的狂犬病疫苗组合物的小鼠中,产生高于标准组两倍的IFN-γ。尽管使用次优水平的PIKA佐剂(10μg),在第二次剂量后,小鼠产生显著的IFN-γ的水平。这显示PIKA佐剂狂犬病疫苗组合物能够在免疫后很快提供T细胞介导的免疫应答,并且提高多至免疫后14天。以上两实施例的含有次优水平的IPRV(0.1IU)和(10μg)佐剂的狂犬病疫苗组合等价于人使用的每单位剂量24.39IUIPRV和2,439μgPIKA佐剂的组合物(参考用于转换的图1和表1)。当以通常使用的安全系数10时,这代表用于人的剂量约2.4IUIPRV和240μgPIKA佐剂。对于使用最优水平的IPRVIPRV(0.2IU)和(50μg或75μg)佐剂,代表用于人的剂量是约4IUIPRV和1,200μg或PIKA佐剂。实施例3:佐剂加强IPRV抗原效价使用相同批次的IPRV以制备无佐剂、PIKA佐剂和铝佐剂疫苗组合物。使用不同的狂犬病疫苗组合物制剂免疫小鼠,并用CVS株脑内攻击。使用NIH方法测量ED50。添加的佐剂的量和得到的ED50在表3中提供:表3:狂犬病疫苗组合物效价试验结果:PIKA佐剂疫苗组合物的ED50降低约10倍,然而铝佐剂疫苗组合物仅降低1倍。作为结论,与铝佐剂相比,PIKA佐剂对狂犬病抗原具有显著更好的加强作用。实施例4:疫苗制剂的最优化现有的狂犬病疫苗通常含有大于4.5IU的IPRV抗原。然而,对于本公开的PIKA狂犬病疫苗,建议的抗原水平是<4.5IU。这是基于临床前研究而推荐,包括使用金仓鼠的接触后保护试验(实施例5)。结果显示与商业上可获得的含有>4.5IU抗原的疫苗组合物相比,含有2IU抗原的PIKA狂犬病疫苗组合物具有更好的保护。同样地,在最终的剂型中,我们试验了从0.25至3.0IU的不同抗原水平;这可能减少副作用,并且PIKA佐剂的添加还在降低疫苗的成本的同时保持良好的效力。用于试验目的,PIKA的剂量保持在1mg的恒量。此外,还研究了基于不同的PIKA的量和人白蛋白的浓度对疫苗效力的影响。4.1添加不同滴度的IPRV抗原的疫苗的效力当狂犬病疫苗的其他成份(PIKA,HSA和麦芽糖)保持恒量时,检测使用不同滴度的抗原的疫苗组合物的免疫保护效力(在下表4中):表4:含有不同滴度的抗原的疫苗的免疫保护效力分析:含有添加抗原滴度0.5和3.0IU/剂量之间(国际单位的相对量)的疫苗效价总高于2.5IU/剂量(国际单位的相对效价),其符合WHO推荐以及中华人民共和国药典,2010版本,卷3用于狂犬病疫苗的标准要求。4.2含有添加不同量的PIKA佐剂的疫苗组合物的效力IPRV、HSA和麦芽糖的量保持恒量,检测含有不同量的PIKA佐剂的疫苗的免疫保护效力(在表5中):表5:含有不同滴度的抗原的疫苗的免疫保护效力分析:当添加的PIKA佐剂的量在0.25和2.0μg/剂量之间时,产生的狂犬病疫苗组合物的效力总是高于2.5IU/剂量,这符合WHO推荐的用于狂犬病疫苗标准要求。当作为抗病毒药物使用时,至多4mg的PIKA被批准重复地用于人受试者中,具有良好的治疗作用并且是良好耐受的。此外,1.0mg的PIKA佐剂已经被用于人I期试验以增强具有良好预防效力的狂犬病抗原。因此,从0.25至4mg范围的PIKA的PIKA佐剂的量添加至最终的制剂中应该是安全的并且有效的。4.3HSA浓度对狂犬病疫苗的稳定性的影响检测在不同HSA浓度下冷冻干燥的PIKA狂犬病疫苗的稳定性(在下表6中):表6:HSA浓度对狂犬病疫苗的稳定性的影响分析:当HSA的浓度是在0和1.0%之间,其他浓度(抗原、PIKA和麦芽糖)保持恒量,疫苗的效价和加速稳定性总是高于2.5IU/剂量。这些结果符合用于市场上相似产品的WHO的标准要求。因此,含有PIKA佐剂的狂犬病疫苗组合物的平衡制剂包括:IPRV-2.0IU;PIKA佐剂-1.0mg;人白蛋白-0.3%(在1ml冷冻干燥前或者重建后的最终疫苗组合物中3mg);以及麦芽糖-5%(即在1ml冷冻干燥前或者重建后的最终疫苗组合物中50mg)。实施例5:金仓鼠接触后保护试验程序7:使用0.1ml的50LD50野生狂犬病病毒BD06株感染7组7至8周龄的雌性金仓鼠(体重100至150g,每组15只)。在后腿肌肉内施用疫苗。观察动物的生存率45天。分组信息如下:组1:生理盐水对照,使用1-1-1-1-1免疫计划(即接触后2小时和3、7、14、28天单剂量注射);组2:商业可获得的狂犬病疫苗(产生于鸡胚细胞中的flurryLEP株IPRV,>2.5IU)使用与组1相同的免疫计划;组3:接触后两小时,在两个位置施用人狂犬病免疫球蛋白,即在右后腿施用1.5IU的一半并且在左后腿施用另一半。组4:含产生于Vero细胞系中的CTN-1株IPRV以及PIKA佐剂的狂犬病疫苗组合物,使用1-1-1-1-1免疫计划;组5:含产生于Vero细胞系中的CTN-1株IPRV和PIKA佐剂的狂犬病疫苗组合物,使用2-2-1免疫计划(即接触后2小时、2天双剂量注射,以及接触后7天单剂量注射)。组6:含产生于PHK细胞中的aG株IPRV和PIKA佐剂的狂犬病疫苗组合物,使用1-1-1-1-1免疫计划;组7:含产生于PHK细胞中的aG株IPRV和PIKA佐剂的狂犬病疫苗组合物,使用2-2-1免疫计划(即接触后2小时、2天双剂量注射,以及接触后7天单剂量注射)。组合物:在组4-5中使用的狂犬病疫苗组合物(含有2.0IU/mlIPRV、1000μg/mlPIKA佐剂、5%麦芽糖、和0.3%HSA)以0.1ml的单位剂量注射,等价于以体重计人使用剂量的每单位剂量10.8IUIPRV和5405μgPIKA佐剂的组合物(参考用于转换的图1和表1)。在除以安全系数10后,该研究的结果指示以约1.0IUIPRV和500μgPIKA应用于人。结果总结:在接触后保护试验中,使用标准免疫计划的商业可获得的狂犬病疫苗仅提供了有限的保护,然而使用相同方案的PIKA狂犬病疫苗组合物能提供显著地更好的保护。使用加强方案的PIKA狂犬病疫苗组合物和使用免疫球蛋白的被动免疫保护了80%的受试者(p<0.005)。所有试验组的保护率在以下显示:表7:金仓鼠的接触保护试验综上所述,商业可获得的疫苗仅提供了有限的保护,然而目前描述的狂犬病疫苗组合物提供了显著更强的保护。通过使用加速2-2-1方案(即双剂量用于前两侧注射),含有产生于Vero细胞的IPRVCTN-1株和PIKA佐剂的狂犬病疫苗组合物能提供如人狂犬病免疫球蛋白相似的保护水平。实施例6:小鼠接触后保护试验程序:在0、3、6和9天,使用不同来源的0.06ml商业可获得的狂犬病疫苗、含PIKA佐剂的狂犬病疫苗组合物或者作为阴性对照的PBS免疫接触了高剂量的CQ92狂犬病病毒的四组小鼠(每组20只)。组合物:组1中所使用的含PIKA佐剂的狂犬病疫苗组合物(含1.5IU/ml产生于PHK细胞的PM株IPRV、1000μg/mlPIKA佐剂和0.2%HSA)以0.06ml的单位剂量注射,等价于人使用的组合物的每单位剂量21.95IUIPRV和14,634μgPIKA佐剂(参考用于转换的图1和表1)。当应用通常使用的安全系数10时,指示以约2IUIPRV和1,500μgPIKA佐剂应用于人。在最后一次注射后观察小鼠21天。在下表8中显示生存率:表8:小鼠接触后保护试验结果总结:在致死剂量病毒攻击下,来自比较疫苗组的小鼠给与了与对照组相似水平的保护。接触后保护试验中,当使用较低的抗原剂量时,含PIKA的狂犬病疫苗证实了对小鼠80%的保护。简而言之,本公开的组合物针对在小鼠中的致死剂量病毒感染,以减少的抗原水平极大的增强了狂犬病疫苗保护率。实施例7:在啮齿动物中急性毒性研究程序:五组3-5周龄的昆明(KM)小鼠,20只小鼠(在每组中10只雄性和10只雌性,平均重20g)施用0.2ml的单剂量组合物,设置在下表中:表9:啮齿动物急性毒性在药物施用后监测小鼠毒性反应、死亡和异常临床症状4小时,随后每日观察持续14天。在第一次注射前以及在注射后第1、4、7、11和14天测量体重。在注射后第1、7和14天记录食物摄取。在第14天处死小鼠,随后对以下器官进行大体病理学检测:心、肝、脾、肺、肾、肾上腺、脑、胃、肠、气管、睾丸、附睾、子宫、卵巢、胸腺、淋巴结(包括颈部淋巴结、肠系膜淋巴结和髂淋巴结集合淋巴结)、左和右下肢肌肉。结果:与对照组相比,在食物摄取和体重方面,研究组中动物没有显示显著差异。在药物施用后14天未观察到异常临床症状,同时施用最大剂量药物时所有动物生存,在器官外观检测中没有观察到毒性反应和异常状况。综上所述,含有PIKA佐剂的狂犬病疫苗组合物在KM小鼠中良好耐受,耐受至含有200μgPIKA的0.4IU狂犬病抗原的最大剂量。接受含有0.4IUIPRV和200μgPIKA佐剂的狂犬病疫苗组合物的小鼠,具有150至300倍的安全范围(MOS),当2IUIPRV和1000μgPIKA被用于人应用时。MOS的计算在下表10中提供:表10:昆明小鼠急性毒性-安全范围计算实施例8:啮齿动物中过敏反应试验程序:七组299.6g至339.1gDunkin-Hartley豚鼠,每组6只动物(3只雄性和3只雌性)每两天肌肉内施用三剂量设置于下表11中的组合物。免疫后10至14天,使用双免疫剂量静脉攻击动物:表11:啮齿动物过敏反应-免疫和攻击计划结果:在阴性对照组中的所有动物没有显示过敏反应的迹象,然而在阳性对照组中的动物在攻击后1分钟开始显示过敏反应。症状包括:挠鼻、咳嗽、紫癜、共济失调和痉挛。不含人白蛋白的PIKA佐剂或狂犬病疫苗组合物组的动物,在免疫和攻击期间未显示任何明显的过敏反应,然而含有人白蛋白的PIKA佐剂和狂犬病疫苗组合物组显示不同程度的过敏反应。从组6和组7(含有0.3%HSA)中取两对动物(1只雄性和1只雌性),分别地使用额外的1ml(攻击体积)低剂量或高剂量不含有人白蛋白的PIKA狂犬病疫苗(标记为组6.1和7.1)。在没有人白蛋白的额外的攻击试验未观察到过敏反应。作为结论,未添加人白蛋白的含有PIKA佐剂的狂犬病疫苗组合物和PIKA佐剂是非过敏性的,并且通过肌肉内途径在至多3IU的狂犬病抗原和1,500μgPIKA佐剂的多剂量后,在试验动物中良好耐受。在过敏反应中,所使用的狂犬病疫苗组合物的MOS是低剂量组的25倍和高剂量组的50倍。在以下提供计算:表12:豚鼠过敏反应-安全范围计算实施例9:在灵长类中重复剂量的慢性毒性和效力研究安全性评估程序:四组2-3年龄的猕猴,每组8只动物(4只雄性和4只雌性),体重在2.5kg至4.0kg之间,以逐步提高的剂量(两组)施用PIKA狂犬病疫苗组合物、单独PIKA或者0.9%NaCl(对照组),在6周的时间内(即第0、2、7、28和42天)通过注射至三角肌五次。前两次注射在两个位置施用(即双剂量),见下表13。表13:灵长类慢性毒性研究组在免疫前和免疫后,观察猴子的注射位置和全身临床症状数次。在0天(即动物检疫期时间)、44天和70天获取血液样本4次。血液样本用于血液学、血液凝固和血清生化试验。效力程序:在第44天和第70天测量体液免疫应答和效价。两个雄性和两个雌性猴子在第45和70天处死用于组织学检查。器官染色前称重、切片和固定用于光学显微镜染色。结果:1.在所有施用PIKA佐剂或者PIKA狂犬病疫苗组合物的动物中没有观察到注射位置或全身临床症状异常。在试验中所有的值在数据中心背景(datacenterbackground)的范围内,无显著变化报告。不同器官的重量在对照组和其他试验组之间未显示显著差异。2.体液免疫应答通过血清中狂犬病特异IgG的滴度和中和抗体效价的几何平均数表示,分别使用ELISA或FAVN试验评估。表14-15和图4-5阐明了施用PIKA和PIKA狂犬病疫苗组合物的灵长类的免疫应答提高。表14:血清IgG(ELISA试验)表15:效价(FAVN试验)在第44天,在猴子中PIKA狂犬病疫苗低剂量和高剂量组分别诱导平均4.795和7.366IU的中和抗体,即高于WHO要求的0.5IU保护水平的9.6和14.7倍。在第70天,高剂量组中的中和抗体效价轻微下降至5.653,以及在低剂量组中的增加至5.670。总之,含有产生于Vero细胞系中的IPRV的狂犬病疫苗组合物是良好耐受的,并且在猕猴中重复肌肉注射后经84天的观察时间里具有良好的免疫原性。特异性抗体在中和游离病毒和防止狂犬病病毒感染中是重要的。在下表16中提供安全范围(MOS)的计算,并且通过MOS=测试的总灵长类动物剂量(mg/kg)/计划总人剂量(mg/kg)测定。表16:灵长类慢性毒性-安全范围当含有0.3%HSA的2IUIPRV和1000μgPIKA佐剂被用于成人时,PIKA狂犬病疫苗的安全范围超过猴子毒性试验剂量,对于全剂量组是28倍以及对于半剂量组是14倍。实施例10:在健康人志愿者中安全性和效力试验使用含有PIKA佐剂的狂犬病疫苗组合物(1IUIPRV和1000μgPIKA佐剂)实施I期临床试验。健康志愿者被分为三组,在每组中10名受试者。在每组中的受试者在第0、3、7、14和28天施用PIKA狂犬病疫苗组合物或者无佐剂的比较疫苗(9.4IUIPRV)。在第0、7、10、30和60天收集血液样本用于中和抗体滴度评估,结果在以下显示:表17:中和抗体的滴度(IU/ml)天比较疫苗PIKA狂犬病疫苗000700.13100.250.42303.245.32608.5517.81结果总结:在试验期间未观察到明显副作用。含有PIKA佐剂的狂犬病疫苗能够早至首次免疫后7天诱导中和抗体。与比较疫苗相比,PIKA狂犬病疫苗产生更早和更高滴度的中和抗体。实施例11:在健康志愿者中早期抗体诱导在另一个试点人试验中开展(evolving)4名健康志愿者,使用2-2-1方案在第0、3和7天施用含2IUIPRV和1000μgPIKA佐剂的狂犬病疫苗组合物于受试者(即在第0天和第3天,在两个不同位置施用总量为4IUIPRV和2000μgPIKA佐剂)。在免疫后第0、7和14天,取血液样本。评估体液免疫应答,结果在表18中列出:表18:在4名人受试者中的中和抗体平均滴度(IU/ml)第0天第7天第14天平均抗体滴度0.001.0818.06结果总结:在试验期间,四名志愿者未报告任何明显的副作用。狂犬病疫苗组合物能够在早至首次免疫后7天诱导高于0.5IU的中和抗体。根据WHO标准,这被认为是有保护的。因此,用于前两次注射高达4IUIPRV和2000μgPIKA佐剂是安全的,并且在人受试者中诱导早期和高水平的保护性免疫是有效的。实施例12:在健康人志愿者中的长期免疫应答使用含有1.5IUIPRV和1,000μg/mlPIKA佐剂的狂犬病疫苗免疫健康志愿者。免疫后2.5年,收集分离自血液样本的外周血单个核细胞。使用PBS对照或不同水平的IPRV刺激细胞,并使用ELISPOT检测法试验干扰素-γ的产生。结果显示,使用含PIKA佐剂的狂犬病疫苗免疫后2.5年后,经刺激,志愿者仍然产生显著水平的干扰素γ。实施例13:冷冻干燥狂犬病疫苗的稳定性分析计划在2至8℃的长期稳定性试验和在37℃的加速试验分析疫苗组合物的稳定性。试验四个批次的冷冻干燥狂犬病疫苗组合物(1.0ml/小瓶)(批次号II-20130401、II-20130402、II-20130501和II-20130901)。组合物批次号II-20130402,狂犬病疫苗组合物包含:2.0IU/剂量IPRV、1000μg/剂量PIKA佐剂、5.0%麦芽糖、0.3%HSA、以及7.60±0.05PBS缓冲液。批次号II-20130401,狂犬病疫苗组合物包含:1.5IU/剂量IPRV、2000μg/剂量PIKA佐剂、5.0%麦芽糖、0.3%HSA、以及7.60±0.05PBS缓冲液。批次号II-20130501,狂犬病疫苗组合物包含:2.0IU/剂量IPRV、2000μg/剂量PIKA佐剂、5.0%麦芽糖、0.3%HSA、以及7.60±0.05PBS缓冲液。批次号II-20130901,狂犬病疫苗组合物包含:4.0IU/剂量IPRV、1000μg/剂量PIKA佐剂、5.0%麦芽糖、0.5%HSA、以及7.60±0.05PBS缓冲液。13.1长期稳定性试验以上4个批次的疫苗组合物存储于2至8℃用于长期稳定性试验,长期稳定性试验根据中国和欧洲药典标准计划为42个月的期间。试验的项目包括外观、pH、水分含量、内毒素、无菌、效价、鉴定、残余牛血清白蛋白、残余硫酸庆大霉素、来自宿主细胞的蛋白质残余、卡那霉素含量、PIKA含量、PIKA分子量、以及来自宿主细胞的DNA残余。根据中国药典(2010版)和欧洲药典(E7.0)标准,长达6个月的结果是满意的,疫苗效价仍然显著高于作为WHO标准要求的2.5IU/ml。与来自第0月观察的外观、pH、水分含量、内毒素和无菌无显著性差异。13.2加速稳定性试验通过在37℃存储疫苗持续6个月,对以上3个批次实施加速稳定性试验。它作为长期稳定性的初步指示。分别在第1、2、3和6月实施外观、pH、水分含量、内毒素、无菌和疫苗效价的质量试验。上述四个批次的狂犬病疫苗组合物的实验结果总结于表19中。表19:加速稳定性试验的结果根据GMP标准制造和试验疫苗组合物。在存储于37℃持续1、2、3和6个月后,疫苗仍然显著高于WHO的标准要求的2.5IU/ml。与来自第0月观察的外观、pH、水分含量、内毒素和无菌无显著性差异。该结果作为狂犬病疫苗组合物的长期稳定性的初步指示。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1