GnRHⅡ型拮抗剂在抑制孕激素耐药子宫内膜癌细胞增殖中的应用的制作方法
本发明属于生物技术领域,具体涉及GnRH Ⅱ型拮抗剂在抑制孕激素耐药子宫内膜癌细胞增殖中的应用。
背景技术:
子宫内膜癌是女性生殖道三大恶性肿瘤之一,占女性全身恶性肿瘤的7%,生殖道恶性肿瘤的25~30%。近10~20年中子宫内膜癌发生率约为上世纪70年代早期的两倍,并且发病具有年轻化趋势。约75%为早期,诊断时病变尚局限于子宫。
子宫内膜癌的治疗,除了常规的手术治疗、放疗和化疗以外,内分泌治疗也成为一种重要的辅助治疗手段。目前在国内外内分泌治疗多被用于晚期、复发子宫内膜癌患者以及要求保留生育能力的早期子宫内膜癌患者的治疗中。临床最常用的内分泌治疗药物为孕激素。但长期孕激素治疗可造成PR表达下调从而导致子宫内膜癌孕激素耐药。
技术实现要素:
本发明的一个目的是提供GnRH Ⅱ型拮抗剂的新用途。
本发明提供了GnRH Ⅱ型拮抗剂在制备预防和/或治疗子宫内膜癌的产品中的应用。其中的子宫内膜癌可以是无耐药性的子宫内膜癌,也可以是有耐药性的子宫内膜癌,耐药具体可为耐孕激素。
本发明还提供了GnRH Ⅱ型拮抗剂在制备具有如下(1)-(5)中至少一种功能的产品中的应用:
(1)促进子宫内膜癌细胞孕激素受体mRNA的表达;
(2)抑制子宫内膜癌细胞增殖;
(3)抑制子宫内膜癌细胞AKT的磷酸化水平;
(4)抑制子宫内膜癌细胞的PI3K/AKT信号通路的激活;
(5)抑制子宫内膜癌细胞的成瘤能力。
上述应用中,
所述抑制子宫内膜癌细胞的成瘤能力具体体现在减小子宫内膜癌细胞肿瘤体积和/或降低子宫内膜癌细胞瘤体重量。
上述应用中,
所述GnRH Ⅱ型拮抗剂为Trptorelix-1。
本发明的另一个目的是提供一种预防和/或治疗子宫内膜癌的物质。
本发明提供的预防和/或治疗子宫内膜癌的物质的活性成分为如下1)或2):
1)GnRH Ⅱ型拮抗剂;
2)由GnRH Ⅱ型拮抗剂和醋酸甲地孕酮组成的组合物。
上述物质中
所述GnRH Ⅱ型拮抗剂为Trptorelix-1。
上述物质中,
所述2)中,所述GnRH Ⅱ型拮抗剂和所述醋酸甲地孕酮的摩尔比为1:1。
上述物质在制备具有如下(1)-(6)中至少一种功能的产品中的应用:
(1)预防和/或治疗子宫内膜癌;
(2)促进子宫内膜癌细胞孕激素受体mRNA的表达;
(3)抑制子宫内膜癌细胞增殖;
(4)抑制子宫内膜癌细胞AKT的磷酸化水平;
(5)抑制子宫内膜癌细胞的PI3K/AKT信号通路的激活;
(6)抑制子宫内膜癌细胞的成瘤能力。
上述应用或上述物质或上述应用中,所述子宫内膜癌细胞可以是无耐药性的子宫内膜癌细胞,也可以是有耐药性的子宫内膜癌细胞,耐药具体可为耐孕激素。所述子宫内膜癌细胞具体为孕激素耐药子宫内膜癌细胞。
上述应用或上述物质或上述应用中,所述产品或物质为药物。
通过试验证明:GnRH Ⅱ拮抗剂(Trptorelix-1)单独使用或者与MPA联合应用,可有效抑制孕激素耐药子宫内膜癌细胞的生长,且GnRH Ⅱ拮抗剂(Trptorelix-1)与MPA联合应用的抑制效果更明显。GnRH Ⅱ拮抗剂(Trptorelix-1)可以通过上调PR表达和抑制PI3K信号通路等机制逆转孕激素耐药,增加孕激素耐药子宫内膜癌细胞株对孕激素的敏感性。
附图说明
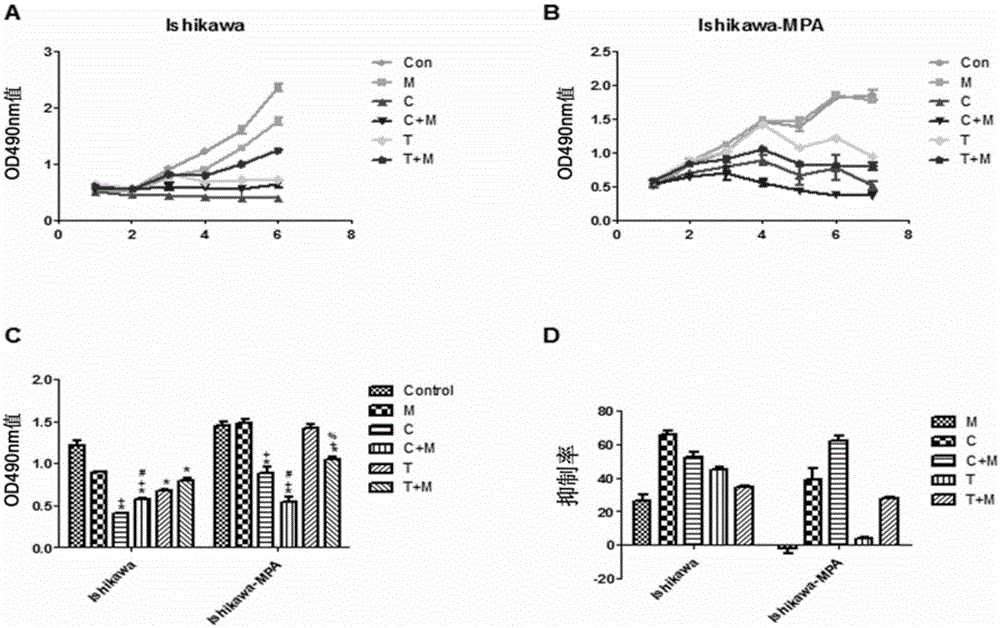
图1为Cetrorelix和Trptorelix-1(培养基中含/不含MPA)对Ishikawa-MPA细胞增殖的影响。图1A为Cetrorelix和Trptorelix-1(培养基中含/不含MPA)对Ishikawa细胞增殖的影响(生长曲线图);图1B为Cetrorelix和Trptorelix-1(培养基中含/不含MPA)对Ishikawa-MPA细胞增殖的影响(生长曲线图);图1C为Cetrorelix和Trptorelix-1(培养基中含/不含MPA)对两种细胞细胞增殖的影响(与生长曲线图相应的柱状图);图1D为Cetrorelix和Trptorelix-1(培养基中含/不含MPA)对两种细胞抑制率的比较。其中Control为不含任何药物组;M为加MPA组;C为Cetrorelix组;C+M为Cetrorelix和MPA联合用药组;T为Trptorelix-1组;T+M为Trptorelix-1和MPA联合用药组。
图2为裸鼠皮下移植瘤的生长曲线。其中,图2A为Ishikawa细胞的裸鼠皮下移植瘤的生长曲线;图2B为Ishikawa-MPA细胞的裸鼠皮下移植瘤的生长曲线;图2C为不同药物处理后各细胞21天后的瘤体重量(*:P<0.05)。
图3为GnRH拮抗剂单独或者联合MPA使用对人子宫内膜癌裸鼠皮下移植瘤的体积的影响。
图4为Realtime-PCR检测不同子宫内膜癌细胞的PR mRNA表达水平。图4A为Realtime-PCR(实时荧光定量PCR)检测不同子宫内膜癌细胞的PR mRNA表达水平;图4B为Cetrorelix和Trptorelix-1作用于Ishikawa-MPA细胞不同时间后,PR mRNA表达水平的变化(与对照组相比*:P<0.05;**:P<0.01)。
图5为GnRH拮抗剂在不同时间作用Ishikawa-MPA细胞对p-AKT/AKT信号通路的影响。其中,图5A为Cetrorelix(10μM)在不同时间作用Ishikawa-MPA细胞对p-AKT/AKT信号通路的影响;图5B为Trptorelix-1(10μM)在不同时间作用Ishikawa-MPA细胞对p-AKT/AKT信号通路的影响。
图6为Cetrorelix和Trptorelix-1(培养基中含/不含MPA)对Ishikawa-MPA细胞30min后PI3K/AKT信号通路的影响。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的人子宫内膜腺癌细胞系Ishikawa(ISK)为高分化腺癌,ERα、β和PR均为阳性,来源于日本,在文献“赵丽君,魏丽惠,李小平,王建六.促性腺激素释放激素I型激动剂和II型对不同PTEN基因表达状态子宫内膜癌细胞的作用.中华妇产科杂志.2009,44(1):45-49”中公开过,由北京大学人民医院妇产科实验室保存。
下述实施例中的Ishikawa-MPA细胞株(ISK-MPA)是前期诱导获得PR表达下调的孕激素耐药Ishikawa细胞株、长期培养于含MPA(10μM)的DMEM-F12高糖培养基(美国Hyclone公司)中,在文献“人子宫内膜癌耐醋酸甲羟孕酮细胞株的建立,中国妇产科临床杂志,2014,15(4)期:341-344”中公开过,公众可从北京大学人民医院获得。
下述实施例中的GnRH I型拮抗剂:西曲瑞克Cetrorelix(Cet),其氨基酸序列为:Ac-D-Nal(2)-DPhe(4Cl)-D-Pal(3)-Ser-Tyr-D-Cit-Leu-Arg-Pro-D-Ala-NH2;由上海紫域有限公司合成。
下述实施例中的GnRH Ⅱ型拮抗剂:Trptorelix-1(Trp-1),其氨基酸序列为:Ac-D-Nal(2)-DPhe(4Cl)-D-Pal(3)-Ser-Tyr-D-Cit-Trp-Tyr-Pro-D-Ala-NH2;由上海紫域有限公司合成。
下述实施例中的醋酸甲地孕酮(MPA)是青岛国海生物制药有限公司的产品;化学名称:6-甲基-17a-羟基孕甾-4,6-二烯-3,20-二酮17-醋酸酯;分子式:C24H32O4;分子量:384.52。
下述实施例中的Cetrorelix、Trptorelix-1和MPA,在使用时,均先用DMSO溶解成10-2M的干液,再用完全培养基(含10%FBS的DMEM-F12高糖培养基)稀释1000倍,使Cetrorelix、Trptorelix-1或MPA的终浓度为10-5M(10μM)。
下述实施例中DMEM-F12高糖培养基是美国Hyclone公司的产品。
实施例1、GnRH拮抗剂在抑制Ishikawa和Ishikawa-MPA细胞增殖中的应用
本实施例中的细胞株:Ishikawa-MPA细胞和Ishikawa细胞。
本实施例中的GnRH拮抗剂:Cetrorelix和Trptorelix-1。
1、铺板
(1)待Ishikawa(ISK)和孕激素耐药细胞株(ISK-MPA)细胞生长至对数期时,接种96孔板;
(2)用质量分数为0.25%的胰酶溶液(0.25g胰蛋白酶和0.02gEDTA溶解到100mlPBS溶液)分别消化处理步骤(1)中的各个细胞,再用含10%FBS的DMEM-F12高糖培养基终止消化,并吹打制成单细胞悬液,取10μl单细胞悬液用细胞计数板计数,用含10%FBS的DMEM-F12高糖培养基稀释,使各个细胞的终浓度均为5000个/ml,每孔加入100μl;
(3)每种细胞5个复孔,同时接种7个96孔板;同时设置调零孔即空白组(仅加培养基),边孔加入灭菌PBS,以保证中间细胞的水分饱和;37℃、5%CO2培养箱内培养。
(4)培养至细胞贴壁起计时,培养过程中隔天换液,分别于第1-7天每天终止一板,用MTS法测定细胞数量。
2、药物处理
细胞接种后,培养24h,按照加入的药物不同,分成如下六组:
第一组(简称Control):向步骤1中的各个细胞培养体系中加入DMSO,作为对照;使DMSO在细胞培养体系中的体积分数均为0.1%。
第二组(简称M):向步骤1中的各个细胞培养体系中加入MPA溶液(溶剂是DMSO,MPA溶液浓度为10μM),使MPA在各个细胞培养体系中的浓度为10μM;
第三组(简称C):向步骤1中的各个细胞培养体系中加入Cetrorelix溶液(溶剂是DMSO,Cetrorelix溶液浓度为10μM),使Cetrorelix在各个细胞培养体系中的浓度均为10μM;
第四组(简称C+M):向步骤1中的各个细胞培养体系中加入MPA溶液和Cetrorelix溶液,使MPA和Cetrorelix在各个细胞培养体系中的浓度均为10μM;
第五组(简称T):向步骤1中的各个细胞培养体系中加入Trptorelix-1溶液,使Trptorelix-1在各个细胞培养体系中的浓度均为10μM;
第六组(简称T+M):向步骤1中的各个细胞培养体系中加入MPA溶液和Trptorelix-1溶液,MPA和Trptorelix-1在各个细胞培养体系中的浓度均为10μM。
每种细胞设立5个平行对照,加药后隔天换液,第1-7天分别取出一板,每孔加入MTS溶液20μl,继续培养4小时后选择490nm波长,在酶联免疫检测仪(96孔酶标仪)上测定各孔吸光度值(OD490nm)。
3、Ishikawa-MPA细胞增殖的检测结果
结果如图1所示:单独使用MPA(M)对Ishikawa-MPA细胞增殖没有抑制作用,对Ishikawa细胞增殖有抑制作用。GnRH拮抗剂Cetrorelix(C)或Trptorelix-1(T)单独使用可抑制Ishikawa和Ishikawa-MPA细胞的增殖。在Ishikawa细胞中,Cetrorelix(C)或Trptorelix-1(T)单独使用对细胞增殖的抑制比这两种药物与MPA(M)联用的抑制作用强(P<0.05)。而在Ishikawa-MPA细胞中,Cetrorelix(C)和Trptorelix-1(T)与MPA(M)联用这种抑制作用更强(P<0.05),说明GnRH拮抗剂可以使Ishikawa-MPA细胞恢复对孕激素的敏感性,从到抑制细胞增殖。
实施例2、GnRH拮抗剂在抑制裸鼠移植瘤中的应用
一、实验材料
Ishikawa(ISK)、孕激素耐药细胞株(Ishikawa-MPA)、受体动物5-6周龄BALB/C遗传背景雌性裸鼠。
二、裸鼠移植瘤模型的建立
1、取对数生长期的子宫内膜癌细胞(Ishikawa、Ishikawa-MPA)分别制备成单细胞悬液(5×106个细胞悬浮于0.5ml的生理盐水中),分别得到Ishikawa单细胞悬液和Ishikawa-MPA单细胞悬液;
2、于无菌条件下将步骤1制备的Ishikawa单细胞悬液和Ishikawa-MPA单细胞悬液分别接种于5只5-6周龄BALB/C遗传背景雌性裸鼠双侧前肢肩背部皮下(每种细胞接种5只);
3、接种后10-20天100%成瘤,颈椎脱臼致死,消毒操作部位皮肤,切开皮肤,剥离出瘤块,置于平皿(平皿应放在冰块上,内置少许灭菌的PBS)上,剔除非肿瘤组织和坏死组织,选取生长良好无坏死的红色、鱼肉状瘤组织,并剪成2mm3小块;
4、将步骤3得到的瘤组织分别接种于5只5-6周龄BALB/C遗传背景雌性裸鼠双侧前肢肩背部皮下(共60只)。
5、待瘤体体积约75mm3时,每种细胞成瘤的裸鼠被随机分成如下6组(n=5只/组)进行药物治疗处理(药物处理方式为腹腔注射):
第一组(Con):空白溶剂(DMSO);
第二组(M):MPA(100mg/kg体重);
第三组(C):Cetrorelix(100μg/只);
第四组(C+M):MPA和Cetrorelix联合治疗组;
第五组(T):Trptorelix-1(100μg/只);
第六组(T+M):MPA和Trptorelix-1联合治疗组;
药物处理具体方式如下:MPA通过MPA溶液(溶剂为DMSO,浓度为10μM)进行处理,腹腔注射200μl每周3次(共9次);Cetrorelix与Trptorelix-1通过Cetrorelix溶液(溶剂为DMSO,浓度为10μM)与Trptorelix-1溶液(溶剂为DMSO,浓度为10μM)每日腹腔注射200μl(共21次)。对照组裸鼠只注射相同体积药物溶剂。
6、成瘤后每周2次测量肿瘤体积(体积计算公式=1/2ab2,其中,a、b分别为移植瘤的长、短径)。肿瘤细胞自打药后第21天处死裸鼠,取瘤测量三组肿瘤平均体积、瘤重,采集肿瘤标本。清洗、固定。并在给药过程中监测裸鼠体重以评估药物副作用。
三、内膜癌裸鼠皮下移植瘤模型实验结果
内膜癌裸鼠皮下移植瘤模型实验结果如图2和图3所示:与只给药物溶剂的对照组(Con)相比,Ishikawa细胞移植瘤中C组瘤体生长最缓慢(图2A),Ishikawa-MPA细胞中,(C+M)组抑瘤效果最明显(图2B)。
不同给药组的移植瘤大小和重量结果如图2C所示:(C+M)组在孕激素耐药子宫内膜癌细胞(Ishikawa-MPA)中的抑瘤效果最为显著;Cetrorelix单独用药组(C)对Ishikawa和Ishikawa-MPA肿瘤体积抑制率为71%和38%,而瘤体重量分别减少为48%和25%。Cetrorelix和MPA联合用药组(C+M)对Ishikawa和Ishikawa-MPA肿瘤体积抑制率为66%和78%,瘤体重量分别减少46%和80%。说明Cetrorelix和MPA联合用药可增强MPA的敏感性,对于孕激素耐药细胞(Ishikawa-MPA)移植瘤抑制效果明显。
Trptorelix-1单独用药组(T)对Ishikawa和Ishikawa-MPA肿瘤体积抑制率为32%和27%,而瘤体重量分别减少为36%和16%。Trptorelix-1和MPA联合用药组(T+M)对Ishikawa和Ishikawa-MPA肿瘤体积抑制率为62%和42%,而瘤体重量分别减少为41%和40%。说明Trptorelix-1和MPA联合用药可增强MPA的敏感性,对于孕激素耐药细胞(Ishikawa-MPA)移植瘤抑制效果明显。
上述结果说明Cetrorelix和Trptorelix-1均可以抑制子宫内膜癌细胞抑制子宫内膜癌细胞成瘤能力,且和MPA联合用药可增强MPA的敏感性,对于孕激素耐药细胞(Ishikawa-MPA)移植瘤抑制效果更加明显
实施例3、GnRH拮抗剂对不同细胞株中PR mRNA和GnRHR mRNA表达水平的影响
本实施例中所用的细胞株:Ishikawa(ISK)、孕激素耐药细胞株(Ishikawa-MPA,ISK-MPA)。本实施例中所用的GnRH拮抗剂:Cetrorelix和Trptorelix-1。
1、铺板
(1)待Ishikawa(ISK)和孕激素耐药细胞株(ISK-MPA)细胞生长至对数期时,接种96孔板;
(2)用质量分数为0.25%的胰酶溶液(0.25g胰蛋白酶和0.02gEDTA溶解到100ml PBS溶液)分别消化处理步骤(1)中的各个细胞,再用含10%FBS的DMEM-F12高糖培养基终止消化,并吹打制成单细胞悬液,取10μl单细胞悬液用细胞计数板计数,用含10%FBS的DMEM-F12高糖培养基稀释,使各个细胞的终浓度均为5000个/ml,每孔加入100μl;
(3)每种细胞5个复孔,同时接种7个96孔板;同时设置调零孔即空白组(仅加培养基),边孔加入灭菌PBS,以保证中间细胞的水分饱和;37℃、5%CO2培养箱内培养。
(4)培养至细胞贴壁起计时,培养过程中隔天换液,分别于第1-7天每天终止一板,用MTS法测定细胞数量。
2、药物处理
细胞接种96孔板后,培养24h,按照药物处理种类的不同分成如下3组:
(1)向步骤1中的各个细胞培养体系中加入GnRH I型拮抗剂Cetrorelix(药物的溶剂是DMSO),使Cetrorelix在细胞培养体系中的终浓度均为10μM,DMSO在细胞培养体系中的体积分数均为0.1%。
(2)向步骤1中的各个细胞培养体系中加入GnRH Ⅱ型拮抗剂Trptorelix-1(药物的溶剂是DMSO),使Trptorelix-1在细胞培养体系中的终浓度均为10μM,DMSO在细胞培养体系中的体积分数均为0.1%。
(3)向步骤1中的各个细胞培养体系中加入DMSO,作为阴性对照(control),使DMSO在细胞培养体系中的体积分数均为0.1%。
3、生长曲线测定
两种细胞Ishikawa(ISK)和孕激素耐药细胞株(ISK-MPA)细胞分别接种96孔板后,培养24h后按照上述步骤2的药物处理方式加药,培养过程中隔天更换含上述药物的新鲜培养液,分别于第1-7天每天终止一板,用MTS法测定细胞数量。绘制细胞生长曲线。
4、RT-PCR检测
RT-PCR检测药物处理后24h、48h、72h和96h后的Ishikawa(ISK)和孕激素耐药细胞株(ISK-MPA)细胞中PR(孕激素受体)mRNA的表达水平。PR的PCR扩增反应引物及内参引物的序列如表1所示,PCR扩增反应条件如表2所示。
表1、PCR引物
表2、扩增条件
读板
72℃5分钟
熔解曲线从60℃-92℃,每0.2℃读一次板,每一PCR反应至少重复三次。
5、RT-PCR检测结果
药物处理前的PR mRNA表达水平的RT-PCR检测结果如图4A所示:从图中可以看出,Ishikawa细胞中PR mRNA表达水平很高,而诱导获得的Ishikawa-MPA细胞株的PR mRNA表达水平远远低于Ishikawa细胞,说明长期孕激素诱导耐药过程中子宫内膜癌细胞PR下调;
不同药物Cetrorelix和Trptorelix-1对Ishikawa-MPA细胞处理不同时间后的RT-PCR检测结果如图4B所示:从图中可以看出,当Cetrorelix和Trptorelix-1对Ishikawa-MPA细胞作用后,随着作用时间延长,PR mRNA表达水平逐渐升高,96h时显著增高。
实施例4、GnRH拮抗剂对Ishikawa-MPA细胞中PI3K/AKT信号通路的影响
本实施例中的细胞株:Ishikawa(ISK)、孕激素耐药细胞株(Ishikawa-MPA)。
本实施例中的GnRH拮抗剂:Cetrorelix和Trptorelix-1。
一、Cetrorelix和Trptorelix-1不同作用时间对Ishikawa-MPA细胞AKT的磷酸化水平的影响
1、铺板
(1)待Ishikawa(ISK)和孕激素耐药细胞株(ISK-MPA)细胞生长至对数期时,接种96孔板;
(2)用质量分数为0.25%的胰酶溶液(0.25g胰蛋白酶和0.02gEDTA溶解到100ml PBS溶液)分别消化处理步骤(1)中的各个细胞,再用含10%FBS的DMEM-F12高糖培养基终止消化,并吹打制成单细胞悬液,取10μl单细胞悬液用细胞计数板计数,用含10%FBS的DMEM-F12高糖培养基稀释,使各个细胞的终浓度均为5000个/ml,每孔加入100μl;
(3)每种细胞5个复孔,同时接种7个96孔板;同时设置调零孔即空白组(仅加培养基),边孔加入灭菌PBS,以保证中间细胞的水分饱和;37℃、5%CO2培养箱内培养。
(4)培养至细胞贴壁起计时,培养过程中隔天换液,分别于第1-7天每天终止一板,用MTS法测定细胞数量。
2、药物作用
细胞接种96孔板,培养24h后分别加入10μM的Cetrorelix和10μM的Trptorelix-1,分别作用0、15min、30min、1h、3h、6h和12h。
3、In cell Western方法检测PI3K/AKT蛋白水平
In cell Western方法检测上述步骤2药物处理后的各个细胞PI3K/AKT蛋白水平的具体方法如下:
(1)去除培养基,迅速加入150μl的新鲜3.7%甲醛固定缓冲液固定细胞(加固定缓冲液时,小心地用移液器沿管壁加入,避免使细胞脱落),免摇动在室温条件下孵育20min。
(2)去除固定缓冲液,用Triton洗脱缓冲液分4次洗脱细胞,每次200μl,以保证可以渗透细胞,(每次洗脱可在摇床上进行,室温条件下5min)
(3)去除Triton洗脱缓冲液,每个孔小心地从管壁加入150μl 5%脱脂奶粉封阻液,在摇床上缓慢摇动室温下孵育1.5h。
(4)去除封阻液,每孔加入用封阻液稀释鼠抗人pAKT单抗和兔抗人AKT单抗(1:100)50ul,以50μl的封阻液,作为由于近红外染料标记的二抗可能产生背景的对照。4℃不摇动孵育过夜
(5)加入0.1%Tween洗脱液200μl,在室温条件下缓慢摇动,洗脱5min,重复4次以上。
(6)每孔加入用封阻液稀释的荧光二抗,羊抗兔IRDyeTM800(1:200),羊抗鼠IRDyeTM680(1:800)各25ml充分混合后加入50ul,同时背景孔也加入50ul二抗。室温下避光缓慢摇动,孵育60min
(7)沿管壁加入Tween洗脱液,重复步骤E4次以上。
(8)洗脱结束之后,从孔内完全去除洗脱液。翻转微孔板底部朝上,在纸巾轻轻敲打,去除残留的洗脱液。
(9)用700nm和800nm两个通道同时扫描,均选择中等质量、169μm的分辨率、3.0mm的焦距、亮度为5。
PI3K/AKT蛋白水平的检测结果如图5所示:Ishikawa-MPA细胞在Cetrorelix作用15min后明显抑制AKT的磷酸化水平,并在作用12小时内无明显改变(图5A);Ishikawa-MPA细胞在Trptorelix-1作用15min后则明显激活AKT的磷酸化水平并呈持续激动状态,12小时后有所降低(图5B)。说明Cetrorelix和Trptorelix-1均可以抑制子宫内膜癌细胞AKT的磷酸化水平。
二、Cetrorelix和Trptorelix-1对Ishikawa-MPA细胞中PI3K/AKT信号通路的影响
1、铺板
(1)待孕激素耐药细胞株(ISK-MPA)细胞生长至对数期时,接种96孔板;
(2)用质量分数为0.25%的胰酶溶液(0.25g胰蛋白酶和0.02gEDTA溶解到100mlPBS溶液)分别消化处理步骤(1)中的各个细胞,再用含10%FBS的DMEM-F12高糖培养基终止消化,并吹打制成单细胞悬液,取10μl单细胞悬液用细胞计数板计数,用含10%FBS的DMEM-F12高糖培养基稀释,使各个细胞的终浓度均为5000个/ml,每孔加入100μl;
(3)每种细胞5个复孔,同时接种7个96孔板;同时设置调零孔即空白组(仅加培养基),边孔加入灭菌PBS,以保证中间细胞的水分饱和;37℃、5%CO2培养箱内培养。
(4)培养至细胞贴壁起计时,培养过程中隔天换液,分别于第1-7天每天终止一板,用MTS法测定细胞数量。
2、药物作用
将Ishikawa-MPA细胞以4×105个/ml的密度接种于96孔板中后,培养24h,分成以下五组,每组中加入不同的药物各作用30min:
第一组(简称Control):向步骤1中的各个细胞培养体系中加入DMSO,作为对照;使DMSO在细胞培养体系中的体积分数均为0.1%。
第二组(简称M):向步骤1中的各个细胞培养体系中加入MPA溶液(溶剂是DMSO,MPA溶液浓度为10μM),使MPA在各个细胞培养体系中的浓度为10μM;
第三组(简称C):向步骤1中的各个细胞培养体系中加入Cetrorelix溶液(溶剂是DMSO,Cetrorelix溶液浓度为10μM),使Cetrorelix在各个细胞培养体系中的浓度均为10μM;
第四组(简称C+M):向步骤1中的各个细胞培养体系中加入MPA溶液和Cetrorelix溶液,使MPA和Cetrorelix在各个细胞培养体系中的浓度均为10μM;
第五组(简称T):向步骤1中的各个细胞培养体系中加入Trptorelix-1溶液,使Trptorelix-1在各个细胞培养体系中的浓度均为10μM;
第六组(简称T+M):向步骤1中的各个细胞培养体系中加入MPA溶液和Trptorelix-1溶液,MPA和Trptorelix-1在各个细胞培养体系中的浓度均为10μM。
3、In Cell Western方法检测PI3K/AKT蛋白水平
检测方法同步骤一的3。
PI3K/AKT蛋白水平的检测结果如图6所示:C组的Ishikawa-MPA细胞30min后抑制pAKT水平明显高于Control组,且C+M组的Ishikawa-MPA细胞30min后抑制pAKT水平明显强于C组,说明Cetrorelix可以抑制子宫内膜癌细胞的PI3K/AKT信号通路的激活,与MPA联用后抑制效果更加更显。
- 还没有人留言评论。精彩留言会获得点赞!