一种层层自组装结构的口服胰岛素输运体系的制备方法与应用与流程
本发明属于生物医药材料技术领域。更具体地,涉及一种层层自组装结构的口服胰岛素输运体系的制备方法与应用。
背景技术:
全世界患糖尿病的人数约为2.8亿,其中5~10%为I型糖尿病,约80~90%为II型糖尿病。I型糖尿病又称青少年糖尿病,50%的患病者在0~4岁发病。I型糖尿病是由免疫系统紊乱使胰岛B细胞死亡引起的,病人初次发病时胰岛B细胞已丧失70%-90%,发病后1~2年胰岛B细胞全部死亡,病人胰岛素分泌量为零。II型糖尿病一般在35~40岁发病。有的患者体内胰岛素甚至产生过多,但胰岛素的作用效果较差,因此患者体内的胰岛素是一种相对缺乏。胰岛素是I型糖尿病必须的治疗药物,也是II型糖尿病人在患病晚期必须的治疗药物。
尽管近年来胰岛素制剂不断更新,有长效、短效等不同类型的胰岛素制剂供病人选择,但是,注射仍然是将胰岛素输入患者体内的方式。一方面,注射胰岛素会引起病人的恐惧、疼痛等不适,研究表明部分II型糖尿病患者会由于这种不适推迟胰岛素的使用时间,长期注射也会引起皮肤问题、增加感染概率;另一方面,注射胰岛素在体内的流通方式也与自然分泌的有所不同,相比来说,注射胰岛素会避开肝脏的首过效应,相对增加外周血管的胰岛素浓度,较快聚集在肾脏并排出。因此,开发胰岛素的非侵入途径的输运研究成为近年来此领域的研究重点。相比于多种非侵入性胰岛素输运途径,经口服途径输运胰岛素具有一大优点,即口服输运的胰岛素在体内循环途径与自身分泌的最相似,口服输运的胰岛素可以在肝部聚集停留较长时间,再经肾排出,在体内各部位的浓度分布和流通路径与自然分泌的胰岛素最为相似,这对于避免或减少并发症、增加胰岛素用药效果都非常重要。此外,口服胰岛素输运体系还具有服用方便,易被患者接受等优点,因此,胰岛素的口服输运体系是目前胰岛素输运研究热点之一。也是近年来最有潜力进入临床应用的一类胰岛素输运方式。
目前,胰岛素口服输运的研究主要集中于增加输运效率这一方面。可以将这类研究分为三类:防止消化酶降解、促进肠粘膜附着、促进穿透肠上皮。其中,促进粒子穿过肠上皮细胞的途径是许多研究致力攻克的问题,目前的成果主要分为四类,即通过M细胞进入系统循环,靶向通过Goblet细胞进入系统循环,通过胞吞作用进入肠上皮细胞打开肠上皮细胞间的紧密连接,使粒子穿过细胞间隙进入系统循环。有些研究全面结合促进提升胰岛素获得率的方式,使用的胰岛素输运系统既促进粘膜附着性,又使用纳米材料输运胰岛素可以借助M细胞,同时还具备打开肠上皮细胞间的紧密连接或促进胞吞作用。现有的胰岛素口服输运体系常见材料主要有壳聚糖(chitosan),藻朊酸盐(alginate),葡聚糖(dextran)等天然材料,也有PLGA、PEG等经过美国FDA认证无毒的人工合成的聚合物,或硅等无机材料。此外,壳聚糖(chitosan)、PEG、某些靶向因子也都可以作为体系的表面修饰物,起到增加小肠吸收率的作用。其中壳聚糖(chitosan)具有正电性、肠粘膜附着性、可打开小肠上皮间紧密连接的作用都已得到明确研究和反复验证。
现有的药物口服输运体系研究通常采取选择天然材料制备输运载体达到低毒或无毒的目的。然而,被现有研究忽略的一点是,天然材料除了具有低毒性质之外,还具有潜在的医疗功能,即,天然材料有同时具备输运材料与治疗药物的双重功能的潜力。印度人早在公元前200年前就将糖尿病分为由遗传引起的和由饮食失调引起的两类。几个世纪以来,各国都有使用植物治疗糖尿病的经验。民族植物学研究研究表明至少有800种植物具有抗糖尿病的潜力。近几十年来,随着化学提纯工艺和生物科学领域的研究不断发展,药用植物中的有效成分被精确的分离提纯,也有几百种降血糖的植物活性物质及其化学结构得到确定,其中部分活性物质降血糖能力和其在细胞层面的作用机理也得到阐明。因此,开展从植物活性物质中选取天然无毒材料制备输运载体,同时使胰岛素输运体系本身具有降血糖功能的研究,具有重要的意义。
技术实现要素:
本发明所要解决的技术问题是通过探索应用具有控制血糖并且带负电的天然聚合物聚半乳糖醛酸与带正电的壳聚糖交替组装层层结构,并对此结构的大小、形状、结构稳定性、药物释放率、胰岛素输运效率、细胞毒性、体内吸收与药效等方面进行研究。所得层层自组装结构的口服胰岛素输运体系以聚半乳糖醛酸为基本材料,合成过程无有机物及有毒物质,具备应用于糖尿病治疗的潜力。
本发明的目的是提供一种层层自组装结构的口服胰岛素输运体系的制备方法。
本发明另一目的是提供所述层层自组装结构的口服胰岛素输运体系的应用。
本发明上述目的通过以下技术方案实现:
一种层层自组装结构的口服胰岛素输运体系的制备方法,首先在低pH条件下,使用盐析法析出带正电性的胰岛素纳米球,根据材料的电性与静电作用力,应用层层自组装法分别使用负电性的聚半乳糖醛酸(PGLA)和正电性的壳聚糖(CS)依次包裹胰岛素纳米球。
本发明首先筛选植物来源、具有降血糖活性的聚合物,得到具有血糖控制功能、带负电的聚半乳糖醛酸(PGLA),与带正电的天然聚合物壳聚糖(CS)相组合,制备层层自组装结构的口服胰岛素输运体系(LBL)。该体系具有天然、低毒、可自然代谢降解、生物相容性好的优点,该体系粒径小,具有较强的小肠吸收率,而且载药率高,稳定性好,能够快速并强效的发挥胰岛素降糖效应,也可以显著、快速、在较长时间内控制血糖水平,具备应用于糖尿病治疗的潜力。
具体地,作为优选的可实施方案,上述层层自组装结构的口服胰岛素输运体系的制备方法,包括如下步骤:
S1.制备正电性的胰岛素纳米球
在10~20℃环境下,将胰岛素溶解在稀盐酸溶液中,再加入NaCl使之终浓度达到0.5~0.7M,溶液搅拌0.4~0.6h,离心得沉淀;
S2.负电性的聚半乳糖醛酸(PGLA)包裹
步骤S1的沉淀加入聚半乳糖醛酸(PGLA)溶液,再搅拌0.4~0.6h,超声0.8~1.5min,继续搅拌0.4~0.6h,离心得沉淀;
S3.正电性的壳聚糖(CS)包裹
步骤S2的沉淀加入壳聚糖(CS)溶液,搅拌0.4~0.6h,离心得沉淀;
S4.反复依次重复步骤S2和步骤S3,即交替加入PGLA溶液和CS溶液进行包裹,得到不同层数的自聚合纳米球,即不同层数的层层自组装结构的口服胰岛素输运体系。
其中,优选地,步骤S1胰岛素与稀盐酸溶液的质量体积比为4~6mg/ml。
更优选地,步骤S1胰岛素与稀盐酸溶液的质量体积比为5mg/ml。
优选地,步骤S1所述环境温度为15℃。
优选地,步骤S1所述稀盐酸溶液的pH为1.0~1.4。
更优选地,步骤S1所述稀盐酸溶液的pH为1.1。
优选地,步骤S1所述NaCl的终浓度为0.6M。
优选地,步骤S1所述搅拌的时间为0.5h。
优选地,步骤S1所述离心是4000~6000rpm离心2~4min。
更优选地,步骤S1所述离心是5000rpm离心3min。
优选地,步骤S2所述聚半乳糖醛酸(PGLA)溶液的pH为3~5。
更优选地,步骤S2所述聚半乳糖醛酸(PGLA)溶液的pH为4。
优选地,步骤S2聚半乳糖醛酸(PGLA)溶液的制备方法为:将聚半乳糖醛酸(PGLA)溶解于稀盐酸溶液中,再加入NaCl,使NaCl终浓度达到0.5~0.7M,pH为3~5。
其中,优选地,所述聚半乳糖醛酸(PGLA)与稀盐酸溶液的质量体积比为4~6mg/ml。
优选地,所述聚半乳糖醛酸(PGLA)与稀盐酸溶液的质量体积比为5mg/ml。
优选地,所述聚半乳糖醛酸(PGLA)溶液中NaCl终浓度为0.6M。
优选地,所述聚半乳糖醛酸(PGLA)溶液的pH为4。
另外,优选地,步骤S2所述搅拌的时间为0.5h。
优选地,步骤S2所述超声的时间为1min。
优选地,步骤S2所述继续搅拌的时间为0.5h。
优选地,步骤S2所述离心是4000~6000rpm离心2~4min。
更优选地,步骤S2所述离心是5000rpm离心3min。
优选地,步骤S3所述壳聚糖(CS)溶液的制备方法为:将壳聚糖(CS)溶解于稀盐酸溶液中,再加入NaCl固体,使NaCl终浓度达到2~4M,pH为3~5。
其中,优选地,所述壳聚糖(CS)与稀盐酸溶液的质量体积比为4~6mg/ml。
更优选地,所述壳聚糖(CS)与稀盐酸溶液的质量体积比为5mg/ml。
优选地,所述壳聚糖(CS)溶液中NaCl终浓度为3M。
优选地,所述壳聚糖(CS)溶液的pH为4。
优选地,步骤S3所述搅拌的时间为0.5h。
优选地,步骤S3所述离心是4000~6000rpm离心2~4min。
更优选地,步骤S3所述离心是5000rpm离心3min。
另外,优选地,步骤S2所述沉淀和聚半乳糖醛酸(PGLA)溶液的质量体积比为0.8~1.2g:100ml。
更优选地,步骤S2所述沉淀和聚半乳糖醛酸(PGLA)溶液的质量体积比为1g:100ml。
优选地,步骤S3所述沉淀和壳聚糖(CS)溶液的质量体积比为4~6g:100ml。
更优选地,步骤S3所述沉淀和壳聚糖(CS)溶液的质量体积比为5g:100ml。
另外,由上述方法制备得到的层层自组装结构的口服胰岛素输运体系,及其在制备口服胰岛素药物方面的应用,也都在本发明的保护范围之内。
层层自组装结构是一种应用材料间正负电荷吸引力进行组装的纳米颗粒,可以通过控制反应次数控制纳米颗粒的组装层数与大小,其尺寸与其它结构的纳米颗粒相比相对较小。所以,可以认为层层自组装结构是研究小尺寸输运体系进行药物口服输运的研究的效果的有效结构。同时,由于其结构是依靠材料之间的电荷吸引力维持的,通常pH值对材料的稳定性有较强的影响,这可以使此结构对药物的释放具有pH感应性。
本发明首先在低pH、高盐的环境下,使胰岛素溶液析出胰岛素纳米球;然后应用聚半乳糖醛酸与壳聚糖两种分别带负电与正电的材料,层层包裹胰岛素纳米球,形成4层LBL结构。该体系具有纳米级的粒径、球形的外形,并带正电,具有较高的肠表面附着能力。
本发明输运体系的选材和设计从源头上保证了其具有极低毒性,该输运体系是由植物细胞壁的主要成分聚半乳糖醛酸制备,聚半乳糖醛酸具有减缓肠道吸收葡萄糖的功能,这使体系不仅毒性低,而且在治疗糖尿病的应用中,可以使输运体系本身就具有对疾病的治疗效果。这是在药物输运领域中的一次创新,即应用天然的、具有治疗功能的物质制备药物输运体系,使载药输运体系从多方面达到治疗作用,具备多重的疾病治疗效果。同时,在合成体系的过程中,不应用有机溶剂或毒性物质,避免了体系产生毒性。
本发明对输运体系的表征研究中,拉曼波谱数据表明体系已成功合成,TEM图像与动态光散射分析都表明粒子具有较小的粒径,这将帮助粒子通过M细胞穿过肠上皮,进入机体血液循环。同时,粒子带正电,其带电量与相对较大(25mV),正电性的粒子易与负电性的小肠粘膜相吸引附着,促进其被肠上皮吸收,也帮助维持了粒子的稳定性。TEM图像中隐约可见粒子的层层包裹结构,这与其它合成LBL体系研究中的结构相似。此外,热重分析表明,LBL体系中材料对胰岛素的包裹显著的降低了胰岛素的热分解速率。
本发明对输运体系的体外释放研究表明,体系在pH=3-5的环境下胰岛素释放速率相对较慢,在中性pH的肠环境胰岛素释放速率相对较快,这一性质也使LBL输运体系具备更大的应用潜力。胃的低pH环境和胃蛋白酶的降解是口服蛋白质药物设计与实践过程中的一个重要的难题,构建pH感应体系,在胃环境中减缓胰岛素释放,在肠环境中增加胰岛素的释放是解决这一难题的途径之一。本发明构建的LBL4体系表现出在极低pH环境与中性pH环境下的快速释放,在中等酸性条件下的慢速释放(pH=3-5)。LBL4的胰岛素低释放区间与进食后胃部的pH值相符合,可以推测在进食后口服LBL4体系可能是提升药物获得率的一个途径。
本发明还使用STZ诱导的SD大鼠建立I型糖尿病大鼠模型,分别验证其结扎肠段对LBL4输运中吸收的胰岛素量及口服胰岛素输运体系后的血糖动态。其中,免疫组化结果显示服用LBL4体系后1h,十二指肠部分就有显著的胰岛素吸收。这种吸收速率对于口服药物来说,相对较快。与此结果相吻合的是,口服LBL4具有快速降血糖的效应,于口服后1h,血糖即降至初始血糖值的40%。与同类研究相比,LBL4体系的体内效果显示出较快的药物吸收、较快的药物起效时间及降糖效果,这是LBL4体系的一大优点。
综上所述,本发明合成的LBL输运体系成功合成,是纳米级粒径的球体,表面带正电,具有较高热稳定性及pH感应性;在体内研究中,表现出较快的肠吸收速率、较快的降糖反应以及较显著的降糖效果,具备进一步研究和实践应用的价值。
本发明具有以下有益效果:
本发明成功制备了一种以植物来源的物质聚半乳糖醛酸为基体材料的胰岛素口服输运体系LBL4,是指交替在纳米胰岛素外包裹4层聚半乳糖醛酸和壳聚糖的纳米体系,体系合成依据材料间的正负电性吸引力,使材料自组装成为纳米输运体系,用于口服输运胰岛素。
本发明所用聚半乳糖醛酸、壳聚糖都是天然来源的聚合物,使此体系具有天然、低毒、可自然代谢降解的优点。且合成过程中没有有机溶剂和有毒物质的参与,所使用的材料均为天然来源的聚合物,保证了体系的生物相容性。
该体系粒径小,具有增加被肠上皮吸收的概率,表面带正电荷促进粒子与带负电的肠上皮相吸附,增强粒子稳定性等特性,这些性质都能够帮助LBL体系从口服途径进入机体血液循环该体系可以穿过小肠上皮进入血液循环,输运体系直径小(小于200nm),吸收率较高。
另外,该体系能够具备较高的载药率、具有较强的小肠吸收率,在体内研究中,能够快速并强效的发挥胰岛素降糖效应,也可以显著、快速、在较长时间内控制血糖水平,具备应用于糖尿病治疗的潜力。
附图说明
图1为LBL粒子合成示意图。
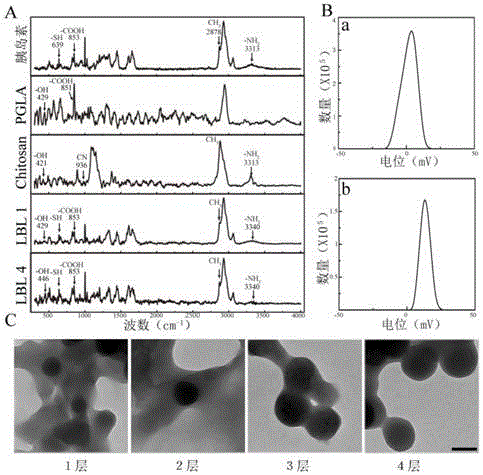
图2为LBL粒子的表征;A:拉曼光谱,从上至下依次为胰岛素、PGLA、壳聚糖、1层LBL粒子,4层LBL粒子。B:纳米胰岛素与LBL4的电位值,a为纳米胰岛素的电位,b为4层LBL体系的电位。C:TEM外观,从左至右依次是包裹1、2、3、4层材料的LBL体系,图中黑色标尺代表100nm。
图3为热重分析;灰色实线表示胰岛素随温度升高的质量变化情况,黑色实线表示LBL 4粒子随温度升高的质量变化情况。
图4为胰岛素紫外光吸收标准曲线。
图5为LBL4粒子在模拟胃、肠缓冲液中的胰岛素释放曲线。
图6为LBL4在不同pH缓冲体系中孵育2h后的胰岛素释放量。
图7为细胞活力受输运体系浓度的影响。
图8为I型糖尿病模型的建立及建模鼠与正常鼠的体型比较。
图9为SD大鼠建模期间血糖和体重监测结果;A图中方形为对照组,其它形状为建模组;B图中黑色线为实验建模组,灰色线为对照组。
图10为SD大鼠建模期间日饮水与进食量监测结果;图中黑色线为实验建模组,灰色线为对照组。
图11为I型糖尿病大鼠喂食LBL4体系1h、2h后十二指肠与回肠吸收胰岛素的情况;图中黑色标尺代表100μm。
图12为I型糖尿病大鼠空腹口服LBL4后血糖动态。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
以下实施例所用到的实验材料如下:
(1)实验试剂:
聚半乳糖醛酸(PGLA),壳聚糖,Pluronic 188,牛胰岛素购于西格玛公司,STZ链尿佐菌素,购于阿拉丁生化科技有限公司。胰酶、高糖DMEM培养基、非必需氨基酸均为Gibco公司产品;新生小牛血清购自杭州四季青生物工程材料有限公司;96/24孔聚苯乙烯细胞培养板为美国Corning康宁公司产品。
(2)实验仪器:
Sigma32184高速冷冻离心机,日本HITACHI 7650透射电子显微镜,江苏省金坛市医疗仪器厂78-1磁力搅拌器,日本Nikon显微镜,英国MalvernZEN3600,日本Olympus光学倒置显微镜,法国H.J.Y公司LabRAM Aramis显微拉曼光谱仪,瑞士Mettler,TGA/DSC 1同步热分析仪。
(3)实验细胞:人结肠癌细胞Caco-2,取得于广东省药科大学。
(4)实验动物:SD大鼠,购于南方医科大学实验动物中心。
实施例1层层自组装结构的口服胰岛素输运体系(LBL)的制备与表征
1、LBL粒子的制备
LBL粒子的合成方法如附图1所示。
(1)在15℃环境下,将5mg胰岛素溶解在1ml pH 1.1的稀盐酸溶液中,再加入NaCl固体,使NaCl终浓度达到0.6M,溶液搅拌0.5h,5000rpm离心3min,得沉淀;
(2)步骤(1)的沉淀加入pH=4、NaCl 0.6M的聚半乳糖醛酸(PGLA)溶液,再搅拌0.5h,超声1min,继续搅拌0.5h,5000rpm离心3min,得沉淀;
所述pH=4、NaCl 0.6M的聚半乳糖醛酸(PGLA)溶液的制备方法为:将聚半乳糖醛酸(PGLA)溶解于1ml稀盐酸溶液中,再加入NaCl固体,使NaCl终浓度达到0.6M,pH=4;
(3)将步骤(2)得到的沉淀加入pH=4、NaCl 3M的壳聚糖(CS)溶液中,搅拌0.5h,离心,得沉淀;
所述pH=4、NaCl 3M的壳聚糖(CS)溶液的制备方法为:将壳聚糖(CS)溶解于1ml稀盐酸溶液中,再加入NaCl固体,使NaCl终浓度达到3M,pH=4;
(4)反复依次重复步骤(2)和步骤(3),交替加入PGLA溶液和壳聚糖溶液进行包裹,得到不同层数的自聚合纳米球,即不同层数的层层自组装结构的口服胰岛素输运体系。
2、LBL粒子的表征
(1)拉曼光谱检测
将体系合成的原材料PGLA、壳聚糖、胰岛素,以及1层、4层包裹的LBL体系完全干燥,取适当样品置于载样板的凹槽中,使用盖玻片压制,使样品紧实并具有平整表面,使用拉曼光谱仪检测。拉曼光谱可以在一定程度上检测粒子的成分。
结果显示:胰岛素在639cm-1,853cm-1,3313cm-1三处分别显示出-SH,-COOH,-NH3三个键的振动。这三个标志峰也都出现于LBL1,LBL4的拉曼波谱中,可以确认终产物中有胰岛素的存在。PGLA和壳聚糖中有丰富的-OH(429cm-1,421cm-1),在LBL1与LBL4的波谱中,也有-OH峰的出现(429cm-1,446cm-1),这说明LBL1与LBL4中含有多糖和胰岛素,可以初步认为粒子成功合成(图2A)。
(2)Zeta电位检测
分别在每一轮合成后,取100μl用于电位的检测。纳米颗粒粒径和Zeta电位检测使用Zetasizer纳米分析仪测量(ZEN3600,马尔文器材,英国)。粒径测定中,样本溶解在超纯水中,最少测量180s。仪器将自动测量多次,并将结果依据相关分析得到流体力学粒径。Zeta电位测定中,样本溶解在0.1mM KCl中,使用自动模式测量。所有的测量重复三次。
图2B分别为纳米胰岛素和LBL4粒子的Zeta电位。结果表明,纳米胰岛素略带正电为1.9±0.01mV,LBL4粒子带正电,其电位值约为13.39±0.01mV。表明纳米胰岛素与LBL4的电性与预期相符,同时表明LBL4的外层由壳聚糖充分包裹,使粒子带较强的正电荷。
(3)透射电镜观察
分别在每一轮合成后,取100μl用于外观和粒径的检测。将粒子的悬液滴在覆有碳膜的铜网上,静置5min,用滤纸吸干多余水分,静置30min,待其完全干透。使用HITACHI 7650透射电镜,电子加速电压为300kV,分别于1x104倍、2x104倍的放大倍数下,观察粒子形态。
图2C为粒子的TEM外形,包裹聚合物后的胰岛素纳米粒子呈圆球形。分别包裹1、2层的图像可见圆球形的胰岛素被包裹于絮状结构中,形成类似葡萄串的形态。随着包裹层数的增加,粒径不断增加。图中可见多糖形成的颜色较浅的膜状结构分布于粒子周围。包裹至第4层时,LBL4粒子形成约200nm的圆球,已有较为独立的形态,但粒子之间仍有一定程度的牵连。同时,可见粒子是由多层膜包裹的结果,从外至内,颜色依次变深。
(4)热重分析
将包裹至四层的纳米颗粒LBL4进行干燥处理,使用瑞士Mettler,TGA/DSC1同步热分析仪,在N2氛围下,测量范围为30℃至900℃,升温速度为10℃/min。
图3展示了LBL4体系与胰岛素在N2气氛下的热重曲线,加热温度从室温至800℃,升温速度为10℃/min。可以观察到,胰岛素的失重有两个区间,分别是30-100℃和200-400℃;LBL4体系的失重有三个区间,30-100℃、200-300℃和750-800℃。第一个区间,300-100℃对应的是胰岛素与LBL4体系约3%的重量损失,这很可能是由体系吸收或结合的水分子的损失引起的。第二个区间,200-400℃对应的是胰岛素约70%的质量损失,大部分胰岛素在此区间分解;相对应的,LBL4体系在此温度区间约损失20%的质量,部分胰岛素、壳聚糖、PGLA在此区间分解。由于LBL4具有较强的分子间氢键与静电吸引力,与胰岛素组相比,这一重量损失阶段开始的较晚,质量损失的程度也较轻。第三个区间,750-800℃LBL4体系开始第三次质量损失过程。在这个温度区间内,LBL4体系各成分进一步分解,不仅包括多糖中糖环的脱水,也包括羧基、乙酰基等基团的脱水,以及部分碳骨架的分解
(5)药物包封率(包裹率)测定
首先绘制胰岛素标准曲线。分别配置不同浓度的胰岛素溶液(0.1mg/ml,0.01mg/ml,0.005mg/ml,0.001mg/ml,0.0005mg/ml,0.0001mg/ml),使用德国Perkin Elmer Lambda 25紫外分光光度计测定其在200~300nm之间的紫外吸收光谱。并依据其吸收峰绘制标准曲线,计算曲线的线性拟合方程与拟合度。
使用高速离心机将最终合成的包裹胰岛素的粒子悬液使用高速离心机离心,11000rpm/min,10℃,30min。取上清真空悬蒸浓缩后,应用紫外分光光度计测定其胰岛素吸收光谱,并依据其在绘制标准曲线的波长处的吸光值换算胰岛素含量。
胰岛素的包封率与载药率根据以下公式计算:
结果如下:胰岛素在稀HCl溶液中的紫外吸收光谱显示,在205nm与275nm分别具有吸收峰,并且位于205nm处的吸收峰高于275nm处10倍以上,胰岛素在205nm处的吸收峰更适宜于低浓度的样本检测。从10-4mg/ml至1mg/ml的范围内,胰岛素在205nm处的紫外吸收值呈半抛物线型。由于本研究涉及的样本胰岛素浓度较低,选取10-4mg/ml与10-2mg/ml之间的紫外吸收值绘制标准曲线,可见其具有线性关系,线性回归方程为y=18.641x+0.0019,其相关性指数R2=0.9967(图4)。
经过三次的合成实验,统计数据,LBL4的包封率为55.21±4%,载药效率为60.73±6%。
(6)药物释放率测定
配置0.1M HCl和pH=6.8的PBS缓冲液,在10ml缓冲液中分别加入200μl粒子溶液,冰浴,置于摇床上,以50r/min轻轻晃动。分别于0.5h,1h,2h,3h,4h取样700μl,离心,取上清用于胰岛素含量检测,即使用紫外分光光度计,测定其吸光度,并依据标准曲线校准换算。每个释放体系重复3次,收集数据用于统计计算。
如附图5和6所示,体外释放实验的结果表明,LBL4体系在pH=1的盐酸溶液中具有一定的缓释作用,0.5h至5h间,其释放量并无显著差异。在pH=6.8的PBS缓冲液中,LBL4体系表现出突释模式,于1h时,达到释放最大值。比较等量LBL4在两种体系中的释放可以发现,体系具有一定的pH感应性,这种性质与口服胰岛素输运体系的需求相吻合,即在胃环境中不释放胰岛素,从而起来保护胰岛素不受胃蛋白酶的破坏,在肠环境中释放,有利于胰岛素被肠上皮吸收。推测这种pH感应性质的来源可能是由于在低pH条件下,材料带电性较强,材料之间具有较强的吸引力可以使由静电作用自组装的粒子更稳定。而在中性pH条件下,粒子层层结构间的作用力较弱,结构较松散,所以较快的释放胰岛素。
LBL4粒子在不同pH体系中孵育2h的胰岛素释放情况表明,在pH值3-5区间,LBL4体系释放胰岛素的速率最慢,其释放量较低具有统计显著性(p<0.05)。而在pH值为2或接近中性时,其胰岛素的释放速率较快。由于进食后,胃部pH约为3左右,因此,该胰岛素输运体系在进食后服用的效果要优于空腹时的效果。
实施例2细胞实验
1、实验方法
(1)细胞培养
Caco-2细胞系由广东药学院提供。细胞在在培养瓶中增殖培养至80%后,以5 000/孔的密度接种至96孔板上,培养1,2天,以进行后续实验。其细胞培养条件为:含20%新生牛血清、非必需氨基酸的高糖DMEM培养基,37℃,5.0%CO2。
(2)输运体系毒性
分别取不同剂量的输运体系加入正在培养的Caco-2细胞中,24h后,使用MTT法测量细胞存活率。即在96孔培养板上接种Caco-2细胞,5 000个/孔,培养24h后,吸出培养基,加入无血清培养基,及不同浓度的胰岛素输运体系,培养24h后,加入5mg/ml的MTT溶液20ul/孔。继续培养4h,吸出培养基,加入DMSO溶解细胞内形成的甲瓒。在摇床上低速振荡10min,于酶标仪读数,波长510nm。
2、实验结果
胰岛素输运体系在细胞层面的生物毒性由MTT法得到评估。结果如附图7所示。
在Caco-2细胞的无血清培养基内加入不同浓度的LBL4输运体系(0μg/ml,125μg/ml,250μg/ml,500μg/ml,1000μg/ml),结果显示细胞活力并未受到太大影响,细胞比活力都保持在90%以上。其中,500μg/ml、1000μg/ml的药物对细胞培养来说,浓度已相对较大。对于有毒药物,100μg/ml以内的药物即可达到50%的细胞致死率。而LBL4体系在上药量达到1000μg/ml时,细胞活力水平仍在100%左右,由此可见,LBL4具有极低细胞毒性,生物相容性非常高。
实施例3体内实验——体系的细胞毒性研究
1、I型糖尿病鼠模型构建
(1)方法
购买6周龄SD大鼠,适应环境一周。取3只为对照组,其余为实验组。大鼠禁食一夜,测量血糖,使用pH=4.4的柠檬酸缓冲液在注射前冰浴避光配制STZ溶液,浓度为15mg/ml。对实验组大鼠按50mg/kg的剂量进行腹腔注射。
自建模当天起,每日测量大鼠体重、进食与饮水量。第3天、第7天使用罗氏活力型血糖仪监测血糖。对血糖较低的大鼠,补充注射STZ(30mg/kg)。
一周后,空腹(饥饿3h后)血糖浓度达到13mmol/L以上的,列为糖尿病患病鼠。
将I型糖尿病成模大鼠按空腹血糖均值分组,保持每组大鼠的血糖均值无显著差异。
(2)结果
如图8所示,使用雄性SD大鼠,禁食16小时,腹腔注射STZ,剂量为50mg/kg,一周后检测血糖,连续4天的空腹血糖值大于13mmol/L的SD大鼠视为建模成功的I型糖尿病大鼠。注射药物12天后,STZ注射组的成模大鼠与对照组大鼠的体型有明显的差别。
从血糖监测数据来看(图9A),注射STZ后第3天,大鼠禁食一夜后,STZ注射组的血糖就已显著高于对照组。实验组中,有1只大鼠血糖值为12.6mmol/L,其余STZ注射组大鼠血糖值都在20mmol/L以上,第6、9天,趋势未变化。可以认定除血糖值为12.6mmol/L的这只大鼠外,都建模成功,建模成功率达到92%。
从注射STZ前1天至注射STZ后第9天的大鼠体重、饮水、进食量的监测数据表明(图9B、图10),STZ注射组与对照组的体重、饮水、进食量在注射STZ前1天的数据无统计差异,注射前1天至注射当天的变化趋势也完全重合。至注射STZ当天起,体重、饮水、进食量出现差异,即对照组体重不断增长,饮水与进食量无显著变化;STZ注射组体重无增长趋势,饮水量激增至注射前的7倍左右,进食量增加约50%。
2、免疫组化法观察小肠绒毛对体系的吸收
(1)方法
取3只患1型糖尿病的SD大鼠,实验前禁食一夜,不禁水。取1只为对照组,灌胃300μl生理盐水,取2只为实验组,灌胃LBL4水溶液300μl。将对照组于灌胃后2小时,实验组分别于灌胃后1小时、2小时使用戊巴比妥钠(0.05mg/kg)麻醉,腹部裸露后,剪出5cm回肠和5cm结肠,分别使用生理盐水清洗。剪出肠段后,注射过量麻药处死大鼠。
(2)结果
图11为禁食一夜的I型糖尿病大鼠灌喂LBL4体系后1h和2h的十二指肠与回肠的免疫组化结果。
由于实验采用的是禁食一夜的饥饿I型糖尿病大鼠,灌胃的药物为胰岛素输运体系LBL4的水溶液,药物可以较快的通过胃并进入十二脂肠。从对照组的染色结果来看,研究所应用的I型糖尿病鼠肠绒毛中已无自身分泌的胰岛素。从十二指肠绒毛的染色结果来看,灌喂1h后,十二指肠的绒毛内就可见明显的胰岛素吸收现象,回肠的绒毛中可见少量的吸收。可见LBL4在十二指肠部分就可以被迅速吸收。灌喂2h后,十二指肠、回肠绒毛内的胰岛素均明显可见。
3、药物体内药效检测——I型糖尿病大鼠空腹给药效果
(1)方法
I型糖尿病大鼠断粮12h,保持饮水通畅。分别设置空白对照组和本发明的纳米载药粒子组2组,每组I型糖尿病大鼠不少于3只,分别服用生理盐水与LBL4体系(口服胰岛素量为50IU/kg),于0h,1h,2h,3h,5h,7h,9h,17h,22h测血糖。17h时给予食物,测定血糖的回升情况。
(2)结果如附图12所示。
糖尿病模型大鼠在口服LBL4(50IU/kg)体系后,从1h起,血糖出现显著的下降趋势,于3h达到最低点,接近实验初期血糖水平的40%。达到血糖最低点后,血糖稳定于较低水平,对照组血糖逐渐出现下降趋势。17h时,实验组与对照组差异甚微。喂食后,实验组与对照组血糖同步回升。
另外,与其它胰岛素口服输运体系的研究相比,在体内效果方面,本研究合成的LBL4具有显著的起效快、效果显著的特点。于服药后1h,显著的将血糖降低至初始血糖值的40%,与此时的对照组相比,LBL4组的血糖水平为对照组的50%。这一结果与肠绒毛吸收的结果相一致,都表明了LBL4粒子的吸收速度快、起效快这一特点。
综上所述,本发明成功应用胰岛素纳米球、聚半乳糖醛酸、壳聚糖成功合成了层层自组装的胰岛素口服输运体系,自组装纳米颗粒热稳定性高于游离胰岛素。包裹4层材料的LBL体系具有较独立的结构、较小的粒径(小于200nm)、表面带正电荷。包封率为55.21±4%,载药效率为60.73±6%,具有较高的载药能力。体外释放实验表明,在pH=1.1的盐酸溶液中,LBL体系具有较明显的控释作用,在pH=6.8的PBS缓冲液中,LBL体系表现出突释模式,可认为LBL体系具有pH感应特性,在低pH条件下的胰岛素释放速率稍慢于高pH条件下的释放速率。在体内实验中发现,该输运体系可以显著并且长效的控制高血糖症,服药1h后即出现血糖下降,于3h达到最低点,在10h内具备调控血糖的能力。
- 还没有人留言评论。精彩留言会获得点赞!